Method Article
Üç Boyutlu Organoid Kültür Kullanarak İnsan Glioblastoma Hücresel Çeşitliliğinin Ex vivo Korunması
Bu Makalede
Özet
Burada, birincil hasta örneklerinden veya hasta kaynaklı hücre kültürlerinden glioblastoma (GBM) organoidleri üretme ve olgunluğa kadar sürdürme yöntemini açıklıyoruz. Bu GBM organoidleri fenotipik olarak çeşitli hücre popülasyonları içerir ve tümör mikroortamlarını ex vivo olarak yeniden yaratır.
Özet
Glioblastoma (GBM), son derece kötü prognozu ile en sık görülen primer malign beyin kanseridir. İntra-tümöral hücresel ve moleküler çeşitliliğin yanı sıra tümör mikro ortamları arasındaki karmaşık etkileşimler, etkili tedaviler bulmayı zorlaştırabilir. Geleneksel yapışkan veya küre kültürü yöntemleri bu tür karmaşıklıkları maskeleyebilirken, üç boyutlu organoid kültür bölgesel mikro çevresel gradyanları özetleyebilir. Organoidler, hasta tümör mimarisini daha iyi taklit eden, fenotipik olarak çeşitli hücre popülasyonları içeren ve orta verimli deneyler için kullanılabilen üç boyutlu GBM kültürünün bir yöntemidir. Üç boyutlu organoid kültür, geleneksel kültüre kıyasla daha zahmetli ve zaman alıcı olmasına rağmen, benzersiz faydalar sunar ve akım in vitro ve in vivo sistemler arasındaki boşluğu kapatmaya hizmet edebilir. Organoidler, tümör davranışını ve direnç mekanizmalarını daha iyi anlamak için kanser biyologlarının cephaneliğinde paha biçilmez araçlar olarak kendilerini kanıtlamışlardır ve uygulamaları sadece büyümeye devam etmektedir. Burada, GBM organoidlerinin üretilmesi ve bakımı için yöntemler hakkında ayrıntılı bilgi verilmektedir. Hem dondurulmuş hem de parafin gömme teknikleri kullanılarak organoid numune gömme ve bölümlemenin nasıl yapılacağına dair talimatların yanı sıra organoid kesitlerde immünohistokimya ve immünofloresan protokolleri için öneriler ve toplam organoid hücre canlılığının ölçülmesi de açıklanmaktadır.
Giriş
Glioblastoma (GBM), tanıdan itibaren yaklaşık 15 aylık korkunç bir prognozu olan en sık görülen primer beyin tümörüdür1. Preklinik çalışmalarda etkili olan tedaviler genellikle hastalarda zayıf etkili olabilir 2,3. Zayıf klinik yanıt, GBM'nin mikroçevresel heterojenliği ve karmaşık tümöral içi etkileşimler de dahil olmak üzere birçok faktöre atfedilir. Bunların, geleneksel yapışkan veya küre kültürü yöntemleriyle laboratuvar ortamında yeniden oluşturulması zor olabilir4. GBM içinde kendi kendini yenileyen kanser kök hücrelerinin (CSC'ler) bir alt kümesinin varlığı da bu karmaşıklığa katkıda bulunabilir 5,6. CSC'ler tümör yayılımı için çok önemlidir ve aktif anjiyogenezi, kanser invazyonunu ve radyasyon dahil tedavilere direnci teşvik ederek tümör büyümesini sürdürür 7,8,9. CSC'ler tümörler boyunca eşit olarak dağılmamıştır, bunun yerine perivasküler niş ve perinekrotik bölgeler de dahil olmak üzere belirli mikro ortamlar içinde zenginleştirilmiştir ve her biri hücresel durumlarının10,11,12,13,14 farklı moleküler düzenlemesini sağlar. CSC'ler mikroçevresel ipuçlarının pasif alıcıları değildir, bunun yerine kendi mikro ortamlarını yeniden şekillendirme yeteneğine sahiptir 7,15,16. Bir CSC'nin mikro ortamı, besin kıtlığı, pH ve hipoksi17,18,19,20 gibi baskılara yanıt olarak kök hücre durumunun korunmasını teşvik edebilir ve bu koşulların model bir sistemde önemini düşündürmektedir. Bu nedenle, tümörlerdeki çeşitli hücresel mikro ortamın özetlenmesi, terapötik direnci anlamak ve yeni tedavileri tanımlamak için kritik öneme sahiptir.
Üç boyutlu kültürün popülaritesi son yıllardaartmıştır 21,22. Organoidler diğer kanser türlerinde kullanılmıştır ve hücreleri organoidler olarak tutmanın birincil amacı, heterojen hücre popülasyonlarının (birçoğu normalde daha homojen küre kültüründe rekabet edebilir) ve genetik özgüllüğe sahip bölgesel tümör mikro ortamları olarak görülen mekansal çeşitliliğin büyümesine izin vermektir 4,23,24,25,26 . Kanser hücrelerinin üç boyutlu kültürü için birçok yöntem vardır, bunların her birinin avantajları ve dezavantajları vardır27,28,29. Organoid kültürün, geleneksel yapışkan veya küre kültürünün yerini alması amaçlanmamıştır. Hücre mikroçevresi ile tümör hücresi yanıtları arasındaki etkileşimin kritik olduğu spesifik sorular olduğunda iki boyutlu yöntemlere tamamlayıcı bir teknik olarak en iyi şekilde kullanılır.
Bu makalede, birincil hasta örneklerinden veya hasta kaynaklı kültürlerden GBM organoidleri oluşturmak için güvenilir ve tekrarlanabilir yöntemler açıklanmaktadır. Üç boyutlu organoid kültür için iki farklı hedefi ele alıyoruz: (1) birincil hasta dokusundan, tekdüzelikten bağımsız olarak maksimum engraftment potansiyeline sahip organoidlerin oluşturulması veya (2) daha kantitatif deneysel kullanım için üniform organoidlerin yetiştirilmesi. Birincil bir örneği organoidler olarak oluştururken, tek hücreler için filtrelemek veya hücreleri saymak gerekli değildir, çünkü başlangıç kültürünü oluşturmak için maksimum hücre sayılarını ve türlerini korumak bir önceliktir. Bununla birlikte, karşılaştırmalı deneyler için organoidler yetiştirilirken, replikasyon organoidlerinin deneysel tutarlılık için karşılaştırılabilir olmasını sağlamak için tek hücreli filtrasyon ve hücre sayımı gereklidir. Bu protokol, organoid kültürlerin nasıl oluşturulacağını ve üniform organoidlerin nasıl oluşturulacağını, ayrıca organoidlerin gömülmesi ve korunması için rafine edilmiş yöntemleri ve immünohistokimya, immünofloresan ve GBM organoidlerinde toplam hücre canlılığının değerlendirilmesi dahil olmak üzere standart hücre kültürü deneylerini detaylandırmaktadır.
Protokol
Aşağıda detaylandırılan protokol(ler)in tüm adımları, Cleveland Clinic Kurumsal İnceleme Kurulu (IRB) Protokolü #2559 ve Kurumsal Biyogüvenlik Komitesi (IBC) onayı #1711'e uygun olarak geliştirilmiş ve yürütülmüştür. Küreler ve organoidler "Neurobazal Media Complete" (NBMc) 'de kültürlenir. Talimatlar için Tablo 1'e bakın.
1. Organoid kalıpların yapımı
- Balmumu kağıdını parafilm tabakasından çıkarın (kabaca 4 cm x 4 cm boyutlarında) ve iki steril 96 delikli polimeraz zincir reaksiyonu (PCR) plakası arasına yerleştirin.
- Bu adımları kültür davlumbazında uygulayın ve parafilmin "içini" (kağıdın kapladığı taraf) temiz tutmak için özel dikkat gösterin. Bu temiz taraf, girintilerin konkavitesini yapmalıdır.
- Parafilmde küçük çukurlar oluşturmak için üst 96 delikli PCR plakasına eşit basınç uygulayın. Amaç, gamzelerin parafilmde delik açmadan kabaca 2 mm derinlikte olmasını sağlamaktır.
- İki adet 96 delikli PCR plakasını nazikçe ayırın. Çukurlu parafilm üst plakaya yapışacaktır. Bunu yaklaşık 30 s boyunca kuru buz üzerine yerleştirin.
- Parafilm 30 sn boyunca kuru buz üzerinde kaldıktan sonra, parafilmi üst 96 kuyucuklu PCR plakasından çekmek için steril forseps kullanın.
- Parafilmi çıkarırken, çok "dikkatli" olmak yerine hızlı bir hareket kullanın. Dondurulmuş parafilmin, ısıtılmış parafilmden daha kolay çıkarılması, çukurların tersine dönmesine neden olabilir.
- Tamamlanan parafilm kalıbını kaplı, steril 10 cm'lik bir hücre kültürü kabına yerleştirin. Kalıplar önceden yapılabilir ve sterilite korunursa saklanabilir.
2. Hasta doku örneğinin makrodiseksiyonu
- Steril bir kültür kabında (10 cm'lik hücre kültürü plakaları), eşit basınç uygularken hasta örneğini ince bir şekilde kesmek için iki steril tıraş bıçağı kullanın.
NOT: Numuneyi kıymak, kültür kabı üzerinde yaklaşık 500 μL NBMc ile en kolay olanıdır. Parçaları mümkün olduğunca ince kıymak için tıraş bıçağı ile deneyin; İdeal olarak, tek tek parçalar 1mm3 veya daha küçüktür. - İnce kıyılmış tümör parçalarını, kesilmiş bir p1000 pipet ucu kullanarak 15 mL'lik bir santrifüj tüpüne aktarın.
NOT: Organoidleri tutarken, yalnızca kesilmiş p1000 pipet uçlarının kullanılması önemlidir. Bunlar, istenen açıklık boyutuna (kabaca 5 ila 8 mm arasında) keskin bir tıraş bıçağı kullanılarak kesilebilir ve otoklavlanabilir. - 2 mL oda sıcaklığı (RT) hücre ayırma çözeltisi (Malzeme Tablosu) ekleyin ve yaklaşık 10 dakika boyunca 37 °C,% 5 CO2 inkübatöre yerleştirin.
NOT: Birkaç dakikada bir gözlemleyin ve karıştırın. Bazı hücre ayrılma çözeltileri veya numuneleri değişen kuluçka sürelerine ihtiyaç duyabilir. Hücre lizisi nedeniyle DNA salınımını gösterebilen kümelenme ortaya çıkarsa, hemen bir sonraki adıma geçin. - Hücre ayrılma çözeltisini nötralize etmek için 8 mL NBMc ortamı ekleyin ve 65 x g'de 3 dakika boyunca döndürün.
- Süpernatantı aspire edin ve dokuyu 1-2 mL NBMc'de yeniden askıya alın.
3. Primer hasta dokusundan organoidlerin üretilmesi
NOT: Primer hasta dokusundan organoid yaparken amaç üç boyutlu kültür oluşturmaktır. Tek hücreler için filtre uygulamayın veya hücreleri saymayın, ancak görsel inceleme kullanarak ilk hücre yükünü mümkün olduğunca eşit tutun. İlk organoidlerin büyümesinde ve oluşumunda heterojenliğe sahip olmak normaldir. Her organoid, hacim olarak 20 μL (16 μL laminin bakımından zengin hücre dışı matriks (lrECM) ve adım 2.5'ten itibaren NBMc'de askıya alınmış 4 μL doku olacaktır). Talimatlar, amaçlanan organoid sayısına göre ayarlanabilir; Amaç, tipik olarak birincil hasta örneklerinden yaklaşık 20-30 organoid oluşturmaktır.
- Bir buz kovasına veya soğuk bloğa, lrECM'yi ve küçük bir santrifüj tüpünü yerleştirin. Küçük santrifüj tüpüne uygun miktarda lrECM (16 μL x X sayıda amaçlanan organoid) yerleştirin.
- Buz üzerindeki santrifüj tüpüne adım 2.5'ten (4 μL x amaçlanan organoid sayısı) uygun miktarda doku süspansiyonu ekleyin.
- lrECM/hücre süspansiyon karışımının 20 μL'sini parafilm kalıplarına dikkatlice pipetleyin; bu inci benzeri bir damlacık oluşturacaktır.
- LRECM/hücre süspansiyon karışımını iyice karıştırdığınızdan emin olun; hücreler lrECM içinde kolayca yerleşme eğilimindedir ve bu da heterojen organoidlere neden olur.
- LRECM/hücre süspansiyon karışımını buz üzerinde tutun. LRECM ısınırsa, polimerize olabilir ve organoid oluşumunu tehlikeye atabilir. LrECM polimerizasyonunu önlemek için pipet ucunu her iki ila üç organoidde bir soğuttuğunuzdan emin olun. Organoidlere hava kabarcıkları sokmayın (pipeti "çift itmekten" kaçının).
- İstenilen sayıda organoid, 10 cm'lik bir hücre kültürü plakasında parafilm kalıbına pipetlendikten sonra, plaka kapağı ile örtün ve 37 ° C'de bir hücre kültürü inkübatöründe 1-2 saat boyunca% 5 CO2 inkübe edin.
- Organoidler katılaştıktan sonra, NBMc ortamını kullanarak onları parafilm kalıbından nazikçe temizleyin ve 20 mL NBMc toplamına sahip yeni, steril 10 cm'lik bir kültür plakasına yerleştirin. Bir p1000 ucu kullanmak, organoidleri kalıptan temizlemek için en iyi sonucu verir; nazikçe kayacaklar.
NOT: Organoidler kalıplardan hücre kültürü plakalarına yıkandığında, ortamda küçük pembe küreler halinde görünmelidir. Organoidler medyada parçalanmış veya parçalanmış gibi görünüyorsa, bu, lrECM'nin polimerize olmasıyla ilgili daha erken bir sorunu gösterir ve organoidler hala büyüyebilir, ancak boyut olarak eşit olmaları pek olası değildir. - 10 cm'lik kültür kabını 4 gün boyunca 37 °C'de,% 5 CO2'de (sallanmadan) bir hücre kültürü inkübatörüne yerleştirin.
NOT: Organoidleri ilk günlerde yörüngesel bir çalkalayıcıya yerleştirmek, parçalanmalarına neden olabilir. 4. güne kadar titremediklerinden emin olun. - 4 gün sonra, medyayı değiştirin ve 37 ° C'de,% 5 CO2'de bir hücre kültürü inkübatöründe 80 RPM'de bir yörüngesel çalkalayıcıya yerleştirin.
- Olgunlaşmamış organoidlerle medya alışverişi zordur çünkü görselleştirmeleri zordur. Hücre kültürü kabını eğin ve en az 20 s bekleyin; organoidler alta yerleşecek ve yukarıdan gelen ortamın cam veya plastik 10-20 mL pipetle yavaşça çıkarılmasına izin verecektir.
- Alttaki organoidlerin toplanmasına dikkat edin; medyanın kaldırılmasının gücüyle karıştırılmış görünüyorlarsa, duraklatmak ve yeniden yerleşmelerine izin vermek en iyisidir. Organoidler olgunlaştıkça ve görselleştirilmesi daha kolay hale geldikçe, bu süreç daha az nüanslı hale gelir.
NOT: Bazen, hücre kültürü plakasının altına bir parça koyu renkli kağıt yerleştirmek, olgunlaşmamış organoidleri görselleştirmeye yardımcı olabilir. Organoidlerin bu şekilde emilmesi ve kaybolması çok kolay olduğundan, ortamları çıkarmak için vakum emişli bir Pasteur pipeti kullanılmaması önerilir. - Organoidler ilk kurulduğunda, olgun organoidler kadar hızlı bir şekilde ortam tüketmezler. %50 medya değişiminden başlayarak gereksiz medya kullanımını azaltır ve medya değişim işlemi sırasında yanlışlıkla yeni organoidlere zarar verme veya aspire etme olasılığını azaltır.
4. Yerleşik GBM küresinden, yapışkan veya organoid kültüründen organoidler üretmek
NOT: Buradaki amaç, karşılaştırmalı deneylerde kullanılmak üzere boyut ve hücre miktarında tek tip organoidler yapmaktır, bu nedenle bunu sağlamak için tek hücreli bir filtre kullanın ve hücreleri sayın.
- GBM küre kültüründen tek hücreli süspansiyonun hazırlanması.
NOT: GBM hücrelerinin küre kültürleri NBMc ortamında tutulur.- Küreleri 15 mL'lik bir santrifüj tüpüne yerleştirin ve 5 dakika boyunca 120 x g'de döndürün.
- Süpernatantı çıkarın ve 2 mL RT hücre ayırma çözeltisi ekleyin. 37 °C'lik bir inkübatöre 3 dakika yerleştirin.
- Hücre ayrılma çözeltisini nötralize etmek için 8 mL NBMc ortamı ekleyin. Tek hücreli süzgeçten (70 μm) süzün ve 120 x g'de 5 dakika boyunca döndürün.
- Süpernatantı tüpten çıkarın ve kalan hücreleri ~ 1 mL NBMc'de yeniden askıya alın. hücreleri sayın (hücre geçirimsiz leke kullanarak) ve adım 4.4'e atlayın.
- GBM yapışkan kültürden tek hücreli süspansiyonun hazırlanması.
- Kullanılan ortamı plakadan çıkarın, plakaya 2 mL RT hücre ayırma çözeltisi ekleyin ve 3 dakika boyunca 37 ° C'lik bir inkübatöre yerleştirin.
- Mikroskop altında hücrelerin plakadan ayrıldığını onaylayın.
- Hücre ayrılma çözeltisini nötralize etmek için 8 mL NBMc ortamı ekleyin. Tek hücreli bir süzgeçten (70 μm) süzün.
NOT: Tek hücreli süzme, yapışkan kültürle çalışırken isteğe bağlıdır. - 120 x g'de 5 dakika boyunca döndürün. Süpernatantı tüpten çıkarın ve kalan hücreleri ~ 1 mL NBMc'de yeniden askıya alın. hücreleri sayın (hücre geçirimsiz leke kullanarak) ve adım 4.4'e atlayın.
- GBM organoid kültüründen tek hücreli süspansiyonun hazırlanması.
- Organoidleri kesilmiş bir p1000 pipet ucu kullanarak 10 cm'lik bir kültür plakasına aktarın ve mümkün olduğunca fazla kalıntı ortamı dikkatlice çıkarın.
- İki steril tıraş bıçağı kullanarak, organoidleri dikkatlice ince ince doğrayın. Kesilmiş p1000 ucu ile kıyılmış organoidleri 15 mL'lik bir santrifüj tüpüne taşıyın ve ~2-3 mL NBMc ortamı ekleyin.
- 3 dakika boyunca 120 x g'de döndürün ve süpernatantı çıkarın (bu parça için vakum emiş yerine bir pipet ucu kullanmanızı öneririz).
- 10 dakika boyunca 2 mL soğuk hücre ayırma çözeltisi ekleyin.
NOT: Hücre ayırma çözeltisi doğrudan 4 °C'den kullanılmalı, önce ısıtılmamalıdır. Bu, kalan herhangi bir matrijeli yumuşatır ve hücre iyileşmesine yardımcı olur. - Daha sonra 10-20 dakika boyunca 37 ° C'lik bir inkübatöre geçin, birkaç dakikada bir gözlemleyin ve karıştırın. Hücre lizisini gösterebilecek kümelenme görülürse, hemen bir sonraki adıma geçin.
- Hücre ayrılma çözeltisini seyreltmek için 8 mL NBMc ortamı ekleyin. Tek hücreli bir süzgeçten (70 μm) süzün ve 120 x g'de 5 dakika boyunca döndürün.
- Süpernatantı tüpten çıkarın ve kalan hücreleri ~ 1 mL NBMc'de yeniden askıya alın. hücreleri sayın (hücre geçirimsiz leke kullanarak) ve adım 4.4'e geçin.
- Tek hücreli süspansiyondan organoid yapımı
- Bir buz kovasına veya soğuk bloğa, lrECM'yi ve küçük bir santrifüj tüpünü yerleştirin. Küçük santrifüj tüpüne uygun miktarda lrECM (16 μL x X sayıda amaçlanan organoid) yerleştirin.
- 20.000 hücre/organoid içerecek toplam hacimde (4 μL x X sayıda amaçlanan organoid) bir hücre karışımı oluşturun ve bunu buz üzerinde lrECM bulunan küçük santrifüj tüpüne ekleyin.
- lrECM/hücre süspansiyon karışımının 20 μL'sini parafilm kalıplarına dikkatlice pipetleyin; bu inci benzeri bir damlacık oluşturacaktır.
- LrECM / hücre süspansiyon karışımını iyice karıştırdığınızdan emin olun, çünkü hücreler lrECM içinde kolayca yerleşme eğilimindedir ve bu da heterojen organoidlere neden olur.
- LRECM/hücre süspansiyon karışımını buz üzerinde tutun. LRECM ısınırsa, polimerize olabilir ve organoid oluşumunu tehlikeye atabilir.
- LrECM polimerizasyonunu önlemek için pipet ucunu her iki ila üç organoidde bir soğuttuğunuzdan emin olun. Organoidlere hava kabarcıkları sokmayın (pipet ucunu "çift itmekten" kaçının).
- İstenilen sayıda organoid 10 cm'lik bir kültür plakasında parafilm kalıbına pipetlendikten sonra, bir hücre kültürü inkübatöründe 1-2 saat boyunca 37 ° C'de inkübe edin.
- Organoidler katılaştıktan sonra, NBMc ortamını kullanarak onları parafilm kalıbından nazikçe temizleyin ve 20 mL NBMc toplamına sahip yeni, steril 10 cm'lik bir kültür plakasına yerleştirin. Bir p1000 ucu kullanmak, organoidleri kalıptan temizlemek için en iyi sonucu verir; nazikçe kayacaklar.
NOT: 10 cm'lik kültür kabı başına yaklaşık 15-20 organoid önerilir. - 10 cm'lik kültür kabını 4 gün boyunca bir inkübatöre (sallanmadan) yerleştirin.
- 4 gün sonra, medyayı değiştirin ve hücre kültürü inkübatöründe 80 RPM'de bir yörüngesel çalkalayıcıya yerleştirin. Bundan sonra her 2-3 günde bir medya alışverişinde bulunun.
- Olgunlaşmamış organoidlerle medya alışverişi zordur çünkü görselleştirmeleri zordur. Hücre kültürü kabını eğin ve en az 20 s bekleyin; organoidler alta yerleşecek ve yukarıdan gelen ortamın büyük bir açılan cam pipetle yavaşça çıkarılmasına izin verecektir.
- Alttaki organoidlerin toplanmasına dikkat edin; medyanın kaldırılmasının gücüyle karıştırılmış görünüyorlarsa, duraklatın ve yeniden yerleşmelerine izin verin. Organoidler olgunlaştıkça ve görselleştirilmesi daha kolay hale geldikçe, bu süreç daha az nüanslı hale gelir.
NOT: Bazen, hücre kültürü plakasının altına bir parça koyu renkli kağıt yerleştirmek, olgunlaşmamış organoidleri görselleştirmeye yardımcı olabilir. Ortamları çıkarmak için vakum emişli bir Pasteur pipet kullanmayın, çünkü organoidlerin bu şekilde emilmesi ve kaybolması çok kolaydır. - Organoidler ilk kurulduğunda, olgun organoidler kadar hızlı bir şekilde ortam tüketmezler. Gereksiz medya kullanımını azaltmak ve medya değişim işlemi sırasında yanlışlıkla yeni organoidlere zarar verme veya aspire etme olasılığını azaltmak için %50 medya değişimi ile başlayın.
5. Kriyoembedding
- Her organoidi, 1 mL% 4 paraformaldehit (PFA) içeren ayrı bir 1,5 mL tüpe (kesilmiş p1000 ucu kullanılarak) yerleştirin. Organoidleri gece boyunca 4 °C'de saklayın. Organoidleri parafine gömüyorsanız, bölüm 6'ya geçin.
- % 4 PFA'da gece boyunca sabitlendikten sonra, organoidleri 1x fosfat tamponlu salin (PBS) içinde üç kez yıkayın.
- Organoidi, suda 1 mL% 30 sakkaroz içeren yeni bir 1,5 mL tüpe (kesilmiş p1000 pipet ucu kullanılarak) aktarın ve gece boyunca 4 ° C'de saklayın.
- Bir kriyomolda az miktarda (tipik olarak 1-2 mL) optimum kesme sıcaklığı bileşiği (OCT) ekleyin, tabanı örtün ve kalıbın derinliğinin yaklaşık 1 / 3 ila 1 / 2'sini doldurun.
- Kesilmiş p1000 pipet ucunu kullanarak tek bir organoidi cryomold'a aktarın. Bu, bazı ortamların organoid ile aktarılmasına neden olur, bu da kaçınılmazdır. Organoidi rahatsız etmeden çevredeki ortamları dikkatlice çıkarmak için daha küçük bir pipet ucu kullanın.
NOT: Bunu görselleştirmek zor olabilir, ancak yavaş pipetleme, ortam ile OCT arasındaki yoğunluklarda net bir fark gösterecektir, bu nedenle bu bir dereceye kadar "hissederek" yapılır). - Cryomold'u kuru buz tepsisine yerleştirin. OCT donmaya başlayacak ve süreçte opak hale gelecektir.
- Organoidi tamamen örtmek için ek OCT ekleyin ve kriyomoldun hacminin geri kalanını doldurun. Bloklar birkaç gün boyunca kısa süreli depolama için -20 ° C'de veya süresiz olarak uzun süreli depolama için -80 ° C'de saklanabilir.
6. Parafin gömme
- Organoidleri boyutlarına göre sıralayın (küçük organoidler 3 mm'nin altında, büyük organoidler 3 mm'nin üzerindedir). Her organoidi kesilmiş bir p1000 pipet ucu kullanarak bir histoloji kasetine aktarın ve Tablo 2 veya Tablo 3'e göre parafin balmumu haline getirin.
NOT: Histoloji kasetinin boyutu/yapılandırması kullanıcıya bağlıdır. - Organoidleri kasetlerden 1-2 mL erimiş parafin mumu ile kalıpları gömmeye aktarın ve balmumu yarı katı olana kadar soğutun.
- Balmumu kısmen katılaştıktan sonra, kalıbın üstüne daha fazla balmumu ekleyin. Etiketli kaset üstünü kalıbın üzerine yerleştirin ve bunu soğuk bir plakaya aktarın. Balmumu tamamen katı olana kadar soğumaya devam edin.
- Balmumu katılaştığında, bloğu bir mikrotom kullanarak kesitleyin. Alternatif olarak, daha sonra bölümleme için RT veya 4 ° C'de saklayın.
7. İmmünofloresan (IF)
- Aşağıdaki adımlara göre, bir slayt boyama kabı kullanarak 5-12 μm parafin gömülü doku kesitlerini parafinden arındırın ve rehidre edin.
NOT: OCT'ye gömülü organoidlerden bölümler kullanıyorsanız, 12 μm kesitler kullanmanızı öneririz. PBS'deki slaytı 30 dakika boyunca sallayarak OCT'yi kaldırın. Adım 7.2'ye geçin.- Ksilende 5 dakika kuluçkaya yatırın. Bunu iki kez daha tekrarlayın. Daha sonra% 100 etanol içinde 10 dakika kuluçkaya yatırın. Bunu bir kez daha tekrarlayın.
- % 95 etanolde 10 dakika inkübe edin. Bir kez daha tekrarlayın. Bölümleri damıtılmış suda 5 dakika, iki kez yıkayın.
- Antijen maskesini kaldırmak için, slaytları 1x sitrat maskeleme çözeltisine (Malzeme Tablosu) batırın ve 10 dakika boyunca kaynama sıcaklığında mikrodalga fırına batırın. Çözeltinin kaynamasına izin vermediğinizden emin olun.
NOT: Bu, kaynama meydana gelene kadar başlangıçta ~ 2 dakika boyunca mikrodalgada pişirilirse, daha sonra çözeltinin kaynamamasını sağlamak için gücü düşürür ve izlerse en iyi şekilde elde edilir. Tercih edilen maskeyi kaldırma sıcaklığı 100 °C'nin hemen altında, ideal olarak 98 °C'dir. - 1x sitrat maskeyi kaldırma çözümünde slaytları RT'de 30 dakika soğumaya bırakın.
NOT: Bu aynı 1x sitrat çözeltisidir; çözümün bu adımda değiştirilmesi gerekmez. - Slaytları damıtılmış suda 5 dakika, iki kez yıkayın.
- Slaytları 5 dakika boyunca 1x TBST (% 0,1 Aralık 20 ile Tris tamponlu salin) tamponunda yıkayın.
- Slaytları TBST'den çıkarın ve doku bölümünün kurumasına izin vermemeye dikkat ederken laboratuvar temizleme mendili kullanarak doku bölümlerinin etrafında dikkatlice kurulayın. Slayt yeterince kuruduktan sonra, hidrofobik bariyer kalemi ile doku bölümlerini daire içine alın.
- Her bölümü RT'de 1 saat boyunca 100-400 μL% 10 serum bloke edici çözelti ile bloke edin. Örneğin, eşek içinde yapılan ikincil bir antikor kullanıyorsanız, 1x TBST'de% 10'luk normal bir eşek serumu kullanın.
- Bloke edici çözeltiyi çıkarın ve daha sonra bloke edici çözeltide istenen konsantrasyona seyreltilmiş 100-400 μL birincil antikor ekleyin.
- 4 ° C'de, bölümleri gece boyunca birincil antikor ile inkübe edin.
- Birincil antikor çözeltisini çıkarın ve slaytları 1x TBST'de 5 dakika, üç kez yıkayın.
- Her bölüme 100-400 μL sekonder antikor (blokaj çözeltisinde veya üreticinin talimatlarına göre 1:1000 seyreltme) ekleyin ve RT'de 1,5 saat inkübe edin.
- Slaytları 1x TBST'de 5 dakika, iki kez yıkayın. Ardından slaytları 5 dakika boyunca 1x PBS'de yıkayın.
- Slaytları PBS'den çıkarın ve laboratuvar temizleme mendili kullanarak doku kesitlerinin etrafında kurulayın. Birkaç damla sıvı kürleme montajı ekleyin ve bir cam kapak kapağını dikkatlice monte edin. Slaytlar kuruduktan sonra, görüntülemeye hazır olana kadar ışıktan korunan -20 °C'de saklayın.
8. İmmünohistokimya
- Aşağıdaki adımlara göre, bir slayt boyama kabı kullanarak parafin gömülü doku bölümlerini parafinden arındırın ve yeniden sulandırın.
NOT: OCT'ye katıştırılmış organoidlerden bölümler kullanıyorsanız, slaytı PBS'de 30 dakika boyunca sallayarak OCT'yi kaldırın. Adım 8.2'ye geçin.- Ksilende 5 dakika kuluçkaya yatırın. İki kez daha tekrarlayın.
- % 100 etanolde 10 dakika inkübe edin. Bir kez daha tekrarlayın.
- % 95 etanolde 10 dakika inkübe edin. Bir kez daha tekrarlayın.
- Bölümleri damıtılmış suda 5 dakika, iki kez yıkayın.
- Antijen maskesini kaldırmak için, slaytları 1x sitrat maskeleme çözeltisine batırın ve 10 dakika boyunca alt kaynama sıcaklığında mikrodalga fırına batırın. Çözeltinin kaynamasına izin vermediğinizden emin olun.
- 1x sitrat maskeleme çözümünde slaytları RT'de 30 dakika soğumaya bırakın.
- Slaytları damıtılmış suda 5 dakika boyunca üç kez yıkayın.
- Slaytları% 3 hidrojen peroksitte 10 dakika boyunca inkübe edin.
- Slaytları iki kez damıtılmış suda 5 dakika yıkayın.
- Slaytları 1x TBST'de 5 dakika yıkayın.
- Slaytları 1x TBST'den çıkarın ve ardından doku bölümlerinin etrafını dikkatlice kurutmak için laboratuvar temizleme mendilinin köşesini kullanın.
- Slayt kuruduktan sonra doku bölümlerini hidrofobik bir bariyer kalemle çevreleyin.
- RT'deki hidrofobik bariyer kalem çemberi içindeki her bölüme 100-400 μL blokaj çözeltisini 1 saat boyunca yerleştirin. 1x TBST'de seyreltilmiş %10 normal eşek serumu (NDS) veya %0.75 sığır serum albümini (BSA) kullanın.
- Daha sonra, bloke edici çözeltiyi çıkarın ve her bölüme 100-400 μL birincil antikor ekleyin. Bu birincil antikoru, uygun üreticinin seyrelticisini kullanarak istenen konsantrasyona kadar seyreltin.
- Bölümleri gece boyunca 4 ° C'de inkübe edin. Birincil antikor çözeltisini çıkarın ve slaytları 1x TBST'de 5 dakika, üç kez yıkayın.
- Her bölüme 100-400 μL IHC tespit reaktifi ekleyin ve RT'de 1 saat inkübe edin.
- Her bölümü 5 dakika boyunca 1x TBST ile iki kez, ardından bir kez 5 dakika boyunca 1x PBS ile yıkayın.
- Üreticinin talimatlarına göre 3,3-Diaminobenzidin (DAB) çözeltisi hazırlayın. Her doku bölümüne 100-400 μL DAB çözeltisi ekleyin ve mikroskop altında yakından izleyin. 1-10 dakika arasında kabul edilebilir boyama yoğunluğu sağlayacaktır; bu sefer not ettiğinizden ve tüm doku bölümleri için tutarlı olduğunuzdan emin olun.
- İstenilen boyama yoğunluğuna ulaşıldıktan sonra, slaytları damıtılmış suya batırın.
- Hematoksilin karşı boyaması yapın ve Tablo 4'teki talimatlara göre montaj için dehidrasyon kaydırın.
- Slaytı ksilen ikamesinden (Malzeme Tablosu) çıkarın ve laboratuvar temizleme mendili kullanarak doku bölümünün etrafındaki ekstra sıvıyı silin. Kapak kaymasını doku bölümünün üzerine monte etmek ve kurumaya bırakmak için az miktarda kalıcı montaj ortamı kullanın.
9. Toplam hücre canlılığının ölçülmesi
- Her organoidi 2 mL'lik bir tüpe aktarın ve küçük bir pipet ucu kullanarak, organoidin etrafındaki tüm fazla ortamları dikkatlice çıkarın (bu prosedürün şeması için Şekil 3'e bakın).
NOT: Hücre canlılığı testleri, aynı sayıda hücreyle yapılan organoidlerle yapılmalıdır. Bu deney, doğrudan ameliyattan alınan hasta örneklerinden, alredy biçimli organoidlerin kesilmesinden veya tek hücrelerin filtrelenmediği ve sayılmadığı diğer durumlardan yapılan organoidler üzerinde yapılmamalıdır. - Işıldayan hücre canlılığı testi reaktifini ve 1: 1 oranında 1x PBS'yi hazırlayın ve her tüpe 500 μL ekleyin.
- Organoidi parçalamak ve 5 dakika bekletmek üzere agresif bir şekilde yukarı ve aşağı pipet çekmek için bir p1000 pipet ucu kullanın. Organoid şimdiye kadar biraz ayrışmış ve daha yumuşak olmalıdır; p1000 pipet ucuyla karıştırmayı tekrarlayın.
- Amaç, 96 kuyucuklu bir plakanın kuyusu başına toplam 100 μL hacme sahip olmaktır. Adım 9.3'ten 25 μL karışım ekleyin (çoklu teknik kopyalar için yeterli olacaktır) ve kalan ışıldayan hücre canlılığı testi ve PBS karışımından 75 μL ekleyin.
- Plakayı 2 dakika boyunca bir çalkalayıcıya yerleştirin ve ardından RT'de 20 dakika boyunca inkübe edin.
- Bir plaka okuyucusunda bir lüminesans ayarı kullanarak plakayı okuyun ve verileri toplayın (bkz. Şekil 4).
Sonuçlar
Şekil 1 , ışık mikroskobu ile 10x büyütmede görülen erken organoid büyümeyi göstermektedir. Şekil 1A, merkez görünümde lrECM aracılığıyla tek hücrelerin göçünü ve istilasını göstermektedir. Hücreler lrECM'yi genişletmeye ve 'kolonize etmeye' devam edecek ve görsel inceleme ile daha yoğun ve sonunda opak görünecekler. Şekil 1B, bir kuruşun boyutuna göre büyütme olmadan birkaç olgun organoid (7 haftada) göstermektedir.
Şekil 2 , aktif proliferasyonun bir belirteci olan fosfo-histon H3 için GBM organoidlerinin immünohistokimyasal boyanmasını göstermektedir. En yüksek proliferatif hücreler, organoid çekirdeğe kıyasla organoid çevrede görülür. Pozitif boyama kahverengi/bakır bir görünüme sahip olacaktır.
Şekil 3, GBM organoidlerindeki toplam hücre sayısını, 3D'ye özgü ışıldayan hücre canlılığı testi kullanarak homojenize etme ve ölçme işlemini açıklamaktadır. GBM organoidlerinde bulunan çok sayıda hücre nedeniyle, daha büyük organoid yapı başlangıçta ışıldayan tahlil reaktifinde tritüre edilerek homojenize edilir. Daha sonra toplam organoid lizatın fraksiyonları ayrı kuyucuklara yüklenir ve inkübasyondan ve uygun bir çok kuyucuklu plaka okuyucuda okunmadan önce ek ışıldayan tahlil reaktifi ile seyreltilir.
Şekil 4 , organoidler için DMSO (ortak araç) kontrol verilerini temsil etmektedir. Çizilen veriler intra-organoid ve inter-organoid tutarlılığı göstermektedir. Işıldayan canlılık verileri tipik olarak deneysel veriler üretilirken her numune için kontrollere normalleştirilecektir.
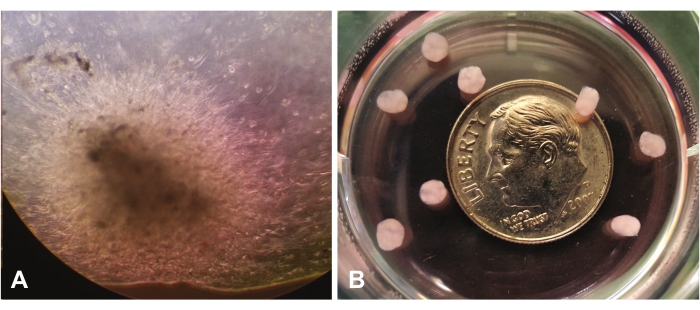
Şekil 1: Işık mikroskobundan görünüm (10x). (A) Laminin bakımından zengin hücre dışı matriks boyunca GBM hücrelerinin göçünü / istilasını gösteren erken organoid büyüme. (B) Bir kuruşun büyüklüğüne göre olgun organoidler. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
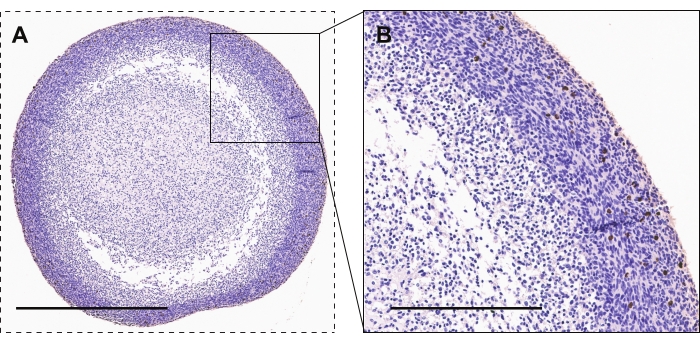
Şekil 2: GBM organoidlerinin immünohistokimyası. (A, B) Aktif proliferasyon için fosfo-histon H3 boyalı hücreleri gösteren GBM organoidleri. Ölçek çubukları, A ve B için sırasıyla 600 μm ve 300 μm'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
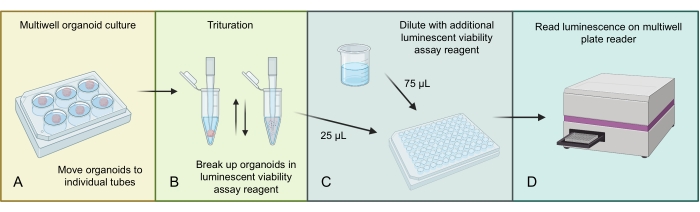
Şekil 3: Organoidler için ışıldayan hücre canlılığı protokolü . (A) Tek tek organoidleri küçük santrifüj tüplerine taşıyın ve fazla ortamı çıkarın. (B) Organoidi parçalamak için her tüpe ve pipete agresif bir şekilde 500 μL 1:1 PBS ve ışıldayan hücre canlılığı testi karışımı ekleyin. (C) Bu organoid karışımın 25 μL'sini ve aynı 1: 1 PBS ve ışıldayan hücre canlılığı tahlil karışımının 75 μL'sini 96 delikli bir plakanın her bir kuyucuğuna ekleyin. (D) 2 dakika boyunca bir çalkalayıcıya yerleştirin, ardından RT'de 20 dakika inkübasyon yapın ve ardından bir plaka okuyucuda ışıltıyı okuyun. Şekil BioRender.com kullanılarak yapılmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
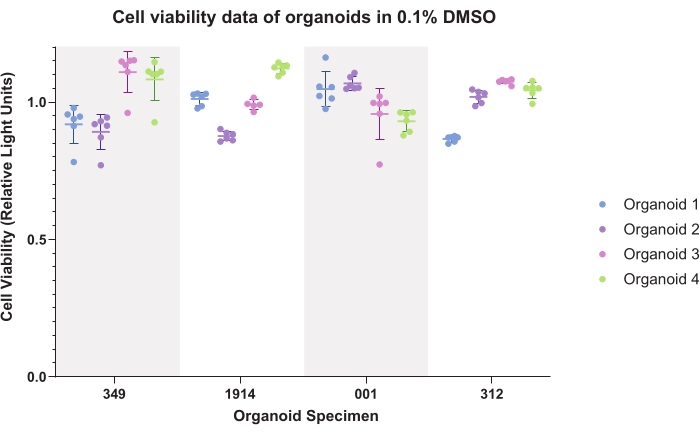
Şekil 4: Hücre canlılığı. Dört hasta örneği için dört organoidin altı teknik kopyası için% 0.1 dimetil sülfoksit (DMSO) içindeki organoidler için hücre canlılığı verileri. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Parça | Miktar |
| Nörobazal orta eksi fenol kırmızı | 500 mL |
| B-27 takviyesi eksi A vitamini (50x) | 10 mL |
| Antibiyotik-antimikotik (100x) | 5 mL |
| Sodyum piruvat (100 mM) | 5 mL |
| %0.85 NaCl (200 mM) cinsinden glutamin | 5 mL |
| Rekombinant insan FGF bazik (250 μg/mL) | 20 μL |
| Rekombinant insan EFG proteini (250 μg/mL) | 20 μL |
| Fenol kırmızısı | 500 μL |
Tablo 1: Nörobazal ortam tam (NBMc) formülasyonu
| Reaktif | Saat |
| %50 Etanol | 3 dk |
| %75 Etanol | 3 dk |
| %95 Etanol | 3 dk |
| %95 Etanol | 4 dk |
| %100 Etanol | 2 dk |
| %100 Etanol | 3 dk |
| %100 Etanol | 4 dk |
| Ksilen ikamesi | 2 dk |
| Ksilen ikamesi | 3 dk |
| Ksilen ikamesi | 4 dk |
| Parafin balmumu | 15 dk |
| Parafin balmumu | 15 dk |
Tablo 2: Küçük organoidler için işleme programı (çapı 3 mm'nin altında)
| Reaktif | Saat |
| %50 Etanol | 6 dk |
| %75 Etanol | 6 dk |
| %95 Etanol | 5 dk |
| %95 Etanol | 8 dk |
| %100 Etanol | 5 dk |
| %100 Etanol | 5 dk |
| %100 Etanol | 8 dk |
| Ksilen ikamesi | 5 dk |
| Ksilen ikamesi | 5 dk |
| Ksilen ikamesi | 8 dk |
| Parafin balmumu | 30 dk |
| Parafin balmumu | 30 dk |
Tablo 3: Büyük organoidler için işleme programı (çapı 3 mm'nin üzerinde)
| Reaktif | Saat |
| Hematoksilen | 2 dk |
| Koşu diH2O | 2 dk |
| Nükleer hematoksilin berraklaştırıcı reaktif | 1 dk |
| Koşu diH2O | 1 dk |
| Bluing Reaktifi | 1 dk |
| Koşu diH2O | 2 dk |
| %70 etanol | 1 dk |
| %100 etanol | 1 dk |
| %100 etanol | 1 dk |
| Ksilen ikamesi | 2 dk |
| Ksilen ikamesi | 2 dk |
Tablo 4: Hematoksilin karşı boyası
Tartışmalar
GBM organoidleri, daha büyük hücresel ve mikroçevresel heterojenliği içeren geleneksel kürelere tamamlayıcı bir kültür yöntemidir 4,22,30. Daha fazla zaman ve kaynak yoğun olmasına rağmen, organoid kültür, tümör içi davranış ve ilaç direnci mekanizmaları hakkında değerli bilgiler sunabilir.
GBM, CSC 5,31'lik bir popülasyon tarafından yönlendirilmektedir ve bu yöntemler, buCSC popülasyonunun sürekli büyümesine ve kendini yenilemesine izin vermek için geliştirilmiştir. Epidermal büyüme faktörü (EGF) ve fibroblast büyüme faktörünün (FGF) kök hücre bakımını ve büyümesini arttırdığı ve aktif reseptör tirozin kinaz (RTK) sinyallemesi sağladığı bilinmektedir. GBM tümörleri içinde heterojen hücresel popülasyonların ve farklı tümör mikroortamlarının oluşumu, CSC davranışlarını desteklemeye dayanır. Bir lrECM seçimi, laminin bakımından zengin beyin ortamını taklit eder ve organoid kültürdeki hücrelerin kendi kendini organize etmesini ve istila yoluyla göç etmesini destekler. Her ne kadar bazı gruplar lrECM veya EGF / FGF zenginleştirilmiş medya24,28 kullanmadan organoid kültürü kurmuş olsalar da, bu kültür yönteminin daha zaman verimli bir yolunu ve büyümeyi yönlendirmek için onkojenik sinyallemenin daha güçlü seçimini sunabilir, bu yöntemler organoidlerin hücresel heterojenliğini en iyi şekilde oluşturmak için pro-kök hücre ortamını optimize etmek için seçilmiştir. Hem serebral organoidler hem de GBM organoidleri literatürde daha önce21,32,33 lrECM ile yapılmıştır. Organoidlerde bulunan tümör popülasyonları ve mekansal varyasyon ile ilgili veriler oluşturmamıza rağmen, organoidler içindeki tümör dışı popülasyonlar ve orijinal hasta örneklerinden ne kadar süre hayatta kaldıkları hakkında daha az şey bilinmektedir. Bazı IHC lekeleri (CD45 gibi) bu verileri sağlayabilir ve gelecekte organoidlerle ilgili ilginç bir araştırma noktası olabilir.
Organoid kültürün kullanım amacının bilinmesi, uygun yöntemlerin seçilmesi açısından önemlidir. Belirli deneyler için büyüyen üniform organoidlere karşı birincil örneklerden organoidlerin oluşturulması biraz farklı prosedürlere sahiptir. Organoidlerin lrECM iskelesinde nasıl olgunlaştığını ve görsel olarak nasıl doldurduğunu takdir etmek, organoid kültüre uygun zaman ve kaynakları tahsis edebilmek için önemlidir. Organoidlerdeki hücrelerin seyrek bölgeleri, numunenin davranışına bağlı olarak 2-8 hafta arasında herhangi bir yerde alabilen lrECM'yi doldurmak için yavaşça genişleyecek ve büyüyecektir. Bu büyüme oranı, her bir numuneye biraz özgüdür; farklı organoid grupları arasında korunur ve küre büyümesinin göreceli hızı ile oldukça tutarlıdır. Organoidler 1 yıldan fazla korunabilir ve ksenogreftte farelere tümör oluşum yeteneklerini koruyabilir; ancak, laboratuvar kaynaklarını (hem malzeme hem de zaman) boşa harcamamak için ayrı bir amaçla yetiştirilmeleri önerilir4. Organoid büyümesi birden fazla kuyucuk boyutu ve formatında test edilmiştir ve 10 cm'lik bir plakanın optimal hücre canlılığını korumak için ideal ayar olduğunu, ardından kuyu başına üç organoid içeren 6 delikli bir plakanın34 olduğunu göstermektedir. Organoidler, iki boyutlu kültür muadillerine kıyasla daha fazla ortam tüketir ve daha küçük bir kuyu formatı kullanmak uygun bakıma yol açmaz. Örneğin, 96 delikli formattaki bir plakanın bir kuyusu, organoid büyümeyi sürdürmek için bir organoidin boyutuna göre yeterli alana veya ortam hacmine sahip değildir.
Organoidlerin kurduğu gibi, gözlemci olmak başarıyı arttırmak için önemlidir. Başlangıçta, organoidler medyayı yavaş tüketir, ancak daha yoğun ve daha olgun hale geldikçe, medyayı daha hızlı tüketirler. Medyaya fenol kırmızısı eklemek, medya tüketiminin bir göstergesi olarak hizmet etmeye yardımcı olabilir. Medya daha sarı olduğunda, daha yüksek hacimli bir ortam değişimi, plakadaki toplam ortam miktarını artırmak, organoidleri büyümelerine ayak uydurmak için çoklu hücre kültürü plakaları arasında bölmek veya hatta deneyler için zaman çizelgesini ayarlamak için besleme düzenini ayarlamamızı isteyebilir.
Birçok yönden, organoidler kanser araştırması yapmanın verimsiz bir yoludur. Uzun zaman ölçekleri içerirler ve GBM küre kültürüne kıyasla pahalı ve kaynak ağırlıklıdırlar. Bununla birlikte, hücresel ve mikro çevresel çeşitliliği yeniden yaratmak için alternatif bir yöntem olan hasta kaynaklı ksenogreftlerle karşılaştırıldığında, daha basit, daha ucuz ve kontrol edilebilirler. Organoidlerin en iyi ne zaman kullanılacağının seçimi kanser araştırmacıları için önemlidir. Geleneksel kürenin veya bağlı kültürün yerini alması ve ksenogreft modellerinin yerini alması amaçlanmamıştır. Organoidler, doğru bilimsel soruya uygulandığında, her iki sistemin faydalarını birleştirebilir ve aksi takdirde gizli kalacak tümör hücresi biyolojisini gözlemlememize izin verebilir. Bilimsel topluluk, organoidlerin hangi öğrenme fırsatlarını sunduğunu anlamaya yeni başlıyor, ancak gelecekte GBM'nin karmaşık biyolojisini anlamak için paha biçilmez bir araç olacakları açık.
Açıklamalar
Yazarların açıklanacak herhangi bir çatışması yoktur.
Teşekkürler
Dr. Justin Lathia'ya paha biçilmez tavsiyeleri ve sürekli desteği için teşekkür ederiz. Ayrıca Katrina Fife, Lisa Wallace ve Maya Camhi'ye mükemmel teknik destekleri için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3,3-Diaminobenzidine (DAB) tablets | MP Biomedicals | 08980681 | 3,3-Diaminobenzidine (DAB) tablets |
| 96-well PCR plates | ThermoFisher Scientific | 96-well PCR plates | |
| Accutase | ThermoFisher Scientific | SCR005 | Cell detachment solution |
| Antibiotic-antimycotic | ThermoFisher Scientific | 15240062 | Antibiotic-antimycotic |
| B-27 supplement minus vitamin A | ThermoFisher Scientific | 12587001 | B-27 supplement minus vitamin A (50x) |
| GelCode Blue Stain Reagent | ThermoFisher Scientific | 24590 | Bluing reagent |
| Cell strainer (70 µm) | CellTreat Scientific | 229483 | Cell strainer (70 µm) |
| CellTiter-Glo 3D | Promega | G9681 | Luminescent cell viability assay |
| Clarifier 2 | ThermoFisher Scientific | 7301 | Nuclear hematoxylin clarifying reagent |
| Clear-Rite 3 | ThermoFisher Scientific | 6901 | xylene substitute |
| Epredia Gill 2 Hematoxylin | ThermoFisher Scientific | 72504 | Hematoxylin |
| Glutamine in 0.85% NaCl | ThermoFisher Scientific | 35050061 | Glutamine in 0.85% NaCl (200 mM) |
| Matrigel | ThermoFisher Scientific | 354234 | Laminin-enriched extracellular matrix |
| Mini PAP pen | ThermoFisher Scientific | 008877 | Hydrophobic barrier pen |
| Mounting medium | ThermoFisher Scientific | 22-050-102 | Mounting medium |
| Neurobasal media minus phenol red | ThermoFisher Scientific | 12349015 | Neurobasal media minus phenol red (500 mL) |
| Normal donkey serum (NDS) | Jackson ImmunoResearch | 017-000-121 | Normal donkey serum (NDS) |
| Paraformaldehyde 4% in PBS | ThermoFisher Scientific | AAJ19943K2 | Paraformaldehyde 4% in PBS |
| Phenol red | Sigma | P0290 | Phenol red (0.5%) |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P10144 | Liquid curing mountant |
| Recombinant human EGF protein | R&D systems | 236-EG-01M | Recombinant human EGF protein (250 µg/mL) |
| Recombinant human FGF basic | R&D systems | 4144-TC-01 | Recombinant human FGF basic (250 µg/mL) |
| SignalStain Antibody Diluent | Cell Signaling | 8112 | Antibody diluent |
| SignalStain Boost IHC Detection Reagent | Cell Signaling | 8114 | Immunohistochemistry detection reagent |
| SignalStain Citrate Unmasking Solution | Cell Signaling | 14746 | Citrate unmasking solution |
| Single edge razor blade | Uline | H-595B | Single edge razor blade |
| Sodium pyruvate | ThermoFisher Scientific | 11360070 | Sodium pyruvate (100 mM) |
| Tissue-Tek Cryomolds | VWR | 25608-916 | Disposable cryomolds |
| Tissue-Tek O.C.T. Compound | VWR | 25608-930 | Optimal cutting temperature compound |
| Trypan Blue Stain | ThermoFisher Scientific | T10282 | Cell impermeant stain (0.4%) |
| Xylene | ThermoFisher Scientific | X3P-1GAL | Xylene |
Referanslar
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352 (10), 987-996 (2005).
- Heffernan, J. M., Sirianni, R. W. Modeling microenvironmental regulation of glioblastoma stem cells: a biomaterials perspective. Frontiers in Materials. 5, 7 (2018).
- Zanders, E. D., Svensson, F., Bailey, D. S. Therapy for glioblastoma: is it working. Drug Discovery Today. 24 (5), 1193-1201 (2019).
- Hubert, C. G., et al. A Three-dimensional organoid culture system derived from human glioblastomas recapitulates the hypoxic gradients and cancer stem cell heterogeneity of tumors found in vivo. Cancer Research. 76 (8), 2465-2477 (2016).
- Lathia, J. D., Heddleston, J. M., Venere, M., Rich, J. N. Deadly teamwork: neural cancer stem cells and the tumor microenvironment. Cell Stem Cell. 8 (5), 482-485 (2011).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), 851-856 (2015).
- Bao, S., et al. Stem cell-like glioma cells promote tumor angiogenesis through vascular endothelial growth factor. Cancer Research. 66 (16), 7843-7848 (2006).
- Yu, S. C., Bian, X. W. Enrichment of cancer stem cells based on heterogeneity of invasiveness. Stem Cell Reviews and Reports. 5 (1), 66-71 (2009).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Vescovi, A. L., Galli, R., Reynolds, B. A. Brain tumour stem cells. Nature Reviews. Cancer. 6 (6), 425-436 (2006).
- Zhu, T. S., et al. Endothelial cells create a stem cell niche in glioblastoma by providing NOTCH ligands that nurture self-renewal of cancer stem-like cells. Cancer Research. 71 (18), 6061-6072 (2011).
- Calabrese, C., et al. A perivascular niche for brain tumor stem cells. Cancer Cell. 11 (1), 69-82 (2007).
- Charles, N., et al. Perivascular nitric oxide activates notch signaling and promotes stem-like character in PDGF-induced glioma cells. Cell Stem Cell. 6 (2), 141-152 (2010).
- Seidel, S., et al. A hypoxic niche regulates glioblastoma stem cells through hypoxia inducible factor 2 alpha. Brain. 133, 983-995 (2010).
- Yan, K., et al. Glioma cancer stem cells secrete Gremlin1 to promote their maintenance within the tumor hierarchy. Genes & Development. 28 (10), 1085-1100 (2014).
- Cheng, L., et al. Glioblastoma stem cells generate vascular pericytes to support vessel function and tumor growth. Cell. 153 (1), 139-152 (2013).
- Flavahan, W. A., et al. Brain tumor initiating cells adapt to restricted nutrition through preferential glucose uptake. Nature Neuroscience. 16 (10), 1373-1382 (2013).
- Hjelmeland, A. B., et al. Acidic stress promotes a glioma stem cell phenotype. Cell Death and Differentiation. 18 (5), 829-840 (2011).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. The American Journal of Pathology. 177 (3), 1491-1502 (2010).
- Li, Z., et al. Hypoxia-inducible factors regulate tumorigenic capacity of glioma stem cells. Cancer Cell. 15 (6), 501-513 (2009).
- Azzarelli, R., Ori, M., Philpott, A., Simons, B. D. Three-dimensional model of glioblastoma by co-culturing tumor stem cells with human brain organoids. Biology Open. 10 (2), 056416 (2021).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Reports. 26 (12), 3203-3211 (2019).
- da Silva, B., Mathew, R. K., Polson, E. S., Williams, J., Wurdak, H. Spontaneous glioblastoma spheroid infiltration of early-stage cerebral organoids models brain tumor invasion. SLAS Discovery: Advancing Life Sciences R & D. 23 (8), 862-868 (2018).
- Jacob, F., et al. A Patient-derived glioblastoma organoid model and biobank recapitulates inter- and intra-tumoral heterogeneity. Cell. 180 (1), 188-204 (2020).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nature Cell Biology. 21 (8), 1041-1051 (2019).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Ledur, P. F., Onzi, G. R., Zong, H., Lenz, G. Culture conditions defining glioblastoma cells behavior: what is the impact for novel discoveries. Oncotarget. 8 (40), 69185-69197 (2017).
- Lenin, S., et al. A drug screening pipeline using 2D and 3D patient-derived in vitro models for preclinical analysis of therapy response in glioblastoma. International Journal of Molecular Sciences. 22 (9), 4322 (2021).
- Rybin, M. J., Ivan, M. E., Ayad, N. G., Zeier, Z. Organoid models of glioblastoma and their role in drug discovery. Frontiers in Cellular Neuroscience. 15 (4), 605255 (2021).
- Shakya, S., et al. Altered lipid metabolism marks glioblastoma stem and non-stem cells in separate tumor niches. Acta Neuropathologica Communications. 9 (1), 101 (2021).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Bian, S., et al. Genetically engineered cerebral organoids model brain tumor formation. Nature Methods. 15 (8), 631-639 (2018).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Sundar, S. J., et al. Three-dimensional organoid culture unveils resistance to clinical therapies in adult and pediatric glioblastoma. Translational Oncology. 15 (1), 101251 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır