Method Article
Mantenimiento de la diversidad celular del glioblastoma humano ex vivo mediante cultivo de organoides tridimensionales
En este artículo
Resumen
Aquí, describimos un método para generar organoides de glioblastoma (GBM) a partir de muestras primarias de pacientes o cultivos celulares derivados de pacientes y mantenerlos hasta la madurez. Estos organoides GBM contienen poblaciones celulares fenotípicamente diversas y recrean microambientes tumorales ex vivo.
Resumen
El glioblastoma (GBM) es el cáncer cerebral maligno primario más común con un pronóstico extremadamente malo. La diversidad celular y molecular intratumoral, así como las interacciones complejas entre microambientes tumorales, pueden hacer que encontrar tratamientos efectivos sea un desafío. Los métodos tradicionales de cultivo adherente o de esfera pueden enmascarar tales complejidades, mientras que el cultivo de organoides tridimensionales puede recapitular gradientes microambientales regionales. Los organoides son un método de cultivo tridimensional de GBM que imita mejor la arquitectura tumoral del paciente, contiene poblaciones celulares fenotípicamente diversas y se puede usar para experimentos de rendimiento medio. Aunque el cultivo de organoides tridimensionales es más laborioso y requiere más tiempo en comparación con el cultivo tradicional, ofrece beneficios únicos y puede servir para cerrar la brecha entre los sistemas actuales in vitro e in vivo . Los organoides se han establecido como herramientas invaluables en el arsenal de los biólogos del cáncer para comprender mejor el comportamiento tumoral y los mecanismos de resistencia, y sus aplicaciones solo continúan creciendo. Aquí, se proporcionan detalles sobre los métodos para generar y mantener organoides GBM. También se describen las instrucciones de cómo realizar la incrustación y seccionamiento de muestras de organoides utilizando técnicas de incrustación de parafina y congeladas, así como recomendaciones para protocolos de inmunohistoquímica e inmunofluorescencia en secciones de organoides, y medición de la viabilidad total de células organoides.
Introducción
El glioblastoma (GBM) es el tumor cerebral primario más común con un pronóstico sombrío de aproximadamente 15 meses desde el diagnóstico1. Los tratamientos que son efectivos en los estudios preclínicos a menudo pueden ser poco efectivos en pacientes 2,3. La respuesta clínica deficiente se atribuye a muchos factores, incluida la heterogeneidad microambiental del GBM y las complejas interacciones intratumorales. Estos pueden ser difíciles de recrear en el entorno de laboratorio con métodos tradicionales de cultivo adherente o de esfera4. La presencia de un subconjunto de células madre cancerosas autorrenovadoras (CSC) dentro del GBM también puede contribuir a esta complejidad 5,6. Las CSC son cruciales para la propagación tumoral y mantienen el crecimiento tumoral al promover la angiogénesis activa, la invasión del cáncer y la resistencia a terapias que incluyen radiación 7,8,9. Las CSC no se distribuyen uniformemente a través de los tumores, sino que se enriquecen dentro de microambientes específicos, incluyendo el nicho perivascular y las regiones perinecróticas, que proporcionan una regulación molecular distinta de sus estados celulares 10,11,12,13,14. Las CSC no son receptoras pasivas de señales microambientales, sino que poseen la capacidad de remodelar sus propios microambientes 7,15,16. El microambiente de una CSC puede promover el mantenimiento del estado de las células madre en respuesta a presiones como la escasez de nutrientes, el pH y la hipoxia17,18,19,20, lo que sugiere la importancia de estas condiciones en un sistema modelo. Por lo tanto, la recapitulación del microambiente celular diverso dentro de los tumores es fundamental para comprender la resistencia terapéutica e identificar nuevas terapias.
La cultura tridimensional ha aumentado en popularidad en los últimos años21,22. Los organoides se han utilizado en otros tipos de cáncer, y el objetivo principal de mantener las células como organoides es permitir el crecimiento de poblaciones celulares heterogéneas (muchas de las cuales normalmente pueden ser superadas en un cultivo de esfera más homogénea) y diversidad espacial, vista como microambientes tumorales regionales con especificidad genética 4,23,24,25,26 . Existen muchos métodos para el cultivo tridimensional de células cancerosas, cada uno de los cuales tiene ventajas y desventajas27,28,29. El cultivo de organoides no pretende ser un reemplazo para el adherente tradicional o el cultivo de esfera. Se utiliza mejor como una técnica complementaria a los métodos bidimensionales cuando hay preguntas específicas donde la interacción entre el microambiente celular y las respuestas de las células tumorales es crítica.
Este artículo describe métodos confiables y repetibles para generar organoides GBM a partir de muestras primarias de pacientes o cultivos derivados de pacientes. Abordamos dos objetivos diferentes para el cultivo de organoides tridimensionales: (1) establecer organoides a partir de tejido primario del paciente, con un potencial de injerto máximo independientemente de la uniformidad, o (2) cultivar organoides uniformes para un uso experimental más cuantitativo. Al establecer una muestra primaria como organoides, no es necesario filtrar por células individuales o contar células, porque mantener el número máximo de células y tipos para establecer el cultivo inicial es una prioridad. Sin embargo, cuando se cultivan organoides para experimentos comparativos, se necesita filtración y recuento de células individuales para garantizar que los organoides replicados sean comparables para la consistencia experimental. Este protocolo detalla cómo establecer cultivos de organoides y crear organoides uniformes, así como métodos refinados para incrustar y preservar organoides y experimentos de cultivo celular estándar, incluida la inmunohistoquímica, la inmunofluorescencia y la evaluación de la viabilidad celular total en organoides GBM.
Protocolo
Todos los pasos de los protocolos detallados a continuación se desarrollaron y realizaron de acuerdo con el Protocolo # 2559 de la Junta de Revisión Institucional (IRB) de Cleveland Clinic y la aprobación # 1711 del Comité Institucional de Bioseguridad (IBC). Las esferas y los organoides se cultivan en "Neurobasal Media Complete" (NBMc). Consulte la Tabla 1 para obtener instrucciones.
1. Hacer moldes de organoides
- Retire el papel encerado de la hoja de parafilm (aproximadamente 4 cm x 4 cm de tamaño) y colóquelo entre dos placas estériles de reacción en cadena de la polimerasa (PCR) de 96 pocillos.
- Realice estos pasos en la campana de cultivo y tenga especial cuidado de mantener limpio el "interior" del parafilm (el lado que está cubierto por el papel). Este lado limpio debe hacer la concavidad de las hendiduras.
- Aplique una presión uniforme a la placa de PCR superior de 96 pocillos para formar pequeños hoyuelos en la parapelícula. El objetivo es que los hoyuelos tengan aproximadamente 2 mm de profundidad sin crear agujeros en la parapelícula.
- Separe suavemente las dos placas de PCR de 96 pocillos. El parafilm con hoyuelos se pegará a la placa superior. Coloque esto en hielo seco durante unos 30 s.
- Después de que la parapelícula haya estado en hielo seco durante 30 s, use fórceps estériles para extraer la parapelícula de la placa superior de PCR de 96 pocillos.
- Al retirar el parafilm, use un movimiento rápido en lugar de ser muy "cuidadoso". La parapelícula congelada es más fácil de quitar que la parapelícula calentada, lo que puede hacer que los hoyuelos se inviertan.
- Coloque el molde de parafilm completo en una placa de cultivo celular estéril de 10 cm cubierta. Los moldes se pueden hacer por adelantado y almacenar si se mantiene la esterilidad.
2. Macrodisección de la muestra de tejido del paciente
- En una placa de cultivo estéril (placas de cultivo celular de 10 cm), use dos cuchillas de afeitar estériles para picar finamente la muestra del paciente mientras se aplica una presión uniforme.
NOTA: Picar la muestra es más fácil con aproximadamente 500 μL de NBMc en la placa de cultivo. Intente con hojas de afeitar picar las piezas lo más finamente posible; Idealmente, las piezas individuales son de 1 mm3 o más pequeñas. - Transfiera las piezas tumorales finamente picadas a un tubo de centrífuga de 15 ml utilizando una punta de pipeta p1000 cortada.
NOTA: Siempre que manipule organoides, es importante utilizar únicamente puntas de pipeta p1000 cortadas. Estos pueden cortarse con una navaja afilada hasta el tamaño de apertura deseado (entre 5 y 8 mm aproximadamente) y en autoclave. - Agregue 2 ml de solución de desprendimiento celular a temperatura ambiente (RT) (Tabla de materiales) y colóquela en una incubadora deCO2 al 5% a 37 °C durante aproximadamente 10 minutos.
NOTA: Observe y mezcle cada pocos minutos. Algunas soluciones o muestras de desprendimiento celular pueden necesitar tiempos de incubación variables. Si aparece aglutinación, lo que puede indicar la liberación de ADN debido a la lisis celular, continúe con el siguiente paso inmediatamente. - Agregue 8 ml de medios NBMc para neutralizar la solución de desprendimiento celular y gire durante 3 minutos a 65 x g.
- Aspirar el sobrenadante y resuspender el tejido en 1-2 ml de NBMc.
3. Generación de organoides a partir del tejido primario del paciente
NOTA: El objetivo al hacer organoides a partir de tejido primario del paciente es establecer un cultivo tridimensional. No filtre por celdas individuales ni cuente celdas, pero mantenga la carga celular inicial lo más uniforme posible mediante la inspección visual. Es normal tener heterogeneidad en el crecimiento y establecimiento de los organoides iniciales. Cada organoide tendrá un volumen de 20 μL (16 μL de matriz extracelular rica en laminina (lrECM) y 4 μL de tejido suspendido en NBMc, a partir del paso 2.5). Las instrucciones se pueden ajustar para el número de organoides previstos; El objetivo es formar típicamente alrededor de 20-30 organoides a partir de muestras primarias de pacientes.
- En una cubitera o bloque frío, coloque el lrECM y un pequeño tubo de centrífuga. Coloque la cantidad adecuada de lrECM (16 μL x X número de organoides previstos) en el pequeño tubo de centrífuga.
- Añadir el volumen adecuado de suspensión tisular desde el paso 2.5 (4 μL x número de organoides previstos) al tubo de centrífuga sobre hielo.
- Pipetear cuidadosamente 20 μL de la mezcla lrECM/suspensión celular sobre moldes de parafilm; Esto formará una gota en forma de perla.
- Asegúrese de mezclar bien la mezcla de lrECM/suspensión celular; las células tienden a asentarse fácilmente dentro de la lrECM, lo que resulta en organoides heterogéneos.
- Mantenga la mezcla de lrECM/suspensión celular en hielo. Si lrECM se calienta, puede polimerizar y comprometer la formación de organoides. Asegúrese de enfriar la punta de la pipeta cada dos o tres organoides para evitar la polimerización de lrECM. No introduzca burbujas de aire en organoides (evite "empujar dos veces" la pipeta).
- Una vez que el número deseado de organoides se pipetea en el molde de parafilm en una placa de cultivo celular de 10 cm, cubrir con la tapa de la placa e incubar en una incubadora de cultivo celular a 37 °C, 5% deCO2 durante 1-2 h.
- Después de que los organoides se solidifiquen, use medios NBMc para enjuagarlos suavemente del molde de parafilm y colocarlos en una nueva placa de cultivo estéril de 10 cm con 20 ml de NBMc en total. Usar una punta p1000 funciona mejor para eliminar los organoides del molde; Se deslizarán suavemente.
NOTA: Cuando los organoides se enjuagan de los moldes en placas de cultivo celular, deben ser visibles en los medios como pequeñas esferas rosadas. Si los organoides parecen haberse desmoronado o roto en los medios, esto indica un problema anterior con lrECM que se ha polimerizado, y los organoides aún pueden crecer, pero es muy poco probable que sean uniformes en tamaño. - Colocar la placa de cultivo de 10 cm en una incubadora de cultivo celular a 37 °C, 5% deCO2 (sin agitar) durante 4 días.
NOTA: Colocar organoides en un agitador orbital en los primeros días puede hacer que se desmoronen. Asegúrese de que no estén temblando hasta el día 4. - Después de 4 días, intercambiar el medio y colocarlo en un agitador orbital a 80 RPM en una incubadora de cultivo celular a 37 °C, 5%CO2.
- El intercambio de medios con organoides inmaduros es un desafío porque son difíciles de visualizar. Incline la placa de cultivo celular y espere al menos 20 s; los organoides se asentarán en la parte inferior y permitirán que los medios de arriba se eliminen lentamente con una pipeta de vidrio o plástico de 10-20 ml.
- Preste mucha atención a la colección de organoides en la parte inferior; Si parecen agitados con la fuerza de la eliminación de medios, es mejor hacer una pausa y permitir que se reasentaran. A medida que los organoides maduran y son más fáciles de visualizar, este proceso se vuelve menos matizado.
NOTA: A veces, colocar un pedazo de papel oscuro debajo de la placa de cultivo celular puede ayudar a visualizar organoides inmaduros. Se recomienda no utilizar una pipeta Pasteur con aspiración al vacío para eliminar los medios, ya que es muy fácil aspirar y perder los organoides de esta manera. - Cuando los organoides se establecen por primera vez, no consumen medios tan rápidamente como los organoides maduros. Comenzar con un 50% de intercambios de medios reduce el uso innecesario de medios y reduce la posibilidad de dañar o aspirar accidentalmente nuevos organoides durante el proceso de intercambio de medios.
4. Generación de organoides a partir de una esfera GBM establecida, adherente o cultivo de organoides
NOTA: El objetivo aquí es hacer organoides que sean uniformes en tamaño y cantidad de células para su uso en experimentos comparativos, así que use un filtro de una sola celda y cuente las celdas para garantizar esto.
- Preparación de la suspensión unicelular a partir del cultivo de esferas de GBM.
NOTA: Los cultivos de esferas de células GBM se mantienen en medios NBMc.- Coloque las esferas en un tubo de centrífuga de 15 ml y gire a 120 x g durante 5 min.
- Retire el sobrenadante y agregue 2 ml de solución de desprendimiento de células RT. Colocar en una incubadora a 37 °C durante 3 min.
- Agregue 8 ml de medios NBMc para neutralizar la solución de desprendimiento celular. Colar a través de un filtro de una sola célula (70 μm) y girar durante 5 min a 120 x g.
- Retire el sobrenadante del tubo y vuelva a suspender las células restantes en ~ 1 ml de NBMc. Cuente las celdas (usando la tinción impermeable de la celda) y vaya al paso 4.4.
- Preparación de la suspensión unicelular a partir del cultivo adherente al GBM.
- Retire el medio usado de la placa, agregue 2 ml de solución de desprendimiento de células RT a la placa y colóquelo en una incubadora a 37 °C durante 3 minutos.
- Confirme bajo el microscopio que las células están separadas de la placa.
- Agregue 8 ml de medios NBMc para neutralizar la solución de desprendimiento celular. Colar a través de un filtro unicelular (70 μm).
NOTA: El deformación de una sola célula es opcional cuando se trabaja con cultivo adherente. - Girar durante 5 min a 120 x g. Retire el sobrenadante del tubo y vuelva a suspender las células restantes en ~ 1 ml de NBMc. Cuente las celdas (usando la tinción impermeable de la celda) y vaya al paso 4.4.
- Preparación de la suspensión unicelular a partir del cultivo de organoides GBM.
- Transfiera los organoides con una punta de pipeta p1000 cortada a una placa de cultivo de 10 cm y retire con cuidado la mayor cantidad posible de medios residuales.
- Usando dos maquinillas de afeitar estériles, pica cuidadosamente los organoides finamente. Con la punta p1000 cortada, mueva los organoides picados a un tubo de centrífuga de 15 ml y agregue ~ 2-3 ml de medios NBMc.
- Girar a 120 x g durante 3 min y retirar el sobrenadante (se recomienda utilizar una punta de pipeta en lugar de aspiración al vacío para esta parte).
- Añadir 2 ml de solución de desprendimiento de células frías durante 10 min.
NOTA: La solución de desprendimiento celular debe usarse directamente a partir de 4 °C, no calentarse primero. Esto parece suavizar cualquier matrigel restante y ayuda en la recuperación celular. - Luego pasar a una incubadora a 37 °C durante 10-20 minutos, observando y mezclando cada pocos minutos. Si aparece aglutinación, lo que puede indicar lisis celular, continúe con el siguiente paso inmediatamente.
- Agregue 8 ml de medios NBMc para diluir la solución de desprendimiento celular. Colar a través de un colador unicelular (70 μm) y girar durante 5 min a 120 x g.
- Retire el sobrenadante del tubo y vuelva a suspender las células restantes en ~ 1 ml de NBMc. Cuente las celdas (usando la tinción impermeable de la celda) y continúe con el paso 4.4.
- Fabricación de organoides a partir de una suspensión unicelular
- En una cubitera o bloque frío, coloque el lrECM y un pequeño tubo de centrífuga. Coloque la cantidad adecuada de lrECM (16 μL x X número de organoides previstos) en el pequeño tubo de centrífuga.
- Cree una mezcla de células en un volumen total (4 μL x X número de organoides previstos) que contenga 20,000 células / organoide y agregue esto al pequeño tubo de centrífuga con lrECM en hielo.
- Pipetear cuidadosamente 20 μL de la mezcla lrECM/suspensión celular sobre moldes de parafilm; Esto formará una gota en forma de perla.
- Asegúrese de mezclar bien la mezcla lrECM/suspensión celular, ya que las células tienden a asentarse fácilmente dentro de la lrECM, y esto dará como resultado organoides heterogéneos.
- Mantenga la mezcla de lrECM/suspensión celular en hielo. Si lrECM se calienta, puede polimerizar y comprometer la formación de organoides.
- Asegúrese de enfriar la punta de la pipeta cada dos o tres organoides para evitar la polimerización de lrECM. No introduzca burbujas de aire en los organoides (evite "empujar dos veces" la punta de la pipeta).
- Una vez que el número deseado de organoides se pipetea en el molde de parafilm en una placa de cultivo de 10 cm, incubar a 37 °C durante 1-2 h en una incubadora de cultivo celular.
- Después de que los organoides se solidifiquen, use medios NBMc para enjuagarlos suavemente del molde de parafilm y colocarlos en una nueva placa de cultivo estéril de 10 cm con 20 ml de NBMc en total. Usar una punta p1000 funciona mejor para eliminar los organoides del molde; Se deslizarán suavemente.
NOTA: Se recomiendan unos 15-20 organoides por plato de cultivo de 10 cm. - Colocar la placa de cultivo de 10 cm en una incubadora (sin agitar) durante 4 días.
- Después de 4 días, cambie el medio y colóquelo en un agitador orbital a 80 RPM en la incubadora de cultivo celular. Intercambie medios cada 2-3 días a partir de entonces.
- El intercambio de medios con organoides inmaduros es un desafío porque son difíciles de visualizar. Incline la placa de cultivo celular y espere al menos 20 s; Los organoides se asentarán en la parte inferior y permitirán que los medios de arriba se eliminen lentamente con una pipeta de vidrio de gran apertura.
- Preste mucha atención a la colección de organoides en la parte inferior; Si parecen agitados con la fuerza de la eliminación de medios, haga una pausa y permita que se reasentaran. A medida que los organoides maduran y son más fáciles de visualizar, este proceso se vuelve menos matizado.
NOTA: A veces, colocar un pedazo de papel oscuro debajo de la placa de cultivo celular puede ayudar a visualizar organoides inmaduros. No utilice una pipeta Pasteur con aspiración al vacío para eliminar los medios, ya que es muy fácil que los organoides sean aspirados y perdidos de esta manera. - Cuando los organoides se establecen por primera vez, no consumen medios tan rápidamente como los organoides maduros. Comience con un 50% de intercambios de medios para reducir el uso innecesario de medios y reducir la posibilidad de dañar o aspirar accidentalmente nuevos organoides durante el proceso de intercambio de medios.
5. Crioincrustación
- Coloque cada organoide en un tubo individual de 1,5 ml (usando la punta cortada p1000) que contenga 1 ml de paraformaldehído al 4% (PFA). Conservar los organoides durante la noche a 4 °C. Si incorpora organoides en parafina, continúe con la sección 6.
- Después de la fijación nocturna en PFA al 4%, lave los organoides en 1x solución salina tamponada con fosfato (PBS) tres veces.
- Transfiera el organoide a un nuevo tubo de 1,5 ml (utilizando la punta de la pipeta p1000 cortada) que contenga 1 ml de sacarosa al 30% en agua y guárdelo a 4 °C durante la noche.
- Agregue una pequeña cantidad (típicamente 1-2 ml) de compuesto de temperatura de corte óptima (OCT) a un criomolde, cubriendo el fondo y llenando aproximadamente 1/3 a 1/2 de la profundidad del molde.
- Transfiera un solo organoide a criomold usando la punta de pipeta p1000 cortada. Esto dará lugar a que algunos medios se transfieran con el organoide, lo cual es inevitable. Utilice una punta de pipeta más pequeña para retirar cuidadosamente los medios circundantes sin perturbar el organoide.
NOTA: Esto puede ser difícil de visualizar, pero el pipeteo lento demostrará una clara diferencia en las densidades entre los medios y la OCT, por lo que esto se hace "por sensación" hasta cierto punto). - Coloque el criomold en una bandeja de hielo seco. OCT comenzará a congelarse, volviéndose opaco en el proceso.
- Agregue OCT adicional para cubrir completamente el organoide, llenando el resto del volumen del criomolde. Los bloques se pueden almacenar a -20 °C para almacenamiento a corto plazo durante varios días o a -80 °C para almacenamiento a largo plazo indefinidamente.
6. Incrustación de parafina
- Ordene los organoides por tamaño (los organoides pequeños miden menos de 3 mm, los organoides grandes miden más de 3 mm). Transfiera cada organoide a un casete histológico utilizando una punta de pipeta p1000 cortada y procese en cera de parafina de acuerdo con la Tabla 2 o la Tabla 3.
NOTA: El tamaño/configuración del casete histológico depende del usuario. - Transfiera los organoides de los casetes a moldes de incrustación con 1-2 ml de cera de parafina derretida y enfríela hasta que la cera esté semisólida.
- Una vez que la cera esté parcialmente solidificada, agregue más cera a la parte superior del molde. Coloque la tapa del cassette etiquetada sobre el molde y transfiéralo a una placa fría. Continúe enfriando hasta que la cera esté completamente sólida.
- Cuando la cera se haya solidificado, secciona el bloque con un micrótomo. Alternativamente, conservar a RT o a 4 °C para seccionar posteriormente.
7. Inmunofluorescencia (IF)
- Desparafinar y rehidratar secciones de tejido incrustadas en parafina de 5-12 μm utilizando un plato de tinción de portaobjetos, de acuerdo con los siguientes pasos.
NOTA: Si se utilizan secciones de organoides integrados en OCT, recomendamos utilizar secciones de 12 μm. Retire OCT agitando la diapositiva en PBS durante 30 minutos. Vaya al paso 7.2.- Incubar durante 5 min en xileno. Repita esto dos veces más. Luego incubar durante 10 minutos en etanol al 100%. Repita esto una vez más.
- Incubar durante 10 min en etanol al 95%. Repita una vez más. Lave las secciones en agua destilada durante 5 minutos, dos veces.
- Para el desenmascaramiento de antígenos, sumerja los portaobjetos en 1x solución de desenmascaramiento de citrato (Tabla de materiales) y microondas a temperatura de subebullición durante 10 min. Asegúrese de no dejar que la solución hierva.
NOTA: Esto se logra mejor si se calienta en el microondas inicialmente durante ~ 2 minutos hasta que se produzca la ebullición, luego se reduce la potencia y se observa para asegurarse de que la solución no hierva. La temperatura de desenmascaramiento preferida es justo por debajo de 100 ° C, idealmente 98 ° C. - Deje que los portaobjetos se enfríen durante 30 minutos en RT en la solución de desenmascaramiento de citrato 1x.
NOTA: Esta es la misma solución de citrato 1x; No es necesario reemplazar la solución en este paso. - Lave los toboganes en agua destilada durante 5 minutos, dos veces.
- Lave los portaobjetos en 1x tunta TBST (solución salina tamponada con Tris con 0,1% de interpolación 20) durante 5 min.
- Retire los portaobjetos de TBST y séquelos cuidadosamente alrededor de las secciones de tejido con una toallita de limpieza de laboratorio mientras tiene cuidado de no dejar que la sección de tejido se seque. Una vez que el portaobjetos esté lo suficientemente seco, rodee las secciones de tejido con un bolígrafo de barrera hidrófobo.
- Bloquear cada sección con 100-400 μL de solución de bloqueo sérico al 10% durante 1 h en RT. Elija la solución bloqueadora del suero basada en el anticuerpo secundario. Por ejemplo, si usa un anticuerpo secundario hecho en burro, use un suero de burro normal al 10% en 1x TBST.
- Retire la solución bloqueante y luego agregue 100-400 μL de anticuerpo primario diluido a la concentración deseada en la solución bloqueante.
- A 4 °C, incubar las secciones con el anticuerpo primario durante la noche.
- Retire la solución de anticuerpos primarios y lave los portaobjetos en 1x TBST durante 5 minutos, tres veces.
- Añadir 100-400 μL de anticuerpo secundario (dilución 1:1000 en solución de bloqueo, o según las indicaciones del fabricante) a cada sección e incubar durante 1,5 h en RT.
- Lave las diapositivas en 1x TBST durante 5 minutos, dos veces. Luego lave las diapositivas en 1x PBS durante 5 minutos.
- Retire los portaobjetos de PBS y séquelos alrededor de las secciones de tejido con una toallita de limpieza de laboratorio. Agregue unas gotas de montante de curado líquido y monte un cubreobjetos de vidrio con cuidado. Una vez que los portaobjetos estén secos, guárdelos a -20 °C protegidos de la luz hasta que estén listos para la obtención de imágenes.
8. Inmunohistoquímica
- Desparafinar y rehidratar las secciones de tejido incrustadas en parafina utilizando un plato de tinción de portaobjetos, de acuerdo con los siguientes pasos.
NOTA: Si utiliza secciones de organoides incrustados en OCT, retire OCT agitando la diapositiva en PBS durante 30 minutos. Vaya al paso 8.2.- Incubar durante 5 min en xileno. Repita dos veces más.
- Incubar durante 10 min en etanol al 100%. Repita una vez más.
- Incubar durante 10 min en etanol al 95%. Repita una vez más.
- Lave las secciones en agua destilada durante 5 minutos, dos veces.
- Para el desenmascaramiento de antígenos, sumerja los portaobjetos en 1x solución de desenmascaramiento de citrato y microondas a temperatura de subebullición durante 10 min. Asegúrese de no dejar que la solución hierva.
- Deje que los toboganes se enfríen durante 30 minutos a RT en la solución de desenmascaramiento de citrato 1x.
- Lave los toboganes durante 5 minutos en agua destilada, tres veces.
- Incubar los portaobjetos durante 10 minutos en peróxido de hidrógeno al 3%.
- Lave los toboganes durante 5 minutos en agua destilada dos veces.
- Lave los portaobjetos durante 5 minutos en 1x TBST.
- Retire los portaobjetos de 1x TBST y luego use la esquina de una toallita de limpieza de laboratorio para secar cuidadosamente alrededor de las secciones de tejido.
- Rodee las secciones de tejido con un bolígrafo de barrera hidrófobo una vez que el portaobjetos esté seco.
- Colocar 100-400 μL de la solución de bloqueo en cada sección dentro del círculo de la pluma de barrera hidrófoba a RT durante 1 h. Use suero de burro normal (NDS) al 10% o albúmina sérica bovina (BSA) al 0,75% diluida en 1x TBST.
- A continuación, retire la solución de bloqueo y agregue 100-400 μL del anticuerpo primario a cada sección. Diluya este anticuerpo primario a la concentración deseada utilizando el diluyente apropiado del fabricante.
- Incubar las secciones a 4 °C durante la noche. Retire la solución de anticuerpos primarios y lave los portaobjetos en 1x TBST durante 5 minutos, tres veces.
- Añadir 100-400 μL de reactivo de detección IHQ a cada sección e incubar durante 1 h en RT. Elija el reactivo de detección IHQ de acuerdo con el anticuerpo primario.
- Lave cada sección con 1x TBST durante 5 min, dos veces, seguido de 1x PBS durante 5 min una vez.
- Prepare la solución de 3,3-diaminobencidina (DAB) de acuerdo con las instrucciones del fabricante. Agregue 100-400 μL de solución DAB a cada sección de tejido y monitoree de cerca bajo un microscopio. Entre 1-10 min proporcionará una intensidad de tinción aceptable; Asegúrese de anotar este tiempo y manténgase constante para todas las secciones de tejido.
- Después de alcanzar la intensidad de tinción deseada, sumerja los portaobjetos en agua destilada.
- Realice la antitinción de hematoxilina y la deshidratación del portaobjetos para el montaje de acuerdo con las instrucciones de la Tabla 4.
- Retire el portaobjetos del sustituto de xileno (Tabla de materiales) y limpie el líquido adicional alrededor de la sección de tejido con una toallita de limpieza de laboratorio. Use una pequeña cantidad de medio de montaje permanente para montar el cubreobjetos sobre la sección de tejido y deje secar.
9. Medición de la viabilidad celular total
- Transfiera cada organoide a un tubo de 2 ml y, con una pequeña punta de pipeta, retire con cuidado todo el exceso de medios alrededor del organoide (ver Figura 3 para el esquema de este procedimiento).
NOTA: Los ensayos de viabilidad celular deben realizarse con organoides que se hicieron con números idénticos de células. Este experimento no debe realizarse en organoides hechos directamente de muestras de pacientes de cirugía, de organoides cortados formados u otros casos en los que las células individuales no se filtraron y contaron. - Prepare el reactivo del ensayo de viabilidad celular luminiscente y 1x PBS en proporción 1:1 y agregue 500 μL a cada tubo.
- Use una punta de pipeta p1000 para pipetear agresivamente hacia arriba y hacia abajo para descomponer el organoide y dejar reposar durante 5 minutos. El organoide debería estar algo disociado y más suave a estas alturas; Vuelva a mezclar con la punta de pipeta P1000.
- El objetivo es tener un volumen total de 100 μL por pocillo de una placa de 96 pocillos. Agregue 25 μL de la mezcla del paso 9.3 (tendrá suficiente para múltiples réplicas técnicas) y agregue 75 μL de ensayo de viabilidad celular luminiscente restante y mezcla de PBS.
- Coloque la placa en una coctelera durante 2 minutos y luego incube durante 20 minutos en RT.
- Lea la placa utilizando un ajuste de luminiscencia en un lector de placas y recopile los datos (consulte la figura 4).
Resultados
La Figura 1 muestra el crecimiento temprano de organoides visto a través de microscopía óptica con un aumento de 10x. La Figura 1A muestra la migración e invasión de celdas individuales a través de lrECM en la vista central. Las células continuarán expandiéndose y "colonizando" el lrECM, y aparecerán más densas y eventualmente opacas mediante inspección visual. La Figura 1B muestra varios organoides maduros (a las 7 semanas) sin aumento, en relación con el tamaño de una moneda de diez centavos.
La Figura 2 demuestra la tinción inmunohistoquímica de los organoides GBM para la fosfohistona H3, un marcador de proliferación activa. La mayoría de las células altamente proliferativas se ven en el perímetro del organoide en comparación con el núcleo del organoide. La tinción positiva tendrá una apariencia marrón / cobriza.
La Figura 3 describe el proceso para homogeneizar y medir el número total de células en organoides GBM utilizando un ensayo de viabilidad celular luminiscente específico en 3D. Debido al alto número de células presentes en los organoides GBM, la estructura organoide más grande se homogeneiza inicialmente mediante trituración en reactivo de ensayo luminiscente. Luego, las fracciones del lisado organoide total se cargan en pocillos individuales y se diluyen con un reactivo de ensayo luminiscente adicional antes de la incubación y la lectura en un lector de placas de múltiples pocillos apropiado.
La Figura 4 representa los datos de control DMSO (vehículo común) para organoides. Los datos trazados demuestran consistencia intraorganoide e interorganoide. Los datos de viabilidad luminiscente normalmente se normalizarán a los controles para cada espécimen al generar datos experimentales.
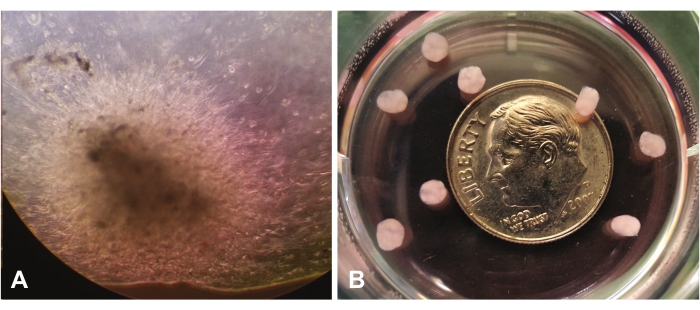
Figura 1: Vista a través de un microscopio óptico (10x). (A) Crecimiento temprano de organoides que demuestra la migración/invasión de células GBM a través de la matriz extracelular rica en laminina. (B) Organoides maduros en relación con el tamaño de una moneda de diez centavos. Haga clic aquí para ver una versión más grande de esta figura.
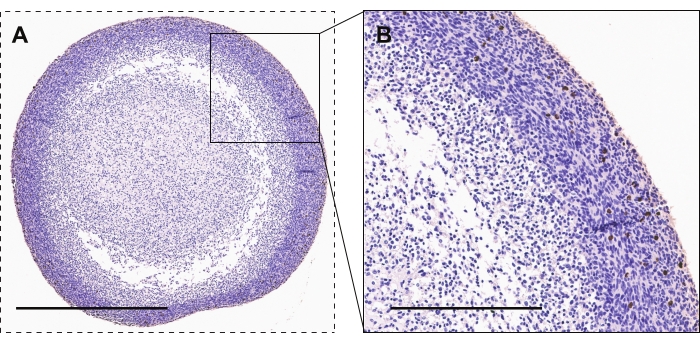
Figura 2: Inmunohistoquímica de organoides GBM . (A, B) Organoides GBM que muestran células teñidas con fosfohistona H3 para la proliferación activa. Las barras de escala son de 600 μm y 300 μm para A y B, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
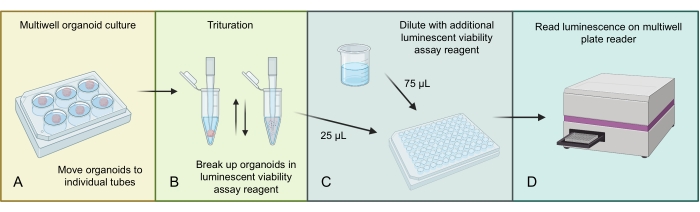
Figura 3: Protocolo de viabilidad celular luminiscente para organoides. (A) Mover organoides individuales a pequeños tubos de centrífuga y eliminar el exceso de medios. (B) Añadir 500 μL de PBS 1:1 y mezcla de ensayo de viabilidad celular luminiscente a cada tubo y pipetear agresivamente para descomponer el organoide. (C) Añadir 25 μL de esta mezcla de organoides y 75 μL de la misma mezcla de 1:1 PBS y ensayo de viabilidad celular luminiscente a cada pocillo de una placa de 96 pocillos. (D) Coloque en un agitador durante 2 minutos, seguido de la incubación durante 20 minutos en RT, y luego lea la luminiscencia en un lector de placas. Figura hecha usando BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
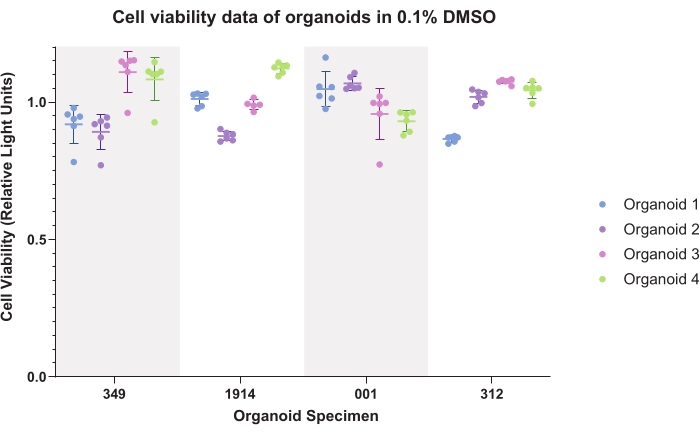
Figura 4: Viabilidad celular. Datos de viabilidad celular para organoides en dimetilsulfóxido (DMSO) al 0,1% para seis réplicas técnicas de cuatro organoides para cuatro muestras de pacientes. Haga clic aquí para ver una versión más grande de esta figura.
| Componente | Cantidad |
| Medio neurobasal menos rojo fenol | 500 ml |
| Suplemento B-27 menos vitamina A (50x) | 10 ml |
| Antibiótico-antimicótico (100x) | 5 ml |
| Pirugranato de sodio (100 mM) | 5 ml |
| Glutamina en NaCl al 0,85% (200 mM) | 5 ml |
| FGF humano recombinante básico (250 μg/mL) | 20 μL |
| Proteína EFG humana recombinante (250 μg/mL) | 20 μL |
| Rojo fenol | 500 μL |
Tabla 1: Formulación del medio neurobasal completo (NBMc)
| Reactivo | Hora |
| 50% Etanol | 3 minutos |
| 75% Etanol | 3 minutos |
| 95% Etanol | 3 minutos |
| 95% Etanol | 4 minutos |
| 100% Etanol | 2 minutos |
| 100% Etanol | 3 minutos |
| 100% Etanol | 4 minutos |
| Sustituto de xileno | 2 minutos |
| Sustituto de xileno | 3 minutos |
| Sustituto de xileno | 4 minutos |
| Parafina | 15 minutos |
| Parafina | 15 minutos |
Tabla 2: Calendario de procesamiento para organoides pequeños (menos de 3 mm de diámetro)
| Reactivo | Hora |
| 50% Etanol | 6 minutos |
| 75% Etanol | 6 minutos |
| 95% Etanol | 5 minutos |
| 95% Etanol | 8 minutos |
| 100% Etanol | 5 minutos |
| 100% Etanol | 5 minutos |
| 100% Etanol | 8 minutos |
| Sustituto de xileno | 5 minutos |
| Sustituto de xileno | 5 minutos |
| Sustituto de xileno | 8 minutos |
| Parafina | 30 minutos |
| Parafina | 30 minutos |
Tabla 3: Calendario de procesamiento para organoides grandes (más de 3 mm de diámetro)
| Reactivo | Hora |
| Hematoxilina | 2 minutos |
| Corriendo diH2O | 2 minutos |
| Reactivo clarificante de hematoxilina nuclear | 1 minuto |
| Corriendo diH2O | 1 minuto |
| Reactivo de azulado | 1 minuto |
| Corriendo diH2O | 2 minutos |
| 70% etanol | 1 minuto |
| 100% etanol | 1 minuto |
| 100% etanol | 1 minuto |
| Sustituto de xileno | 2 minutos |
| Sustituto de xileno | 2 minutos |
Tabla 4: Contratinción de hematoxilina
Discusión
Los organoides GBM son un método de cultivo complementario a las esferas tradicionales que incluyen mayor heterogeneidad celular y microambiental 4,22,30. Aunque requiere más tiempo y recursos, el cultivo de organoides puede ofrecer información valiosa sobre el comportamiento intratumoral y los mecanismos de resistencia a los medicamentos.
GBM es impulsado por una población de CSC 5,31, y estos métodos fueron desarrollados para permitir el crecimiento continuo y la auto-renovación de esta población de CSC. Se sabe que el factor de crecimiento epidérmico (EGF) y el factor de crecimiento de fibroblastos (FGF) mejoran el mantenimiento y el crecimiento de las células madre y proporcionan señalización activa del receptor tirosina quinasa (RTK). La formación de poblaciones celulares heterogéneas y microambientes tumorales distintos dentro de los tumores GBM depende del apoyo a los comportamientos de CSC. La selección de un lrECM imita el entorno cerebral rico en laminina y ayuda a las células en cultivo de organoides a autoorganizarse y migrar por invasión. Aunque algunos grupos han establecido el cultivo de organoides sin el uso de un medio enriquecido con lrECM o EGF/FGF24,28, lo que puede ofrecer una manera más eficiente en el tiempo de este método de cultivo y una selección más fuerte de señalización oncogénica para impulsar el crecimiento, estos métodos fueron elegidos para optimizar el entorno de células madre para establecer mejor la heterogeneidad celular de los organoides. Tanto los organoides cerebrales como los organoides GBM han sido elaborados con lrECM en la literatura previamente 21,32,33. Aunque hemos establecido datos sobre las poblaciones tumorales encontradas dentro de los organoides y la variación espacial, se sabe menos sobre las poblaciones no tumorales dentro de los organoides y cuánto tiempo sobreviven de las muestras originales de pacientes. Ciertas tinciones IHQ (como CD45) pueden proporcionar estos datos, y podrían ser un punto interesante de investigación en el futuro con organoides.
Conocer el uso previsto para el cultivo de organoides es importante para seleccionar los métodos apropiados. El establecimiento de organoides a partir de especímenes primarios versus el cultivo de organoides uniformes para experimentos específicos tiene procedimientos ligeramente diferentes. Apreciar cómo los organoides maduran y llenan visualmente el andamio lrECM es importante para poder asignar el tiempo y los recursos adecuados al cultivo de organoides. Las regiones dispersas de células en los organoides se expandirán y crecerán lentamente para llenar la lrECM, lo que puede tomar de 2 a 8 semanas, dependiendo del comportamiento de la muestra. Esta tasa de crecimiento es algo intrínseca a cada espécimen; Se conserva en diferentes lotes de organoides y es bastante consistente con la tasa relativa de crecimiento de la esfera. Los organoides se pueden mantener durante más de 1 año y retener las capacidades de formación de tumores en xenoinjertos en ratones; Sin embargo, se recomienda cultivarlos con un propósito distinto para no desperdiciar recursos de laboratorio (tanto materiales como tiempo)4. El crecimiento de organoides se ha probado en múltiples tamaños y formatos de pozo, y muestra que una placa de 10 cm es el entorno ideal para mantener una viabilidad celular óptima, seguida de una placa de 6 pocillos con tres organoides por pocillo34. Los organoides consumen más medios en comparación con sus contrapartes de cultivo bidimensionales, y el uso de un formato de pozo más pequeño no conduce a un mantenimiento adecuado. Por ejemplo, un pocillo de una placa de formato de 96 pocillos no tiene suficiente espacio o volumen de medios en relación con el tamaño de un organoide para sostener el crecimiento del organoide.
Como establecen los organoides, ser observador es importante para aumentar el éxito. Inicialmente, los organoides consumirán medios lentamente, pero a medida que se vuelven más densos y maduros, consumirán medios más rápidamente. Agregar rojo fenol a los medios puede ayudar a servir como un indicador del consumo de medios. Cuando el medio es más amarillo, puede incitar a ajustar el patrón de alimentación, ya sea para intercambiar un mayor volumen de medios, aumentar la cantidad total de medios en la placa, dividir organoides entre múltiples placas de cultivo celular para mantenerse al día con su crecimiento, o incluso ajustar la línea de tiempo para experimentos.
En muchos sentidos, los organoides son una forma ineficiente de realizar investigaciones sobre el cáncer. Implican escalas de tiempo largas, y son costosos y requieren muchos recursos en comparación con la cultura de la esfera GBM. Sin embargo, en comparación con los xenoinjertos derivados de pacientes, un método alternativo para recrear la diversidad celular y microambiental, son más sencillos, menos costosos y controlables. La selección de cuándo usar mejor los organoides es importante para los investigadores del cáncer. No pretenden reemplazar la esfera tradicional o el cultivo adherente y no reemplazar los modelos de xenoinjerto. Los organoides pueden, cuando se aplican a la pregunta científica correcta, combinar los beneficios de ambos sistemas y pueden permitirnos observar la biología de las células tumorales que de otro modo permanecerían ocultas. La comunidad científica apenas está empezando a comprender qué oportunidades de aprendizaje ofrecen los organoides, pero está claro que serán una herramienta invaluable en el futuro para comprender la compleja biología del GBM.
Divulgaciones
Los autores no tienen conflictos que revelar.
Agradecimientos
Nos gustaría agradecer al Dr. Justin Lathia por sus valiosos consejos y apoyo continuo. También agradecemos a Katrina Fife, Lisa Wallace y Maya Camhi por su excelente apoyo técnico.
Materiales
| Name | Company | Catalog Number | Comments |
| 3,3-Diaminobenzidine (DAB) tablets | MP Biomedicals | 08980681 | 3,3-Diaminobenzidine (DAB) tablets |
| 96-well PCR plates | ThermoFisher Scientific | 96-well PCR plates | |
| Accutase | ThermoFisher Scientific | SCR005 | Cell detachment solution |
| Antibiotic-antimycotic | ThermoFisher Scientific | 15240062 | Antibiotic-antimycotic |
| B-27 supplement minus vitamin A | ThermoFisher Scientific | 12587001 | B-27 supplement minus vitamin A (50x) |
| GelCode Blue Stain Reagent | ThermoFisher Scientific | 24590 | Bluing reagent |
| Cell strainer (70 µm) | CellTreat Scientific | 229483 | Cell strainer (70 µm) |
| CellTiter-Glo 3D | Promega | G9681 | Luminescent cell viability assay |
| Clarifier 2 | ThermoFisher Scientific | 7301 | Nuclear hematoxylin clarifying reagent |
| Clear-Rite 3 | ThermoFisher Scientific | 6901 | xylene substitute |
| Epredia Gill 2 Hematoxylin | ThermoFisher Scientific | 72504 | Hematoxylin |
| Glutamine in 0.85% NaCl | ThermoFisher Scientific | 35050061 | Glutamine in 0.85% NaCl (200 mM) |
| Matrigel | ThermoFisher Scientific | 354234 | Laminin-enriched extracellular matrix |
| Mini PAP pen | ThermoFisher Scientific | 008877 | Hydrophobic barrier pen |
| Mounting medium | ThermoFisher Scientific | 22-050-102 | Mounting medium |
| Neurobasal media minus phenol red | ThermoFisher Scientific | 12349015 | Neurobasal media minus phenol red (500 mL) |
| Normal donkey serum (NDS) | Jackson ImmunoResearch | 017-000-121 | Normal donkey serum (NDS) |
| Paraformaldehyde 4% in PBS | ThermoFisher Scientific | AAJ19943K2 | Paraformaldehyde 4% in PBS |
| Phenol red | Sigma | P0290 | Phenol red (0.5%) |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P10144 | Liquid curing mountant |
| Recombinant human EGF protein | R&D systems | 236-EG-01M | Recombinant human EGF protein (250 µg/mL) |
| Recombinant human FGF basic | R&D systems | 4144-TC-01 | Recombinant human FGF basic (250 µg/mL) |
| SignalStain Antibody Diluent | Cell Signaling | 8112 | Antibody diluent |
| SignalStain Boost IHC Detection Reagent | Cell Signaling | 8114 | Immunohistochemistry detection reagent |
| SignalStain Citrate Unmasking Solution | Cell Signaling | 14746 | Citrate unmasking solution |
| Single edge razor blade | Uline | H-595B | Single edge razor blade |
| Sodium pyruvate | ThermoFisher Scientific | 11360070 | Sodium pyruvate (100 mM) |
| Tissue-Tek Cryomolds | VWR | 25608-916 | Disposable cryomolds |
| Tissue-Tek O.C.T. Compound | VWR | 25608-930 | Optimal cutting temperature compound |
| Trypan Blue Stain | ThermoFisher Scientific | T10282 | Cell impermeant stain (0.4%) |
| Xylene | ThermoFisher Scientific | X3P-1GAL | Xylene |
Referencias
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352 (10), 987-996 (2005).
- Heffernan, J. M., Sirianni, R. W. Modeling microenvironmental regulation of glioblastoma stem cells: a biomaterials perspective. Frontiers in Materials. 5, 7 (2018).
- Zanders, E. D., Svensson, F., Bailey, D. S. Therapy for glioblastoma: is it working. Drug Discovery Today. 24 (5), 1193-1201 (2019).
- Hubert, C. G., et al. A Three-dimensional organoid culture system derived from human glioblastomas recapitulates the hypoxic gradients and cancer stem cell heterogeneity of tumors found in vivo. Cancer Research. 76 (8), 2465-2477 (2016).
- Lathia, J. D., Heddleston, J. M., Venere, M., Rich, J. N. Deadly teamwork: neural cancer stem cells and the tumor microenvironment. Cell Stem Cell. 8 (5), 482-485 (2011).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), 851-856 (2015).
- Bao, S., et al. Stem cell-like glioma cells promote tumor angiogenesis through vascular endothelial growth factor. Cancer Research. 66 (16), 7843-7848 (2006).
- Yu, S. C., Bian, X. W. Enrichment of cancer stem cells based on heterogeneity of invasiveness. Stem Cell Reviews and Reports. 5 (1), 66-71 (2009).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Vescovi, A. L., Galli, R., Reynolds, B. A. Brain tumour stem cells. Nature Reviews. Cancer. 6 (6), 425-436 (2006).
- Zhu, T. S., et al. Endothelial cells create a stem cell niche in glioblastoma by providing NOTCH ligands that nurture self-renewal of cancer stem-like cells. Cancer Research. 71 (18), 6061-6072 (2011).
- Calabrese, C., et al. A perivascular niche for brain tumor stem cells. Cancer Cell. 11 (1), 69-82 (2007).
- Charles, N., et al. Perivascular nitric oxide activates notch signaling and promotes stem-like character in PDGF-induced glioma cells. Cell Stem Cell. 6 (2), 141-152 (2010).
- Seidel, S., et al. A hypoxic niche regulates glioblastoma stem cells through hypoxia inducible factor 2 alpha. Brain. 133, 983-995 (2010).
- Yan, K., et al. Glioma cancer stem cells secrete Gremlin1 to promote their maintenance within the tumor hierarchy. Genes & Development. 28 (10), 1085-1100 (2014).
- Cheng, L., et al. Glioblastoma stem cells generate vascular pericytes to support vessel function and tumor growth. Cell. 153 (1), 139-152 (2013).
- Flavahan, W. A., et al. Brain tumor initiating cells adapt to restricted nutrition through preferential glucose uptake. Nature Neuroscience. 16 (10), 1373-1382 (2013).
- Hjelmeland, A. B., et al. Acidic stress promotes a glioma stem cell phenotype. Cell Death and Differentiation. 18 (5), 829-840 (2011).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. The American Journal of Pathology. 177 (3), 1491-1502 (2010).
- Li, Z., et al. Hypoxia-inducible factors regulate tumorigenic capacity of glioma stem cells. Cancer Cell. 15 (6), 501-513 (2009).
- Azzarelli, R., Ori, M., Philpott, A., Simons, B. D. Three-dimensional model of glioblastoma by co-culturing tumor stem cells with human brain organoids. Biology Open. 10 (2), 056416 (2021).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Reports. 26 (12), 3203-3211 (2019).
- da Silva, B., Mathew, R. K., Polson, E. S., Williams, J., Wurdak, H. Spontaneous glioblastoma spheroid infiltration of early-stage cerebral organoids models brain tumor invasion. SLAS Discovery: Advancing Life Sciences R & D. 23 (8), 862-868 (2018).
- Jacob, F., et al. A Patient-derived glioblastoma organoid model and biobank recapitulates inter- and intra-tumoral heterogeneity. Cell. 180 (1), 188-204 (2020).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nature Cell Biology. 21 (8), 1041-1051 (2019).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Ledur, P. F., Onzi, G. R., Zong, H., Lenz, G. Culture conditions defining glioblastoma cells behavior: what is the impact for novel discoveries. Oncotarget. 8 (40), 69185-69197 (2017).
- Lenin, S., et al. A drug screening pipeline using 2D and 3D patient-derived in vitro models for preclinical analysis of therapy response in glioblastoma. International Journal of Molecular Sciences. 22 (9), 4322 (2021).
- Rybin, M. J., Ivan, M. E., Ayad, N. G., Zeier, Z. Organoid models of glioblastoma and their role in drug discovery. Frontiers in Cellular Neuroscience. 15 (4), 605255 (2021).
- Shakya, S., et al. Altered lipid metabolism marks glioblastoma stem and non-stem cells in separate tumor niches. Acta Neuropathologica Communications. 9 (1), 101 (2021).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Bian, S., et al. Genetically engineered cerebral organoids model brain tumor formation. Nature Methods. 15 (8), 631-639 (2018).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Sundar, S. J., et al. Three-dimensional organoid culture unveils resistance to clinical therapies in adult and pediatric glioblastoma. Translational Oncology. 15 (1), 101251 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados