Method Article
Manutenção da Diversidade Celular Glioblastoma Humano Ex vivo usando cultura organoide tridimensional
Neste Artigo
Resumo
Aqui, descrevemos um método de geração de organoides de glioblastoma (GBM) a partir de amostras de pacientes primários ou culturas celulares derivadas do paciente e mantê-los até a maturidade. Esses organoides GBM contêm populações de células fenotipicamente diversas e recriam microambientes tumorais ex vivo.
Resumo
Glioblastoma (GBM) é o câncer cerebral maligno primário mais comumente ocorrido com um prognóstico extremamente ruim. A diversidade celular e molecular intra-tumoral, bem como interações complexas entre microambientes tumorais, podem tornar a busca de tratamentos eficazes um desafio. Métodos tradicionais de cultura aderente ou esfera podem mascarar tais complexidades, enquanto a cultura organoide tridimensional pode recapitular gradientes microambientais regionais. Organoides são um método de cultura gbm tridimensional que imita melhor a arquitetura tumoral do paciente, contém populações de células fenotipicamente diversas e pode ser usado para experimentos de médio rendimento. Embora a cultura organoide tridimensional seja mais trabalhosa e demorada em comparação com a cultura tradicional, ela oferece benefícios únicos e pode servir para preencher a lacuna entre os sistemas in vitro atuais e in vivo . Os organoides estabeleceram-se como ferramentas inestimáveis no arsenal de biólogos do câncer para entender melhor o comportamento do tumor e os mecanismos de resistência, e suas aplicações só continuam a crescer. Aqui, são fornecidos detalhes sobre métodos de geração e manutenção de organoides GBM. Instruções de como realizar a incorporação e secção de amostras organoides usando técnicas congeladas e de incorporação de parafina, bem como recomendações para protocolos de imunohistoquímica e imunofluorescência em seções organoides, e medição da viabilidade total das células organoides, também são descritas.
Introdução
Glioblastoma (GBM) é o tumor cerebral primário mais comumente ocorrência com um prognóstico sombrio de aproximadamente 15 meses a partir do diagnóstico1. Tratamentos eficazes em estudos pré-clínicos podem muitas vezes ser pouco eficazes em pacientes 2,3. A má resposta clínica é atribuída a muitos fatores, incluindo a heterogeneidade microambiental do GBM e interações intra-tumorais complexas. Estes podem ser difíceis de recriar no ambiente de laboratório com métodos tradicionais de cultura aderente ou esfera4. A presença de um subconjunto de células-tronco cancerígenas autoconexantes (CSCs) dentro do GBM também pode contribuir para essa complexidade 5,6. Os CSCs são cruciais para a propagação do tumor e mantêm o crescimento do tumor, promovendo angiogênese ativa, invasão do câncer e resistência a terapias, incluindo radiação 7,8,9. Os CSCs não são uniformemente distribuídos em todos os tumores, mas sim são enriquecidos dentro de microambientes específicos, incluindo o nicho perivascular e regiões perinecroticas, que cada uma fornece regulação molecular distinta de seus estados celulares 10,11,12,13,14. Os CSCs não são receptores passivos de pistas microambientais, mas possuem a capacidade de remodelar seus próprios microambientes 7,15,16. O microambiente de um CSC pode promover a manutenção do estado das células-tronco em resposta a pressões como escassez de nutrientes, pH e hipóxia 17,18,19,20, sugerindo a importância dessas condições em um sistema modelo. A recapitulação do diversos microambientes celulares dentro dos tumores é, portanto, fundamental para compreender a resistência terapêutica e identificar novas terapias.
A cultura tridimensional aumentou em popularidade nos últimos anos21,22. Organoides têm sido usados em outros tipos de câncer, e o objetivo principal de manter as células como organoides é permitir o crescimento de populações de células heterogêneas (muitas das quais normalmente podem ser superadas em cultura de esferas mais homogêneas) e diversidade espacial, vistas como microambientes tumorais regionais com especificidade genética 4,23,24,25,26 . Existem muitos métodos para a cultura tridimensional das células cancerosas, que cada uma tem vantagens e desvantagens 27,28,29. A cultura organoide não se destina a ser um substituto para a cultura tradicional de adeptos ou esferas. É melhor usado como técnica complementar a métodos bidimensionais quando há questões específicas onde a interação entre microambiente celular e respostas de células tumorais é crítica.
Este artigo descreve métodos confiáveis e repetitivos para gerar organoides GBM a partir de amostras de pacientes primários ou culturas derivadas do paciente. Abordamos dois objetivos diferentes para a cultura organoide tridimensional: (1) estabelecer organoides a partir do tecido primário do paciente, com potencial máximo de engrafamento, independentemente da uniformidade, ou (2) organoides uniformes em crescimento para uso experimental mais quantitativo. Ao estabelecer um espécime primário como organoides, não é necessário filtrar para células únicas ou contar células, pois manter o número máximo de células e tipos para estabelecer a cultura inicial é uma prioridade. Quando os organoides em crescimento para experimentos comparativos, no entanto, a filtração de células únicas e a contagem celular são necessárias para garantir que os organoides de replicação sejam comparáveis para a consistência experimental. Este protocolo detalha como estabelecer culturas organoides e criar organoides uniformes, bem como métodos refinados para incorporar e preservar organoides e experimentos de cultura celular padrão, incluindo imunohistoquímica, imunofluorescência e avaliação da viabilidade celular total em organoides GBM.
Protocolo
Todas as etapas do protocolo detalhados abaixo foram desenvolvidas e conduzidas de acordo com o Protocolo nº 2559 do Cleveland Clinic Institutional Review Board (IRB) e aprovação do Comitê de Biossegurança Institucional (IBC) nº 1711. Esferas e organoides são cultivados em "Neurobasal Media Complete" (NBMc). Consulte a Tabela 1 para obter instruções.
1. Fabricação de moldes organoides
- Tire o papel de cera da folha de parafilm (aproximadamente 4 cm x 4 cm de tamanho) e coloque-o entre duas placas de reação de corrente de polimerase de 96 poços (PCR).
- Realize essas etapas no capô da cultura e tome cuidado especial para manter o "interior" do parafilm (o lado que é coberto pelo papel) limpo. Este lado limpo deve fazer a concavidade das recuos.
- Aplique até pressão na placa pcr de 96 poços para formar pequenas covinhas no parafilme. O objetivo é que as covinhas tenham aproximadamente 2 mm de profundidade sem criar furos no parafilme.
- Separe as duas placas PCR de 96 poços suavemente. O parafilme dimpled vai ficar na placa superior. Coloque isso em gelo seco por cerca de 30 s.
- Depois que o parafilm estiver em gelo seco por 30 s, use fórceps estéreis para puxar o parafilm da placa pcr de 96 poços.
- Ao remover o parafilm, use um movimento rápido em vez de ser muito "cuidadoso". Parafilm congelado é mais fácil de remover do que o parafilme aquecido, o que pode fazer com que as covinhas invertam.
- Coloque o molde de parafilme completo em um prato coberto e estéril de cultura celular de 10 cm. Os moldes podem ser feitos com antecedência e armazenados se a esterilidade for mantida.
2. Macrodisseção da amostra de tecido do paciente
- Em um prato de cultura estéril (placas de cultura celular de 10 cm), use duas lâminas de barbear estéreis para picar finamente a amostra do paciente enquanto aplica pressão uniforme.
NOTA: Picar o espécime é mais fácil com cerca de 500 μL de NBMc no prato de cultura. Tente com lâminas de barbear para picar pedaços tão finamente quanto possível; idealmente, as peças individuais são 1 mm3 ou menores. - Transfira as peças tumorais finamente picadas para um tubo centrífuga de 15 mL usando uma ponta de pipeta p1000 cortada.
NOTA: Sempre que manusear organoides, é importante usar apenas pontas de pipeta p1000 cortadas. Estes podem ser cortados usando uma navalha afiada para o tamanho de abertura desejado (entre 5 e 8 mm aproximadamente) e autoclaved. - Adicione 2 mL de solução de desprendimento celular (RT) de temperatura ambiente (Tabela de Materiais) e coloque-a em uma incubadora de 37 °C, 5% CO2 por aproximadamente 10 minutos.
NOTA: Observe e misture a cada poucos minutos. Algumas soluções de destacamento celular ou espécimes podem precisar de tempos variados de incubação. Se aparecer o clumping, que pode indicar liberação de DNA devido à lise celular, proceda imediatamente para o próximo passo. - Adicione 8 mL de mídia NBMc para neutralizar a solução de descolamento celular e gire por 3 min a 65 x g.
- Aspire o supernatante e resuspenda o tecido em 1-2 mL de NBMc.
3. Geração de organoides a partir do tecido do paciente primário
NOTA: O objetivo ao fazer organoides a partir do tecido do paciente primário é estabelecer a cultura tridimensional. Não filtre células únicas ou células de contagem, mas mantenha a carga celular inicial o mais uniforme possível usando inspeção visual. É normal ter heterogeneidade no crescimento e estabelecimento de organoides iniciais. Cada organoide terá 20 μL em volume (16 μL de matriz extracelular rica em laminina (lrECM) e 4 μL de tecido suspenso em NBMc, a partir da etapa 2.5). As instruções podem ser ajustadas para o número de organoides pretendidos; o objetivo é tipicamente formar cerca de 20-30 organoides a partir de amostras de pacientes primários.
- Em um balde de gelo ou bloco frio, coloque o LrECM e um pequeno tubo de centrífuga. Coloque a quantidade apropriada de 16 μL x X número de organoides pretendidos) no pequeno tubo de centrífuga.
- Adicione o volume apropriado de suspensão do tecido da etapa 2.5 (4 μL x número de organoides pretendidos) ao tubo de centrífuga no gelo.
- Pipeta cuidadosamente 20 μL da mistura lrECM/suspensão celular em moldes de parafilm; isso formará uma gota semelhante a uma pérola.
- Certifique-se de misturar bem a mistura lrECM/suspensão celular; as células tendem a se estabelecer facilmente dentro do LrECM, resultando em organoides heterogêneos.
- Mantenha a mistura lrECM/suspensão celular no gelo. Se o 1ECM aquecer, pode polimerizar e comprometer a formação organoide. Certifique-se de esfriar a ponta da pipeta a cada dois ou três organoides para evitar a polimerização do 1ECM. Não introduza bolhas de ar em organoides (evite "empurrar duas vezes" a pipeta).
- Uma vez que o número desejado de organoides são pipetados em molde de parafilme em uma placa de cultura celular de 10 cm, cubra com tampa de placa e incubar em uma incubadora de cultura celular a 37 °C, 5% CO2 para 1-2 h.
- Após os organoides se solidificarem, use mídia NBMc para lavá-los suavemente do molde de parafilme e em uma nova placa de cultura estéril de 10 cm com 20 mL de NBMc total. Usar uma ponta p1000 funciona melhor para tirar os organoides do molde; eles vão deslizar suavemente.
NOTA: Quando os organoides são lavados dos moldes em placas de cultura celular, eles devem ser visíveis na mídia como pequenas esferas cor-de-rosa. Se os organoides parecem ter desmoronado ou quebrado na mídia, isso indica um problema anterior com o LrECM tendo polimerizado, e organoides ainda podem crescer, mas será muito improvável que seja uniforme em tamanho. - Coloque o prato de cultura de 10 cm em uma incubadora de cultura celular a 37 °C, 5% DE CO2 (sem agitação) por 4 dias.
NOTA: Colocar organoides em um agitador orbital nos dias iniciais pode fazer com que eles desmoronem. Certifique-se de que eles não estão tremendo até o dia 4. - Após 4 dias, troque a mídia e coloque em um agitador orbital a 80 RPM em uma incubadora de cultura celular a 37 °C, 5% DE CO2.
- Trocar mídia com organoides imaturos é desafiador porque são difíceis de visualizar. Incline o prato de cultura celular e espere pelo menos 20 s; os organoides se estabelecerão na parte inferior e permitirão que a mídia de cima seja removida com uma pipeta de vidro ou plástico de 10-20 mL lentamente.
- Preste atenção à coleta de organoides na parte inferior; se eles aparecerem agitados com a força de remoção da mídia, é melhor fazer uma pausa e permitir que eles se reassentem. À medida que os organoides amadurecem e são mais fáceis de visualizar, esse processo se torna menos nuances.
NOTA: Às vezes, colocar um pedaço de papel escuro sob a placa de cultura celular pode ajudar a visualizar organoides imaturos. É aconselhável não usar uma pipeta Pasteur com sucção a vácuo para remover a mídia, pois é muito fácil para os organoides serem sugados e perdidos desta forma. - Quando os organoides são estabelecidos pela primeira vez, eles não consomem mídia tão rapidamente quanto organoides maduros. A partir de 50% das trocas de mídia reduz o uso desnecessário de mídia e reduz a chance de danificar acidentalmente ou aspirar novos organoides durante o processo de troca de mídia.
4. Geração de organoides a partir da cultura gbm estabelecida, aderente ou organoide
NOTA: O objetivo aqui é fazer organoides que são uniformes em tamanho e quantidade celular para uso em experimentos comparativos, então use um filtro de célula única e conte células para garantir isso.
- Preparando suspensão unicelular da cultura da esfera GBM.
NOTA: As culturas de esfera das células GBM são mantidas em mídia NBMc.- Coloque esferas em um tubo de centrífuga de 15 mL e gire a 120 x g por 5 min.
- Remova o supernatante e adicione 2 mL de solução de desprendimento de células RT. Coloque em uma incubadora de 37 °C por 3 min.
- Adicione 8 mL de mídia NBMc para neutralizar a solução de desprendimento celular. Coe através de um único coador de células (70 μm) e gire por 5 min a 120 x g.
- Remova o supernascedor do tubo e resuspense as células restantes em ~1 mL de NBMc. Conte as células (usando a mancha impermeável celular) e pule para o passo 4.4.
- Preparando suspensão unicelular da cultura aderente gbm.
- Retire a mídia usada da placa, adicione 2 mL de solução de descolamento de células RT à placa e coloque em uma incubadora de 37 °C por 3 min.
- Confirme sob o microscópio que as células estão separadas da placa.
- Adicione 8 mL de mídia NBMc para neutralizar a solução de desprendimento celular. Coe através de um coador de célula única (70 μm).
NOTA: O esforço de célula única é opcional ao trabalhar com cultura aderente. - Gire por 5 min a 120 x g. Remova o supernascedor do tubo e resuspense as células restantes em ~1 mL de NBMc. Conte as células (usando a mancha impermeável celular) e pule para o passo 4.4.
- Preparando suspensão unicelular da cultura organoide GBM.
- Transfira os organoides usando uma ponta de pipeta p1000 cortada para uma placa de cultura de 10 cm e remova cuidadosamente o máximo de mídia residual possível.
- Usando duas lâminas estéreis, cuidadosamente picado organoides finamente. Com a ponta p1000 cortada, mova os organoides picados para um tubo de centrífuga de 15 mL e adicione ~2-3 mL de mídia NBMc.
- Gire a 120 x g por 3 min e remova o supernatante (recomendo usar uma ponta de pipeta em vez de aspiração de vácuo para esta parte).
- Adicione 2 mL de solução de descolamento de células frias por 10 minutos.
NOTA: A solução de desprendimento celular deve ser usada diretamente a partir de 4 °C, não aquecida primeiro. Isso parece suavizar qualquer matrigel restante e auxilia na recuperação celular. - Em seguida, mova-se para uma incubadora de 37 °C por 10-20 min, observando e misturando a cada poucos minutos. Se aparecer o clumping, que pode indicar lise celular, proceda imediatamente para o próximo passo.
- Adicione 8 mL de mídia NBMc para diluir a solução de descolamento celular. Coe através de um coador de célula única (70 μm) e gire por 5 min a 120 x g.
- Remova o supernascedor do tubo e resuspense as células restantes em ~1 mL de NBMc. Conte as células (usando mancha impermeável celular) e prossiga para o passo 4.4.
- Fazendo organoides a partir de uma suspensão de células únicas
- Em um balde de gelo ou bloco frio, coloque o LrECM e um pequeno tubo de centrífuga. Coloque a quantidade apropriada de 16 μL x X número de organoides pretendidos) no pequeno tubo de centrífuga.
- Crie uma mistura de células em um volume total (4 μL x X número de organoides pretendidos) que conterá 20.000 células/organoides e adicione isso ao pequeno tubo de centrífuga com lrECM no gelo.
- Pipeta cuidadosamente 20 μL da mistura lrECM/suspensão celular em moldes de parafilm; isso formará uma gota semelhante a uma pérola.
- Certifique-se de misturar bem a mistura lrECM/célula de suspensão celular, pois as células tendem a se acomodar facilmente dentro do LrECM, e isso resultará em organoides heterogêneos.
- Mantenha a mistura lrECM/suspensão celular no gelo. Se o 1ECM aquecer, pode polimerizar e comprometer a formação organoide.
- Certifique-se de esfriar a ponta da pipeta a cada dois ou três organoides para evitar a polimerização do 1ECM. Não introduza bolhas de ar em organoides (evite "empurrar duas vezes" a ponta da pipeta).
- Uma vez que o número desejado de organoides são pipetados em molde de parafilme em uma placa de cultura de 10 cm, incubar a 37 °C por 1-2 h em uma incubadora de cultura celular.
- Depois de solidificar os organoides, use mídia NBMc para lavá-los suavemente do molde de parafilme e em uma nova placa de cultura estéril de 10 cm com 20 mL de NBMc total. Usar uma dica p1000 funciona melhor para tirar organoides do molde; eles vão deslizar suavemente.
NOTA: Recomenda-se cerca de 15-20 organoides por prato de cultura de 10 cm. - Coloque o prato de cultura de 10 cm em uma incubadora (sem tremer) por 4 dias.
- Após 4 dias, troque a mídia e coloque em um agitador orbital a 80 RPM na incubadora de cultura celular. Troque mídia a cada 2-3 dias depois.
- Trocar mídia com organoides imaturos é desafiador porque são difíceis de visualizar. Incline o prato de cultura celular e espere pelo menos 20 s; os organoides se estabelecerão na parte inferior e permitirão que a mídia de cima seja removida com uma grande pipeta de vidro de abertura lentamente.
- Preste atenção à coleta de organoides na parte inferior; se eles aparecerem agitados com a força de remoção da mídia, pausar e permitir que eles se reassentem. À medida que os organoides amadurecem e são mais fáceis de visualizar, esse processo se torna menos nuances.
NOTA: Às vezes, colocar um pedaço de papel escuro sob a placa de cultura celular pode ajudar a visualizar organoides imaturos. Não use uma pipeta Pasteur com sucção a vácuo para remover a mídia, pois é muito fácil para os organoides serem sugados e perdidos desta forma. - Quando os organoides são estabelecidos pela primeira vez, eles não consomem mídia tão rapidamente quanto organoides maduros. Comece com 50% de trocas de mídia para reduzir o uso desnecessário da mídia e reduzir a chance de danificar acidentalmente ou aspirar novos organoides durante o processo de troca de mídia.
5. Cryoembedding
- Coloque cada organoide em um tubo individual de 1,5 mL (usando ponta p1000 cortada) contendo 1 mL de 4% de paraformaldeído (PFA). Armazenar organoides durante a noite a 4 °C. Se incorporar organoides em parafina, vá para a seção 6.
- Após fixação durante a noite em 4% de PFA, lave os organoides em 1x de soro fisco tamponado (PBS) três vezes.
- Transfira o organoide para um novo tubo de 1,5 mL (usando ponta de pipeta p1000 cortada) contendo 1 mL de 30% de sacarose na água e armazene a 4 °C durante a noite.
- Adicione uma pequena quantidade (tipicamente 1-2 mL) de composto de temperatura de corte ideal (OUT) a um criomold, cobrindo a parte inferior e preenchendo cerca de 1/3 a 1/2 da profundidade do molde.
- Transfira um único organoide para criomold usando ponta de pipeta p1000 cortada. Isso resultará em alguma transferência de mídia com o organoide, o que é inevitável. Use uma ponta de pipeta menor para remover cuidadosamente a mídia circundante sem perturbar o organoide.
NOTA: Isso pode ser difícil de visualizar, mas a tubulação lenta demonstrará uma clara diferença nas densidades entre mídia e OCT, por isso isso é feito "por sentimento" até certo ponto). - Coloque o criomold em uma bandeja de gelo seco. O OCT começará a congelar, tornando-se opaco no processo.
- Adicione oct adicional para cobrir completamente o organoide, preenchendo o resto do volume do criomold. Os blocos podem ser armazenados a -20 °C para armazenamento a curto prazo por vários dias ou a -80 °C para armazenamento a longo prazo indefinidamente.
6. Incorporação de parafina
- Classificar organoides por tamanho (pequenos organoides estão abaixo de 3 mm, organoides grandes são mais de 3 mm). Transfira cada organoide para um de histologia usando uma ponta de pipeta p1000 cortada e processe em cera de parafina de acordo com a Tabela 2 ou Tabela 3.
NOTA: O tamanho/configuração do de histologia cabe ao usuário. - Transfira organoides das fitas para incorporar moldes com 1-2 mL de cera de parafina derretida e esfrie-a até que a cera seja semisóida.
- Uma vez que a cera esteja parcialmente solidificada, adicione mais cera ao topo do molde. Coloque a parte superior da fita adesiada sobre o molde e transfira isso para uma placa fria. Continue resfriando até que a cera esteja completamente sólida.
- Quando a cera se solidificar, sele o bloco usando um microtome. Alternativamente, armazene em RT ou 4 °C para posterior secção.
7. Imunofluorescência (IF)
- Desinfinar e reidratar seções de tecido embutido em parafina de 5-12 μm usando uma folha de coloração de slides, de acordo com as etapas a seguir.
NOTA: Se usar seções de organoides embutidos em OCT, recomendamos o uso de seções de 12 μm. Remova o OCT agitando o slide em PBS por 30 minutos. Pule para o passo 7.2.- Incubar por 5 minutos em xileno. Repita isso mais duas vezes. Em seguida, incubar por 10 min em 100% etanol. Repita isso mais uma vez.
- Incubar por 10 min em 95% de etanol. Repita mais uma vez. Lave as seções em água destilada por 5 minutos, duas vezes.
- Para desmascarar o antígeno, submergir slides em solução de desmascaramento de 1x (Tabela de Materiais) e micro-ondas em temperatura abaixo da ebulição por 10 minutos. Certifique-se de não deixar a solução ferver.
NOTA: Isso é melhor alcançado se micro-ondas inicialmente por ~2 min até que ocorra ebulição, em seguida, baixar a potência e observar para garantir que a solução não ferva. A temperatura preferencial é de pouco menos de 100 °C, idealmente 98 °C. - Deixe os slides esfriarem por 30 minutos no RT na solução de desmascaramento 1x.
NOTA: Esta é a mesma solução de citrato 1x; a solução não precisa ser substituída nesta etapa. - Lave os slides em água destilada por 5 minutos, duas vezes.
- Lave os slides em 1x TBST (soro fisiológico tris-tampão com tampão de 0,1% Tween 20) por 5 min.
- Remova os slides do TBST e seque-os cuidadosamente em torno de seções de tecido usando uma limpeza de laboratório, enquanto tome cuidado para não deixar a seção de tecido secar. Uma vez que o slide esteja suficientemente seco, seções de tecido circular com uma caneta de barreira hidrofóbica.
- Bloqueie cada seção com 100-400 μL de solução de bloqueio de soro de 10% por 1 h na RT. Escolha a solução de bloqueio de soro com base no anticorpo secundário. Por exemplo, se usar um anticorpo secundário feito em burro, use um soro de burro 10% normal em 1x TBST.
- Remova a solução de bloqueio e adicione 100-400 μL de anticorpo primário diluído à concentração desejada na solução de bloqueio.
- A 4 °C, incubar as seções com o anticorpo primário durante a noite.
- Remova a solução de anticorpos primários e lave os slides em 1x TBST por 5 minutos, três vezes.
- Adicione 100-400 μL de anticorpo secundário (diluição de 1:1000 na solução de bloqueio, ou por direções do fabricante) a cada seção e incubar por 1,5 h na RT.
- Lave os slides em 1x TBST por 5 min, duas vezes. Em seguida, lave os slides em 1x PBS por 5 min.
- Remova os slides da PBS e seque-os em torno de seções de tecido usando um lenço de limpeza de laboratório. Adicione algumas gotas de montador de cura líquida e monte um deslizamento de vidro cuidadosamente. Uma vez que os slides estejam secos, armazene a -20 °C protegido da luz até estar pronto para a imagem.
8. Imunohistoquímica
- Desinfinar e reidratar as seções de tecido embutidos na parafina usando uma folha de coloração de slides, de acordo com as etapas seguintes.
NOTA: Se usar seções de organoides embutidos em OCT, remova o OCT agitando o slide em PBS por 30 minutos. Pule para o passo 8.2.- Incubar por 5 minutos em xileno. Repita mais duas vezes.
- Incubar por 10 min em 100% etanol. Repita mais uma vez.
- Incubar por 10 min em 95% de etanol. Repita mais uma vez.
- Lave seções em água destilada por 5 minutos, duas vezes.
- Para desmascarar o antígeno, submergir slides em solução de desmascaramento de 1x e micro-ondas em temperatura de sub-ebulição por 10 minutos. Certifique-se de não deixar a solução ferver.
- Deixe os slides esfriarem por 30 minutos no RT na solução de desmascaramento 1x.
- Lave os slides por 5 minutos em água destilada, três vezes.
- Incubar os slides por 10 min em 3% de peróxido de hidrogênio.
- Lave os slides por 5 minutos em água destilada duas vezes.
- Lave os slides por 5 min em 1x TBST.
- Remova os slides de 1x TBST e, em seguida, use o canto de uma limpeza de laboratório para secar cuidadosamente em torno de seções de tecido.
- Circule as seções teciduais com uma caneta de barreira hidrofóbica quando o escorregador estiver seco.
- Coloque 100-400 μL da solução de bloqueio em cada seção dentro do círculo de caneta de barreira hidrofóbica em RT por 1 h. Use 10% de soro de burro normal (NDS) ou 0,75% de albumina de soro bovino (BSA) diluída em 1x TBST.
- Em seguida, remova a solução de bloqueio e adicione 100-400 μL do anticorpo primário a cada seção. Diluir este anticorpo primário à concentração desejada utilizando o diluído do fabricante apropriado.
- Incubar as seções a 4 °C durante a noite. Remova a solução de anticorpos primários e lave os slides em 1x TBST por 5 minutos, três vezes.
- Adicione 100-400 μL de reagente de detecção de IHC a cada seção e incubar por 1 h no RT. Escolha o reagente de detecção de IHC de acordo com o anticorpo primário.
- Lave cada seção com 1x TBST por 5 min, duas vezes, seguida por 1x PBS por 5 min uma vez.
- Prepare a solução 3,3-Diaminobenzidina (DAB) de acordo com as instruções do fabricante. Adicione 100-400 μL de solução DAB a cada seção de tecido e monitore de perto sob um microscópio. Entre 1-10 min fornecerá intensidade de coloração aceitável; certifique-se de observar desta vez e manter-se consistente para todas as seções de tecido.
- Após a intensidade de coloração desejada ser alcançada, mergulhe os slides em água destilada.
- Realize a contra-mancha de hematoxílina e a desidratação do slide para montagem de acordo com as instruções da Tabela 4.
- Remova o slide do substituto do xileno (Tabela de Materiais) e limpe o líquido extra ao redor da seção tecidual usando um lenço de limpeza de laboratório. Use uma pequena quantidade de meio de montagem permanente para montar o deslizamento de cobertura sobre a seção do tecido e deixe secar.
9. Medição da viabilidade celular total
- Transfira cada organoide para um tubo de 2 mL e, usando uma pequena ponta de pipeta, remova cuidadosamente todo o excesso de mídia ao redor do organoide (ver Figura 3 para o esquema deste procedimento).
NOTA: Os ensaios de viabilidade celular devem ser realizados com organoides que foram feitos com número idêntico de células. Este experimento não deve ser realizado em organoides feitos diretamente de amostras de pacientes a partir da cirurgia, do corte de organoides formados por alredia, ou outros casos em que células únicas não foram filtradas e contadas. - Prepare o reagente de ensaio de viabilidade celular luminescente e 1x PBS na proporção 1:1 e adicione 500 μL a cada tubo.
- Use uma ponta de pipeta p1000 para agressivamente pipeta para cima e para baixo para quebrar o organoide e deixe sentar por 5 minutos. O organoide deve ser um pouco dissociado e mais suave até agora; repetir a mistura com a ponta de pipeta p1000 novamente.
- O objetivo é ter 100 μL de volume total por poço de uma placa de 96 poços. Adicione 25 μL da mistura da etapa 9.3 (terá o suficiente para múltiplas réplicas técnicas) e adicione 75 μL de ensaio de viabilidade celular luminescente restante e mistura pbs.
- Coloque a placa em um shaker por 2 minutos e, em seguida, incubar por 20 min no RT.
- Leia a placa usando uma configuração de luminescência em um leitor de placas e colete os dados (ver Figura 4).
Resultados
A Figura 1 mostra o crescimento organoide precoce visto através de microscopia leve na ampliação de 10x. A Figura 1A mostra a migração e invasão de células únicas através do IrECM na visão central. As células continuarão a expandir e 'colonizar' o LrECM, e elas parecerão mais densas e eventualmente opacas por inspeção visual. A Figura 1B mostra vários organoides maduros (com 7 semanas) sem ampliação, em relação ao tamanho de um centavo.
A Figura 2 demonstra a coloração imunohistoquímica de organoides GBM para fosfo-histona H3, um marcador de proliferação ativa. A maioria das células altamente proliferativas são vistas no perímetro organoide comparado com o núcleo organoide. A coloração positiva terá uma aparência marrom/cobre.
A Figura 3 descreve o processo para homogeneizar e medir o número total de células em organoides GBM usando um ensaio de viabilidade celular luminescente 3D. Devido ao alto número de células presentes nos organoides GBM, a maior estrutura organoide é inicialmente homogeneizada por trituração em reagente de ensaio luminescente. Em seguida, frações do total organoide lysate são carregadas em poços individuais e diluídas com reagente de ensaio luminescente adicional antes da incubação e leitura em um leitor de placas multi-poço apropriado.
A Figura 4 representa dados de controle DMSO (veículo comum) para organoides. Dados plotados demonstram consistência intra-organóide e inter-organóide. Os dados de viabilidade luminescente serão normalmente normalizados para controles para cada espécime ao gerar dados experimentais.
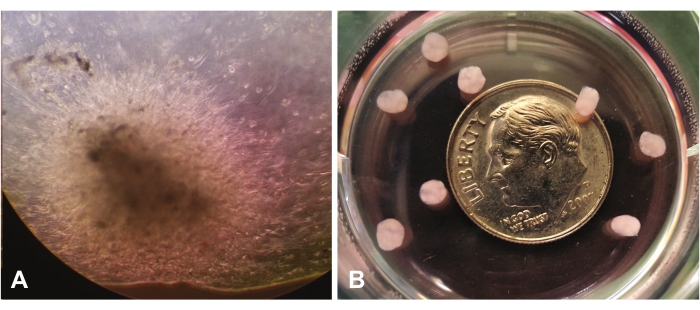
Figura 1: Ver através de um microscópio leve (10x). (A) Crescimento organoide precoce demonstrando migração/invasão de células GBM em toda a matriz extracelular rica em laminina. (B) Organoides maduros em relação ao tamanho de um centavo. Clique aqui para ver uma versão maior desta figura.
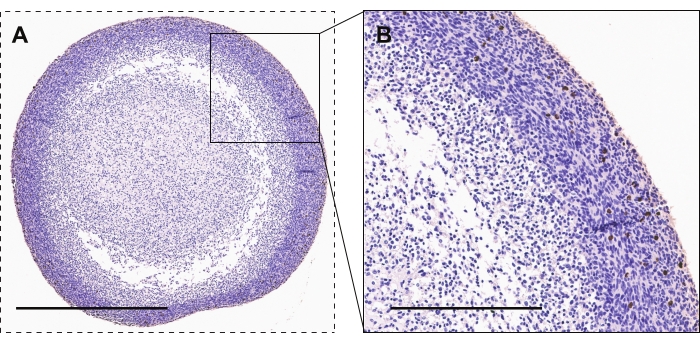
Figura 2: Imunohistoquímica de organoides GBM. (A, B) Organoides GBM mostrando células manchadas de fosfo-histona H3 para proliferação ativa. As barras de escala são de 600 μm e 300 μm para A e B, respectivamente. Clique aqui para ver uma versão maior desta figura.
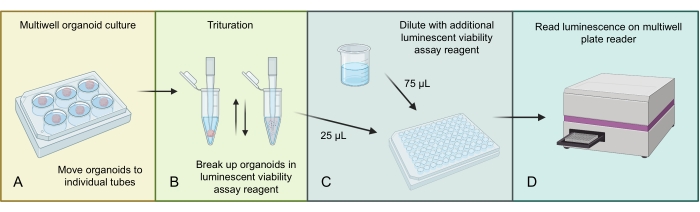
Figura 3: Protocolo de viabilidade celular luminescente para organoides. (A) Mova organoides individuais para pequenos tubos de centrífugas e remova o excesso de mídia. (B) Adicione 500 μL de 1:1 PBS e mistura de ensaio de viabilidade celular luminescente a cada tubo e pipeta agressivamente para quebrar o organoide. (C) Adicione 25 μL desta mistura organoide e 75 μL da mesma mistura de ensaio de viabilidade celular de 1:1 PBS e luminescente a cada poço de uma placa de 96 poços. (D) Coloque em um agitador por 2 minutos, seguido de incubação por 20 min no RT e, em seguida, leia luminescência em um leitor de placas. Figura feita usando BioRender.com. Clique aqui para ver uma versão maior desta figura.
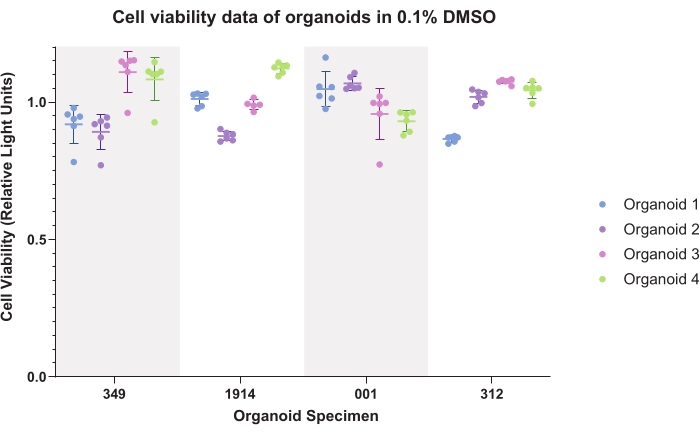
Figura 4: Viabilidade celular. Dados de viabilidade celular para organoides em 0,1% de sulfóxido de dimetil (DMSO) para seis réplicas técnicas de quatro organoides para quatro amostras de pacientes. Clique aqui para ver uma versão maior desta figura.
| Componente | Quantidade |
| Meio neurobásal menos fenol vermelho | 500 mL |
| Suplemento B-27 menos vitamina A (50x) | 10 mL |
| Antibiótico-antimicoótico (100x) | 5 mL |
| Piruvato de sódio (100 mM) | 5 mL |
| Glutamina em 0,85% NaCl (200 mM) | 5 mL |
| Padrão humano recombinante FGF (250 μg/mL) | 20 μL |
| Proteína EFG humana recombinante (250 μg/mL) | 20 μL |
| Phenol vermelho | 500 μL |
Tabela 1: Formulação completa do meio neurobásal (NBMc)
| Reagente | Hora |
| 50% etanol | 3 min. |
| 75% etanol | 3 min. |
| 95% Etanol | 3 min. |
| 95% Etanol | 4 min. |
| 100% Etanol | 2 min. |
| 100% Etanol | 3 min. |
| 100% Etanol | 4 min. |
| Substituto de xileno | 2 min. |
| Substituto de xileno | 3 min. |
| Substituto de xileno | 4 min. |
| Parafina | 15 min. |
| Parafina | 15 min. |
Tabela 2: Cronograma de processamento de organoides pequenos (abaixo de 3 mm de diâmetro)
| Reagente | Hora |
| 50% etanol | 6 min. |
| 75% etanol | 6 min. |
| 95% Etanol | 5 min. |
| 95% Etanol | 8 min. |
| 100% Etanol | 5 min. |
| 100% Etanol | 5 min. |
| 100% Etanol | 8 min. |
| Substituto de xileno | 5 min. |
| Substituto de xileno | 5 min. |
| Substituto de xileno | 8 min. |
| Parafina | 30 min. |
| Parafina | 30 min. |
Tabela 3: Cronograma de processamento de organoides de grande porte (acima de 3 mm de diâmetro)
| Reagente | Hora |
| Hematoxilina | 2 min. |
| Executando diH2O | 2 min. |
| Hematoxilina nuclear esclarece reagente | 1 min. |
| Executando diH2O | 1 min. |
| Reagente bluing | 1 min. |
| Executando diH2O | 2 min. |
| 70% de etanol | 1 min. |
| 100% etanol | 1 min. |
| 100% etanol | 1 min. |
| Substituto de xileno | 2 min. |
| Substituto de xileno | 2 min. |
Tabela 4: Contra-mancha de hematoxilina
Discussão
Os organoides GBM são um método de cultura complementar às esferas tradicionais que incluem maior heterogeneidade celular e microambiental 4,22,30. Embora mais tempo e recursos intensivos, a cultura organoide pode oferecer uma visão valiosa sobre o comportamento intra-tumoral e mecanismos de resistência a medicamentos.
O GBM é impulsionado por uma população de CSCs 5,31, e esses métodos foram desenvolvidos para permitir o crescimento contínuo e a auto-renovação dessa população CSC. O fator de crescimento epidérmico (EGF) e o fator de crescimento do fibroblasto (FGF) são conhecidos por aumentar a manutenção e o crescimento de células-tronco e fornecer sinalização ativa de tyrosina quinase receptora (RTK). A formação de populações celulares heterogêneas e microambientes tumorais distintos dentro de tumores GBM depende do apoio aos comportamentos de CSC. A seleção de um irECM imita o ambiente cerebral rico em laminina e apoia as células na cultura organoide para se auto-organizar e migrar por invasão. Embora alguns grupos tenham estabelecido a cultura organoide sem o uso de uma mídia lrECM ou EGF/FGF enriquecida24,28, o que pode oferecer uma forma mais eficiente deste método de cultura e uma seleção mais forte de sinalização oncogênica para impulsionar o crescimento, esses métodos foram escolhidos para otimizar o ambiente de células pró-tronco para melhor estabelecer a heterogeneidade celular dos organoides. Tanto organoides cerebrais quanto organoides GBM foram feitos com lrECM na literatura anteriormente 21,32,33. Embora tenhamos estabelecido dados sobre as populações tumorais encontradas dentro dos organoides e da variação espacial, menos se sabe sobre populações não tumorais dentro dos organoides e quanto tempo sobrevivem dos espécimes originais do paciente. Certas manchas de IHC (como CD45) podem fornecer esses dados, e podem ser um ponto interessante de pesquisa no futuro com organoides.
Conhecer o uso pretendido para a cultura organoide é importante para selecionar métodos apropriados. Estabelecer organoides de espécimes primários versus organoides uniformes em crescimento para experimentos específicos têm procedimentos ligeiramente diferentes. Ter uma apreciação de como os organoides amadurecem e preenchem visualmente o andaime LrECM é importante para poder alocar tempo e recursos adequados para a cultura organoide. Regiões esparsas de células em organoides se expandirão lentamente e crescerão para preencher o LrECM, que pode levar de 2 a 8 semanas, dependendo do comportamento do espécime. Esta taxa de crescimento é um pouco intrínseca a cada espécime; é preservado em diferentes lotes de organoides e bastante consistente com a taxa relativa de crescimento da esfera. Os organoides podem ser mantidos por mais de 1 ano e reter capacidades de formação de tumores em xenoenxerto em camundongos; no entanto, recomenda-se cultivá-los com um propósito distinto de não desperdiçar recursos de laboratório (materiais e tempo)4. O crescimento organoide foi testado em múltiplos tamanhos e formatos de poços, e mostra que uma placa de 10 cm é o cenário ideal para manter a viabilidade celular ideal, seguido por uma placa de 6 poços com três organoides por poço34. Organoides consomem mais mídia em comparação com suas contrapartes de cultura bidimensional, e usar um formato de poço menor não leva à manutenção adequada. Por exemplo, um poço de uma placa de formato de 96 poços não tem espaço ou volume de mídia suficiente em relação ao tamanho de um organoide para sustentar o crescimento organoide.
À medida que os organoides se estabelecem, ser observador é importante para aumentar o sucesso. Inicialmente, os organoides consumirão mídia lentamente, mas à medida que se tornam mais densos e maduros, consumirão mídia mais rapidamente. Adicionar fenol vermelho à mídia pode ajudar a servir como um indicador de consumo de mídia. Quando a mídia é mais amarela, pode nos levar a ajustar o padrão de alimentação, seja para trocar um maior volume de mídia, aumentar a quantidade total de mídia na placa, dividir organoides entre múltiplas placas de cultura celular para acompanhar seu crescimento, ou até mesmo ajustar a linha do tempo para experimentos.
Em muitos aspectos, organoides são uma maneira ineficiente de conduzir pesquisas sobre câncer. Eles envolvem escalas de longo prazo, e são caros e pesados em termos de recursos em comparação com a cultura da esfera GBM. No entanto, em comparação com os xenoenxertos derivados do paciente, um método alternativo para recriar a diversidade celular e microambiental, eles são mais simples, menos caros e controláveis. A seleção de quando melhor usar organoides é importante para os pesquisadores de câncer. Eles não se destinam a substituir a esfera tradicional ou a cultura aderente e não substituir os modelos de xenoenxerto. Organoides podem, quando aplicados à questão científica certa, combinar os benefícios desses dois sistemas e podem nos permitir observar a biologia das células tumorais que de outra forma permaneceriam escondidas. A comunidade científica está apenas começando a entender quais oportunidades de aprendizagem os organoides oferecem, mas é claro que eles serão uma ferramenta inestimável no futuro para entender a complexa biologia do GBM.
Divulgações
Os autores não têm conflitos para revelar.
Agradecimentos
Gostaríamos de agradecer ao Dr. Justin Lathia por seus conselhos inestimáveis e apoio contínuo. Agradecemos também a Katrina Fife, Lisa Wallace e Maya Camhi pelo excelente apoio técnico.
Materiais
| Name | Company | Catalog Number | Comments |
| 3,3-Diaminobenzidine (DAB) tablets | MP Biomedicals | 08980681 | 3,3-Diaminobenzidine (DAB) tablets |
| 96-well PCR plates | ThermoFisher Scientific | 96-well PCR plates | |
| Accutase | ThermoFisher Scientific | SCR005 | Cell detachment solution |
| Antibiotic-antimycotic | ThermoFisher Scientific | 15240062 | Antibiotic-antimycotic |
| B-27 supplement minus vitamin A | ThermoFisher Scientific | 12587001 | B-27 supplement minus vitamin A (50x) |
| GelCode Blue Stain Reagent | ThermoFisher Scientific | 24590 | Bluing reagent |
| Cell strainer (70 µm) | CellTreat Scientific | 229483 | Cell strainer (70 µm) |
| CellTiter-Glo 3D | Promega | G9681 | Luminescent cell viability assay |
| Clarifier 2 | ThermoFisher Scientific | 7301 | Nuclear hematoxylin clarifying reagent |
| Clear-Rite 3 | ThermoFisher Scientific | 6901 | xylene substitute |
| Epredia Gill 2 Hematoxylin | ThermoFisher Scientific | 72504 | Hematoxylin |
| Glutamine in 0.85% NaCl | ThermoFisher Scientific | 35050061 | Glutamine in 0.85% NaCl (200 mM) |
| Matrigel | ThermoFisher Scientific | 354234 | Laminin-enriched extracellular matrix |
| Mini PAP pen | ThermoFisher Scientific | 008877 | Hydrophobic barrier pen |
| Mounting medium | ThermoFisher Scientific | 22-050-102 | Mounting medium |
| Neurobasal media minus phenol red | ThermoFisher Scientific | 12349015 | Neurobasal media minus phenol red (500 mL) |
| Normal donkey serum (NDS) | Jackson ImmunoResearch | 017-000-121 | Normal donkey serum (NDS) |
| Paraformaldehyde 4% in PBS | ThermoFisher Scientific | AAJ19943K2 | Paraformaldehyde 4% in PBS |
| Phenol red | Sigma | P0290 | Phenol red (0.5%) |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P10144 | Liquid curing mountant |
| Recombinant human EGF protein | R&D systems | 236-EG-01M | Recombinant human EGF protein (250 µg/mL) |
| Recombinant human FGF basic | R&D systems | 4144-TC-01 | Recombinant human FGF basic (250 µg/mL) |
| SignalStain Antibody Diluent | Cell Signaling | 8112 | Antibody diluent |
| SignalStain Boost IHC Detection Reagent | Cell Signaling | 8114 | Immunohistochemistry detection reagent |
| SignalStain Citrate Unmasking Solution | Cell Signaling | 14746 | Citrate unmasking solution |
| Single edge razor blade | Uline | H-595B | Single edge razor blade |
| Sodium pyruvate | ThermoFisher Scientific | 11360070 | Sodium pyruvate (100 mM) |
| Tissue-Tek Cryomolds | VWR | 25608-916 | Disposable cryomolds |
| Tissue-Tek O.C.T. Compound | VWR | 25608-930 | Optimal cutting temperature compound |
| Trypan Blue Stain | ThermoFisher Scientific | T10282 | Cell impermeant stain (0.4%) |
| Xylene | ThermoFisher Scientific | X3P-1GAL | Xylene |
Referências
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352 (10), 987-996 (2005).
- Heffernan, J. M., Sirianni, R. W. Modeling microenvironmental regulation of glioblastoma stem cells: a biomaterials perspective. Frontiers in Materials. 5, 7 (2018).
- Zanders, E. D., Svensson, F., Bailey, D. S. Therapy for glioblastoma: is it working. Drug Discovery Today. 24 (5), 1193-1201 (2019).
- Hubert, C. G., et al. A Three-dimensional organoid culture system derived from human glioblastomas recapitulates the hypoxic gradients and cancer stem cell heterogeneity of tumors found in vivo. Cancer Research. 76 (8), 2465-2477 (2016).
- Lathia, J. D., Heddleston, J. M., Venere, M., Rich, J. N. Deadly teamwork: neural cancer stem cells and the tumor microenvironment. Cell Stem Cell. 8 (5), 482-485 (2011).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), 851-856 (2015).
- Bao, S., et al. Stem cell-like glioma cells promote tumor angiogenesis through vascular endothelial growth factor. Cancer Research. 66 (16), 7843-7848 (2006).
- Yu, S. C., Bian, X. W. Enrichment of cancer stem cells based on heterogeneity of invasiveness. Stem Cell Reviews and Reports. 5 (1), 66-71 (2009).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Vescovi, A. L., Galli, R., Reynolds, B. A. Brain tumour stem cells. Nature Reviews. Cancer. 6 (6), 425-436 (2006).
- Zhu, T. S., et al. Endothelial cells create a stem cell niche in glioblastoma by providing NOTCH ligands that nurture self-renewal of cancer stem-like cells. Cancer Research. 71 (18), 6061-6072 (2011).
- Calabrese, C., et al. A perivascular niche for brain tumor stem cells. Cancer Cell. 11 (1), 69-82 (2007).
- Charles, N., et al. Perivascular nitric oxide activates notch signaling and promotes stem-like character in PDGF-induced glioma cells. Cell Stem Cell. 6 (2), 141-152 (2010).
- Seidel, S., et al. A hypoxic niche regulates glioblastoma stem cells through hypoxia inducible factor 2 alpha. Brain. 133, 983-995 (2010).
- Yan, K., et al. Glioma cancer stem cells secrete Gremlin1 to promote their maintenance within the tumor hierarchy. Genes & Development. 28 (10), 1085-1100 (2014).
- Cheng, L., et al. Glioblastoma stem cells generate vascular pericytes to support vessel function and tumor growth. Cell. 153 (1), 139-152 (2013).
- Flavahan, W. A., et al. Brain tumor initiating cells adapt to restricted nutrition through preferential glucose uptake. Nature Neuroscience. 16 (10), 1373-1382 (2013).
- Hjelmeland, A. B., et al. Acidic stress promotes a glioma stem cell phenotype. Cell Death and Differentiation. 18 (5), 829-840 (2011).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. The American Journal of Pathology. 177 (3), 1491-1502 (2010).
- Li, Z., et al. Hypoxia-inducible factors regulate tumorigenic capacity of glioma stem cells. Cancer Cell. 15 (6), 501-513 (2009).
- Azzarelli, R., Ori, M., Philpott, A., Simons, B. D. Three-dimensional model of glioblastoma by co-culturing tumor stem cells with human brain organoids. Biology Open. 10 (2), 056416 (2021).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Reports. 26 (12), 3203-3211 (2019).
- da Silva, B., Mathew, R. K., Polson, E. S., Williams, J., Wurdak, H. Spontaneous glioblastoma spheroid infiltration of early-stage cerebral organoids models brain tumor invasion. SLAS Discovery: Advancing Life Sciences R & D. 23 (8), 862-868 (2018).
- Jacob, F., et al. A Patient-derived glioblastoma organoid model and biobank recapitulates inter- and intra-tumoral heterogeneity. Cell. 180 (1), 188-204 (2020).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nature Cell Biology. 21 (8), 1041-1051 (2019).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Ledur, P. F., Onzi, G. R., Zong, H., Lenz, G. Culture conditions defining glioblastoma cells behavior: what is the impact for novel discoveries. Oncotarget. 8 (40), 69185-69197 (2017).
- Lenin, S., et al. A drug screening pipeline using 2D and 3D patient-derived in vitro models for preclinical analysis of therapy response in glioblastoma. International Journal of Molecular Sciences. 22 (9), 4322 (2021).
- Rybin, M. J., Ivan, M. E., Ayad, N. G., Zeier, Z. Organoid models of glioblastoma and their role in drug discovery. Frontiers in Cellular Neuroscience. 15 (4), 605255 (2021).
- Shakya, S., et al. Altered lipid metabolism marks glioblastoma stem and non-stem cells in separate tumor niches. Acta Neuropathologica Communications. 9 (1), 101 (2021).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Bian, S., et al. Genetically engineered cerebral organoids model brain tumor formation. Nature Methods. 15 (8), 631-639 (2018).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Sundar, S. J., et al. Three-dimensional organoid culture unveils resistance to clinical therapies in adult and pediatric glioblastoma. Translational Oncology. 15 (1), 101251 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados