Method Article
标准化 体外 测定,以可视化和量化人中性粒细胞与 金黄色葡萄球菌 生物膜之间的相互作用
摘要
本协议描述了中性粒细胞 - 生物膜相互作用的研究。 金黄色葡萄球菌 生物膜在体外建立并与 外 周血来源的人中性粒细胞一起孵育。量化中性粒细胞的氧化爆发反应,并通过显微镜确定生物膜内的中性粒细胞定位。
摘要
中性粒细胞是免疫系统在微生物感染期间部署的第一道防线。 在体内,中性粒细胞被募集到感染部位,在那里它们使用吞噬作用、活性氧和氮物质(分别为 ROS、RNS)、NETosis(中性粒细胞细胞外陷阱)和脱颗粒等过程来杀死微生物并解决感染。中性粒细胞和浮游微生物之间的相互作用已被广泛研究。近年来,人们对研究由生物膜引起的感染越来越感兴趣。生物膜表现出的特性,包括对中性粒细胞杀伤的耐受性,与浮游生物生长的对应物不同。随着 体外 和 体内 生物膜模型的成功建立,现在可以研究这些微生物群落与不同免疫细胞之间的相互作用。在这里,使用传统生物膜模型和成熟的中性粒细胞活性测定相结合的技术专门用于研究中性粒细胞和生物膜相互作用。宽场荧光显微镜用于监测中性粒细胞在生物膜中的定位。这些生物膜在静态条件下生长,然后添加来自人外周血的中性粒细胞。在显微镜下可视化之前,用适当的染料对样品进行染色。此外,ROS的产生是在生物膜存在下量化的,ROS是针对病原体的众多中性粒细胞反应之一。将免疫细胞添加到该已建立的系统中将扩展对宿主 - 病原体相互作用的理解,同时确保使用标准化和优化的条件来准确测量这些过程。
引言
生物膜是包裹在细胞外聚合物物质(EPS)中的表面相关微生物或非附着聚集体的群落1,2。这些群落保护包裹的微生物免受环境压力源的影响,包括对抗菌剂和免疫系统的耐受性3.几种致病微生物物种形成与慢性感染相关的生物膜4。生物膜的发展是一个复杂的过程,涉及附着在表面上、EPS 产生、细胞增殖、生物膜结构和细胞分离5。一旦细胞分散形成生物膜,它们就会保持浮游或转移到新的基质并重新启动生物膜发育6。
金黄色葡萄球菌是一种机会性病原体,遵循生物膜发育的一般方案,包括附着、增殖、成熟和传播7。 金黄色葡萄球菌 生物膜中的附着过程由疏水相互作用、乳胆酸和识别粘附基质分子 (MSCRAMM) 的微生物表面成分决定8,9。随着 金黄色葡萄球菌 的增殖开始,产生主要由多糖,蛋白质,细胞外DNA和teichoic酸组成的EPS5。随着EPS成分的产生,还会产生各种外切酶和小分子,有助于生物膜的三维结构并有助于分离5。 金黄色葡萄球菌 利用这种高度协调的生活方式来建立各种慢性感染,包括由于医疗设备留置引起的感染10。
耐甲氧西林 金黄色葡萄球菌 (MRSA) 是留置医疗器械相关感染的主要原因之一,例如中心静脉和导尿管、假体关节、起搏器、机械心脏瓣膜和宫内节育器11。在这种感染期间,中性粒细胞是第一个募集到感染部位的宿主免疫细胞,通过多种策略 对抗 病原体12。这些包括吞噬作用、脱颗粒、活性氧和氮物质 (ROS/RNS) 的产生,或释放中性粒细胞细胞外陷阱 (NET) 以消除病原体13。
微生物吞噬时产生ROS是中性粒细胞14表现出的关键抗菌反应之一。如果微生物涂有调理素,特别是血清15中的免疫球蛋白和补体成分,吞噬作用会增强。然后,调理的微生物被中性粒细胞上的细胞表面受体识别并吞噬,形成一个称为吞噬体15的隔室。中性粒细胞通过膜相关的NADPH-氧化酶16在吞噬体中产生和释放ROS。这种多组分酶复合物通过将电子转移到分子氧16来产生超氧阴离子。此外,中性粒细胞还通过表达诱导性一氧化氮合酶(iNOS)产生RNS17。吞噬体内的这些高超氧化物和一氧化氮自由基具有广泛的抗菌活性。它们可以与酶中的金属中心相互作用并破坏病原体18,19,20,21的核酸,蛋白质和细胞膜。许多微生物采用生物膜生活方式,并采用不同的策略来逃避ROS22,23的杀戮。因此,将生物膜与中性粒细胞耦合以量化ROS的标准化测定有利于获得一致的结果。
虽然定量中性粒细胞ROS产生等测定提供了有关中性粒细胞对生物膜的反应的信息,但可视化生物膜内中性粒细胞相互作用的能力也可以作为一种强大的工具。使用荧光染料进行显微镜检查通常需要优化以获得可用于显微镜成像分析的高质量图像。优化某些条件的灵活性是有限的,因为中性粒细胞在分离后会经历细胞死亡。此外,通常在添加中性粒细胞之前洗涤生物膜以从实验设置中去除浮游生物种群。在洗涤时,如果生物膜松散地粘附在表面上,则由于部分生物质的损失,复制生物膜之间可能会出现差异。
从广义上讲,目前该领域分析中性粒细胞和生物膜之间相互作用的方法主要包括显微镜、流式细胞术和集落形成单位(CFU)计数24,25,26,27。显微镜涉及使用染料,这些染料可以直接染色中性粒细胞和生物膜,或针对微生物的各种中性粒细胞反应,例如NET形成,脱颗粒和细胞死亡25,28。这些反应的一个子集,例如中性粒细胞死亡和脱颗粒,也可以通过流式细胞术进行分析,但要求中性粒细胞优先与生物膜中的大量微生物聚集体无关28,29。流式细胞术还可以量化一些生物膜参数,例如细胞活力27。然而,这些过程需要破坏生物膜生物量,并且对于可视化其他重要相互作用(例如中性粒细胞及其组分在生物膜中的空间分布)没有用27,29,30。
本协议侧重于调整一些传统使用的方法,以研究生物膜上的中性粒细胞 - 生物膜相互作用,这些生物膜已经过优化以在处理过程中提供最小的变异性。因此,该协议提供了标准化方法来生长和定量生物膜,从外周血中分离原代人中性粒细胞,量化ROS产生,并通过显微镜 可视化 生物膜 - 中性粒细胞相互作用。该协议可以适用于不同的系统,以了解生物膜 - 中性粒细胞相互作用,同时考虑供体池之间的异质性。
研究方案
所有程序均已获得俄亥俄州立大学机构审查委员会(IRB)(2014H0154)的批准。获得所有供体的知情书面同意,收集外周血以分离原代人中性粒细胞。 金黄色葡萄球菌 (USA300 LAC)31 被用作进行实验的模式生物。由于可能暴露于血源性病原体,因此使用适当的个人防护设备(PPE)进行实验。
1. 体外 生物膜的制备
- 使用条纹板技术32,33在营养丰富的琼脂平板(例如胰蛋白酶大豆琼脂)上从冷冻保存的原液31中获得金黄色葡萄球菌的分离菌落(见材料表)。
- 用无菌 H2O 稀释的 100 μL 0.001% (v/v) 聚-L-赖氨酸 (PLL) 涂覆 96 孔板的各个孔,并在室温下孵育 30 分钟。无菌地,使用真空辅助抽吸阱吸出PLL溶液。让孔在室温下干燥过夜。
注意:除非另有说明,否则协议中的所有抽吸步骤均使用真空辅助抽吸阱进行。 - 通过在补充有2%葡萄糖的最小必需培养基α(MEMα)中接种金 黄色葡萄球菌 菌落来制备过夜培养物,并在37°C孵育,以200rpm振荡16-18小时。
- 通过将 50 μL 转移到补充有 2% 葡萄糖的 5 mL 新鲜 MEMα 中稀释过夜培养物,并在 37 °C 下孵育,以 200 rpm 振荡,直到中间对数期,通常在光密度 600 (OD600nm) 之间 0.5-0.8。使用 MEMα 将中对数培养标准化为 OD600nm 为 0.1。
- 将 150 μL 标准化培养物转移到 PLL 处理的 96 孔板的每个孔中。在37°C的加湿室中静态孵育18-20小时。
注意:生物膜也可以以其他形式生长,例如μ通道载玻片(参见 材料表)。 - 吸出上清液以除去浮游细胞。用 150 μL 汉克斯平衡盐溶液 (HBSS) 轻轻洗涤剩余的生物质,以去除未附着的细胞。滴加HBSS以避免破坏生物膜。
注意:在洗涤过程中吸出上清液和HBSS时,在含有生物膜的孔中留下足够的液体(上清液或HBSS),以使生物膜仍然浸入其中。这可以防止滴加HBSS以洗涤生物膜时生物膜结构的破坏。 - 再重复步骤1.6至少两次以去除所有浮游细胞。在这一点上,生物膜已准备好立即进行下游实验。
注意:如果生物膜不用于中性粒细胞实验,则可以用磷酸盐缓冲盐水(PBS)代替HBSS。HBSS优于PBS,因为HBSS含有包括葡萄糖在内的成分,可为中性粒细胞活化提供最佳条件34。
2. 生物膜生物质的定量
- 通过溶解在20%(v / v)乙醇和80%(v / v)H2O中来制备0.1%(w / v)结晶紫(CV)溶液(见材料表)的储备。
- 向洗涤的生物膜中加入 150 μL 0.1% CV 溶液,并在室温下孵育 20 分钟。使用至少三个空孔作为仅培养基对照。
- 从生物膜中吸出 0.1% CV 溶液,并用 200 μL 1x PBS 洗涤染色的生物膜。重复此过程,总共三次洗涤,以去除孔中多余的CV。
- 加入 150 μL 用 H2O 稀释的 33% (v/v) 冰醋酸.在室温下在摇杆上以 50 rpm 孵育 30 分钟,以使与生物质结合的 CV 完全溶解。
注意:在具有适当PPE的层流罩中执行此步骤,因为冰醋酸是一种腐蚀性化学物质。 - 同时,设置酶标仪(参见 材料表)以读取CV染色值。冰醋酸处理后,读取595nm波长的板。
注意:用于测量CV外径的波长范围为500-600 nm35。
3.中性粒细胞分离
注意:按照先前发表的方法分离中性粒细胞,略有变化36。该分离方案首先结合密度梯度离心,然后进行3%葡聚糖沉降。本节仅介绍整个中性粒细胞分离方案,重点介绍对已发布方案所做的更改。此外,下面概述的方案是可以分离中性粒细胞的众多方法之一,可以根据需要进行替代。分离中性粒细胞的其它方法包括使用细胞分离培养基或磁性抗体细胞分离37。
- 根据机构IRB中概述的方案,通过静脉穿刺 从 成年献血者那里抽血。在抽血之前,确保注射器有足够的无防腐剂肝素,使肝素的最终浓度为20U / mL。
- 在室温下用3/4体积的无内毒素0.9%NaCl(参见 材料表)在H2O中稀释肝素化的血液。
- 对于每 20 mL 稀释的血液样品,在新鲜的 50 mL 锥形管中等分 14 mL 市售密度梯度培养基(参见 材料表)。小心地将稀释的血液样品分层在密度梯度培养基的顶部。
- 在室温下以400× g 离心分层血液样品40分钟。确保离心机有缓慢的休息时间,以避免离心完成后干扰层。
注意:血液样本将有五层,包含盐水和血浆的混合物,单核细胞层,密度梯度培养基,中性粒细胞和红细胞。 - 使用血清移液管吸出中性粒细胞和红细胞沉淀上方的所有层,然后将沉淀在 H2O 中无内毒素的 0.9% NaCl 中轻轻重悬。对于从 20 mL 血液样本生成的每个沉淀,将沉淀重悬回 20 mL 总体积。加入1:1体积的3%葡聚糖(见 材料表)。将试管在冰上直立孵育18-20分钟。
注意:确保 3% 葡聚糖在 H2O 中用不含内毒素的 0.9% NaCl 制成。 - 将含有中性粒细胞和一些红细胞的上层的20mL取出到新的50mL锥形管中,并在4°C下以355× g 离心10分钟。 倒出上清液,留下红色沉淀。
- 轻轻地将沉淀重悬于10mL冷的无菌H2O中30秒以裂解剩余的红细胞。立即向混合物中加入 10 mL 不含内毒素的冷内毒素 0.9% 盐水以恢复张力。将溶液在4°C下以233× g 离心3分钟。
- 倒出上清液,将含有95%-97%中性粒细胞的沉淀重悬于每20mL血液样本的1mL冷HBSS中。
- 将 10 μL 重悬的中性粒细胞转移到 90 μL 的 0.4% 台盼蓝排除染料中,并使用血细胞计数器计数细胞(参见 材料表)。
注意:非活细胞被染成蓝色,因为台盼蓝排除染料在活细胞中是不可渗透的。该协议提供>99%的细胞活力37,38。 - 添加额外的HBSS,使中性粒细胞的最终浓度为4 x 106 个细胞/ mL。
注意:对于细胞活力<99%的情况,仍然可以达到4 x 106 个细胞/ mL的最终浓度;然而,获得的含有4 x 106 个细胞/mL的溶液的总体积会减少。中性粒细胞的最终浓度可根据用户的实验需要进行调整。将中性粒细胞以4 x 106 个细胞/ mL终浓度重悬,用于下述所有实验。为了解释供体与供体之间的差异,强烈建议所有涉及中性粒细胞的实验至少与三个不同的供体进行。
4. 中性粒细胞产生的ROS的测定
- 将100μL20%正常人血清(在HBSS中稀释)滴加到洗涤的生物膜中(步骤1.6),并在37°C下在静态条件下孵育30分钟以调理生物膜。
- 吸出 20% 血清溶液,并用 150 μL HBSS 滴加洗涤生物膜一次。吸出HBSS,留下带有调理生物膜的孔。
注意:为了解释实验,建议至少四组:(A)中性粒细胞+生物膜,(B)中性粒细胞+ PMA(阳性对照,见 材料表),(C)仅中性粒细胞和(D)仅生物膜。 - 将鲁米诺(见 材料表)以4 x 106 个细胞/ mL的浓度重悬于HBSS中的嗜中性粒细胞中,使得最终鲁米诺浓度为50μM。此解决方案已准备好用于组 (A) 和 (C)。将4 x 105 中性粒细胞与鲁米诺混合到具有调理生物膜的孔中。
- 在单独的管中,在没有任何嗜中性粒细胞的HBSS中制备50μM鲁米诺溶液,并将其添加到含有生物膜(D组)的孔中。
- 将 350 μL 中性粒细胞与鲁米诺混合,并以终浓度为 500 ng/mL 的终浓度加入佛波醇 12-肉豆蔻酸 13-乙酸酯 (PMA)。对于组(B),将该混合物中的4 x 105 个中性粒细胞加入没有生物膜的孔中。这可以作为阳性对照。
注意:此步骤中指示的PMA浓度相对较高,以确保强大的突发响应,因为PMA刺激的中性粒细胞是阳性对照。PMA可以在较低的浓度下用于激活中性粒细胞,具体取决于实验。 - 在4°C下以270× g 离心板30秒。
- 确保将读板器设置为37°C以及发光和动力学读数设置60分钟,间隔3分钟。将板放入读板器中以测量嗜中性粒细胞产生的ROS60分钟。
注意:对于该测定,生物膜在用于发光测定的白色板中生长。PMA是氧化爆发反应的已知激动剂39。在进行涉及PMA的研究时,请确保在最后一步添加PMA,而含有中性粒细胞的溶液是冷的,因为PMA会立即启动突发反应。
5. 成像生物膜-中性粒细胞相互作用
- 使用步骤1.2-1.6设置生物膜。为了促进生物膜成像,使用金黄色葡萄球菌的荧光菌株,例如表达绿色荧光蛋白(GFP)40,41的USA300,以增加显微镜成像的便利性。
注意:使用6 μ通道载玻片(参见 材料表)代替96孔板来演示 体外 生物膜模型(步骤1)。 - 将4 x 106 细胞/ mL中性粒细胞与100μM蓝色CMAC(7-氨基-4-氯甲基香豆素)染料(BCD,见 材料表)在37°C和5%CO2的摇臂中孵育30分钟。确保样品在黑暗中孵育,并在剩余步骤中限制暴露在光线下。
- 为了洗涤过量的BCD,将中性粒细胞以270× g 离心5分钟并吸出上清液。将中性粒细胞重悬于新鲜的HBSS中。此时,将乙锭同源二聚体-1(参见 材料表)以终浓度4μM添加到BCD染色的中性粒细胞中,以监测中性粒细胞和细菌死亡。
- 向在μ载玻片中生长的 金黄色葡萄球菌 生物膜中加入 150 μL 中性粒细胞,使得中性粒细胞与细菌的比例为 1:30(中性粒细胞:细菌)。将μ载玻片在加湿室中孵育30分钟。细菌细胞的数量基于通过接种18小时生物膜获得的细胞计数。
- 使用对应于荧光染料/蛋白质的激发和发射波长的荧光通道对中性粒细胞-生物膜相互作用进行成像。
注意:对于本研究,BCD为353/466 nm,乙锭同源二聚体-1为528/617 nm,GFP为395/509 nm。限制样品暴露在激光或光线下,以防止样品的光漂白。 - 使用显微镜图像分析软件或程序(如FIJI / ImageJ,COMSTAT2,BiofilmQ和BAIT)分析图像42,43,44,45。
注意:处理染色剂时,重要的是要考虑所用染料的特异性。一些染色剂对原核细胞和真核细胞起作用,而另一些染色剂只对一个细胞起作用。如果使用可以染色两种细胞类型的染料分别对中性粒细胞和生物膜进行染色,请确保在结合中性粒细胞和生物膜之前洗掉任何残留的染料,以防止交叉染色。
结果
用于培养细菌生物膜的培养基会影响中性粒细胞的存活。测试了不同的培养基,以减少单独培养基对中性粒细胞活力的影响,以研究中性粒细胞-生物膜相互作用(图1)。细菌生长培养基如胰蛋白酶大豆肉汤最大限度地减少了中性粒细胞的活力,使得~60%的中性粒细胞在37°C和5%CO2孵育30分钟后存活。哺乳动物细胞培养基,如MEMα,不影响中性粒细胞的活力,并支持 金黄色葡萄球菌 生物膜的生长。事实上,最小的培养基促进了其他细菌中生物膜的强劲生长46,47。
为了评估培养基对生物膜生长的影响和洗涤生物质以消除浮游细胞后生物膜生物质定量的变异性,在96孔板中生长18小时 金黄色葡萄球菌 生物膜,用聚L-赖氨酸处理或未处理孔。营养丰富的(胰蛋白酶大豆肉汤(TSB))和最少(MEMα)培养基按原样使用或补充2%葡萄糖。用CV染色的生物膜生物质显示,在补充有2%葡萄糖的MEMα中生长的 金黄色葡萄球菌 生物膜在所有测试培养基中产生了最坚固的生物膜(图2A)。此外,在含有MEMα + 2%葡萄糖的PLL预处理孔中生长的生物膜比含有MEMα + 2%葡萄糖的PLL未处理孔中的生物膜表现出更少的变异性。这些生物膜 在 精确处理生物膜进行生物质定量后通过CV测定35 和CFU/mL进行定量时表现出较小的变异性。这些生物膜平均含有 1 x 108 CFU/mL,如在 3 天内接种生物膜所证明的那样(图 2B)。该数字可用于确定添加到生物膜中以进行中性粒细胞功能测定的中性粒细胞数量。
为了测量中性粒细胞响应生物膜产生的ROS,将 金黄色葡萄球菌 生物膜在96孔板中静态生长18-20小时。然后调理生物膜,并加入中性粒细胞。然后测量ROS产生60分钟(图3A)。曲线下面积由动力学曲线计算,以量化中性粒细胞的总ROS产生量。用激动剂(如PMA)治疗的中性粒细胞作为对照,显示ROS产生增加。在没有生物膜的情况下,用PMA处理的中性粒细胞显示出强大的ROS产生。在 存在金黄色葡萄球菌 生物膜的情况下,用PMA处理的中性粒细胞的总ROS产生减少。在没有PMA的情况下,中性粒细胞仅依赖于它们与生物膜的相互作用,这进一步减少了产生的ROS量(图3B)。
为了使用荧光显微镜可视化中性粒细胞-生物膜相互作用,使用了表达GFP的金黄色葡萄球菌,蓝色CMAC染料和乙锭同源二聚体-1菌株,分别对活细胞的细胞质和死细胞的DNA进行染色。金黄色葡萄球菌生物膜在6 μ通道载玻片中生长18小时。将蓝色CMAC染料标记的中性粒细胞与乙锭同源二聚体-1一起加入到洗涤的生物膜中,并在成像前在37°C下用5%CO2孵育30分钟。宽场荧光显微镜显示,许多中性粒细胞位于金黄色葡萄球菌生物膜的表面,而少数位于生物膜内(图4A)。中性粒细胞内金黄色葡萄球菌细胞之间的相互作用也很明显(图4C)。大多数与中性粒细胞(青色)相互作用的金黄色葡萄球菌细胞是死亡的(洋红色),而少数仍然活着(黄色),通过活死染色确定(图4C)。为了进行比较,表达GFP的金黄色葡萄球菌生物膜用乙锭同源二聚体-1染色,这揭示了生物膜中死亡的金黄色葡萄球菌种群的一小部分(图4B)。与金黄色葡萄球菌生物膜孵育后,使用分析软件(参见材料表)对乙锭同源二聚体-1阳性的非活中性粒细胞进行定量。大约48%的中性粒细胞在与金黄色葡萄球菌生物膜孵育后30分钟内已经死亡。在显微镜方案的优化过程中,还评估了孵育30分钟后洗涤生物膜和中性粒细胞以去除非粘附中性粒细胞的效果,显示约33%的死中性粒细胞仍然附着在生物膜上(图4D)。
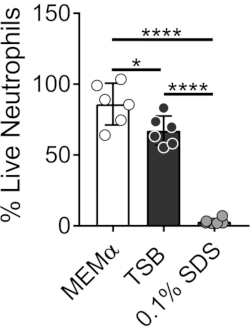
图 1:LIVE-DEAD 测定比较细菌和哺乳动物生长培养基之间的中性粒细胞存活率。分离中性粒细胞并在HBSS,MEMα,TSB或0.1%SDS中孵育30分钟。 使用钙黄绿素AM(活)和乙锭同源二聚体-1(死)进行LIVE-DEAD染色。确定活中性粒细胞的百分比,其中HBSS孵育的中性粒细胞被视为100%活中性粒细胞。结果代表平均两次独立实验一式三份,中性粒细胞来自两个不同的供体。数据以标准偏差±平均值表示(*p < 0.05,****p < 0.0001。单向方差分析)。请点击此处查看此图的大图。
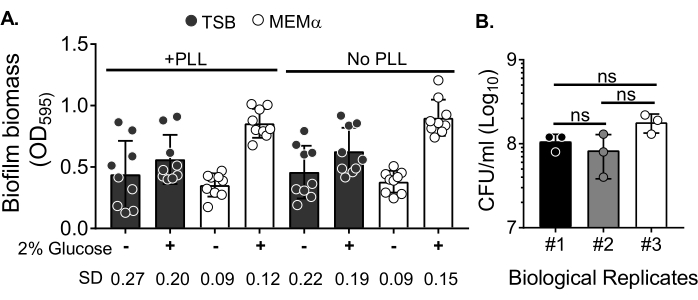
图2:不同条件下生物膜生物量的定量和优化条件下生长的生物膜的细菌活力计数。 (A)将金黄色葡萄球菌接种在用聚-L-赖氨酸(PLL)包被或未包被的96孔板中。在TSB,MEMα或补充有2%葡萄糖的培养基中在静态条件下生长生物膜18小时。进行结晶紫(CV)染色以染色生物膜生物质。洗脱的CV染色剂以1:10稀释并在酶标仪中读取。结果代表平均三个独立实验一式三份。数据以平均值±SD表示。每组的SD显示在底部,以显示不同的生物膜生长条件变异性。(B)从优化培养基(MEMα + 2%葡萄糖)中生长的生物膜中获得细菌CFU计数。将18小时静态生物膜进行相同次数的洗涤,然后进行10分钟的超声处理以松开生物膜生物质,并在电镀前通过22G针头以破坏聚集体。结果代表一式三份进行的三次重复。数据以平均值表示±SD(ns=不显著。单向方差分析)。请点击此处查看此图的大图。
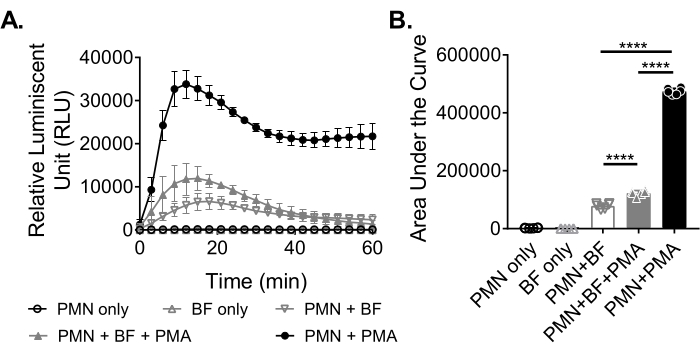
图3: 通过 化学发光测定定量中性粒细胞产生的ROS。 (A)中性粒细胞(PMN)与HBSS洗涤的 金黄色葡萄球菌 生物膜(BF)在PMA的存在(闭合灰色三角形)或不存在(开放灰色倒三角形)下孵育,以测量中性粒细胞产生的ROS。使用Luminol在酶标仪中每3分钟检测一次ROS,持续60分钟。在没有生物膜(闭合黑色圆圈)的情况下用PMA处理的中性粒细胞作为阳性对照,仅中性粒细胞(开放黑色圆圈)和仅生物膜(开放灰色三角形)组作为阴性对照。数据代表使用从两个不同供体获得的中性粒细胞一式三份进行的两次独立实验的平均值。数据以平均±SD表示。 (B)计算(A)曲线下的面积以量化中性粒细胞产生的总ROS。数据表示为标准偏差±平均值(***p < 0.0001。单向方差分析)。 请点击此处查看此图的大图。
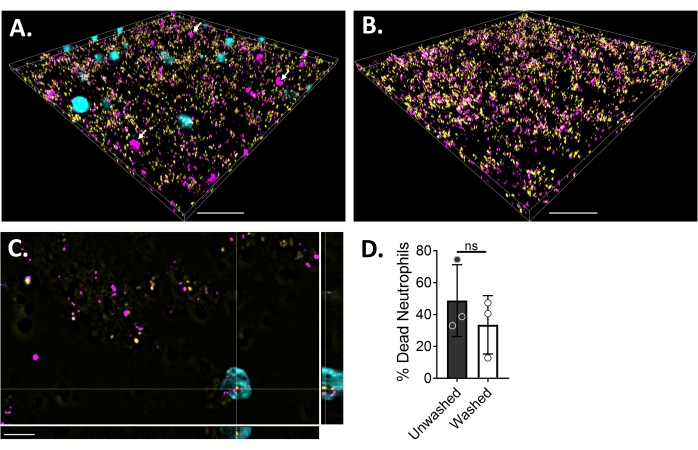
图 4:使用宽场荧光显微镜可视化金黄色葡萄球菌生物膜和中性粒细胞之间的相互作用。 蓝色CMAC染料标记的中性粒细胞(青色)补充乙锭同源二聚体-1(品红色;死),然后与18小时金黄色葡萄球菌生物膜(黄色)孵育。使用宽场荧光显微镜对生物膜-中性粒细胞相互作用进行成像,并使用图像分析软件处理图像。用三种不同的供体进行了实验。代表性图像呈现为(A)金黄色葡萄球菌生物膜的3D视图,具有活(青色)和死(品红色;少数用白色箭头表示)中性粒细胞,(B)在没有中性粒细胞的情况下金黄色葡萄球菌生物膜的3D视图,其中活金黄色葡萄球菌表达GFP(黄色)或用乙锭同型二聚体-1(品红色)染色的死金黄色葡萄球菌,(C)金黄色葡萄球菌的正交视图 和由XY,YZ和XZ平面描述的中性粒细胞相互作用,以及(D)在金黄色葡萄球菌生物膜存在下定量中性粒细胞活力,在30分钟后立即(未洗涤)或用HBSS洗涤三轮以去除非粘附的中性粒细胞(洗涤)。中性粒细胞死亡表现为SD±平均值(学生t检验)。比例尺表示 (A) 和 (B) 中的 50 μm 和 (C) 中的 10 μm。请点击此处查看此图的大图。
讨论
已经有许多努力来培养稳健且可重复的金黄色葡萄球菌生物膜,用于体外实验48,49,50。概述了一个标准化的方案,该方案利用了PLL的阳离子性质,以及用葡萄糖补充培养基以生长健壮的体外金黄色葡萄球菌生物膜。PLL的添加允许带负电荷的细菌细胞更好地附着到带正电荷的PLL涂层表面上。需要注意的是,浓度为 10 μg/mL 的 PLL 在孵育 24 小时51 时对铜绿假单胞菌、大肠杆菌和金黄色葡萄球菌具有抗菌活性。相同的浓度用于涂覆表面;然而,过量的PLL被吸入,使得PLL的浓度在接种生物膜生长时低于10μg/mL。
重要的是要注意,PLL仅在特定的生长培养基中起作用,例如具有2%葡萄糖的MEMα,其中观察到 金黄色葡萄球菌 产生具有最小变异性的稳健生物膜(图2A)。与其他介质类型结合使用的PLL浓度需要进一步优化,例如使用增加的PLL浓度来涂覆孔。此外,这些条件已针对单种 金黄色葡萄球菌 生物膜进行了优化。虽然慢性伤口生物膜通常是多种微生物的,但标准化测定以研究单物种生物膜及其与中性粒细胞和其他免疫细胞的相互作用是了解其对发病机制的贡献的关键52。这些标准化方案可以进一步优化,以维持和研究多种微生物生物膜及其与中性粒细胞的相互作用。
还观察到丰富的细菌培养基,如TSB,导致中性粒细胞活力丧失(图1)。因此,优化了用于哺乳动物细胞培养的MEMα中 金黄色葡萄球菌 生物膜的生长条件。对于涉及中性粒细胞的研究,该培养基支持中性粒细胞活力并促进 金黄色葡萄球菌 生长。虽然观察到培养基影响中性粒细胞的活力,但同样重要的是要考虑到从外周人血中分离的中性粒细胞在 20 小时53时发生体外凋亡,凋亡中性粒细胞约为70%。这需要适当的处理,例如在准备实验时将中性粒细胞储存在冰上,使用无内毒素试剂,以及通过避免中性粒细胞涡旋样品来防止中性粒细胞活化。
常规评估中性粒细胞中的氧化爆发,以确定中性粒细胞对病原体14,54,55的杀灭作用。这些研究经常使用添加中性粒细胞的浮游细菌进行,并使用鲁米诺放大的化学发光来检测中性粒细胞产生的超氧阴离子来量化氧化爆发反应。通过用静态生长的18小时金黄色葡萄球菌生物膜替换浮游细菌来修改本协议。因此,中性粒细胞可以直接添加到生物膜中以评估其活化。另一方面,生物膜中的细菌产生酶,例如过氧化氢酶和超氧化物歧化酶来解毒 ROS23,56。表皮葡萄球菌生物膜在胁迫下产生比浮游对应物更高的过氧化氢酶57。金黄色葡萄球菌生物膜中PMA刺激的中性粒细胞的总化学发光明显低于没有生物膜的PMA刺激中性粒细胞(图2)。这可能是由于这些解毒酶的活性。此外,金黄色葡萄球菌生物膜产生几种称为白细胞杀伤细胞的造孔毒素58。爆发反应的降低也可能是由于中性粒细胞在金黄色葡萄球菌生物膜存在下的活力降低。虽然这项研究使用鲁米诺来检测细胞内外产生的总ROS,但如果工作的目标是专门研究细胞内或细胞外ROS产生14,53,54,则需要考虑其他试剂,例如CM-H2DCFDA(5-(和-6)-氯甲基-2'7'-二氯二氢荧光素二乙酸酯)或异鲁米诺。
通过显微镜可视化中性粒细胞-生物膜相互作用的能力可以提供有关中性粒细胞和生物膜在彼此存在下的行为的信息。荧光染料和蛋白质的激发和发射光谱代表了30分钟孵育后18小时金黄色葡萄球菌生物膜与中性粒细胞之间相互作用的快照。为了有效地捕获来自染色细胞的信号,在设置样品进行显微镜检查时,限制样品暴露于光源非常重要。在成像时,在调整所有参数(例如Z堆栈高度和不同通道的曝光时间)时,通过降低光源强度来避免样品的快速光漂白。
这些简单的实践允许适当的显微镜成像,其中观察到很少有中性粒细胞位于生物膜内(图4A)。这可能是由于生物膜内存在空间,因为在具有2%葡萄糖的MEMα中生长的18小时金黄色葡萄球菌生物膜不能均匀地覆盖表面(图4B)。然而,其他研究对富媒体的使用表明,金黄色葡萄球菌生物膜生长和白细胞穿透生物膜的均匀草坪30,58。此外,还观察到,由于金黄色葡萄球菌生物膜产生的白细胞杀青素裂解中性粒细胞58,因此在与金黄色葡萄球菌生物膜孵育30分钟后出现中性粒细胞死亡(图4A,D)。与未洗涤组相比,在用生物膜孵育30分钟后,添加洗涤步骤以去除未粘附的中性粒细胞,从系统中去除~15%的死中性粒细胞,其中在孵育30分钟后立即进行显微镜检查(图4D)。还观察到与金黄色葡萄球菌相互作用的中性粒细胞(图4C)。需要进一步的实验来评估金黄色葡萄球菌是否被中性粒细胞吞噬或附着在中性粒细胞54的细胞表面。对中性粒细胞和生物膜进行成像是评估下游几种中性粒细胞功能的第一步,例如吞噬作用和NETosis54,59。中性粒细胞对生物膜的影响也可以通过使用步骤5.6中列出的图像分析工具量化生物膜生物量,生物膜的结构变化和生物膜活力等来评估。最后,中性粒细胞中存在供体与供体之间的差异;因此,建议至少使用三种不同的供体进行涉及中性粒细胞的研究。
总体而言,结合标准化体外测定来评估中性粒细胞和生物膜之间的相互作用。虽然这些测定利用金黄色葡萄球菌,但所描述的方案可以很容易地适应研究其他病原体。虽然有各种体内模型来研究宿主 - 病原体相互作用,但它们可能是昂贵和劳动密集型的,特别是在条件没有优化的情况下。使用标准化的体外测定可以优化实验条件并在转移到体内系统之前确认观察结果。最后,各种动物感染模型已被用于研究体内生物膜-中性粒细胞相互作用。然而,重要的是要考虑人类和动物模型之间的免疫学差异60,61,62,63。这需要使用来自人类的中性粒细胞来研究这些复杂的宿主 - 病原体相互作用。
披露声明
作者没有什么可透露的。
致谢
这项工作由美国国家过敏和传染病研究所(R01AI077628)资助给DJW,并获得了美国心脏协会职业发展奖(19CDA34630005)给ESG。我们感谢Paul Stoodley博士为我们提供USA 300 LAC GFP菌株。此外,我们感谢来自俄亥俄州立大学校园显微镜和成像设施 (CMIF) 和俄亥俄州立大学综合癌症中心 (OSUCCC) 显微镜共享资源 (MSR) 的资源。我们还要感谢Stoodley实验室的Amelia Staats,Peter Burback和Lisa Coleman进行抽血。
材料
| Name | Company | Catalog Number | Comments |
| 0.9% sodium chloride irrigation, USP | Baxter | 2F7124 | Endotoxin-free; Used for isolation of neutrophils |
| 150 mL rapid-flow filter unit | Thermo Scientific | 565-0020 | |
| 200 proof ethanol | VWR | 89125-188 | |
| 3 mL syringe | BD | 309657 | Used for blood draw |
| 50 mL conical centrifuge tubes | Thermo Scientific | 339652 | |
| 60 mL syringe | BD | 309653 | Used for blood draw |
| Agar | Fisher Bioreagents | BP1423-2 | |
| Alcohol swab | BD | Used for blood draw | |
| Band-aids | Used for blood draw | ||
| BD Bacto Tryptic Soy Broth | BD | DF0370-07-5 | Combine with 1.5% agar to make Tryptic Soy Agar |
| Cell counter | Bal Saupply | 202C | |
| CellTracker blue CMCH | Invitrogen | C2111 | Blue CMAC Dye (BCD) |
| Clear bottom 96-well flat bottom polystyrene plates | Costar | 3370 | |
| Cotton gauze | Fisherbrand | 13-761-52 | Used for blood draw |
| Crystal violet | Acros Organic | 40583-0250 | |
| Culture tubes | Fisherbrand | 14-961-27 | Borosilicate Glass 13 x 100 mm |
| D-(+)-glucose | Sigma | G-8270 | |
| Dextran from Leuconostoc spp. | Sigma | 31392-250G | Used for isolation of neutrophils |
| Dulbecco's phosphate buffered saline (DPBS) 1x | Gibco | 14190-144 | |
| Ethidium homodimer-1 | Invitrogen | L3224 B | |
| Ficoll-Paque plus | Cytiva | 17144003 | Used for isolation of neutrophils (density gradient medium) |
| Hanks' balanced salt solution (HBSS) 1x | Corning cellgro | 21-022-CV | without calcium, magnesium, and phenol red |
| Hemacytometer | Bright Line | ||
| Heparin | Novaplus | NDC 63323-540-57 | 1000 USP units/mL, Used for blood draw |
| IMARIS 9.8 | Oxford Instruments | Microscopy image analysis software | |
| Luminol | Sigma | A8511-5G | |
| Minimal essential media (MEM) Alpha 1x | Gibco | 41061-029 | |
| Needle (23 G1) | BD | 305145 | Used for blood draw |
| Nikon Eclipse Ti2 | Nikon | ||
| NIS-Elements | Nikon | Quantification of dead neutrophils | |
| Normal human serum | Complement Technology | NHS | |
| Petri Dish (100 x 15 mm) | VWR | 25384-342 | |
| Phorbol 12-myristate 13-acetate | |||
| Poly-L-lysine solution | Sigma | P4707-50ML | |
| Sodium chloride | Fisher Bioreagents | BP358-10 | Used for neutrophil isolation |
| SoftMax Pro Software | Molecular Devices | Microplate reader software used for data acquisition | |
| SpectraMax i3x | Molecular Devices | Microplate reader | |
| Sterile water for irrigation, USP | Baxter | 2F7114 | Endotoxin-free; Used for neutrophil isolation |
| Surflo winged infusion set | Terumo | SC*19BLK | 19 G x 3/4", used for blood draw |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Turnicate | Used for blood draw | ||
| UltraPure distilled water | Invitrogen | 10977015 | |
| White opaque 96-well plates | Falcon | 353296 | Tissue culture treated and flat bottom plate |
| μ-Slide VI 0.4 | Ibidi | 80601 | μ-channel slide |
参考文献
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerging Infectious Diseases. 8 (9), 881-890 (2002).
- Alhede, M., et al. Phenotypes of non-attached Pseudomonas aeruginosa aggregates resemble surface attached biofilm. PLoS One. 6 (11), 27943(2011).
- Hall-Stoodley, L., Costerton, J. W., Stoodley, P. Bacterial biofilms: from the natural environment to infectious diseases. Nature Reviews: Microbiology. 2 (2), 95-108 (2004).
- Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clinical Microbiology Reviews. 15 (2), 167-193 (2002).
- Schilcher, K., Horswill, A. R. Staphylococcal biofilm development: structure, regulation, and treatment strategies. Microbiology and Molecular Biology Reviews. 84 (3), 0002(2020).
- Kaplan, J. B. Biofilm dispersal: mechanisms, clinical implications, and potential therapeutic uses. Journal of Dental Research. 89 (3), 205-218 (2010).
- Otto, M. Staphylococcal Biofilms. Microbiology Spectrum. 6 (4), 10(2018).
- Moormeier, D. E., Bayles, K. W. Staphylococcus aureus biofilm: a complex developmental organism. Molecular Microbiology. 104 (3), 365-376 (2017).
- Gross, M., Cramton, S. E., Gotz, F., Peschel, A. Key role of teichoic acid net charge in Staphylococcus aureus colonization of artificial surfaces. Infection and Immunity. 69 (5), 3423-3426 (2001).
- Zheng, Y., He, L., Asiamah, T. K., Otto, M. Colonization of medical devices by staphylococci. Environmental Microbiology. 20 (9), 3141-3153 (2018).
- Donlan, R. M. Biofilms and device-associated infections. Emerging Infectious Diseases. 7 (2), 277-281 (2001).
- Kolaczkowska, E., Kubes, P. Neutrophil recruitment and function in health and inflammation. Nature Reviews Immunology. 13 (3), 159-175 (2013).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annual Review of Immunology. 30, 459-489 (2012).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- van Kessel, K. P., Bestebroer, J., van Strijp, J. A. Neutrophil-mediated phagocytosis of Staphylococcus aureus. Frontiers in Immunology. 5, 467(2014).
- Nguyen, G. T., Green, E. R., Mecsas, J. Neutrophils to the ROScue: Mechanisms of NADPH oxidase activation and bacterial resistance. Frontiers in Cellular and Infection Microbiology. 7, 373(2017).
- Saini, R., Singh, S. Inducible nitric oxide synthase: An asset to neutrophils. Journal of Leukocyte Biology. 105 (1), 49-61 (2019).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Segal, A. W. The function of the NADPH oxidase of phagocytes and its relationship to other NOXs in plants, invertebrates, and mammals. The International Journal of Biochemistry and Cell Biology. 40 (4), 604-618 (2008).
- Fang, F. C. Antimicrobial reactive oxygen and nitrogen species: concepts and controversies. Nature Reviews Microbiology. 2 (10), 820-832 (2004).
- Bogdan, C. Nitric oxide and the immune response. Nature Immunology. 2 (10), 907-916 (2001).
- Chua, S. L., et al. Reactive oxygen species drive evolution of pro-biofilm variants in pathogens by modulating cyclic-di-GMP levels. Open Biology. 6 (11), 160162(2016).
- El Haj, C., Lichtenberg, M., Nielsen, K. L., Bjarnsholt, T., Jensen, P. O. Catalase protects biofilm of Staphylococcus aureus against daptomycin activity. Antibiotics. 10 (5), 511(2021).
- Ghimire, N., et al. Direct microscopic observation of human neutrophil-Staphylococcus aureus interaction in vitro suggests a potential mechanism for initiation of biofilm infection on an implanted medical device. Infection and Immunity. 87 (12), 00745(2019).
- Bhattacharya, M., et al. Leukocidins and the nuclease nuc prevent neutrophil-mediated killing of Staphylococcus aureus biofilms. Infection and Immunity. 88 (10), 00372(2020).
- Bogachev, M. I., et al. Fast and simple tool for the quantification of biofilm-embedded cells sub-populations from fluorescent microscopic images. PLoS One. 13 (5), 0193267(2018).
- Kerstens, M., et al. A flow cytometric approach to quantify biofilms. Folia Microbiologica. 60 (4), 335-342 (2015).
- Meyle, E., et al. Destruction of bacterial biofilms by polymorphonuclear neutrophils: relative contribution of phagocytosis, DNA release, and degranulation. The International Journal of Artificial Organs. 33 (9), 608-620 (2010).
- Oveisi, M., et al. Novel assay to characterize neutrophil responses to oral biofilms. Infection and Immunity. 87 (2), 00790(2019).
- Leid, J. G., Shirtliff, M. E., Costerton, J. W., Stoodley, P. Human leukocytes adhere to, penetrate, and respond to Staphylococcus aureus biofilms. Infection and Immunity. 70 (11), 6339-6345 (2002).
- Fey, P. D., et al. A genetic resource for rapid and comprehensive phenotype screening of nonessential Staphylococcus aureus genes. mBio. 4 (1), 00537(2013).
- Cody, W. L., et al. Skim milk enhances the preservation of thawed -80 degrees C bacterial stocks. Journal of Microbiological Methods. 75 (1), 135-138 (2008).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. 63, 3064(2012).
- Freitas, M., Porto, G., Lima, J. L., Fernandes, E. Optimization of experimental settings for the analysis of human neutrophils oxidative burst in vitro. Talanta. 78 (4-5), 1476-1483 (2009).
- Merritt, J. H., Kadouri, D. E., O'Toole, G. A. Growing and analyzing static biofilms. Current Protocols in Microbiology. , Chapter 1 Unit 1B 1 (2005).
- Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. 412, 15-20 (2007).
- Zhou, L., et al. Impact of human granulocyte and monocyte isolation procedures on functional studies. Clinical and Vaccine Immunology. 19 (7), 1065-1074 (2012).
- Quach, A., Ferrante, A. The application of dextran sedimentation as an initial step in neutrophil purification promotes their stimulation, due to the presence of monocytes. Journal of Immunology Research. 2017, 1254792(2017).
- Karlsson, A., Nixon, J. B., McPhail, L. C. Phorbol myristate acetate induces neutrophil NADPH-oxidase activity by two separate signal transduction pathways: dependent or independent of phosphatidylinositol 3-kinase. Journal of Leukocyte Biology. 67 (3), 396-404 (2000).
- Staats, A., et al. Rapid aggregation of Staphylococcus aureus in synovial fluid is influenced by synovial fluid concentration, viscosity, and fluid dynamics, with evidence of polymer bridging. mBio. , 0023622(2022).
- Chiu, I. M., et al. Bacteria activate sensory neurons that modulate pain and inflammation. Nature. 501 (7465), 52-57 (2013).
- Hartig, S. M. Basic image analysis and manipulation in ImageJ. Current Protocols in Molecular Biology. 102 (1), 14-15 (2013).
- Heydorn, A., et al. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146 (10), 2395-2407 (2000).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Luo, T. L., et al. Introducing BAIT (Biofilm Architecture Inference Tool): a software program to evaluate the architecture of oral multi-species biofilms. Microbiology. 165 (5), 527-537 (2019).
- Naves, P., et al. Measurement of biofilm formation by clinical isolates of Escherichia coli is method-dependent. Journal of Applied Microbiology. 105 (2), 585-590 (2008).
- Eze, E. C., El Zowalaty, M. E. Combined effects of low incubation temperature, minimal growth medium, and low hydrodynamics optimize Acinetobacter baumannii biofilm formation. Infection and Drug Resistance. 12, 3523-3536 (2019).
- Harris, L. G., Tosatti, S., Wieland, M., Textor, M., Richards, R. G. Staphylococcus aureus adhesion to titanium oxide surfaces coated with non-functionalized and peptide-functionalized poly(L-lysine)-grafted-poly(ethylene glycol) copolymers. Biomaterials. 25 (18), 4135-4148 (2004).
- Miao, J., et al. Biofilm formation of Staphylococcus aureus under food heat processing conditions: first report on cml production within biofilm. Scientific Reports. 9 (1), 1312(2019).
- Lade, H., et al. Biofilm formation by Staphylococcus aureus clinical isolates is differentially affected by glucose and sodium chloride supplemented culture media. Journal of Clinical Medicine. 8 (11), 1853(2019).
- Guzel Kaya, G., et al. Antibacterial activity of linezolid against gram-negative bacteria: utilization of epsilon-Poly-l-Lysine capped silica xerogel as an activating carrier. Pharmaceutics. 12 (11), 1126(2020).
- Clinton, A., Carter, T. Chronic wound biofilms: pathogenesis and potential therapies. Laboratory Medicine. 46 (4), 277-284 (2015).
- Scheel-Toellner, D., et al. Reactive oxygen species limit neutrophil life span by activating death receptor signaling. Blood. 104 (8), 2557-2564 (2004).
- Pestrak, M. J., et al. Pseudomonas aeruginosa rugose small-colony variants evade host clearance, are hyper-inflammatory, and persist in multiple host environments. PLoS Pathogens. 14 (2), 1006842(2018).
- Guerra, F. E., et al. Staphylococcus aureus SaeR/S-regulated factors reduce human neutrophil reactive oxygen species production. Journal of Leukocyte Biology. 100 (5), 1005-1010 (2016).
- Suo, Y., Huang, Y., Liu, Y., Shi, C., Shi, X. The expression of superoxide dismutase (SOD) and a putative ABC transporter permease is inversely correlated during biofilm formation in Listeria monocytogenes 4b G. PLoS One. 7 (10), 48467(2012).
- Olwal, C. O., Ang'ienda, P. O., Ochiel, D. O. Alternative sigma factor B (sigma(B)) and catalase enzyme contribute to Staphylococcus epidermidis biofilm's tolerance against physico-chemical disinfection. Scientific Reports. 9 (1), 5355(2019).
- Bhattacharya, M., et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing. Proceedings of the National Academy of Sciences of the United States of America. 115 (28), 7416-7421 (2018).
- Masuda, S., et al. NETosis markers: Quest for specific, objective, and quantitative markers. Clinica Chimica Acta. 459, 89-93 (2016).
- Dworsky, E. M., et al. Novel in vivo mouse model of implant related spine infection. Journal of Orthopaedic Research. 35 (1), 193-199 (2017).
- Pletzer, D., Mansour, S. C., Wuerth, K., Rahanjam, N., Hancock, R. E. New mouse model for chronic infections by gram-negative bacteria enabling the study of anti-infective efficacy and host-microbe interactions. mBio. 8 (1), 00140(2017).
- Davis, M. M. A prescription for human immunology. Immunity. 29 (6), 835-838 (2008).
- Mestas, J., Hughes, C. C. Of mice and not men: differences between mouse and human immunology. The Journal of Immunology. 172 (5), 2731-2738 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。