Method Article
Стандартизированные анализы in vitro для визуализации и количественной оценки взаимодействий между нейтрофилами человека и биопленками золотистого стафилококка
В этой статье
Резюме
Настоящий протокол описывает изучение взаимодействий нейтрофилов и биопленки. Биопленки золотистого стафилококка устанавливаются in vitro и инкубируются с нейтрофилами человека, полученными из периферической крови. Реакция окислительного всплеска от нейтрофилов количественно определяется, а локализация нейтрофилов в биопленке определяется с помощью микроскопии.
Аннотация
Нейтрофилы являются первой линией защиты, развернутой иммунной системой во время микробной инфекции. In vivo нейтрофилы набираются в место инфекции, где они используют такие процессы, как фагоцитоз, производство активных форм кислорода и азота (ROS, RNS, соответственно), NETosis (внеклеточная ловушка нейтрофилов) и дегрануляция для уничтожения микробов и разрешения инфекции. Взаимодействия между нейтрофилами и планктонными микробами были широко изучены. В последние годы появился интерес к изучению инфекций, вызванных биопленками. Биопленки проявляют свойства, в том числе толерантность к уничтожению нейтрофилами, в отличие от их планктонных аналогов. С успешным созданием моделей биопленки in vitro и in vivo теперь можно исследовать взаимодействие между этими микробными сообществами с различными иммунными клетками. Здесь методы, которые используют комбинацию традиционных моделей биопленки и хорошо зарекомендовавших себя анализов активности нейтрофилов, специально разработаны для изучения взаимодействий нейтрофилов и биопленок. Широкоугольная флуоресцентная микроскопия используется для мониторинга локализации нейтрофилов в биопленках. Эти биопленки выращивают в статических условиях с последующим добавлением нейтрофилов, полученных из периферической крови человека. Образцы окрашиваются соответствующими красителями перед визуализацией под микроскопом. Кроме того, производство АФК, которое является одним из многих нейтрофильных ответов против патогенов, количественно определяется в присутствии биопленки. Добавление иммунных клеток в эту установленную систему расширит понимание взаимодействий хозяина и патогена, обеспечивая при этом использование стандартизированных и оптимизированных условий для точного измерения этих процессов.
Введение
Биопленка представляет собой сообщество поверхностно-ассоциированных микробов или неприсоединенных агрегатов, заключенных во внеклеточное полимерное вещество (EPS)1,2. Эти сообщества защищают заключенные микроорганизмы от стрессоров окружающей среды, включая толерантность к противомикробным агентам и иммунной системе3. Несколько патогенных микробных видов образуют биопленки, которые были связаны с хроническими инфекциями4. Разработка биопленок представляет собой сложный процесс, включающий прикрепление к поверхностям, производство EPS, пролиферацию клеток, структурирование биопленки и отслоение клеток5. Как только клетки рассеиваются с образованием биопленки, они остаются планктонными или перемещаются в новый субстрат и повторно инициируют развитие биопленки6.
Золотистый стафилококк, условно-патогенный микроорганизм, следует общей схеме развития биопленки, включая прикрепление, пролиферацию, созревание и рассеивание7. Процесс присоединения в биопленках S. aureus продиктован гидрофобными взаимодействиями, тейховыми кислотами и компонентами поверхности микробов, распознающими молекулы адгезивной матрицы (MSCRAMMs)8,9. По мере того, как начинается пролиферация S. aureus, EPS, которая в основном состоит из полисахаридов, белков, внеклеточной ДНК и тейховых кислот, продуцируется5. По мере производства компонентов EPS также образуются различные экзоферменты и малые молекулы, способствующие 3-мерной структуре биопленки и способствующие отслоению5. S. aureus использует этот высоко скоординированный образ жизни для установления различных хронических инфекций, включая инфекции, вызванные пребыванием в медицинских устройствах10.
Метициллин-резистентный S. aureus (MRSA) является одной из ведущих причин инфекций, связанных с внутренними медицинскими устройствами, такими как центральные венозные и мочевые катетеры, протезные суставы, кардиостимуляторы, механические клапаны сердца и внутриматочные устройства11. Во время таких инфекций нейтрофилы являются первыми иммунными клетками-хозяевами, набранными в место инфекции для борьбы с патогенами с помощью нескольких стратегий12. К ним относятся фагоцитоз, дегрануляция, производство активных форм кислорода и азота (АФК/RNS) или высвобождение внеклеточных ловушек нейтрофилов (НЭТ) для устранения патогенов13.
Генерация АФК при фагоцитозе микробов является одним из ключевых антимикробных ответов, проявляемых нейтрофилами14. Фагоцитоз усиливается, если микробы покрыты опсонинами, особенно иммуноглобулинами и компонентами комплемента, содержащимися в сыворотке15. Затем опсонизированные микробы распознаются рецепторами клеточной поверхности на нейтрофилах и поглощаются, образуя компартмент, называемый фагосомой15. Нейтрофилы генерируют и высвобождают АФК в фагосоме через мембраноассоциированную NADPH-оксидазу16. Этот многокомпонентный ферментный комплекс генерирует супероксидные анионы путем переноса электронов в молекулярный кислород16. Кроме того, нейтрофилы также генерируют RNS посредством экспрессии индуцируемой синтазы оксида азота (iNOS)17. Эти радикалы с высоким содержанием супероксида и оксида азота в фагосоме обладают широкой антимикробной активностью. Они могут взаимодействовать с металлическими центрами в ферментах и повреждать нуклеиновые кислоты, белки и клеточные мембраны возбудителя 18,19,20,21. Многочисленные микробы принимают биопленочный образ жизни и используют различные стратегии, чтобы избежать убийства ROS22,23. Таким образом, стандартизированные анализы, которые связывают биопленки с нейтрофилами для количественной оценки АФК, полезны для последовательных результатов.
В то время как анализы, такие как количественная оценка производства АФК нейтрофилов, предоставляют информацию о реакциях нейтрофилов на биопленки, способность визуализировать взаимодействия нейтрофилов в биопленке также может служить мощным инструментом. Использование флуоресцентных красителей для микроскопии часто требует оптимизации для получения высококачественных изображений, которые могут быть использованы для анализа изображений микроскопии. Гибкость для оптимизации некоторых условий ограничена, поскольку нейтрофилы могут подвергаться гибели клеток после изоляции. Кроме того, биопленки обычно промывают, чтобы удалить планктонную популяцию из экспериментальной установки перед добавлением нейтрофилов. Во время промывки изменчивость между реплицированными биопленками может возникнуть из-за потери частичной биомассы, если биопленки слабо прилипают к поверхности.
В целом, современные методы в этой области для анализа взаимодействий между нейтрофилами и биопленками в основном включают микроскопию, проточную цитометрию и перечисление колониеобразующих единиц (КОЕ) 24,25,26,27. Микроскопия включает в себя использование красителей, которые либо непосредственно окрашивают нейтрофилы и биопленки, либо нацелены на различные реакции нейтрофилов против микробов, таких как образование NET, дегрануляция и гибель клеток25,28. Подмножество этих реакций, таких как гибель нейтрофильных клеток и дегрануляция, также может быть проанализировано с помощью проточной цитометрии, но требует, чтобы нейтрофилы были преимущественно не связаны с большими агрегатами микробов в биопленке 28,29. Проточная цитометрия также может количественно определять некоторые параметры биопленки, такие как жизнеспособность клеток27. Эти процессы, однако, требуют разрушения биомассы биопленки и не были бы полезны для визуализации других важных взаимодействий, таких как пространственное распределение нейтрофилов и их компонентов в биопленке 27,29,30.
Настоящий протокол фокусируется на адаптации некоторых из традиционно используемых методов для изучения взаимодействий нейтрофилов и биопленок на биопленках, которые были оптимизированы для обеспечения минимальной изменчивости во время обработки. Таким образом, этот протокол обеспечивает стандартизированные методы для выращивания и количественной оценки биопленок, выделения первичных нейтрофилов человека из периферической крови, количественной оценки производства АФК и визуализации взаимодействий биопленки и нейтрофилов с помощью микроскопии. Этот протокол может быть адаптирован к различным системам для понимания взаимодействий биопленки и нейтрофилов при одновременном рассмотрении гетерогенности среди донорских пулов.
протокол
Все процедуры были одобрены Советом по институциональному обзору Университета штата Огайо (IRB) (2014H0154). Получено информированное письменное согласие от всех доноров на сбор периферической крови для выделения первичных нейтрофилов человека. В качестве модельного организма для проведения экспериментов использовался золотистый стафилококк (USA300 LAC)31 . Эксперименты проводились с надлежащими средствами индивидуальной защиты (СИЗ) из-за потенциального воздействия патогена, передающегося через кровь.
1. Получение биопленки in vitro
- Получают изолированные колонии S. aureus из криоконсервированного запаса31 с использованием метода32,33 полосатых пластин на богатой питательными веществами агаровой пластине, такой как триптический соевый агар (см. Таблицу материалов).
- Покрывать отдельные скважины из 96-луночной пластины 100 мкл 0,001% (v/v) поли-L-лизина (PLL), разведенного в стерильномH2Oи инкубировать при комнатной температуре в течение 30 мин. Аспирировать раствор ФАПЧ с помощью вакуумной аспирационной ловушки. Дайте колодцам высохнуть ночью при комнатной температуре.
ПРИМЕЧАНИЕ: Все этапы аспирации в протоколе выполняются с использованием вакуумной аспирационной ловушки, если не указано иное. - Готовят культуру на ночь, инокулируя колонию S. aureus в минимально необходимую среду альфа (MEMα), дополненную 2% глюкозой и инкубируем при 37 °C, встряхивая при 200 об/мин в течение 16-18 ч.
- Разбавляют культуру на ночь путем переноса 50 мкл в 5 мл свежего MEMα, дополненного 2% глюкозой, и инкубируют при 37 °C, встряхивая при 200 об/мин, до средней логарифмической фазы, обычно между оптической плотностью 600 (OD600 нм) 0,5-0,8. Используйте MEMα для нормализации среднелогарифмической культуры до OD600 нм 0,1.
- Перенос 150 мкл нормированной культуры в каждую скважину обработанной ФАПЧ 96-луночной пластины. Инкубировать статически в течение 18-20 ч в увлажненной камере при 37 °C.
ПРИМЕЧАНИЕ: Биопленки также могут быть выращены в других форматах, таких как μ-канальные слайды (см. Таблицу материалов). - Аспирировать супернатант для удаления планктонных клеток. Осторожно промыть оставшуюся биомассу 150 мкл сбалансированного раствора соли Хэнкса (HBSS), чтобы удалить неприкрепленные клетки. Добавьте HBSS по каплям, чтобы избежать разрушения биопленки.
ПРИМЕЧАНИЕ: Во время аспирации супернатанта и HBSS во время промывок оставляйте достаточно жидкости (надводного вещества или HBSS) в скважинах, содержащих биопленку, чтобы биопленка все еще погружалась. Это предотвращает нарушение структуры биопленки, когда HBSS добавляется по каплям для промывки биопленки. - Повторите шаг 1.6 по крайней мере еще два раза, чтобы удалить все планктонные ячейки. На этом этапе биопленки готовы к немедленным последующим экспериментам.
ПРИМЕЧАНИЕ: Если биопленки не используются для экспериментов с нейтрофилами, HBSS может быть заменен фосфат-буферным физиологическим раствором (PBS). HBSS предпочтительнее PBS, поскольку HBSS содержит компоненты, включая глюкозу, которые обеспечивают оптимальные условия для активации нейтрофилов34.
2. Количественная оценка биомассы биопленки
- Готовят запас 0,1% (мас./об.) раствора кристаллической фиалки (CV) (см. Таблицу материалов) путем растворения в 20% (v/v) этаноле и 80% (v/v)H2O. Убедитесь, что CV полностью растворен в этаноле перед добавлениемH2O. Фильтруйте-стерилизуйте раствор.
- Добавить 150 мкл 0,1% раствора CV к промытой биопленке и инкубировать в течение 20 мин при комнатной температуре. Используйте по крайней мере три пустые скважины в качестве элементов управления только для носителей.
- Аспирировать 0,1% раствор CV из биопленок и промыть окрашенные биопленки 200 мкл 1x PBS. Повторите этот процесс в общей сложности три промывки, чтобы удалить излишки CV из скважин.
- Добавьте 150 мкл 33% (v/v) ледниковой уксусной кислоты, разбавленнойH2O. Инкубировать при комнатной температуре на коромысле при 50 об/мин в течение 30 мин, чтобы CV, связанный с биомассой, полностью растворился.
ВНИМАНИЕ: Выполните этот шаг в ламинарной вытяжке с соответствующими СИЗ, так как ледниковая уксусная кислота является коррозионным химическим веществом. - Тем временем настройте считыватель микропластин (см. Таблицу материалов) для считывания значений пятен CV. После обработки ледниковой уксусной кислотой считайте пластину на длине волны 595 нм.
ПРИМЕЧАНИЕ: Длина волны, используемая для измерения OD CV, может варьироваться от 500-600 нм35.
3. Выделение нейтрофилов
ПРИМЕЧАНИЕ: Нейтрофилы были выделены по ранее опубликованному методу с незначительными изменениями36. Этот протокол изоляции сначала сочетает в себе центрифугирование градиента плотности, а затем осаждение декстрана 3%. Этот раздел охватывает только общий протокол изоляции нейтрофилов, уделяя особое внимание изменениям, внесенным в опубликованный протокол. Кроме того, протокол, описанный ниже, является одним из многих методов, которые могут изолировать нейтрофилы и могут быть заменены по мере необходимости. Другие методы выделения нейтрофилов включают использование среды разделения клеток или магнитного антитела разделения клеток37.
- Взять кровь у взрослого донора с помощью венипунктуры в соответствии с протоколом, изложенным в институциональном IRB. Перед забором крови убедитесь, что шприц содержит достаточное количество гепарина без консервантов, так что конечная концентрация гепарина составляет 20 Ед/мл.
- Разжижают гепаринизированную кровь на 3/4 объема без эндотоксинов 0,9% NaCl (см. Таблицу материалов) вН2Опри комнатной температуре.
- На каждые 20 мл разбавленного образца крови приходится аликвота 14 мл коммерчески доступной среды градиента плотности (см. Таблицу материалов) в свежей конической пробирке объемом 50 мл. Аккуратно нанесите разбавленный образец крови поверх среды градиента плотности.
- Центрифугировать слоистый образец крови при 400 х г в течение 40 мин при комнатной температуре. Убедитесь, что центрифуга имеет медленный разрыв, чтобы избежать нарушения слоя после завершения центрифугирования.
ПРИМЕЧАНИЕ: Образец крови будет иметь пять слоев, содержащих смесь физиологического раствора и плазмы, слой мононуклеарных клеток, градиентную среду плотности, нейтрофилы и эритроциты. - Используя серологическую пипетку, аспирируют все слои над нейтрофилами и гранулами эритроцитов с последующим мягким повторным суспензией гранулы в холодном эндотоксине без 0,9% NaCl вH2O. Для каждой гранулы, полученной из образца крови объемом 20 мл, повторно суспендируйте гранулу обратно до общего объема 20 мл. Добавьте 1:1 объем 3% декстрана (см. Таблицу материалов). Высиживать трубку в вертикальном положении в течение 18-20 мин на льду.
ПРИМЕЧАНИЕ: Убедитесь, что 3% декстран изготовлен из 0,9% NaCl без эндотоксинов вH2O. - Удалите 20 мл верхнего слоя, содержащего нейтрофилы и некоторые эритроциты, на новую коническую трубку объемом 50 мл и центрифугируйте ее при 355 х г в течение 10 мин при 4 °C. Вылейте супернатант, оставив после себя красную гранулу.
- Осторожно повторно суспендируют гранулу в 10 мл холодного, стерильногоH2Oв течение 30 с для лизирования оставшихся эритроцитов. Немедленно добавьте в смесь 10 мл холодного раствора без эндотоксинов 0,9% для восстановления тонуса. Центрифугируют раствор при 233 х г в течение 3 мин при 4 °С.
- Вылейте супернатант и повторно суспендируйте гранулу, содержащую 95%-97% нейтрофилов в 1 мл холодного HBSS на 20 мл образца крови.
- Переведите 10 мкл ресуспендированных нейтрофилов в 90 мкл 0,4% трипана синего исключающего красителя и подсчитайте клетки с помощью гемоцитометра (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Нежизнеспособные клетки окрашиваются в синий цвет, так как краситель для исключения трипан-синего непроницаем в жизнеспособных клетках. Этот протокол обеспечивает >99% жизнеспособности клеток37,38. - Добавьте дополнительный HBSS таким образом, чтобы конечная концентрация нейтрофилов составляла 4 х 106 клеток/мл.
ПРИМЕЧАНИЕ: Для случаев с жизнеспособностью клеток <99% конечная концентрация 4 х 106 клеток/мл все еще может быть достигнута; однако общий объем полученного раствора, содержащего 4 х 106 клеток/мл, уменьшится. Конечная концентрация нейтрофилов может быть скорректирована в соответствии с экспериментальными потребностями пользователя. Нейтрофилы были повторно суспендированы при конечной концентрации 4x 10 6 клеток / мл для всех экспериментов, описанных ниже. Чтобы учесть изменчивость от донора к донору, настоятельно рекомендуется, чтобы все эксперименты, связанные с нейтрофилами, проводились по крайней мере с тремя различными донорами.
4. Измерение АФК, продуцируемой нейтрофилами
- Добавьте 100 мкл 20% нормальной сыворотки человека (разведенной в HBSS) по каплям в промытую биопленку (стадия 1.6) и инкубируйте при 37 °C в статическом состоянии в течение 30 мин для опсонизации биопленки.
- Аспирировать 20% раствор сыворотки и промыть биопленки по каплям 150 мкл HBSS один раз. Аспирировать HBSS, оставляя после себя колодцы с опсонизированными биопленками.
ПРИМЕЧАНИЕ: Для интерпретации эксперимента рекомендуется как минимум четыре группы: (A) нейтрофилы + биопленка, (B) нейтрофилы + PMA (положительный контроль, см. Таблицу материалов), (C) только нейтрофилы и (D) только биопленка. - Добавьте люминол (см. Таблицу материалов) к нейтрофилам, повторно суспендированным в HBSS в концентрации 4 х 106 клеток/мл таким образом, чтобы конечная концентрация люминола составляла 50 мкМ. Это решение готово к использованию для групп (A) и (C). Добавьте 4 х 105 нейтрофилов, смешанных с люминолом, в лунки с опсонизированными биопленками.
- В отдельной пробирке готовят 50 мкМ раствора люминола в HBSS без каких-либо нейтрофилов и добавляют его в скважину, содержащую биопленку (группа D).
- Аликвот 350 мкл нейтрофилов смешивают с люминолом и добавляют в смесь форбол 12-миристат 13-ацетат (ПМА) в конечной концентрации 500 нг/мл. Для группы (В) добавить 4 х 105 нейтрофилов из этой смеси в лунки без биопленки. Это служит положительным контролем.
ПРИМЕЧАНИЕ: Концентрация PMA, указанная на этом этапе, относительно высока для обеспечения надежного ответа на всплеск, поскольку стимулируемые PMA нейтрофилы являются положительным контролем. ПМА можно использовать в более низкой концентрации для активации нейтрофилов, в зависимости от эксперимента. - Центрифугировать пластину при 270 х г в течение 30 с при 4 °C.
- Убедитесь, что считыватель пластин установлен на 37 °C вместе с настройкой люминесценции и кинетического считывания в течение 60 минут с интервалом 3 минуты. Поместите пластину в считыватель пластин, чтобы измерить выработку АФК нейтрофилами в течение 60 мин.
ПРИМЕЧАНИЕ: Для этого анализа биопленки выращивались в белых пластинах, используемых для анализа люминесценции. PMA является известным агонистом окислительной реакции39. При проведении исследований с участием PMA убедитесь, что PMA добавляется на заключительном этапе, пока раствор, содержащий нейтрофилы, холодный, поскольку PMA немедленно инициирует взрывной ответ.
5. Визуализация биопленочных и нейтрофильных взаимодействий
- Настройте биопленку с помощью шагов 1.2-1.6. Чтобы облегчить визуализацию биопленки, используйте флуоресцентный штамм S. aureus, такой как USA300, экспрессирующий зеленый флуоресцентный белок (GFP)40,41, чтобы повысить легкость микроскопической визуализации.
ПРИМЕЧАНИЕ: Для демонстрации модели биопленки in vitro использовался 6-μ-канальный слайд (см. Таблицу материалов) вместо 96-луночной пластины (шаг 1). - Инкубировать 4 х 106 клеток/мл нейтрофилов со 100 мкМ красителя Blue CMAC (7-амино-4-хлорметилкумарин) (BCD, см. Таблицу материалов) в течение 30 мин в коромысле при 37 °C и 5% CO2. Убедитесь, что образцы инкубируются в темноте и ограничьте воздействие света на оставшихся этапах.
- Для промывания избытка БКД центрифугируют нейтрофилы по 270 х г в течение 5 мин и аспирируют супернатант. Повторное суспендирование нейтрофилов в свежем HBSS. На этом этапе добавляют гомодимер этидия-1 (см. Таблицу материалов) к окрашенным BCD нейтрофилам в конечной концентрации 4 мкМ для мониторинга гибели нейтрофилов и бактерий.
- Добавьте 150 мкл нейтрофилов к биопленке S. aureus , которая была выращена в μ-слайдах, так что отношение нейтрофилов к бактериям составляет 1:30 (нейтрофил: бактерии). Высиживайте μ-горки в увлажненной камере в течение 30 минут. Количество бактериальных клеток основано на количестве клеток, полученных при покрытии 18-часовой биопленки.
- Изобразите взаимодействие нейтрофил-биопленка с помощью флуоресцентных каналов, соответствующих длинам волн возбуждения и излучения флуоресцентных красителей/белков.
ПРИМЕЧАНИЕ: Для настоящего исследования BCD составляет 353/466 нм, гомодимер этидия-1 - 528/617 нм, а GFP - 395/509 нм. Ограничьте воздействие на образец лазера или света, чтобы предотвратить фотоотбеливание образцов. - Анализируйте изображения с помощью программного обеспечения для анализа изображений микроскопии или программ, таких как FIJI / ImageJ, COMSTAT2, BiofilmQ и BAIT, среди многих других 42,43,44,45.
ПРИМЕЧАНИЕ: При работе с пятнами важно учитывать специфику используемых красителей. Некоторые пятна работают на прокариотических и эукариотических клетках, в то время как другие работают только на одной. Если нейтрофилы и биопленки окрашиваются отдельно с использованием красителей, которые могут окрашивать оба типа клеток, убедитесь, что они смывают любой оставшийся краситель перед объединением нейтрофилов и биопленок, чтобы предотвратить перекрестное окрашивание.
Результаты
Среда, используемая для выращивания бактериальных биопленок, влияет на выживание нейтрофилов. Различные среды были протестированы для снижения влияния одних только сред на жизнеспособность нейтрофилов для изучения взаимодействий нейтрофилов и биопленки (рисунок 1). Бактериальные питательные среды, такие как триптический соевый бульон, минимизируют жизнеспособность нейтрофилов, так что ~ 60% нейтрофилов живы после 30-минутного инкубационного периода при 37 ° C с 5% CO2. Питательные среды клеток млекопитающих, такие как MEMα, не влияют на жизнеспособность нейтрофилов и поддерживают рост биопленок S. aureus. Фактически, минимальные среды способствуют устойчивому росту биопленок у других бактерий46,47.
Чтобы оценить влияние среды на рост биопленки и изменчивость количественной оценки биомассы биопленки после промывки биомассы для устранения планктонных клеток, 18-часовую биопленку S. aureus выращивали в 96-луночной пластине, с лунками, обработанными или необработанными поли-L-лизином. Богатые питательными веществами (tryptic Soy Broth (TSB)) и минимальные (MEMα) среды использовались как есть или дополнялись 2% глюкозой. Биомасса биопленки, окрашенная CV, показала, что биопленка S. aureus , выращенная в MEMα, дополненная 2% глюкозой, производит самую надежную биопленку среди всех протестированных сред (рисунок 2A). Кроме того, биопленки, выращенные в скважинах с предварительной обработкой ФАПЧ, содержащих MEMα + 2% глюкозы, показали меньшую изменчивость, чем биопленки в скважинах без обработки ФАПЧ, содержащих MEMα + 2% глюкозы. Эти биопленки показали меньшую вариабельность количественной оценки с помощью анализа CV35 и КОЕ/ мл при нанесении на покрытие после точной обработки биопленок для количественной оценки биомассы. Эти биопленки содержали, в среднем, 1 х 108 КОЕ/мл, что было продемонстрировано путем покрытия биопленок за 3 отдельных дня (рисунок 2B). Это число полезно при определении количества нейтрофилов, добавляемых в биопленки для анализа функциональности нейтрофилов.
Для измерения производства АФК нейтрофилами в ответ на биопленки биопленки S. aureus выращивали статически в течение 18-20 ч в 96-луночной пластине. Затем биопленки были опсонизированы, и были добавлены нейтрофилы. Затем производство ROS измерялось в течение 60 мин (рисунок 3А). Площадь под кривой рассчитывается на основе кинетической кривой для количественной оценки общего производства АФК нейтрофилами. Нейтрофилы, обработанные агонистом, таким как PMA, используемые в качестве контроля, показывают повышенную выработку АФК. В отсутствие биопленок нейтрофилы, обработанные PMA, показали надежную продукцию АФК. В присутствии биопленки S. aureus общая продукция АФК нейтрофилами, получавшими ПМА, снижалась. При отсутствии ПМА нейтрофилы полагаются исключительно на свое взаимодействие с биопленкой, что еще больше снижает количество вырабатываемой АФК (рисунок 3В).
Для визуализации взаимодействия нейтрофил-биопленка с помощью флуоресцентной микроскопии был использован GFP-экспрессирующий штамм S. aureus, краситель Blue CMAC и гомодимер этидия-1, окрашивающий цитоплазму живых клеток и ДНК мертвых клеток, соответственно. Биопленку S. aureus выращивали в течение 18 ч на 6-μ-канальном слайде. Нейтрофилы, меченные красителем Blue CMAC, добавляли вместе с гомодимером этидия-1 в промытые биопленки и инкубировали в течение 30 мин при 37 °C с 5% CO2 перед визуализацией. Широкоугольная флуоресцентная микроскопия показала, что многие нейтрофилы локализованы на поверхности биопленок S. aureus , в то время как некоторые находятся в биопленке (рисунок 4A). Взаимодействие между клетками S. aureus внутри нейтрофилов также было очевидным (рисунок 4C). Большинство клеток S. aureus , взаимодействующих с нейтрофилами (голубой), были мертвы (пурпурные), в то время как некоторые остались живыми (желтые), как определено живым мертвым окрашиванием (рисунок 4C). Для сравнения, GFP-экспрессирующие биопленки S. aureus были окрашены гомодимером этидия-1, который выявил часть мертвой популяции S. aureus в биопленке (рисунок 4B). Нежизнеспособные нейтрофилы, которые были положительными для гомодимера этидия-1, были количественно определены с использованием аналитического программного обеспечения (см. Таблицу материалов) после инкубации с биопленками S. aureus . Приблизительно 48% нейтрофилов уже были мертвы в течение 30 минут после инкубации с биопленкой S. aureus . Во время оптимизации протокола микроскопии также оценивали эффект промывки биопленки и нейтрофилов после 30 мин инкубации для удаления неприлипших нейтрофилов, выявляя около 33% мертвых нейтрофилов, все еще прикрепленных к биопленке (рисунок 4D).
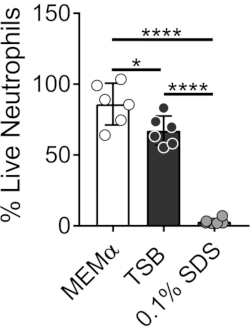
Рисунок 1: Анализ LIVE-DEAD сравнивает выживаемость нейтрофилов между бактериальными и млекопитающими питательными средами. Нейтрофилы выделяли и инкубировали в HBSS, MEMα, TSB или 0,1% SDS в течение 30 мин. Окрашивание LIVE-DEAD проводили с использованием Calcein AM (живой) и гомодимера этидия-1 (мертвый). Был определен процент живых нейтрофилов, где HBSS-инкубированные нейтрофилы лечились как 100% живые нейтрофилы. Результаты представляют собой в среднем два независимых эксперимента, выполненных в трех экземплярах, с нейтрофилами, полученными от двух разных доноров. Данные представлены в виде среднего значения ± SD (*p < 0,05, ****p < 0,0001. Односторонняя ANOVA). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
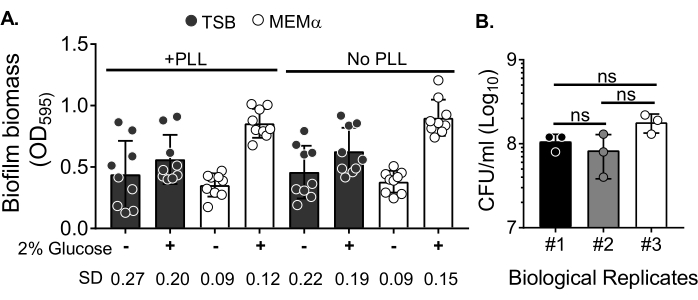
Рисунок 2: Количественная оценка биомассы биопленки в различных условиях и количество бактериальной жизнеспособности биопленок, выращенных в оптимизированных условиях. (A) S. aureus засеяли в 96-луночную пластину, покрытую или не покрытую поли-L-лизином (ФАПЧ). Биопленки выращивали в TSB, MEMα или любой из сред, дополненных 2% глюкозой в статических условиях в течение 18 ч. Окрашивание кристаллической фиалкой (CV) проводилось для окрашивания биомассы биопленки. Элюированное пятно CV разбавляли в 1:10 и считывали в считывателе микропластин. Результаты представляют собой в среднем три независимых эксперимента, выполненных в трех экземплярах. Данные представлены в виде среднего ± УР. SD для каждой группы показан внизу, чтобы продемонстрировать изменчивость различных условий роста биопленки. (B) Количество бактериальных КОЕ было получено из биопленок, выращенных в оптимизированной среде (MEMα + 2% глюкозы). 18-часовые статические биопленки подвергали такому же количеству промывок с последующим 10-минутным ультразвуком для ослабления биомассы биопленки и пропускали через иглу 22G, чтобы разрушить агрегаты перед покрытием. Результаты представляют собой три реплики, выполненные в трех экземплярах. Данные представляются в виде среднего ± УР (ns = незначителен. Односторонняя ANOVA). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
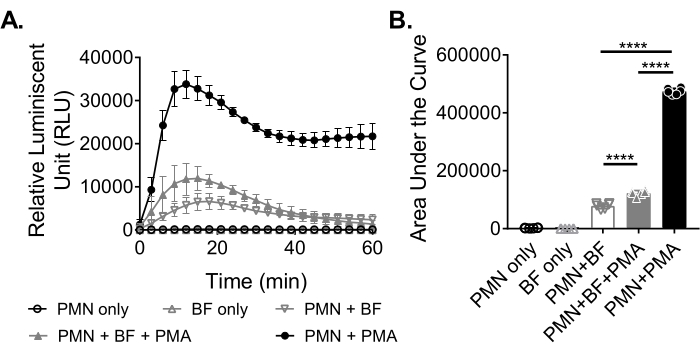
Рисунок 3: Количественная оценка производства АФК нейтрофилами с помощью хемилюминесцентного анализа. (A) Нейтрофилы (PMN) инкубировали с биопленками S. aureus (BF), промытыми HBSS, либо в присутствии (закрытый серый треугольник), либо в отсутствии (открытый серый перевернутый треугольник) PMA для измерения продукции АФК нейтрофилами. Люминол использовался для обнаружения АФК каждые 3 мин в течение 60 мин в микропластинчатом считывателе. В то время как нейтрофилы, получавшие ПМА в отсутствие биопленки (замкнутого черного круга), служили положительным контролем, группы только нейтрофилов (открытый черный круг) и только биопленки (открытый серый треугольник) служили отрицательным контролем. Данные представляют собой в среднем два независимых эксперимента, выполненных в трех экземплярах с нейтрофилами, полученными от двух разных доноров. Данные представлены в виде среднего ± SD. (B) Площадь под кривой из (A) была рассчитана для количественной оценки общего АФК, генерируемого нейтрофилами. Данные представлены в виде среднего ± SD. (***p < 0,0001. Односторонняя ANOVA). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
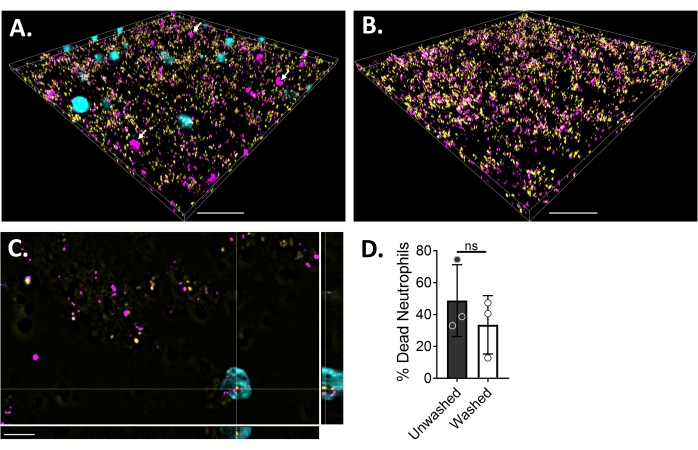
Рисунок 4: Визуализация взаимодействия между биопленкой S. aureus и нейтрофилами с помощью широкопольной флуоресцентной микроскопии. Синие нейтрофилы, меченые красителем CMAC (голубой), были дополнены гомодимером этидия-1 (пурпурный; мертвый) перед инкубацией с 18-часовой биопленкой S. aureus (желтый). Взаимодействия биопленки и нейтрофилов были получены с использованием широкопольной флуоресцентной микроскопии и изображений, обработанных с использованием программного обеспечения для анализа изображений. Эксперименты проводились с тремя разными донорами. Репрезентативные изображения представлены в виде (A) 3D-вида биопленки S. aureus с живыми (голубой) и мертвыми (пурпурными; несколько обозначены белыми стрелками) нейтрофилами, (B) 3D-вид биопленки S. aureus в отсутствие нейтрофилов с живым S. aureus , экспрессирующим GFP (желтый), либо с мертвым S. aureus , окрашенным гомодимером этидия-1 (пурпурным), (C) ортогональным видом S. aureus и взаимодействие нейтрофилов, как показано плоскостями xy, yz и xz, и (D) количественная оценка жизнеспособности нейтрофилов в присутствии биопленки S. aureus через 30 мин либо немедленно (немытая), либо после трех раундов промывок HBSS для удаления неприлипших нейтрофилов (промытых). Гибель нейтрофильных клеток представлена как средняя ± SD (t-тест Стьюдента). Шкала указывает на 50 мкм в (A) и (B) и 10 мкм в (C). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Были предприняты многочисленные усилия по выращиванию надежных и воспроизводимых биопленок S. aureus для последующих экспериментов in vitro 48,49,50. Изложен стандартизированный протокол, который использует катионную природу ФАПЧ, а также дополняет среды глюкозой для роста надежных биопленок S. aureus in vitro. Добавление ФАПЧ позволяет лучше прикреплять отрицательно заряженную бактериальную клетку к положительно заряженным поверхностям с покрытием ФАПЧ. Важно отметить, что ФАПЧ при концентрации 10 мкг/мл обладает антимикробной активностью в отношении Pseudomonas aeruginosa, Escherichia coli и S. aureus при инкубации в течение 24 ч51. Такая же концентрация используется для покрытия поверхностей; однако избыток ФАПЧ аспирируется, в результате чего концентрация ФАПЧ ниже 10 мкг/мл при посеве для роста биопленки.
Важно отметить, что PLL работал только в специфических средах роста, таких как MEMα с 2% глюкозы, где было замечено, что S. aureus производит надежные биопленки с минимальной изменчивостью (рисунок 2A). Концентрация ФАПЧ для использования в сочетании с другими типами сред потребует дальнейшей оптимизации, такой как использование повышенной концентрации ФАПЧ для покрытия скважин. Кроме того, эти условия были оптимизированы для моновидовой биопленки S. aureus . В то время как хронические раневые биопленки часто являются полимикробными, стандартизация анализов для изучения моновидовой биопленки и ее взаимодействия с нейтрофилами и другими иммунными клетками является ключом к пониманию их вклада в патогенез52. Эти стандартизированные протоколы могут быть дополнительно оптимизированы для поддержания и изучения полимикробных биопленок и их взаимодействия с нейтрофилами.
Было также отмечено, что богатые бактериальные питательные среды, такие как TSB, приводят к потере жизнеспособности нейтрофилов (рисунок 1). Поэтому были оптимизированы условия роста биопленок S. aureus в MEMα, используемых для культур клеток млекопитающих. Для исследований с участием нейтрофилов эта среда поддерживает жизнеспособность нейтрофилов и способствует росту S. aureus . Хотя было замечено, что среды влияют на жизнеспособность нейтрофилов, также важно учитывать, что нейтрофилы, выделенные из периферической крови человека, подвергаются апоптозу ex vivo с примерно 70% апоптотических нейтрофилов к 20 ч53. Это требует правильного обращения, такого как хранение нейтрофилов на льду при подготовке к экспериментам, использование реагентов без эндотоксинов и предотвращение активации нейтрофилов, избегая вихря образцов с нейтрофилами.
Оценка окислительного всплеска в нейтрофилах обычно проводится для определения убивающего эффекта нейтрофилов на возбудителя 14,54,55. Эти исследования часто проводятся с планктонными бактериями, где добавляются нейтрофилы, а окислительный взрывной ответ количественно определяется с использованием люминол-амплифицированной хемилюминесценции, которая обнаруживает супероксидные анионы, продуцируемые нейтрофилами. Настоящий протокол модифицируется путем замены планктонных бактерий статически выращенной 18-часовой биопленкой S. aureus. Таким образом, нейтрофилы могут быть непосредственно добавлены в биопленку для оценки их активации. С другой стороны, бактерии в биопленках продуцируют ферменты, такие как каталаза и супероксиддисмутаза для детоксикации ROS23,56. Биопленки Staphylococcus epidermidis производят больше каталазы, чем его планктонный аналог при стрессе57. Общая хемилюминесценция ПМА-стимулированных нейтрофилов в биопленке S. aureus значительно ниже, чем у нейтрофилов, стимулируемых ПМА, где биопленка отсутствует (рисунок 2). Это может быть связано с активностью этих детоксикационных ферментов. Кроме того, биопленки S. aureus производят несколько порообразующих токсинов, называемых лейкоцидинами, которые убивают нейтрофилы58. Снижение реакции на всплеск также вероятно из-за снижения жизнеспособности нейтрофилов в присутствии биопленки S. aureus. В то время как в этом исследовании используется люминол, который обнаруживает общий АФК, продуцируемый как внутри, так и снаружи клеток, другие реагенты, такие как CM-H2DCFDA (5-(и-6)-хлорметил-2'7'-дихлордигидрофлюоресцеин диацетат) или изолюминол, должны быть рассмотрены, если целью работы является изучение внутриклеточной или внеклеточной продукции АФК 14,53,54 конкретно.
Способность визуализировать взаимодействия нейтрофилов и биопленок с помощью микроскопии может быть информативной о поведении нейтрофилов и биопленок в присутствии друг друга. Спектры возбуждения и излучения флуоресцентных красителей и белков представляют собой снимок взаимодействия между 18-часовой биопленкой S. aureus и нейтрофилами после 30-минутной инкубации. Для эффективного захвата сигналов от окрашенных клеток важно ограничить воздействие образцов на источники света при настройке образцов для микроскопии. При визуализации быстрого фотоотбеливания образцов удалось избежать за счет снижения интенсивности источника света при регулировке всех параметров, таких как высота Z-стека и время экспозиции для разных каналов.
Эти простые методы позволили провести правильную микроскопическую визуализацию, где было замечено, что в биопленке локализовано мало нейтрофилов (рисунок 4А). Это может быть связано с пространствами, присутствующими внутри биопленки, поскольку 18 ч S. aureus биопленка, выращенная в MEMα с 2% глюкозой, неравномерно не покрывает поверхность (рисунок 4B). Тем не менее, использование других исследований богатых сред показало однородный газон роста биопленки S. aureus и лейкоцитов, проникающих через биопленку30,58. Кроме того, также наблюдается гибель клеток нейтрофилов после 30 мин инкубации с биопленками S. aureus из-за лейкоцидинов, продуцируемых биопленкой S. aureus, которые лизируют нейтрофилы58 (рисунок 4A,D). Добавление промывочного этапа для удаления неприлипших нейтрофилов после инкубации их биопленкой в течение 30 мин удаляло ~15% мертвых нейтрофилов из системы по сравнению с немытой группой, в которой микроскопию проводили сразу после 30 мин инкубации (рисунок 4D). Также наблюдались нейтрофилы, взаимодействующие с S. aureus (рисунок 4C). Необходимы дальнейшие эксперименты, чтобы оценить, поглощен ли S. aureus нейтрофилами или прикреплен к клеточной поверхности нейтрофилов54. Визуализация нейтрофилов и биопленок является первым шагом для оценки нескольких функциональных возможностей нейтрофилов, таких как фагоцитоз и NETosis54,59. Влияние нейтрофилов на биопленки также может быть оценено путем количественной оценки биомассы биопленки, структурных изменений биопленки и жизнеспособности биопленки, среди многих других, с использованием инструментов анализа изображений, перечисленных на этапе 5.6. Наконец, изменчивость от донора к донору существует в нейтрофилах; таким образом, рекомендуется использовать по крайней мере трех различных доноров для исследований с участием нейтрофилов.
В целом, стандартизированные анализы in vitro были объединены для оценки взаимодействия между нейтрофилами и биопленками. Хотя эти анализы используют S. aureus, описанные протоколы могут быть легко адаптированы для изучения других патогенов. Хотя существуют различные модели in vivo для изучения взаимодействий хозяина и патогена, они могут быть дорогостоящими и трудоемкими, особенно если условия не оптимизированы. Работа со стандартизированными анализами in vitro позволяет оптимизировать экспериментальные условия и подтвердить наблюдения перед переходом на систему in vivo. Наконец, различные модели инфекции животных были использованы для изучения взаимодействий биопленки и нейтрофилов in vivo. Тем не менее, важно учитывать иммунологические различия между человеческими и животными моделями 60,61,62,63. Это требует использования нейтрофилов, полученных от людей, для изучения этих сложных взаимодействий хозяин-патоген.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа финансировалась Национальным институтом аллергии и инфекционных заболеваний (R01AI077628) для DJW и премией Американской кардиологической ассоциации за развитие карьеры (19CDA34630005) для ESG. Мы благодарим д-ра Пола Стэндли за предоставление нам штамма США 300 LAC GFP. Кроме того, мы признаем ресурсы из Центра микроскопии и визуализации кампуса (CMIF) и Комплексного онкологического центра OSU (OSUCCC) Microscopy Shared Resource (MSR), Университета штата Огайо. Мы также благодарим Амелию Стаатс, Питера Бербэка и Лизу Коулман из лаборатории Стэндли за проведение забора крови.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% sodium chloride irrigation, USP | Baxter | 2F7124 | Endotoxin-free; Used for isolation of neutrophils |
| 150 mL rapid-flow filter unit | Thermo Scientific | 565-0020 | |
| 200 proof ethanol | VWR | 89125-188 | |
| 3 mL syringe | BD | 309657 | Used for blood draw |
| 50 mL conical centrifuge tubes | Thermo Scientific | 339652 | |
| 60 mL syringe | BD | 309653 | Used for blood draw |
| Agar | Fisher Bioreagents | BP1423-2 | |
| Alcohol swab | BD | Used for blood draw | |
| Band-aids | Used for blood draw | ||
| BD Bacto Tryptic Soy Broth | BD | DF0370-07-5 | Combine with 1.5% agar to make Tryptic Soy Agar |
| Cell counter | Bal Saupply | 202C | |
| CellTracker blue CMCH | Invitrogen | C2111 | Blue CMAC Dye (BCD) |
| Clear bottom 96-well flat bottom polystyrene plates | Costar | 3370 | |
| Cotton gauze | Fisherbrand | 13-761-52 | Used for blood draw |
| Crystal violet | Acros Organic | 40583-0250 | |
| Culture tubes | Fisherbrand | 14-961-27 | Borosilicate Glass 13 x 100 mm |
| D-(+)-glucose | Sigma | G-8270 | |
| Dextran from Leuconostoc spp. | Sigma | 31392-250G | Used for isolation of neutrophils |
| Dulbecco's phosphate buffered saline (DPBS) 1x | Gibco | 14190-144 | |
| Ethidium homodimer-1 | Invitrogen | L3224 B | |
| Ficoll-Paque plus | Cytiva | 17144003 | Used for isolation of neutrophils (density gradient medium) |
| Hanks' balanced salt solution (HBSS) 1x | Corning cellgro | 21-022-CV | without calcium, magnesium, and phenol red |
| Hemacytometer | Bright Line | ||
| Heparin | Novaplus | NDC 63323-540-57 | 1000 USP units/mL, Used for blood draw |
| IMARIS 9.8 | Oxford Instruments | Microscopy image analysis software | |
| Luminol | Sigma | A8511-5G | |
| Minimal essential media (MEM) Alpha 1x | Gibco | 41061-029 | |
| Needle (23 G1) | BD | 305145 | Used for blood draw |
| Nikon Eclipse Ti2 | Nikon | ||
| NIS-Elements | Nikon | Quantification of dead neutrophils | |
| Normal human serum | Complement Technology | NHS | |
| Petri Dish (100 x 15 mm) | VWR | 25384-342 | |
| Phorbol 12-myristate 13-acetate | |||
| Poly-L-lysine solution | Sigma | P4707-50ML | |
| Sodium chloride | Fisher Bioreagents | BP358-10 | Used for neutrophil isolation |
| SoftMax Pro Software | Molecular Devices | Microplate reader software used for data acquisition | |
| SpectraMax i3x | Molecular Devices | Microplate reader | |
| Sterile water for irrigation, USP | Baxter | 2F7114 | Endotoxin-free; Used for neutrophil isolation |
| Surflo winged infusion set | Terumo | SC*19BLK | 19 G x 3/4", used for blood draw |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Turnicate | Used for blood draw | ||
| UltraPure distilled water | Invitrogen | 10977015 | |
| White opaque 96-well plates | Falcon | 353296 | Tissue culture treated and flat bottom plate |
| μ-Slide VI 0.4 | Ibidi | 80601 | μ-channel slide |
Ссылки
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerging Infectious Diseases. 8 (9), 881-890 (2002).
- Alhede, M., et al. Phenotypes of non-attached Pseudomonas aeruginosa aggregates resemble surface attached biofilm. PLoS One. 6 (11), 27943(2011).
- Hall-Stoodley, L., Costerton, J. W., Stoodley, P. Bacterial biofilms: from the natural environment to infectious diseases. Nature Reviews: Microbiology. 2 (2), 95-108 (2004).
- Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clinical Microbiology Reviews. 15 (2), 167-193 (2002).
- Schilcher, K., Horswill, A. R. Staphylococcal biofilm development: structure, regulation, and treatment strategies. Microbiology and Molecular Biology Reviews. 84 (3), 0002(2020).
- Kaplan, J. B. Biofilm dispersal: mechanisms, clinical implications, and potential therapeutic uses. Journal of Dental Research. 89 (3), 205-218 (2010).
- Otto, M. Staphylococcal Biofilms. Microbiology Spectrum. 6 (4), 10(2018).
- Moormeier, D. E., Bayles, K. W. Staphylococcus aureus biofilm: a complex developmental organism. Molecular Microbiology. 104 (3), 365-376 (2017).
- Gross, M., Cramton, S. E., Gotz, F., Peschel, A. Key role of teichoic acid net charge in Staphylococcus aureus colonization of artificial surfaces. Infection and Immunity. 69 (5), 3423-3426 (2001).
- Zheng, Y., He, L., Asiamah, T. K., Otto, M. Colonization of medical devices by staphylococci. Environmental Microbiology. 20 (9), 3141-3153 (2018).
- Donlan, R. M. Biofilms and device-associated infections. Emerging Infectious Diseases. 7 (2), 277-281 (2001).
- Kolaczkowska, E., Kubes, P. Neutrophil recruitment and function in health and inflammation. Nature Reviews Immunology. 13 (3), 159-175 (2013).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annual Review of Immunology. 30, 459-489 (2012).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- van Kessel, K. P., Bestebroer, J., van Strijp, J. A. Neutrophil-mediated phagocytosis of Staphylococcus aureus. Frontiers in Immunology. 5, 467(2014).
- Nguyen, G. T., Green, E. R., Mecsas, J. Neutrophils to the ROScue: Mechanisms of NADPH oxidase activation and bacterial resistance. Frontiers in Cellular and Infection Microbiology. 7, 373(2017).
- Saini, R., Singh, S. Inducible nitric oxide synthase: An asset to neutrophils. Journal of Leukocyte Biology. 105 (1), 49-61 (2019).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Segal, A. W. The function of the NADPH oxidase of phagocytes and its relationship to other NOXs in plants, invertebrates, and mammals. The International Journal of Biochemistry and Cell Biology. 40 (4), 604-618 (2008).
- Fang, F. C. Antimicrobial reactive oxygen and nitrogen species: concepts and controversies. Nature Reviews Microbiology. 2 (10), 820-832 (2004).
- Bogdan, C. Nitric oxide and the immune response. Nature Immunology. 2 (10), 907-916 (2001).
- Chua, S. L., et al. Reactive oxygen species drive evolution of pro-biofilm variants in pathogens by modulating cyclic-di-GMP levels. Open Biology. 6 (11), 160162(2016).
- El Haj, C., Lichtenberg, M., Nielsen, K. L., Bjarnsholt, T., Jensen, P. O. Catalase protects biofilm of Staphylococcus aureus against daptomycin activity. Antibiotics. 10 (5), 511(2021).
- Ghimire, N., et al. Direct microscopic observation of human neutrophil-Staphylococcus aureus interaction in vitro suggests a potential mechanism for initiation of biofilm infection on an implanted medical device. Infection and Immunity. 87 (12), 00745(2019).
- Bhattacharya, M., et al. Leukocidins and the nuclease nuc prevent neutrophil-mediated killing of Staphylococcus aureus biofilms. Infection and Immunity. 88 (10), 00372(2020).
- Bogachev, M. I., et al. Fast and simple tool for the quantification of biofilm-embedded cells sub-populations from fluorescent microscopic images. PLoS One. 13 (5), 0193267(2018).
- Kerstens, M., et al. A flow cytometric approach to quantify biofilms. Folia Microbiologica. 60 (4), 335-342 (2015).
- Meyle, E., et al. Destruction of bacterial biofilms by polymorphonuclear neutrophils: relative contribution of phagocytosis, DNA release, and degranulation. The International Journal of Artificial Organs. 33 (9), 608-620 (2010).
- Oveisi, M., et al. Novel assay to characterize neutrophil responses to oral biofilms. Infection and Immunity. 87 (2), 00790(2019).
- Leid, J. G., Shirtliff, M. E., Costerton, J. W., Stoodley, P. Human leukocytes adhere to, penetrate, and respond to Staphylococcus aureus biofilms. Infection and Immunity. 70 (11), 6339-6345 (2002).
- Fey, P. D., et al. A genetic resource for rapid and comprehensive phenotype screening of nonessential Staphylococcus aureus genes. mBio. 4 (1), 00537(2013).
- Cody, W. L., et al. Skim milk enhances the preservation of thawed -80 degrees C bacterial stocks. Journal of Microbiological Methods. 75 (1), 135-138 (2008).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. 63, 3064(2012).
- Freitas, M., Porto, G., Lima, J. L., Fernandes, E. Optimization of experimental settings for the analysis of human neutrophils oxidative burst in vitro. Talanta. 78 (4-5), 1476-1483 (2009).
- Merritt, J. H., Kadouri, D. E., O'Toole, G. A. Growing and analyzing static biofilms. Current Protocols in Microbiology. , Chapter 1 Unit 1B 1 (2005).
- Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. 412, 15-20 (2007).
- Zhou, L., et al. Impact of human granulocyte and monocyte isolation procedures on functional studies. Clinical and Vaccine Immunology. 19 (7), 1065-1074 (2012).
- Quach, A., Ferrante, A. The application of dextran sedimentation as an initial step in neutrophil purification promotes their stimulation, due to the presence of monocytes. Journal of Immunology Research. 2017, 1254792(2017).
- Karlsson, A., Nixon, J. B., McPhail, L. C. Phorbol myristate acetate induces neutrophil NADPH-oxidase activity by two separate signal transduction pathways: dependent or independent of phosphatidylinositol 3-kinase. Journal of Leukocyte Biology. 67 (3), 396-404 (2000).
- Staats, A., et al. Rapid aggregation of Staphylococcus aureus in synovial fluid is influenced by synovial fluid concentration, viscosity, and fluid dynamics, with evidence of polymer bridging. mBio. , 0023622(2022).
- Chiu, I. M., et al. Bacteria activate sensory neurons that modulate pain and inflammation. Nature. 501 (7465), 52-57 (2013).
- Hartig, S. M. Basic image analysis and manipulation in ImageJ. Current Protocols in Molecular Biology. 102 (1), 14-15 (2013).
- Heydorn, A., et al. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146 (10), 2395-2407 (2000).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Luo, T. L., et al. Introducing BAIT (Biofilm Architecture Inference Tool): a software program to evaluate the architecture of oral multi-species biofilms. Microbiology. 165 (5), 527-537 (2019).
- Naves, P., et al. Measurement of biofilm formation by clinical isolates of Escherichia coli is method-dependent. Journal of Applied Microbiology. 105 (2), 585-590 (2008).
- Eze, E. C., El Zowalaty, M. E. Combined effects of low incubation temperature, minimal growth medium, and low hydrodynamics optimize Acinetobacter baumannii biofilm formation. Infection and Drug Resistance. 12, 3523-3536 (2019).
- Harris, L. G., Tosatti, S., Wieland, M., Textor, M., Richards, R. G. Staphylococcus aureus adhesion to titanium oxide surfaces coated with non-functionalized and peptide-functionalized poly(L-lysine)-grafted-poly(ethylene glycol) copolymers. Biomaterials. 25 (18), 4135-4148 (2004).
- Miao, J., et al. Biofilm formation of Staphylococcus aureus under food heat processing conditions: first report on cml production within biofilm. Scientific Reports. 9 (1), 1312(2019).
- Lade, H., et al. Biofilm formation by Staphylococcus aureus clinical isolates is differentially affected by glucose and sodium chloride supplemented culture media. Journal of Clinical Medicine. 8 (11), 1853(2019).
- Guzel Kaya, G., et al. Antibacterial activity of linezolid against gram-negative bacteria: utilization of epsilon-Poly-l-Lysine capped silica xerogel as an activating carrier. Pharmaceutics. 12 (11), 1126(2020).
- Clinton, A., Carter, T. Chronic wound biofilms: pathogenesis and potential therapies. Laboratory Medicine. 46 (4), 277-284 (2015).
- Scheel-Toellner, D., et al. Reactive oxygen species limit neutrophil life span by activating death receptor signaling. Blood. 104 (8), 2557-2564 (2004).
- Pestrak, M. J., et al. Pseudomonas aeruginosa rugose small-colony variants evade host clearance, are hyper-inflammatory, and persist in multiple host environments. PLoS Pathogens. 14 (2), 1006842(2018).
- Guerra, F. E., et al. Staphylococcus aureus SaeR/S-regulated factors reduce human neutrophil reactive oxygen species production. Journal of Leukocyte Biology. 100 (5), 1005-1010 (2016).
- Suo, Y., Huang, Y., Liu, Y., Shi, C., Shi, X. The expression of superoxide dismutase (SOD) and a putative ABC transporter permease is inversely correlated during biofilm formation in Listeria monocytogenes 4b G. PLoS One. 7 (10), 48467(2012).
- Olwal, C. O., Ang'ienda, P. O., Ochiel, D. O. Alternative sigma factor B (sigma(B)) and catalase enzyme contribute to Staphylococcus epidermidis biofilm's tolerance against physico-chemical disinfection. Scientific Reports. 9 (1), 5355(2019).
- Bhattacharya, M., et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing. Proceedings of the National Academy of Sciences of the United States of America. 115 (28), 7416-7421 (2018).
- Masuda, S., et al. NETosis markers: Quest for specific, objective, and quantitative markers. Clinica Chimica Acta. 459, 89-93 (2016).
- Dworsky, E. M., et al. Novel in vivo mouse model of implant related spine infection. Journal of Orthopaedic Research. 35 (1), 193-199 (2017).
- Pletzer, D., Mansour, S. C., Wuerth, K., Rahanjam, N., Hancock, R. E. New mouse model for chronic infections by gram-negative bacteria enabling the study of anti-infective efficacy and host-microbe interactions. mBio. 8 (1), 00140(2017).
- Davis, M. M. A prescription for human immunology. Immunity. 29 (6), 835-838 (2008).
- Mestas, J., Hughes, C. C. Of mice and not men: differences between mouse and human immunology. The Journal of Immunology. 172 (5), 2731-2738 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены