Method Article
İnsan Nötrofiller ve Staphylococcus aureus Biyofilmleri Arasındaki Etkileşimleri Görselleştirmek ve Ölçmek için Standartlaştırılmış In vitro Testler
Bu Makalede
Özet
Mevcut protokol, nötrofil-biyofilm etkileşimlerinin incelenmesini açıklamaktadır. Staphylococcus aureus biyofilmleri in vitro olarak kurulur ve periferik kan kaynaklı insan nötrofilleri ile inkübe edilir. Nötrofillerden oksidatif patlama tepkisi ölçülür ve biyofilm içindeki nötrofil lokalizasyonu mikroskopi ile belirlenir.
Özet
Nötrofiller, mikrobiyal enfeksiyon sırasında bağışıklık sistemi tarafından kullanılan ilk savunma hattıdır. İn vivo, nötrofiller, fagositoz, reaktif oksijen ve azot türlerinin üretimi (sırasıyla ROS, RNS), NETosis (nötrofil hücre dışı tuzağı) ve mikropları öldürmek ve enfeksiyonu çözmek için degranülasyon gibi süreçleri kullandıkları enfeksiyon bölgesine alınır. Nötrofiller ve planktonik mikroplar arasındaki etkileşimler kapsamlı bir şekilde incelenmiştir. Son yıllarda biyofilmlerin neden olduğu enfeksiyonları incelemek için ortaya çıkan ilgi alanları olmuştur. Biyofilmler, planktonik olarak yetiştirilen muadillerinden farklı olarak, nötrofiller tarafından öldürülmeye tolerans da dahil olmak üzere özellikler sergiler. Hem in vitro hem de in vivo biyofilm modellerinin başarılı bir şekilde kurulmasıyla, bu mikrobiyal topluluklar ile farklı bağışıklık hücreleri arasındaki etkileşimler artık araştırılabilir. Burada, geleneksel biyofilm modellerinin ve köklü nötrofil aktivite testlerinin bir kombinasyonunu kullanan teknikler, nötrofil ve biyofilm etkileşimlerini incelemek için özel olarak uyarlanmıştır. Geniş alan floresan mikroskopisi, biyofilmlerdeki nötrofillerin lokalizasyonunu izlemek için kullanılır. Bu biyofilmler statik koşullarda yetiştirilir, ardından insan periferik kanından elde edilen nötrofillerin eklenmesiyle takip edilir. Numuneler mikroskop altında görselleştirilmeden önce uygun boyalarla boyanır. Ek olarak, patojenlere karşı birçok nötrofil yanıtından biri olan ROS'un üretimi, bir biyofilm varlığında ölçülür. Bu yerleşik sisteme bağışıklık hücrelerinin eklenmesi, konakçı-patojen etkileşimlerinin anlaşılmasını genişletirken, bu süreçleri doğru bir şekilde ölçmek için standartlaştırılmış ve optimize edilmiş koşulların kullanılmasını sağlayacaktır.
Giriş
Bir biyofilm, hücre dışı bir polimerik madde (EPS) 1,2 içine yerleştirilmiş yüzeyle ilişkili mikropların veya bağlı olmayan agregaların bir topluluğudur. Bu topluluklar, antimikrobiyal ajanlara ve bağışıklık sistemine tolerans da dahil olmak üzere çevresel stres faktörlerinden korunan mikroorganizmaları korur3. Birkaç patojenik mikrobiyal tür, kronik enfeksiyonlarla ilişkili biyofilmler oluşturur4. Biyofilmlerin gelişimi, yüzeylere bağlanma, EPS üretimi, hücre proliferasyonu, biyofilm yapılandırması ve hücre ayrılması5'i içeren karmaşık bir süreçtir. Hücreler bir biyofilm oluşturmak için dağıldıklarında, planktonik kalırlar veya yeni bir substrata dönüşürler ve biyofilm gelişimini yeniden başlatırlar6.
Fırsatçı bir patojen olan Staphylococcus aureus, bağlanma, proliferasyon, olgunlaşma ve dağılım7 dahil olmak üzere genel bir biyofilm gelişim şemasını izler. S. aureus biyofilmlerindeki bağlanma süreci, hidrofobik etkileşimler, teikoik asitler ve yapışkan matris moleküllerini (MSCRAMM'ler) tanıyan mikrobiyal yüzey bileşenleri tarafından belirlenir8,9. S. aureus'un proliferasyonu başladığında, esas olarak polisakkaritler, proteinler, hücre dışı DNA ve teikoik asitlerden oluşan EPSüretilir 5. EPS bileşenleri üretilirken, biyofilm 3 boyutlu yapıya katkıda bulunan ve ayrılmaya yardımcı olan çeşitli ekzoenzimler ve küçük moleküller de üretilir5. S. aureus, tıbbi cihazların yerleşmesine bağlı enfeksiyonlar da dahil olmak üzere çeşitli kronik enfeksiyonlar oluşturmak için bu son derece koordineli yaşam tarzından yararlanır10.
Metisiline dirençli S. aureus (MRSA), santral venöz ve üriner kateterler, protez eklemler, kalp pilleri, mekanik kalp kapakçıkları ve rahim içi cihazlar gibi yerleşik tıbbi cihazlarla ilgili enfeksiyonların önde gelen nedenlerinden biridir11. Bu tür enfeksiyonlar sırasında, nötrofiller , çoklu stratejilerle patojenlerle savaşmak için enfeksiyon bölgesine alınan ilk konakçı bağışıklık hücreleridir12. Bunlar arasında fagositoz, degranülasyon, reaktif oksijen ve azot türlerinin (ROS / RNS) üretimi veya patojenleri ortadan kaldırmak için nötrofil hücre dışı tuzakların (NET'ler) salınması13.
Mikropların fagositozu üzerine ROS üretimi, nötrofiller tarafından sergilenen anahtar antimikrobiyal yanıtlardan biridir14. Fagositoz, mikroplar opsoninlerle, özellikle immünoglobulinlerle ve serum15'te bulunan kompleman bileşenleriyle kaplanırsa artar. Opsonize mikroplar daha sonra nötrofiller üzerindeki hücre yüzey reseptörleri tarafından tanınır ve fagozom15 adı verilen bir bölme oluşturarak yutulur. Nötrofiller, membranla ilişkili NADPH-oksidaz16 aracılığıyla fagozomda ROS üretir ve serbest bırakır. Bu çok bileşenli enzim kompleksi, elektronları moleküler oksijene aktararak süperoksit anyonları üretir16. Ek olarak, nötrofiller ayrıca indüklenebilir nitrik oksit sentaz (iNOS) 17 ekspresyonu yoluyla RNS üretir. Fagozom içindeki bu yüksek süperoksit ve nitrik oksit radikalleri geniş antimikrobiyal aktivitelere sahiptir. Enzimlerdeki metal merkezlerle etkileşime girebilir ve patojenin nükleik asitlerine, proteinlerine ve hücre zarlarına zarar verebilirler 18,19,20,21. Çok sayıda mikrop biyofilm yaşam tarzını benimser ve ROS22,23 tarafından öldürülmekten kaçınmak için farklı stratejiler kullanır. Bu nedenle, ROS'u ölçmek için nötrofiller ile çift biyofilmlerin standartlaştırılmış tahlilleri, tutarlı sonuçlar için faydalıdır.
Nötrofil ROS üretimini ölçmek gibi tahliller, nötrofillerin biyofilmlere tepkileri hakkında bilgi sağlarken, nötrofillerin bir biyofilm içindeki etkileşimlerini görselleştirme yeteneği de güçlü bir araç olarak hizmet edebilir. Mikroskopi için floresan boyaların kullanımı genellikle mikroskopi görüntüleme analizi için kullanılabilecek yüksek kaliteli görüntüler elde etmek için optimizasyon gerektirir. Bazı koşulları optimize etme esnekliği sınırlıdır, çünkü nötrofiller izolasyon sonrası hücre ölümüne maruz kalabilir. Ayrıca, biyofilmler tipik olarak, nötrofillerin eklenmesinden önce planktonik popülasyonu deney düzeneğinden çıkarmak için yıkanır. Yıkama sırasında, biyofilmler yüzeye gevşek bir şekilde yapışırsa, kısmi biyokütle kaybına bağlı olarak replika biyofilmler arasındaki değişkenlik ortaya çıkabilir.
Genel olarak, nötrofiller ve biyofilmler arasındaki etkileşimleri analiz etmek için alandaki mevcut yöntemler esas olarak mikroskopi, akış sitometrisi ve koloni oluşturan birimler (CFU) numaralandırma 24,25,26,27'yi içerir. Mikroskopi, nötrofilleri ve biyofilmleri doğrudan boyayan veya NET oluşumu, degranülasyon ve hücre ölümü gibi mikroplara karşı çeşitli nötrofil tepkilerini hedefleyen boyaların kullanımını içerir25,28. Nötrofil hücre ölümü ve degranülasyon gibi bu yanıtların bir alt kümesi, akış sitometrisi ile de analiz edilebilir, ancak nötrofillerin bir biyofilm28,29'daki büyük mikrop agregalarıyla tercihen ilişkisiz olmasını gerektirir. Akış sitometrisi, hücre canlılığı27 gibi bazı biyofilm parametrelerini de ölçebilir. Bununla birlikte, bu süreçler biyofilm biyokütlesinin bozulmasını gerektirir ve nötrofillerin ve bileşenlerinin bir biyofilm 27,29,30 içindeki uzamsal dağılımı gibi diğer önemli etkileşimleri görselleştirmek için yararlı olmayacaktır.
Mevcut protokol, kullanım sırasında minimum değişkenlik sağlamak için optimize edilmiş biyofilmler üzerindeki nötrofil-biyofilm etkileşimlerini incelemek için geleneksel olarak kullanılan yöntemlerden bazılarının uyarlanmasına odaklanmaktadır. Bu protokol böylece biyofilmleri büyütmek ve ölçmek, birincil insan nötrofillerini periferik kandan izole etmek, ROS üretimini ölçmek ve mikroskopi yoluyla biyofilm-nötrofil etkileşimlerini görselleştirmek için standartlaştırılmış yöntemler sağlar. Bu protokol, donör havuzları arasındaki heterojenliği göz önünde bulundururken biyofilm-nötrofil etkileşimlerini anlamak için farklı sistemlere uyarlanabilir.
Protokol
Tüm prosedürler Ohio State Üniversitesi Kurumsal İnceleme Kurulu (IRB) (2014H0154) tarafından onaylanmıştır. Primer insan nötrofillerini izole etmek için periferik kan toplamak için tüm donörlerden bilgilendirilmiş yazılı onam alındı. Staphylococcus aureus (USA300 LAC)31 , deneylerin gerçekleştirilmesinde model organizma olarak kullanılmıştır. Deneyler, kan yoluyla bulaşan bir patojene potansiyel maruz kalma nedeniyle uygun kişisel koruyucu ekipman (KKD) ile gerçekleştirildi.
1. İn vitro biyofilm hazırlanması
- Triptik Soya Agar gibi besin açısından zengin bir agar plakası üzerinde çizgi plaka tekniği32,33 kullanarak kriyokorunmuş bir stoktan izole edilmiş S. aureus kolonileri elde edin31 (bkz.
- 96 delikli bir plakanın ayrı ayrı kuyularını, sterilH2O içinde seyreltilmiş 100 μL %0,001 (v/v) poli-L-Lizin (PLL) ile kaplayın ve 30 dakika boyunca oda sıcaklığında inkübe edin. Aseptik olarak, vakum yardımlı bir aspirasyon tuzağı kullanarak PLL çözeltisini aspire edin. Kuyuların gece boyunca oda sıcaklığında kurumasını bekleyin.
NOT: Protokoldeki tüm aspirasyon adımları, aksi belirtilmedikçe vakum yardımlı aspirasyon tuzağı kullanılarak gerçekleştirilir. - % 2 glikoz ile desteklenmiş minimal esansiyel media alfada (MEMα) bir S. aureus kolonisini aşılayarak bir gecelik kültür hazırlayın ve 37 ° C'de inkübe edin, 16-18 saat boyunca 200 rpm'de çalkalayın.
- % 2 glikoz ile desteklenmiş 50 μL ila 5 mL taze MEMα aktararak gece kültürünü seyreltin ve 37 ° C'de inkübe edin, 200 rpm'de sallayın, orta logaritmik faza kadar, genellikle 0.5-0.8 optik yoğunluk 600 (OD600nm) arasında. Orta logaritmik kültürü OD600nm'lik 0,1'e normalleştirmek için MEMα kullanın.
- 150 μL normalleştirilmiş kültürü, PLL işlenmiş 96 kuyucuklu plakanın her bir kuyucuğuna aktarın. 37 °C'de nemlendirilmiş bir odada 18-20 saat boyunca statik olarak inkübe edin.
NOT: Biyofilmler, μ kanallı slaytlar gibi diğer formatlarda da yetiştirilebilir (bkz. - Planktonik hücreleri çıkarmak için süpernatantı aspire edin. Bağlanmamış hücreleri çıkarmak için kalan biyokütleyi 150 μL Hanks Dengeli Tuz Çözeltisi (HBSS) ile nazikçe yıkayın. Biyofilmi bozmamak için HBSS'yi damla damla ekleyin.
NOT: Yıkamalar sırasında süpernatant ve HBSS'yi aspire ederken, biyofilm içeren kuyucuklarda biyofilm hala daldırılmış olacak şekilde yeterli miktarda sıvı (süpernatant veya HBSS) bırakın. Bu, biyofilmi yıkamak için HBSS damla damla eklendiğinde biyofilm yapısının bozulmasını önler. - Tüm planktonik hücreleri çıkarmak için adım 1.6'yı en az iki kez daha tekrarlayın. Bu noktada, biyofilmler hemen aşağı akış deneyleri için hazırdır.
NOT: Biyofilmler nötrofil deneyleri için kullanılmazsa, HBSS fosfat tamponlu salin (PBS) ile değiştirilebilir. HBSS, nötrofil aktivasyonu için optimum koşullar sağlayan glikoz da dahil olmak üzere bileşenler içerdiğinden HBSS yerine tercih edilir34.
2. Biyofilm biyokütlesinin nicelleştirilmesi
- % 20 (v / v) etanol ve% 80 (v / v) H2O'da çözünerek% 0.1 (w / v) Kristal Menekşe (CV) çözeltisi (Malzeme Tablosuna bakınız) bir stok hazırlayın.
- Yıkanmış biyofilme 150 μL% 0.1 CV çözeltisi ekleyin ve oda sıcaklığında 20 dakika boyunca inkübe edin. Yalnızca medya denetimleri olarak en az üç boş kuyu kullanın.
- Biyofilmlerden% 0.1 CV çözeltisini aspire edin ve lekeli biyofilmleri 200 μL 1x PBS ile yıkayın. Fazla CV'yi kuyulardan çıkarmak için toplam üç yıkama için bu işlemi tekrarlayın.
- H2O ile seyreltilmiş 150 μL % 33 (v / v) buzul asetik asit ekleyin. biyokütleye bağlı CV'nin tamamen çözünmesini sağlamak için 30 dakika boyunca 50 rpm'de bir rocker üzerinde oda sıcaklığında inkübe edin.
DİKKAT: Bu adımı, buzul asetik asit aşındırıcı bir kimyasal olduğundan, uygun KKD'li laminer bir akış başlığında gerçekleştirin. - Bu arada, CV leke değerlerini okumak için mikro plaka okuyucuyu ayarlayın (bkz. Buzul asetik asit tedavisini takiben, plakayı 595 nm dalga boyunda okuyun.
NOT: CV'nin OD'sini ölçmek için kullanılan dalga boyu 500-600 nm35 arasında değişebilir.
3. Nötrofil izolasyonu
NOT: Nötrofiller, daha önce yayınlanmış bir yöntem izlenerek küçük değişikliklerle izole edildi36. Bu izolasyon protokolü önce yoğunluk gradyanı santrifüjlemeyi, ardından %3 dekstran çökeltmesini birleştirir. Bu bölüm yalnızca yayınlanan protokolde yapılan değişikliklere odaklanarak genel nötrofil izolasyon protokolünü kapsamaktadır. Ayrıca, aşağıda özetlenen protokol, nötrofilleri izole edebilen ve gerektiğinde değiştirilebilen birçok yöntemden biridir. Nötrofillerin izole edilmesi için diğer yöntemler, hücre ayırma ortamının veya manyetik antikor hücre ayırma37'nin kullanımını içerir.
- Kurumsal IRB'de belirtilen protokole göre, yetişkin bir donörden venipunktur yoluyla kan alın. Kan alımından önce, şırınganın yeterli koruyucu içermeyen heparine sahip olduğundan emin olun, böylece son heparin konsantrasyonu 20 U / mL'dir.
- Heparinize olmuş kanı oda sıcaklığındaH2O'da endotoksin içermeyen% 0.9 NaCl hacminin 3/4'ü ile seyreltin (bakınız Malzeme Tablosu).
- Seyreltilmiş kan örneğinin her 20 mL'si için, taze bir 50 mL konik tüpte ticari olarak temin edilebilen bir yoğunluk gradyanı ortamının 14 mL'sini (bkz. Seyreltilmiş kan örneğini yoğunluk gradyanı ortamının üzerine dikkatlice katlayın.
- Katmanlı kan örneğini oda sıcaklığında 40 dakika boyunca 400 x g'de santrifüj yapın. Santrifüjleme tamamlandıktan sonra tabakayı rahatsız etmemek için santrifüjün yavaş bir mola verdiğinden emin olun.
NOT: Kan örneği, bir salin ve plazma karışımı, bir mononükleer hücre tabakası, yoğunluk gradyan ortamı, nötrofiller ve eritrositler içeren beş katmana sahip olacaktır. - Serolojik bir pipet kullanarak, nötrofillerin ve eritrosit peletinin üzerindeki tüm katmanları aspire edin, ardındanH2O'da soğuk endotoksin içermeyen% 0.9 NaCl'de peletin nazik bir şekilde yeniden süspansiyonu yapılır. 20 mL'lik bir kan örneğinden üretilen her pelet için, peleti toplam 20 mL hacme geri askıya alın. %3 dekstran 1:1 hacim ekleyin (bkz. Tüpü buz üzerinde 18-20 dakika dik olarak inkübe edin.
NOT: %3 dekstranınH2O'da endotoksin içermeyen% 0.9 NaCl ile yapıldığından emin olun. - Nötrofiller ve bazı eritrositler içeren üst tabakanın 20 mL'sini yeni bir 50 mL konik tüp üzerine çıkarın ve 4 ° C'de 10 dakika boyunca 355 x g'de santrifüj yapın. Süpernatantı kırmızı bir pelet bırakarak dökün.
- Kalan eritrositleri lize etmek için peleti 10 mL soğuk, sterilH2O'da 30 s boyunca nazikçe askıya alın. Tonisiteyi geri kazanmak için karışıma hemen 10 mL soğuk endotoksin içermeyen% 0.9 salin ekleyin. Çözeltiyi 4 °C'de 3 dakika boyunca 233 x g'de santrifüj yapın.
- Süpernatantı dökün ve% 95-97 nötrofil içeren peleti, kan örneğinin 20 mL'si başına 1 mL soğuk HBSS'de yeniden askıya alın.
- Yeniden askıya alınan nötrofillerin 10 μL'sini% 0.4 tripan mavisi dışlama boyasının 90 μL'sine aktarın ve bir hemositometre kullanarak hücreleri sayın (bkz.
NOT: Canlı olmayan hücreler, tripan mavisi dışlama boyası canlı hücrelerde geçirimsiz olduğu için maviye boyanır. Bu protokol %99 > hücre canlılığı sağlar37,38. - Nötrofillerin son konsantrasyonu 4 x 106 hücre / mL olacak şekilde ek HBSS ekleyin.
NOT: %<99 hücre canlılığına sahip örnekler için, 4 x 106 hücre/mL'lik nihai konsantrasyon hala elde edilebilir; Bununla birlikte, elde edilen 4 x 106 hücre/mL içeren çözeltinin toplam hacmi azalacaktır. Nötrofillerin nihai konsantrasyonu, kullanıcının deneysel ihtiyaçlarına göre ayarlanabilir. Nötrofiller, aşağıda açıklanan tüm deneyler için 4 x 106 hücre / mL nihai konsantrasyonda yeniden askıya alındı. Donörden donöre değişkenliği hesaba katmak için, nötrofiller ile ilgili tüm deneylerin en az üç farklı donör ile yapılması şiddetle tavsiye edilir.
4. Nötrofiller tarafından üretilen ROS'un ölçümü
- Yıkanmış biyofilme (adım 1.6) damla damla 100 μL% 20 normal insan serumu (HBSS'de seyreltilmiş) ekleyin ve biyofilmi opsonize etmek için 30 dakika boyunca statik koşullar altında 37 ° C'de inkübe edin.
- % 20 serum çözeltisini aspire edin ve biyofilmleri bir kez 150 μL HBSS ile damla damla yıkayın. HBSS'yi aspire edin, opsonize biyofilmlerle kuyuları geride bırakın.
NOT: Deneyin yorumlanması için en az dört grup önerilir: (A) Nötrofiller + Biyofilm, (B) Nötrofiller + PMA (pozitif kontrol, bakınız Malzeme Tablosu), (C) Yalnızca nötrofiller ve (D) Yalnızca Biyofilm. - HBSS'de 4 x 106 hücre/mL konsantrasyonunda yeniden askıya alınan nötrofillere, nihai luminol konsantrasyonu 50 μM olacak şekilde luminol ekleyin (bakınız Malzeme Tablosu). Bu çözüm (A) ve (C) grupları için kullanıma hazırdır. Opsonize biyofilmlerle kuyucuklara luminol ile karıştırılmış 4 x 105 nötrofil ekleyin.
- Ayrı bir tüpte, HBSS'de herhangi bir nötrofil olmadan 50 μM luminol çözeltisi hazırlayın ve bunu içeren biyofilm içeren kuyuya ekleyin (D grubu).
- Luminol ile karıştırılmış Aliquot 350 μL nötrofiller ve karışıma 500 ng / mL'lik son konsantrasyonda forbol 12-miristat 13-asetat (PMA) ekleyin. Grup (B) için, bu karışımdan 4 x 105 nötrofil biyofilmsiz kuyucuklara ekleyin. Bu olumlu bir kontrol görevi görür.
NOT: Bu adımda belirtilen PMA konsantrasyonu, PMA uyarılmış nötrofiller pozitif bir kontrol olduğundan, sağlam patlama tepkisi sağlamak için nispeten yüksektir. PMA, deneye bağlı olarak nötrofilleri aktive etmek için daha düşük bir konsantrasyonda kullanılabilir. - Plakayı 4 °C'de 30 s için 270 x g'de santrifüj yapın.
- Plaka okuyucunun, 3 dakikalık aralıklarla 60 dakika boyunca lüminesans ve kinetik okuma ayarıyla birlikte 37 °C'ye ayarlandığından emin olun. 60 dakika boyunca nötrofiller tarafından ROS üretimini ölçmek için plakayı plaka okuyucuya yerleştirin.
NOT: Bu test için, biyofilmler lüminesans testleri için kullanılan beyaz plakalarda yetiştirilmiştir. PMA, oksidatif patlama yanıtı39 için bilinen bir agonisttir. PMA içeren çalışmalar yaparken, PMA patlama tepkisini hemen başlattığından, nötrofil içeren çözelti soğukken PMA'nın son adımda eklendiğinden emin olun.
5. Biyofilm-nötrofil etkileşimlerinin görüntülenmesi
- 1.2-1.6 adımlarını kullanarak bir biyofilm oluşturun. Biyofilm görüntülemeyi kolaylaştırmak için, mikroskopi görüntülemenin kolaylığını artırmak için yeşil floresan proteini (GFP) 40,41'i ifade eden USA300 gibi bir floresan S. aureus suşu kullanın.
NOT: In vitro biyofilm modelini göstermek için 96 delikli bir plaka yerine 6 μ kanallı bir slayt (bkz. Malzeme Tablosu) kullanılmıştır (adım 1). - 4 x 106 hücre/mL nötrofilleri, 100 μM Mavi CMAC (7-amino-4-klorometilkumarin) Boya (BCD, bakınız Malzeme Tablosu) ile 37 °C'de bir rocker'da 30 dakika boyunca ve %5 CO2'de inkübe edin. Numunelerin karanlıkta inkübe edildiğinden emin olun ve kalan adımlar için ışığa maruz kalmayı sınırlayın.
- Fazla BCD'yi yıkamak için, nötrofilleri 5 dakika boyunca 270 x g'de santrifüj yapın ve süpernatanı aspire edin. Nötrofilleri taze HBSS'de yeniden askıya alın. Bu noktada, nötrofil ve bakteriyel ölümü izlemek için BCD boyalı nötrofillere 4 μM'lik son konsantrasyonda ethidyum homodimer-1 (bakınız Malzeme Tablosu) ekleyin.
- μ slaytlarda yetiştirilen S. aureus biyofilmine 150 μL nötrofil ekleyin, böylece nötrofil-bakteri oranı 1:30'dur (nötrofil: bakteri). μ kızaklarını nemlendirilmiş bir odada 30 dakika boyunca inkübe edin. Bakteriyel hücrelerin sayısı, 18 saatlik bir biyofilmin kaplanmasından elde edilen hücre sayımlarına dayanmaktadır.
- Nötrofil-biyofilm etkileşimini, floresan boyaların / proteinlerin uyarılmasına ve emisyon dalga boylarına karşılık gelen floresan kanalları kullanarak görüntüleyin.
NOT: Bu çalışmada BCD 353/466 nm, ethidium homodimer-1 528/617 nm ve GFP 395/509 nm'dir. Numunelerin fotobeyazlamasını önlemek için numunenin lazere veya ışığa maruz kalmasını sınırlayın. - Mikroskopi görüntü analiz yazılımını veya FIJI/ImageJ, COMSTAT2, BiofilmQ ve BAIT gibi programları kullanarak görüntüleri analiz edin, bunların yanı sıradaha birçok 42,43,44,45.
NOT: Lekelerle çalışırken, kullanılan boyaların özgüllüğünü göz önünde bulundurmak önemlidir. Bazı lekeler prokaryotik ve ökaryotik hücreler üzerinde çalışırken, diğerleri sadece bir tanesi üzerinde çalışır. Nötrofiller ve biyofilmler her iki hücre tipini de lekeleyebilen boyalar kullanılarak ayrı ayrı boyanırsa, çapraz lekelenmeyi önlemek için nötrofiller ve biyofilmleri birleştirmeden önce kalan boyaları yıkadığınızdan emin olun.
Sonuçlar
Bakteriyel biyofilmler yetiştirmek için kullanılan medya, nötrofillerin hayatta kalmasını etkiler. Nötrofil-biyofilm etkileşimlerini incelemek için nötrofillerin yaşayabilirliği üzerindeki tek başına ortamın etkisini azaltmak için farklı ortamlar test edilmiştir (Şekil 1). Triptik Soya Suyu gibi bakteriyel büyüme ortamları, nötrofillerin yaşayabilirliğini en aza indirir, öyle ki,% 60'ı 37 ° C'de 30 dakikalık bir kuluçka süresinden sonra% 5 CO2 ile canlı. MEMα gibi memeli hücre kültürü ortamı, nötrofillerin yaşayabilirliğini etkilemez ve S. aureus biyofilmlerinin büyümesini destekler. Aslında, minimal medya, diğer bakterilerde biyofilmlerin sağlam büyümesini teşvik eder46,47.
Planktonik hücreleri ortadan kaldırmak için biyokütleyi yıkadıktan sonra medyanın biyofilm büyümesi ve biyofilm biyokütle nicelleştirmesindeki değişkenlik üzerindeki etkisini değerlendirmek için, 18 saatlik bir S. aureus biyofilmi, poli-L-Lizin ile işlenmiş veya muamele edilmemiş kuyucuklarla 96 kuyucuklu bir plakada yetiştirildi. Besin açısından zengin (Triptik Soya Suyu (TSB)) ve minimal (MEMa) bir ortam olduğu gibi kullanıldı veya% 2 glikoz ile desteklendi. CV ile boyanmış biyofilm biyokütlesi, MEMa'da yetiştirilen S. aureus biyofilminin% 2 glikoz ile desteklendiğini, test edilen tüm ortamlar arasında en sağlam biyofilmi ürettiğini ortaya koymuştur (Şekil 2A). Ayrıca, MEMα +% 2 glikoz içeren PLL ön işlemden geçirilmiş kuyucuklarda yetiştirilen biyofilmler, MEMa + % 2 glikoz içeren PLL-işlenmemiş kuyucuklardaki biyofilmlerden daha az değişkenlik göstermiştir. Bu biyofilmler, CV testi35 ve biyokütle nicelemesi için biyofilmleri hassas bir şekilde kullandıktan sonra kaplandığında CFU / mL ile nicelemede daha az değişkenlik göstermiştir. Bu biyofilmler, biyofilmlerin 3 ayrı günde kaplanmasıyla gösterildiği gibi, ortalama olarak 1 x 108 CFU / mL içeriyordu (Şekil 2B). Bu sayı, nötrofil işlevsellik testleri için biyofilmlere eklenecek nötrofil sayısının belirlenmesinde yararlıdır.
Biyofilmlere yanıt olarak nötrofiller tarafından ROS üretimini ölçmek için, S. aureus biyofilmleri 96 kuyucuklu bir plakada 18-20 saat boyunca statik olarak yetiştirildi. Biyofilmler daha sonra opsonize edildi ve nötrofiller eklendi. ROS üretimi daha sonra 60 dakika boyunca ölçüldü (Şekil 3A). Eğrinin altındaki alan, nötrofiller tarafından toplam ROS üretimini ölçmek için kinetik eğriden hesaplanır. Kontrol olarak kullanılan PMA gibi bir agonist ile tedavi edilen nötrofiller, artmış bir ROS üretimi gösterir. Biyofilmlerin yokluğunda, PMA ile muamele edilen nötrofiller sağlam ROS üretimi gösterdi. S. aureus biyofilminin varlığında, PMA ile muamele edilen nötrofillerin genel ROS üretimi azalmıştır. PMA'nın yokluğunda, nötrofiller yalnızca biyofilm ile etkileşimlerine dayanır ve bu da üretilen ROS miktarını daha da azaltır (Şekil 3B).
Floresan mikroskobu kullanarak nötrofil-biyofilm etkileşimlerini görselleştirmek için, sırasıyla canlı hücrelerin sitoplazmasını ve ölü hücrelerin DNA'sını boyayan S. aureus, Blue CMAC boya ve ethidium homodimer-1'in GFP eksprese eden bir suşu kullanılmıştır. S. aureus biyofilmi, 6 μ kanallı bir slaytta 18 saat boyunca yetiştirildi. Mavi CMAC boya etiketli nötrofiller, yıkanmış biyofilmlere ethidyum homodimer-1 ile birlikte eklendi ve görüntülemeden önce% 5 CO2 ile 37 ° C'de 30 dakika boyunca inkübe edildi. Geniş alan floresan mikroskopisi, birçok nötrofilin S. aureus biyofilmlerinin yüzeyine lokalize olduğunu, birkaçının ise biyofilm içinde olduğunu ortaya koymuştur (Şekil 4A). Nötrofiller içindeki S. aureus hücreleri arasındaki etkileşim de belirgindi (Şekil 4C). Nötrofiller (camgöbeği) ile etkileşime giren S. aureus hücrelerinin çoğu ölü (macenta) iken, birkaçı canlı-ölü boyama ile belirlendiği gibi canlı (sarı) kaldı (Şekil 4C). Karşılaştırma için, GFP eksprese eden S. aureus biyofilmleri, biyofilm içindeki ölü S. aureus popülasyonunun bir kısmını ortaya çıkaran ethidium homodimer-1 ile boyandı (Şekil 4B). Ethidiyum homodimer-1 için pozitif olan canlı olmayan nötrofiller, S. aureus biyofilmleri ile inkübasyondan sonra analiz yazılımı (bakınız Malzeme Tablosu) kullanılarak ölçülmüştür. Nötrofillerin yaklaşık% 48'i, S. aureus biyofilmi ile inkübasyondan sonraki 30 dakika içinde zaten ölmüştü. Mikroskopi protokolünün optimizasyonu sırasında, yapışmamış nötrofillerin çıkarılması için 30 dakikalık inkübasyondan sonra biyofilm ve nötrofillerin yıkanmasının etkisi de değerlendirildi ve hala biyofilme bağlı ölü nötrofillerin yaklaşık% 33'ü ortaya çıkarıldı (Şekil 4D).
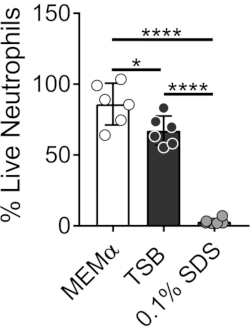
Şekil 1: LIVE-DEAD testi, bakteriyel ve memeli büyüme ortamları arasındaki nötrofil sağkalımını karşılaştırır. Nötrofiller izole edildi ve HBSS, MEMa, TSB veya% 0.1 SDS'de 30 dakika boyunca inkübe edildi. LIVE-DEAD boyaması Calcein (canlı) ve ethidyum homodimer-1 (ölü) kullanılarak gerçekleştirildi. HBSS ile inkübe edilmiş nötrofillerin% 100 canlı nötrofil olarak muamele gördüğü canlı nötrofillerin yüzdesi belirlendi. Sonuçlar, iki farklı donörden elde edilen nötrofiller ile üçlü olarak gerçekleştirilen ortalama iki bağımsız deneyi temsil etmektedir. Veriler ortalama ± SD (*p < 0.05, ****p < 0.0001 olarak sunulmuştur. Tek yönlü ANOVA). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
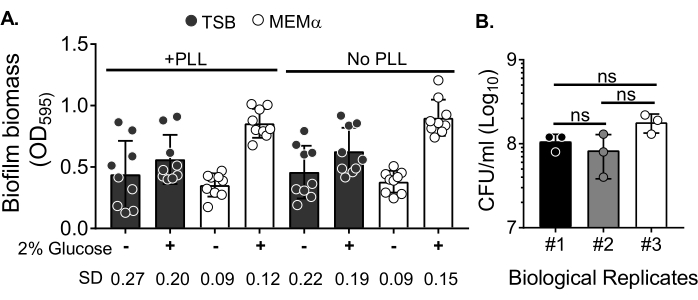
Şekil 2: Biyofilm biyokütlesinin farklı koşullarda nicelleştirilmesi ve optimize edilmiş koşullarda yetiştirilen biyofilmlerin bakteriyel canlılık sayısı. (A) S. aureus, poli-L-Lizin (PLL) ile kaplanmış veya kaplanmamış 96 delikli bir plakaya tohumlanmıştır. Biyofilmler TSB, MEMα veya 18 saat boyunca statik koşullar altında% 2 glikoz ile desteklenen ortamlardan herhangi birinde yetiştirildi. Biyofilm biyokütlesini boyamak için kristal menekşe (CV) boyama yapıldı. Salınan CV lekesi 1: 10'da seyreltildi ve bir mikro plaka okuyucuda okundu. Sonuçlar, üçlü olarak gerçekleştirilen ortalama üç bağımsız deneyi temsil etmektedir. Veriler ortalama SD ± olarak sunulmuştur. Her grubun SD'si, farklı biyofilm büyüme koşulları değişkenliğini göstermek için altta gösterilmiştir. (B) Bakteriyel CFU sayımları, optimize edilmiş bir ortamda (MEMa +% 2 glikoz) yetiştirilen biyofilmlerden elde edilmiştir. 18 saatlik statik biyofilmler, biyofilm biyokütlesini gevşetmek için 10 dakikalık bir sonikasyon ile aynı sayıda yıkamaya tabi tutuldu ve kaplamadan önce agregaları bozmak için 22G iğnesinden geçirildi. Sonuçlar üçlü olarak gerçekleştirilen üç replikayı temsil eder. Veriler ortalama ± SD olarak sunulmaktadır (ns = anlamlı değildir. Tek yönlü ANOVA). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
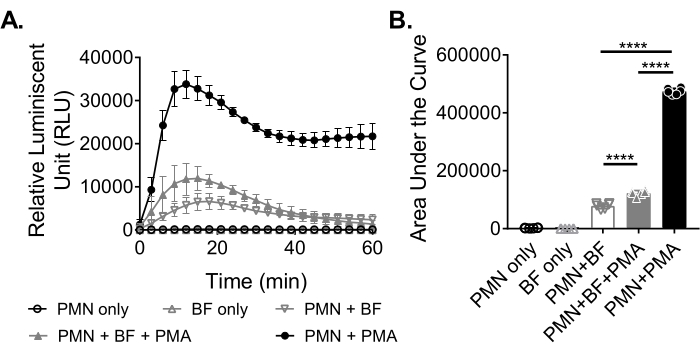
Şekil 3: Kemilüminesans testi ile nötrofiller tarafından ROS üretiminin ölçülmesi. (A) Nötrofiller (PMN), nötrofiller tarafından ROS üretimini ölçmek için PMA'nın varlığında (kapalı gri üçgen) veya yokluğunda (açık gri ters üçgen) HBSS ile yıkanmış S. aureus biyofilmleri (BF) ile inkübe edildi. Luminol, bir mikroplaka okuyucuda 60 dakika boyunca her 3 dakikada bir ROS'u tespit etmek için kullanıldı. Bir biyofilm (kapalı siyah daire) yokluğunda PMA ile tedavi edilen nötrofiller pozitif bir kontrol görevi görürken, sadece nötrofil (açık siyah daire) ve sadece biyofilm (açık gri üçgen) grupları negatif kontrol olarak görev yaptı. Veriler, iki farklı donörden elde edilen nötrofiller ile üçlü olarak gerçekleştirilen ortalama iki bağımsız deneyi temsil etmektedir. Veriler ortalama ± SD olarak sunulmaktadır. (B) (A) 'dan itibaren eğrinin altındaki alan, nötrofiller tarafından üretilen toplam ROS'u ölçmek için hesaplanmıştır. Veriler ortalama ± SD olarak gösterilir. (***p < 0.0001. Tek yönlü ANOVA). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
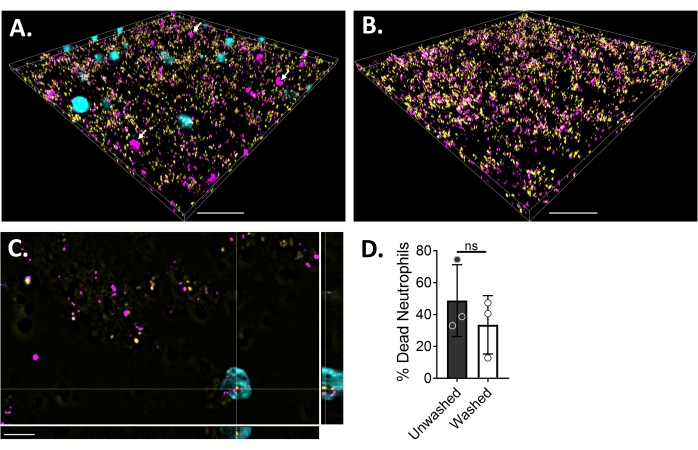
Şekil 4: Geniş alan floresan mikroskobu kullanılarak S. aureus biyofilmi ve nötrofiller arasındaki etkileşimin görselleştirilmesi. Mavi CMAC boya etiketli nötrofiller (camgöbeği), 18 saatlik bir S. aureus biyofilmi (sarı) ile inkübe edilmeden önce ethidium homodimer-1 (macenta; ölü) ile desteklenmiştir. Biyofilm-nötrofil etkileşimleri, geniş alan floresan mikroskobu kullanılarak görüntülendi ve görüntüler bir görüntü analiz yazılımı kullanılarak işlendi. Deneyler üç farklı donör ile yapıldı. Temsili görüntüler, (A) canlı (camgöbeği) ve ölü (macenta; beyaz oklarla belirtilmiş birkaçı) nötrofillere sahip S. aureus biyofilminin 3D görünümü, (B) GFP'yi (sarı) ifade eden canlı S. aureus veya ethidium homodimer-1 (macenta) ile boyanmış ölü S. aureus nötrofillerin yokluğunda bir S. aureus biyofilminin 3D görünümü, (C) S. aureus'un ortogonal bir görünümü olarak sunulmaktadır. ve xy, yz ve xz düzlemleri tarafından tasvir edildiği gibi nötrofil etkileşimi ve (D) yapışmamış nötrofillerin çıkarılması (yıkanmış) çıkarmak için HBSS ile 30 dakika sonra ya hemen (yıkanmamış) ya da HBSS ile üç tur yıkamadan sonra S. aureus biyofilm varlığında nötrofil canlılığının nicelleştirilmesi. Nötrofil hücre ölümü ortalama ± SD (Student's t-testi) olarak sunulmaktadır. Ölçek çubuğu (A) ve (B) içinde 50 μm ve (C) cinsinden 10 μm değerini gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
In vitro 48,49,50 aşağı akış deneyleri için sağlam ve tekrarlanabilir S. aureus biyofilmleri yetiştirmek için çok sayıda çaba sarf edilmiştir. PLL'nin katyonik doğasından yararlanan ve sağlam in vitro S. aureus biyofilmlerinin büyümesi için medyayı glikozla destekleyen standartlaştırılmış bir protokol özetlenmiştir. PLL ilavesi, negatif yüklü bakteri hücresinin pozitif yüklü PLL kaplı yüzeylere daha iyi bağlanmasını sağlar. 10 μg / mL konsantrasyonunda PLL'nin, 24 saat51 saat boyunca inkübe edildiğinde Pseudomonas aeruginosa, Escherichia coli ve S. aureus'a karşı antimikrobiyal aktiviteye sahip olduğunu belirtmek önemlidir. Aynı konsantrasyon yüzeyleri kaplamak için kullanılır; Bununla birlikte, fazla PLL aspire edilir, bu da biyofilm büyümesi için tohumlama yaparken PLL konsantrasyonunu 10 μg / mL'den düşürür.
PLL'nin sadece% 2 glikozlu MEMα gibi spesifik büyüme ortamlarında çalıştığını, burada S. aureus'un minimum değişkenliğe sahip sağlam biyofilmler ürettiğini belirtmek önemlidir (Şekil 2A). Diğer ortam türleriyle birlikte kullanılacak PLL konsantrasyonu, kuyucukları kaplamak için artan bir PLL konsantrasyonu kullanmak gibi daha fazla optimizasyon gerektirecektir. Ek olarak, bu koşullar bir monotür S. aureus biyofilmi için optimize edilmiştir. Kronik yara biyofilmleri genellikle polimikrobiyal olmakla birlikte, monotür biyofilmi ve nötrofiller ve diğer bağışıklık hücreleri ile etkileşimlerini incelemek için tahlilleri standartlaştırmak, patogeneze katkılarını anlamada anahtardır52. Bu standartlaştırılmış protokoller, polimikrobiyal biyofilmleri ve nötrofiller ile etkileşimlerini sürdürmek ve incelemek için daha da optimize edilebilir.
TSB gibi zengin bakteri kültürü ortamlarının nötrofil canlılığının kaybına yol açtığı da gözlenmiştir (Şekil 1). Bu nedenle, memeli hücre kültürleri için kullanılan MEMa'daki S. aureus biyofilmlerinin büyüme koşulları optimize edildi. Nötrofiller içeren çalışmalar için, bu ortam nötrofil canlılığını destekler ve S. aureus büyümesini teşvik eder. Medyanın nötrofillerin yaşayabilirliğini etkilediği gözlenirken, periferik insan kanından izole edilen nötrofillerin 20 saat53'e kadar yaklaşık% 70 apoptotik nötrofil ile ex vivo apoptoza maruz kaldığını düşünmek de önemlidir. Bu, deneylere hazırlanırken nötrofillerin buz üzerinde depolanması, endotoksin içermeyen reaktiflerin kullanılması ve nötrofillerin bulunduğu örneklerin girdabından kaçınarak nötrofillerin aktivasyonunun önlenmesi gibi uygun kullanımı gerektirir.
Nötrofillerde oksidatif patlamanın değerlendirilmesi, nötrofillerin patojen 14,54,55 üzerindeki öldürücü etkisini belirlemek için rutin olarak yapılır. Bu çalışmalar sıklıkla nötrofillerin eklendiği planktonik bakterilerle gerçekleştirilir ve oksidatif patlama yanıtı, nötrofiller tarafından üretilen süperoksit anyonları tespit eden luminol amplifikasyonlu kemilüminesans kullanılarak ölçülür. Mevcut protokol, planktonik bakterilerin statik olarak yetiştirilen 18 saat S. aureus biyofilmi ile değiştirilmesiyle modifiye edilir. Bu nedenle, nötrofiller aktivasyonlarını değerlendirmek için doğrudan biyofilme eklenebilir. Öte yandan, biyofilmlerdeki bakteriler, ROS 23,56'yı detoksifiye etmek için katalaz ve süperoksit dismutaz gibi enzimler üretir. Staphylococcus epidermidis biyofilmleri, stres57 altında planktonik muadilinden daha yüksek katalaz üretir. Bir S. aureus biyofilmindeki PMA ile uyarılmış nötrofillerin toplam kemilüminesansı, biyofilmin bulunmadığı PMA ile uyarılmış nötrofillerden anlamlı derecede düşüktür (Şekil 2). Bu, bu detoksifiye edici enzimlerin aktivitesinden kaynaklanıyor olabilir. Ayrıca, S. aureus biyofilmleri, nötrofilleri öldüren lökocidinler adı verilen birkaç gözenek oluşturan toksin üretir58. Azalan patlama tepkisi, S. aureus biyofilminin varlığında nötrofillerin canlılığının azalmasından da kaynaklanmaktadır. Bu çalışma, hücrelerin hem içinde hem de dışında üretilen toplam ROS'u tespit eden luminol kullanırken, CM-H2 DCFDA (5-(ve-6)-klorometil-2'7'-diklorodihidrofloresein diasetat) veya isoluminol gibi diğer reaktifler, çalışmanın amacı hücre içi veya hücre dışıROS üretimini incelemek ise göz önünde bulundurulmalıdır.
Nötrofil-biyofilm etkileşimlerini mikroskopi yoluyla görselleştirme yeteneği, nötrofillerin ve biyofilmlerin birbirlerinin varlığındaki davranışları hakkında bilgilendirici olabilir. Floresan boyaların ve proteinlerin uyarılması ve emisyon spektrumları, 30 dakikalık bir inkübasyondan sonra 18 saatlik bir S. aureus biyofilmi ve nötrofiller arasındaki etkileşimin anlık görüntüsünü temsil eder. Lekeli hücrelerden gelen sinyalleri etkili bir şekilde yakalamak için, mikroskopi için numuneleri ayarlarken numunelerin ışık kaynaklarına maruz kalmasını sınırlamak önemlidir. Görüntüleme sırasında, farklı kanallar için Z-yığını yüksekliği ve pozlama süresi gibi tüm parametreleri ayarlarken ışık kaynağının yoğunluğunu azaltarak numunelerin hızlı fotobeyazlatılması önlendi.
Bu basit uygulamalar, biyofilm içinde az sayıda nötrofilin lokalize olduğunun gözlemlendiği uygun mikroskopi görüntülemesine izin verdi (Şekil 4A). Bunun nedeni, biyofilm içinde bulunan boşluklardan kaynaklanabilir, çünkü MEMa'da% 2 glikoz ile yetiştirilen 18 h S. aureus biyofilmi, yüzeyi düzgün bir şekilde kaplamaz (Şekil 4B). Bununla birlikte, diğer çalışmaların zengin medya kullanımı, S. aureus biyofilm büyümesinin ve biyofilm 30,58'e nüfuz eden lökositlerin tek tip bir çimini göstermiştir. Ayrıca, nötrofiller58'i lize eden S. aureus biyofilm tarafından üretilen lökocidinlere bağlı olarak S. aureus biyofilmleri ile 30 dakikalık inkübasyondan sonra nötrofil hücre ölümü olduğu da gözlenmiştir (Şekil 4A, D). Yapışmamış nötrofillerin 30 dakika boyunca biyofilm ile inkübe edilmesinden sonra çıkarılması için bir yıkama adımının eklenmesi, 30 dakikalık inkübasyondan hemen sonra mikroskopinin yapıldığı yıkanmamış gruba kıyasla ölü nötrofillerin ~% 15'ini sistemden uzaklaştırdı (Şekil 4D). S. aureus ile etkileşen nötrofiller de gözlenmiştir (Şekil 4C). S. aureus'un nötrofiller tarafından yutulup yutulmadığını veya nötrofillerin hücre yüzeyine bağlanıp bağlanmadığını değerlendirmek için daha fazla deney gereklidir54. Nötrofillerin ve biyofilmlerin görüntülenmesi, fagositoz ve NETosis54,59 gibi akış aşağı yönde çeşitli nötrofil işlevlerini değerlendirmek için ilk adımdır. Nötrofillerin biyofilmler üzerindeki etkisi, diğerlerinin yanı sıra, adım 5.6'da listelenen görüntü analiz araçları kullanılarak biyofilm biyokütlesinin, biyofilmin yapısal değişikliklerinin ve biyofilm canlılığının ölçülmesiyle de değerlendirilebilir. Son olarak, nötrofillerde donörden donöre değişkenlik vardır; Bu nedenle, nötrofiller içeren çalışmalar için en az üç farklı donörün kullanılması önerilmektedir.
Genel olarak, nötrofiller ve biyofilmler arasındaki etkileşimleri değerlendirmek için standartlaştırılmış in vitro testler birleştirildi. Bu tahlillerde S. aureus kullanılsa da, açıklanan protokoller diğer patojenleri incelemek için kolayca uyarlanabilir. Konakçı-patojen etkileşimlerini incelemek için çeşitli in vivo modeller olsa da, özellikle koşullar optimize edilmemişse, pahalı ve emek yoğun olabilirler. Standartlaştırılmış in vitro tahlillerle çalışmak, deneysel koşulları optimize etmeyi ve in vivo bir sisteme geçmeden önce gözlemleri doğrulamayı sağlar. Son olarak, in vivo biyofilm-nötrofil etkileşimlerini incelemek için çeşitli hayvan enfeksiyon modelleri kullanılmıştır. Bununla birlikte, insanlar ve hayvan modelleri arasındaki immünolojik farklılıkları göz önünde bulundurmak önemlidir60,61,62,63. Bu, bu karmaşık konakçı-patojen etkileşimlerini incelemek için insanlardan türetilen nötrofillerin kullanılmasını gerektirir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, DJW'ye Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü (R01AI077628) ve ESG'ye Amerikan Kalp Derneği Kariyer Geliştirme Ödülü (19CDA34630005) tarafından finanse edildi. Dr. Paul Stoodley'e bize USA 300 LAC GFP suşu sağladığı için teşekkür ederiz. Ayrıca, Ohio State University olan Kampüs Mikroskopi ve Görüntüleme Tesisi (CMIF) ve OSU Kapsamlı Kanser Merkezi (OSUCCC) Mikroskopi Ortak Kaynağı (MSR) kaynaklarından gelen kaynakları kabul ediyoruz. Ayrıca Stoodley laboratuvarından Amelia Staats, Peter Burback ve Lisa Coleman'a kan alımı yaptıkları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.9% sodium chloride irrigation, USP | Baxter | 2F7124 | Endotoxin-free; Used for isolation of neutrophils |
| 150 mL rapid-flow filter unit | Thermo Scientific | 565-0020 | |
| 200 proof ethanol | VWR | 89125-188 | |
| 3 mL syringe | BD | 309657 | Used for blood draw |
| 50 mL conical centrifuge tubes | Thermo Scientific | 339652 | |
| 60 mL syringe | BD | 309653 | Used for blood draw |
| Agar | Fisher Bioreagents | BP1423-2 | |
| Alcohol swab | BD | Used for blood draw | |
| Band-aids | Used for blood draw | ||
| BD Bacto Tryptic Soy Broth | BD | DF0370-07-5 | Combine with 1.5% agar to make Tryptic Soy Agar |
| Cell counter | Bal Saupply | 202C | |
| CellTracker blue CMCH | Invitrogen | C2111 | Blue CMAC Dye (BCD) |
| Clear bottom 96-well flat bottom polystyrene plates | Costar | 3370 | |
| Cotton gauze | Fisherbrand | 13-761-52 | Used for blood draw |
| Crystal violet | Acros Organic | 40583-0250 | |
| Culture tubes | Fisherbrand | 14-961-27 | Borosilicate Glass 13 x 100 mm |
| D-(+)-glucose | Sigma | G-8270 | |
| Dextran from Leuconostoc spp. | Sigma | 31392-250G | Used for isolation of neutrophils |
| Dulbecco's phosphate buffered saline (DPBS) 1x | Gibco | 14190-144 | |
| Ethidium homodimer-1 | Invitrogen | L3224 B | |
| Ficoll-Paque plus | Cytiva | 17144003 | Used for isolation of neutrophils (density gradient medium) |
| Hanks' balanced salt solution (HBSS) 1x | Corning cellgro | 21-022-CV | without calcium, magnesium, and phenol red |
| Hemacytometer | Bright Line | ||
| Heparin | Novaplus | NDC 63323-540-57 | 1000 USP units/mL, Used for blood draw |
| IMARIS 9.8 | Oxford Instruments | Microscopy image analysis software | |
| Luminol | Sigma | A8511-5G | |
| Minimal essential media (MEM) Alpha 1x | Gibco | 41061-029 | |
| Needle (23 G1) | BD | 305145 | Used for blood draw |
| Nikon Eclipse Ti2 | Nikon | ||
| NIS-Elements | Nikon | Quantification of dead neutrophils | |
| Normal human serum | Complement Technology | NHS | |
| Petri Dish (100 x 15 mm) | VWR | 25384-342 | |
| Phorbol 12-myristate 13-acetate | |||
| Poly-L-lysine solution | Sigma | P4707-50ML | |
| Sodium chloride | Fisher Bioreagents | BP358-10 | Used for neutrophil isolation |
| SoftMax Pro Software | Molecular Devices | Microplate reader software used for data acquisition | |
| SpectraMax i3x | Molecular Devices | Microplate reader | |
| Sterile water for irrigation, USP | Baxter | 2F7114 | Endotoxin-free; Used for neutrophil isolation |
| Surflo winged infusion set | Terumo | SC*19BLK | 19 G x 3/4", used for blood draw |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Turnicate | Used for blood draw | ||
| UltraPure distilled water | Invitrogen | 10977015 | |
| White opaque 96-well plates | Falcon | 353296 | Tissue culture treated and flat bottom plate |
| μ-Slide VI 0.4 | Ibidi | 80601 | μ-channel slide |
Referanslar
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerging Infectious Diseases. 8 (9), 881-890 (2002).
- Alhede, M., et al. Phenotypes of non-attached Pseudomonas aeruginosa aggregates resemble surface attached biofilm. PLoS One. 6 (11), 27943(2011).
- Hall-Stoodley, L., Costerton, J. W., Stoodley, P. Bacterial biofilms: from the natural environment to infectious diseases. Nature Reviews: Microbiology. 2 (2), 95-108 (2004).
- Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clinical Microbiology Reviews. 15 (2), 167-193 (2002).
- Schilcher, K., Horswill, A. R. Staphylococcal biofilm development: structure, regulation, and treatment strategies. Microbiology and Molecular Biology Reviews. 84 (3), 0002(2020).
- Kaplan, J. B. Biofilm dispersal: mechanisms, clinical implications, and potential therapeutic uses. Journal of Dental Research. 89 (3), 205-218 (2010).
- Otto, M. Staphylococcal Biofilms. Microbiology Spectrum. 6 (4), 10(2018).
- Moormeier, D. E., Bayles, K. W. Staphylococcus aureus biofilm: a complex developmental organism. Molecular Microbiology. 104 (3), 365-376 (2017).
- Gross, M., Cramton, S. E., Gotz, F., Peschel, A. Key role of teichoic acid net charge in Staphylococcus aureus colonization of artificial surfaces. Infection and Immunity. 69 (5), 3423-3426 (2001).
- Zheng, Y., He, L., Asiamah, T. K., Otto, M. Colonization of medical devices by staphylococci. Environmental Microbiology. 20 (9), 3141-3153 (2018).
- Donlan, R. M. Biofilms and device-associated infections. Emerging Infectious Diseases. 7 (2), 277-281 (2001).
- Kolaczkowska, E., Kubes, P. Neutrophil recruitment and function in health and inflammation. Nature Reviews Immunology. 13 (3), 159-175 (2013).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annual Review of Immunology. 30, 459-489 (2012).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- van Kessel, K. P., Bestebroer, J., van Strijp, J. A. Neutrophil-mediated phagocytosis of Staphylococcus aureus. Frontiers in Immunology. 5, 467(2014).
- Nguyen, G. T., Green, E. R., Mecsas, J. Neutrophils to the ROScue: Mechanisms of NADPH oxidase activation and bacterial resistance. Frontiers in Cellular and Infection Microbiology. 7, 373(2017).
- Saini, R., Singh, S. Inducible nitric oxide synthase: An asset to neutrophils. Journal of Leukocyte Biology. 105 (1), 49-61 (2019).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Segal, A. W. The function of the NADPH oxidase of phagocytes and its relationship to other NOXs in plants, invertebrates, and mammals. The International Journal of Biochemistry and Cell Biology. 40 (4), 604-618 (2008).
- Fang, F. C. Antimicrobial reactive oxygen and nitrogen species: concepts and controversies. Nature Reviews Microbiology. 2 (10), 820-832 (2004).
- Bogdan, C. Nitric oxide and the immune response. Nature Immunology. 2 (10), 907-916 (2001).
- Chua, S. L., et al. Reactive oxygen species drive evolution of pro-biofilm variants in pathogens by modulating cyclic-di-GMP levels. Open Biology. 6 (11), 160162(2016).
- El Haj, C., Lichtenberg, M., Nielsen, K. L., Bjarnsholt, T., Jensen, P. O. Catalase protects biofilm of Staphylococcus aureus against daptomycin activity. Antibiotics. 10 (5), 511(2021).
- Ghimire, N., et al. Direct microscopic observation of human neutrophil-Staphylococcus aureus interaction in vitro suggests a potential mechanism for initiation of biofilm infection on an implanted medical device. Infection and Immunity. 87 (12), 00745(2019).
- Bhattacharya, M., et al. Leukocidins and the nuclease nuc prevent neutrophil-mediated killing of Staphylococcus aureus biofilms. Infection and Immunity. 88 (10), 00372(2020).
- Bogachev, M. I., et al. Fast and simple tool for the quantification of biofilm-embedded cells sub-populations from fluorescent microscopic images. PLoS One. 13 (5), 0193267(2018).
- Kerstens, M., et al. A flow cytometric approach to quantify biofilms. Folia Microbiologica. 60 (4), 335-342 (2015).
- Meyle, E., et al. Destruction of bacterial biofilms by polymorphonuclear neutrophils: relative contribution of phagocytosis, DNA release, and degranulation. The International Journal of Artificial Organs. 33 (9), 608-620 (2010).
- Oveisi, M., et al. Novel assay to characterize neutrophil responses to oral biofilms. Infection and Immunity. 87 (2), 00790(2019).
- Leid, J. G., Shirtliff, M. E., Costerton, J. W., Stoodley, P. Human leukocytes adhere to, penetrate, and respond to Staphylococcus aureus biofilms. Infection and Immunity. 70 (11), 6339-6345 (2002).
- Fey, P. D., et al. A genetic resource for rapid and comprehensive phenotype screening of nonessential Staphylococcus aureus genes. mBio. 4 (1), 00537(2013).
- Cody, W. L., et al. Skim milk enhances the preservation of thawed -80 degrees C bacterial stocks. Journal of Microbiological Methods. 75 (1), 135-138 (2008).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. 63, 3064(2012).
- Freitas, M., Porto, G., Lima, J. L., Fernandes, E. Optimization of experimental settings for the analysis of human neutrophils oxidative burst in vitro. Talanta. 78 (4-5), 1476-1483 (2009).
- Merritt, J. H., Kadouri, D. E., O'Toole, G. A. Growing and analyzing static biofilms. Current Protocols in Microbiology. , Chapter 1 Unit 1B 1 (2005).
- Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. 412, 15-20 (2007).
- Zhou, L., et al. Impact of human granulocyte and monocyte isolation procedures on functional studies. Clinical and Vaccine Immunology. 19 (7), 1065-1074 (2012).
- Quach, A., Ferrante, A. The application of dextran sedimentation as an initial step in neutrophil purification promotes their stimulation, due to the presence of monocytes. Journal of Immunology Research. 2017, 1254792(2017).
- Karlsson, A., Nixon, J. B., McPhail, L. C. Phorbol myristate acetate induces neutrophil NADPH-oxidase activity by two separate signal transduction pathways: dependent or independent of phosphatidylinositol 3-kinase. Journal of Leukocyte Biology. 67 (3), 396-404 (2000).
- Staats, A., et al. Rapid aggregation of Staphylococcus aureus in synovial fluid is influenced by synovial fluid concentration, viscosity, and fluid dynamics, with evidence of polymer bridging. mBio. , 0023622(2022).
- Chiu, I. M., et al. Bacteria activate sensory neurons that modulate pain and inflammation. Nature. 501 (7465), 52-57 (2013).
- Hartig, S. M. Basic image analysis and manipulation in ImageJ. Current Protocols in Molecular Biology. 102 (1), 14-15 (2013).
- Heydorn, A., et al. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146 (10), 2395-2407 (2000).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Luo, T. L., et al. Introducing BAIT (Biofilm Architecture Inference Tool): a software program to evaluate the architecture of oral multi-species biofilms. Microbiology. 165 (5), 527-537 (2019).
- Naves, P., et al. Measurement of biofilm formation by clinical isolates of Escherichia coli is method-dependent. Journal of Applied Microbiology. 105 (2), 585-590 (2008).
- Eze, E. C., El Zowalaty, M. E. Combined effects of low incubation temperature, minimal growth medium, and low hydrodynamics optimize Acinetobacter baumannii biofilm formation. Infection and Drug Resistance. 12, 3523-3536 (2019).
- Harris, L. G., Tosatti, S., Wieland, M., Textor, M., Richards, R. G. Staphylococcus aureus adhesion to titanium oxide surfaces coated with non-functionalized and peptide-functionalized poly(L-lysine)-grafted-poly(ethylene glycol) copolymers. Biomaterials. 25 (18), 4135-4148 (2004).
- Miao, J., et al. Biofilm formation of Staphylococcus aureus under food heat processing conditions: first report on cml production within biofilm. Scientific Reports. 9 (1), 1312(2019).
- Lade, H., et al. Biofilm formation by Staphylococcus aureus clinical isolates is differentially affected by glucose and sodium chloride supplemented culture media. Journal of Clinical Medicine. 8 (11), 1853(2019).
- Guzel Kaya, G., et al. Antibacterial activity of linezolid against gram-negative bacteria: utilization of epsilon-Poly-l-Lysine capped silica xerogel as an activating carrier. Pharmaceutics. 12 (11), 1126(2020).
- Clinton, A., Carter, T. Chronic wound biofilms: pathogenesis and potential therapies. Laboratory Medicine. 46 (4), 277-284 (2015).
- Scheel-Toellner, D., et al. Reactive oxygen species limit neutrophil life span by activating death receptor signaling. Blood. 104 (8), 2557-2564 (2004).
- Pestrak, M. J., et al. Pseudomonas aeruginosa rugose small-colony variants evade host clearance, are hyper-inflammatory, and persist in multiple host environments. PLoS Pathogens. 14 (2), 1006842(2018).
- Guerra, F. E., et al. Staphylococcus aureus SaeR/S-regulated factors reduce human neutrophil reactive oxygen species production. Journal of Leukocyte Biology. 100 (5), 1005-1010 (2016).
- Suo, Y., Huang, Y., Liu, Y., Shi, C., Shi, X. The expression of superoxide dismutase (SOD) and a putative ABC transporter permease is inversely correlated during biofilm formation in Listeria monocytogenes 4b G. PLoS One. 7 (10), 48467(2012).
- Olwal, C. O., Ang'ienda, P. O., Ochiel, D. O. Alternative sigma factor B (sigma(B)) and catalase enzyme contribute to Staphylococcus epidermidis biofilm's tolerance against physico-chemical disinfection. Scientific Reports. 9 (1), 5355(2019).
- Bhattacharya, M., et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing. Proceedings of the National Academy of Sciences of the United States of America. 115 (28), 7416-7421 (2018).
- Masuda, S., et al. NETosis markers: Quest for specific, objective, and quantitative markers. Clinica Chimica Acta. 459, 89-93 (2016).
- Dworsky, E. M., et al. Novel in vivo mouse model of implant related spine infection. Journal of Orthopaedic Research. 35 (1), 193-199 (2017).
- Pletzer, D., Mansour, S. C., Wuerth, K., Rahanjam, N., Hancock, R. E. New mouse model for chronic infections by gram-negative bacteria enabling the study of anti-infective efficacy and host-microbe interactions. mBio. 8 (1), 00140(2017).
- Davis, M. M. A prescription for human immunology. Immunity. 29 (6), 835-838 (2008).
- Mestas, J., Hughes, C. C. Of mice and not men: differences between mouse and human immunology. The Journal of Immunology. 172 (5), 2731-2738 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır