Method Article
ヒト好中球と黄色ブドウ球菌バイオフィルムの間の相互作用を視覚化および定量するための標準化されたin vitroアッセイ
要約
本プロトコルは、好中球-バイオフィルム相互作用の研究を記載している。 黄色ブドウ球 菌バイオフィルムは in vitro で確立され、末梢血由来のヒト好中球とインキュベートされます。好中球からの酸化バースト応答を定量化し、バイオフィルム内の好中球局在を顕微鏡で測定します。
要約
好中球は、微生物感染中に免疫系によって展開される最初の防御線です。 生体内では、好中球は感染部位に動員され、食作用、活性酸素種と窒素種(それぞれROS、RNS)の産生、NETosis(好中球細胞外トラップ)、脱顆粒などのプロセスを使用して微生物を殺し、感染を解決します。好中球と浮遊微生物との相互作用は広く研究されています。近年、バイオフィルムによって引き起こされる感染症の研究に新たな関心が寄せられています。バイオフィルムは、好中球による殺傷に対する耐性を含む、プランクトン成長対応物とは異なる特性を示します。in vitro および in vivo の両方のバイオフィルムモデルの確立が成功したことで、これらの微生物群集と異なる免疫細胞との相互作用を調査できるようになりました。ここでは、従来のバイオフィルムモデルと確立された好中球活性アッセイの組み合わせを使用する技術が、好中球とバイオフィルムの相互作用を研究するために特別に調整されています。広視野蛍光顕微鏡は、バイオフィルム中の好中球の局在を監視するために使用されます。これらのバイオフィルムは静的条件下で増殖させ、続いてヒト末梢血由来の好中球を添加する。サンプルは、顕微鏡下で可視化する前に適切な色素で染色されます。さらに、病原体に対する多くの好中球応答の1つであるROSの産生は、バイオフィルムの存在下で定量化されます。この確立されたシステムに免疫細胞を追加することで、宿主と病原体の相互作用の理解が深まり、標準化され最適化された条件を使用してこれらのプロセスを正確に測定できるようになります。
概要
バイオフィルムは、細胞外高分子物質(EPS)に包まれた表面関連微生物または非付着凝集体のコミュニティです1,2。これらのコミュニティは、抗菌剤や免疫系に対する耐性を含む環境ストレス要因から包まれた微生物を保護します3。いくつかの病原性微生物種は、慢性感染症に関連するバイオフィルムを形成します4。バイオフィルムの発生は、表面への付着、EPS産生、細胞増殖、バイオフィルムの構造化、および細胞剥離を含む複雑なプロセスです5。細胞が分散してバイオフィルムを形成すると、それらはプランクトン性のままであるか、新しい基層に移動し、バイオフィルムの発生を再開します6。
日和見病原体である黄色ブドウ球菌は、付着、増殖、成熟、分散を含むバイオフィルム発生の一般的なスキームに従います7。黄色ブドウ球菌バイオフィルムの付着プロセスは、疎水性相互作用、テイコ酸、および接着マトリックス分子を認識する微生物表面成分(MSCRAM)によって決定されます8,9。黄色ブドウ球菌の増殖が始まると、主に多糖類、タンパク質、細胞外DNA、およびテイコ酸からなるEPSが生成されます5。EPS成分が産生されると、様々なエキソエンザイムや低分子も産生され、バイオフィルムの3次元構造に寄与し、剥離を助ける5。黄色ブドウ球菌は、この高度に調整されたライフスタイルを利用して、医療機器の留置による感染症を含むさまざまな慢性感染症を確立します10。
メチシリン耐性 黄色ブドウ球菌 (MRSA)は、中心静脈および尿道カテーテル、人工関節、ペースメーカー、機械式心臓弁、子宮内装置などの留置医療機器に関連する感染症の主な原因の1つです11。このような感染の間、好中球は、複数の戦略 を介して 病原体と戦うために感染部位に動員される最初の宿主免疫細胞です12。これらには、食作用、脱顆粒、活性酸素および窒素種(ROS / RNS)産生、または病原体を排除するための好中球細胞外トラップ(NET)の放出が含まれます13。
微生物の食作用によるROSの生成は、好中球によって示される重要な抗菌応答の1つです14。微生物がオプソニン、特に血清15に含まれる免疫グロブリンと補体成分でコーティングされている場合、食作用が促進されます。次に、オプソニン化された微生物は好中球の細胞表面受容体によって認識され、飲み込まれ、ファゴソーム15と呼ばれるコンパートメントを形成します。好中球は、膜結合NADPHオキシダーゼ16を介してファゴソーム内でROSを生成および放出します。この多成分系酵素複合体は、電子を分子状酸素16に伝達することによってスーパーオキシドアニオンを生成する。さらに、好中球は誘導性一酸化窒素合成酵素(iNOS)17の発現を通じてRNSも生成します。ファゴソーム内のこれらの高スーパーオキシドおよび一酸化窒素ラジカルは、幅広い抗菌活性を有する。それらは酵素の金属中心と相互作用し、病原体の核酸、タンパク質、および細胞膜を損傷する可能性があります18,19,20,21。多くの微生物がバイオフィルムライフスタイルを採用し、ROS22,23による死滅を回避するためにさまざまな戦略を採用しています。したがって、バイオフィルムと好中球を結合させてROSを定量化する標準化されたアッセイは、一貫した結果を得るために有益です。
好中球ROS産生の定量化などのアッセイは、バイオフィルムに対する好中球の応答に関する情報を提供しますが、バイオフィルム内の好中球の相互作用を視覚化する機能も強力なツールとして役立ちます。顕微鏡に蛍光色素を使用するには、顕微鏡イメージング分析に使用できる高品質の画像を取得するための最適化が必要になることがよくあります。好中球は単離後に細胞死を起こす可能性があるため、一部の条件を最適化する柔軟性は限られています。さらに、バイオフィルムは通常、好中球を添加する前に実験セットアップからプランクトン集団を除去するために洗浄されます。洗浄中、バイオフィルムが表面に緩く付着している場合、部分的なバイオマスの損失により、複製バイオフィルム間の変動が生じる可能性があります。
大まかに言えば、好中球とバイオフィルムとの間の相互作用を分析するための分野における現在の方法には、主に顕微鏡、フローサイトメトリー、およびコロニー形成単位(CFU)列挙が含まれる24、25、26、27。顕微鏡検査には、好中球とバイオフィルムを直接染色するか、NET形成、脱顆粒、細胞死などの微生物に対するさまざまな好中球応答を標的とする色素の使用が含まれます25,28。好中球細胞死および脱顆粒などのこれらの応答のサブセットもフローサイトメトリーを介して分析することができるが、好中球はバイオフィルム中の微生物の大きな凝集体と優先的に関連していない必要がある28,29。フローサイトメトリーは、細胞生存率27などのいくつかのバイオフィルムパラメータを定量することもできます。しかしながら、これらのプロセスはバイオフィルムバイオマスの破壊を必要とし、バイオフィルム内の好中球とその成分の空間分布などの他の重要な相互作用を視覚化するのに有用ではないであろう27,29,30。
本プロトコルは、取り扱い中の変動を最小限に抑えるように最適化されたバイオフィルム上の好中球-バイオフィルム相互作用を研究するために伝統的に使用されている方法のいくつかを適応させることに焦点を当てています。したがって、このプロトコルは、バイオフィルムの成長と定量、末梢血からの初代ヒト好中球の分離、ROS産生の定量化、および顕微鏡 による バイオフィルムと好中球の相互作用の視覚化のための標準化された方法を提供します。このプロトコルは、ドナープール間の不均一性を考慮しながら、バイオフィルムと好中球の相互作用を理解するために、さまざまなシステムに適合させることができます。
プロトコル
すべての手順は、オハイオ州立大学治験審査委員会(IRB)(2014H0154)によって承認されました。初代ヒト好中球を単離するために末梢血を採取するためのインフォームド・書面による同意がすべてのドナーから得られた。 黄色ブドウ球 菌(USA300 LAC)31 を実験を行うためのモデル生物として使用しました。実験は、血液媒介病原体への潜在的な曝露のために、適切な個人用保護具(PPE)を使用して実施されました。
1. in vitro バイオフィルムの調製
- トリプシン大豆寒天培地などの栄養豊富な寒天プレート上のストリークプレート技術32,33を用いて凍結保存ストック31から黄色ブドウ球菌の単離されたコロニーを得る(材料の表を参照)。
- 滅菌H2Oで希釈した0.001%(v/v)ポリ-L-リジン(PLL)100 μLで96ウェルプレートの個々のウェルをコーティングし、室温で30分間インキュベートします。無菌的に、真空アシスト吸引トラップを使用してPLL溶液を吸引します。ウェルを室温で一晩乾燥させます。
注意: プロトコルのすべての吸引ステップは、特に明記されていない限り、真空支援吸引トラップを使用して実行されます。 - 黄色 ブドウ球 菌のコロニーに2%グルコースを添加した最小必須培地α(MEMα)に接種して一晩培養を準備し、37°Cでインキュベートし、200rpmで16〜18時間振とうします。
- 2%グルコースを添加した5 mLの新鮮なMEMαに50 μLを移して一晩培養液を希釈し、37°Cで200 rpmで振とうし、対数期半ばまで、一般に光学密度600(OD600nm)が0.5〜0.8になるまでインキュベートします。MEMαを使用して、中対数培養をOD600nm の0.1に正規化します。
- 150 μLの正規化培養液をPLL処理96ウェルプレートの各ウェルに移します。37°Cの加湿チャンバーで18〜20時間静置インキュベートします。
注:バイオフィルムは、μチャンネルスライドなどの他の形式で成長させることもできます(材料表を参照)。 - 上清を吸引して浮遊細胞を除去する。残りのバイオマスを150 μLのハンクスバランスソルトソルト溶液(HBSS)で穏やかに洗浄し、付着していない細胞を取り除きます。バイオフィルムの乱れを避けるためにHBSSを滴下します。
注:洗浄中に上清とHBSSを吸引している間は、バイオフィルムがまだ浸っているように、バイオフィルムを含むウェルに十分な液体(上清またはHBSS)を残してください。これにより、HBSSを滴下してバイオフィルムを洗浄する際のバイオフィルム構造の破壊を防止します。 - 手順 1.6 を少なくとも 2 回繰り返して、すべてのプランクトン細胞を削除します。この時点で、バイオフィルムはすぐに下流の実験の準備ができています。
注:バイオフィルムを好中球実験に使用しない場合は、HBSSをリン酸緩衝生理食塩水(PBS)に置き換えることができます。HBSSは、好中球活性化のための最適条件を提供するグルコースを含む成分を含むので、PBSよりも好ましい34。
2. バイオフィルムバイオマスの定量化
- 20%(v / v)エタノールと80%(v / v)H 2 Oに溶解することにより、0.1%(w / v)クリスタルバイオレット(CV)溶液(材料の表を参照)のストックを準備します。 H2Oを添加する前に、CVがエタノールに完全に溶解していることを確認してください。 溶液をフィルター滅菌します。
- 洗浄したバイオフィルムに150 μLの0.1%CV溶液を加え、室温で20分間インキュベートします。少なくとも 3 つの空のウェルをメディアのみのコントロールとして使用します。
- バイオフィルムから0.1%CV溶液を吸引し、染色したバイオフィルムを200 μLの1x PBSで洗浄します。このプロセスを合計3回の洗浄で繰り返し、ウェルから余分なCVを除去します。
- H2Oで希釈した33%(v/v)氷酢酸150 μLを加え、ロッカー上で室温で50 rpmで30分間インキュベートし、バイオマスに結合したCVを完全に溶解させます。
注意: 氷酢酸は腐食性の化学物質であるため、適切なPPEを使用した層流フードでこの手順を実行してください。 - それまでの間、マイクロプレートリーダー( 材料表を参照)をセットアップして、CV染色値を読み取ってください。氷酢酸処理後、595nmの波長でプレートを読み取ります。
注:CVのODを測定するために使用される波長は、500〜600nm35の範囲である可能性があります。
3.好中球の分離
注:好中球は、以前に発表された方法に従って分離され、わずかな変更がありました36。この分離プロトコルは、最初に密度勾配遠心分離、次に3%デキストラン沈降を組み合わせたものです。このセクションでは、公開されたプロトコルに加えられた変更に焦点を当てて、好中球分離プロトコル全体についてのみ説明します。さらに、以下に概説するプロトコルは、好中球を単離することができる多くの方法の1つであり、必要に応じて置換することができる。好中球を単離するための他の方法には、細胞分離培地または磁気抗体細胞分離の使用が含まれる37。
- 施設のIRBで概説されているプロトコルに従って、静脈穿刺 を介して 成人ドナーから採血します。採血の前に、ヘパリンの最終濃度が20 U / mLになるように、シリンジに十分な防腐剤を含まないヘパリンが含まれていることを確認してください。
- ヘパリン化血液を室温でH2O中のエンドトキシンフリー0.9%NaCl(材料の表を参照)の3/4の容量で希釈する。
- 希釈した血液サンプル20 mLごとに、市販の密度勾配培地( 材料の表を参照)を新鮮な50 mLコニカルチューブに14 mL分注します。希釈した血液サンプルを密度勾配培地の上に慎重に重ねます。
- 層状血液サンプルを400 x g で室温で40分間遠心分離します。遠心分離が完了した後に層を乱さないように、遠心分離機のブレークが遅いことを確認してください。
注:血液サンプルには、生理食塩水と血漿の混合物、単核細胞層、密度勾配培地、好中球、赤血球を含む5つの層があります。 - 血清学的ピペットを用いて、好中球および赤血球ペレットの上方のすべての層を吸引し、続いて、H2O中の冷たいエンドトキシンフリー0.9%NaCl中のペレットの穏やかな再懸濁を行った。20 mLの血液サンプルから生成された各ペレットについて、ペレットを合計20 mLの容量に再懸濁します。3%デキストランの1:1体積を追加します( 材料表を参照)。チューブを氷上で18〜20分間直立させます。
注:3%デキストランがH2O中のエンドトキシンフリー0.9%NaClで作られていることを確認してください。 - 好中球と赤血球を含む上層20 mLを新しい50 mLコニカルチューブに移し、355 x g で4°Cで10分間遠心分離します。 赤いペレットを残して上清を注ぎます。
- ペレットを10 mLの冷たく滅菌したH2Oに30秒間静かに再懸濁して、残りの赤血球を溶解します。すぐに10 mLの冷たいエンドトキシンフリーの0.9%生理食塩水を混合物に加えて、張度を回復させます。溶液を233 x g で4°Cで3分間遠心分離します。
- 上清を注ぎ、血液サンプル20 mLあたり1 mLの冷たいHBSSに95%〜97%の好中球を含むペレットを再懸濁します。
- 再懸濁した好中球10 μLを90 μLの0.4%トリパンブルー排除色素に移し、血球計算盤を使用して細胞をカウントします(材料の表を参照)。
注:トリパンブルー排除色素は生細胞では不透過性であるため、非生存細胞は青色に染色されます。このプロトコルは、>99%の細胞生存率を提供する37,38。 - 好中球の最終濃度が4 x 106 細胞/ mLになるようにHBSSを追加します。
注:細胞生存率が<99%の場合、4 x 106 細胞/ mLの最終濃度を達成できます。ただし、得られる4 x 106 細胞/ mLを含む溶液の総量は減少します。好中球の最終濃度は、ユーザーの実験ニーズに応じて調整することができます。好中球は、以下に説明するすべての実験について、4 x 106 細胞/ mLの最終濃度で再懸濁されました。ドナー間のばらつきを説明するために、好中球に関連するすべての実験は、少なくとも3つの異なるドナーで実行することを強くお勧めします。
4. 好中球が産生するROSの測定
- 洗浄したバイオフィルムに100 μLの20%正常ヒト血清(HBSSで希釈)を滴下し(ステップ1.6)、静置条件下で37°Cで30分間インキュベートしてバイオフィルムをオプソニン化します。
- 20%血清溶液を吸引し、バイオフィルムを150μLのHBSSで1回滴下して洗浄します。HBSSを吸引し、オプソニン化されたバイオフィルムを含むウェルを残します。
注:実験の解釈のために、最低4つのグループが推奨されます:(A)好中球+バイオフィルム、(B)好中球+ PMA(ポジティブコントロール、 材料の表を参照)、(C)好中球のみ、および(D)バイオフィルムのみ。 - HBSSに再懸濁した好中球にルミノール( 材料の表を参照)を4 x 106 細胞/mLの濃度で加え、最終的なルミノール濃度が50 μMになるようにします。このソリューションは、グループ (A) と (C) にすぐに使用できます。ルミノールと混合した4 x 105 好中球をオプソニン化バイオフィルムを含むウェルに加える。
- 別のチューブで、好中球を含まないHBSS中の50 μMルミノール溶液を調製し、バイオフィルムを含むウェル(グループD)に加えます。
- 350 μLの好中球をルミノールと混合し、ホルボール12-ミリスチン酸13-アセテート(PMA)を最終濃度500 ng/mLで混合物に加えます。グループ(B)の場合、この混合物から4 x 105 好中球をバイオフィルムのないウェルに追加します。これはポジティブコントロールとして機能します。
注:このステップで示されるPMAの濃度は、PMA刺激好中球がポジティブコントロールであるため、堅牢なバースト応答を確保するために比較的高くなっています。PMAは、実験に応じて、好中球を活性化するために低濃度で使用できます。 - プレートを270 x g で4°Cで30秒間遠心分離します。
- プレートリーダーが37°Cに設定され、発光とキネティックリードの設定が3分間隔で60分間設定されていることを確認します。プレートをプレートリーダーに入れて、好中球によるROS産生を60分間測定します。
注:このアッセイでは、発光アッセイに使用される白色プレートでバイオフィルムを成長させました。PMAは、酸化的バースト応答39の既知のアゴニストである。PMAを含む研究を実施する場合、PMAはすぐにバースト応答を開始するため、好中球を含む溶液が冷たくなっている間に、最終ステップでPMAが追加されていることを確認してください。
5. バイオフィルム-好中球相互作用のイメージング
- 手順1.2〜1.6を使用してバイオフィルムを設定します。バイオフィルムイメージングを容易にするために、緑色蛍光タンパク質(GFP)40,41を発現するUSA300などの黄色ブドウ球菌の蛍光株を採用して、顕微鏡イメージングの容易さを高めます。
注:in vitroバイオフィルムモデルを実証するために、96ウェルプレートの代わりに6 μチャンネルスライド(材料の表を参照)を使用しました(ステップ1)。 - 4 x 106 細胞/mLの好中球を100 μMのBlue CMAC(7-アミノ-4-クロロメチルクマリン)色素(BCD、 材料表を参照)とともに、37°Cおよび5%CO2のロッカーで30分間インキュベートします。サンプルが暗闇でインキュベートされていることを確認し、残りのステップでは光への露出を制限します。
- 余分なBCDを洗浄するには、好中球を270 x g で5分間遠心分離し、上清を吸引します。好中球を新鮮なHBSSに再懸濁します。この時点で、エチジウムホモ二量体-1( 材料の表を参照)をBCD染色好中球に最終濃度4 μMで添加して、好中球と細菌の死を監視します。
- μスライドで成長させた 黄色ブドウ球菌 バイオフィルムに150 μLの好中球を追加し、好中球と細菌の比率が1:30(好中球:細菌)になるようにします。μスライドを加湿チャンバーで30分間インキュベートします。細菌細胞の数は、18時間のバイオフィルムをめっきして得られた細胞数に基づいています。
- 蛍光色素/タンパク質の励起波長と発光波長に対応する蛍光チャネルを使用して、好中球とバイオフィルムの相互作用を画像化します。
注:本研究では、BCDは353/466 nm、エチジウムホモ二量体-1は528/617 nm、GFPは395/509 nmです。サンプルの光退色を防ぐために、サンプルのレーザーまたは光への曝露を制限します。 - 顕微鏡画像解析ソフトウェアまたはFIJI / ImageJ、COMSTAT2、BiofilmQ、BAITなどのプログラムを使用して画像を分析します42,43,44,45。
注意: 汚れを扱うときは、使用する染料の特異性を考慮することが重要です。一部の染色は原核細胞と真核細胞に作用しますが、他の染色剤は1つにのみ作用します。好中球とバイオフィルムを両方の細胞タイプを染色できる色素を使用して別々に染色する場合は、クロス染色を防ぐために、好中球とバイオフィルムを組み合わせる前に、残っている色素を必ず洗い流してください。
結果
細菌バイオフィルムを増殖させるために使用される培地は、好中球の生存に影響を与えます。好中球とバイオフィルムの相互作用を研究するために、好中球の生存率に対する培地単独の影響を減らすために、さまざまな培地をテストしました(図1)。Tryptic Soy Brothなどの細菌増殖培地は好中球の生存率を最小限に抑え、好中球の~60%が5%CO2で37°Cで30分間のインキュベーション期間後に生きています。MEMαなどの哺乳類細胞培養培地は、好中球の生存率に影響を与えず、黄色ブドウ球菌バイオフィルムの成長をサポートします。実際、最小限の培地は、他の細菌におけるバイオフィルムの堅固な成長を促進する46,47。
バイオフィルムの成長に対する培地の影響と、バイオマスを洗浄してプランクトン細胞を除去した後のバイオフィルムバイオマス定量の変動性を評価するために、18時間の黄色ブドウ球菌バイオフィルムを96ウェルプレートで増殖させ、ウェルをポリ-L-リジンで処理または未処理にしました。栄養豊富な培地(トリプシン大豆ブロス(TSB))および最小培地(MEMα)をそのまま使用するか、2%グルコースを添加しました。CVで染色されたバイオフィルムバイオマスは、2%グルコースを添加したMEMαで増殖した黄色ブドウ球菌バイオフィルムが、すべての試験培地の中で最も堅牢なバイオフィルムを生成することを明らかにしました(図2A)。さらに、MEMα+2%グルコースを含むPLL前処理ウェルで増殖したバイオフィルムは、MEMα+2%グルコースを含むPLL未処理ウェルのバイオフィルムよりも変動性が小さいことを示した。これらのバイオフィルムは、バイオマス定量のためにバイオフィルムを正確に処理した後に播種した場合、CVアッセイ35およびCFU/mLによる定量の変動が少ないことを示しました。これらのバイオフィルムは、3日間に分けてバイオフィルムをめっきすることによって実証されるように、平均して1 x 108 CFU / mLを含んでいました(図2B)。この数は、好中球機能アッセイのためにバイオフィルムに追加する好中球の数を決定するのに役立ちます。
バイオフィルムに応答した好中球によるROS産生を測定するために、 黄色ブドウ球菌 バイオフィルムを96ウェルプレート中で18〜20時間静的に増殖させた。その後、バイオフィルムをオプソニン化し、好中球を添加した。その後、ROSの生成を60分間測定しました(図3A)。曲線下面積は、好中球による総ROS産生を定量化するために、速度曲線から計算される。対照として使用されるPMAなどのアゴニストで処理された好中球は、ROS産生の増加を示す。バイオフィルムが存在しない場合、PMAで処理された好中球は堅牢なROS産生を示した。 黄色ブドウ 球菌バイオフィルムの存在下では、PMAで処理された好中球による全体的なROS産生が減少した。PMAが存在しない場合、好中球はバイオフィルムとの相互作用のみに依存しているため、産生されるROSの量がさらに減少します(図3B)。
蛍光顕微鏡を用いて好中球とバイオフィルムの相互作用を可視化するために、生細胞の細胞質と死細胞のDNAをそれぞれ染色する黄色ブドウ球菌、Blue CMAC色素、およびエチジウムホモ二量体-1のGFP発現株を使用しました。黄色ブドウ球菌バイオフィルムは、6 μチャネルスライドで18時間成長しました。青色CMAC色素標識好中球をエチジウムホモ二量体-1と共に洗浄したバイオフィルムに添加し、イメージング前に5%CO2と共に37°Cで30分間インキュベートした。広視野蛍光顕微鏡により、多くの好中球が黄色ブドウ球菌バイオフィルムの表面に局在し、いくつかはバイオフィルム内にあることが明らかになりました(図4A)。好中球内の黄色ブドウ球菌細胞間の相互作用も明らかでした(図4C)。好中球と相互作用する黄色ブドウ球菌細胞のほとんどは死んでいました(マゼンタ)が、生死染色によって決定されたように、いくつかは生きたままでした(黄色)。比較のために、GFP発現黄色ブドウ球菌バイオフィルムをエチジウムホモ二量体-1で染色したところ、バイオフィルム内の死んだ黄色ブドウ球菌集団の一部が明らかになりました(図4B)。エチジウムホモ二量体-1陽性の生存不能好中球は、黄色ブドウ球菌バイオフィルムとのインキュベーション後に分析ソフトウェア(材料の表を参照)を使用して定量されました。好中球の約48%は、黄色ブドウ球バイオフィルムとのインキュベーションから30分以内にすでに死んでいました。顕微鏡プロトコルの最適化中に、30分間のインキュベーション後にバイオフィルムと好中球を洗浄して非付着好中球を除去する効果も評価され、バイオフィルムに付着したままの死んだ好中球の約33%が明らかになりました(図4D)。
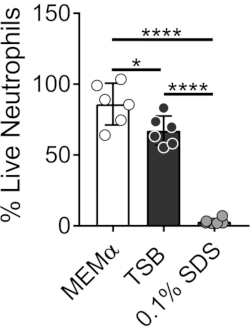
図1:LIVE-DEADアッセイは、細菌と哺乳類の成長培地の間で好中球の生存を比較します。好中球を単離し、HBSS、MEMα、TSB、または0.1%SDS中で30分間インキュベートし、カルセインAM(生)およびエチジウムホモ二量体-1(死)を用いてLIVE-DEAD染色を行った。HBSSインキュベートされた好中球を100%生きた好中球として処理した生好中球の割合を決定した。結果は、2つの異なるドナーから得られた好中球を用いて、三重に実施された2つの独立した実験の平均を表す。データは、平均± SD (*p < 0.05, ****p < 0.0001 として表されます。一方向分散分析)。この図の拡大版を表示するには、ここをクリックしてください。
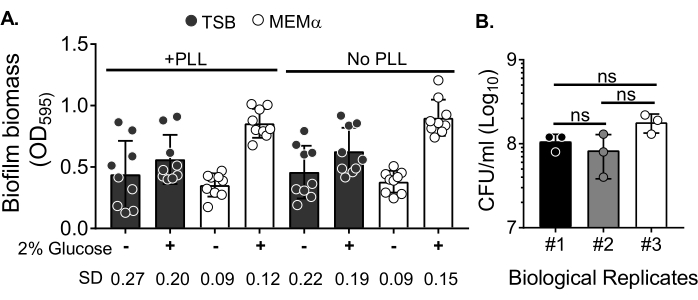
図2:異なる条件でのバイオフィルムバイオマスの定量と、最適化された条件で成長したバイオフィルムの細菌生存率数。 (A) 黄色ブドウ球菌 をポリ-L-リジン(PLL)でコーティングまたはコーティングしていない96ウェルプレートに播種した。バイオフィルムは、TSB、MEMα、または2%グルコースを添加した培地のいずれかで、静的条件下で18時間増殖させた。バイオマスのバイオフィルムを染色するためにクリスタルバイオレット(CV)染色を行った。溶出したCV染色剤を1:10で希釈し、マイクロプレートリーダーで読み取りました。結果は、3回に分けて実施された3つの独立した実験の平均を表す。データはSD±平均値として表されます。各グループのSDは、異なるバイオフィルム増殖条件の変動性を示すために下部に示されています。(B)細菌CFU数は、最適化された培地(MEMα+2%グルコース)で増殖したバイオフィルムから得られた。18時間の静的バイオフィルムを同じ数の洗浄にかけた後、バイオフィルムバイオマスを緩めるために10分間の超音波処理を行い、メッキ前に凝集体を破壊するために22G針を通過させた。結果は、3連で実行された3回の反復を表します。データはSD±平均値として表されます(ns =有意ではありません。一方向分散分析)。 この図の拡大版を表示するには、ここをクリックしてください。
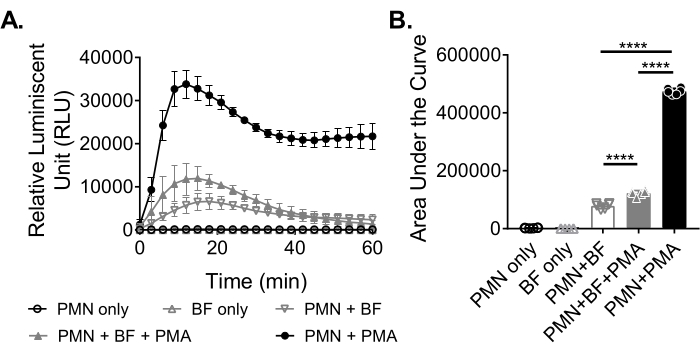
図3:化学発光アッセイによる好中球 による ROS産生の定量。 (A)好中球(PMN)をHBSS洗浄 した黄色ブドウ球菌 バイオフィルム(BF)とともに、PMAの存在下(閉じた灰色の三角形)または非存在下(開いた灰色の逆三角形)でインキュベートし、好中球によるROS産生を測定しました。ルミノールを使用して、マイクロプレートリーダーで3分ごとに60分間ROSを検出しました。バイオフィルムの非存在下でPMAで処理された好中球(閉じた黒丸)はポジティブコントロールとして機能し、好中球のみ(白黒丸)およびバイオフィルムのみ(白い灰色の三角形)グループはネガティブコントロールとして機能しました。データは、2つの異なるドナーから得られた好中球を用いて三重に実施された2つの独立した実験の平均を表す。(B)(A)からの曲線下面積は±、好中球によって生成された総ROSを定量化するために計算された。データは、SD±平均値として表されます。 (***p < 0.0001.一方向分散分析)。 この図の拡大版を表示するには、ここをクリックしてください。
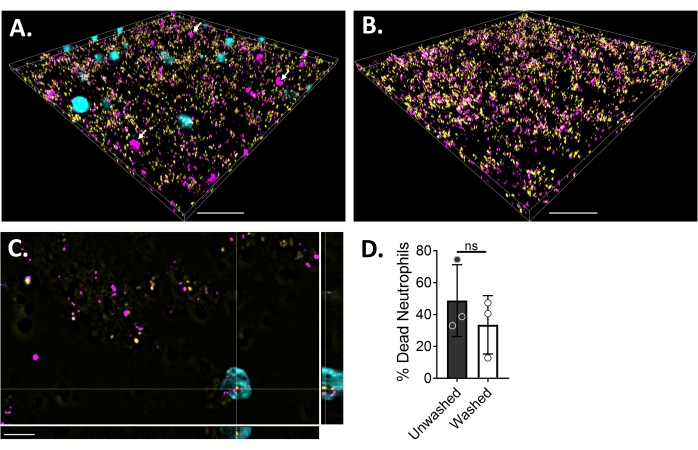
図4:広視野蛍光顕微鏡を用いた黄色ブドウ球菌バイオフィルムと好中球の相互作用の可視化。 青色CMAC色素標識好中球(シアン)にエチジウムホモ二量体-1(マゼンタ;デッド)を添加してから、18時間黄色ブドウ球菌バイオフィルム(黄色)とインキュベートした。バイオフィルムと好中球の相互作用は、広視野蛍光顕微鏡法を使用して画像化され、画像解析ソフトウェアを使用して画像処理されました。実験は3人の異なるドナーを用いて行った。代表的な画像は、(A)生きた(シアン)および死んだ(マゼンタ;いくつかは白い矢印で示されている)好中球を含む黄色ブドウ球菌バイオフィルムの3Dビュー、(B)GFP(黄色)またはエチジウムホモ二量体-1(マゼンタ)で染色された死んだ黄色ブドウ球菌のいずれかを有する好中球が存在しない場合の黄色ブドウ球菌バイオフィルムの3Dビュー、(C) 黄色ブドウ球菌の直交ビューとして提示されます。 xy、yz、およびxz平面によって描かれる好中球相互作用、および(D)黄色ブドウ球バイオフィルムの存在下での好中球生存率の定量化 30分後 すぐに(洗浄)またはHBSSで3ラウンド洗浄した後、非接着好中球を除去します(洗浄)。好中球細胞死は、平均±SD(スチューデントのt検定)として提示されます。スケールバーは、(A)と(B)で50μm、(C)で10μmを示します。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
in vitroでのダウンストリーム実験のために堅牢で再現性のある黄色ブドウ球菌バイオフィルムを成長させるための多くの努力がありました48,49,50。PLLのカチオン性を利用し、堅牢なin vitro黄色ブドウ球菌バイオフィルムの成長のために培地にグルコースを補給する標準化されたプロトコルが概説されています。PLLの追加により、負に帯電した細菌細胞を正に帯電したPLLコーティング表面によりよく付着させることができます。10 μg/mL濃度のPLLは、24時間51時間インキュベートすると、緑膿菌、大腸菌、および黄色ブドウ球菌に対して抗菌活性があることに注意することが重要です。同じ濃度が表面をコーティングするために使用されます。ただし、過剰なPLLが吸引されるため、バイオフィルム成長のために播種すると、PLLの濃度が10 μg/mL未満になります。
PLLは、2%グルコースを含むMEMαなどの特定の増殖培地でのみ機能し、 黄色ブドウ球菌 が最小限の変動性で堅牢なバイオフィルムを生成することが観察されたことに注意することが重要です(図2A)。PLL濃度を他の培地タイプと組み合わせて使用するには、ウェルをコーティングするためにPLLの濃度を上げるなど、さらなる最適化が必要です。さらに、これらの条件は、単種の 黄色ブドウ球菌 バイオフィルムに対して最適化されています。慢性創傷バイオフィルムは多微生物であることが多いが、単一種のバイオフィルムと好中球および他の免疫細胞との相互作用を研究するためのアッセイを標準化することは、病因への寄与を理解する上で重要である52。これらの標準化されたプロトコルは、ポリ微生物バイオフィルムおよび好中球との相互作用を維持および研究するためにさらに最適化することができます。
また、TSBなどの豊富な細菌培養培地は、好中球の生存率の低下につながることも観察されました(図1)。そこで、哺乳類細胞培養に用いるMEMαにおける黄色ブドウ球菌バイオフィルムの増殖条件を最適化した。好中球を含む研究の場合、この培地は好中球の生存率をサポートし、黄色ブドウ球菌の成長を促進します。培地が好中球の生存率に影響を与えることが観察されたが、末梢ヒト血液から単離された好中球は、20時間53までに約70%のアポトーシス好中球でex vivoでアポトーシスを起こすことを考慮することも重要である。これには、実験の準備時に好中球を氷上に保管したり、エンドトキシンフリーの試薬を使用したり、好中球を含むサンプルのボルテックスを回避して好中球の活性化を防ぐなど、適切な取り扱いが必要です。
好中球における酸化バーストの評価は、病原体に対する好中球の殺傷効果を決定するために日常的に行われている14,54,55。これらの研究は、好中球が添加された浮遊細菌で頻繁に行われ、好中球によって生成されたスーパーオキシドアニオンを検出するルミノール増幅化学発光を使用して酸化バースト応答を定量化します。本プロトコルは、プランクトン性細菌を静的に増殖した18時間黄色ブドウ球菌バイオフィルムに置き換えることによって変更されます。そのため、好中球をバイオフィルムに直接添加して、その活性化を評価することができます。一方、バイオフィルム中の細菌は、カタラーゼやスーパーオキシドジスムターゼなどの酵素を産生してROS23,56を解毒します。表皮ブドウ球菌バイオフィルムは、ストレス下でプランクトンのバイオフィルムよりも高いカタラーゼを産生します57。黄色ブドウ球菌バイオフィルムにおけるPMA刺激好中球の総化学発光は、バイオフィルムが存在しないPMA刺激好中球よりも有意に低い(図2)。これは、これらの解毒酵素の活性が原因である可能性があります。さらに、黄色ブドウ球菌のバイオフィルムは、好中球を殺すロイコシジンと呼ばれるいくつかの孔形成毒素を産生します58。バースト応答の低下は、黄色ブドウ球菌バイオフィルムの存在下での好中球の生存率の低下によるものでもある可能性があります。この研究では、細胞内外で産生される総ROSを検出するルミノールを使用していますが、CM-H 2 DCFDA(5-(および-6)-クロロメチル-2'7'-ジクロロジヒドロフルオレセインジアセテート)またはイソルミノールなどの他の試薬は、研究の目的が細胞内または細胞外のROS産生を具体的に研究することである場合は考慮する必要があります14,53,54。
顕微鏡 検査によって 好中球とバイオフィルムの相互作用を視覚化する機能は、好中球とバイオフィルムが互いに存在した場合の挙動について有益です。蛍光色素とタンパク質の励起スペクトルと発光スペクトルは、30分間のインキュベーション後の18時間の 黄色ブドウ 球バイオフィルムと好中球との相互作用のスナップショットを表しています。染色された細胞からのシグナルを効果的にキャプチャするには、顕微鏡用にサンプルをセットアップする際に、サンプルの光源への曝露を制限することが重要です。イメージング中、異なるチャネルのZスタックの高さや露光時間などのすべてのパラメータを調整するときに光源の強度を下げることで、サンプルの急速な光退色を回避しました。
これらの簡単な方法により、バイオフィルム内に局在する好中球がほとんどないことが観察された適切な顕微鏡イメージングが可能になりました(図4A)。これは、2%グルコースを含むMEMαで成長した18時間黄色ブドウ球菌バイオフィルムが表面を均一に覆っていないため、バイオフィルム内に存在する空間が原因である可能性があります(図4B)。しかし、他の研究によるリッチメディアの使用は、黄色ブドウ球菌バイオフィルムの成長とバイオフィルムを貫通する白血球の均一な芝生を示しています30,58。さらに、好中球を溶解する黄色ブドウ球バイオフィルム産生ロイコシジンによる黄色ブドウ球バイオフィルムとのインキュベーションの30分後に好中球細胞死があったことも観察される58(図4A、D)。バイオフィルムと30分間インキュベートした後、非付着好中球を除去する洗浄ステップの追加は、30分間のインキュベーション直後に顕微鏡検査が行われた非洗浄群と比較して、系から~15%の死球を除去した(図4D)。黄色ブドウ球菌と相互作用する好中球も観察された(図4C)。黄色ブドウ球菌が好中球に飲み込まれているか、好中球の細胞表面に付着しているかを評価するには、さらなる実験が必要です54。好中球とバイオフィルムのイメージングは、食作用やNETosisなど、下流のいくつかの好中球機能を評価するための最初のステップです54,59。バイオフィルムに対する好中球の影響は、ステップ5.6にリストされている画像分析ツールを使用して、バイオフィルムバイオマス、バイオフィルムの構造変化、およびバイオフィルム生存率などを定量化することによっても評価できます。最後に、ドナー間の変動性は好中球に存在します。したがって、好中球を含む研究には、少なくとも3つの異なるドナーを使用することをお勧めします。
全体として、標準化されたin vitroアッセイを組み合わせて、好中球とバイオフィルムの間の相互作用を評価しました。これらのアッセイは黄色ブドウ球菌を利用しますが、記載されているプロトコルは他の病原体の研究に簡単に適合させることができます。宿主と病原体の相互作用を研究するためのさまざまなin vivoモデルがありますが、特に条件が最適化されていない場合、それらは高価で労働集約的になる可能性があります。標準化されたin vitroアッセイを使用することで、in vivoシステムに移行する前に、実験条件を最適化し、観察を確認することができます。最後に、様々な動物感染モデルが、in vivoでのバイオフィルム-好中球相互作用を研究するために使用されている。しかしながら、ヒトと動物モデルとの間の免疫学的差異を考慮することが重要である60、61、62、63。これには、これらの複雑な宿主と病原体の相互作用を研究するために、ヒト由来の好中球を使用する必要があります。
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、国立アレルギー感染症研究所(R01AI077628)からDJWに、米国心臓協会のキャリア開発賞(19CDA34630005)からESGに資金提供されました。米国300 LAC GFP株を提供してくださったポール・ストゥードリー博士に感謝します。さらに、オハイオ州立大学のキャンパス顕微鏡およびイメージング施設(CMIF)およびOSU総合がんセンター(OSUCCC)顕微鏡共有リソース(MSR)からのリソースを認めます。また、採血を行ったストゥードリーラボのアメリア・スターツ、ピーター・バーバック、リサ・コールマンにも感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 0.9% sodium chloride irrigation, USP | Baxter | 2F7124 | Endotoxin-free; Used for isolation of neutrophils |
| 150 mL rapid-flow filter unit | Thermo Scientific | 565-0020 | |
| 200 proof ethanol | VWR | 89125-188 | |
| 3 mL syringe | BD | 309657 | Used for blood draw |
| 50 mL conical centrifuge tubes | Thermo Scientific | 339652 | |
| 60 mL syringe | BD | 309653 | Used for blood draw |
| Agar | Fisher Bioreagents | BP1423-2 | |
| Alcohol swab | BD | Used for blood draw | |
| Band-aids | Used for blood draw | ||
| BD Bacto Tryptic Soy Broth | BD | DF0370-07-5 | Combine with 1.5% agar to make Tryptic Soy Agar |
| Cell counter | Bal Saupply | 202C | |
| CellTracker blue CMCH | Invitrogen | C2111 | Blue CMAC Dye (BCD) |
| Clear bottom 96-well flat bottom polystyrene plates | Costar | 3370 | |
| Cotton gauze | Fisherbrand | 13-761-52 | Used for blood draw |
| Crystal violet | Acros Organic | 40583-0250 | |
| Culture tubes | Fisherbrand | 14-961-27 | Borosilicate Glass 13 x 100 mm |
| D-(+)-glucose | Sigma | G-8270 | |
| Dextran from Leuconostoc spp. | Sigma | 31392-250G | Used for isolation of neutrophils |
| Dulbecco's phosphate buffered saline (DPBS) 1x | Gibco | 14190-144 | |
| Ethidium homodimer-1 | Invitrogen | L3224 B | |
| Ficoll-Paque plus | Cytiva | 17144003 | Used for isolation of neutrophils (density gradient medium) |
| Hanks' balanced salt solution (HBSS) 1x | Corning cellgro | 21-022-CV | without calcium, magnesium, and phenol red |
| Hemacytometer | Bright Line | ||
| Heparin | Novaplus | NDC 63323-540-57 | 1000 USP units/mL, Used for blood draw |
| IMARIS 9.8 | Oxford Instruments | Microscopy image analysis software | |
| Luminol | Sigma | A8511-5G | |
| Minimal essential media (MEM) Alpha 1x | Gibco | 41061-029 | |
| Needle (23 G1) | BD | 305145 | Used for blood draw |
| Nikon Eclipse Ti2 | Nikon | ||
| NIS-Elements | Nikon | Quantification of dead neutrophils | |
| Normal human serum | Complement Technology | NHS | |
| Petri Dish (100 x 15 mm) | VWR | 25384-342 | |
| Phorbol 12-myristate 13-acetate | |||
| Poly-L-lysine solution | Sigma | P4707-50ML | |
| Sodium chloride | Fisher Bioreagents | BP358-10 | Used for neutrophil isolation |
| SoftMax Pro Software | Molecular Devices | Microplate reader software used for data acquisition | |
| SpectraMax i3x | Molecular Devices | Microplate reader | |
| Sterile water for irrigation, USP | Baxter | 2F7114 | Endotoxin-free; Used for neutrophil isolation |
| Surflo winged infusion set | Terumo | SC*19BLK | 19 G x 3/4", used for blood draw |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Turnicate | Used for blood draw | ||
| UltraPure distilled water | Invitrogen | 10977015 | |
| White opaque 96-well plates | Falcon | 353296 | Tissue culture treated and flat bottom plate |
| μ-Slide VI 0.4 | Ibidi | 80601 | μ-channel slide |
参考文献
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerging Infectious Diseases. 8 (9), 881-890 (2002).
- Alhede, M., et al. Phenotypes of non-attached Pseudomonas aeruginosa aggregates resemble surface attached biofilm. PLoS One. 6 (11), 27943(2011).
- Hall-Stoodley, L., Costerton, J. W., Stoodley, P. Bacterial biofilms: from the natural environment to infectious diseases. Nature Reviews: Microbiology. 2 (2), 95-108 (2004).
- Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clinical Microbiology Reviews. 15 (2), 167-193 (2002).
- Schilcher, K., Horswill, A. R. Staphylococcal biofilm development: structure, regulation, and treatment strategies. Microbiology and Molecular Biology Reviews. 84 (3), 0002(2020).
- Kaplan, J. B. Biofilm dispersal: mechanisms, clinical implications, and potential therapeutic uses. Journal of Dental Research. 89 (3), 205-218 (2010).
- Otto, M. Staphylococcal Biofilms. Microbiology Spectrum. 6 (4), 10(2018).
- Moormeier, D. E., Bayles, K. W. Staphylococcus aureus biofilm: a complex developmental organism. Molecular Microbiology. 104 (3), 365-376 (2017).
- Gross, M., Cramton, S. E., Gotz, F., Peschel, A. Key role of teichoic acid net charge in Staphylococcus aureus colonization of artificial surfaces. Infection and Immunity. 69 (5), 3423-3426 (2001).
- Zheng, Y., He, L., Asiamah, T. K., Otto, M. Colonization of medical devices by staphylococci. Environmental Microbiology. 20 (9), 3141-3153 (2018).
- Donlan, R. M. Biofilms and device-associated infections. Emerging Infectious Diseases. 7 (2), 277-281 (2001).
- Kolaczkowska, E., Kubes, P. Neutrophil recruitment and function in health and inflammation. Nature Reviews Immunology. 13 (3), 159-175 (2013).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annual Review of Immunology. 30, 459-489 (2012).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- van Kessel, K. P., Bestebroer, J., van Strijp, J. A. Neutrophil-mediated phagocytosis of Staphylococcus aureus. Frontiers in Immunology. 5, 467(2014).
- Nguyen, G. T., Green, E. R., Mecsas, J. Neutrophils to the ROScue: Mechanisms of NADPH oxidase activation and bacterial resistance. Frontiers in Cellular and Infection Microbiology. 7, 373(2017).
- Saini, R., Singh, S. Inducible nitric oxide synthase: An asset to neutrophils. Journal of Leukocyte Biology. 105 (1), 49-61 (2019).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Segal, A. W. The function of the NADPH oxidase of phagocytes and its relationship to other NOXs in plants, invertebrates, and mammals. The International Journal of Biochemistry and Cell Biology. 40 (4), 604-618 (2008).
- Fang, F. C. Antimicrobial reactive oxygen and nitrogen species: concepts and controversies. Nature Reviews Microbiology. 2 (10), 820-832 (2004).
- Bogdan, C. Nitric oxide and the immune response. Nature Immunology. 2 (10), 907-916 (2001).
- Chua, S. L., et al. Reactive oxygen species drive evolution of pro-biofilm variants in pathogens by modulating cyclic-di-GMP levels. Open Biology. 6 (11), 160162(2016).
- El Haj, C., Lichtenberg, M., Nielsen, K. L., Bjarnsholt, T., Jensen, P. O. Catalase protects biofilm of Staphylococcus aureus against daptomycin activity. Antibiotics. 10 (5), 511(2021).
- Ghimire, N., et al. Direct microscopic observation of human neutrophil-Staphylococcus aureus interaction in vitro suggests a potential mechanism for initiation of biofilm infection on an implanted medical device. Infection and Immunity. 87 (12), 00745(2019).
- Bhattacharya, M., et al. Leukocidins and the nuclease nuc prevent neutrophil-mediated killing of Staphylococcus aureus biofilms. Infection and Immunity. 88 (10), 00372(2020).
- Bogachev, M. I., et al. Fast and simple tool for the quantification of biofilm-embedded cells sub-populations from fluorescent microscopic images. PLoS One. 13 (5), 0193267(2018).
- Kerstens, M., et al. A flow cytometric approach to quantify biofilms. Folia Microbiologica. 60 (4), 335-342 (2015).
- Meyle, E., et al. Destruction of bacterial biofilms by polymorphonuclear neutrophils: relative contribution of phagocytosis, DNA release, and degranulation. The International Journal of Artificial Organs. 33 (9), 608-620 (2010).
- Oveisi, M., et al. Novel assay to characterize neutrophil responses to oral biofilms. Infection and Immunity. 87 (2), 00790(2019).
- Leid, J. G., Shirtliff, M. E., Costerton, J. W., Stoodley, P. Human leukocytes adhere to, penetrate, and respond to Staphylococcus aureus biofilms. Infection and Immunity. 70 (11), 6339-6345 (2002).
- Fey, P. D., et al. A genetic resource for rapid and comprehensive phenotype screening of nonessential Staphylococcus aureus genes. mBio. 4 (1), 00537(2013).
- Cody, W. L., et al. Skim milk enhances the preservation of thawed -80 degrees C bacterial stocks. Journal of Microbiological Methods. 75 (1), 135-138 (2008).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. 63, 3064(2012).
- Freitas, M., Porto, G., Lima, J. L., Fernandes, E. Optimization of experimental settings for the analysis of human neutrophils oxidative burst in vitro. Talanta. 78 (4-5), 1476-1483 (2009).
- Merritt, J. H., Kadouri, D. E., O'Toole, G. A. Growing and analyzing static biofilms. Current Protocols in Microbiology. , Chapter 1 Unit 1B 1 (2005).
- Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. 412, 15-20 (2007).
- Zhou, L., et al. Impact of human granulocyte and monocyte isolation procedures on functional studies. Clinical and Vaccine Immunology. 19 (7), 1065-1074 (2012).
- Quach, A., Ferrante, A. The application of dextran sedimentation as an initial step in neutrophil purification promotes their stimulation, due to the presence of monocytes. Journal of Immunology Research. 2017, 1254792(2017).
- Karlsson, A., Nixon, J. B., McPhail, L. C. Phorbol myristate acetate induces neutrophil NADPH-oxidase activity by two separate signal transduction pathways: dependent or independent of phosphatidylinositol 3-kinase. Journal of Leukocyte Biology. 67 (3), 396-404 (2000).
- Staats, A., et al. Rapid aggregation of Staphylococcus aureus in synovial fluid is influenced by synovial fluid concentration, viscosity, and fluid dynamics, with evidence of polymer bridging. mBio. , 0023622(2022).
- Chiu, I. M., et al. Bacteria activate sensory neurons that modulate pain and inflammation. Nature. 501 (7465), 52-57 (2013).
- Hartig, S. M. Basic image analysis and manipulation in ImageJ. Current Protocols in Molecular Biology. 102 (1), 14-15 (2013).
- Heydorn, A., et al. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146 (10), 2395-2407 (2000).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Luo, T. L., et al. Introducing BAIT (Biofilm Architecture Inference Tool): a software program to evaluate the architecture of oral multi-species biofilms. Microbiology. 165 (5), 527-537 (2019).
- Naves, P., et al. Measurement of biofilm formation by clinical isolates of Escherichia coli is method-dependent. Journal of Applied Microbiology. 105 (2), 585-590 (2008).
- Eze, E. C., El Zowalaty, M. E. Combined effects of low incubation temperature, minimal growth medium, and low hydrodynamics optimize Acinetobacter baumannii biofilm formation. Infection and Drug Resistance. 12, 3523-3536 (2019).
- Harris, L. G., Tosatti, S., Wieland, M., Textor, M., Richards, R. G. Staphylococcus aureus adhesion to titanium oxide surfaces coated with non-functionalized and peptide-functionalized poly(L-lysine)-grafted-poly(ethylene glycol) copolymers. Biomaterials. 25 (18), 4135-4148 (2004).
- Miao, J., et al. Biofilm formation of Staphylococcus aureus under food heat processing conditions: first report on cml production within biofilm. Scientific Reports. 9 (1), 1312(2019).
- Lade, H., et al. Biofilm formation by Staphylococcus aureus clinical isolates is differentially affected by glucose and sodium chloride supplemented culture media. Journal of Clinical Medicine. 8 (11), 1853(2019).
- Guzel Kaya, G., et al. Antibacterial activity of linezolid against gram-negative bacteria: utilization of epsilon-Poly-l-Lysine capped silica xerogel as an activating carrier. Pharmaceutics. 12 (11), 1126(2020).
- Clinton, A., Carter, T. Chronic wound biofilms: pathogenesis and potential therapies. Laboratory Medicine. 46 (4), 277-284 (2015).
- Scheel-Toellner, D., et al. Reactive oxygen species limit neutrophil life span by activating death receptor signaling. Blood. 104 (8), 2557-2564 (2004).
- Pestrak, M. J., et al. Pseudomonas aeruginosa rugose small-colony variants evade host clearance, are hyper-inflammatory, and persist in multiple host environments. PLoS Pathogens. 14 (2), 1006842(2018).
- Guerra, F. E., et al. Staphylococcus aureus SaeR/S-regulated factors reduce human neutrophil reactive oxygen species production. Journal of Leukocyte Biology. 100 (5), 1005-1010 (2016).
- Suo, Y., Huang, Y., Liu, Y., Shi, C., Shi, X. The expression of superoxide dismutase (SOD) and a putative ABC transporter permease is inversely correlated during biofilm formation in Listeria monocytogenes 4b G. PLoS One. 7 (10), 48467(2012).
- Olwal, C. O., Ang'ienda, P. O., Ochiel, D. O. Alternative sigma factor B (sigma(B)) and catalase enzyme contribute to Staphylococcus epidermidis biofilm's tolerance against physico-chemical disinfection. Scientific Reports. 9 (1), 5355(2019).
- Bhattacharya, M., et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing. Proceedings of the National Academy of Sciences of the United States of America. 115 (28), 7416-7421 (2018).
- Masuda, S., et al. NETosis markers: Quest for specific, objective, and quantitative markers. Clinica Chimica Acta. 459, 89-93 (2016).
- Dworsky, E. M., et al. Novel in vivo mouse model of implant related spine infection. Journal of Orthopaedic Research. 35 (1), 193-199 (2017).
- Pletzer, D., Mansour, S. C., Wuerth, K., Rahanjam, N., Hancock, R. E. New mouse model for chronic infections by gram-negative bacteria enabling the study of anti-infective efficacy and host-microbe interactions. mBio. 8 (1), 00140(2017).
- Davis, M. M. A prescription for human immunology. Immunity. 29 (6), 835-838 (2008).
- Mestas, J., Hughes, C. C. Of mice and not men: differences between mouse and human immunology. The Journal of Immunology. 172 (5), 2731-2738 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved