Method Article
בדיקות סטנדרטיות במבחנה כדי להמחיש ולכמת אינטראקציות בין נויטרופילים אנושיים לבין סטפילוקוקוס אאורוס ביופילמים
In This Article
Summary
הפרוטוקול הנוכחי מתאר את המחקר של אינטראקציות נויטרופיל-ביופילם. ביופילמים של Staphylococcus aureus מבוססים במבחנה ודוגרים עם נויטרופילים אנושיים שמקורם בדם היקפי. תגובת פרץ החמצון של נויטרופילים ניתנת לכימות, ולוקליזציה של הנויטרופילים בתוך הביופילם נקבעת על ידי מיקרוסקופיה.
Abstract
נויטרופילים הם קו ההגנה הראשון של מערכת החיסון במהלך זיהום מיקרוביאלי. in vivo, נויטרופילים מגויסים לאתר ההדבקה שבו הם משתמשים בתהליכים כגון פאגוציטוזה, ייצור של מיני חמצן וחנקן תגובתיים (ROS, RNS, בהתאמה), NETosis (מלכודת נויטרופילים חוץ-תאיים) ודגרנולציה כדי להרוג מיקרובים ולפתור את הזיהום. אינטראקציות בין נויטרופילים למיקרובים פלנקטוניים נחקרו בהרחבה. בשנים האחרונות מתעוררים תחומי עניין בחקר זיהומים הנגרמים על ידי ביופילמים. ביופילמים מפגינים תכונות, כולל עמידות להרג על ידי נויטרופילים, הנבדלות ממקביליהם שגודלו בפלנקטונים. עם ההקמה המוצלחת של מודלים של ביופילם במבחנה ו-in vivo , ניתן כעת לחקור אינטראקציות בין הקהילות המיקרוביאליות האלה עם תאי חיסון שונים. כאן, טכניקות המשתמשות בשילוב של מודלים מסורתיים של ביופילם ומבחני פעילות נויטרופילים מבוססים היטב מותאמות במיוחד לחקר אינטראקציות נויטרופילים וביופילם. מיקרוסקופיה פלואורסצנטית רחבת שדה משמשת לניטור לוקליזציה של נויטרופילים בביופילמים. ביופילמים אלה גדלים בתנאים סטטיים, ולאחר מכן תוספת של נויטרופילים שמקורם בדם היקפי אנושי. הדגימות מוכתמות בצבעים מתאימים לפני ההדמיה תחת המיקרוסקופ. בנוסף, הייצור של ROS, שהוא אחד מתגובות נויטרופילים רבות נגד פתוגנים, מכמת בנוכחות ביופילם. הוספת תאי מערכת החיסון למערכת מבוססת זו תרחיב את ההבנה של אינטראקציות פונדקאי-פתוגן תוך הבטחת השימוש בתנאים סטנדרטיים וממוטבים למדידת תהליכים אלה במדויק.
Introduction
ביופילם הוא קהילה של מיקרובים הקשורים לפני השטח או אגרגטים שאינם מחוברים העטופים בחומר פולימרי חוץ-תאי (EPS)1,2. קהילות אלה מגינות על המיקרואורגניזמים העטופים מפני גורמי עקה סביבתיים, כולל עמידות לחומרים אנטי-מיקרוביאליים ולמערכת החיסון3. מספר מינים מיקרוביאליים פתוגניים יוצרים ביופילמים שנקשרו לזיהומים כרוניים4. פיתוח ביופילמים הוא תהליך מורכב הכולל חיבור למשטחים, ייצור EPS, התפשטות תאים, מבנה ביופילם וניתוק תאים5. ברגע שהתאים מתפזרים ויוצרים ביופילם, הם נשארים פלנקטוניים או עוברים טרנסלוקציה לתת-שכבה חדשה ומתחילים מחדש את פיתוח הביופילם6.
Staphylococcus aureus, פתוגן אופורטוניסטי, עוקב אחר תוכנית כללית של התפתחות ביופילם, כולל התקשרות, התפשטות, התבגרות ופיזור7. תהליך ההתקשרות בביופילמים של S. aureus מוכתב על ידי אינטראקציות הידרופוביות, חומצות טייכיות ורכיבי פני שטח מיקרוביאליים המזהים מולקולות מטריצת דבק (MSCRAMMs)8,9. עם התפשטות של S. aureus מתחיל, EPS, אשר מורכב בעיקר פוליסכרידים, חלבונים, DNA חוץ-תאי, וחומצות teichoic, מיוצר5. כאשר רכיבי EPS מיוצרים, נוצרים גם אקסואנזימים שונים ומולקולות קטנות, מה שתורם למבנה התלת-ממדי של הביופילם ומסייע בניתוק5. S. aureus מנצל את אורח החיים המתואם הזה כדי לבסס זיהומים כרוניים שונים, כולל זיהומים עקב החדרת מכשירים רפואיים10.
עמיד למתיצילין S. aureus (MRSA) הוא אחד הגורמים המובילים לזיהומים הקשורים למכשירים רפואיים שוכנים, כגון צנתרים ורידיים מרכזיים ומשתנים, מפרקים תותבים, קוצבי לב, מסתמי לב מכניים והתקנים תוך רחמיים11. במהלך זיהומים כאלה, נויטרופילים הם תאי החיסון המארחים הראשונים שגויסו לאתר הזיהום כדי להילחם בפתוגנים באמצעות אסטרטגיות מרובות12. אלה כוללים פאגוציטוזה, דה-גרנולציה, ייצור חמצן תגובתי וחנקן (ROS/RNS), או שחרור של מלכודות נויטרופיליות חוץ-תאיות (NETs) לחיסול פתוגנים13.
יצירת ROS על פאגוציטוזה של מיקרובים היא אחת התגובות האנטי-מיקרוביאליות העיקריות שמפגינים נויטרופילים14. Phagocytosis משופרת אם חיידקים מצופים אופסונינים, במיוחד אימונוגלובולינים ורכיבים משלימים הנמצאים בסרום15. המיקרובים האופסונליים מזוהים על ידי קולטני פני השטח של התא על נויטרופילים ונבלעים, ויוצרים תא שנקרא פאגוזום15. נויטרופילים מייצרים ומשחררים ROS בפאגוזום באמצעות NADPH-אוקסידאז16 הקשור לממברנה. קומפלקס אנזימים רב-רכיבי זה מייצר אניוני סופראוקסיד על ידי העברת אלקטרונים לחמצן מולקולרי16. בנוסף, נויטרופילים גם מייצרים RNS באמצעות ביטוי של סינתאז תחמוצת החנקן (iNOS)17. לרדיקלים הגבוהים האלה של סופראוקסיד ותחמוצת החנקן בתוך הפאגוזום יש פעילות אנטי-בקטריאלית רחבה. הם יכולים לקיים אינטראקציה עם מרכזי מתכת באנזימים ולפגוע בחומצות גרעין, חלבונים וקרומי תאים של הפתוגן 18,19,20,21. מיקרובים רבים מאמצים אורח חיים של ביופילם ומשתמשים באסטרטגיות שונות כדי להתחמק מהרג על ידיROS 22,23. לפיכך, בדיקות סטנדרטיות כי זוג ביופילמים עם נויטרופילים כדי לכמת ROS מועילים לתוצאות עקביות.
בעוד שמבחנים, כגון כימות ייצור ROS של נויטרופילים, מספקים מידע על תגובות של נויטרופילים לביופילמים, היכולת לדמיין את האינטראקציות של נויטרופילים בתוך ביופילם יכולה לשמש גם ככלי רב עוצמה. השימוש בצבעים פלואורסצנטיים למיקרוסקופיה דורש לעתים קרובות אופטימיזציה כדי להשיג תמונות באיכות גבוהה שניתן להשתמש בהן לניתוח הדמיית מיקרוסקופיה. הגמישות לייעל תנאים מסוימים מוגבלת מכיוון שנויטרופילים יכולים לעבור מוות תאי לאחר הבידוד. יתר על כן, ביופילמים נשטפים בדרך כלל כדי להסיר את האוכלוסייה הפלנקטונית ממערך הניסויים לפני הוספת נויטרופילים. בזמן השטיפה, שונות בין ביופילמים משוכפלים עשויה להיווצר עקב אובדן ביומסה חלקית אם ביופילמים נדבקים באופן רופף לפני השטח.
באופן כללי, השיטות הקיימות כיום בתחום לניתוח אינטראקציות בין נויטרופילים לביופילמים כוללות בעיקר מיקרוסקופיה, ציטומטריה של זרימה ויחידות יוצרות מושבה (CFU) המונה24,25,26,27. מיקרוסקופיה כוללת שימוש בצבעים שמכתימים ישירות את הנויטרופילים והביופילמים, או מכוונים לתגובות נויטרופילים שונות נגד מיקרובים כגון היווצרות NET, דה-גרנולציה ומוות תאי25,28. תת-קבוצה של תגובות אלה, כגון מוות של תאי נויטרופילים ודה-גרנולציה, ניתנת לניתוח גם באמצעות ציטומטריה של זרימה, אך דורשת שנויטרופילים לא יהיו קשורים באופן מועדף לאגרגטים גדולים של מיקרובים בביופילם28,29. ציטומטריה של זרימה יכולה גם לכמת כמה פרמטרים של ביופילם, כגון כדאיות התא27. עם זאת, תהליכים אלה דורשים שיבוש של הביומסה של הביופילם ולא יהיה שימושי כדי לדמיין אינטראקציות חשובות אחרות כגון ההתפלגות המרחבית של נויטרופילים ומרכיביהם בתוך ביופילם27,29,30.
הפרוטוקול הנוכחי מתמקד בהתאמת חלק מהשיטות המסורתיות המשמשות לחקר אינטראקציות נויטרופילים-ביופילם על ביופילמים שעברו אופטימיזציה כדי לספק שונות מינימלית במהלך הטיפול. פרוטוקול זה מספק אפוא שיטות סטנדרטיות לגידול וכימות ביופילמים, בידוד נויטרופילים אנושיים ראשוניים מדם היקפי, כימות ייצור ROS והדמיה של אינטראקציות ביופילם-נויטרופילים באמצעות מיקרוסקופיה. פרוטוקול זה יכול להיות מותאם למערכות שונות כדי להבין אינטראקציות ביופילם-נויטרופילים תוך התחשבות בהטרוגניות בין מאגרי התורמים.
Protocol
כל ההליכים אושרו על ידי מועצת הביקורת המוסדית של אוניברסיטת אוהיו (IRB) (2014H0154). הסכמה מדעת בכתב התקבלה מכל התורמים לאיסוף דם היקפי לבידוד נויטרופילים אנושיים ראשוניים. סטפילוקוקוס אאורוס (USA300 LAC)31 שימש כאורגניזם המודל לביצוע הניסויים. הניסויים בוצעו עם ציוד מגן אישי מתאים (PPE) עקב חשיפה פוטנציאלית לפתוגן הנישא בדם.
1. הכנת ביופילם במבחנה
- השג מושבות מבודדות של S. aureus ממלאי בהקפאה 31 באמצעות טכניקת לוח פסים32,33 על צלחת אגר עשירה בחומרים מזינים, כגון אגר סויה טריפטית (ראו טבלת חומרים).
- מצפים בארות בודדות של צלחת 96 בארות עם 100 μL של 0.001% (v/v) poly-L-Lysine (PLL) מדולל ב H2O סטרילי דגירה בטמפרטורת החדר במשך 30 דקות. באופן אספטי, שאף את פתרון ה- PLL באמצעות מלכודת שאיפה בסיוע ואקום. תנו לבארות להתייבש למשך הלילה בטמפרטורת החדר.
הערה: כל שלבי השאיפה בפרוטוקול מבוצעים באמצעות מלכודת שאיפה בסיוע ואקום, אלא אם כן צוין אחרת. - הכינו תרבית לילה על ידי חיסון מושבה של S. aureus במדיה חיונית מינימלית אלפא (MEMα) בתוספת 2% גלוקוז ודגירה ב 37 מעלות צלזיוס, רועד ב 200 סל"ד במשך 16-18 שעות.
- לדלל את תרבית הלילה על ידי העברת 50 μL ל-5 מ"ל של MEMα טרי בתוספת 2% גלוקוז ודגירה ב-37 מעלות צלזיוס, טלטול ב-200 סל"ד, עד לאמצע השלב הלוגריתמי, בדרך כלל בין צפיפות אופטית 600 (OD600nm) של 0.5-0.8. השתמש ב-MEMα כדי לנרמל את התרבות הלוגריתמית האמצעיתל-OD 600nm של 0.1.
- העבר 150 μL של תרבית מנורמלת לכל באר של צלחת PLL שטופלה 96 באר. דגירה סטטית במשך 18-20 שעות בתא לחות ב 37 מעלות צלזיוס.
הערה: ניתן לגדל את הביופילמים גם בתבניות אחרות כגון שקופיות μ ערוצים (ראה טבלת חומרים). - שאפו את הסופרנטנט כדי להסיר את התאים הפלנקטוניים. יש לשטוף בעדינות את הביומסה שנותרה עם 150 μL של תמיסת המלח המאוזנת (HBSS) של הנקס כדי להסיר את התאים שאינם מחוברים. יש להוסיף HBSS באופן טיפה כדי למנוע הפרעה לביופילם.
הערה: בזמן שאתם שואפים את הסופרנטנט וה-HBSS במהלך השטיפה, השאירו מספיק נוזלים (סופרנטנט או HBSS) בבארות המכילות ביופילם, כך שהביופילם עדיין שקוע. זה מונע את ההפרעה של מבנה הביופילם כאשר מוסיפים HBSS טיפה כדי לשטוף את הביופילם. - חזור על שלב 1.6 לפחות פעמיים נוספות כדי להסיר את כל התאים הפלנקטוניים. בשלב זה, ביופילמים מוכנים לניסויים מיידיים במורד הזרם.
הערה: אם הביופילמים אינם משמשים לניסויים בנויטרופילים, HBSS יכול להיות מוחלף בתמיסת מלח עם אגירת פוספט (PBS). HBSS מועדף על פני PBS מכיוון ש-HBSS מכיל רכיבים, כולל גלוקוז, המספקים תנאים אופטימליים להפעלת נויטרופילים34.
2. כימות ביומסה של ביופילם
- הכינו מלאי של תמיסת קריסטל ויולט (CV) של 0.1% (w/v) (ראו טבלת חומרים) על ידי המסת 20% (v/v) אתנול ו-80% (v/v) H2 O. ודאו שה-CV מומס לחלוטין באתנול לפני הוספת H2O. סננו ועקרו את התמיסה.
- יש להוסיף 150 μL של תמיסת CV של 0.1% לביופילם השטוף ולדגירה למשך 20 דקות בטמפרטורת החדר. השתמש בלפחות שלוש בארות ריקות כפקדי מדיה בלבד.
- שאפו את תמיסת CV של 0.1% מהביופילמים ושטפו את הביופילמים המוכתמים עם 200 μL של PBS אחד. חזור על תהליך זה בסך הכל שלוש שטיפות כדי להסיר כל קורות חיים עודפים מהבארות.
- יש להוסיף 150 μL של 33% (v/v) חומצה אצטית קרחונית מדוללת ב-H2O. דגירה בטמפרטורת החדר על נדנדה ב-50 סל"ד למשך 30 דקות כדי לאפשר ל-CV הקשור לביומסה להתמוסס לחלוטין.
התראה: בצע שלב זה במכסה מנוע זרימה למינרית עם PPE מתאים מכיוון שחומצה אצטית קרחונית היא כימיקל קורוזיבי. - בינתיים, הגדר את קורא המיקרו-לוחות (ראה טבלת חומרים) כדי לקרוא את ערכי כתמי קורות החיים. לאחר טיפול בחומצה אצטית קרחונית, יש לקרוא את הצלחת באורך גל של 595 ננומטר.
הערה: אורך הגל המשמש למדידת OD של CV יכול לנוע בין 500-600 ננומטר35.
3. בידוד נויטרופילים
הערה: נויטרופילים בודדו בעקבות שיטה שפורסמה בעבר עם שינויים קלים36. פרוטוקול בידוד זה משלב תחילה צנטריפוגה הדרגתית של צפיפות, ואחריה שקיעה דקסטרנית של 3%. חלק זה מכסה רק את פרוטוקול בידוד הנויטרופילים הכולל, תוך התמקדות בשינויים שבוצעו בפרוטוקול שפורסם. יתר על כן, הפרוטוקול המפורט להלן הוא אחת מהשיטות הרבות שיכולות לבודד נויטרופילים, וניתן להחליף אותן לפי הצורך. שיטות אחרות לבידוד נויטרופילים כוללות שימוש במדיה להפרדת תאים או הפרדת תאים מגנטית37.
- שאיבת דם מתורם מבוגר באמצעות דיקור ורי, בהתאם לפרוטוקול המפורט ב- IRB המוסדי. לפני שאיבת הדם, יש לוודא כי המזרק מכיל כמות מספקת של הפרין ללא חומרים משמרים, כך שהריכוז הסופי של הפרין הוא 20 U/mL.
- לדלל את הדם ההיפריני עם 3/4 נפח של 0.9% NaCl ללא אנדוטוקסין (ראה טבלת חומרים) ב- H2O בטמפרטורת החדר.
- עבור כל 20 מ"ל של דגימת הדם המדוללת, aliquot 14 מ"ל של מדיום גרדיאנט צפיפות זמין מסחרית (ראה טבלת חומרים) בצינור חרוטי טרי של 50 מ"ל. שכבה בזהירות את דגימת הדם המדוללת על גבי מדיום שיפוע הצפיפות.
- צנטריפוגה דגימת דם שכבתית ב 400 x גרם במשך 40 דקות בטמפרטורת החדר. ודא שלצנטריפוגה יש הפסקה איטית כדי למנוע הפרעה לשכבה לאחר השלמת הצנטריפוגה.
הערה: דגימת הדם תכלול חמש שכבות המכילות תערובת של מלח ופלזמה, שכבת תאים חד-גרעינית, מדיום גרדיאנט צפיפות, נויטרופילים ואריתרוציטים. - באמצעות פיפטה סרולוגית, שאפו את כל השכבות שמעל הנויטרופילים וכדורית כדורית כדורית הדם, ולאחר מכן הרחקה עדינה של הכדור ב 0.9% NaCl ללא אנדוטוקסין קר ב H2O. עבור כל כדור שנוצר מדגימת דם של 20 מ"ל, החזירו את הכדור לנפח כולל של 20 מ"ל. הוסף נפח 1:1 של 3% דקסטרן (ראה טבלת חומרים). לדגור את הצינור זקוף במשך 18-20 דקות על קרח.
הערה: ודא כי 3% dextran נעשה עם 0.9% NaCl ללא אנדוטוקסין ב H2O. - הסר 20 מ"ל של השכבה העליונה המכילה נויטרופילים וכמה אריתרוציטים על צינור חרוטי חדש של 50 מ"ל וצנטריפוגה אותו ב 355 x גרם במשך 10 דקות ב 4 מעלות צלזיוס. יוצקים את הסופר-נאטנט ומשאירים אחריו כדור אדום.
- בעדינות להשהות את הכדור ב 10 מ"ל של קר סטרילי H2O במשך 30 שניות כדי lyse את אריתרוציטים הנותרים. הוסיפו מיד 10 מ"ל של מי מלח קרים נטולי אנדוטוקסין 0.9% לתערובת כדי להחזיר את הטוניקה. צנטריפוגה הפתרון ב 233 x g במשך 3 דקות ב 4 מעלות צלזיוס.
- יש לשפוך את הסופר-נטנט ולהשהות את הכדור המכיל 95%-97% נויטרופילים ב-HBSS קר של 1 מ"ל לכל 20 מ"ל של דגימת הדם.
- מעבירים 10 μL מהנויטרופילים המחיים ב-90 μL של 0.4% צבע כחול טריפאן וסופרים את התאים באמצעות המוציטומטר (ראו טבלת חומרים).
הערה: תאים שאינם בני קיימא מוכתמים בכחול מכיוון שצבע הרחקה כחול טריפאן הוא אטום בתאים בני קיימא. פרוטוקול זה מספק >99% כדאיות תאים37,38. - הוסף HBSS נוסף כך שהריכוז הסופי של נויטרופילים הוא 4 x 106 תאים למ"ל.
הערה: במקרים עם כדאיות תאים של <99%, עדיין ניתן להשיג את הריכוז הסופי של 4 x 106 תאים למ"ל; עם זאת, הנפח הכולל של תמיסה המכילה 4 x 106 תאים / מ"ל המתקבל יקטן. ניתן להתאים את הריכוז הסופי של נויטרופילים בהתאם לצרכי הניסוי של המשתמש. הנויטרופילים הוחזרו בריכוז סופי של 4 x 106 תאים /מ"ל עבור כל הניסויים המתוארים להלן. כדי לקחת בחשבון את השונות בין תורם לתורם, מומלץ מאוד שכל הניסויים המעורבים בנויטרופילים יבוצעו עם לפחות שלושה תורמים שונים.
4. מדידת ROS המיוצרת על ידי נויטרופילים
- יש להוסיף 100 μL של 20% סרום אנושי רגיל (מדולל ב-HBSS) באופן טיפה לביופילם השטוף (שלב 1.6) ולדגור בטמפרטורה של 37°C במצב סטטי למשך 30 דקות כדי להפוך את הביופילם לאופטימאלי.
- שאפו את תמיסת הסרום ב-20% ושטפו את הביופילמים עם 150 מיקרוגרם של HBSS פעם אחת. שאפו את ה-HBSS, והותירו אחריהם בארות עם ביופילמים מאופרים.
הערה: לצורך פענוח הניסוי, מומלץ לפחות ארבע קבוצות: (A) נויטרופילים + ביופילם, (B) נויטרופילים + PMA (בקרה חיובית, ראו טבלת חומרים), (C) נויטרופילים בלבד, ו-(D) ביופילם בלבד. - הוסף לומינול (ראו טבלת חומרים) לנויטרופילים שעברו החייאה ב-HBSS בריכוז של 4 x 106 תאים /מ"ל, כך שריכוז הלומינול הסופי הוא 50 מיקרומטר. פתרון זה מוכן לשימוש עבור קבוצות (A) ו- (C). הוסף 4 x 105 נויטרופילים מעורבבים עם לומינול לבארות עם ביופילמים opsonized.
- בצינור נפרד, הכינו תמיסת לומינול של 50 מיקרומטר ב-HBSS ללא נויטרופילים והוסיפו אותה לביופילם המכיל היטב (קבוצה D).
- Aliquot 350 μL של נויטרופילים מעורבבים עם לומינול ומוסיפים פורבול 12-myristate 13-אצטט (PMA) בריכוז סופי של 500 ng/mL לתערובת. עבור קבוצה (B), הוסף 4 x 105 נויטרופילים מתערובת זו לבארות ללא ביופילם. זה משמש שליטה חיובית.
הערה: ריכוז ה-PMA המצוין בשלב זה גבוה יחסית כדי להבטיח תגובת פרץ חזקה מכיוון שנויטרופילים מעוררי PMA הם שליטה חיובית. ניתן להשתמש ב-PMA בריכוז נמוך יותר כדי להפעיל נויטרופילים, בהתאם לניסוי. - צנטריפוגה את הצלחת ב 270 x גרם במשך 30 שניות ב 4 מעלות צלזיוס.
- ודא שקורא הלוחות מוגדר ל-37 מעלות צלזיוס יחד עם ההגדרה לזוהר וקריאה קינטית למשך 60 דקות במרווחים של 3 דקות. הניחו את הצלחת בקורא הצלחות כדי למדוד את ייצור ה-ROS על ידי נויטרופילים למשך 60 דקות.
הערה: עבור בדיקה זו, ביופילמים גודלו בלוחות לבנים המשמשים לבדיקות זוהר. PMA הוא אגוניסט ידוע לתגובת פרץ חמצונית39. בעת ביצוע מחקרים הכוללים PMA, ודא כי PMA מתווסף בשלב הסופי בזמן שהתמיסה המכילה נויטרופילים קרה מכיוון ש- PMA יוזם מיד את תגובת ההתפרצות.
5. הדמיית אינטראקציות ביופילם-נויטרופילים
- הגדר ביופילם באמצעות שלבים 1.2-1.6. כדי להקל על הדמיית ביופילם, השתמשו בזן פלואורסצנטי של S. aureus, כגון USA300 המבטא חלבון פלואורסצנטי ירוק (GFP)40,41, כדי להגביר את הקלות של הדמיית מיקרוסקופיה.
הערה: נעשה שימוש בשקופית בת 6 μ ערוצים (ראה טבלת חומרים) במקום בלוח של 96 בארות כדי להדגים את מודל הביופילם במבחנה (שלב 1). - דגירה של 4 x 106 תאים /מ"ל של נויטרופילים עם 100 מיקרומטר של צבע CMAC כחול (7-אמינו-4-כלורומתילקומרין) (BCD, ראו טבלת חומרים) למשך 30 דקות בנדנדה בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2. ודא שהדגימות דוגרות בחושך והגבל את החשיפה לאור בצעדים הנותרים.
- כדי לשטוף עודף BCD, נויטרופילים צנטריפוגה ב 270 x גרם במשך 5 דקות ולשאוף supernatant. יש להשעות את הנויטרופילים ב-HBSS טרי. בשלב זה, הוסיפו אתידיום הומודימר-1 (ראו טבלת חומרים) לנויטרופילים המוכתמים ב-BCD בריכוז סופי של 4 מיקרומטר כדי לנטר נויטרופילים ומוות חיידקי.
- הוסף 150 μL של נויטרופילים לביופילם S. aureus שגדל בשקופיות μ, כך שיחס הנויטרופילים לחיידקים הוא 1:30 (נויטרופיל: חיידקים). דגרו את מגלשות μ בתא לח למשך 30 דקות. מספר תאי החיידקים מבוסס על ספירות התאים המתקבלות מציפוי ביופילם של 18 שעות.
- דמיינו את האינטראקציה בין נויטרופיל לביופילם באמצעות תעלות פלואורסצנטיות המתאימות לאורכי הגל של העירור והפליטה של הצבעים/חלבונים הפלואורסצנטיים.
הערה: עבור המחקר הנוכחי, BCD הוא 353/466 ננומטר, אתידיום הומודימר-1 הוא 528/617 ננומטר, ו- GFP הוא 395/509 ננומטר. הגבל את החשיפה של הדגימה ללייזר או לאור כדי למנוע הלבנה של הדגימות. - נתח את התמונות באמצעות תוכנות ניתוח תמונות מיקרוסקופיה או תוכנות כגון FIJI / ImageJ, COMSTAT2, BiofilmQ ו- BAIT, ביןרבים אחרים 42,43,44,45.
הערה: כאשר עובדים עם כתמים, חשוב לקחת בחשבון את הספציפיות של הצבעים בשימוש. חלק מהכתמים פועלים על תאים פרוקריוטים ואאוקריוטים, בעוד שאחרים עובדים רק על אחד. אם נויטרופילים וביופילמים מוכתמים בנפרד באמצעות צבעים שיכולים להכתים את שני סוגי התאים, הקפידו לשטוף את כל הצבעים שנותרו לפני שילוב של נויטרופילים וביופילמים כדי למנוע צביעה צולבת.
תוצאות
המדיה המשמשת לגידול ביופילמים חיידקיים משפיעה על הישרדותם של נויטרופילים. מדיות שונות נבדקו כדי להפחית את ההשפעה של מדיה בלבד על הכדאיות של נויטרופילים לחקר אינטראקציות נויטרופיל-ביופילם (איור 1). מדיית צמיחה חיידקית כגון מרק סויה טריפטי ממזערת את הכדאיות של נויטרופילים, כך ש~ 60% מהנויטרופילים חיים לאחר תקופת דגירה של 30 דקות ב -37 מעלות צלזיוס עם 5% CO2. מדיה של תרביות תאים של יונקים, כגון MEMα, אינה משפיעה על הכדאיות של נויטרופילים ותומכת בצמיחה של ביופילמים של S. aureus. למעשה, מדיה מינימלית מקדמת צמיחה חזקה של ביופילמים בחיידקים אחרים46,47.
כדי להעריך את השפעת המדיה על גדילת הביופילם ואת השונות בכימות הביומסה של ביופילם לאחר שטיפת הביומסה כדי לחסל תאים פלנקטוניים, גדל ביופילם של 18 שעות S. aureus בצלחת של 96 בארות, כאשר בארות טופלו או לא טופלו בפולי-ל-ליזין. במדיה עשירה בחומרים מזינים (מרק סויה טריפטי (TSB)) ובמדיה מינימלית (MEMα) נעשה שימוש כפי שהוא או בתוספת 2% גלוקוז. הביומסה של הביופילם שהוכתמה ב-CV גילתה שביופילם S. aureus שגדל ב-MEMα בתוספת 2% גלוקוז הפיק את הביופילם החזק ביותר מבין כל המדיות שנבדקו (איור 2A). יתר על כן, ביופילמים שגודלו בבארות PLL שטופלו מראש המכילות MEMα + 2% גלוקוז הראו שונות פחותה מאשר ביופילמים בבארות לא מטופלות PLL המכילות MEMα + 2% גלוקוז. ביופילמים אלה הראו פחות שונות בכימות באמצעות בדיקת CV35 וה-CFU/mL כאשר הם מצופים לאחר טיפול מדויק בביופילמים לכימות ביומסה. הביופילמים האלה הכילו, בממוצע, 1 x 108 CFU/mL, כפי שהוכח על-ידי ציפוי הביופילמים בשלושה ימים נפרדים (איור 2B). מספר זה שימושי בקביעת מספר הנויטרופילים שיש להוסיף לביופילמים עבור מבחני פונקציונליות נויטרופילים.
כדי למדוד את ייצור ה-ROS על ידי נויטרופילים בתגובה לביופילמים, הביופילמים של S. aureus גודלו באופן סטטי במשך 18-20 שעות בלוח של 96 בארות. לאחר מכן נוספו ביופילמים, ונוספו נויטרופילים. לאחר מכן נמדד ייצור ROS במשך 60 דקות (איור 3A). השטח שמתחת לעקומה מחושב מהעקומה הקינטית כדי לכמת את סך ייצור ה-ROS על ידי נויטרופילים. נויטרופילים המטופלים באגוניסט, כגון PMA, המשמשים כבקרה, מראים ייצור ROS מוגבר. בהיעדר ביופילמים, נויטרופילים שטופלו ב-PMA הראו ייצור ROS חזק. בנוכחות ביופילם S. aureus , הייצור הכולל של ROS על ידי נויטרופילים שטופלו ב- PMA ירד. בהיעדר PMA, נויטרופילים מסתמכים אך ורק על האינטראקציה שלהם עם הביופילם, מה שמפחית עוד יותר את כמות ה-ROS המיוצרת (איור 3B).
כדי להמחיש את יחסי הגומלין בין נויטרופיל לביופילם באמצעות מיקרוסקופיה פלואורסצנטית, נעשה שימוש בזן המבטא GFP של S. aureus, צבע CMAC כחול ואתידיום הומודימר-1, המכתיים את הציטופלסמה של תאים חיים ודנ"א של תאים מתים, בהתאמה. הביופילם S. aureus גודל במשך 18 שעות בשקופית של 6 μ ערוצים. נויטרופילים המסומנים בצבע כחול CMAC נוספו יחד עם אתידיום הומודימר-1 לביופילמים השטופים והודגרו במשך 30 דקות בטמפרטורה של 37 מעלות צלזיוס עם 5% CO2 לפני ההדמיה. מיקרוסקופיה פלואורסצנטית רחבת שדה גילתה שנויטרופילים רבים היו ממוקמים על פני השטח של ביופילמים מסוג S. aureus, בעוד שכמה מהם נמצאים בתוך הביופילם (איור 4A). האינטראקציה בין תאי S. aureus בתוך נויטרופילים נראתה גם היא (איור 4C). רוב תאי S. aureus שקיימו אינטראקציה עם נויטרופילים (ציאן) היו מתים (מגנטה), בעוד שכמה מהם נשארו חיים (צהובים) כפי שנקבע על-ידי צביעת מתים חיים (איור 4C). לשם השוואה, ביופילמים של S. aureus המבטאים GFP הוכתמו באתידיום הומודימר-1, שחשף שבריר מאוכלוסיית S. aureus המתה בתוך הביופילם (איור 4B). נויטרופילים שאינם בני קיימא שהיו חיוביים לאתידיום הומודימר-1 כומתו באמצעות תוכנת אנליזה (ראו טבלת חומרים) לאחר דגירה עם ביופילמים של S. aureus. כ-48% מהנויטרופילים כבר היו מתים תוך 30 דקות מהדגירה עם ביופילם S. aureus. במהלך אופטימיזציה של פרוטוקול המיקרוסקופיה, הוערכה גם ההשפעה של שטיפת הביופילם והנויטרופילים לאחר 30 דקות של דגירה כדי להסיר נויטרופילים שאינם דבקים, וגילתה שכ-33% מהנויטרופילים המתים עדיין מחוברים לביופילם (איור 4D).
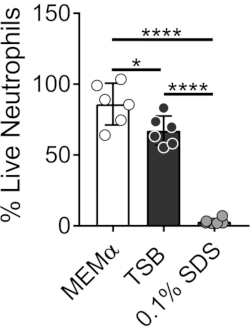
איור 1: בדיקת LIVE-DEAD משווה את הישרדות הנויטרופילים בין אמצעי גדילה של חיידקים ויונקים. נויטרופילים בודדו ודוגרו ב-HBSS, MEMα, TSB או 0.1% SDS במשך 30 דקות. אחוז הנויטרופילים החיים נקבע, כאשר נויטרופילים מודגרים של HBSS טופלו כ-100% נויטרופילים חיים. התוצאות מייצגות בממוצע שני ניסויים בלתי תלויים שבוצעו במשולש, כאשר נויטרופילים מתקבלים משני תורמים שונים. הנתונים מוצגים כממוצע ± SD (*p < 0.05, ****p < 0.0001. ANOVA חד כיוונית). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
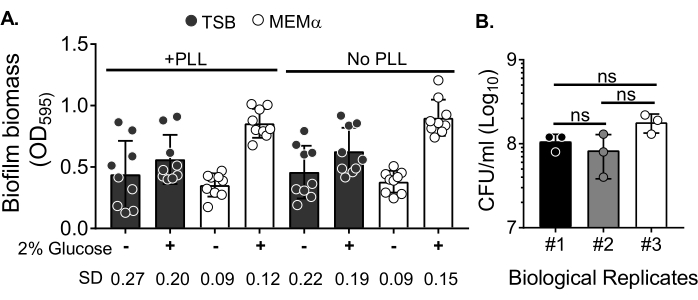
איור 2: כימות של ביומסה של ביופילם בתנאים שונים וספירת הכדאיות של חיידקים של ביופילמים שגדלו בתנאים הממוטבים. (A) S. aureus נזרע בצלחת בת 96 בארות מצופה או לא מצופה בפולי-ל-ליזין (PLL). ביופילמים גודלו ב-TSB, ב-MEMα או בכל אחד מחומרי ההדפסה בתוספת 2% גלוקוז בתנאים סטטיים במשך 18 שעות. צביעת קריסטל סגול (CV) בוצעה כדי להכתים ביומסה של ביופילם. כתם קורות החיים המלוטש דולל בשעה 1:10 ונקרא בקורא מיקרו-לוחית. התוצאות מייצגות בממוצע שלושה ניסויים בלתי תלויים שבוצעו במשולש. הנתונים מוצגים כממוצע ± SD. ה-SD של כל קבוצה מוצג בתחתית כדי להדגים שונות בתנאי הגידול של ביופילם. (B) ספירות CFU של חיידקים התקבלו מביופילמים שגודלו בתווך אופטימלי (MEMα + 2% גלוקוז). הביופילמים הסטטיים של 18 שעות היו נתונים למספר זהה של שטיפות ואחריהן סוניקציה של 10 דקות כדי לשחרר את הביומסה של הביופילם ועברו דרך מחט 22G כדי לשבש את האגרגטים לפני הציפוי. התוצאות מייצגות שלושה שכפולים המבוצעים במשולש. הנתונים מוצגים כממוצע ± SD (ns = לא משמעותי. ANOVA חד כיוונית). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
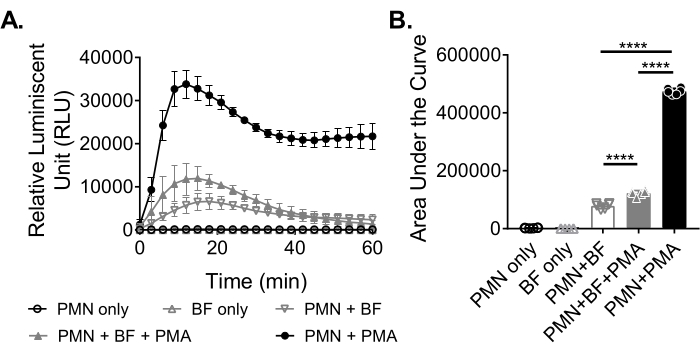
איור 3: כימות ייצור ROS על-ידי נויטרופילים באמצעות בדיקת כימילומינסנציה. (A) נויטרופילים (PMN) דוגרו עם ביופילמים מסוג S. aureus (BF) שנשטפו על ידי HBSS בנוכחות (משולש אפור סגור) או בהיעדר (משולש אפור הפוך פתוח) של PMA כדי למדוד את ייצור ROS על ידי נויטרופילים. Luminol שימש כדי לזהות ROS כל 3 דקות במשך 60 דקות בקורא microplate. בעוד שנויטרופילים שטופלו ב-PMA בהיעדר ביופילם (עיגול שחור סגור) שימשו כבקרה חיובית, קבוצות נויטרופילים בלבד (עיגול שחור פתוח) וביופילם בלבד (משולש אפור פתוח) שימשו כבקרות שליליות. הנתונים מייצגים בממוצע שני ניסויים בלתי תלויים שבוצעו במשולש עם נויטרופילים שהתקבלו משני תורמים שונים. הנתונים מוצגים כממוצע ± SD. (B) השטח שמתחת לעקומה מ-(A) חושב כדי לכמת את סך ה-ROS שנוצר על ידי הנויטרופילים. הנתונים מיוצגים כממוצע ± SD. (***p < 0.0001. ANOVA חד כיוונית). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
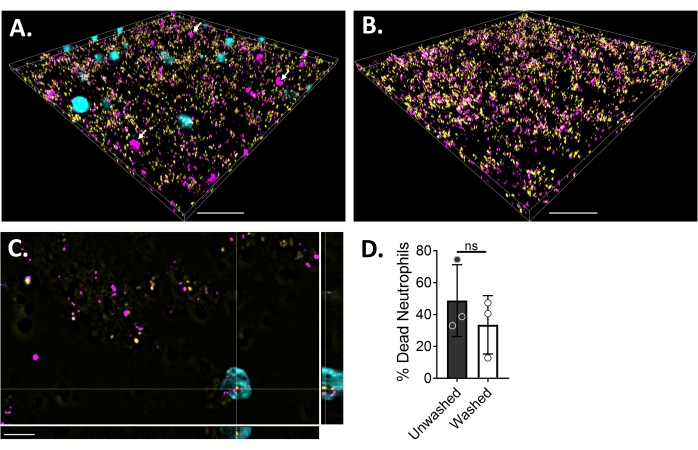
איור 4: הדמיה של האינטראקציה בין ביופילם S. aureus ונויטרופילים באמצעות מיקרוסקופיה פלואורסצנטית רחבת שדה. נויטרופילים המסומנים בצבע כחול CMAC (ציאן) נוספו עם אתידיום הומודימר-1 (מג'נטה; מת) לפני הדגירה עם ביופילם S. aureus באורך 18 שעות (צהוב). אינטראקציות ביופילם-נויטרופילים צולמו באמצעות מיקרוסקופיה פלואורסצנטית רחבת שדה ותמונות שעובדו באמצעות תוכנה לניתוח תמונות. ניסויים נערכו עם שלושה תורמים שונים. תמונות מייצגות מוצגות כ- (A) תצוגה תלת-ממדית של ביופילם S. aureus עם נויטרופילים חיים (ציאן) ומתים (מגנטה; כמה מהם מסומנים בחצים לבנים), (B) תצוגה תלת-ממדית של ביופילם S. aureus בהיעדר נויטרופילים עם S. aureus חי המבטא GFP (צהוב) או מת S. aureus מוכתם באתידיום הומודימר-1 (מגנטה), (C) מבט אורתוגונלי של S. aureus ואינטראקציה בין נויטרופילים כפי שהיא מתוארת במישורי xy, yz ו-xz, ו-(D) כימות של כדאיות נויטרופילים בנוכחות ביופילם S. aureus לאחר 30 דקות מיד (לא שטוף) או לאחר שלושה סבבים של שטיפות עם HBSS כדי להסיר נויטרופילים שאינם דבקים (שטפים). מוות תאי נויטרופילים מוצג כממוצע ± SD (מבחן t של התלמיד). סרגל קנה מידה מציין 50 מיקרומטר אינץ' (A) ו- (B) ו- 10 μm אינץ' (C). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
נעשו מאמצים רבים לגדל ביופילמים חזקים וניתנים לשחזור של S. aureus עבור ניסויים במורד הזרם במבחנה48,49,50. מתואר פרוטוקול סטנדרטי המנצל את האופי הקטיוני של PLL, כמו גם משלים את המדיה עם גלוקוז לצמיחה של ביופילמים חזקים במבחנה S. aureus. התוספת של PLL מאפשרת חיבור טוב יותר של תא החיידק הטעון שלילית למשטחים המצופים ב-PLL הטעונים חיובית. חשוב לציין כי ל-PLL בריכוז של 10 מיקרוגרם/מ"ל יש פעילות אנטי-בקטריאלית נגד פסאודומונס ארוגינוסה, Escherichia coli ו-S. aureus כאשר דגירה במשך 24 שעות51. אותו ריכוז משמש לציפוי משטחים; עם זאת, עודף PLL הוא שאפתן, מה שהופך את הריכוז של PLL נמוך מ 10 מיקרוגרם / מ"ל בעת זריעה לצמיחת ביופילם.
חשוב לציין ש-PLL עבד רק במדיות גדילה ספציפיות כמו MEMα עם 2% גלוקוז, שם נצפה ש-S. aureus ייצר ביופילמים חזקים עם שונות מינימלית (איור 2A). ריכוז PLL לשימוש בשילוב עם סוגי מדיה אחרים ידרוש אופטימיזציה נוספת, כגון שימוש בריכוז מוגבר של PLL כדי לצפות את הבארות. בנוסף, תנאים אלה הותאמו לביופילם מונו-מיני S. aureus. בעוד שביופילמים של פצעים כרוניים הם לעתים קרובות פולימיקרוביאליים, סטנדרטיזציה של מבחנים לחקר ביופילם מונו-מיני והאינטראקציות שלו עם נויטרופילים ותאי חיסון אחרים היא המפתח להבנת תרומתם לפתוגנזה52. פרוטוקולים סטנדרטיים אלה יכולים להיות ממוטבים עוד יותר כדי לקיים ולחקור ביופילמים פולימיקרוביאליים ואת האינטראקציות שלהם עם נויטרופילים.
כמו כן, נצפה כי מדיה עשירה של תרביות חיידקים, כגון TSB, הובילה לאובדן הכדאיות של נויטרופילים (איור 1). לכן, תנאי הגידול של ביופילמים של S. aureus ב-MEMα, המשמשים לתרביות תאים של יונקים, היו אופטימליים. עבור מחקרים המערבים נויטרופילים, מדיה זו תומכת בכדאיות הנויטרופילים ומקדמת את צמיחת S. aureus. אמנם נצפה כי התקשורת משפיעה על הכדאיות של נויטרופילים, חשוב גם לשקול כי נויטרופילים מבודדים מדם אנושי היקפי לעבור אפופטוזיס ex vivo עם כ 70% נויטרופילים אפופטוטיים על ידי 20 שעות53. זה מחייב טיפול נכון, כגון אחסון הנויטרופילים על הקרח בעת הכנה לניסויים, שימוש בריאגנטים נטולי אנדוטוקסין ומניעת הפעלה של נויטרופילים על ידי הימנעות ממערבולת של דגימות עם נויטרופילים.
ההערכה של פרץ חמצוני בנויטרופילים מבוצעת באופן שגרתי כדי לקבוע את השפעת ההרג של נויטרופילים על הפתוגן14,54,55. מחקרים אלה מבוצעים לעתים קרובות עם חיידקים פלנקטוניים שבהם מוסיפים נויטרופילים, ותגובת פרץ החמצון מכמתת באמצעות כימילומינסנציה מוגברת של לומינול המזהה אניונים סופראוקסיד המיוצרים על ידי נויטרופילים. הפרוטוקול הנוכחי משתנה על ידי החלפת חיידקים פלנקטוניים בביופילם S. aureus שגדל באופן סטטי 18 שעות. ככאלה, ניתן להוסיף נויטרופילים ישירות לביופילם כדי להעריך את הפעלתם. מצד שני, חיידקים בביופילמים מייצרים אנזימים, כגון קטלאז וסופראוקסיד דיסמוטאז כדי לנקות את ROS23,56 מרעלים. ביופילמים של סטפילוקוקוס אפידרמידיס מייצרים קטלאז גבוה יותר ממקבילו הפלנקטוני תחת לחץ57. הכימילומינסנציה הכוללת של נויטרופילים מגורה PMA בביופילם S. aureus נמוכה משמעותית מהנויטרופילים המגורה על-ידי PMA שבהם אין ביופילם (איור 2). ייתכן שהסיבה לכך היא פעילותם של אנזימים אלה לניקוי רעלים. יתר על כן, ביופילמים של S. aureus מייצרים מספר רעלנים יוצרי נקבוביות הנקראים לוקוצידינים שהורגים נויטרופילים58. תגובת ההתפרצות המופחתת נובעת ככל הנראה גם מהכדאיות המופחתת של נויטרופילים בנוכחות ביופילם S. aureus. בעוד שמחקר זה משתמש בלומינול המזהה את סך ה-ROS המיוצר הן בתוך התאים והן מחוצה להם, ריאגנטים אחרים, כגון CM-H 2 DCFDA (5-(ו-6)-כלורומתיל-2'7'-דיכלורודהידרופלואורסצין דיאצטט) או איזולומינול, צריכים להיחשב אם מטרת העבודה היא לחקור ייצור ROSתוך-תאי או חוץ-תאי14,53,54 באופן ספציפי.
היכולת לדמיין אינטראקציות נויטרופיל-ביופילם באמצעות מיקרוסקופיה יכולה להיות אינפורמטיבית על התנהגותם של נויטרופילים וביופילמים זה בנוכחות זה. ספקטרום העירור והפליטה של הצבעים והחלבונים הפלואורסצנטיים מייצג תמונת מצב של האינטראקציה בין ביופילם S. aureus באורך 18 שעות לבין נויטרופילים לאחר דגירה של 30 דקות. כדי ללכוד ביעילות אותות מתאים מוכתמים, חשוב להגביל את החשיפה של הדגימות למקורות אור תוך הגדרת הדגימות למיקרוסקופיה. בזמן ההדמיה, נמנעה הלבנה מהירה של הדגימות על ידי הורדת עוצמת מקור האור בעת התאמת כל הפרמטרים כגון גובה ערימת Z וזמן חשיפה לערוצים שונים.
שיטות העבודה הפשוטות האלה אפשרו הדמיה תקינה של מיקרוסקופיה שבה נצפה שמעט נויטרופילים ממוקמים בתוך הביופילם (איור 4A). ייתכן שהסיבה לכך היא חללים שנמצאים בתוך הביופילם, שכן ביופילם S. aureus שגדל ב-18 שעות ב-MEMα עם 2% גלוקוז אינו מכסה את פני השטח באופן אחיד (איור 4B). עם זאת, שימוש של מחקרים אחרים במדיה עשירה הראה מדשאה אחידה של צמיחת ביופילם S. aureus ולויקוציטים חודרים דרך הביופילם 30,58. יתר על כן, נצפה גם כי היה מוות של תאי נויטרופילים לאחר 30 דקות של דגירה עם ביופילמים של S. aureus עקב לויקוצידינים המיוצרים על ידי S. aureus biofilm כי lyse נויטרופילים58 (איור 4A,D). תוספת של שלב שטיפה להסרת נויטרופילים שאינם דבוקים לאחר דגירה שלהם עם ביופילם במשך 30 דקות הוסרה ~15% מהנויטרופילים המתים מהמערכת בהשוואה לקבוצה הלא שטופה, שבה מיקרוסקופיה בוצעה מיד לאחר 30 דקות של דגירה (איור 4D). כמו כן נצפו נויטרופילים המקיימים אינטראקציה עם S. aureus (איור 4C). ניסויים נוספים נדרשים כדי להעריך אם S. aureus נבלע על ידי נויטרופילים או מחובר לפני השטח התא של נויטרופילים54. הדמיה של נויטרופילים וביופילמים היא הצעד הראשון להערכת מספר תפקודי נויטרופילים במורד הזרם, כגון פאגוציטוזה ו-NETosis54,59. ניתן להעריך את השפעת הנויטרופילים על ביופילמים גם על ידי כימות הביומסה של הביופילם, השינויים המבניים של הביופילם וכדאיות הביופילם, בין רבים אחרים, באמצעות כלי ניתוח תמונה המפורטים בשלב 5.6. לבסוף, שונות בין תורם לתורם קיימת בנויטרופילים; לפיכך, מומלץ להשתמש לפחות בשלושה תורמים שונים למחקרים המערבים נויטרופילים.
באופן כללי, מבחני מבחנה מתוקננים שולבו כדי להעריך אינטראקציות בין נויטרופילים לביופילמים. למרות שמבחנים אלה משתמשים ב- S. aureus, הפרוטוקולים המתוארים יכולים בקלות להיות מותאמים לחקר פתוגנים אחרים. אמנם ישנם מודלים שונים של in vivo לחקר אינטראקציות בין מארח לפתוגן, אך הם יכולים להיות יקרים ודורשים עבודה רבה, במיוחד אם התנאים אינם אופטימליים. עבודה עם מבחני in vitro סטנדרטיים מאפשרת לייעל את תנאי הניסוי ולאשר תצפיות לפני המעבר למערכת in vivo. לבסוף, מודלים שונים של זיהום בעלי חיים שימשו לחקר אינטראקציות ביופילם-נויטרופילים in vivo. עם זאת, חשוב לקחת בחשבון הבדלים אימונולוגיים בין בני אדם לבין מודלים של בעלי חיים60,61,62,63. זה מחייב שימוש בנויטרופילים שמקורם בבני אדם כדי לחקור את האינטראקציות המורכבות האלה בין פונדקאי לפתוגן.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו מומנה על ידי המכון הלאומי לאלרגיה ומחלות זיהומיות (R01AI077628) ל- DJW ופרס פיתוח קריירה של איגוד הלב האמריקאי (19CDA34630005) ל- ESG. אנו מודים לד"ר פול סטודלי על שסיפק לנו זן USA 300 LAC GFP. יתר על כן, אנו מכירים במשאבים ממתקן המיקרוסקופיה וההדמיה בקמפוס (CMIF) וממרכז הסרטן המקיף של OSU (OSUCCC) משאב משותף למיקרוסקופיה (MSR), אוניברסיטת אוהיו. אנו מודים גם לאמליה סטאטס, פיטר ברבק וליסה קולמן ממעבדת סטודלי על ביצוע שאיבות דם.
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% sodium chloride irrigation, USP | Baxter | 2F7124 | Endotoxin-free; Used for isolation of neutrophils |
| 150 mL rapid-flow filter unit | Thermo Scientific | 565-0020 | |
| 200 proof ethanol | VWR | 89125-188 | |
| 3 mL syringe | BD | 309657 | Used for blood draw |
| 50 mL conical centrifuge tubes | Thermo Scientific | 339652 | |
| 60 mL syringe | BD | 309653 | Used for blood draw |
| Agar | Fisher Bioreagents | BP1423-2 | |
| Alcohol swab | BD | Used for blood draw | |
| Band-aids | Used for blood draw | ||
| BD Bacto Tryptic Soy Broth | BD | DF0370-07-5 | Combine with 1.5% agar to make Tryptic Soy Agar |
| Cell counter | Bal Saupply | 202C | |
| CellTracker blue CMCH | Invitrogen | C2111 | Blue CMAC Dye (BCD) |
| Clear bottom 96-well flat bottom polystyrene plates | Costar | 3370 | |
| Cotton gauze | Fisherbrand | 13-761-52 | Used for blood draw |
| Crystal violet | Acros Organic | 40583-0250 | |
| Culture tubes | Fisherbrand | 14-961-27 | Borosilicate Glass 13 x 100 mm |
| D-(+)-glucose | Sigma | G-8270 | |
| Dextran from Leuconostoc spp. | Sigma | 31392-250G | Used for isolation of neutrophils |
| Dulbecco's phosphate buffered saline (DPBS) 1x | Gibco | 14190-144 | |
| Ethidium homodimer-1 | Invitrogen | L3224 B | |
| Ficoll-Paque plus | Cytiva | 17144003 | Used for isolation of neutrophils (density gradient medium) |
| Hanks' balanced salt solution (HBSS) 1x | Corning cellgro | 21-022-CV | without calcium, magnesium, and phenol red |
| Hemacytometer | Bright Line | ||
| Heparin | Novaplus | NDC 63323-540-57 | 1000 USP units/mL, Used for blood draw |
| IMARIS 9.8 | Oxford Instruments | Microscopy image analysis software | |
| Luminol | Sigma | A8511-5G | |
| Minimal essential media (MEM) Alpha 1x | Gibco | 41061-029 | |
| Needle (23 G1) | BD | 305145 | Used for blood draw |
| Nikon Eclipse Ti2 | Nikon | ||
| NIS-Elements | Nikon | Quantification of dead neutrophils | |
| Normal human serum | Complement Technology | NHS | |
| Petri Dish (100 x 15 mm) | VWR | 25384-342 | |
| Phorbol 12-myristate 13-acetate | |||
| Poly-L-lysine solution | Sigma | P4707-50ML | |
| Sodium chloride | Fisher Bioreagents | BP358-10 | Used for neutrophil isolation |
| SoftMax Pro Software | Molecular Devices | Microplate reader software used for data acquisition | |
| SpectraMax i3x | Molecular Devices | Microplate reader | |
| Sterile water for irrigation, USP | Baxter | 2F7114 | Endotoxin-free; Used for neutrophil isolation |
| Surflo winged infusion set | Terumo | SC*19BLK | 19 G x 3/4", used for blood draw |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Turnicate | Used for blood draw | ||
| UltraPure distilled water | Invitrogen | 10977015 | |
| White opaque 96-well plates | Falcon | 353296 | Tissue culture treated and flat bottom plate |
| μ-Slide VI 0.4 | Ibidi | 80601 | μ-channel slide |
References
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerging Infectious Diseases. 8 (9), 881-890 (2002).
- Alhede, M., et al. Phenotypes of non-attached Pseudomonas aeruginosa aggregates resemble surface attached biofilm. PLoS One. 6 (11), 27943(2011).
- Hall-Stoodley, L., Costerton, J. W., Stoodley, P. Bacterial biofilms: from the natural environment to infectious diseases. Nature Reviews: Microbiology. 2 (2), 95-108 (2004).
- Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clinical Microbiology Reviews. 15 (2), 167-193 (2002).
- Schilcher, K., Horswill, A. R. Staphylococcal biofilm development: structure, regulation, and treatment strategies. Microbiology and Molecular Biology Reviews. 84 (3), 0002(2020).
- Kaplan, J. B. Biofilm dispersal: mechanisms, clinical implications, and potential therapeutic uses. Journal of Dental Research. 89 (3), 205-218 (2010).
- Otto, M. Staphylococcal Biofilms. Microbiology Spectrum. 6 (4), 10(2018).
- Moormeier, D. E., Bayles, K. W. Staphylococcus aureus biofilm: a complex developmental organism. Molecular Microbiology. 104 (3), 365-376 (2017).
- Gross, M., Cramton, S. E., Gotz, F., Peschel, A. Key role of teichoic acid net charge in Staphylococcus aureus colonization of artificial surfaces. Infection and Immunity. 69 (5), 3423-3426 (2001).
- Zheng, Y., He, L., Asiamah, T. K., Otto, M. Colonization of medical devices by staphylococci. Environmental Microbiology. 20 (9), 3141-3153 (2018).
- Donlan, R. M. Biofilms and device-associated infections. Emerging Infectious Diseases. 7 (2), 277-281 (2001).
- Kolaczkowska, E., Kubes, P. Neutrophil recruitment and function in health and inflammation. Nature Reviews Immunology. 13 (3), 159-175 (2013).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annual Review of Immunology. 30, 459-489 (2012).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- van Kessel, K. P., Bestebroer, J., van Strijp, J. A. Neutrophil-mediated phagocytosis of Staphylococcus aureus. Frontiers in Immunology. 5, 467(2014).
- Nguyen, G. T., Green, E. R., Mecsas, J. Neutrophils to the ROScue: Mechanisms of NADPH oxidase activation and bacterial resistance. Frontiers in Cellular and Infection Microbiology. 7, 373(2017).
- Saini, R., Singh, S. Inducible nitric oxide synthase: An asset to neutrophils. Journal of Leukocyte Biology. 105 (1), 49-61 (2019).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Segal, A. W. The function of the NADPH oxidase of phagocytes and its relationship to other NOXs in plants, invertebrates, and mammals. The International Journal of Biochemistry and Cell Biology. 40 (4), 604-618 (2008).
- Fang, F. C. Antimicrobial reactive oxygen and nitrogen species: concepts and controversies. Nature Reviews Microbiology. 2 (10), 820-832 (2004).
- Bogdan, C. Nitric oxide and the immune response. Nature Immunology. 2 (10), 907-916 (2001).
- Chua, S. L., et al. Reactive oxygen species drive evolution of pro-biofilm variants in pathogens by modulating cyclic-di-GMP levels. Open Biology. 6 (11), 160162(2016).
- El Haj, C., Lichtenberg, M., Nielsen, K. L., Bjarnsholt, T., Jensen, P. O. Catalase protects biofilm of Staphylococcus aureus against daptomycin activity. Antibiotics. 10 (5), 511(2021).
- Ghimire, N., et al. Direct microscopic observation of human neutrophil-Staphylococcus aureus interaction in vitro suggests a potential mechanism for initiation of biofilm infection on an implanted medical device. Infection and Immunity. 87 (12), 00745(2019).
- Bhattacharya, M., et al. Leukocidins and the nuclease nuc prevent neutrophil-mediated killing of Staphylococcus aureus biofilms. Infection and Immunity. 88 (10), 00372(2020).
- Bogachev, M. I., et al. Fast and simple tool for the quantification of biofilm-embedded cells sub-populations from fluorescent microscopic images. PLoS One. 13 (5), 0193267(2018).
- Kerstens, M., et al. A flow cytometric approach to quantify biofilms. Folia Microbiologica. 60 (4), 335-342 (2015).
- Meyle, E., et al. Destruction of bacterial biofilms by polymorphonuclear neutrophils: relative contribution of phagocytosis, DNA release, and degranulation. The International Journal of Artificial Organs. 33 (9), 608-620 (2010).
- Oveisi, M., et al. Novel assay to characterize neutrophil responses to oral biofilms. Infection and Immunity. 87 (2), 00790(2019).
- Leid, J. G., Shirtliff, M. E., Costerton, J. W., Stoodley, P. Human leukocytes adhere to, penetrate, and respond to Staphylococcus aureus biofilms. Infection and Immunity. 70 (11), 6339-6345 (2002).
- Fey, P. D., et al. A genetic resource for rapid and comprehensive phenotype screening of nonessential Staphylococcus aureus genes. mBio. 4 (1), 00537(2013).
- Cody, W. L., et al. Skim milk enhances the preservation of thawed -80 degrees C bacterial stocks. Journal of Microbiological Methods. 75 (1), 135-138 (2008).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. 63, 3064(2012).
- Freitas, M., Porto, G., Lima, J. L., Fernandes, E. Optimization of experimental settings for the analysis of human neutrophils oxidative burst in vitro. Talanta. 78 (4-5), 1476-1483 (2009).
- Merritt, J. H., Kadouri, D. E., O'Toole, G. A. Growing and analyzing static biofilms. Current Protocols in Microbiology. , Chapter 1 Unit 1B 1 (2005).
- Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. 412, 15-20 (2007).
- Zhou, L., et al. Impact of human granulocyte and monocyte isolation procedures on functional studies. Clinical and Vaccine Immunology. 19 (7), 1065-1074 (2012).
- Quach, A., Ferrante, A. The application of dextran sedimentation as an initial step in neutrophil purification promotes their stimulation, due to the presence of monocytes. Journal of Immunology Research. 2017, 1254792(2017).
- Karlsson, A., Nixon, J. B., McPhail, L. C. Phorbol myristate acetate induces neutrophil NADPH-oxidase activity by two separate signal transduction pathways: dependent or independent of phosphatidylinositol 3-kinase. Journal of Leukocyte Biology. 67 (3), 396-404 (2000).
- Staats, A., et al. Rapid aggregation of Staphylococcus aureus in synovial fluid is influenced by synovial fluid concentration, viscosity, and fluid dynamics, with evidence of polymer bridging. mBio. , 0023622(2022).
- Chiu, I. M., et al. Bacteria activate sensory neurons that modulate pain and inflammation. Nature. 501 (7465), 52-57 (2013).
- Hartig, S. M. Basic image analysis and manipulation in ImageJ. Current Protocols in Molecular Biology. 102 (1), 14-15 (2013).
- Heydorn, A., et al. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146 (10), 2395-2407 (2000).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Luo, T. L., et al. Introducing BAIT (Biofilm Architecture Inference Tool): a software program to evaluate the architecture of oral multi-species biofilms. Microbiology. 165 (5), 527-537 (2019).
- Naves, P., et al. Measurement of biofilm formation by clinical isolates of Escherichia coli is method-dependent. Journal of Applied Microbiology. 105 (2), 585-590 (2008).
- Eze, E. C., El Zowalaty, M. E. Combined effects of low incubation temperature, minimal growth medium, and low hydrodynamics optimize Acinetobacter baumannii biofilm formation. Infection and Drug Resistance. 12, 3523-3536 (2019).
- Harris, L. G., Tosatti, S., Wieland, M., Textor, M., Richards, R. G. Staphylococcus aureus adhesion to titanium oxide surfaces coated with non-functionalized and peptide-functionalized poly(L-lysine)-grafted-poly(ethylene glycol) copolymers. Biomaterials. 25 (18), 4135-4148 (2004).
- Miao, J., et al. Biofilm formation of Staphylococcus aureus under food heat processing conditions: first report on cml production within biofilm. Scientific Reports. 9 (1), 1312(2019).
- Lade, H., et al. Biofilm formation by Staphylococcus aureus clinical isolates is differentially affected by glucose and sodium chloride supplemented culture media. Journal of Clinical Medicine. 8 (11), 1853(2019).
- Guzel Kaya, G., et al. Antibacterial activity of linezolid against gram-negative bacteria: utilization of epsilon-Poly-l-Lysine capped silica xerogel as an activating carrier. Pharmaceutics. 12 (11), 1126(2020).
- Clinton, A., Carter, T. Chronic wound biofilms: pathogenesis and potential therapies. Laboratory Medicine. 46 (4), 277-284 (2015).
- Scheel-Toellner, D., et al. Reactive oxygen species limit neutrophil life span by activating death receptor signaling. Blood. 104 (8), 2557-2564 (2004).
- Pestrak, M. J., et al. Pseudomonas aeruginosa rugose small-colony variants evade host clearance, are hyper-inflammatory, and persist in multiple host environments. PLoS Pathogens. 14 (2), 1006842(2018).
- Guerra, F. E., et al. Staphylococcus aureus SaeR/S-regulated factors reduce human neutrophil reactive oxygen species production. Journal of Leukocyte Biology. 100 (5), 1005-1010 (2016).
- Suo, Y., Huang, Y., Liu, Y., Shi, C., Shi, X. The expression of superoxide dismutase (SOD) and a putative ABC transporter permease is inversely correlated during biofilm formation in Listeria monocytogenes 4b G. PLoS One. 7 (10), 48467(2012).
- Olwal, C. O., Ang'ienda, P. O., Ochiel, D. O. Alternative sigma factor B (sigma(B)) and catalase enzyme contribute to Staphylococcus epidermidis biofilm's tolerance against physico-chemical disinfection. Scientific Reports. 9 (1), 5355(2019).
- Bhattacharya, M., et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing. Proceedings of the National Academy of Sciences of the United States of America. 115 (28), 7416-7421 (2018).
- Masuda, S., et al. NETosis markers: Quest for specific, objective, and quantitative markers. Clinica Chimica Acta. 459, 89-93 (2016).
- Dworsky, E. M., et al. Novel in vivo mouse model of implant related spine infection. Journal of Orthopaedic Research. 35 (1), 193-199 (2017).
- Pletzer, D., Mansour, S. C., Wuerth, K., Rahanjam, N., Hancock, R. E. New mouse model for chronic infections by gram-negative bacteria enabling the study of anti-infective efficacy and host-microbe interactions. mBio. 8 (1), 00140(2017).
- Davis, M. M. A prescription for human immunology. Immunity. 29 (6), 835-838 (2008).
- Mestas, J., Hughes, C. C. Of mice and not men: differences between mouse and human immunology. The Journal of Immunology. 172 (5), 2731-2738 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved