Method Article
Standardisierte In-vitro-Assays zur Visualisierung und Quantifizierung von Interaktionen zwischen humanen Neutrophilen und Staphylococcus aureus-Biofilmen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt die Untersuchung neutrophiler Biofilmwechselwirkungen. Staphylococcus aureus Biofilme werden in vitro etabliert und mit peripheren aus Blut gewonnenen menschlichen Neutrophilen inkubiert. Die oxidative Burst-Reaktion von Neutrophilen wird quantifiziert, und die Neutrophilenlokalisation innerhalb des Biofilms wird mikroskopisch bestimmt.
Zusammenfassung
Neutrophile sind die erste Verteidigungslinie, die das Immunsystem bei mikrobiellen Infektionen einsetzt. In vivo werden Neutrophile an die Infektionsstelle rekrutiert, wo sie Prozesse wie Phagozytose, Produktion von reaktiven Sauerstoff- und Stickstoffspezies (ROS, RNS), NETose (neutrophile extrazelluläre Falle) und Degranulation verwenden, um Mikroben abzutöten und die Infektion zu lösen. Wechselwirkungen zwischen Neutrophilen und planktonischen Mikroben wurden umfassend untersucht. In den letzten Jahren gab es ein wachsendes Interesse an der Untersuchung von Infektionen, die durch Biofilme verursacht werden. Biofilme weisen Eigenschaften auf, einschließlich der Toleranz gegenüber der Abtötung durch Neutrophile, die sich von ihren planktonisch gewachsenen Gegenstücken unterscheiden. Mit der erfolgreichen Etablierung von in vitro und in vivo Biofilmmodellen können nun Interaktionen zwischen diesen mikrobiellen Gemeinschaften mit verschiedenen Immunzellen untersucht werden. Hier werden Techniken, die eine Kombination aus traditionellen Biofilmmodellen und etablierten Neutrophilenaktivitätsassays verwenden, speziell auf die Untersuchung von Neutrophilen- und Biofilminteraktionen zugeschnitten. Die Weitfeld-Fluoreszenzmikroskopie wird verwendet, um die Lokalisation von Neutrophilen in Biofilmen zu überwachen. Diese Biofilme werden unter statischen Bedingungen gezüchtet, gefolgt von der Zugabe von Neutrophilen aus menschlichem peripherem Blut. Die Proben werden vor der Visualisierung unter dem Mikroskop mit geeigneten Farbstoffen angefärbt. Zusätzlich wird die Produktion von ROS, einer der vielen neutrophilen Reaktionen gegen Krankheitserreger, in Gegenwart eines Biofilms quantifiziert. Die Hinzufügung von Immunzellen zu diesem etablierten System wird das Verständnis der Wirt-Pathogen-Interaktionen erweitern und gleichzeitig die Verwendung standardisierter und optimierter Bedingungen sicherstellen, um diese Prozesse genau zu messen.
Einleitung
Ein Biofilm ist eine Gemeinschaft von oberflächenassoziierten Mikroben oder nicht angebundenen Aggregaten, die von einer extrazellulären polymeren Substanz (EPS)1,2 umhüllt sind. Diese Gemeinschaften schützen die eingeschlossenen Mikroorganismen vor Umweltstressoren, einschließlich der Toleranz gegenüber antimikrobiellen Wirkstoffen und dem Immunsystem3. Mehrere pathogene mikrobielle Spezies bilden Biofilme, die mit chronischen Infektionen in Verbindung gebracht wurden4. Die Entwicklung von Biofilmen ist ein komplizierter Prozess, der die Anhaftung an Oberflächen, die EPS-Produktion, die Zellproliferation, die Biofilmstrukturierung und die Zellablösungumfasst 5. Sobald sich Zellen zu einem Biofilm zerstreut haben, bleiben sie planktonisch oder translozieren sich in ein neues Substrat und beginnen die Biofilmentwicklung wieder6.
Staphylococcus aureus, ein opportunistischer Erreger, folgt einem allgemeinen Schema der Biofilmentwicklung, einschließlich Anheftung, Proliferation, Reifung und Ausbreitung7. Der Bindungsprozess in S. aureus-Biofilmen wird durch hydrophobe Wechselwirkungen, Teichonsäuren und mikrobielle Oberflächenkomponenten, die adhäsive Matrixmoleküle (MSCRAMMs) erkennen, bestimmt8,9. Wenn die Vermehrung von S. aureus beginnt, wird EPS produziert, das hauptsächlich aus Polysacchariden, Proteinen, extrazellulärer DNA und Teichonsäuren besteht5. Bei der Herstellung von EPS-Komponenten werden auch verschiedene Exoenzyme und kleine Moleküle produziert, die zur 3-dimensionalen Struktur des Biofilms beitragen und die Ablösung5 unterstützen. S. aureus nutzt diesen hochgradig koordinierten Lebensstil, um verschiedene chronische Infektionen zu etablieren, einschließlich Infektionen durch das Verweilen in Medizinprodukten10.
Methicillin-resistenter S. aureus (MRSA) ist eine der Hauptursachen für Infektionen im Zusammenhang mit verweilten medizinischen Geräten wie Zentralvenen- und Harnkathetern, Gelenkprothesen, Herzschrittmachern, mechanischen Herzklappen und Intrauterinpessaren11. Während solcher Infektionen sind Neutrophile die ersten Immunzellen des Wirts, die an der Infektionsstelle rekrutiert werden, um Krankheitserreger über mehrere Strategien zu bekämpfen12. Dazu gehören Phagozytose, Degranulation, Produktion von reaktiven Sauerstoff- und Stickstoffspezies (ROS/RNS) oder Freisetzung von neutrophilen extrazellulären Fallen (NETs) zur Eliminierung von Krankheitserregern13.
Die Erzeugung von ROS bei Phagozytose von Mikroben ist eine der wichtigsten antimikrobiellen Reaktionen von Neutrophilen14. Die Phagozytose wird verstärkt, wenn Mikroben mit Opsoninen beschichtet sind, insbesondere Immunglobuline und Komplementkomponenten, die im Serum15 vorkommen. Die opsonisierten Mikroben werden dann von Zelloberflächenrezeptoren auf Neutrophilen erkannt und verschlingt, wobei sie ein Kompartiment bilden, das als Phagosom15 bezeichnet wird. Neutrophile erzeugen und setzen ROS im Phagosom über die membranassoziierte NADPH-Oxidase16 frei. Dieser Mehrkomponenten-Enzymkomplex erzeugt Superoxidanionen, indem er Elektronen auf molekularen Sauerstoff16 überträgt. Darüber hinaus erzeugen Neutrophile auch RNS durch die Expression der induzierbaren Stickstoffmonoxidsynthase (iNOS)17. Diese hohen Superoxid- und Stickstoffmonoxidradikale im Phagosom haben breite antimikrobielle Aktivitäten. Sie können mit Metallzentren in Enzymen interagieren und Nukleinsäuren, Proteine und Zellmembranen des Erregers 18,19,20,21 schädigen. Zahlreiche Mikroben nehmen einen Biofilm-Lebensstil an und wenden unterschiedliche Strategien an, um der Tötung durch ROS22,23 zu entgehen. Daher sind standardisierte Assays, die Biofilme mit Neutrophilen koppeln, um ROS zu quantifizieren, für konsistente Ergebnisse von Vorteil.
Während Assays, wie die Quantifizierung der neutrophilen ROS-Produktion, Informationen über die Reaktionen von Neutrophilen auf Biofilme liefern, kann die Fähigkeit, die Wechselwirkungen von Neutrophilen innerhalb eines Biofilms zu visualisieren, ebenfalls als leistungsfähiges Werkzeug dienen. Die Verwendung von Fluoreszenzfarbstoffen für die Mikroskopie erfordert oft eine Optimierung, um qualitativ hochwertige Bilder zu erhalten, die für die mikroskopische Bildgebungsanalyse verwendet werden können. Die Flexibilität, einige Bedingungen zu optimieren, ist begrenzt, da Neutrophile nach der Isolierung den Zelltod durchlaufen können. Darüber hinaus werden typischerweise Biofilme gewaschen, um die planktonische Population vor der Zugabe von Neutrophilen aus dem Versuchsaufbau zu entfernen. Während des Waschens kann es aufgrund des Verlusts von partieller Biomasse zu Variabilität zwischen replizierten Biofilmen kommen, wenn Biofilme lose an der Oberfläche haften.
Im Großen und Ganzen umfassen aktuelle Methoden auf diesem Gebiet zur Analyse von Wechselwirkungen zwischen Neutrophilen und Biofilmen hauptsächlich Mikroskopie, Durchflusszytometrie und die Enumeration koloniebildender Einheiten (CFU)24,25,26,27. Die Mikroskopie beinhaltet die Verwendung von Farbstoffen, die entweder die Neutrophilen und Biofilme direkt anfärben oder auf verschiedene neutrophile Reaktionen gegen Mikroben wie NET-Bildung, Degranulation und Zelltod abzielen25,28. Eine Teilmenge dieser Reaktionen, wie Neutrophilenzelltod und Degranulation, kann auch mittels Durchflusszytometrie analysiert werden, erfordert jedoch, dass Neutrophile vorzugsweise nicht mit großen Aggregaten von Mikroben in einem Biofilm assoziiert sind28,29. Die Durchflusszytometrie kann auch einige Biofilmparameter quantifizieren, wie z. B. die Zelllebensfähigkeit27. Diese Prozesse erfordern jedoch eine Störung der Biofilmbiomasse und wären nicht nützlich, um andere wichtige Wechselwirkungen wie die räumliche Verteilung von Neutrophilen und ihren Komponenten innerhalb eines Biofilms27,29,30 zu visualisieren.
Das vorliegende Protokoll konzentriert sich auf die Anpassung einiger der traditionell verwendeten Methoden zur Untersuchung von Neutrophil-Biofilm-Wechselwirkungen auf Biofilmen, die optimiert wurden, um eine minimale Variabilität während der Handhabung zu gewährleisten. Dieses Protokoll bietet somit standardisierte Methoden zur Züchtung und Quantifizierung von Biofilmen, zur Isolierung primärer humaner Neutrophile aus peripherem Blut, zur Quantifizierung der ROS-Produktion und zur Visualisierung von Biofilm-Neutrophilen-Interaktionen mittels Mikroskopie. Dieses Protokoll kann an verschiedene Systeme angepasst werden, um Biofilm-Neutrophilen-Interaktionen unter Berücksichtigung der Heterogenität zwischen Spenderpools zu verstehen.
Protokoll
Alle Verfahren wurden vom Ohio State University Institutional Review Board (IRB) genehmigt (2014H0154). Die schriftliche Zustimmung aller Spender zur Entnahme von peripherem Blut zur Isolierung primärer humaner Neutrophilen wurde von allen Spendern eingeholt. Staphylococcus aureus (USA300 LAC)31 wurde als Modellorganismus für die Durchführung der Experimente verwendet. Die Experimente wurden mit geeigneter persönlicher Schutzausrüstung (PSA) aufgrund einer möglichen Exposition gegenüber einem durch Blut übertragenen Krankheitserreger durchgeführt.
1. Herstellung von In-vitro-Biofilm
- Isolierte Kolonien von S. aureus werden aus einem kryokonservierten Bestand 31 unter Verwendung einer Streifenplattentechnik32,33 auf einer nährstoffreichen Agarplatte, wie z. B. Tryptose-Soja-Agar, erhalten (siehe Materialtabelle).
- Einzelne Vertiefungen einer 96-Well-Platte mit 100 μL 0,001% (v/v) Poly-L-Lysin (PLL) verdünnt in sterilemH2Obeschichten und bei Raumtemperatur 30 min inkubieren. Aseptisch saugen Sie die PLL-Lösung mit einer vakuumunterstützten Aspirationsfalle ab. Lassen Sie die Brunnen über Nacht bei Raumtemperatur trocknen.
HINWEIS: Alle Aspirationsschritte im Protokoll werden mit einer vakuumunterstützten Aspirationsfalle durchgeführt, sofern nicht anders angegeben. - Bereiten Sie eine Übernachtkultur vor, indem Sie eine Kolonie von S. aureus in minimal essentiellem Alpha (MEMα) mit 2% Glucose beimpfen und bei 37 °C inkubieren, bei 200 U/min für 16-18 h schütteln.
- Die Übernachtkultur wird durch Übertragen von 50 μL bis 5 ml frischem MEMα, ergänzt mit 2% Glucose, verdünnt und bei 37 °C unter Schütteln bei 200 U/min bis zur mittleren logarithmischen Phase inkubiert, im Allgemeinen zwischen der optischen Dichte 600 (OD600nm) von 0,5-0,8. Verwenden Sie MEMα, um die mittellogarithmische Kultur auf einen OD600nm von 0,1 zu normalisieren.
- Übertragen Sie 150 μL normalisierte Kultur in jede Vertiefung der mit PLL behandelten 96-Well-Platte. In einer befeuchteten Kammer bei 37 °C statisch 18-20 h inkubieren.
HINWEIS: Die Biofilme können auch in anderen Formaten wie μ-Kanal-Objektträgern gezüchtet werden (siehe Materialtabelle). - Saugen Sie den Überstand ab, um die Planktonzellen zu entfernen. Waschen Sie die verbleibende Biomasse vorsichtig mit 150 μL Hanks' Balanced Salt Solution (HBSS), um die nicht anhaftenden Zellen zu entfernen. Fügen Sie HBSS tropfenweise hinzu, um eine Unterbrechung des Biofilms zu vermeiden.
HINWEIS: Lassen Sie beim Absaugen des Überstands und des HBSS während des Waschens gerade genug Flüssigkeit (Überstand oder HBSS) in den Vertiefungen, die den Biofilm enthalten, so dass der Biofilm noch eingetaucht ist. Dies verhindert die Störung der Biofilmstruktur, wenn HBSS tropfenweise hinzugefügt wird, um den Biofilm zu waschen. - Wiederholen Sie Schritt 1.6 mindestens zwei weitere Male, um alle Planktonzellen zu entfernen. An diesem Punkt sind Biofilme bereit für sofortige nachgeschaltete Experimente.
HINWEIS: Wenn die Biofilme nicht für neutrophile Experimente verwendet werden, kann HBSS durch phosphatgepufferte Kochsalzlösung (PBS) ersetzt werden. HBSS wird gegenüber PBS bevorzugt, da HBSS Komponenten enthält, einschließlich Glukose, die optimale Bedingungen für die Aktivierung von Neutrophilen bieten34.
2. Quantifizierung der Biomasse von Biofilmen
- Bereiten Sie eine Brühe von 0,1% (w/v) kristallvioletter (CV) Lösung (siehe Tabelle der Materialien) vor, indem Sie in 20% (v/v) Ethanol und 80% (v/v) H2O auflösen. Stellen Sie sicher, dass der CV vollständig in Ethanol gelöst ist, bevor SieH2O hinzufügen.
- 150 μL 0,1% ige CV-Lösung in den gewaschenen Biofilm geben und 20 min bei Raumtemperatur inkubieren. Verwenden Sie mindestens drei leere Bohrlöcher als reine Mediensteuerung.
- Die 0,1%ige CV-Lösung aus den Biofilmen absaugen und die gefärbten Biofilme mit 200 μL 1x PBS waschen. Wiederholen Sie diesen Vorgang für insgesamt drei Wäschen, um überschüssiges CV aus den Vertiefungen zu entfernen.
- 150 μL 33%ige (v/v) Eisessigsäure verdünnt mitH2Ozugeben. Bei Raumtemperatur auf einer Wippe bei 50 U/min für 30 min inkubieren, damit sich der an die Biomasse gebundene CV vollständig auflösen kann.
VORSICHT: Führen Sie diesen Schritt in einer Laminar-Flow-Haube mit geeigneter PSA durch, da Eisessig eine korrosive Chemikalie ist. - In der Zwischenzeit richten Sie den Mikroplattenleser (siehe Materialtabelle) ein, um die CV-Färbewerte abzulesen. Nach der Eisessigbehandlung die Platte bei 595 nm Wellenlänge ablesen.
HINWEIS: Die Wellenlänge, die zur Messung des OD von CV verwendet wird, kann zwischen 500 und 600 nm35 liegen.
3. Neutrophilen-Isolierung
ANMERKUNG: Neutrophile wurden nach einer zuvor veröffentlichten Methode mit geringfügigen Änderungen isoliert36. Dieses Isolationsprotokoll kombiniert zuerst die Dichtegradientenzentrifugation, gefolgt von einer 3%igen Dextransedimentation. Dieser Abschnitt behandelt nur das gesamte Neutrophilen-Isolierungsprotokoll und konzentriert sich auf die Änderungen am veröffentlichten Protokoll. Darüber hinaus ist das unten beschriebene Protokoll eine der vielen Methoden, die Neutrophile isolieren und bei Bedarf ersetzen können. Andere Verfahren zur Isolierung von Neutrophilen umfassen die Verwendung von Zelltrennmedien oder magnetische Antikörperzelltrennung37.
- Entnehmen Sie Blut von einem erwachsenen Spender durch Venenpunktion, gemäß dem im institutionellen IRB beschriebenen Protokoll. Stellen Sie vor der Blutentnahme sicher, dass die Spritze ausreichend konservierungsmittelfreies Heparin enthält, so dass die Endkonzentration von Heparin 20 U / ml beträgt.
- Das heparinisierte Blut wird mit 3/4 des Volumens des endotoxinfreien 0,9% NaCl (siehe Materialtabelle) inH2Obei Raumtemperatur verdünnt.
- Für jeweils 20 ml der verdünnten Blutprobe aliquot 14 ml eines handelsüblichen Dichtegradientenmediums (siehe Materialtabelle) in einem frischen 50 ml konischen Röhrchen. Schichten Sie die verdünnte Blutprobe vorsichtig auf das Dichtegradientenmedium.
- Zentrifugieren Sie die geschichtete Blutprobe bei 400 x g für 40 min bei Raumtemperatur. Stellen Sie sicher, dass die Zentrifuge eine langsame Pause hat, um eine Störung der Schicht nach Abschluss der Zentrifugation zu vermeiden.
HINWEIS: Die Blutprobe besteht aus fünf Schichten, die eine Mischung aus Kochsalzlösung und Plasma, eine mononukleäre Zellschicht, ein Dichtegradientenmedium, Neutrophile und Erythrozyten enthalten. - Mit einer serologischen Pipette alle Schichten über den Neutrophilen und dem Erythrozytenpellet aspirieren, gefolgt von einer sanften Resuspension des Pellets in kaltem endotoxinfreiem 0,9% NaCl inH2O. Für jedes Pellet, das aus einer 20-ml-Blutprobe erzeugt wird, resuspendieren Sie das Pellet wieder auf insgesamt 20 ml Volumen. Fügen Sie 1:1 Volumen von 3% Dextran hinzu (siehe Materialtabelle). Inkubieren Sie das Rohr aufrecht für 18-20 min auf Eis.
HINWEIS: Stellen Sie sicher, dass das 3% ige Dextran mit endotoxinfreiem 0,9% NaCl inH2Ohergestellt wird. - Entfernen Sie 20 ml der oberen Schicht, die Neutrophile und einige Erythrozyten enthält, in ein neues 50 ml konisches Röhrchen und zentrifugieren Sie es bei 355 x g für 10 min bei 4 °C. Gießen Sie den Überstand ab und hinterlassen Sie ein rotes Pellet.
- Resuspendieren Sie das Pellet vorsichtig in 10 ml kaltem, sterilemH2Ofür 30 s, um die restlichen Erythrozyten zu lysieren. Fügen Sie der Mischung sofort 10 ml kalte endotoxinfreie 0,9% Kochsalzlösung hinzu, um die Spannkraft wiederherzustellen. Die Lösung wird bei 233 x g für 3 min bei 4 °C zentrifugiert.
- Gießen Sie den Überstand ab und resuspendieren Sie das Pellet mit 95% -97% Neutrophilen in 1 ml kaltem HBSS pro 20 ml der Blutprobe.
- Übertragen Sie 10 μL der resuspendierten Neutrophilen in 90 μL 0,4% Trypanblau-Ausschlussfarbstoff und zählen Sie die Zellen mit einem Hämozytometer (siehe Materialtabelle).
HINWEIS: Nicht lebensfähige Zellen sind blau gefärbt, da der Trypanblau-Ausschlussfarbstoff in lebensfähigen Zellen undurchlässig ist. Dieses Protokoll bietet >99% Zelllebensfähigkeit37,38. - Fügen Sie zusätzliches HBSS hinzu, so dass die Endkonzentration der Neutrophilen 4 x 106 Zellen / ml beträgt.
HINWEIS: Für Fälle mit <99% Zelllebensfähigkeit kann die Endkonzentration von 4 x 106 Zellen / ml immer noch erreicht werden; Das Gesamtvolumen der erhaltenen Lösung, die 4 x 106 Zellen / ml enthält, nimmt jedoch ab. Die Endkonzentration der Neutrophilen kann entsprechend den experimentellen Bedürfnissen des Benutzers angepasst werden. Die Neutrophilen wurden bei einer Endkonzentration von 4 x 106 Zellen/ml für alle unten beschriebenen Experimente resuspendiert. Um die Variabilität von Spender zu Spender zu berücksichtigen, wird dringend empfohlen, dass alle Experimente mit Neutrophilen mit mindestens drei verschiedenen Spendern durchgeführt werden.
4. Messung der ROS durch Neutrophile
- 100 μL 20% normales menschliches Serum (verdünnt in HBSS) tropfenweise in den gewaschenen Biofilm geben (Schritt 1.6) und bei 37 °C unter statischen Bedingungen für 30 min inkubieren, um den Biofilm zu opsonisieren.
- Die 20%ige Serumlösung absaugen und die Biofilme tropfenweise mit 150 μL HBSS einmal waschen. Absaugen Sie das HBSS und hinterlassen Sie Vertiefungen mit opsonisierten Biofilmen.
HINWEIS: Für die Interpretation des Experiments werden mindestens vier Gruppen empfohlen: (A) Neutrophile + Biofilm, (B) Neutrophile + PMA (Positivkontrolle, siehe Materialtabelle), (C) Nur Neutrophile und (D) Nur Biofilm. - Zugabe von Luminol (siehe Materialtabelle) zu den in HBSS resuspendierten Neutrophilen in einer Konzentration von 4 x 106 Zellen/ml, so dass die endgültige Luminolkonzentration 50 μM beträgt. Diese Lösung ist sofort einsatzbereit für die Gruppen (A) und (C). Fügen Sie 4 x 105 Neutrophile gemischt mit Luminol in die Vertiefungen mit opsonisierten Biofilmen hinzu.
- In einem separaten Röhrchen 50 μM Luminollösung in HBSS ohne Neutrophile herstellen und in den gut enthaltenden Biofilm (Gruppe D) geben.
- Aliquot 350 μL Neutrophile gemischt mit Luminol und Zugabe von Phorbol-12-Myristat-13-acetat (PMA) in einer Endkonzentration von 500 ng/ml zu der Mischung. Für Gruppe (B) 4 x 105 Neutrophile aus dieser Mischung in Vertiefungen ohne Biofilm geben. Dies dient als Positivkontrolle.
HINWEIS: Die in diesem Schritt angegebene PMA-Konzentration ist relativ hoch, um eine robuste Burst-Reaktion zu gewährleisten, da PMA-stimulierte Neutrophile eine positive Kontrolle darstellen. PMA kann je nach Experiment in einer niedrigeren Konzentration verwendet werden, um Neutrophile zu aktivieren. - Zentrifugieren Sie die Platte bei 270 x g für 30 s bei 4 °C.
- Stellen Sie sicher, dass das Plattenlesegerät auf 37 °C eingestellt ist, zusammen mit der Einstellung für Lumineszenz und kinetisches Ablesen für 60 Minuten mit 3-Minuten-Intervallen. Legen Sie die Platte in den Plattenleser, um die ROS-Produktion durch Neutrophile für 60 Minuten zu messen.
HINWEIS: Für diesen Assay wurden Biofilme in weißen Platten gezüchtet, die für Lumineszenztests verwendet wurden. PMA ist ein bekannter Agonist für die oxidative Burst-Reaktion39. Wenn Sie Studien mit PMA durchführen, stellen Sie sicher, dass PMA im letzten Schritt hinzugefügt wird, während die Lösung, die Neutrophile enthält, kalt ist, da PMA sofort die Burst-Reaktion einleitet.
5. Bildgebung von Biofilm-Neutrophilen-Interaktionen
- Richten Sie einen Biofilm mit den Schritten 1.2-1.6 ein. Um die Biofilmbildgebung zu erleichtern, verwenden Sie einen fluoreszierenden Stamm von S. aureus, wie USA300, der grün fluoreszierendes Protein (GFP) 40,41 exprimiert, um die Mikroskopie-Bildgebung zu erleichtern.
HINWEIS: Ein 6-μ-Kanal-Objektträger (siehe Materialtabelle) wurde anstelle einer 96-Well-Platte verwendet, um das In-vitro-Biofilmmodell zu demonstrieren (Schritt 1). - 4 x 106 Zellen/ml Neutrophile mit 100 μM Blue CMAC (7-Amino-4-chlormethylcumarin) Farbstoff (BCD, siehe Materialtabelle) für 30 min in einer Wippe bei 37 °C und 5%CO2 inkubieren. Stellen Sie sicher, dass die Proben im Dunkeln inkubiert werden, und begrenzen Sie die Lichteinwirkung für die verbleibenden Schritte.
- Um überschüssiges BCD zu waschen, zentrifugieren Sie Neutrophile bei 270 x g für 5 min und saugen Sie den Überstand ab. Resuspendieren Sie die Neutrophilen in frischem HBSS. An dieser Stelle fügen Sie den BCD-gefärbten Neutrophilen Ethidiumhomodimer-1 (siehe Materialtabelle) in einer Endkonzentration von 4 μM hinzu, um den Neutrophilen- und Bakterientod zu überwachen.
- Fügen Sie 150 μL Neutrophile in den S. aureus-Biofilm hinzu, der in μ-Objektträgern gezüchtet wurde, so dass das Verhältnis von Neutrophilen zu Bakterien 1:30 beträgt (neutrophil: Bakterien). Inkubieren Sie die μ-Objektträger in einer befeuchteten Kammer für 30 min. Die Anzahl der Bakterienzellen basiert auf der Zellzahl, die aus der Beschichtung eines 18-stündigen Biofilms gewonnen wird.
- Stellen Sie sich die Neutrophil-Biofilm-Wechselwirkung mit fluoreszierenden Kanälen vor, die den Anregungs- und Emissionswellenlängen der fluoreszierenden Farbstoffe/Proteine entsprechen.
HINWEIS: Für die vorliegende Studie beträgt BCD 353/466 nm, Ethidiumhomodimer-1 528/617 nm und GFP 395/509 nm. Begrenzen Sie die Exposition der Probe gegenüber dem Laser oder dem Licht, um ein Photobleichen der Proben zu verhindern. - Analysieren Sie die Bilder mit Mikroskopie-Bildanalysesoftware oder Programmen wie FIJI / ImageJ, COMSTAT2, BiofilmQ und BAIT, unter vielen mehr42,43,44,45.
HINWEIS: Bei der Arbeit mit Flecken ist es wichtig, die Spezifität der verwendeten Farbstoffe zu berücksichtigen. Einige Färbungen wirken auf prokaryotische und eukaryotische Zellen, während andere nur auf einer funktionieren. Wenn Neutrophile und Biofilme separat mit Farbstoffen gefärbt werden, die beide Zelltypen färben können, stellen Sie sicher, dass Sie den verbleibenden Farbstoff abwaschen, bevor Sie Neutrophile und Biofilme kombinieren, um eine Kreuzfärbung zu verhindern.
Ergebnisse
Die Medien, mit denen bakterielle Biofilme gezüchtet werden, beeinflussen das Überleben von Neutrophilen. Verschiedene Medien wurden getestet, um die Wirkung von Medien allein auf die Lebensfähigkeit von Neutrophilen für die Untersuchung von Neutrophil-Biofilm-Wechselwirkungen zu reduzieren (Abbildung 1). Bakterielle Wachstumsmedien wie Tryptose-Sojabrühe minimieren die Lebensfähigkeit von Neutrophilen, so dass ~60% der Neutrophilen nach einer 30-minütigen Inkubationszeit bei 37 °C mit 5%CO2 am Leben sind. Säugetierzellkulturmedien wie MEMα haben keinen Einfluss auf die Lebensfähigkeit von Neutrophilen und unterstützen das Wachstum von S. aureus-Biofilmen. Tatsächlich fördern minimale Medien ein robustes Wachstum von Biofilmen in anderen Bakterien46,47.
Um die Wirkung von Medien auf das Biofilmwachstum und die Variabilität in der Biofilmbiomassequantifizierung nach dem Waschen der Biomasse zur Eliminierung von Planktonzellen zu bewerten, wurde ein 18 h S. aureus-Biofilm in einer 96-Well-Platte gezüchtet, wobei Vertiefungen mit Poly-L-Lysin behandelt oder unbehandelt wurden. Ein nährstoffreiches (Tryptose-Soja-Bouillon (TSB)) und minimales (MEMα) Medium wurde unverändert verwendet oder mit 2% Glukose ergänzt. Die mit CV angefärbte Biofilmbiomasse zeigte, dass der in MEMα mit 2% Glukose angebaute Biofilm S. aureus den robustesten Biofilm unter allen getesteten Medien produzierte (Abbildung 2A). Darüber hinaus zeigten Biofilme, die in PLL-vorbehandelten Vertiefungen mit MEMα + 2% Glukose gezüchtet wurden, eine geringere Variabilität als Biofilme in PLL-unbehandelten Vertiefungen, die MEMα + 2% Glukose enthielten. Diese Biofilme zeigten eine geringere Variabilität in der Quantifizierung mittels CV-Assay35 und der KBE/ml, wenn sie nach präziser Handhabung von Biofilmen für die Biomassequantifizierung plattiert wurden. Diese Biofilme enthielten im Durchschnitt 1 x 108 KBE/ml, wie durch Plattieren der Biofilme in 3 verschiedenen Tagen gezeigt wurde (Abbildung 2B). Diese Zahl ist nützlich, um die Anzahl der Neutrophilen zu bestimmen, die den Biofilmen für Neutrophilen-Funktionstests hinzugefügt werden sollen.
Um die ROS-Produktion von Neutrophilen als Reaktion auf Biofilme zu messen, wurden S. aureus-Biofilme für 18-20 h in einer 96-Well-Platte statisch gezüchtet. Biofilme wurden dann opsonisiert und Neutrophile hinzugefügt. Anschließend wurde die ROS-Produktion 60 Minuten lang gemessen (Abbildung 3A). Die Fläche unter der Kurve wird aus der kinetischen Kurve berechnet, um die gesamte ROS-Produktion durch Neutrophile zu quantifizieren. Neutrophile, die mit einem Agonisten wie PMA behandelt wurden, der als Kontrolle verwendet wird, zeigen eine erhöhte ROS-Produktion. In Abwesenheit von Biofilmen zeigten mit PMA behandelte Neutrophile eine robuste ROS-Produktion. In Gegenwart von S. aureus Biofilm nahm die gesamte ROS-Produktion von Neutrophilen, die mit PMA behandelt wurden, ab. In Abwesenheit von PMA verlassen sich Neutrophile ausschließlich auf ihre Interaktion mit dem Biofilm, wodurch die Menge an produziertem ROS weiter reduziert wird (Abbildung 3B).
Um die Neutrophil-Biofilm-Wechselwirkungen mittels Fluoreszenzmikroskopie zu visualisieren, wurde ein GFP-exprimierender Stamm von S. aureus, Blue CMAC Farbstoff und Ethidiumhomodimer-1 verwendet, der das Zytoplasma lebender Zellen bzw. DNA toter Zellen färbt. S. aureus Biofilm wurde für 18 h in einem 6 μ-Kanal-Dia gezüchtet. Blaue CMAC-Farbstoff-markierte Neutrophile wurden zusammen mit Ethidiumhomodimer-1 zu den gewaschenen Biofilmen gegeben und vor der Bildgebung für 30 min bei 37 °C mit 5% CO2 inkubiert. Die Weitfeld-Fluoreszenzmikroskopie zeigte, dass viele Neutrophile auf der Oberfläche von S. aureus-Biofilmen lokalisiert waren, während sich einige im Biofilm befinden (Abbildung 4A). Die Interaktion zwischen S. aureus-Zellen innerhalb von Neutrophilen war ebenfalls offensichtlich (Abbildung 4C). Die meisten S. aureus-Zellen, die mit Neutrophilen (Cyan) interagieren, waren tot (Magenta), während einige am Leben blieben (gelb), wie durch Lebend-Tot-Färbung bestimmt (Abbildung 4C). Zum Vergleich wurden GFP-exprimierende S. aureus-Biofilme mit Ethidiumhomodimer-1 angefärbt, was einen Bruchteil der toten S. aureus-Population innerhalb des Biofilms zeigte (Abbildung 4B). Nicht lebensfähige Neutrophile, die positiv für Ethidiumhomodimer-1 waren, wurden nach Inkubation mit S. aureus-Biofilmen mittels Analysesoftware (siehe Materialtabelle) quantifiziert. Etwa 48% der Neutrophilen waren bereits innerhalb von 30 Minuten nach der Inkubation mit S. aureus Biofilm tot. Während der Optimierung des Mikroskopieprotokolls wurde auch die Wirkung des Waschens des Biofilms und der Neutrophilen nach 30-minütiger Inkubation zur Entfernung von nicht haftenden Neutrophilen bewertet, wobei etwa 33% der toten Neutrophilen noch am Biofilm gebunden waren (Abbildung 4D).
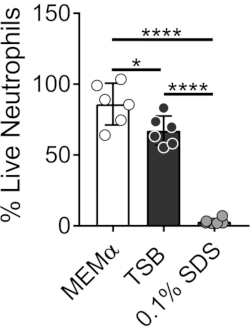
Abbildung 1: Der LIVE-DEAD-Assay vergleicht das Überleben von Neutrophilen zwischen Bakterien- und Säugetierwachstumsmedien. Neutrophile wurden isoliert und in HBSS, MEMα, TSB oder 0,1% SDS für 30 min inkubiert. Die LIVE-DEAD-Färbung wurde mit Calcein AM (lebend) und Ethidiumhomodimer-1 (tot) durchgeführt. Der Prozentsatz der lebenden Neutrophilen wurde bestimmt, wobei HBSS-inkubierte Neutrophile als 100% lebende Neutrophile behandelt wurden. Die Ergebnisse stellen einen Durchschnitt von zwei unabhängigen Experimenten dar, die in dreifacher Ausfertigung durchgeführt wurden, wobei Neutrophile von zwei verschiedenen Donatoren gewonnen wurden. Die Daten werden als Mittelwert ± SD (*p < 0,05, ****p < 0,0001 dargestellt. Einweg-ANOVA). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
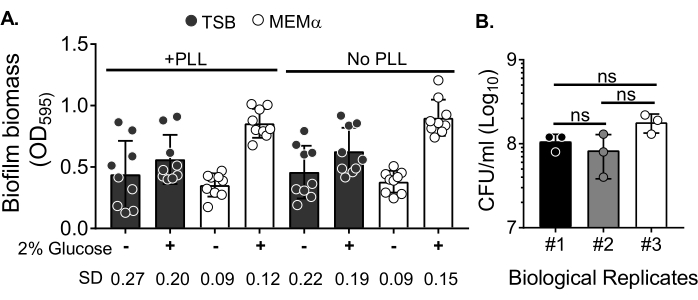
Abbildung 2: Quantifizierung der Biofilmbiomasse unter verschiedenen Bedingungen und bakterielle Lebensfähigkeit von Biofilmen, die unter den optimierten Bedingungen gezüchtet wurden. (A) S. aureus wurde in einer 96-Well-Platte ausgesät, die entweder mit Poly-L-Lysin (PLL) beschichtet oder unbeschichtet war. Biofilme wurden in TSB, MEMα oder einem der mit 2% Glucose ergänzten Medien unter statischen Bedingungen für 18 h gezüchtet. Kristallviolette (CV) Färbung wurde durchgeführt, um Biofilmbiomasse zu färben. Der eluierte CV-Fleck wurde bei 1:10 verdünnt und in einem Mikrotiterplatten-Reader abgelesen. Die Ergebnisse repräsentieren durchschnittlich drei unabhängige Experimente, die in dreifacher Ausfertigung durchgeführt wurden. Die Daten werden als Mittelwert ± SD dargestellt. Der SD für jede Gruppe ist unten dargestellt, um die Variabilität verschiedener Biofilmwachstumsbedingungen zu demonstrieren. (B) Bakterielle KBE-Zahlen wurden aus Biofilmen erhalten, die in einem optimierten Medium (MEMα + 2% Glukose) gezüchtet wurden. Die statischen 18-Stunden-Biofilme wurden der gleichen Anzahl von Wäschen unterzogen, gefolgt von einer 10-minütigen Beschallung, um die Biofilmbiomasse zu lösen, und durch eine 22G-Nadel geleitet, um die Aggregate vor der Beschichtung zu stören. Die Ergebnisse repräsentieren drei Replikate, die in dreifacher Ausführung durchgeführt werden. Die Daten werden als Mittelwert ± SD (ns = nicht signifikant) dargestellt. Einweg-ANOVA). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
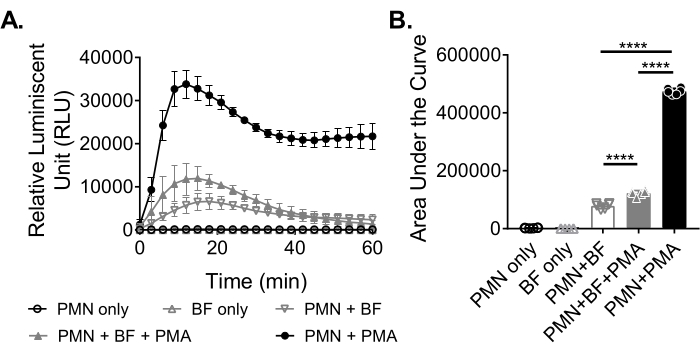
Abbildung 3: Quantifizierung der ROS-Produktion durch Neutrophile mittels Chemilumineszenz-Assay. (A) Neutrophile (PMN) wurden mit HBSS-gewaschenen S. aureus-Biofilmen (BF) entweder in Gegenwart (geschlossenes graues Dreieck) oder Abwesenheit (offenes graues umgekehrtes Dreieck) von PMA inkubiert, um die ROS-Produktion durch Neutrophile zu messen. Luminol wurde verwendet, um ROS alle 3 Minuten für 60 Minuten in einem Mikrotiterplatten-Reader zu detektieren. Während Neutrophile, die in Abwesenheit eines Biofilms (geschlossener schwarzer Kreis) mit PMA behandelt wurden, als Positivkontrolle dienten, dienten nur neutrophile (offener schwarzer Kreis) und nur Biofilm (offenes graues Dreieck) Gruppen als Negativkontrollen. Die Daten stellen durchschnittlich zwei unabhängige Experimente dar, die in dreifacher Ausfertigung mit Neutrophilen von zwei verschiedenen Donatoren durchgeführt wurden. Die Daten werden als Mittelwert ± SD dargestellt. (B) Die Fläche unter der Kurve von (A) wurde berechnet, um die von den Neutrophilen erzeugte Gesamt-ROS zu quantifizieren. Die Daten werden als Mittelwert ± SD dargestellt. (***p < 0,0001. Einweg-ANOVA). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
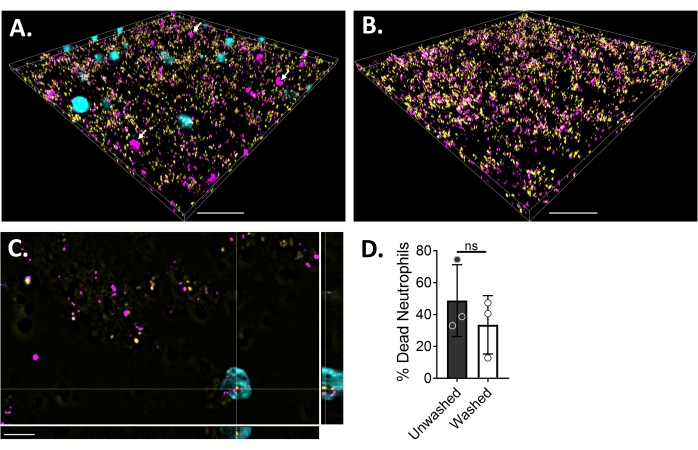
Abbildung 4: Visualisierung der Interaktion zwischen S. aureus Biofilm und Neutrophilen mittels Weitfeldfluoreszenzmikroskopie. Blaue CMAC-Farbstoff-markierte Neutrophile (Cyan) wurden mit Ethidiumhomodimer-1 (Magenta; tot) ergänzt, bevor sie mit einem 18 h S. aureus-Biofilm (gelb) inkubiert wurden. Biofilm-Neutrophilen-Wechselwirkungen wurden mittels Weitfeld-Fluoreszenzmikroskopie abgebildet und Bilder mit einer Bildanalysesoftware verarbeitet. Die Experimente wurden mit drei verschiedenen Spendern durchgeführt. Repräsentative Bilder werden präsentiert als (A) 3D-Ansicht des S. aureus-Biofilms mit lebenden (cyan) und toten (Magenta; einige mit weißen Pfeilen gekennzeichnet) Neutrophilen, (B) 3D-Ansicht eines S. aureus-Biofilms in Abwesenheit von Neutrophilen mit entweder lebendem S. aureus, das GFP (gelb) oder totes S. aureus exprimiert, gefärbt mit Ethidiumhomodimer-1 (Magenta), (C) eine orthogonale Ansicht von S. aureus und Neutrophilen-Interaktion, dargestellt durch die xy-, yz- und xz-Ebenen, und (D) Quantifizierung der Neutrophilenlebensfähigkeit in Gegenwart von S. aureus-Biofilm nach 30 min entweder sofort (ungewaschen) oder nach drei Waschrunden mit HBSS, um nicht haftende Neutrophile (gewaschen) zu entfernen. Der neutrophile Zelltod wird als mittlerer ± SD (Student's t-Test) dargestellt. Der Maßstabsbalken zeigt 50 μm in (A) und (B) und 10 μm in (C) an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Es gab zahlreiche Bemühungen, robuste und reproduzierbare S. aureus-Biofilme für nachgeschaltete Experimente in vitro48,49,50 zu züchten. Es wird ein standardisiertes Protokoll skizziert, das die kationische Natur von PLL nutzt und die Medien mit Glukose für das Wachstum robuster In-vitro-S. aureus-Biofilme ergänzt. Die Zugabe von PLL ermöglicht eine bessere Bindung der negativ geladenen Bakterienzelle an die positiv geladenen PLL-beschichteten Oberflächen. Es ist wichtig zu beachten, dass PLL bei einer Konzentration von 10 μg / ml antimikrobielle Aktivität gegen Pseudomonas aeruginosa, Escherichia coli und S. aureus hat, wenn es für 24 h51 inkubiert wird. Die gleiche Konzentration wird verwendet, um Oberflächen zu beschichten; Überschüssige PLL wird jedoch abgesaugt, wodurch die Konzentration von PLL bei der Aussaat für das Biofilmwachstum unter 10 μg / ml liegt.
Es ist wichtig zu beachten, dass PLL nur in spezifischen Wachstumsmedien wie MEMα mit 2% Glukose funktioniert hat, wo beobachtet wurde, dass S. aureus robuste Biofilme mit minimaler Variabilität produziert (Abbildung 2A). Die PLL-Konzentration, die in Verbindung mit anderen Medientypen verwendet werden soll, würde eine weitere Optimierung erfordern, z. B. die Verwendung einer erhöhten Konzentration von PLL zur Beschichtung der Wells. Zusätzlich wurden diese Bedingungen für einen monospeziesischen S. aureus-Biofilm optimiert. Während chronische Wundbiofilme oft polymikrobiell sind, ist die Standardisierung von Assays zur Untersuchung des Monospezies-Biofilms und seiner Wechselwirkungen mit Neutrophilen und anderen Immunzellen der Schlüssel zum Verständnis ihres Beitrags zur Pathogenese52. Diese standardisierten Protokolle können weiter optimiert werden, um polymikrobielle Biofilme und ihre Wechselwirkungen mit Neutrophilen zu erhalten und zu untersuchen.
Es wurde auch beobachtet, dass reichhaltige bakterielle Kulturmedien wie TSB zu einem Verlust der Lebensfähigkeit von Neutrophilen führten (Abbildung 1). Daher wurden die Wachstumsbedingungen von S. aureus-Biofilmen in MEMα, die für Säugetierzellkulturen verwendet werden, optimiert. Für Studien mit Neutrophilen unterstützt dieses Medium die Lebensfähigkeit von Neutrophilen und fördert das Wachstum von S. aureus. Während beobachtet wurde, dass Medien die Lebensfähigkeit von Neutrophilen beeinflussen, ist es auch wichtig zu berücksichtigen, dass Neutrophile, die aus peripherem menschlichem Blut isoliert wurden, eine Apoptose ex vivo mit etwa 70% apoptotischen Neutrophilen bis 20 h53 durchlaufen. Dies erfordert eine ordnungsgemäße Handhabung, wie die Lagerung der Neutrophilen auf Eis bei der Vorbereitung von Experimenten, die Verwendung endotoxinfreier Reagenzien und die Verhinderung der Aktivierung von Neutrophilen, indem das Wirbeln von Proben mit Neutrophilen vermieden wird.
Die Bewertung des oxidativen Bursts in Neutrophilen wird routinemäßig durchgeführt, um die Abtötungswirkung von Neutrophilen auf den Erreger14,54,55 zu bestimmen. Diese Studien werden häufig mit planktonischen Bakterien durchgeführt, bei denen Neutrophile hinzugefügt werden, und die oxidative Burst-Reaktion wird mit luminol-amplifizierter Chemilumineszenz quantifiziert, die Superoxid-Anionen nachweist, die von Neutrophilen produziert werden. Das vorliegende Protokoll wird modifiziert, indem planktonische Bakterien durch statisch gewachsenen 18 h S. aureus-Biofilm ersetzt werden. So können Neutrophile direkt dem Biofilm zugesetzt werden, um ihre Aktivierung zu beurteilen. Auf der anderen Seite produzieren Bakterien in Biofilmen Enzyme wie Katalase und Superoxiddismutase, um ROS23,56 zu entgiften. Staphylococcus epidermidis Biofilme produzieren unter Stress eine höhere Katalase als ihr planktonisches Gegenstück57. Die Gesamtchemilumineszenz von PMA-stimulierten Neutrophilen in einem S. aureus-Biofilm ist signifikant niedriger als die PMA-stimulierten Neutrophilen, bei denen kein Biofilm vorhanden ist (Abbildung 2). Dies kann auf die Aktivität dieser entgiftenden Enzyme zurückzuführen sein. Darüber hinaus produzieren S. aureus-Biofilme mehrere porenbildende Toxine, die Leukocidine genannt werden und Neutrophile abtöten58. Die reduzierte Burst-Reaktion ist wahrscheinlich auch auf die verminderte Lebensfähigkeit von Neutrophilen in Gegenwart von S. aureus-Biofilm zurückzuführen. Während diese Studie Luminol verwendet, das das gesamte ROS sowohl innerhalb als auch außerhalb der Zellen nachweist, müssen andere Reagenzien wie CM-H2DCFDA (5-(und-6)-Chlormethyl-2'7'-dichlordihydrofluoresceindiacetat oder Isoluminol in Betracht gezogen werden, wenn das Ziel der Arbeit darin besteht, die intrazelluläre oder extrazelluläre ROS-Produktion14,53,54 spezifisch zu untersuchen.
Die Fähigkeit, Neutrophil-Biofilm-Wechselwirkungen mittels Mikroskopie sichtbar zu machen, kann Aufschluss über das Verhalten von Neutrophilen und Biofilmen in Gegenwart zueinander geben. Die Anregungs- und Emissionsspektren der fluoreszierenden Farbstoffe und Proteine stellen eine Momentaufnahme der Interaktion zwischen einem 18 h S. aureus Biofilm und Neutrophilen nach einer 30-minütigen Inkubation dar. Um Signale von gefärbten Zellen effektiv zu erfassen, ist es wichtig, die Exposition der Proben gegenüber Lichtquellen zu begrenzen, während die Proben für die Mikroskopie eingerichtet werden. Bei der Bildgebung wurde ein schnelles Photobleaching der Proben vermieden, indem die Intensität der Lichtquelle verringert wurde, wenn alle Parameter wie Z-Stack-Höhe und Belichtungszeit für verschiedene Kanäle angepasst wurden.
Diese einfachen Praktiken ermöglichten eine korrekte Mikroskopie-Bildgebung, bei der beobachtet wurde, dass nur wenige Neutrophile im Biofilm lokalisiert sind (Abbildung 4A). Dies kann auf Räume innerhalb des Biofilms zurückzuführen sein, da der 18 h S. aureus-Biofilm, der in MEMα mit 2% Glukose gezüchtet wird, die Oberfläche nicht gleichmäßig bedeckt (Abbildung 4B). Die Verwendung von Rich Media durch andere Studien hat jedoch gezeigt, dass ein einheitlicher Rasen von S. aureus-Biofilmwachstum und Leukozyten durch den Biofilmeindringen 30,58. Darüber hinaus wird auch beobachtet, dass es nach 30 Minuten Inkubation mit S. aureus-Biofilmen zu einem neutrophilen Zelltod kam, der auf S. aureus-Biofilm-produzierte Leukocidine zurückzuführen ist, die Neutrophile58 lysieren (Abbildung 4A,D). Zugabe eines Waschschritts zur Entfernung von nicht adhärenten Neutrophilen nach Inkubation mit Biofilm für 30 min entfernte ~15% der toten Neutrophilen aus dem System im Vergleich zur ungewaschenen Gruppe, in der die Mikroskopie unmittelbar nach 30 min Inkubation durchgeführt wurde (Abbildung 4D). Neutrophile, die mit S. aureus interagieren, wurden ebenfalls beobachtet (Abbildung 4C). Weitere Experimente sind erforderlich, um zu beurteilen, ob S. aureus von Neutrophilen verschlungen oder an die Zelloberfläche von Neutrophilen54 gebunden ist. Die Bildgebung von Neutrophilen und Biofilmen ist der erste Schritt, um mehrere neutrophile Funktionalitäten wie Phagozytose und NETosis54,59 zu bewerten. Die Wirkung von Neutrophilen auf Biofilme kann auch bewertet werden, indem unter anderem die Biomasse des Biofilms, strukturelle Veränderungen des Biofilms und die Lebensfähigkeit des Biofilms unter Verwendung der in Schritt 5.6 aufgeführten Bildanalysewerkzeuge quantifiziert werden. Schließlich besteht bei Neutrophilen eine Donor-to-Donor-Variabilität; Daher wird empfohlen, mindestens drei verschiedene Spender für Studien mit Neutrophilen zu verwenden.
Insgesamt wurden standardisierte in vitro Assays kombiniert, um Wechselwirkungen zwischen Neutrophilen und Biofilmen zu bewerten. Obwohl diese Assays S. aureus verwenden, können die beschriebenen Protokolle leicht angepasst werden, um andere Krankheitserreger zu untersuchen. Während es verschiedene In-vivo-Modelle gibt, um Wirt-Pathogen-Interaktionen zu untersuchen, können sie teuer und arbeitsintensiv sein, insbesondere wenn die Bedingungen nicht optimiert sind. Die Arbeit mit standardisierten In-vitro-Assays ermöglicht es, die experimentellen Bedingungen zu optimieren und Beobachtungen zu bestätigen, bevor man zu einem In-vivo-System übergeht. Schließlich wurden verschiedene Tierinfektionsmodelle verwendet, um Biofilm-Neutrophilen-Interaktionen in vivo zu untersuchen. Es ist jedoch wichtig, immunologische Unterschiede zwischen Menschen- und Tiermodellenzu berücksichtigen 60,61,62,63. Dies erfordert die Verwendung von Neutrophilen aus dem Menschen, um diese komplexen Wirt-Pathogen-Interaktionen zu untersuchen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde vom National Institute of Allergy and Infectious Diseases (R01AI077628) an DJW und einem American Heart Association Career Development Award (19CDA34630005) an ESG finanziert. Wir danken Dr. Paul Stoodley für die Bereitstellung des USA 300 LAC GFP-Stammes. Darüber hinaus würdigen wir Ressourcen der Campus Microscopy and Imaging Facility (CMIF) und der OSU Comprehensive Cancer Center (OSUCCC) Microscopy Shared Resource (MSR) der Ohio State University. Wir danken auch Amelia Staats, Peter Burback und Lisa Coleman vom Stoodley-Labor für die Durchführung von Blutabnahmen.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.9% sodium chloride irrigation, USP | Baxter | 2F7124 | Endotoxin-free; Used for isolation of neutrophils |
| 150 mL rapid-flow filter unit | Thermo Scientific | 565-0020 | |
| 200 proof ethanol | VWR | 89125-188 | |
| 3 mL syringe | BD | 309657 | Used for blood draw |
| 50 mL conical centrifuge tubes | Thermo Scientific | 339652 | |
| 60 mL syringe | BD | 309653 | Used for blood draw |
| Agar | Fisher Bioreagents | BP1423-2 | |
| Alcohol swab | BD | Used for blood draw | |
| Band-aids | Used for blood draw | ||
| BD Bacto Tryptic Soy Broth | BD | DF0370-07-5 | Combine with 1.5% agar to make Tryptic Soy Agar |
| Cell counter | Bal Saupply | 202C | |
| CellTracker blue CMCH | Invitrogen | C2111 | Blue CMAC Dye (BCD) |
| Clear bottom 96-well flat bottom polystyrene plates | Costar | 3370 | |
| Cotton gauze | Fisherbrand | 13-761-52 | Used for blood draw |
| Crystal violet | Acros Organic | 40583-0250 | |
| Culture tubes | Fisherbrand | 14-961-27 | Borosilicate Glass 13 x 100 mm |
| D-(+)-glucose | Sigma | G-8270 | |
| Dextran from Leuconostoc spp. | Sigma | 31392-250G | Used for isolation of neutrophils |
| Dulbecco's phosphate buffered saline (DPBS) 1x | Gibco | 14190-144 | |
| Ethidium homodimer-1 | Invitrogen | L3224 B | |
| Ficoll-Paque plus | Cytiva | 17144003 | Used for isolation of neutrophils (density gradient medium) |
| Hanks' balanced salt solution (HBSS) 1x | Corning cellgro | 21-022-CV | without calcium, magnesium, and phenol red |
| Hemacytometer | Bright Line | ||
| Heparin | Novaplus | NDC 63323-540-57 | 1000 USP units/mL, Used for blood draw |
| IMARIS 9.8 | Oxford Instruments | Microscopy image analysis software | |
| Luminol | Sigma | A8511-5G | |
| Minimal essential media (MEM) Alpha 1x | Gibco | 41061-029 | |
| Needle (23 G1) | BD | 305145 | Used for blood draw |
| Nikon Eclipse Ti2 | Nikon | ||
| NIS-Elements | Nikon | Quantification of dead neutrophils | |
| Normal human serum | Complement Technology | NHS | |
| Petri Dish (100 x 15 mm) | VWR | 25384-342 | |
| Phorbol 12-myristate 13-acetate | |||
| Poly-L-lysine solution | Sigma | P4707-50ML | |
| Sodium chloride | Fisher Bioreagents | BP358-10 | Used for neutrophil isolation |
| SoftMax Pro Software | Molecular Devices | Microplate reader software used for data acquisition | |
| SpectraMax i3x | Molecular Devices | Microplate reader | |
| Sterile water for irrigation, USP | Baxter | 2F7114 | Endotoxin-free; Used for neutrophil isolation |
| Surflo winged infusion set | Terumo | SC*19BLK | 19 G x 3/4", used for blood draw |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Turnicate | Used for blood draw | ||
| UltraPure distilled water | Invitrogen | 10977015 | |
| White opaque 96-well plates | Falcon | 353296 | Tissue culture treated and flat bottom plate |
| μ-Slide VI 0.4 | Ibidi | 80601 | μ-channel slide |
Referenzen
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerging Infectious Diseases. 8 (9), 881-890 (2002).
- Alhede, M., et al. Phenotypes of non-attached Pseudomonas aeruginosa aggregates resemble surface attached biofilm. PLoS One. 6 (11), 27943(2011).
- Hall-Stoodley, L., Costerton, J. W., Stoodley, P. Bacterial biofilms: from the natural environment to infectious diseases. Nature Reviews: Microbiology. 2 (2), 95-108 (2004).
- Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clinical Microbiology Reviews. 15 (2), 167-193 (2002).
- Schilcher, K., Horswill, A. R. Staphylococcal biofilm development: structure, regulation, and treatment strategies. Microbiology and Molecular Biology Reviews. 84 (3), 0002(2020).
- Kaplan, J. B. Biofilm dispersal: mechanisms, clinical implications, and potential therapeutic uses. Journal of Dental Research. 89 (3), 205-218 (2010).
- Otto, M. Staphylococcal Biofilms. Microbiology Spectrum. 6 (4), 10(2018).
- Moormeier, D. E., Bayles, K. W. Staphylococcus aureus biofilm: a complex developmental organism. Molecular Microbiology. 104 (3), 365-376 (2017).
- Gross, M., Cramton, S. E., Gotz, F., Peschel, A. Key role of teichoic acid net charge in Staphylococcus aureus colonization of artificial surfaces. Infection and Immunity. 69 (5), 3423-3426 (2001).
- Zheng, Y., He, L., Asiamah, T. K., Otto, M. Colonization of medical devices by staphylococci. Environmental Microbiology. 20 (9), 3141-3153 (2018).
- Donlan, R. M. Biofilms and device-associated infections. Emerging Infectious Diseases. 7 (2), 277-281 (2001).
- Kolaczkowska, E., Kubes, P. Neutrophil recruitment and function in health and inflammation. Nature Reviews Immunology. 13 (3), 159-175 (2013).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annual Review of Immunology. 30, 459-489 (2012).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- van Kessel, K. P., Bestebroer, J., van Strijp, J. A. Neutrophil-mediated phagocytosis of Staphylococcus aureus. Frontiers in Immunology. 5, 467(2014).
- Nguyen, G. T., Green, E. R., Mecsas, J. Neutrophils to the ROScue: Mechanisms of NADPH oxidase activation and bacterial resistance. Frontiers in Cellular and Infection Microbiology. 7, 373(2017).
- Saini, R., Singh, S. Inducible nitric oxide synthase: An asset to neutrophils. Journal of Leukocyte Biology. 105 (1), 49-61 (2019).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Segal, A. W. The function of the NADPH oxidase of phagocytes and its relationship to other NOXs in plants, invertebrates, and mammals. The International Journal of Biochemistry and Cell Biology. 40 (4), 604-618 (2008).
- Fang, F. C. Antimicrobial reactive oxygen and nitrogen species: concepts and controversies. Nature Reviews Microbiology. 2 (10), 820-832 (2004).
- Bogdan, C. Nitric oxide and the immune response. Nature Immunology. 2 (10), 907-916 (2001).
- Chua, S. L., et al. Reactive oxygen species drive evolution of pro-biofilm variants in pathogens by modulating cyclic-di-GMP levels. Open Biology. 6 (11), 160162(2016).
- El Haj, C., Lichtenberg, M., Nielsen, K. L., Bjarnsholt, T., Jensen, P. O. Catalase protects biofilm of Staphylococcus aureus against daptomycin activity. Antibiotics. 10 (5), 511(2021).
- Ghimire, N., et al. Direct microscopic observation of human neutrophil-Staphylococcus aureus interaction in vitro suggests a potential mechanism for initiation of biofilm infection on an implanted medical device. Infection and Immunity. 87 (12), 00745(2019).
- Bhattacharya, M., et al. Leukocidins and the nuclease nuc prevent neutrophil-mediated killing of Staphylococcus aureus biofilms. Infection and Immunity. 88 (10), 00372(2020).
- Bogachev, M. I., et al. Fast and simple tool for the quantification of biofilm-embedded cells sub-populations from fluorescent microscopic images. PLoS One. 13 (5), 0193267(2018).
- Kerstens, M., et al. A flow cytometric approach to quantify biofilms. Folia Microbiologica. 60 (4), 335-342 (2015).
- Meyle, E., et al. Destruction of bacterial biofilms by polymorphonuclear neutrophils: relative contribution of phagocytosis, DNA release, and degranulation. The International Journal of Artificial Organs. 33 (9), 608-620 (2010).
- Oveisi, M., et al. Novel assay to characterize neutrophil responses to oral biofilms. Infection and Immunity. 87 (2), 00790(2019).
- Leid, J. G., Shirtliff, M. E., Costerton, J. W., Stoodley, P. Human leukocytes adhere to, penetrate, and respond to Staphylococcus aureus biofilms. Infection and Immunity. 70 (11), 6339-6345 (2002).
- Fey, P. D., et al. A genetic resource for rapid and comprehensive phenotype screening of nonessential Staphylococcus aureus genes. mBio. 4 (1), 00537(2013).
- Cody, W. L., et al. Skim milk enhances the preservation of thawed -80 degrees C bacterial stocks. Journal of Microbiological Methods. 75 (1), 135-138 (2008).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. 63, 3064(2012).
- Freitas, M., Porto, G., Lima, J. L., Fernandes, E. Optimization of experimental settings for the analysis of human neutrophils oxidative burst in vitro. Talanta. 78 (4-5), 1476-1483 (2009).
- Merritt, J. H., Kadouri, D. E., O'Toole, G. A. Growing and analyzing static biofilms. Current Protocols in Microbiology. , Chapter 1 Unit 1B 1 (2005).
- Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. 412, 15-20 (2007).
- Zhou, L., et al. Impact of human granulocyte and monocyte isolation procedures on functional studies. Clinical and Vaccine Immunology. 19 (7), 1065-1074 (2012).
- Quach, A., Ferrante, A. The application of dextran sedimentation as an initial step in neutrophil purification promotes their stimulation, due to the presence of monocytes. Journal of Immunology Research. 2017, 1254792(2017).
- Karlsson, A., Nixon, J. B., McPhail, L. C. Phorbol myristate acetate induces neutrophil NADPH-oxidase activity by two separate signal transduction pathways: dependent or independent of phosphatidylinositol 3-kinase. Journal of Leukocyte Biology. 67 (3), 396-404 (2000).
- Staats, A., et al. Rapid aggregation of Staphylococcus aureus in synovial fluid is influenced by synovial fluid concentration, viscosity, and fluid dynamics, with evidence of polymer bridging. mBio. , 0023622(2022).
- Chiu, I. M., et al. Bacteria activate sensory neurons that modulate pain and inflammation. Nature. 501 (7465), 52-57 (2013).
- Hartig, S. M. Basic image analysis and manipulation in ImageJ. Current Protocols in Molecular Biology. 102 (1), 14-15 (2013).
- Heydorn, A., et al. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146 (10), 2395-2407 (2000).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Luo, T. L., et al. Introducing BAIT (Biofilm Architecture Inference Tool): a software program to evaluate the architecture of oral multi-species biofilms. Microbiology. 165 (5), 527-537 (2019).
- Naves, P., et al. Measurement of biofilm formation by clinical isolates of Escherichia coli is method-dependent. Journal of Applied Microbiology. 105 (2), 585-590 (2008).
- Eze, E. C., El Zowalaty, M. E. Combined effects of low incubation temperature, minimal growth medium, and low hydrodynamics optimize Acinetobacter baumannii biofilm formation. Infection and Drug Resistance. 12, 3523-3536 (2019).
- Harris, L. G., Tosatti, S., Wieland, M., Textor, M., Richards, R. G. Staphylococcus aureus adhesion to titanium oxide surfaces coated with non-functionalized and peptide-functionalized poly(L-lysine)-grafted-poly(ethylene glycol) copolymers. Biomaterials. 25 (18), 4135-4148 (2004).
- Miao, J., et al. Biofilm formation of Staphylococcus aureus under food heat processing conditions: first report on cml production within biofilm. Scientific Reports. 9 (1), 1312(2019).
- Lade, H., et al. Biofilm formation by Staphylococcus aureus clinical isolates is differentially affected by glucose and sodium chloride supplemented culture media. Journal of Clinical Medicine. 8 (11), 1853(2019).
- Guzel Kaya, G., et al. Antibacterial activity of linezolid against gram-negative bacteria: utilization of epsilon-Poly-l-Lysine capped silica xerogel as an activating carrier. Pharmaceutics. 12 (11), 1126(2020).
- Clinton, A., Carter, T. Chronic wound biofilms: pathogenesis and potential therapies. Laboratory Medicine. 46 (4), 277-284 (2015).
- Scheel-Toellner, D., et al. Reactive oxygen species limit neutrophil life span by activating death receptor signaling. Blood. 104 (8), 2557-2564 (2004).
- Pestrak, M. J., et al. Pseudomonas aeruginosa rugose small-colony variants evade host clearance, are hyper-inflammatory, and persist in multiple host environments. PLoS Pathogens. 14 (2), 1006842(2018).
- Guerra, F. E., et al. Staphylococcus aureus SaeR/S-regulated factors reduce human neutrophil reactive oxygen species production. Journal of Leukocyte Biology. 100 (5), 1005-1010 (2016).
- Suo, Y., Huang, Y., Liu, Y., Shi, C., Shi, X. The expression of superoxide dismutase (SOD) and a putative ABC transporter permease is inversely correlated during biofilm formation in Listeria monocytogenes 4b G. PLoS One. 7 (10), 48467(2012).
- Olwal, C. O., Ang'ienda, P. O., Ochiel, D. O. Alternative sigma factor B (sigma(B)) and catalase enzyme contribute to Staphylococcus epidermidis biofilm's tolerance against physico-chemical disinfection. Scientific Reports. 9 (1), 5355(2019).
- Bhattacharya, M., et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing. Proceedings of the National Academy of Sciences of the United States of America. 115 (28), 7416-7421 (2018).
- Masuda, S., et al. NETosis markers: Quest for specific, objective, and quantitative markers. Clinica Chimica Acta. 459, 89-93 (2016).
- Dworsky, E. M., et al. Novel in vivo mouse model of implant related spine infection. Journal of Orthopaedic Research. 35 (1), 193-199 (2017).
- Pletzer, D., Mansour, S. C., Wuerth, K., Rahanjam, N., Hancock, R. E. New mouse model for chronic infections by gram-negative bacteria enabling the study of anti-infective efficacy and host-microbe interactions. mBio. 8 (1), 00140(2017).
- Davis, M. M. A prescription for human immunology. Immunity. 29 (6), 835-838 (2008).
- Mestas, J., Hughes, C. C. Of mice and not men: differences between mouse and human immunology. The Journal of Immunology. 172 (5), 2731-2738 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten