Method Article
Saggi standardizzati in vitro per visualizzare e quantificare le interazioni tra neutrofili umani e biofilm di Staphylococcus aureus
In questo articolo
Riepilogo
Il presente protocollo descrive lo studio delle interazioni neutrofili-biofilm. I biofilm di Staphylococcus aureus sono stabiliti in vitro e incubati con neutrofili umani derivati dal sangue periferico. La risposta di scoppio ossidativo dei neutrofili viene quantificata e la localizzazione dei neutrofili all'interno del biofilm viene determinata al microscopio.
Abstract
I neutrofili sono la prima linea di difesa dispiegata dal sistema immunitario durante l'infezione microbica. In vivo, i neutrofili vengono reclutati nel sito di infezione dove utilizzano processi come la fagocitosi, la produzione di specie reattive dell'ossigeno e dell'azoto (ROS, RNS, rispettivamente), la NETosi (trappola extracellulare dei neutrofili) e la degranulazione per uccidere i microbi e risolvere l'infezione. Le interazioni tra neutrofili e microbi planctonici sono state ampiamente studiate. Negli ultimi anni sono emersi interessi nello studio delle infezioni causate dai biofilm. I biofilm mostrano proprietà, tra cui la tolleranza all'uccisione da parte dei neutrofili, distinte dalle loro controparti coltivate in planctonico. Con il successo della creazione di modelli di biofilm sia in vitro che in vivo , le interazioni tra queste comunità microbiche con diverse cellule immunitarie possono ora essere studiate. Qui, le tecniche che utilizzano una combinazione di modelli di biofilm tradizionali e saggi di attività dei neutrofili ben consolidati sono adattate specificamente per studiare le interazioni tra neutrofili e biofilm. La microscopia a fluorescenza ad ampio campo viene utilizzata per monitorare la localizzazione dei neutrofili nei biofilm. Questi biofilm sono coltivati in condizioni statiche, seguiti dall'aggiunta di neutrofili derivati dal sangue periferico umano. I campioni vengono colorati con coloranti appropriati prima della visualizzazione al microscopio. Inoltre, la produzione di ROS, che è una delle tante risposte dei neutrofili contro i patogeni, è quantificata in presenza di un biofilm. L'aggiunta di cellule immunitarie a questo sistema consolidato amplierà la comprensione delle interazioni ospite-patogeno, garantendo al contempo l'uso di condizioni standardizzate e ottimizzate per misurare accuratamente questi processi.
Introduzione
Un biofilm è una comunità di microbi associati alla superficie o aggregati non attaccati racchiusi in una sostanza polimerica extracellulare (EPS)1,2. Queste comunità proteggono i microrganismi racchiusi dai fattori di stress ambientali, compresa la tolleranza agli agenti antimicrobici e al sistema immunitario3. Diverse specie microbiche patogene formano biofilm che sono stati associati a infezioni croniche4. Lo sviluppo di biofilm è un processo complesso che coinvolge l'attaccamento alle superfici, la produzione di EPS, la proliferazione cellulare, la strutturazione del biofilm e il distacco cellulare5. Una volta che le cellule si disperdono per formare un biofilm, rimangono planctoniche o traslocano in un nuovo substrato e riavviano lo sviluppo del biofilm6.
Lo Staphylococcus aureus, un patogeno opportunista, segue uno schema generale di sviluppo del biofilm, tra cui attaccamento, proliferazione, maturazione e dispersione7. Il processo di attaccamento nei biofilm di S. aureus è dettato da interazioni idrofobiche, acidi teicoici e componenti superficiali microbici che riconoscono le molecole della matrice adesiva (MSCRAMM)8,9. All'inizio della proliferazione di S. aureus,viene prodotto EPS, che consiste principalmente di polisaccaridi, proteine, DNA extracellulare e acidi teicoici, 5. Man mano che vengono prodotti componenti EPS, vengono prodotti anche vari esoenzimi e piccole molecole, contribuendo alla struttura 3-dimensionale del biofilm e favorendo il distacco5. S. aureus sfrutta questo stile di vita altamente coordinato per stabilire varie infezioni croniche, comprese le infezioni dovute alla presenza di dispositivi medici10.
Lo S. aureus meticillino-resistente (MRSA) è una delle principali cause di infezioni correlate ai dispositivi medici permanenti, come cateteri venosi e urinari centrali, articolazioni protesiche, pacemaker, valvole cardiache meccaniche e dispositivi intrauterini11. Durante tali infezioni, i neutrofili sono le prime cellule immunitarie ospiti reclutate nel sito di infezione per combattere i patogeni attraverso strategie multiple12. Questi includono la fagocitosi, la degranulazione, la produzione di specie reattive dell'ossigeno e dell'azoto (ROS / RNS) o il rilascio di trappole extracellulari (NET) per eliminare i patogeni13.
La generazione di ROS dopo fagocitosi dei microbi è una delle risposte antimicrobiche chiave esibite dai neutrofili14. La fagocitosi è potenziata se i microbi sono rivestiti in opsonine, in particolare immunoglobuline e componenti del complemento presenti nel siero15. I microbi opsonizzati vengono quindi riconosciuti dai recettori della superficie cellulare sui neutrofili e inghiottiti, formando un compartimento chiamato fagosoma15. I neutrofili generano e rilasciano ROS nel fagosoma attraverso la NADPH-ossidasi16 associata alla membrana. Questo complesso enzimatico multicomponente genera anioni superossido trasferendo elettroni all'ossigeno molecolare16. Inoltre, i neutrofili generano anche RNS attraverso l'espressione di ossido nitrico sintasi inducibile (iNOS)17. Questi radicali ad alto superossido e ossido nitrico all'interno del fagosoma hanno ampie attività antimicrobiche. Possono interagire con i centri metallici negli enzimi e danneggiare gli acidi nucleici, le proteine e le membrane cellulari del patogeno 18,19,20,21. Numerosi microbi adottano uno stile di vita biofilm e impiegano diverse strategie per eludere l'uccisione da ROS22,23. Pertanto, saggi standardizzati che accoppiano biofilm con neutrofili per quantificare i ROS sono utili per risultati coerenti.
Mentre i saggi, come la quantificazione della produzione di ROS neutrofili, forniscono informazioni sulle risposte dei neutrofili ai biofilm, la capacità di visualizzare le interazioni dei neutrofili all'interno di un biofilm può anche servire come un potente strumento. L'uso di coloranti fluorescenti per la microscopia richiede spesso l'ottimizzazione per ottenere immagini di alta qualità che possono essere utilizzate per l'analisi di imaging al microscopio. La flessibilità di ottimizzare alcune condizioni è limitata in quanto i neutrofili possono subire la morte cellulare post-isolamento. Inoltre, i biofilm vengono tipicamente lavati per rimuovere la popolazione planctonica dal set-up sperimentale prima dell'aggiunta di neutrofili. Durante il lavaggio, la variabilità tra i biofilm replicati può verificarsi a causa della perdita di biomassa parziale se i biofilm sono debolmente aderenti alla superficie.
In generale, i metodi attuali nel campo per analizzare le interazioni tra neutrofili e biofilm includono principalmente microscopia, citometria a flusso e enumerazione delle unità formanti colonie (CFU)24,25,26,27. La microscopia prevede l'uso di coloranti che colorano direttamente i neutrofili e i biofilm o colpiscono varie risposte dei neutrofili contro microbi come la formazione di NET, la degranulazione e la morte cellulare25,28. Un sottoinsieme di queste risposte, come la morte e la degranulazione delle cellule neutrofile, può anche essere analizzato tramite citometria a flusso, ma richiede che i neutrofili siano preferenzialmente non associati a grandi aggregati di microbi in un biofilm28,29. La citometria a flusso può anche quantificare alcuni parametri del biofilm, come la vitalità cellulare27. Questi processi, tuttavia, richiedono la rottura della biomassa del biofilm e non sarebbero utili per visualizzare altre importanti interazioni come la distribuzione spaziale dei neutrofili e dei loro componenti all'interno di un biofilm27,29,30.
Il presente protocollo si concentra sull'adattamento di alcuni dei metodi tradizionalmente utilizzati per studiare le interazioni neutrofili-biofilm su biofilm che sono stati ottimizzati per fornire una variabilità minima durante la manipolazione. Questo protocollo fornisce quindi metodi standardizzati per coltivare e quantificare biofilm, isolare i neutrofili umani primari dal sangue periferico, quantificare la produzione di ROS e visualizzare le interazioni biofilm-neutrofili tramite microscopia. Questo protocollo può essere adattato a diversi sistemi per comprendere le interazioni biofilm-neutrofili considerando l'eterogeneità tra i pool di donatori.
Protocollo
Tutte le procedure sono state approvate dall'Ohio State University Institutional Review Board (IRB) (2014H0154). È stato ottenuto il consenso scritto informato da tutti i donatori per la raccolta di sangue periferico per isolare i neutrofili umani primari. Lo Staphylococcus aureus (USA300 LAC)31 è stato utilizzato come organismo modello per l'esecuzione degli esperimenti. Gli esperimenti sono stati eseguiti con dispositivi di protezione individuale (DPI) adeguati a causa della potenziale esposizione a un agente patogeno trasmesso per via ematica.
1. Preparazione del biofilm in vitro
- Ottenere colonie isolate di S. aureus da uno stock crioconservato31 utilizzando una tecnica a piastra striata32,33 su una piastra di agar ricca di sostanze nutritive, come l'agar di soia triptico (vedi tabella dei materiali).
- Rivestire i singoli pozzetti di una piastra da 96 pozzetti con 100 μL di poli-L-lisina (PLL) allo 0,001% (v/v) diluita in H2O sterile e incubare a temperatura ambiente per 30 minuti. Asetticamente aspirare la soluzione PLL utilizzando una trappola di aspirazione assistita da vuoto. Lasciare asciugare i pozzetti durante la notte a temperatura ambiente.
NOTA: tutte le fasi di aspirazione nel protocollo vengono eseguite utilizzando una trappola di aspirazione assistita da vuoto, se non diversamente specificato. - Preparare una coltura durante la notte inoculando una colonia di S. aureus in mezzi essenziali alfa minimi (MEMα) integrata con glucosio al 2% e incubare a 37 °C, agitando a 200 giri/min per 16-18 ore.
- Diluire la coltura durante la notte trasferendo 50 μL a 5 ml di MEMα fresco integrato con glucosio al 2% e incubare a 37 °C, agitando a 200 rpm, fino alla fase logaritmica intermedia, generalmente tra densità ottica 600 (OD600nm) di 0,5-0,8. Utilizzare MEMα per normalizzare la coltura mid-logaritmica a un OD600nm di 0,1.
- Trasferire 150 μL di coltura normalizzata in ciascun pozzetto della piastra a 96 pozzetti trattata con PLL. Incubare staticamente per 18-20 h in camera umidificata a 37 °C.
NOTA: I biofilm possono essere coltivati anche in altri formati, come diapositive a μ canali (vedere Tabella dei materiali). - Aspirare il surnatante per rimuovere le cellule planctoniche. Lavare delicatamente la biomassa rimanente con 150 μL di soluzione salina bilanciata di Hanks (HBSS) per rimuovere le cellule non attaccate. Aggiungere HBSS a goccia per evitare di interrompere il biofilm.
NOTA: Durante l'aspirazione del surnatante e dell'HBSS durante i lavaggi, lasciare una quantità di liquido (surnatante o HBSS) nei pozzetti contenenti il biofilm in modo che il biofilm sia ancora immerso. Ciò impedisce l'interruzione della struttura del biofilm quando l'HBSS viene aggiunto a goccia per lavare il biofilm. - Ripetere il passaggio 1.6 almeno altre due volte per rimuovere tutte le cellule planctoniche. A questo punto, i biofilm sono pronti per esperimenti immediati a valle.
NOTA: Se i biofilm non vengono utilizzati per esperimenti sui neutrofili, l'HBSS può essere sostituito con soluzione salina tamponata con fosfato (PBS). L'HBSS è preferibile al PBS poiché l'HBSS contiene componenti, incluso il glucosio, che forniscono condizioni ottimali per l'attivazione dei neutrofili34.
2. Quantificazione della biomassa del biofilm
- Preparare una scorta di soluzione allo 0,1% (p/v) di cristallo violetto (CV) (vedere la tabella dei materiali) sciogliendo in etanolo al 20% (v/v) e all'80% (v/v) H 2 O. Assicurarsi che il CV sia completamente sciolto in etanolo prima diaggiungere H2O. Filtrare-sterilizzare la soluzione.
- Aggiungere 150 μL di soluzione CV allo 0,1% al biofilm lavato e incubare per 20 minuti a temperatura ambiente. Utilizzare almeno tre pozzi vuoti come controlli solo per i supporti.
- Aspirare la soluzione di CV allo 0,1% dai biofilm e lavare i biofilm colorati con 200 μL di 1x PBS. Ripetere questo processo per un totale di tre lavaggi per rimuovere eventuali CV in eccesso dai pozzetti.
- Aggiungere 150 μL di acido acetico glaciale al 33% (v/v) diluito con H2O. Incubare a temperatura ambiente su un bilanciere a 50 giri/min per 30 minuti per consentire al CV legato alla biomassa di dissolversi completamente.
ATTENZIONE: Eseguire questo passaggio in una cappa a flusso laminare con DPI appropriati poiché l'acido acetico glaciale è una sostanza chimica corrosiva. - Nel frattempo, impostare il lettore di micropiastre (vedi Tabella dei materiali) per leggere i valori delle macchie CV. Dopo il trattamento con acido acetico glaciale, leggere la piastra alla lunghezza d'onda di 595 nm.
NOTA: La lunghezza d'onda utilizzata per misurare l'OD di CV può variare da 500-600 nm35.
3. Isolamento dei neutrofili
NOTA: I neutrofili sono stati isolati seguendo un metodo precedentemente pubblicato con modifiche minori36. Questo protocollo di isolamento combina prima la centrifugazione a gradiente di densità, seguita dalla sedimentazione del destrano al 3%. Questa sezione copre solo il protocollo generale di isolamento dei neutrofili, concentrandosi sulle modifiche apportate al protocollo pubblicato. Inoltre, il protocollo descritto di seguito è uno dei tanti metodi che possono isolare i neutrofili e possono essere sostituiti secondo necessità. Altri metodi per isolare i neutrofili includono l'uso di mezzi di separazione cellulare o separazione delle cellule anticorpali magnetiche37.
- Prelevare il sangue da un donatore adulto tramite venipuntura, come da protocollo delineato nell'IRB istituzionale. Prima del prelievo di sangue, assicurarsi che la siringa abbia sufficiente eparina priva di conservanti, in modo tale che la concentrazione finale di eparina sia di 20 U/ml.
- Diluire il sangue eparinizzato con 3/4 del volume di NaCl privo di endotossine 0,9% (vedere Tabella dei materiali) in H2O a temperatura ambiente.
- Per ogni 20 ml di campione di sangue diluito, aliquote 14 mL di un mezzo con gradiente di densità disponibile in commercio (cfr. tabella dei materiali) in un tubo conico fresco da 50 ml. Posizionare accuratamente il campione di sangue diluito sopra il mezzo del gradiente di densità.
- Centrifugare il campione di sangue stratificato a 400 x g per 40 minuti a temperatura ambiente. Assicurarsi che la centrifuga si rompa lentamente per evitare di disturbare lo strato una volta completata la centrifugazione.
NOTA: Il campione di sangue avrà cinque strati contenenti una miscela di soluzione salina e plasma, uno strato di cellule mononucleate, un mezzo di gradiente di densità, neutrofili ed eritrociti. - Utilizzando una pipetta sierologica, aspirare tutti gli strati sopra i neutrofili e il pellet eritrocitario, seguito da una delicata risospensione del pellet in NaCl freddo privo di endotossine 0,9% in H2O. Per ogni pellet generato da un campione di sangue di 20 ml, risospendere il pellet a 20 ml di volume totale. Aggiungere un volume 1:1 di destrano al 3% (vedi Tabella dei materiali). Incubare il tubo in posizione verticale per 18-20 minuti sul ghiaccio.
NOTA: Assicurarsi che il destrano al 3% sia prodotto con NaCl 0,9% privo di endotossine in H2O. - Prelevare 20 mL dello strato superiore contenente neutrofili e alcuni eritrociti su un nuovo tubo conico da 50 mL e centrifugarlo a 355 x g per 10 minuti a 4 °C. Versare il surnatante lasciando dietro di sé un pellet rosso.
- Risospendere delicatamente il pellet in 10 ml di H2O freddo e sterile per 30 s per lisare gli eritrociti rimanenti. Aggiungere immediatamente 10 ml di soluzione salina fredda allo 0,9% priva di endotossine alla miscela per ripristinare la tonicità. Centrifugare la soluzione a 233 x g per 3 minuti a 4 °C.
- Versare il surnatante e risospendere il pellet contenente il 95% -97% di neutrofili in 1 mL di HBSS freddo per 20 mL di campione di sangue.
- Trasferire 10 μL dei neutrofili risospesi in 90 μL di colorante di esclusione blu tripano allo 0,4% e contare le cellule utilizzando un emocitometro (vedere Tabella dei materiali).
NOTA: Le cellule non vitali sono colorate di blu poiché il colorante di esclusione del blu tripano è impermeabile nelle cellule vitali. Questo protocollo fornisce il >99% di vitalità cellulare37,38. - Aggiungere ulteriore HBSS in modo tale che la concentrazione finale di neutrofili sia 4 x 106 cellule / ml.
NOTA: Per i casi con vitalità cellulare del <99%, è ancora possibile raggiungere la concentrazione finale di 4 x 106 cellule/ml; tuttavia, il volume totale della soluzione contenente 4 x 106 cellule/ml ottenuta diminuirà. La concentrazione finale di neutrofili può essere regolata in base alle esigenze sperimentali dell'utente. I neutrofili sono stati risospesi ad una concentrazione finale di 4 x 106 cellule/ml per tutti gli esperimenti descritti di seguito. Per tenere conto della variabilità da donatore a donatore, si raccomanda vivamente che tutti gli esperimenti coinvolti con i neutrofili siano eseguiti con almeno tre diversi donatori.
4. Misura dei ROS prodotti dai neutrofili
- Aggiungere 100 μL di siero umano normale al 20% (diluito in HBSS) goccia per goccia al biofilm lavato (fase 1.6) e incubare a 37 °C in condizioni statiche per 30 minuti per opsonizzare il biofilm.
- Aspirare la soluzione di siero al 20% e lavare i biofilm a goccia con 150 μL di HBSS una volta. Aspirare l'HBSS, lasciando dietro di sé pozzi con biofilm opsonizzati.
NOTA: Per l'interpretazione dell'esperimento, si raccomanda un minimo di quattro gruppi: (A) Neutrofili + Biofilm, (B) Neutrofili + PMA (controllo positivo, vedere Tabella dei materiali), (C) Solo neutrofili e (D) Solo biofilm. - Aggiungere luminolo (vedi Tabella dei materiali) ai neutrofili risospesi in HBSS ad una concentrazione di 4 x 106 cellule/ml in modo tale che la concentrazione finale di luminolo sia di 50 μM. Questa soluzione è pronta all'uso per i gruppi (A) e (C). Aggiungere 4 x 105 neutrofili mescolati con luminolo ai pozzetti con biofilm opsonizzati.
- In una provetta separata, preparare una soluzione di luminolo da 50 μM in HBSS senza neutrofili e aggiungerla al biofilm contenente il pozzetto (gruppo D).
- Aliquot 350 μL di neutrofili miscelati con luminolo e aggiungere forbolo 12-miristato 13-acetato (PMA) ad una concentrazione finale di 500 ng/mL alla miscela. Per il gruppo (B), aggiungere 4 x 105 neutrofili da questa miscela in pozzetti senza biofilm. Questo serve come controllo positivo.
NOTA: La concentrazione di PMA indicata in questa fase è relativamente elevata per garantire una robusta risposta allo scoppio poiché i neutrofili stimolati dalla PMA sono un controllo positivo. La PMA può essere utilizzata a una concentrazione inferiore per attivare i neutrofili, a seconda dell'esperimento. - Centrifugare la piastra a 270 x g per 30 s a 4 °C.
- Assicurarsi che il lettore di piastre sia impostato su 37 °C insieme all'impostazione per la luminescenza e la lettura cinetica per 60 minuti con intervalli di 3 minuti. Posizionare la piastra nel lettore di piastre per misurare la produzione di ROS da parte dei neutrofili per 60 minuti.
NOTA: Per questo test, i biofilm sono stati coltivati in lastre bianche utilizzate per i saggi di luminescenza. La PMA è un agonista noto per la risposta di scoppio ossidativo39. Quando si eseguono studi che coinvolgono PMA, assicurarsi che il PMA venga aggiunto nella fase finale mentre la soluzione contenente neutrofili è fredda poiché la PMA avvia immediatamente la risposta allo scoppio.
5. Imaging delle interazioni biofilm-neutrofili
- Impostare un biofilm utilizzando i passaggi 1.2-1.6. Per facilitare l'imaging di biofilm, utilizzare un ceppo fluorescente di S. aureus, come USA300 che esprime la proteina fluorescente verde (GFP)40,41, per aumentare la facilità di imaging al microscopio.
NOTA: È stato utilizzato un vetrino a 6 canali μ (vedi Tabella dei materiali) invece di una piastra a 96 pozzetti per dimostrare il modello di biofilm in vitro (fase 1). - Incubare 4 x 106 cellule/ml di neutrofili con 100 μM di colorante blu CMAC (7-ammino-4-clorometilcumarina) (BCD, vedi tabella dei materiali) per 30 minuti in un bilanciere a 37 °C e 5% di CO2. Assicurarsi che i campioni siano incubati al buio e limitare l'esposizione alla luce per i passaggi rimanenti.
- Per lavare i GAV in eccesso, centrifugare i neutrofili a 270 x g per 5 minuti e aspirare il surnatante. Risospendere i neutrofili nell'HBSS fresco. A questo punto, aggiungere l'omodimero-1 di etidio (vedi Tabella dei materiali) ai neutrofili colorati con BCD ad una concentrazione finale di 4 μM per monitorare la morte dei neutrofili e batterica.
- Aggiungere 150 μL di neutrofili al biofilm di S. aureus che è stato coltivato in μ-vetrini, in modo tale che il rapporto neutrofili/batteri sia 1:30 (neutrofili: batteri). Incubare i vetrini μ in camera umidificata per 30 min. Il numero di cellule batteriche si basa sulla conta cellulare ottenuta dalla placcatura di un biofilm di 18 ore.
- Immagina l'interazione neutrofili-biofilm usando canali fluorescenti corrispondenti alle lunghezze d'onda di eccitazione ed emissione dei coloranti/proteine fluorescenti.
NOTA: Per il presente studio, BCD è 353/466 nm, omodimero-1 di etidio è 528/617 nm e GFP è 395/509 nm. Limitare l'esposizione del campione al laser o alla luce per evitare il fotosbiancamento dei campioni. - Analizza le immagini utilizzando software di analisi delle immagini al microscopio o programmi come FIJI / ImageJ, COMSTAT2, BiofilmQ e BAIT, tra molti altri42,43,44,45.
NOTA: Quando si lavora con le macchie, è importante considerare la specificità dei coloranti in uso. Alcune macchie funzionano sulle cellule procariotiche ed eucariotiche, mentre altre lavorano solo su una. Se i neutrofili e i biofilm vengono colorati separatamente utilizzando coloranti che possono macchiare entrambi i tipi di cellule, assicurarsi di lavare via qualsiasi colorante rimanente prima di combinare neutrofili e biofilm per prevenire la colorazione incrociata.
Risultati
I terreni utilizzati per coltivare biofilm batterici influenzano la sopravvivenza dei neutrofili. Diversi mezzi sono stati testati per ridurre l'effetto dei soli mezzi sulla vitalità dei neutrofili per lo studio delle interazioni neutrofili-biofilm (Figura 1). I mezzi di crescita batterica come il brodo di soia triptico riducono al minimo la vitalità dei neutrofili, in modo tale che ~ 60% dei neutrofili sono vivi dopo un periodo di incubazione di 30 minuti a 37 ° C con il 5% di CO2. I terreni di coltura cellulare di mammifero, come MEMα, non influenzano la vitalità dei neutrofili e supportano la crescita dei biofilm di S. aureus. Infatti, i mezzi minimi promuovono una crescita robusta di biofilm in altri batteri46,47.
Per valutare l'effetto dei mezzi sulla crescita del biofilm e la variabilità nella quantificazione della biomassa del biofilm dopo il lavaggio della biomassa per eliminare le cellule planctoniche, è stato coltivato un biofilm di S. aureus di 18 ore in una piastra da 96 pozzetti, con pozzetti trattati o non trattati con poli-L-lisina. Un mezzo ricco di sostanze nutritive (brodo di soia triptico (TSB)) e minimo (MEMα) sono stati utilizzati così come sono o integrati con glucosio al 2%. La biomassa del biofilm colorata con CV ha rivelato che il biofilm di S. aureus coltivato in MEMα integrato con glucosio al 2% ha prodotto il biofilm più robusto tra tutti i terreni testati (Figura 2A). Inoltre, i biofilm coltivati in pozzetti pretrattati PLL contenenti MEMα + 2% di glucosio hanno mostrato una minore variabilità rispetto ai biofilm nei pozzetti non trattati con PLL contenenti MEMα + 2% di glucosio. Questi biofilm hanno mostrato una minore variabilità nella quantificazione tramite il saggio CV35 e la CFU / mL quando placcati dopo aver maneggiato con precisione i biofilm per la quantificazione della biomassa. Questi biofilm contengono, in media, 1 x 108 CFU/ml, come dimostrato dalla placcatura dei biofilm in 3 giorni separati (Figura 2B). Questo numero è utile per determinare il numero di neutrofili da aggiungere ai biofilm per i saggi di funzionalità dei neutrofili.
Per misurare la produzione di ROS da parte dei neutrofili in risposta ai biofilm, i biofilm di S. aureus sono stati coltivati staticamente per 18-20 ore in una piastra da 96 pozzetti. I biofilm sono stati quindi opsonizzati e sono stati aggiunti i neutrofili. La produzione di ROS è stata quindi misurata per 60 minuti (Figura 3A). L'area sotto la curva viene calcolata dalla curva cinetica per quantificare la produzione totale di ROS da parte dei neutrofili. I neutrofili trattati con un agonista, come il PMA, usato come controllo, mostrano un aumento della produzione di ROS. In assenza di biofilm, i neutrofili trattati con PMA hanno mostrato una robusta produzione di ROS. In presenza del biofilm di S. aureus , la produzione complessiva di ROS da parte dei neutrofili trattati con PMA è diminuita. In assenza di PMA, i neutrofili si basano esclusivamente sulla loro interazione con il biofilm, che riduce ulteriormente la quantità di ROS prodotta (Figura 3B).
Per visualizzare le interazioni neutrofili-biofilm utilizzando la microscopia a fluorescenza, sono stati utilizzati rispettivamente un ceppo che esprime GFP di S. aureus, colorante Blue CMAC e omodimero-1 di etidio, che colora il citoplasma delle cellule vive e il DNA delle cellule morte. Il biofilm di S. aureus è stato coltivato per 18 ore in un vetrino a 6 μ canali. I neutrofili marcati con colorante blu CMAC sono stati aggiunti insieme all'omodimero-1 di etidio ai biofilm lavati e incubati per 30 minuti a 37 °C con il 5% di CO2 prima dell'imaging. La microscopia fluorescente ad ampio campo ha rivelato che molti neutrofili erano localizzati sulla superficie dei biofilm di S. aureus, mentre alcuni sono all'interno del biofilm (Figura 4A). Anche l'interazione tra le cellule di S. aureus all'interno dei neutrofili era evidente (Figura 4C). La maggior parte delle cellule di S. aureus che interagiscono con i neutrofili (ciano) erano morte (magenta), mentre alcune sono rimaste vive (gialle) come determinato dalla colorazione viva-morta (Figura 4C). Per confronto, i biofilm di S. aureus che esprimono GFP sono stati colorati con omodimero-1 di etidio, che ha rivelato una frazione della popolazione morta di S. aureus all'interno del biofilm (Figura 4B). I neutrofili non vitali positivi per l'omodimero-1 di etidio sono stati quantificati utilizzando un software di analisi (vedi Tabella dei materiali) dopo l'incubazione con biofilm di S. aureus. Circa il 48% dei neutrofili era già morto entro 30 minuti dall'incubazione con il biofilm di S. aureus. Durante l'ottimizzazione del protocollo di microscopia, è stato valutato anche l'effetto del lavaggio del biofilm e dei neutrofili dopo 30 minuti di incubazione per rimuovere i neutrofili non aderenti, rivelando circa il 33% dei neutrofili morti ancora attaccati al biofilm (Figura 4D).
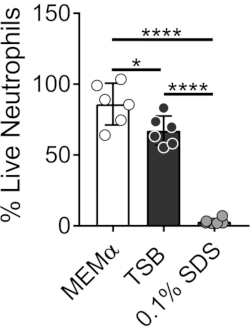
Figura 1: Il saggio LIVE-DEAD confronta la sopravvivenza dei neutrofili tra i mezzi di crescita batterici e quelli dei mammiferi. I neutrofili sono stati isolati e incubati in HBSS, MEMα, TSB o SDS allo 0,1% per 30 minuti. La colorazione LIVE-DEAD è stata eseguita utilizzando Calcein AM (vivo) e omodimero di etidio-1 (morto). È stata determinata la percentuale di neutrofili vivi, dove i neutrofili incubati da HBSS sono stati trattati come neutrofili vivi al 100%. I risultati rappresentano una media di due esperimenti indipendenti eseguiti in triplice copia, con neutrofili ottenuti da due donatori diversi. I dati sono presentati come media ± SD (*p < 0,05, ****p < 0,0001. Anova a senso unico). Fare clic qui per visualizzare una versione ingrandita di questa figura.
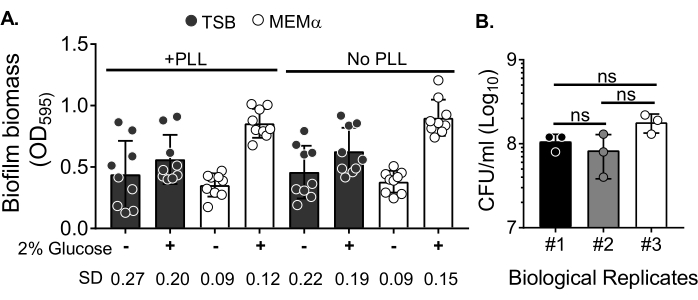
Figura 2: Quantificazione della biomassa del biofilm in diverse condizioni e conteggio della vitalità batterica dei biofilm coltivati nelle condizioni ottimizzate. (A) S. aureus è stato seminato in una piastra da 96 pozzetti rivestita o non rivestita con poli-L-lisina (PLL). I biofilm sono stati coltivati in TSB, MEMα o uno dei terreni integrati con glucosio al 2% in condizioni statiche per 18 ore. La colorazione viola cristallino (CV) è stata eseguita per colorare la biomassa del biofilm. La colorazione CV eluita è stata diluita a 1:10 e letta in un lettore di micropiastre. I risultati rappresentano una media di tre esperimenti indipendenti eseguiti in triplice copia. I dati sono presentati come media ± DS. La SD per ciascun gruppo è mostrata in basso per dimostrare la variabilità delle diverse condizioni di crescita del biofilm. (B) La conta batterica dei CFU è stata ottenuta da biofilm coltivati in un mezzo ottimizzato (MEMα + 2% di glucosio). I biofilm statici di 18 ore sono stati sottoposti allo stesso numero di lavaggi seguiti da una sonicazione di 10 minuti per allentare la biomassa del biofilm e sono passati attraverso un ago da 22G per interrompere gli aggregati prima della placcatura. I risultati rappresentano tre repliche eseguite in triplice copia. I dati sono presentati come media ± DS (ns = non significativo. Anova a senso unico). Fare clic qui per visualizzare una versione ingrandita di questa figura.
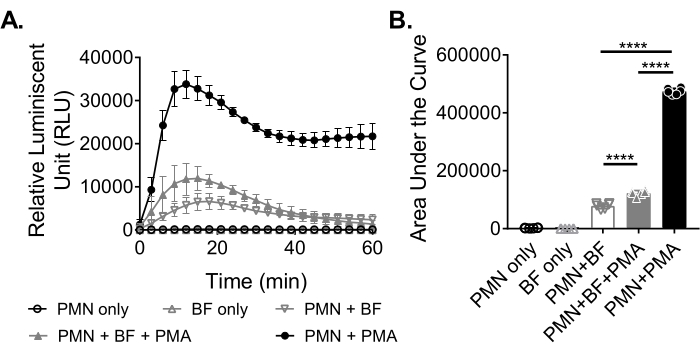
Figura 3: Quantificazione della produzione di ROS da parte dei neutrofili mediante saggio a chemiluminescenza. (A) I neutrofili (PMN) sono stati incubati con biofilm di S. aureus lavati con HBSS (BF) in presenza (triangolo grigio chiuso) o in assenza (triangolo invertito grigio aperto) di PMA per misurare la produzione di ROS da parte dei neutrofili. Luminol è stato utilizzato per rilevare ROS ogni 3 minuti per 60 minuti in un lettore di micropiastre. Mentre i neutrofili trattati con PMA in assenza di un biofilm (cerchio nero chiuso) servivano come controllo positivo, i gruppi solo neutrofili (cerchio nero aperto) e solo biofilm (triangolo grigio aperto) fungevano da controlli negativi. I dati rappresentano una media di due esperimenti indipendenti eseguiti in triplice copia con neutrofili ottenuti da due donatori diversi. I dati sono presentati come media ± DS. (B) L'area sotto la curva da (A) è stata calcolata per quantificare il ROS totale generato dai neutrofili. I dati sono rappresentati come media ± DS. (***p < 0,0001. Anova a senso unico). Fare clic qui per visualizzare una versione ingrandita di questa figura.
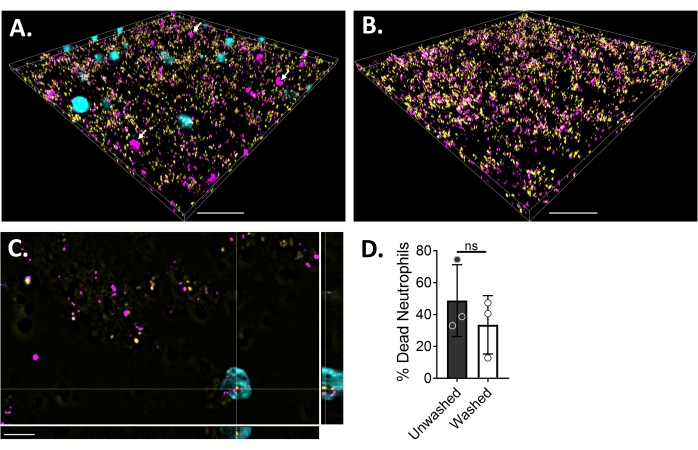
Figura 4: Visualizzazione dell'interazione tra biofilm di S. aureus e neutrofili mediante microscopia a fluorescenza ad ampio campo. I neutrofili marcati con colorante blu CMAC (ciano) sono stati integrati con omodimero-1 di etidio (magenta; morto) prima dell'incubazione con un biofilm di 18 ore di S. aureus (giallo). Le interazioni biofilm-neutrofili sono state visualizzate utilizzando microscopia fluorescente ad ampio campo e immagini elaborate utilizzando un software di analisi delle immagini. Gli esperimenti sono stati eseguiti con tre diversi donatori. Le immagini rappresentative sono presentate come (A) vista 3D del biofilm di S. aureus con neutrofili vivi (ciano) e morti (magenta; alcuni indicati con frecce bianche), (B) vista 3D di un biofilm di S. aureus in assenza di neutrofili con S. aureus vivo che esprime GFP (giallo) o S. aureus morto colorato con omodimero di etidio-1 (magenta), (C) una vista ortogonale di S. aureus e l'interazione dei neutrofili come rappresentata dai piani xy, yz e xz, e (D) quantificazione della vitalità dei neutrofili in presenza di biofilm di S. aureus dopo 30 minuti immediatamente (non lavato) o dopo tre cicli di lavaggi con HBSS per rimuovere i neutrofili non aderenti (lavati). La morte delle cellule neutrofile è presentata come media ± SD (test t di Student). La barra della scala indica 50 μm in (A) e (B) e 10 μm in (C). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Ci sono stati numerosi sforzi per far crescere biofilm di S. aureus robusti e riproducibili per esperimenti a valle in vitro48,49,50. Viene delineato un protocollo standardizzato che sfrutta la natura cationica del PLL, oltre a integrare i terreni con glucosio per la crescita di robusti biofilm in vitro di S. aureus. L'aggiunta di PLL consente un migliore fissaggio della cellula batterica caricata negativamente alle superfici rivestite PLL caricate positivamente. È importante notare che PLL a una concentrazione di 10 μg/mL ha attività antimicrobica contro Pseudomonas aeruginosa, Escherichia coli e S. aureus quando incubato per 24 ore51. La stessa concentrazione viene utilizzata per rivestire le superfici; tuttavia, il PLL in eccesso viene aspirato, rendendo la concentrazione di PLL inferiore a 10 μg / ml durante la semina per la crescita del biofilm.
È importante notare che PLL ha funzionato solo in specifici terreni di crescita come MEMα con glucosio al 2%, dove è stato osservato che S. aureus produceva biofilm robusti con una variabilità minima (Figura 2A). La concentrazione di PLL da utilizzare in combinazione con altri tipi di fluidi richiederebbe un'ulteriore ottimizzazione, ad esempio utilizzando una maggiore concentrazione di PLL per rivestire i pozzi. Inoltre, queste condizioni sono state ottimizzate per un biofilm monospecie di S. aureus. Mentre i biofilm cronici delle ferite sono spesso polimicrobici, standardizzare i saggi per studiare il biofilm monospecie e le sue interazioni con i neutrofili e altre cellule immunitarie è fondamentale per comprendere il loro contributo alla patogenesi52. Questi protocolli standardizzati possono essere ulteriormente ottimizzati per sostenere e studiare i biofilm polimicrobici e le loro interazioni con i neutrofili.
È stato anche osservato che ricchi terreni di coltura batterica, come TSB, hanno portato a una perdita di vitalità dei neutrofili (Figura 1). Pertanto, le condizioni di crescita dei biofilm di S. aureus in MEMα, utilizzati per colture cellulari di mammifero, sono state ottimizzate. Per gli studi che coinvolgono i neutrofili, questo mezzo supporta la vitalità dei neutrofili e promuove la crescita di S. aureus. Mentre è stato osservato che i media influenzano la vitalità dei neutrofili, è anche importante considerare che i neutrofili isolati dal sangue umano periferico vanno incontro ad apoptosi ex vivo con circa il 70% di neutrofili apoptotici entro 20 h53. Ciò richiede una corretta manipolazione, come la conservazione dei neutrofili sul ghiaccio durante la preparazione per gli esperimenti, l'uso di reagenti privi di endotossine e la prevenzione dell'attivazione dei neutrofili evitando il vortice dei campioni con neutrofili.
La valutazione del burst ossidativo nei neutrofili viene eseguita di routine per determinare l'effetto di uccisione dei neutrofili sul patogeno14,54,55. Questi studi sono spesso eseguiti con batteri planctonici in cui vengono aggiunti neutrofili e la risposta di scoppio ossidativo viene quantificata utilizzando chemiluminescenza amplificata da luminolo che rileva gli anioni superossido prodotti dai neutrofili. Il presente protocollo viene modificato sostituendo i batteri planctonici con biofilm 18 h S. aureus coltivato staticamente. Pertanto, i neutrofili possono essere aggiunti direttamente al biofilm per valutare la loro attivazione. D'altra parte, i batteri nei biofilm producono enzimi, come la catalasi e la superossido dismutasi per disintossicare ROS23,56. I biofilm di Staphylococcus epidermidis producono una catalasi superiore rispetto alla sua controparte planctonica sotto stress57. La chemiluminescenza totale dei neutrofili stimolati da PMA in un biofilm di S. aureus è significativamente inferiore rispetto ai neutrofili stimolati da PMA in cui il biofilm è assente (Figura 2). Ciò può essere dovuto all'attività di questi enzimi disintossicanti. Inoltre, i biofilm di S. aureus producono diverse tossine che formano pori chiamate leucocidine che uccidono i neutrofili58. La ridotta risposta al burst è probabilmente dovuta anche alla ridotta vitalità dei neutrofili in presenza del biofilm di S. aureus. Mentre questo studio utilizza luminolo che rileva i ROS totali prodotti sia all'interno che all'esterno delle cellule, altri reagenti, come CM-H 2 DCFDA (5-(e-6)-clorometil-2'7'-diclorodiidrofluoresceina diacetato) o isoluminolo, devono essere considerati se l'obiettivodel lavoro è studiare specificamente la produzione di ROS intracellulari o extracellulari 14,53,54.
La capacità di visualizzare le interazioni neutrofili-biofilm tramite microscopia può essere informativa sul comportamento dei neutrofili e dei biofilm in presenza l'uno dell'altro. Gli spettri di eccitazione ed emissione dei coloranti fluorescenti e delle proteine rappresentano un'istantanea dell'interazione tra un biofilm di 18 h S. aureus e neutrofili dopo un'incubazione di 30 minuti. Per catturare efficacemente i segnali dalle cellule colorate, è importante limitare l'esposizione dei campioni alle sorgenti luminose durante la configurazione dei campioni per la microscopia. Durante l'imaging, è stato evitato il rapido fotosbiancamento dei campioni abbassando l'intensità della sorgente luminosa durante la regolazione di tutti i parametri come l'altezza dello stack Z e il tempo di esposizione per i diversi canali.
Queste semplici pratiche hanno permesso una corretta imaging al microscopio in cui è stato osservato che pochi neutrofili sono localizzati all'interno del biofilm (Figura 4A). Ciò può essere dovuto agli spazi presenti all'interno del biofilm poiché il biofilm di S. aureus 18 h coltivato in MEMα con glucosio al 2% non copre uniformemente la superficie (Figura 4B). Tuttavia, l'uso di altri studi di rich media ha mostrato un prato uniforme di crescita del biofilm di S. aureus e leucociti che penetrano attraverso il biofilm30,58. Inoltre, si osserva anche che c'è stata morte delle cellule neutrofile dopo 30 minuti di incubazione con biofilm di S. aureus a causa di leucocidine prodotte da biofilm di S. aureus che lisano i neutrofili58 (Figura 4A,D). L'aggiunta di una fase di lavaggio per rimuovere i neutrofili non aderenti dopo averli incubati con biofilm per 30 minuti ha rimosso ~ 15% di neutrofili morti dal sistema rispetto al gruppo non lavato, in cui la microscopia è stata eseguita immediatamente dopo 30 minuti di incubazione (Figura 4D). Sono stati osservati anche neutrofili che interagiscono con S. aureus (Figura 4C). Sono necessari ulteriori esperimenti per valutare se S. aureus è inghiottito dai neutrofili o attaccato alla superficie cellulare dei neutrofili54. L'imaging di neutrofili e biofilm è il primo passo per valutare diverse funzionalità dei neutrofili a valle, come la fagocitosi e la NETosi54,59. L'effetto dei neutrofili sui biofilm può anche essere valutato quantificando la biomassa del biofilm, i cambiamenti strutturali del biofilm e la vitalità del biofilm, tra molti altri, utilizzando gli strumenti di analisi delle immagini elencati nella fase 5.6. Infine, esiste una variabilità da donatore a donatore nei neutrofili; Pertanto, si raccomanda di utilizzare almeno tre diversi donatori per studi che coinvolgono i neutrofili.
Nel complesso, sono stati combinati saggi in vitro standardizzati per valutare le interazioni tra neutrofili e biofilm. Sebbene questi test utilizzino S. aureus, i protocolli descritti possono essere facilmente adattati per studiare altri agenti patogeni. Mentre ci sono vari modelli in vivo per studiare le interazioni ospite-patogeno, possono essere costosi e laboriosi, specialmente se le condizioni non sono ottimizzate. Lavorare con saggi standardizzati in vitro consente di ottimizzare le condizioni sperimentali e confermare le osservazioni prima di passare a un sistema in vivo. Infine, vari modelli di infezione animale sono stati utilizzati per studiare le interazioni biofilm-neutrofili in vivo. Tuttavia, è importante considerare le differenze immunologiche tra esseri umani e modelli animali60,61,62,63. Ciò richiede l'uso di neutrofili derivati dall'uomo per studiare queste complesse interazioni ospite-patogeno.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato dal National Institute of Allergy and Infectious Diseases (R01AI077628) a DJW e un American Heart Association Career Development Award (19CDA34630005) a ESG. Ringraziamo il Dr. Paul Stoodley per averci fornito il ceppo USA 300 LAC GFP. Inoltre, riconosciamo le risorse del Campus Microscopy and Imaging Facility (CMIF) e dell'OSU Comprehensive Cancer Center (OSUCCC) Microscopy Shared Resource (MSR), The Ohio State University. Ringraziamo anche Amelia Staats, Peter Burback e Lisa Coleman del laboratorio Stoodley per aver eseguito prelievi di sangue.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.9% sodium chloride irrigation, USP | Baxter | 2F7124 | Endotoxin-free; Used for isolation of neutrophils |
| 150 mL rapid-flow filter unit | Thermo Scientific | 565-0020 | |
| 200 proof ethanol | VWR | 89125-188 | |
| 3 mL syringe | BD | 309657 | Used for blood draw |
| 50 mL conical centrifuge tubes | Thermo Scientific | 339652 | |
| 60 mL syringe | BD | 309653 | Used for blood draw |
| Agar | Fisher Bioreagents | BP1423-2 | |
| Alcohol swab | BD | Used for blood draw | |
| Band-aids | Used for blood draw | ||
| BD Bacto Tryptic Soy Broth | BD | DF0370-07-5 | Combine with 1.5% agar to make Tryptic Soy Agar |
| Cell counter | Bal Saupply | 202C | |
| CellTracker blue CMCH | Invitrogen | C2111 | Blue CMAC Dye (BCD) |
| Clear bottom 96-well flat bottom polystyrene plates | Costar | 3370 | |
| Cotton gauze | Fisherbrand | 13-761-52 | Used for blood draw |
| Crystal violet | Acros Organic | 40583-0250 | |
| Culture tubes | Fisherbrand | 14-961-27 | Borosilicate Glass 13 x 100 mm |
| D-(+)-glucose | Sigma | G-8270 | |
| Dextran from Leuconostoc spp. | Sigma | 31392-250G | Used for isolation of neutrophils |
| Dulbecco's phosphate buffered saline (DPBS) 1x | Gibco | 14190-144 | |
| Ethidium homodimer-1 | Invitrogen | L3224 B | |
| Ficoll-Paque plus | Cytiva | 17144003 | Used for isolation of neutrophils (density gradient medium) |
| Hanks' balanced salt solution (HBSS) 1x | Corning cellgro | 21-022-CV | without calcium, magnesium, and phenol red |
| Hemacytometer | Bright Line | ||
| Heparin | Novaplus | NDC 63323-540-57 | 1000 USP units/mL, Used for blood draw |
| IMARIS 9.8 | Oxford Instruments | Microscopy image analysis software | |
| Luminol | Sigma | A8511-5G | |
| Minimal essential media (MEM) Alpha 1x | Gibco | 41061-029 | |
| Needle (23 G1) | BD | 305145 | Used for blood draw |
| Nikon Eclipse Ti2 | Nikon | ||
| NIS-Elements | Nikon | Quantification of dead neutrophils | |
| Normal human serum | Complement Technology | NHS | |
| Petri Dish (100 x 15 mm) | VWR | 25384-342 | |
| Phorbol 12-myristate 13-acetate | |||
| Poly-L-lysine solution | Sigma | P4707-50ML | |
| Sodium chloride | Fisher Bioreagents | BP358-10 | Used for neutrophil isolation |
| SoftMax Pro Software | Molecular Devices | Microplate reader software used for data acquisition | |
| SpectraMax i3x | Molecular Devices | Microplate reader | |
| Sterile water for irrigation, USP | Baxter | 2F7114 | Endotoxin-free; Used for neutrophil isolation |
| Surflo winged infusion set | Terumo | SC*19BLK | 19 G x 3/4", used for blood draw |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Turnicate | Used for blood draw | ||
| UltraPure distilled water | Invitrogen | 10977015 | |
| White opaque 96-well plates | Falcon | 353296 | Tissue culture treated and flat bottom plate |
| μ-Slide VI 0.4 | Ibidi | 80601 | μ-channel slide |
Riferimenti
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerging Infectious Diseases. 8 (9), 881-890 (2002).
- Alhede, M., et al. Phenotypes of non-attached Pseudomonas aeruginosa aggregates resemble surface attached biofilm. PLoS One. 6 (11), 27943(2011).
- Hall-Stoodley, L., Costerton, J. W., Stoodley, P. Bacterial biofilms: from the natural environment to infectious diseases. Nature Reviews: Microbiology. 2 (2), 95-108 (2004).
- Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clinical Microbiology Reviews. 15 (2), 167-193 (2002).
- Schilcher, K., Horswill, A. R. Staphylococcal biofilm development: structure, regulation, and treatment strategies. Microbiology and Molecular Biology Reviews. 84 (3), 0002(2020).
- Kaplan, J. B. Biofilm dispersal: mechanisms, clinical implications, and potential therapeutic uses. Journal of Dental Research. 89 (3), 205-218 (2010).
- Otto, M. Staphylococcal Biofilms. Microbiology Spectrum. 6 (4), 10(2018).
- Moormeier, D. E., Bayles, K. W. Staphylococcus aureus biofilm: a complex developmental organism. Molecular Microbiology. 104 (3), 365-376 (2017).
- Gross, M., Cramton, S. E., Gotz, F., Peschel, A. Key role of teichoic acid net charge in Staphylococcus aureus colonization of artificial surfaces. Infection and Immunity. 69 (5), 3423-3426 (2001).
- Zheng, Y., He, L., Asiamah, T. K., Otto, M. Colonization of medical devices by staphylococci. Environmental Microbiology. 20 (9), 3141-3153 (2018).
- Donlan, R. M. Biofilms and device-associated infections. Emerging Infectious Diseases. 7 (2), 277-281 (2001).
- Kolaczkowska, E., Kubes, P. Neutrophil recruitment and function in health and inflammation. Nature Reviews Immunology. 13 (3), 159-175 (2013).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annual Review of Immunology. 30, 459-489 (2012).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- van Kessel, K. P., Bestebroer, J., van Strijp, J. A. Neutrophil-mediated phagocytosis of Staphylococcus aureus. Frontiers in Immunology. 5, 467(2014).
- Nguyen, G. T., Green, E. R., Mecsas, J. Neutrophils to the ROScue: Mechanisms of NADPH oxidase activation and bacterial resistance. Frontiers in Cellular and Infection Microbiology. 7, 373(2017).
- Saini, R., Singh, S. Inducible nitric oxide synthase: An asset to neutrophils. Journal of Leukocyte Biology. 105 (1), 49-61 (2019).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Segal, A. W. The function of the NADPH oxidase of phagocytes and its relationship to other NOXs in plants, invertebrates, and mammals. The International Journal of Biochemistry and Cell Biology. 40 (4), 604-618 (2008).
- Fang, F. C. Antimicrobial reactive oxygen and nitrogen species: concepts and controversies. Nature Reviews Microbiology. 2 (10), 820-832 (2004).
- Bogdan, C. Nitric oxide and the immune response. Nature Immunology. 2 (10), 907-916 (2001).
- Chua, S. L., et al. Reactive oxygen species drive evolution of pro-biofilm variants in pathogens by modulating cyclic-di-GMP levels. Open Biology. 6 (11), 160162(2016).
- El Haj, C., Lichtenberg, M., Nielsen, K. L., Bjarnsholt, T., Jensen, P. O. Catalase protects biofilm of Staphylococcus aureus against daptomycin activity. Antibiotics. 10 (5), 511(2021).
- Ghimire, N., et al. Direct microscopic observation of human neutrophil-Staphylococcus aureus interaction in vitro suggests a potential mechanism for initiation of biofilm infection on an implanted medical device. Infection and Immunity. 87 (12), 00745(2019).
- Bhattacharya, M., et al. Leukocidins and the nuclease nuc prevent neutrophil-mediated killing of Staphylococcus aureus biofilms. Infection and Immunity. 88 (10), 00372(2020).
- Bogachev, M. I., et al. Fast and simple tool for the quantification of biofilm-embedded cells sub-populations from fluorescent microscopic images. PLoS One. 13 (5), 0193267(2018).
- Kerstens, M., et al. A flow cytometric approach to quantify biofilms. Folia Microbiologica. 60 (4), 335-342 (2015).
- Meyle, E., et al. Destruction of bacterial biofilms by polymorphonuclear neutrophils: relative contribution of phagocytosis, DNA release, and degranulation. The International Journal of Artificial Organs. 33 (9), 608-620 (2010).
- Oveisi, M., et al. Novel assay to characterize neutrophil responses to oral biofilms. Infection and Immunity. 87 (2), 00790(2019).
- Leid, J. G., Shirtliff, M. E., Costerton, J. W., Stoodley, P. Human leukocytes adhere to, penetrate, and respond to Staphylococcus aureus biofilms. Infection and Immunity. 70 (11), 6339-6345 (2002).
- Fey, P. D., et al. A genetic resource for rapid and comprehensive phenotype screening of nonessential Staphylococcus aureus genes. mBio. 4 (1), 00537(2013).
- Cody, W. L., et al. Skim milk enhances the preservation of thawed -80 degrees C bacterial stocks. Journal of Microbiological Methods. 75 (1), 135-138 (2008).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. 63, 3064(2012).
- Freitas, M., Porto, G., Lima, J. L., Fernandes, E. Optimization of experimental settings for the analysis of human neutrophils oxidative burst in vitro. Talanta. 78 (4-5), 1476-1483 (2009).
- Merritt, J. H., Kadouri, D. E., O'Toole, G. A. Growing and analyzing static biofilms. Current Protocols in Microbiology. , Chapter 1 Unit 1B 1 (2005).
- Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. 412, 15-20 (2007).
- Zhou, L., et al. Impact of human granulocyte and monocyte isolation procedures on functional studies. Clinical and Vaccine Immunology. 19 (7), 1065-1074 (2012).
- Quach, A., Ferrante, A. The application of dextran sedimentation as an initial step in neutrophil purification promotes their stimulation, due to the presence of monocytes. Journal of Immunology Research. 2017, 1254792(2017).
- Karlsson, A., Nixon, J. B., McPhail, L. C. Phorbol myristate acetate induces neutrophil NADPH-oxidase activity by two separate signal transduction pathways: dependent or independent of phosphatidylinositol 3-kinase. Journal of Leukocyte Biology. 67 (3), 396-404 (2000).
- Staats, A., et al. Rapid aggregation of Staphylococcus aureus in synovial fluid is influenced by synovial fluid concentration, viscosity, and fluid dynamics, with evidence of polymer bridging. mBio. , 0023622(2022).
- Chiu, I. M., et al. Bacteria activate sensory neurons that modulate pain and inflammation. Nature. 501 (7465), 52-57 (2013).
- Hartig, S. M. Basic image analysis and manipulation in ImageJ. Current Protocols in Molecular Biology. 102 (1), 14-15 (2013).
- Heydorn, A., et al. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146 (10), 2395-2407 (2000).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Luo, T. L., et al. Introducing BAIT (Biofilm Architecture Inference Tool): a software program to evaluate the architecture of oral multi-species biofilms. Microbiology. 165 (5), 527-537 (2019).
- Naves, P., et al. Measurement of biofilm formation by clinical isolates of Escherichia coli is method-dependent. Journal of Applied Microbiology. 105 (2), 585-590 (2008).
- Eze, E. C., El Zowalaty, M. E. Combined effects of low incubation temperature, minimal growth medium, and low hydrodynamics optimize Acinetobacter baumannii biofilm formation. Infection and Drug Resistance. 12, 3523-3536 (2019).
- Harris, L. G., Tosatti, S., Wieland, M., Textor, M., Richards, R. G. Staphylococcus aureus adhesion to titanium oxide surfaces coated with non-functionalized and peptide-functionalized poly(L-lysine)-grafted-poly(ethylene glycol) copolymers. Biomaterials. 25 (18), 4135-4148 (2004).
- Miao, J., et al. Biofilm formation of Staphylococcus aureus under food heat processing conditions: first report on cml production within biofilm. Scientific Reports. 9 (1), 1312(2019).
- Lade, H., et al. Biofilm formation by Staphylococcus aureus clinical isolates is differentially affected by glucose and sodium chloride supplemented culture media. Journal of Clinical Medicine. 8 (11), 1853(2019).
- Guzel Kaya, G., et al. Antibacterial activity of linezolid against gram-negative bacteria: utilization of epsilon-Poly-l-Lysine capped silica xerogel as an activating carrier. Pharmaceutics. 12 (11), 1126(2020).
- Clinton, A., Carter, T. Chronic wound biofilms: pathogenesis and potential therapies. Laboratory Medicine. 46 (4), 277-284 (2015).
- Scheel-Toellner, D., et al. Reactive oxygen species limit neutrophil life span by activating death receptor signaling. Blood. 104 (8), 2557-2564 (2004).
- Pestrak, M. J., et al. Pseudomonas aeruginosa rugose small-colony variants evade host clearance, are hyper-inflammatory, and persist in multiple host environments. PLoS Pathogens. 14 (2), 1006842(2018).
- Guerra, F. E., et al. Staphylococcus aureus SaeR/S-regulated factors reduce human neutrophil reactive oxygen species production. Journal of Leukocyte Biology. 100 (5), 1005-1010 (2016).
- Suo, Y., Huang, Y., Liu, Y., Shi, C., Shi, X. The expression of superoxide dismutase (SOD) and a putative ABC transporter permease is inversely correlated during biofilm formation in Listeria monocytogenes 4b G. PLoS One. 7 (10), 48467(2012).
- Olwal, C. O., Ang'ienda, P. O., Ochiel, D. O. Alternative sigma factor B (sigma(B)) and catalase enzyme contribute to Staphylococcus epidermidis biofilm's tolerance against physico-chemical disinfection. Scientific Reports. 9 (1), 5355(2019).
- Bhattacharya, M., et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing. Proceedings of the National Academy of Sciences of the United States of America. 115 (28), 7416-7421 (2018).
- Masuda, S., et al. NETosis markers: Quest for specific, objective, and quantitative markers. Clinica Chimica Acta. 459, 89-93 (2016).
- Dworsky, E. M., et al. Novel in vivo mouse model of implant related spine infection. Journal of Orthopaedic Research. 35 (1), 193-199 (2017).
- Pletzer, D., Mansour, S. C., Wuerth, K., Rahanjam, N., Hancock, R. E. New mouse model for chronic infections by gram-negative bacteria enabling the study of anti-infective efficacy and host-microbe interactions. mBio. 8 (1), 00140(2017).
- Davis, M. M. A prescription for human immunology. Immunity. 29 (6), 835-838 (2008).
- Mestas, J., Hughes, C. C. Of mice and not men: differences between mouse and human immunology. The Journal of Immunology. 172 (5), 2731-2738 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon