Method Article
从人多能干细胞中产生气道上皮细胞气液界面培养物
摘要
人类诱导多能干细胞分化方案的最新进展允许逐步衍生器官特异性细胞类型。在这里,我们提供了在气液界面培养物中维持和扩增iPSC衍生的气道基底细胞及其分化为粘纤毛上皮的详细步骤。
摘要
传导气道疾病,如哮喘、囊性纤维化 (CF)、原发性纤毛运动障碍 (PCD) 和病毒性呼吸道感染,是全世界发病和死亡的主要原因。使用人支气管上皮细胞(HBECs)的 体外 平台有助于我们了解健康和疾病中的气道上皮。从患有罕见遗传疾病或罕见突变的个体中获取HBECs是肺部研究的瓶颈。
诱导多能干细胞(iPSCs)很容易通过"重编程"体细胞产生,并保留个体供体的独特遗传背景。最近的进展允许iPSCs定向分化为肺上皮祖细胞,肺泡2型细胞,以及 通过 基底细胞(主要气道干细胞)传导气道上皮的细胞。
在这里,我们概述了iPSC衍生的气道基底细胞(以下简称iBC)的维持和扩增方案,以及它们在气液界面(ALI)培养物中的三系分化。iBC作为上皮球体维持和扩增,悬浮在细胞外基质液滴中,在补充TGF-ß和BMP信号通路抑制剂的初级基底细胞培养基中培养。这些上皮球内的iBC表达关键的基础标志物TP63和NGFR,可以通过荧光活化细胞分选(FACS)纯化,并且在标准ALI培养条件下接种在多孔膜上时,分化成功能性气道上皮。来自健康供体的ALI培养物由基底细胞、分泌细胞和多纤毛细胞组成,并显示出上皮屏障完整性、运动纤毛和粘液分泌。源自CF或PCD个体的培养物概括了功能失调的CFTR介导的氯化物转运或纤毛不力,以及相应的致病上皮缺陷。
在这里,我们提出了一种用于生成人体细胞的方案,可用于建模和理解气道疾病。
引言
慢性肺病在全世界的发病率和死亡率方面负担很大1.影响传导气道的疾病,如哮喘、囊性纤维化 (CF)、原发性纤毛运动障碍 (PCD) 和病毒感染,都是常见和罕见的获得性疾病和遗传性疾病,这些疾病导致了这一全球负担。传导气道的主要功能是:1)作为层流空气的导管,以及2)提供病原体和碎片的粘膜纤毛清除。分泌性、多纤毛细胞和基底细胞代表了传导气道的主要上皮细胞类型。较罕见的上皮细胞类型包括离子细胞、簇状细胞和神经内分泌细胞,并已在其他地方进行了回顾2.
从广义上讲,理解疾病机制和推进治疗方法的一个主要障碍是始终缺乏用于临床前模型的人类原代组织。HBECs通常被认为是人类气道上皮生物学的金标准 体外 模型,并在CF研究中发挥了关键作用,特别是3。然而,它们通常从支气管镜活检中分离出来,从手术后的肺组织中分离出来,或者从移植目的而被排斥的肺部中分离出来。从遗传病患者那里获得HBECs,包括CF和PCD的研究重点,是罕见且不可预测的。需要克服患者来源的气道上皮细胞的这一瓶颈。iPSCs很容易从任何个体产生,它们保留了供体的独特遗传背景,并且在细胞培养条件下具有显着的增殖和长期存活能力4,5,6。通过概括关键的胚胎学步骤,iPSCs经历"定向分化"成器官特异性细胞类型。我们和其他人已经开发了方案来产生iPSC衍生的肺祖细胞,肺泡2型细胞7,8 和传导气道的细胞,包括气道基底细胞9,10,11,12。
气道基底细胞是传导气道13的干细胞。在先前发表的工作中,我们的团队已经产生了iPSC衍生的气道上皮细胞,包括表达典型基底细胞标志物(包括TP63,KRT5和NGFR)的亚群(iBC)。根据成人基底细胞生物学的线索,抑制双SMAD途径(TGF-β和BMP)导致NGFR + iBC11,14的上调。NGFR + iBC作为单细胞重悬于细胞外基质液滴中,并在基底细胞培养基中培养。它们自我更新以维持ibc种群并形成上皮球体;然而,一定比例也以这种格式分化成分泌细胞(称为3-D培养物)。在以下实验方案中,我们详细介绍了在3-D培养物中维持和扩展这些iBC的步骤,以及生成功能性2-D粘膜纤毛ALI培养物所需的步骤。
该分化方案的初始步骤先前已经发布,在此不再回顾11,12。本手稿将围绕iBC的扩增和纯化以及它们随后在ALI培养物中分化为功能性分泌细胞和多纤毛细胞。
研究方案
以下每个步骤都应在生物安全2级层流罩中使用无菌技术进行。所有培养基在加入细胞之前应加热至室温(22°C),除非另有特别提及。每个离心步骤应在室温(约22°C)下进行。 图 1 概述了该协议的原理图。
1. 所需培养基的制备
注:有关详细信息 ,请参阅补充文件 1 。
- 基底细胞培养基
- 根据制造商的说明准备基介质。
- 在每50 mL碱基培养基中,加入5μLA83-01(10mM),5μLDMH1(10mM),50μLY-27632(10mM)和100μLPrimocin(50mg / mL)。此后,该培养基称为基底细胞培养基。
- 在4°C下储存长达1个月。
- ALI 分化培养基
- 根据制造商的说明准备培养基。
- 对于每50mLALI分化培养基,加入100μLPrimocin(50mg / mL)。
- 在4°C下避光保存长达1个月。
- 排序缓冲区
- 对于每 50 mL 分类缓冲液,将 47.5 mL Hanks 平衡盐溶液、1 mL FBS、200 μL EDTA (500 mM)、1.25 mL HEPES 缓冲液(1 M)、50 μL Y-27632 (10 mM) 和 100 μL Primocin(50 mg/mL)混合。
- 过滤器使用0.4μm孔径灭菌。
- 在4°C下储存长达1个月。
- 冷冻保存培养基
- 对于每50 mL冷冻保存培养基,将45 mL基底细胞培养基和5 mL二甲基亚砜(DMSO)组合。
- 过滤器使用0.4μm孔径灭菌。
- 在4°C下储存长达1个月。
2. 冷冻保存iBC的解冻
- 解冻(在冰上)足够体积的3-D生长因子减少细胞外基质(以下3-D基质)。保持在冰上,直到准备使用。
注意:当解冻一个小瓶(含有250,000个细胞)时,解冻100-200μL3-D基质。 - 通过在37°C水或珠浴中孵育一小瓶先前冷冻保存的iBC单细胞悬浮液,直到没有可见的冷冻培养基(1-2分钟)。
- 使用5 mL血清学移液器,将细胞悬浮液加入15 mL锥形管中。
- 向细胞悬浮液中滴加6-10mL DMEM / F12,轻轻混合,并以300× g 离心5分钟以沉淀细胞。
- 吸出上清液并用P1000微量移液管将细胞沉淀重悬于1mL基底细胞培养基中。取出10μL等分试样并进行细胞计数。
- 将细胞以300× g 离心5分钟。吸出上清液,并以4,000个细胞/ μL的密度重悬于先前解冻的3-D基质中用P1000微量移液管。
注意:避免向 3-D 矩阵添加气泡至关重要。缓慢而小心地移液基质。 - 使用P200微量移液管,将一个液滴(25或50μL)加入12孔组织培养处理板的每个孔的基底。如果从250,000个冷冻细胞开始,则此步骤中的预期液滴数在3-4(25μL液滴)之间,具体取决于细胞活力。
- 将板在37°C下孵育约15分钟,然后向每个孔中加入足够的基础细胞培养基以完全浸没液滴(1.5mL用于50μL; 1mL用于25μL),使用5mL血清学移液管。将板放回加湿的培养箱中。
- 使用新鲜的基底细胞培养基每2天喂养一次细胞。用5 mL血清移液管将新鲜培养基加入孔的侧面,注意不要干扰细胞液滴。
注意:该阶段接种的细胞密度比第3节中iBC的常规传代高10倍。
3. 三维培养中球体的解离和iBC的扩增
- 解冻(在冰上)足够体积的3-D矩阵。保持在冰上,直到准备使用。
注意:所需的3-D矩阵的体积将根据用户需要的单元数量而有所不同。 - 大约5-7天后,从每个孔中吸取培养基,并用P1000微量移液管,直接在球体上加入1mL分散酶II(1 U / mL)以从基质液滴中解离。
- 将板置于37°C培养箱中10-15分钟。
- 使用P1000微量移液管,将分散酶上下移液1-2次,分解大团块的3-D基质。将板返回到37°C再30-40分钟,使基质完全溶解。
- 当3-D基质的液滴在光学显微镜下不再可见时,使用5 mL血清学移液器吸头将自由漂浮的球体加入15 mL锥形中。加入DMEM / F12,最终体积为每锥形10 mL,并以200 x g 离心3分钟以沉淀球体。
- 抽吸上清液,并为每个解离的初始液滴加入1mL 0.05%胰蛋白酶(37°C)(例如,如果从4个液滴开始,则向锥形烧瓶中加入4mL胰蛋白酶)。
- 在37°C下孵育,频繁研磨(每2-3分钟一次)。
- 每隔几分钟用光学显微镜进行一次评估。一旦大多数(>90%)球体解离到单细胞,以1:1的体积比加入10%胎牛血清(DMEM / F12)到胰蛋白酶中。
- 通过40μm细胞过滤器过滤细胞,并以300× g 离心5分钟。
- 进行细胞计数,并以400个细胞/ μL解冻的3-D基质的密度均匀地重悬细胞。避免引入气泡。根据需要重悬尽可能多的液滴以进行下游应用。对每个孔重复步骤2.6-2.9。
4. NGFR+iBC的评价和纯化
- 在最近一次传代10-14天后,将球状体解离为单细胞悬浮液,如步骤3.2-3.5所示,并进行细胞计数。
注意:不同的iPSC线路行为不同;因此,10-14天的范围可能因不同的iBC而异。请参阅 图 2 ,了解 1、4、8 和 14 天后 3-D iBC 的典型外观,此时它们足以进行 NGFR+ 细胞分选。比推荐的更早排序(例如, 如图2C所示的第8天),导致整体细胞数较低,NGFR表达频率较低。分选晚于推荐的(例如,最近一次传代后超过 14 天)导致分选后细胞存活率低下。 - 在分类缓冲液(主要群体)中以1 x 106 个细胞/ 100μL的密度重悬细胞。将小等分试样(25-50μL)转移到单独的管(次要人群)中。
- 将偶联抗NGFR抗体(1:100稀释)添加到主细胞群中。
- 将同种型对照抗体(1:200稀释)添加到次要细胞群中。
- 保护细胞免受光照,并在冰上保持30分钟,间歇性地(每5-10分钟)研磨细胞以防止沉淀。
- 30分钟后,将分选缓冲液以1:1的比例加入每管细胞。将细胞以300× g 离心5分钟。
- 吸出上清液,以10 x 106 细胞/ mL的密度在分选缓冲液中重悬沉淀的细胞,并加入活细胞或死细胞染色剂。
- 使用适当的NGFR +门控策略(基于同种型控制,见 图3),对足够的活NGFR +细胞进行分类,用于必要的下游应用。
注意:如果将iBC与荧光报告基因(即NKX2-1GFP TP63tdTomato)一起使用,建议对"三重阳性"细胞(即NKX2-1GFP +,TP63tdTomato+,NGFR +)进行排序,并进行适当的门选择和补偿(图3)。在iBC的这种扩增过程中,一部分细胞分化成分泌细胞,并且还可以检测到非常小比例的多纤毛细胞。这两个种群都是NGFR-。
5. 粘液纤毛 ALI 培养物的生成
- 根据制造商的说明,通过将200μL基质添加到顶端室(人胚胎干细胞合格的基质或重组人层粘连蛋白-521)来制备6.5mm多孔膜插入物。
- 在需要之前在37°C下放置至少2小时。
- 从刀片的顶端腔室吸出涂层基质。向基底外侧室中加入500μL基底细胞培养基。
- 将至少30,000个分类的NGFR +细胞(从步骤4.5)重悬于100-200μL基底细胞培养基中,并使用P200微量移液管转移到顶端室。根据需要对任意数量的孔(和可用的细胞)重复。将板置于加湿的37°C培养箱中。
- 在2-3天内,吸入顶端和基底外侧室,并用新鲜的基底细胞培养基(500μL至顶端,100μL至基底外侧)喂养。
- 每天用光学显微镜监测顶端室。当细胞汇合>80%(通常为3-7天)时,在顶端和基底外侧腔室中用ALI分化培养基(未预热)替换基底细胞培养基。使用ALI差异化介质时,通过将介质容器包裹在铝箔中并在可能的情况下关闭头顶灯来避光。
- 第二天,从顶端室吸出培养基,从而将顶端表面暴露在空气中。
- 每2-3天更换基底外侧室中的ALI分化培养基。
- 每 1-2 天监测一次培养物外观。小心地从顶端腔室中吸取任何积聚的液体,而不会干扰细胞层。
- 评估上皮完整性的跨上皮电阻 (TEER)。
注意:TEER可以在空气暴露后的几天内进行评估,以提供上皮层完整性的读数。测量 TEER 的理想时间尚未确定,但与高质量粘膜纤毛分化一致的值通常为 >500 xcm 2。 - 如果需要去除碎屑或粘液,请轻轻地向顶室加入100μL PBS(不含Ca2 + 或Mg2 +)。在37°C下孵育10分钟,然后小心地吸出PBS。
- 在空气暴露7-10天后,通常会出现运动纤毛,并且可以使用光学显微镜观察。根据计划的实验和读数,可以在空气暴露14-28天后分析细胞。
注意:如果使用了荧光报告细胞,并且如果有活细胞荧光显微镜,则可以使用光学显微镜和报告荧光跟踪细胞。
6. 可选(但推荐)冷冻保存 iBC
- 在最近一次3-D培养传代10-14天后,将球状体解离为单细胞悬浮液,如步骤3.2-3.5所示。执行细胞计数。
- 在冷冻卵巢中以250,000个细胞/ 500μL的密度重悬于冷冻保存培养基中。
- 将冷冻管放入容器中以确保温度稳定下降(1°C / min),并转移到-80°C24-48小时,然后转移到-150°C长期储存。
注意:已经对先前NGFR +分类的细胞进行了重复的冷冻保存以及冷冻保存,但这些细胞活力和形成功能性ALI培养物的能力尚未得到充分评估。特别是对于延长的细胞传代,建议评估核型,因为已经注意到iPSC和iPSC衍生细胞的核型不同。
结果
按照该协议,在3D培养物中解冻并扩增了200,000个冷冻保存的iBC(先前确认具有正常的46XY核型)11。五天后,所得的球体被解离,计数,并再次通过以进一步扩增。获得约480,000个细胞并将其重新悬浮在3-D基质中(12×50μL液滴,密度400细胞/ μL)。每2-3天施用新鲜基底细胞培养基。十天后,细胞再次解离并计数。共收获19.7 x 106个细胞并制备用于FACS。用APC偶联的IgG 1 κ同种型对照染色106个细胞,其余的18.7×106个细胞用APC偶联抗NGFR抗体染色30分钟,避光(图3)。
在与同种型对照细胞进行比较后进行NGFR +门控,并专门设置以收集表达最高的NGFR +细胞(图3)。使用这种门控技术,28%的活单细胞是NGFR +。虽然有更多的细胞可用,但收集了750,000个细胞用于下游培养。将分选的细胞以50,000个细胞/ 100μL的浓度重悬于基底细胞培养基中,然后将50,000个细胞接种到每个6.5mm多孔膜插入物上,该插入物已根据制造商的指南涂有人重组层粘连蛋白-521(2μg/ 200μL)。将500μL基底细胞培养基加入到每个插入物的基底外侧室中,并将板置于37°C加湿的培养箱中。三天后,吸出顶室中的培养基,通过光学显微镜将细胞融合约90%(图4B)。来自基底外侧室的介质被抽吸;将ALI分化培养基加入顶端(100μL)和基底外侧(500μL)室中。第二天,来自顶端室的介质被吸入。
在接下来的21天内,定期通过光学显微镜评估细胞,并每2-3天喂入新鲜的ALI分化培养基(仅限基底外侧室)。单个细胞最初易于识别(图4A),具有细长和纺锤形的外观,并形成松散堆积的单层(图4B)。在随后的几天到几周内,细胞形成了一个紧密堆积,高度细胞的上皮层,7-10天后,明显出现了跳动纤毛和粘液的产生。计算样品的TEER,并与原代细胞对照相似(范围从700-1600 Ω x cm2)11。随后用多聚甲醛固定(第21-28天)并对MUC5AC和乙酰化α微管蛋白等进行规范气道上皮细胞标志物的免疫标记(图4C)。总体而言,通过观察运动纤毛,粘液产生以及类似于原代HBECs的多纤毛和分泌细胞的确认免疫染色,我们得出结论,我们成功地从诱导多能干细胞中产生了气道上皮细胞。
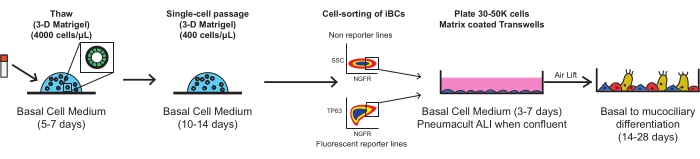
图1:协议的总体示意图。 冷冻保存的iBC在多孔膜插入物上接种之前被解冻,膨胀和FACS纯化,在那里它们分化成功能性粘膜纤毛上皮。 请点击此处查看此图的大图。

图 2:代表性相差图像。 代表性相差图像显示(A)1天,(B)4天,(C)8天和(D)14天后iBC在3D培养中的常见外观(仅NGFR分类前)。比例尺代表 500 μm。 请点击此处查看此图的大图。
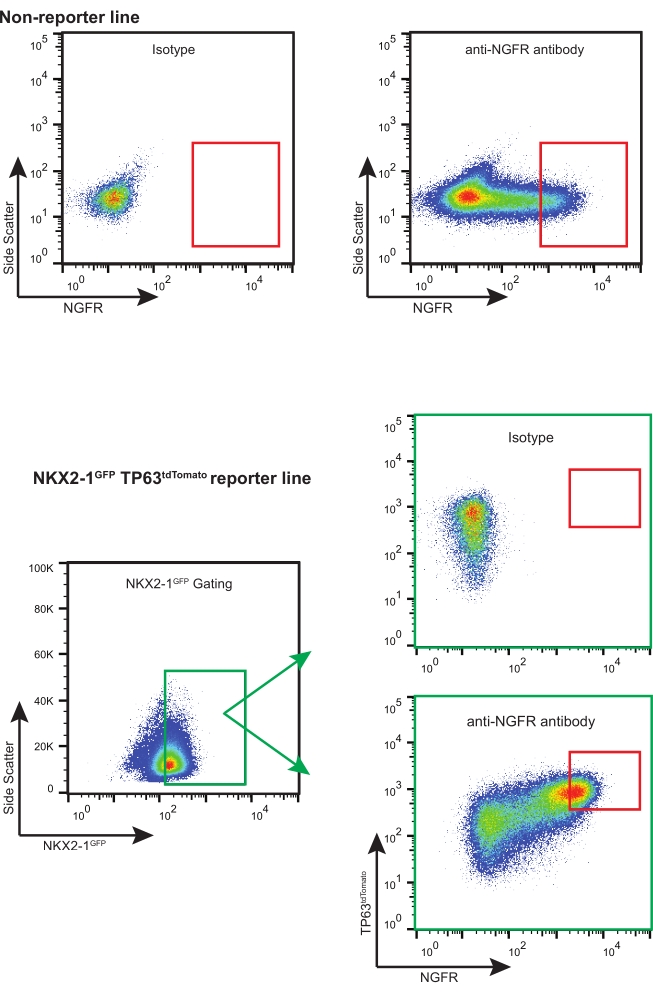
图3:代表性的外地资产管制碳排放系统图。 非报告基因和荧光报告基因iBC的代表性FACS图。显示了同种型对照的示例,并用于选择表达最高的NGFR +细胞。含荧光报告基因的iPSC品系对NKX2-1GFP+ TP63tdTomato+ NGFR+细胞进行"三重分类"。 请点击此处查看此图的大图。
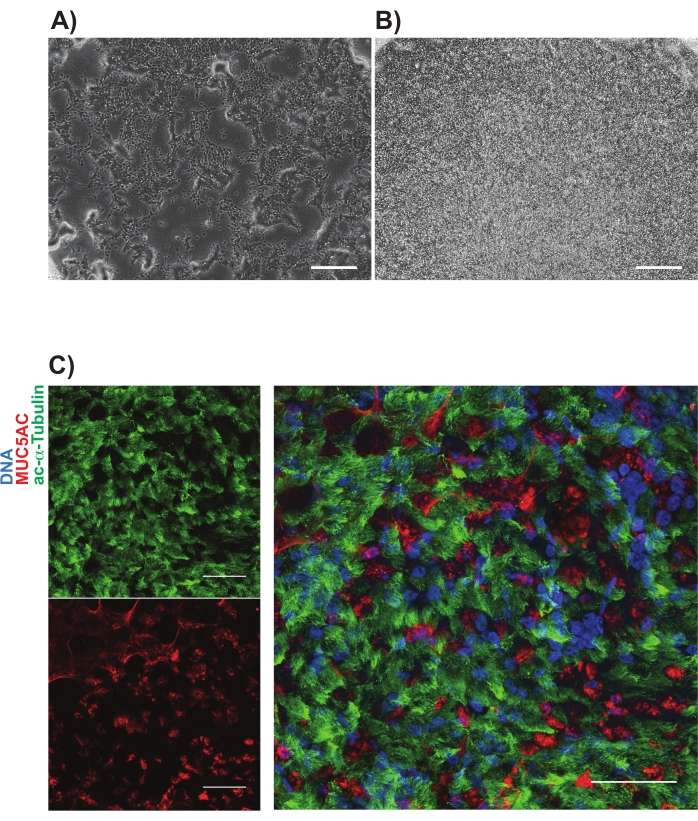
图4:多孔膜上ibc培养物的代表性图像。 相衬图像在电镀后(A)1天和 (B)3天显示。(C)中所示的粘膜纤毛培养物的代表性免疫标记;乙酰化α微管蛋白(绿色)和MUC5AC(红色)。比例尺代表 25 μm。 请点击此处查看此图的放大版本。
补充文件 1:介质组件表。请点击此处下载此文件。
讨论
HBECs是研究气道上皮疾病的金标准细胞类型。由于它们的局限性(包括可及性和遗传操作的难度),我们产生了iBC和ALI培养物的衍生方案。这些细胞可以来自任何供体并保留其独特的遗传背景,从而允许进行基本的发育研究,疾病建模和新的治疗发展。
虽然所描述的协议的每个单独步骤都是必要的,但有几个步骤值得额外提及。首先,在需要将球体解离成单个细胞的每个步骤中,避免过度移液至关重要;酶消化(使用脱饷酶或胰蛋白酶)可促进更好的细胞存活,而过度移液会导致严重的细胞死亡。其次,在纯化NGFR + iBC时,同种型对照的利用至关重要,我们建议选择具有FACS表达最高的NGFR +细胞(图3)。这种方法可获得最佳的 ALI 培养效果,并进行适当的粘膜纤毛分化。最后,按照方案中的记录精确制备和接种多孔膜是ALI培养物生存的基础。虽然我们通常每个插入片段接种30,000-60,000个细胞,但我们的成功细胞只有20,000个。虽然可以使用人胚胎干细胞合格的基质包衣产生成功的培养物,但我们最近使用了人重组层粘连蛋白-521,其ALI培养物的耐久性显着更高。
极少数情况下,iPSC分化可能无法上调足够百分比的NGFR + iBC。在这种情况下,iBC的串行传代(在3D培养中)可能导致NGFR频率随着时间的推移而增加。该协议的局限性包括生成这些单元所需的时间,成本和专业知识。此外,我们认识到许多研究人员对气道上皮的不太常见的细胞类型(例如,离子细胞,神经内分泌细胞)感兴趣。虽然我们已经检测到一些这些更稀有的细胞类型,如在原代HBEC培养物中,但它们没有被可重复地识别,可能是由于对产生这些细胞所需的发育线索的不完全了解。
正如所写的,上述协议从已经冷冻保存的iBC的解冻开始。这种冷冻保存之前的细节先前已经描述过,并且超出了本手稿11,12的范围。
我们的气道上皮ALI培养方法允许从几乎任何供体中产生功能性气道上皮细胞。这大大增加了珍贵的遗传控制气道上皮细胞的可及性,这些细胞可用于疾病建模,药物筛选,未来的基于细胞的疗法,以及提高对气道上皮内发育模式的理解。
披露声明
作者没有披露。
致谢
我们感谢霍金斯,科顿和戴维斯实验室的成员多年来对这个项目和其他项目的有益投入。我们还感谢Brian Tilton(BU细胞分选总监)的奉献精神和技术专长,我们感谢波士顿大学再生医学中心(CReM)的Greg Miller和Marianne James在患者特定iPSC的维护和表征方面的支持和技术专长,并得到NIH拨款NO1 75N92020C00005和U01TR001810的支持。这项工作得到了NIH拨款U01HL148692,U01HL134745,U01HL134766和R01HL095993到D.N.K,R01HL139876到B.R.D,R01 HL139799到F.H.,囊性纤维化基金会(CFF)资助CFF 00987G220和CFF WANG20GO到D.N.K,CFF DAVIS15XX1,DAVIS17XX0,DAVIS19XX0到B.R.D,CFF SUZUKI19XX0到S.S,CFF BERICA2010到A.B., 和CFF HAWKIN20XX2到F.H.
材料
| Name | Company | Catalog Number | Comments |
| 12-well tissue culture treated plate | Corning | 3515 | flat bottom |
| 3-D growth factor reduced Matrigel | Corning | 356230 | |
| A83-01 | ThermoFisher Scientific | 293910 | |
| Cell culture inserts (Transwell) | Corning | 3470 | 6.5mm diameter; 0.4μm pore size |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | |
| Dispase II, Powder | ThermoFisher Scientific | 17105-041 | |
| DMH1 | ThermoFisher Scientific | 412610 | |
| Dulbecco's Modified Eagle Medium/Nutrient Mixture (DMEM):F-12 | ThermoFisher Scientific | 11330-032 | |
| Dulbecco's Phosphate Buffered Saline (PBS) (1X) | Gibco | 14190-144 | |
| Ethylenediaminetetraacetic acid disodium salt solution (EDTA) | Sigma | E7889 | |
| Fetal Bovine Serum (FBS) | Fisher | SH3007003E | |
| Hanks' Balanced Salt Solution (HBSS) | ThermoFisher Scientific | 14175-079 | |
| HEPES | Sigma | H3375 | |
| hESC-qualified Matrigel | Corning | 354277 | |
| Mouse IgG1kappa isotype control, APC-conjugated | Biolegend | 400122 | |
| Mouse monoclonal anti-human CD271/NGFR, APC-conjugated | Biolegend | 345108 | |
| PneumaCult-ALI Medium (ALI Differentiation Medium) | StemCell Technologies | 05001 | |
| PneumaCult-Ex Plus Medium (Basal Cell Base Medium) | StemCell Technologies | 05040 | |
| Primocin | InvivoGen | ant-pm-2 | |
| rhLaminin-521 | ThermoFisher Scientific | A29248 | Final Concentration: 10ug/mL |
| Trypsin-EDTA Solution, 0.05% | Invitrogen | T3924 | |
| Y-27632 | Tocris | 1254 |
参考文献
- GBD Chronic Respiratory Disease Collaborators. Prevalence and attributable health burden of chronic respiratory diseases, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. The Lancet. Respiratory Medicine. 8 (6), 585-596 (2020).
- Alysandratos, K. -. D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Medicine. 107, 183-206 (2005).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Takahashi, K., et al. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131 (5), 861-872 (2007).
- Berical, A., Lee, R. E., Randell, S. H., Hawkins, F. Challenges facing airway epithelial cell-based therapy for cystic fibrosis. Frontiers in Pharmacology. 10, 74 (2019).
- Jacob, A., et al. Derivation of self-renewing lung alveolar epithelial type II cells from human pluripotent stem cells. Nature Protocols. 14 (12), 3303-3332 (2019).
- Gotoh, S., et al. Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Reports. 3 (3), 394-403 (2014).
- Huang, S. X. L., et al. Efficient generation of lung and airway epithelial cells from human pluripotent stem cells. Nature Biotechnology. 32 (1), 84-91 (2013).
- Mou, H., et al. Generation of multipotent lung and airway progenitors from mouse ESCs and patient-specific cystic fibrosis iPSCs. Cell Stem Cell. 10 (4), 385-397 (2012).
- Hawkins, F. J., et al. Derivation of airway basal stem cells from human pluripotent stem cells. Cell Stem Cell. 28 (1), 79-95 (2021).
- Suzuki, S., et al. Differentiation of human pluripotent stem cells into functional airway basal stem cells. STAR Protocols. 2 (3), 100683 (2021).
- Rock, J. R., et al. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12771-12775 (2009).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。