Method Article
인간 다능성 줄기 세포로부터의 기도 상피 세포 공기-액체 계면 배양물의 생성
요약
인간 유도 만능 줄기 세포 분화 프로토콜의 최근 발전은 기관 특이적 세포 유형의 단계적 유도를 허용한다. 여기에서, 우리는 iPSC 유래 기도 기저 세포의 유지 및 확장과 공기-액체 계면 배양물에서 점막 상피로의 분화를 위한 상세한 단계를 제공한다.
초록
천식, 낭포성 섬유증 (CF), 원발성 섬모 운동 장애 (PCD) 및 바이러스 성 호흡기 감염과 같은 실시기도의 질병은 전 세계적으로 이환률 및 사망률의 주요 원인입니다. 인간 기관지 상피 세포 (HBECs)를 사용하는 시험관 내 플랫폼은 건강과 질병에서기도 상피에 대한 우리의 이해에 도움이되었습니다. 희귀 한 유전 질환 또는 희귀 한 돌연변이를 가진 개인의 HBEC에 대한 접근은 폐 연구의 병목 현상입니다.
유도 만능 줄기 세포 (iPSCs)는 체세포를 "재 프로그래밍"함으로써 쉽게 생성되며 개별 기증자의 독특한 유전 적 배경을 유지합니다. 최근의 발전은 iPSCs를 폐 상피 전구 세포, 폐포 유형 2 세포뿐만 아니라 주요 기도 줄기 세포인 기저 세포를 통해 전도하는 기도 상피의 세포로의 지향적 분화를 허용한다.
여기서 우리는 iPSC 유래 기도 기저 세포 (이하 iBCs)의 유지 및 확장뿐만 아니라 공기 액체 계면 (ALI) 배양물에서의 삼선 분화를위한 프로토콜을 개략적으로 설명합니다. iBCs는 TGF-ß 및 BMP 신호전달 경로의 억제제로 보충된 일차 기저 세포 배지에서 배양된 세포외 매트릭스의 액적에 현탁된 상피 구체로서 유지되고 확장된다. 이들 상피 구체 내의 iBCs는 주요 기저 마커 TP63 및 NGFR을 발현하고, 형광 활성화 세포 분류(FACS)에 의해 정제될 수 있고, 표준 ALI 배양 조건에서 다공성 멤브레인 상에 플레이팅될 때, 기능성 기도 상피로 분화된다. 건강한 기증자로부터 유래된 ALI 배양물은 기저, 분비 및 다균 세포로 구성되며 상피 장벽 완전성, 운동성 섬모 및 점액 분비를 입증합니다. CF 또는 PCD를 갖는 개체로부터 유래된 배양물은 각각의 질환-유발 상피 결함인 기능장애성 CFTR-매개된 클로라이드 수송 또는 이모성 섬모를 재검토한다.
여기에서, 우리는 기도 질환을 모델링하고 이해하는데 적용될 수 있는 인간 세포의 생성을 위한 프로토콜을 제시한다.
서문
만성 폐 질환은 전 세계적으로 이환률과 사망률의 큰 부담을 차지합니다1. 천식, 낭포성 섬유증 (CF), 원발성 섬모 운동 장애 (PCD) 및 바이러스 감염과 같은 실시기도에 영향을 미치는 상태는 후천성 및 유전 적 흔하고 희귀 한 질병을 나타내며, 이는 전 세계적인 부담에 기여합니다. 전도 기도의 주요 기능은 1) 공기의 층류를위한 도관 역할을하고, 2) 병원균과 파편의 점액 제거를 제공하는 것입니다. 분비, 다섬모, 및 기저 세포는 전도 기도의 주요 상피 세포 유형을 나타낸다. 희귀한 상피 세포 유형은 이온세포, 터프트 세포, 및 신경내분비 세포를 포함하며, 다른 곳에서 검토되었다2.
광범위하게, 질병의 메카니즘을 이해하고 치료 접근법을 발전시키는 데 대한 주요 장벽은 전임상 모델에서 사용하기 위한 인간 일차 조직의 일관된 부족이었다. HBECs는 일반적으로 인간 기도 상피 생물학의 금 표준 시험관 내 모델로 간주되며 특히 CF 연구에서 중요한 역할을수행했습니다 3. 그러나 이들은 일반적으로 기관지 경 생검, 수술 후 폐 조직 또는 이식 목적으로 거부 된 폐에서 분리됩니다. CF 및 PCD의 연구 우선 순위를 포함하여 유전 질환을 앓고있는 개인의 HBEC에 대한 접근은 드물고 예측할 수 없습니다. 환자 유래 기도 상피 세포에 대한 이러한 병목 현상을 극복하는 것이 필요하다. iPSCs는 임의의 개체로부터 쉽게 생성되고, 공여자의 독특한 유전적 배경을 보유하며, 세포 배양 조건4,5,6에서 장기간 증식하고 생존할 수 있는 현저한 능력을 갖는다. 주요 배아 학적 단계를 되풀이함으로써 iPSC는 장기 특이적 세포 유형으로 "직접 분화"를 겪습니다. 우리와 다른 사람들은 iPSC 유래 폐 전구 인자, 폐포 유형 2 세포 7,8 및 기도 기저 세포9,10,11,12를 포함하는 전도 기도의 세포를 생성하기위한 프로토콜을 개발했습니다.
기도 기저 세포는 전도 기도(13)의 줄기 세포이다. 이전에 발표 된 연구에서 우리 그룹은 TP63, KRT5 및 NGFR을 포함한 표준 기저 세포 마커를 발현하는 하위 집합 (iBCs)을 포함하여 iPSC 유래 기도 상피 세포를 생성했습니다. 성인 기저 세포 생물학의 단서에 따라, 이중 SMAD 경로 (TGF-β 및 BMP)의 억제는 NGFR + iBC11,14의 상향 조절을 유도합니다. NGFR+ iBCs는 세포외 매트릭스의 액적에 단일 세포로서 재현탁되고 기저 세포 배지에서 배양된다. 그들은 iBC 인구를 유지하고 상피 구상체를 형성하기 위해 스스로 갱신합니다. 그러나, 비율은 또한 이 포맷(3-D 배양물이라고 함)에서 분비 세포로 분화된다. 다음 프로토콜에서는 3-D 배양물에서 이러한 iBC를 유지 및 확장하는 단계와 기능적 2-D 점막질 ALI 배양물을 생성하는 데 필요한 단계를 자세히 설명합니다.
이 분화 프로토콜의 초기 단계는 이전에 발표되었으며 여기에서 검토되지 않을 것입니다11,12. 이 원고는 iBCs의 확장 및 정제와 ALI 배양물에서 기능적 분비 및 다균 세포로의 후속 분화에 중점을 둘 것입니다.
프로토콜
다음 각 단계는 생물안전 레벨 2 층류 후드에서 멸균 기술을 사용하여 수행해야 합니다. 모든 배지는 달리 구체적으로 언급되는 경우를 제외하고 세포에 첨가되기 전에 실온 (22°C)으로 가온되어야 한다. 각 원심분리 단계는 실온(약 22°C)에서 수행되어야 한다. 그림 1에서는 프로토콜의 회로도를 간략하게 설명합니다.
1. 필요한 매체의 준비
참고: 자세한 내용은 보충 파일 1을 참조하십시오.
- 기저 세포 배지
- 제조업체의 지침에 따라 기본 매체를 준비하십시오.
- 기본 배지 50mL마다 A83-01 5μL(10mM), DMH1 5μL(10mM), Y-27632 50μL(10mM) 및 프리모신 100μL(50mg/mL)를 첨가한다. 이후, 이 배지를 기저 세포 배지라고 한다.
- 4°C에서 최대 1개월 동안 보관하십시오.
- ALI 분화 배지
- 제조업체의 지침에 따라 매체를 준비하십시오.
- ALI 분화 배지 50mL마다 프리모신 100μL(50mg/mL)를 첨가한다.
- 최대 1 개월 동안 4 ° C에서 빛으로부터 보호 된 보관하십시오.
- 정렬 버퍼
- 정렬 버퍼 50mL마다 행크스의 밸런스드 소금 용액 47.5mL, FBS 1mL, EDTA 200μL(500mM), HEPES 버퍼 1.25mL(1M), Y-27632 50μL(10mM), 프리모신 100μL(50mg/mL)를 섞는다.
- 필터는 0.4 μm 공극 크기를 사용하여 멸균한다.
- 4°C에서 최대 1개월 동안 보관하십시오.
- 동결 보존 매체
- 동결보존 배지 50mL마다 기저 세포 배지 45mL와 디메틸설폭사이드(DMSO) 5mL를 섞습니다.
- 필터는 0.4 μm 공극 크기를 사용하여 멸균한다.
- 4°C에서 최대 1개월 동안 보관하십시오.
2. 냉동 보존 된 iBC의 해동
- 충분한 부피의 3-D 성장 인자 감소된 세포외 매트릭스(이하 3-D 매트릭스)를 해동(얼음 상에서). 사용할 준비가 될 때까지 얼음 위에 보관하십시오.
참고: 하나의 바이알(250,000개의 세포 포함)을 해동할 때, 100-200μL의 3-D 매트릭스를 해동시킨다. - iBCs의 이전에 동결보존된 단일 세포 현탁액의 바이알을 해동시키고, 눈에 보이는 냉동 배지가 없을 때까지 37°C 물 또는 비드 배쓰에서 인큐베이션한다(1-2분).
- 5 mL 혈청학적 피펫을 사용하여, 세포 현탁액을 15 mL 코니컬 튜브에 첨가한다.
- DMEM/F12 6-10 mL를 세포 현탁액에 적하하고, 부드럽게 혼합하고, 300 x g 에서 5분 동안 원심분리하여 세포를 펠릿화한다.
- 상청액을 흡인하고, 세포 펠릿을 P1000 마이크로피펫으로 1 mL의 기초 세포 배지에 재현탁시킨다. 10 μL 분취량을 제거하고 세포 계수를 수행한다.
- 세포를 300 x g 에서 5분 동안 원심분리한다. 상층액을 흡인하고 P1000 마이크로피펫으로 이전에 해동된 3-D 매트릭스에서 4,000 cells/μL의 밀도로 세포를 재현탁시킵니다.
참고: 3D 행렬에 거품이 추가되지 않도록 하는 것이 중요합니다. 매트릭스를 천천히 그리고 조심스럽게 피펫하십시오. - P200 마이크로피펫으로, 12-웰 조직 배양 처리된 플레이트의 각 웰의 기저부에 하나의 액적(25 또는 50 μL)을 첨가한다. 250,000개의 동결된 세포로 시작하는 경우, 이 단계에서 예상되는 액적 수는 세포 생존력에 따라 3-4(25μL 액적) 사이이다.
- 플레이트를 대략 15분 동안 37°C에서 인큐베이션하고, 이어서 5 mL 혈청학적 피펫을 사용하여 액적(50 μL의 경우 1.5 mL; 25 μL의 경우 1 mL)을 완전히 침수시키기 위해 각 웰에 충분한 기초 세포 배지를 첨가하였다. 플레이트를 가습 인큐베이터로 되돌립니다.
- 신선한 기초 세포 배지를 사용하여 2 일마다 세포를 먹이십시오. 5 mL 혈청 학적 피펫으로 우물 측면에 신선한 배지를 넣고 세포 방울을 방해하지 않도록주의하십시오.
참고: 이 단계에서 도금된 셀의 밀도는 섹션 3의 iBC의 일상적인 통과보다 10배 더 높습니다.
3. 3D 문화에서 구상체의 해리와 iBC의 확장
- 충분한 부피의 3-D 매트릭스를 해동(얼음 위)합니다. 사용할 준비가 될 때까지 얼음 위에 보관하십시오.
참고: 필요한 3D 매트릭스의 볼륨은 사용자에게 필요한 셀 수에 따라 달라집니다. - 약 5-7 일 후, 각 웰에서 배지를 흡인하고 P1000 마이크로 피펫으로 Dispase II (1 U / mL) 1 mL를 구상체에 직접 첨가하여 매트릭스의 액적에서 해리시킵니다.
- 플레이트를 37°C 인큐베이터에 10-15분 동안 놓는다.
- P1000 마이크로피펫을 사용하여 디스파제를 1-2회 위아래로 피펫하여 3D 매트릭스의 큰 덩어리를 분해합니다. 플레이트를 추가 30-40분 동안 37°C로 복귀시켜, 매트릭스가 완전히 용해되도록 한다.
- 3-D 매트릭스의 액적이 광학 현미경으로 더 이상 보이지 않으면 5mL 혈청 학적 피펫 팁을 사용하여 자유롭게 떠있는 구상체를 15mL 원뿔형에 추가하십시오. DMEM/F12를 원뿔형 당 10 mL의 최종 부피로 첨가하고, 200 x g 에서 3분 동안 원심분리하여 구상체를 펠릿화한다.
- 상청액을 흡인하고, 해리된 모든 초기 액적에 대해 0.05% 트립신 (37°C) 1 mL를 첨가한다 (예를 들어, 4개의 액적으로 시작하는 경우, 원뿔형 플라스크에 4 mL 트립신을 첨가).
- 37°C에서 인큐베이션하고, 자주 분쇄한다(2-3분마다).
- 몇 분마다 광학 현미경으로 평가하십시오. 구상체의 대다수 (>90 %)가 단일 세포로 해리되면 트립신에 1 : 1 부피비로 10 % 태아 소 혈청 (DMEM / F12)을 첨가하십시오.
- 세포를 40 μm 세포 스트레이너를 통해 여과하고, 5분 동안 300 x g 에서 원심분리한다.
- 셀 카운트를 수행하고 해동된 3-D 매트릭스의 400 cells/μL의 밀도로 세포를 고르게 재현탁하십시오. 기포가 유입되지 않도록 하십시오. 다운스트림 응용 프로그램에 필요한 만큼 물방울을 다시 일시 중단합니다. 각 웰에 대해 2.6-2.9단계를 반복합니다.
4. NGFR+ iBC의 평가 및 정제
- 가장 최근의 계대 후 10-14일 후, 단계 3.2-3.5에서와 같이 구상체를 단일 세포 현탁액으로 해리시키고 세포 계수를 수행한다.
참고: 다른 iPSC 라인은 다르게 동작합니다. 따라서 10-14 일의 범위는 iBC마다 다를 수 있습니다. NGFR+ 셀 분류에 적합한 1, 4, 8 및 14일 후에 3-D iBC의 일반적인 모양은 그림 2 를 참조하십시오. 권장보다 일찍 정렬하면(예를 들어, 도 2C에서와 같이 8일째), NGFR 발현이 덜 빈번한 전체적으로 더 낮은 셀 수를 초래한다. 권장보다 늦게 정렬(예를 들어, 가장 최근의 통과 후 14일 초과)은 불량한 사후 정렬 세포 생존을 초래한다. - 세포를 정렬 완충액 (주요 개체군)에서 1 x 106 세포 / 100 μL의 밀도로 재현탁하십시오. 작은 분취량 (25-50 μL)을 별도의 튜브 (소수 집단)로 옮깁니다.
- 컨쥬게이션된 항-NGFR 항체 (1:100 희석)를 주요 세포 집단에 첨가한다.
- 이소타입 대조군 항체 (1:200 희석)를 마이너 세포 집단에 첨가한다.
- 세포를 빛으로부터 보호하고 30 분 동안 얼음 위에 유지하고, 간헐적으로 (5-10 분마다) 세포를 분쇄하여 펠릿을 방지하십시오.
- 30분 후, 세포의 각 튜브에 1:1 비율로 정렬 버퍼를 추가합니다. 세포를 300 x g 에서 5분 동안 원심분리한다.
- 상층액을 흡인하고, 펠렛화된 세포를 정렬 버퍼에 10 x 106 cells/mL의 밀도로 재현탁시키고, 살아있는 세포 또는 죽은 세포 얼룩을 첨가한다.
- 적절한 NGFR+ 게이팅 전략(이소타입 제어 기반, 그림 3 참조)을 사용하여 필요한 다운스트림 애플리케이션을 위해 충분한 라이브 NGFR+ 셀을 정렬합니다.
참고: 형광 리포터와 함께 iBC를 사용하는 경우(예: NKX2-1GFP TP63 tdTomato), 적절한 게이트 선택 및 보정을 통해 "삼중 양성" 세포(예: NKX2-1GFP+, TP63 tdTomato+, NGFR+)를 정렬하는 것이 좋습니다(그림 3). iBCs의 이러한 확장 동안, 세포의 비율이 분비 세포로 분화되고 다섬화된 세포의 매우 작은 비율이 또한 검출될 수 있다. 이 두 집단 모두 NGFR-이다.
5. 점액성 ALI 문화의 생성
- 제조자의 지시에 따라 정점 챔버(인간 배아 줄기 세포-적격 매트릭스 또는 재조합 인간 라미닌-521)에 200 μL 매트릭스를 첨가하여 6.5 mm 다공성 막 삽입물을 제조하였다.
- 필요하기 전에 적어도 2 시간 동안 37 °C에서 두십시오.
- 코팅 매트릭스를 인서트의 정점 챔버로부터 흡인한다. 500 μL의 기저 세포 배지를 기저 측방 챔버에 첨가한다.
- 적어도 30,000개의 분류된 NGFR+ 세포(단계 4.5로부터)를 100-200 μL 기초 세포 배지에 재현탁시키고 P200 마이크로피펫을 사용하여 정점 챔버로 옮긴다. 원하는 만큼 많은 웰(및 사용 가능한 셀)에 대해 반복합니다. 플레이트를 가습된 37°C 인큐베이터에 놓는다.
- 2-3 일 후, 흡인물 정점 및 기저 측부 챔버를 신선한 기저 세포 배지 (500 μL에서 정점으로, 100 μL를 기저 측방으로)로 공급하십시오.
- 가벼운 현미경으로 매일 정점 챔버를 모니터링하십시오. 세포가 >80% 합류할 때(전형적으로 3-7일), 기저 세포 배지를 정점 및 기저 챔버 모두에서 ALI 분화 배지(예열되지 않음)로 대체한다. ALI 차별화 매체로 작업할 때는 미디어 용기를 호일로 감싸고 가능한 경우 오버헤드 조명을 꺼서 빛으로부터 보호하십시오.
- 다음날, 정점 챔버에서 매체를 흡인하여 정점 표면을 공기에 노출시킵니다.
- 2-3일마다 기저측 챔버에서 ALI 분화 배지를 교체하십시오.
- 1-2 일마다 배양 모양을 모니터링하십시오. 세포층을 방해하지 않고 정점 챔버에서 축적 된 액체를 조심스럽게 흡인하십시오.
- 상피 완전성에 대한 경상피 전기 저항(TEER)을 평가한다.
참고: TEER는 공기 노출 후 며칠 동안 평가하여 상피층 무결성을 판독할 수 있습니다. TEER를 측정하는 이상적인 시간은 확립되지 않았지만 고품질 점막질 분화와 일치하는 값은 일반적으로 >500 xcm2입니다. - 파편이나 점액을 제거해야 하는 경우, 100 μL PBS (Ca2+ 또는 Mg2+ 없이)를 정점 챔버에 부드럽게 첨가한다. 37°C에서 10분 동안 인큐베이션한 다음, PBS를 조심스럽게 흡인한다.
- 공기 노출 후 7-10 일 후, 운동성 섬모가 일반적으로 나타나고 광 현미경을 사용하여 볼 수 있습니다. 계획된 실험 및 판독에 따라, 세포는 공기 노출 후 14-28일 후에 분석될 수 있다.
참고 : 형광 리포터 세포를 사용하고 라이브 세포 형광 현미경을 사용할 수있는 경우 리포터 형광뿐만 아니라 광 현미경으로 세포를 추적 할 수 있습니다.
6. iBC의 선택적(그러나 권장되는) 냉동 보존
- 가장 최근의 3-D 배양 계대 후 10-14일 후, 단계 3.2-3.5에서와 같이 구상체를 단일 세포 현탁액에 해리시킨다. 셀 카운트를 수행합니다.
- 냉동 보존 배지에서 250,000 세포 / 500 μL의 밀도로 재현탁하십시오.
- 냉동 용기에 넣어 온도가 꾸준히 떨어지도록(1°C/분) -80°C로 24-48시간 동안 옮긴 다음 -150°C로 옮겨 장기간 보관하십시오.
참고: 이전의 NGFR+ 분류된 세포의 동결보존뿐만 아니라 반복적인 동결보존이 수행되었지만, 이들은 세포 생존력 및 기능적 ALI 배양물을 형성하는 능력에 대해 적절하게 평가되지 않았다. 특히 확장된 세포 통과의 경우, iPSCs 및 iPSC 유래 세포에서 다양한 것으로 밝혀졌기 때문에 핵형에 대해 평가하는 것이 좋습니다.
결과
이 프로토콜에 따라, 200,000개의 동결보존된 iBCs(이전에 정상 46XY 핵형을 갖는 것으로 확인됨)11을 해동하고 3-D 배양물에서 확장시켰다. 닷새 후, 생성 된 구상체는 해리되고, 계산되고, 더 많은 확장을 위해 다시 통과되었습니다. 약 480,000개의 세포를 수득하고 3-D 매트릭스(12 x 50μL 액적, 밀도 400 세포/μL)에 재현탁시켰다. 신선한 기초 세포 배지는 2-3일마다 적용되었다. 열흘 후, 세포는 다시 한번 해리되고 계수되었다. 총 19.7 x 106 세포를 수확하고 FACS를 준비하였다. 10개의 6개의 세포를 APC 컨쥬게이션된IgG1κ이소형으로 염색하고, 나머지 18.7 x 106 세포를 빛으로부터 보호된 30분 동안 APC 컨쥬게이션된 항-NGFR 항체로 염색하였다 (도 3).
NGFR+ 게이팅은 이소형 대조군 세포와 비교한 후에 수행되었고, 가장 높은 발현의 NGFR+ 세포를 수집하기 위해 의도적으로 설정되었다(도 3). 이 게이팅 기술을 사용하면 살아있는 단일 세포의 28 %가 NGFR +였습니다. 더 많은 세포가 이용 가능한 동안, 750,000개의 세포가 하류 배양을 위해 수집되었다. 분류된 세포를 50,000 세포/100 μL의 농도로 기초 세포 배지에 재현탁시켰다. 50,000 세포를 각각의 6.5 mm 다공성 막 인서트에 시딩한 다음, 제조자의 가이드라인에 따라 인간 재조합 라미닌-521(2 μg/200 μL)로 코팅하였다. 500 μL 기저 세포 배지를 각각의 인서트의 기저측성 챔버에 첨가하고, 플레이트를 37°C 가습 인큐베이터에 넣었다. 사흘 후, 정점 챔버 내의 배지를 흡인하고, 세포를 광 현미경으로 ~90% 합류시켰다(도 4B). 기저측 챔버로부터의 배지는 흡인되었다; ALI 분화 배지를 정점 (100 μL) 및 기저측성 (500 μL) 챔버에 첨가하였다. 다음 날, 정점 방의 언론은 열망했다.
그 후 21일에 걸쳐, 세포를 주기적으로 광 현미경으로 평가하고, 2-3일마다 신선한 ALI 분화 배지(기저측성 챔버만)를 공급하였다. 개별 세포는 초기에 쉽게 식별할 수 있었고(도 4A), 길쭉하고 스핀들 모양의 외관을 가지며, 느슨하게 패킹된 단일층을 형성하였다(도 4B). 그 후 며칠에서 몇 주 동안, 세포는 단단히 포장되고 고도로 세포질의 상피층을 형성했으며, 7-10 일 후에 섬모와 점액 생산이 분명하게 나타났습니다. 샘플의 TER은 일차 세포 대조군 (700-1600 Ω xcm2의 범위)11과 유사하게 계산되었다. 정준 기도 상피 세포 마커에 대한 파라포름알데히드 및 면역표지를 사용한 후속 고정(21-28일째)을 MUC5AC 및 아세틸화된 α-튜불린에 대해 수행하였다(도 4C). 전반적으로, 운동성 섬모, 점액 생산 및 원발성 HBEC와 유사한 다섬모 및 분비 세포의 확인 면역 염색에 대한 우리의 관찰을 통해 우리는 유도 만능 줄기 세포로부터기도 상피 세포를 성공적으로 생성했다고 결론지었습니다.
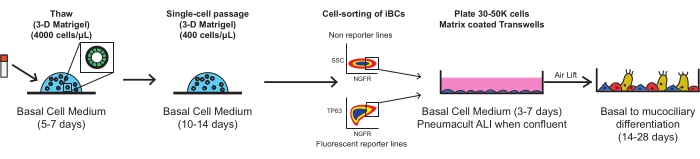
그림 1: 프로토콜의 전체 회로도. 동결보존된 iBC는 다공성 멤브레인 인서트에 도금하기 전에 해동, 팽창 및 FACS를 정제하여 기능성 점막 상피로 분화됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 대표적인 위상차 이미지. 대표적인 위상 콘트라스트 이미지는 (A) 1일, (B) 4일, (C) 8일, 및 (D) 14일 후(단지 NGFR 정렬 전) 후 3-D 배양에서 iBCs의 일반적인 모습을 보여준다. 배율 막대는 500μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
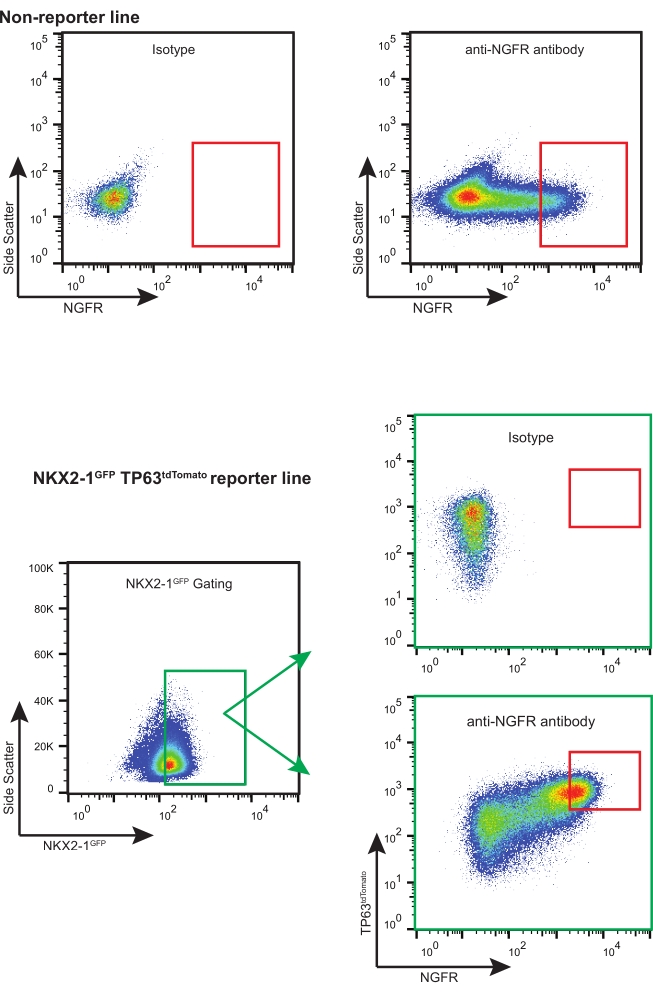
그림 3: 대표적인 FACS 플롯. 비리포터 및 형광 리포터 iBC에 대한 대표적인 FACS 플롯. 이소타입 대조군의 예가 도시되어 있고, 가장 높은 발현의 NGFR+ 세포를 선택하기 위해 사용되었다. 형광 리포터-함유 iPSC 라인은 NKX2-1GFP+ TP63 tdTomato + NGFR+ 세포에 대해 "삼중 분류"된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
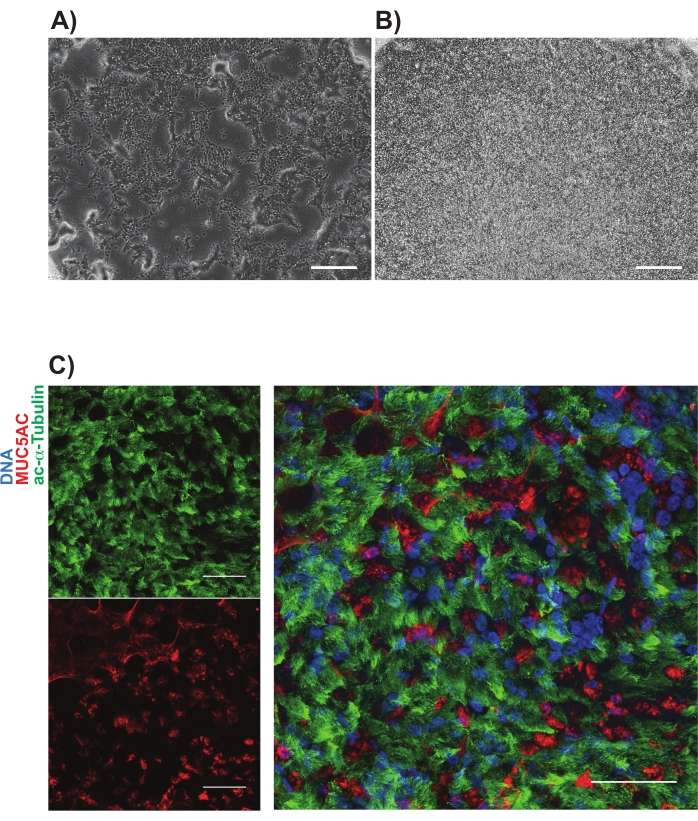
도 4: 다공성 멤브레인 상의 iBC 배양물의 대표적인 이미지. 위상차 이미지는 도금 후 (A) 1일 및 (B) 3일 후에 나타내었다. (C)에 나타낸 점막균 배양물의 대표적인 면역표지; 아세틸화 된 알파 튜불린 (녹색) 및 MUC5AC (빨간색). 배율 막대는 25μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: 미디어 구성 요소 테이블. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
HBECs는 기도 상피의 질병을 연구하는 금 표준 세포 유형입니다. 그들의 한계 (접근성 및 유전자 조작의 어려움 포함)로 인해 우리는 iBC 및 ALI 배양의 유도를위한 프로토콜을 생성했습니다. 이 세포는 모든 기증자로부터 유래 될 수 있으며 고유 한 유전 적 배경을 유지하므로 기본 발달 연구, 질병 모델링 및 새로운 치료 개발을 허용합니다.
설명 된 프로토콜의 각 개별 단계가 필요하지만 추가 언급이 필요한 몇 가지가 있습니다. 첫째, 구상체를 단일 세포로 해리해야하는 각 단계에서 과도한 피펫팅을 피하는 것이 중요합니다. 효소 소화 (디스파제 또는 트립신 사용)는 더 나은 세포 생존을 촉진하는 반면, 과도한 피펫팅은 상당한 세포 사멸을 초래합니다. 둘째, NGFR+ iBC를 정제할 때 이소타입 조절의 활용이 매우 중요하며, FACS를 사용하여 가장 많이 발현하는 NGFR+ 세포를 선택하는 것이 좋습니다(그림 3). 이 접근법은 적절한 점막질 분화를 갖는 최적의 ALI 배양을 초래한다. 마지막으로, 프로토콜에 문서화 된 바와 같이 정확하게 다공성 멤브레인의 준비 및 시딩은 ALI 문화 생존을위한 기본입니다. 우리는 일반적으로 삽입 당 30,000-60,000 개의 세포를 시드하지만 20,000 개의 세포로 성공을 거두었습니다. 성공적인 배양은 인간 배아 줄기 세포 자격을 갖춘 매트릭스 코팅을 사용하여 생성 될 수 있지만, 우리는 ALI 배양물의 상당히 높은 내구성을 가진 인간 재조합 라미닌 -521을 최근에 사용했습니다.
매우 드물게, iPSC 분화는 NGFR+ iBC의 적절한 비율을 상향조절하지 못할 수 있다. 이 경우, iBC의 직렬 패시징(3D 문화권에서)은 시간이 지남에 따라 NGFR 주파수가 증가할 수 있습니다. 이 프로토콜의 한계에는 이러한 셀을 생성하는 데 필요한 시간, 비용 및 전문 지식이 포함됩니다. 또한, 우리는 많은 연구자들이 기도 상피의 덜 일반적인 세포 유형 (예 : 이온세포, 신경 내분비 세포)에 관심이 있음을 알고 있습니다. 우리는 일차 HBEC 배양에서와 같이 이러한 희귀 한 세포 유형 중 일부를 발견했지만, 재현 가능하게 확인되지 않았으며, 이는 이러한 세포를 생성하는 데 필요한 발달 단서에 관한 불완전한 지식 때문일 수 있습니다.
쓰여진 바와 같이, 위의 프로토콜은 이미 냉동 보존 된 iBC의 해동으로 시작됩니다. 이 냉동 보존 이전의 세부 사항은 이전에 설명되었으며이 원고11,12의 범위를 벗어납니다.
우리의 기도 상피 ALI 배양 방법은 거의 모든 기증자로부터 기능적 기도 상피 세포의 생성을 허용합니다. 이것은 질병 모델링, 약물 스크리닝, 미래의 세포 기반 요법에 사용될 수있는 귀중한 유전자 조절기도 상피 세포에 대한 접근성을 크게 증가시킬뿐만 아니라기도 상피 내의 발달 패터닝에 대한 이해를 향상시킵니다.
공개
저자는 공개가 없습니다.
감사의 말
Hawkins, Kotton 및 Davis 연구소의 회원들이이 프로젝트와 다른 프로젝트와 관련하여 수년 동안 도움을 주신 것에 감사드립니다. 우리는 또한 브라이언 틸튼 (BU Cell Sorting Director)의 헌신과 기술 전문 지식에 대한 빚을지고 있으며, NIH 보조금 NO1 75N92020C00005 및 U01TR001810의 지원을 받아 환자 별 iPSC의 유지 보수 및 특성화에 대한 지원 및 기술 전문 지식에 대해 보스턴 대학 재생 의학 센터 (CReM)의 Greg Miller와 Marianne James에게 감사드립니다. 이 작업은 NIH 보조금 U01HL148692, U01HL134745, U01HL134766 및 R01HL095993을 D.N.K, R01HL139876을 B.R.D, R01 HL139799를 F.H.에 부여하고, 낭포성 섬유증 재단 (CFF)은 CFF 00987G220 및 CFF WANG20GO를 D.N.K, CFF DAVIS15XX1, DAVIS17XX0, DAVIS19XX0에서 B.R.D, CFF SUZUKI19XX0에서 S.S, CFF BERICA2010을 A.B.에 부여합니다. CFF HAWKIN20XX2에서 F.H.로
자료
| Name | Company | Catalog Number | Comments |
| 12-well tissue culture treated plate | Corning | 3515 | flat bottom |
| 3-D growth factor reduced Matrigel | Corning | 356230 | |
| A83-01 | ThermoFisher Scientific | 293910 | |
| Cell culture inserts (Transwell) | Corning | 3470 | 6.5mm diameter; 0.4μm pore size |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | |
| Dispase II, Powder | ThermoFisher Scientific | 17105-041 | |
| DMH1 | ThermoFisher Scientific | 412610 | |
| Dulbecco's Modified Eagle Medium/Nutrient Mixture (DMEM):F-12 | ThermoFisher Scientific | 11330-032 | |
| Dulbecco's Phosphate Buffered Saline (PBS) (1X) | Gibco | 14190-144 | |
| Ethylenediaminetetraacetic acid disodium salt solution (EDTA) | Sigma | E7889 | |
| Fetal Bovine Serum (FBS) | Fisher | SH3007003E | |
| Hanks' Balanced Salt Solution (HBSS) | ThermoFisher Scientific | 14175-079 | |
| HEPES | Sigma | H3375 | |
| hESC-qualified Matrigel | Corning | 354277 | |
| Mouse IgG1kappa isotype control, APC-conjugated | Biolegend | 400122 | |
| Mouse monoclonal anti-human CD271/NGFR, APC-conjugated | Biolegend | 345108 | |
| PneumaCult-ALI Medium (ALI Differentiation Medium) | StemCell Technologies | 05001 | |
| PneumaCult-Ex Plus Medium (Basal Cell Base Medium) | StemCell Technologies | 05040 | |
| Primocin | InvivoGen | ant-pm-2 | |
| rhLaminin-521 | ThermoFisher Scientific | A29248 | Final Concentration: 10ug/mL |
| Trypsin-EDTA Solution, 0.05% | Invitrogen | T3924 | |
| Y-27632 | Tocris | 1254 |
참고문헌
- GBD Chronic Respiratory Disease Collaborators. Prevalence and attributable health burden of chronic respiratory diseases, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. The Lancet. Respiratory Medicine. 8 (6), 585-596 (2020).
- Alysandratos, K. -. D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Medicine. 107, 183-206 (2005).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Takahashi, K., et al. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131 (5), 861-872 (2007).
- Berical, A., Lee, R. E., Randell, S. H., Hawkins, F. Challenges facing airway epithelial cell-based therapy for cystic fibrosis. Frontiers in Pharmacology. 10, 74 (2019).
- Jacob, A., et al. Derivation of self-renewing lung alveolar epithelial type II cells from human pluripotent stem cells. Nature Protocols. 14 (12), 3303-3332 (2019).
- Gotoh, S., et al. Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Reports. 3 (3), 394-403 (2014).
- Huang, S. X. L., et al. Efficient generation of lung and airway epithelial cells from human pluripotent stem cells. Nature Biotechnology. 32 (1), 84-91 (2013).
- Mou, H., et al. Generation of multipotent lung and airway progenitors from mouse ESCs and patient-specific cystic fibrosis iPSCs. Cell Stem Cell. 10 (4), 385-397 (2012).
- Hawkins, F. J., et al. Derivation of airway basal stem cells from human pluripotent stem cells. Cell Stem Cell. 28 (1), 79-95 (2021).
- Suzuki, S., et al. Differentiation of human pluripotent stem cells into functional airway basal stem cells. STAR Protocols. 2 (3), 100683 (2021).
- Rock, J. R., et al. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12771-12775 (2009).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유