Method Article
Generazione di colture di interfaccia aria-liquido di cellule epiteliali delle vie aeree da cellule staminali pluripotenti umane
In questo articolo
Riepilogo
I recenti progressi nei protocolli di differenziazione delle cellule staminali pluripotenti indotte dall'uomo consentono la derivazione graduale di tipi di cellule specifiche per organo. Qui, forniamo passaggi dettagliati per il mantenimento e l'espansione delle cellule basali delle vie aeree derivate da iPSC e la loro differenziazione in un epitelio mucociliare in colture di interfaccia aria-liquido.
Abstract
Le malattie delle vie aeree conduttrici come l'asma, la fibrosi cistica (FC), la discinesia ciliare primaria (PCD) e le infezioni respiratorie virali sono le principali cause di morbilità e mortalità in tutto il mondo. Le piattaforme in vitro che utilizzano cellule epiteliali bronchiali umane (HBEC) sono state strumentali alla nostra comprensione dell'epitelio delle vie aeree in salute e malattia. L'accesso alle HBEC da parte di individui con malattie genetiche rare o mutazioni rare è un collo di bottiglia nella ricerca polmonare.
Le cellule staminali pluripotenti indotte (iPSC) sono facilmente generate dalla "riprogrammazione" delle cellule somatiche e conservano il background genetico unico del singolo donatore. I recenti progressi consentono la differenziazione diretta delle iPSC in cellule progenitrici epiteliali polmonari, cellule alveolari di tipo 2, nonché cellule dell'epitelio delle vie aeree conduttori attraverso le cellule basali, le principali cellule staminali delle vie aeree.
Qui delineiamo un protocollo per il mantenimento e l'espansione delle cellule basali delle vie aeree derivate da iPSC (di seguito iBC) e la loro differenziazione del trilineaggio in colture di interfaccia aria-liquido (ALI). Le iBC sono mantenute ed espanse come sfere epiteliali sospese in goccioline di matrice extracellulare coltivate in un mezzo cellulare basale primario integrato con inibitori delle vie di segnalazione TGF-ß e BMP. Gli iBC all'interno di queste sfere epiteliali esprimono i marcatori basali chiave TP63 e NGFR, possono essere purificati mediante selezione cellulare attivata a fluorescenza (FACS) e, quando placcati su membrane porose in condizioni di coltura ALI standard, differenziarsi in un epitelio funzionale delle vie aeree. Le colture ali derivate da donatori sani sono composte da cellule basali, secretorie e multiciliate e dimostrano l'integrità della barriera epiteliale, le ciglia mobili e la secrezione di muco. Le colture derivate da individui con CF o PCD ricapitolano il trasporto disfunzionale di cloruro mediato da CFTR o le ciglia immotili, i rispettivi difetti epiteliali che causano la malattia.
Qui, presentiamo un protocollo per la generazione di cellule umane che può essere applicato per modellare e comprendere le malattie delle vie aeree.
Introduzione
Le malattie polmonari croniche rappresentano un grande carico di morbilità e mortalità in tutto il mondo1. Le condizioni che colpiscono le vie aeree conduttrici, come l'asma, la fibrosi cistica (FC), la discinesia ciliare primaria (PCD) e le infezioni virali rappresentano malattie sia comuni che più rare, acquisite e genetiche, che contribuiscono a questo onere mondiale. Le principali funzioni delle vie aeree conduttrici sono: 1) fungere da condotto per il flusso laminare d'aria e 2) fornire la clearance mucociliare di agenti patogeni e detriti. Le cellule secretorie, multiciliate e basali rappresentano i principali tipi di cellule epiteliali delle vie aeree conduttrici. I tipi di cellule epiteliali più rari includono ionociti, cellule del ciuffo e cellule neuroendocrine e sono stati esaminati altrove2.
In generale, uno dei principali ostacoli alla comprensione dei meccanismi della malattia e all'avanzamento degli approcci terapeutici è stata la costante mancanza di tessuto primario umano per l'uso in modelli preclinici. Gli HBEC sono generalmente considerati il modello in vitro gold standard della biologia epiteliale delle vie aeree umane e hanno svolto ruoli chiave nella ricerca sulla FC in particolare3. Tuttavia, sono tipicamente isolati da biopsie broncoscopie, da tessuto polmonare dopo l'intervento chirurgico o da polmoni respinti a scopo di trapianto. L'accesso alle HBEC da parte di individui con malattie genetiche, comprese le priorità di ricerca di CF e PCD, è raro e imprevedibile. È necessario superare questo collo di bottiglia per le cellule epiteliali delle vie aeree derivate dal paziente. Le iPSC sono facilmente generate da qualsiasi individuo, mantengono il background genetico unico del donatore e hanno una notevole capacità di proliferare e sopravvivere a lungo termine in condizioni di coltura cellulare 4,5,6. Ricapitolando i passaggi embriologici chiave, le iPSC subiscono una "differenziazione diretta" in tipi di cellule specifiche per organo. Noi e altri abbiamo sviluppato protocolli per generare progenitori polmonari derivati da iPSC, cellule alveolari di tipo 2 7,8 e cellule delle vie aeree conduttrici comprese le cellule basali delle vie aeree 9,10,11,12.
La cellula basale delle vie aeree è la cellula staminale delle vie aeree conduttrici13. In un lavoro pubblicato in precedenza, il nostro gruppo ha generato cellule epiteliali delle vie aeree derivate da iPSC, tra cui un sottoinsieme (iBC) che esprime marcatori di cellule basali canoniche tra cui TP63, KRT5 e NGFR. Seguendo i segnali della biologia delle cellule basali adulte, l'inibizione delle doppie vie SMAD (TGF-β e BMP) porta all'upregulation di NGFR+ iBC11,14. Gli iBC NGFR+ vengono risospesi come singole cellule in goccioline di matrice extracellulare e coltivate in un mezzo cellulare basale. Si auto-rinnovano per mantenere una popolazione di iBC e formare sferoidi epiteliali; tuttavia, una proporzione si differenzia anche in cellule secretorie in questo formato (indicato come coltura 3D). Nel seguente protocollo, descriviamo in dettaglio i passaggi per mantenere ed espandere questi iBC in coltura 3D, nonché i passaggi necessari per generare una cultura ALI mucociliare 2D funzionale.
I primi passi di questo protocollo di differenziazione sono stati pubblicati in precedenza e non saranno esaminati qui11,12. Questo manoscritto sarà incentrato sull'espansione e la purificazione degli iBC e la loro successiva differenziazione in cellule secretorie funzionali e multiciliate in coltura ALI.
Protocollo
Ciascuno dei seguenti passaggi deve essere eseguito utilizzando una tecnica sterile in una cappa a flusso laminare di livello di biosicurezza 2. Tutti i fluidi devono essere riscaldati a temperatura ambiente (22 °C) prima di essere aggiunti alle celle, salvo quando espressamente indicato diversamente. Ogni fase di centrifugazione deve essere eseguita a temperatura ambiente (circa 22 °C). Nella Figura 1 vengono illustrati gli schemi del protocollo.
1. Preparazione dei supporti richiesti
NOTA: vedere il file supplementare 1 per i dettagli.
- Mezzo cellulare basale
- Preparare il supporto di base secondo le istruzioni del produttore.
- Per ogni 50 mL del mezzo di base, aggiungere 5 μL di A83-01 (10 mM), 5 μL di DMH1 (10 mM), 50 μL di Y-27632 (10mM) e 100 μL di Primocin (50 mg/mL). Di seguito, questo mezzo è chiamato mezzo cellulare basale.
- Conservare a 4 °C per un massimo di 1 mese.
- Mezzo di differenziazione ALI
- Preparare il mezzo secondo le istruzioni del produttore.
- Ad ogni 50 mL di mezzo di differenziazione ALI, aggiungere 100 μL di Primocin (50 mg/mL).
- Conservare al riparo dalla luce a 4 °C per un massimo di 1 mese.
- Buffer di ordinamento
- Per ogni 50 mL di Sort Buffer, combinare 47,5 mL di soluzione salina bilanciata di Hanks, 1 mL di FBS, 200 μL di EDTA (500 mM), 1,25 mL di HEPES Buffer (1 M), 50 μL di Y-27632 (10 mM) e 100 μL di Primocin (50 mg/mL).
- Filtrare sterilizzare utilizzando una dimensione dei pori di 0,4 μm.
- Conservare a 4 °C per un massimo di 1 mese.
- Crioconservazione Media
- Per ogni 50 mL di mezzo di crioconservazione, combinare 45 mL di mezzo cellulare basale e 5 mL di dimetilsolfossido (DMSO).
- Filtrare sterilizzare utilizzando una dimensione dei pori di 0,4 μm.
- Conservare a 4 °C per un massimo di 1 mese.
2. Scongelamento di iBC crioconservati
- Scongelare (su ghiaccio) un volume sufficiente di fattore di crescita 3D ha ridotto la matrice extracellulare (di seguito matrice 3D). Tenere sul ghiaccio fino al momento dell'uso.
NOTA: Quando si scongela un flaconcino (contenente 250.000 cellule), scongelare 100-200 μL di matrice 3D. - Scongelare un flaconcino di sospensioni unicellulari di iBC precedentemente crioconservate incubando in un bagno di acqua o perline a 37 °C solo fino a quando non vi è alcun mezzo congelato visibile (1-2 min).
- Utilizzando una pipetta sierologica da 5 ml, aggiungere la sospensione cellulare a un tubo conico da 15 ml.
- Aggiungere 6-10 mL di DMEM/F12 a goccia alla sospensione cellulare, mescolare delicatamente e centrifugare a 300 x g per 5 minuti per pellettizzare le celle.
- Aspirare il surnatante e risospescere il pellet cellulare in 1 mL di basal cell medium con una micropipetta P1000. Rimuovere un'aliquota di 10 μL ed eseguire un conteggio delle cellule.
- Centrifugare le celle a 300 x g per 5 min. Aspirare il surnatante e risospese le cellule ad una densità di 4.000 cellule/μL in matrice 3D precedentemente scongelata con una micropipetta P1000.
NOTA: è fondamentale evitare di aggiungere bolle alla matrice 3D. Pipettare la matrice lentamente e con attenzione. - Con una micropipetta P200, aggiungere una goccia (25 o 50 μL) alla base di ciascun pozzetto di una piastra trattata con coltura tissutale a 12 pozzetti. Se si inizia con 250.000 cellule congelate, il numero previsto di goccioline in questa fase è compreso tra 3-4 (25 μL di goccioline), a seconda della vitalità cellulare.
- Incubare la piastra a 37 °C per circa 15 minuti, quindi aggiungere abbastanza basale medium a ciascun pozzetto per immergere completamente la goccia (1,5 mL per 50 μL; 1 mL per 25 μL), usando una pipetta sierologica da 5 mL. Riportare la piastra in un incubatore umidificato.
- Nutrire le cellule ogni 2 giorni usando il mezzo cellulare basale fresco. Aggiungere il mezzo fresco sul lato del pozzo con una pipetta sierologica da 5 ml, facendo attenzione a non disturbare la goccia di cellule.
NOTA: La densità delle cellule placcate in questa fase è 10 volte superiore al passaggio di routine degli iBC nella sezione 3.
3. Dissociazione degli sferoidi ed espansione degli iBC in coltura 3D
- Scongelare (su ghiaccio) un volume sufficiente di matrice 3D. Tenere sul ghiaccio fino al momento dell'uso.
NOTA: il volume della matrice 3D richiesta varia in base al numero di celle richieste dall'utente. - Circa 5-7 giorni dopo, aspirare il mezzo da ciascun pozzetto e con una micropipetta P1000, aggiungere 1 mL di Dispase II (1 U/mL) direttamente sugli sferoidi per dissociarsi dalla goccia della matrice.
- Posizionare la piastra in un'incubatrice a 37 °C per 10-15 minuti.
- Utilizzando una micropipetta P1000, pipettare il Dispase su e giù 1-2 volte, rompendo grandi grumi di matrice 3D. Riportare la piastra a 37 °C per altri 30-40 minuti, permettendo alla matrice di dissolversi completamente.
- Quando la goccia di matrice 3D non è più visibile al microscopio ottico, aggiungere gli sferoidi liberamente fluttuanti a una conica da 15 ml utilizzando una punta della pipetta sierologica da 5 ml. Aggiungere DMEM/F12 per un volume finale di 10 ml per conica e centrifuga a 200 x g per 3 minuti per pellettizzare gli sferoidi.
- Aspirare il surnatante e aggiungere 1 mL di tripsina allo 0,05% (37 °C) per ogni goccia iniziale dissociata (ad esempio, se si inizia con quattro goccioline, aggiungere 4 ml di tripsina al matraccio conico).
- Incubare a 37 °C, triturando frequentemente (ogni 2-3 min).
- Valutare con il microscopio ottico ogni pochi minuti. Una volta che la maggior parte (>90%) degli sferoidi sono stati dissociati a singole cellule, aggiungere il 10% di siero bovino fetale (in DMEM / F12) con un rapporto di volume 1: 1 alla tripsina.
- Filtrare le cellule attraverso un filtro cellulare da 40 μm e centrifugare a 300 x g per 5 min.
- Eseguire un conteggio delle cellule e risospese uniformemente le cellule ad una densità di 400 celle / μL di matrice 3D scongelata. Evitare di introdurre bolle d'aria. Risospesciare tutte le goccioline necessarie per l'applicazione a valle. Ripetere i passaggi 2.6-2.9 per ogni pozzetto.
4. Valutazione e purificazione di iBC NGFR+
- Dopo 10-14 giorni dal passaggio più recente, dissociare gli sferoidi in una sospensione a singola cellula come nei passaggi 3.2-3.5 ed eseguire un conteggio cellulare.
NOTA: linee iPSC diverse si comportano in modo diverso; pertanto, l'intervallo di 10-14 giorni può variare per diversi iBC. Fare riferimento alla Figura 2 per le apparizioni tipiche degli iBC 3D dopo 1, 4, 8 e 14 giorni, quando sono adeguate per l'ordinamento delle cellule NGFR+. L'ordinamento prima di quanto raccomandato (ad esempio, il giorno 8 come nella Figura 2C), si traduce in un numero complessivo di cellule inferiore con un'espressione NGFR meno frequente. L'ordinamento più tardi di quanto raccomandato (ad esempio, più di 14 giorni dopo il passaggio più recente) porta a una scarsa sopravvivenza cellulare post-ordinamento. - Risospesso le celle ad una densità di 1 x 106 celle/100 μL in Sort Buffer (popolazione principale). Trasferire una piccola aliquota (25-50 μL) in un tubo separato (popolazione minore).
- Aggiungere l'anticorpo anti-NGFR coniugato (diluizione 1:100) alla popolazione cellulare principale.
- Aggiungere l'anticorpo di controllo dell'isotipo (diluizione 1:200) alla popolazione cellulare minore.
- Proteggere le cellule dalla luce e tenere sul ghiaccio per 30 minuti, a intermittenza (ogni 5-10 min) triturando le celle per evitare la pellettizzazione.
- Dopo 30 minuti, aggiungere il buffer di ordinamento in un rapporto 1:1 a ciascun tubo di celle. Centrifugare le celle a 300 x g per 5 min.
- Aspirare il surnatante, risospesciare le celle pellettate nel Sort Buffer ad una densità di 10 x 106 celle/ml e aggiungere macchie di cellule vive o morte.
- Utilizzando un'appropriata strategia di gating NGFR+ (basata sul controllo dell'isotipo, vedere la Figura 3), ordinare abbastanza celle NGFR+ vive per le necessarie applicazioni a valle.
NOTA: Se si utilizzano iBC con reporter fluorescenti (ad esempio, NKX2-1GFP TP63tdTomato), si consiglia di ordinare per celle "triple positive" (ad esempio, NKX2-1GFP +, TP63tdTomato +, NGFR +), con selezione e compensazione del gate appropriate (Figura 3). Durante questa espansione di iBC, una percentuale di cellule si differenzia in cellule secretorie e può anche essere rilevata una percentuale molto piccola di cellule multiciliate. Entrambe queste popolazioni sono NGFR-.
5. Generazione di colture ALI mucociliarie
- Preparare inserti di membrana porosa da 6,5 mm aggiungendo una matrice da 200 μL alla camera apicale (matrice qualificata con cellule staminali embrionali umane o laminina umana ricombinante-521) secondo le istruzioni del produttore.
- Porre a 37 °C per almeno 2 ore prima del necessario.
- Aspirare la matrice di rivestimento dalla camera apicale dell'inserto. Aggiungere 500 μL del mezzo cellulare basale alla camera basolaterale.
- Sospendere almeno 30.000 cellule NGFR+ selezionate (dal passo 4.5) in 100-200 μL basal cell medium e trasferirle nella camera apicale utilizzando una micropipetta P200. Ripetere l'operazione per tutti i pozzetti desiderati (e le celle disponibili). Posizionare la piastra in un incubatore umidificato a 37 °C.
- In 2-3 giorni, aspirare le camere apicali e basolaterali e alimentare con mezzo cellulare basale fresco (da 500 μL a apicale, da 100 μL a basolaterale).
- Monitorare quotidianamente la camera apicale con la microscopia ottica. Quando le cellule sono >80% confluenti (in genere 3-7 giorni), sostituire il mezzo cellulare basale con il mezzo di differenziazione ALI (non preriscaldato) in entrambe le camere apicali e basolaterali. Quando si lavora con ALI Differentiation Medium, proteggere dalla luce mantenendo i contenitori dei supporti avvolti in un foglio e spegnendo le luci a soffitto quando possibile.
- Il giorno dopo, aspirare il mezzo dalla camera apicale, esponendo così la superficie apicale all'aria.
- Sostituire il mezzo di differenziazione ALI nella camera basolaterale ogni 2-3 giorni.
- Monitorare l'aspetto della coltura ogni 1-2 giorni. Aspirare accuratamente qualsiasi liquido accumulato dalla camera apicale, senza disturbare lo strato cellulare.
- Valutare la resistenza elettrica transepiteliale (TEER) per l'integrità epiteliale.
NOTA: TEER può essere valutato nei giorni successivi all'esposizione all'aria per dare una lettura dell'integrità dello strato epiteliale. Il tempo ideale per misurare TEER non è stato stabilito, anche se i valori coerenti con la differenziazione mucociliare di alta qualità sono in genere >500 x cm2. - Se è necessario rimuovere detriti o muco, aggiungere delicatamente 100 μL PBS (senza Ca2+ o Mg2+) alla camera apicale. Incubare a 37 °C per 10 minuti, quindi aspirare accuratamente PBS.
- Dopo 7-10 giorni di esposizione all'aria, le ciglia mobili appaiono tipicamente e possono essere viste usando la microscopia ottica. A seconda dell'esperimento pianificato e della lettura, le cellule possono essere analizzate dopo 14-28 giorni di esposizione all'aria.
NOTA: se sono state utilizzate cellule reporter fluorescenti e se è disponibile un microscopio fluorescente a cellule vive, le cellule possono essere tracciate con microscopia ottica e fluorescenza reporter.
6. Crioconservazione facoltativa (ma consigliata) di iBC
- Dopo 10-14 giorni dall'ultimo passaggio della coltura 3D, dissociare gli sferoidi in sospensione unicellulare come nei passaggi 3.2-3.5. Eseguire un conteggio delle celle.
- Risospendo in mezzo di crioconservazione ad una densità di 250.000 cellule/500 μL in una crioviale.
- Posizionare i crioviali in un contenitore per garantire un calo costante della temperatura (1 °C/min) e trasferirli a -80 °C per 24-48 ore, seguiti da trasferimento a -150 °C per la conservazione a lungo termine.
NOTA: Sono state eseguite la crioconservazione ripetuta e la crioconservazione di cellule precedentemente selezionate con NGFR+, ma queste non sono state adeguatamente valutate per la vitalità cellulare e la capacità di formare colture ALI funzionali. Soprattutto con il passaggio cellulare esteso, si raccomanda di valutare il cariotipo in quanto è stato notato che questo varia nelle iPSC e nelle cellule derivate da iPSC.
Risultati
Seguendo questo protocollo, 200.000 iBC crioconservati (precedentemente confermati per avere un normale cariotipo 46XY)11 sono stati scongelati ed espansi in coltura 3D. Cinque giorni dopo, gli sferoidi risultanti furono dissociati, contati e passati di nuovo per un'ulteriore espansione. Circa 480.000 cellule sono state ottenute e ri-sospese in matrice 3D (12 x 50 μL di goccioline, densità 400 cellule/μL). Fresh Basal Cell Medium è stato applicato ogni 2-3 giorni. Dieci giorni dopo, le cellule sono state ancora una volta dissociate e contate. Un totale di 19,7 x 106 cellule sono state raccolte e preparate per FACS. 106 cellule sono state colorate con il controllo dell'isotipo IgG1κ coniugato con APC e le restanti 18,7 x 106 cellule sono state colorate con l'anticorpo anti-NGFR coniugato APC per 30 minuti al riparo dalla luce (Figura 3).
Il gating NGFR+ è stato eseguito dopo il confronto con le cellule di controllo dell'isotipo ed è stato impostato appositamente per raccogliere le cellule NGFR+ a più alta espressione (Figura 3). Con questa tecnica di gating, il 28% delle cellule singole vive erano NGFR+. Mentre erano disponibili più cellule, 750.000 cellule sono state raccolte per la coltura a valle. Le cellule selezionate sono state risospese in Basal Cell Medium ad una concentrazione di 50.000 cellule / 100 μL. 50.000 cellule sono state poi seminate su ogni inserto di membrana porosa da 6,5 mm, che era stato rivestito con laminina-521 ricombinante umana (2 μg / 200 μL) secondo le linee guida del produttore. Il mezzo cellulare basale da 500 μL è stato aggiunto alla camera basolaterale di ciascun inserto e la piastra è stata collocata in un incubatore umidificato a 37 °C. Tre giorni dopo, i mezzi nella camera apicale sono stati aspirati e le cellule erano confluenti al 90% con la microscopia ottica (Figura 4B). I media della camera basolaterale sono stati aspirati; Il mezzo di differenziazione ALI è stato aggiunto alle camere apicale (100 μL) e basolaterale (500 μL). Il giorno dopo, i media dalla camera apicale sono stati aspirati.
Nei successivi 21 giorni, le cellule sono state valutate periodicamente al microscopio ottico e alimentate con un nuovo mezzo di differenziazione ALI (solo camera basolaterale) ogni 2-3 giorni. Le singole cellule erano inizialmente facilmente identificabili (Figura 4A), avevano un aspetto allungato e a forma di fuso e formavano un monostrato vagamente imballato (Figura 4B). Nei giorni successivi alle settimane, le cellule formarono uno strato epiteliale strettamente imballato, altamente cellulare, e dopo 7-10 giorni ci fu la chiara comparsa della produzione di ciglia e muco. Il TEER dei campioni è stato calcolato e simile ai controlli cellulari primari (intervallo da 700-1600 Ω x cm2)11. La successiva fissazione (giorno 21-28) con paraformaldeide e immunolabeling per i marcatori delle cellule epiteliali canoniche delle vie aeree è stata eseguita per MUC5AC e acetilato-α-tubulina, tra gli altri (Figura 4C). Nel complesso, con la nostra osservazione delle ciglia mobili, della produzione di muco e dell'immunocolorazione di conferma delle cellule multiciliate e secretorie che è simile a quella delle HBEC primarie, abbiamo concluso che abbiamo generato con successo cellule epiteliali delle vie aeree da cellule staminali pluripotenti indotte.
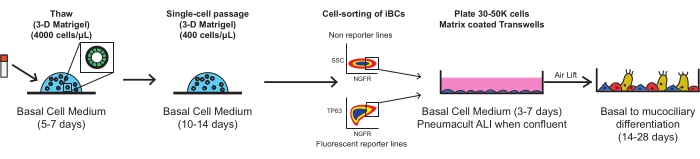
Figura 1: Schema generale del protocollo. Gli iBC crioconservati vengono scongelati, espansi e purificati FACS prima della placcatura su inserti di membrana porosa, dove si differenziano in un epitelio mucociliare funzionale. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Immagini rappresentative a contrasto di fase. Immagini rappresentative di contrasto di fase che dimostrano l'aspetto abituale di iBC in coltura 3D dopo (A) 1 giorno, (B) 4 giorni, (C) 8 giorni e (D) 14 giorni (solo tipo pre-NGFR). Le barre di scala rappresentano 500 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
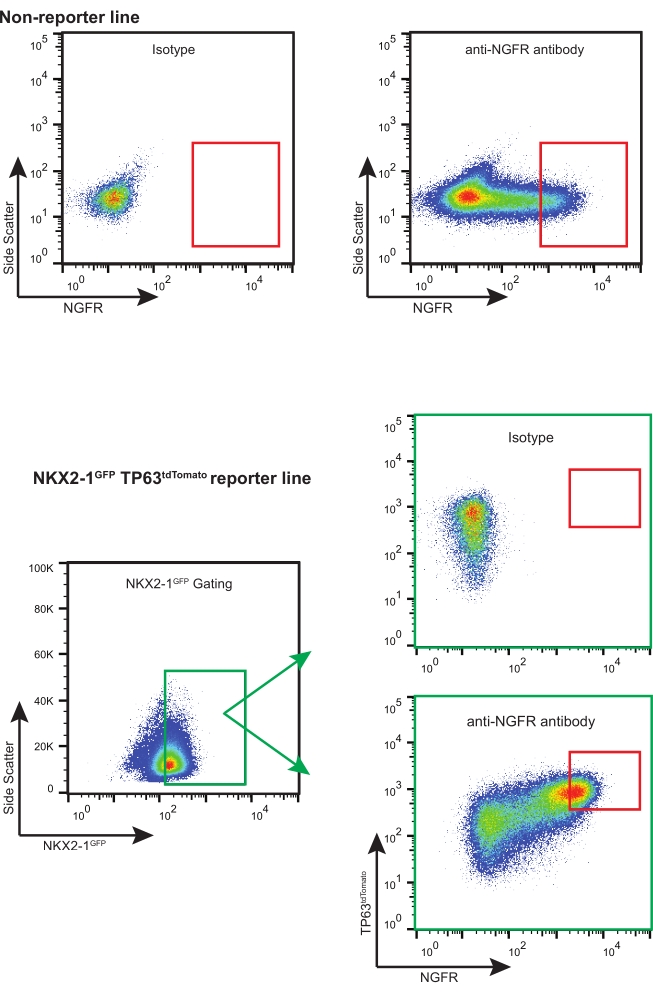
Figura 3: Grafici FACS rappresentativi. Grafici FACS rappresentativi per iBC non reporter e fluorescenti-reporter. Vengono mostrati esempi di controlli isotipici che sono stati utilizzati per selezionare le cellule NGFR+ più espressive. Le linee iPSC contenenti reporter fluorescenti sono "triple sorted" per le cellule NKX2-1GFP+ TP63tdTomato+ NGFR+. Fare clic qui per visualizzare una versione più grande di questa figura.
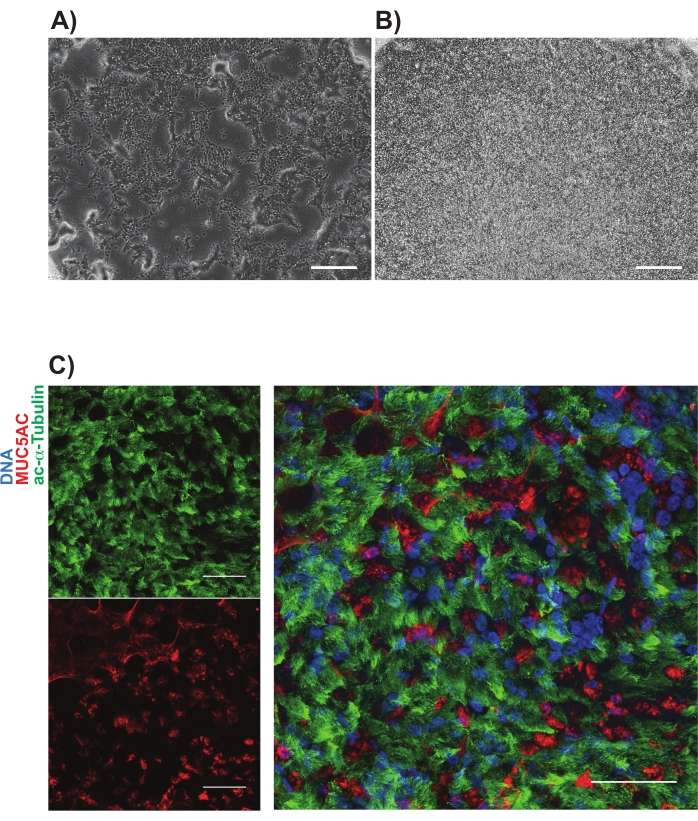
Figura 4: Immagini rappresentative di colture iBC su membrane porose. Le immagini a contrasto di fase vengono mostrate (A) 1 giorno e (B) 3 giorni dopo la placcatura. Immunolabeling rappresentativo di colture mucociliarie di cui alla (C); tubulina alfa acetilata (verde) e MUC5AC (rosso). Le barre di scala rappresentano 25 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
File supplementare 1: Tabella dei componenti multimediali. Fare clic qui per scaricare questo file.
Discussione
Gli HBEC sono il tipo di cellula gold standard per studiare le malattie dell'epitelio delle vie aeree. A causa delle loro limitazioni (tra cui l'accessibilità e la difficoltà di manipolare geneticamente), abbiamo generato un protocollo per la derivazione di iBC e colture ALI. Queste cellule possono essere derivate da qualsiasi donatore e mantenere il loro background genetico unico, consentendo così studi di sviluppo di base, modelli di malattia e nuovo sviluppo terapeutico.
Mentre ogni singolo passaggio del protocollo descritto è necessario, ce ne sono diversi che meritano una menzione extra. In primo luogo, in ogni fase che richiede la dissociazione degli sferoidi in singole cellule, è fondamentale evitare un pipettaggio eccessivo; la digestione enzimatica (con dispasi o tripsina) favorisce una migliore sopravvivenza cellulare, mentre un eccessivo pipettaggio porta a una significativa morte cellulare. In secondo luogo, quando si purificano gli iBC NGFR+, l'utilizzo del controllo dell'isotipo è cruciale e si consiglia di selezionare le celle NGFR+ con FACS (Figura 3). Questo approccio si traduce in colture ALI ottimali con un'appropriata differenziazione mucociliare. Infine, la preparazione e la semina di membrane porose proprio come documentato nel protocollo è fondamentale per la sopravvivenza della coltura ALI. Mentre in genere seminiamo 30.000-60.000 cellule per inserto, abbiamo avuto successo con un minimo di 20.000 cellule. Mentre le colture di successo possono essere generate utilizzando il rivestimento a matrice qualificato con cellule staminali embrionali umane, più recentemente abbiamo utilizzato laminina-521 ricombinante umana con una durata significativamente più elevata delle colture ALI.
Molto raramente, le differenziazioni iPSC possono non riuscire a sovraregolare una percentuale adeguata di iBC NGFR+. In questo caso, il passaggio seriale di iBC (in coltura 3D) può comportare un aumento della frequenza NGFR nel tempo. I limiti di questo protocollo includono il tempo, i costi e le competenze necessarie per generare queste celle. Inoltre, riconosciamo che molti ricercatori sono interessati ai tipi di cellule meno comuni dell'epitelio delle vie aeree (ad esempio, ionociti, cellule neuroendocrine). Mentre abbiamo rilevato alcuni di questi tipi di cellule più rare, come nelle colture primarie di HBEC, non sono identificati in modo riproducibile, probabilmente a causa di conoscenze incomplete riguardanti i segnali di sviluppo necessari per generare queste cellule.
Come è scritto, il protocollo di cui sopra inizia con lo scongelamento di iBC già crioconservati. I dettagli precedenti a questa crioconservazione sono descritti in precedenza e al di là dello scopo di questo manoscritto11,12.
Il nostro metodo di coltura ALI epiteliale delle vie aeree consente la generazione di cellule epiteliali funzionali delle vie aeree da quasi tutti i donatori. Ciò aumenta notevolmente l'accessibilità a preziose cellule epiteliali delle vie aeree geneticamente controllate che possono essere utilizzate per la modellazione delle malattie, lo screening farmacologico, le future terapie a base cellulare, nonché per migliorare la comprensione del modello di sviluppo all'interno dell'epitelio delle vie aeree.
Divulgazioni
Gli autori non hanno divulgazioni.
Riconoscimenti
Ringraziamo i membri dei laboratori di Hawkins, Kotton e Davis per il loro utile contributo nel corso degli anni riguardo a questo e ad altri progetti. Siamo anche in debito con Brian Tilton (BU Cell Sorting Director) per la sua dedizione e competenza tecnica, e siamo grati a Greg Miller e Marianne James del Boston University Center for Regenerative Medicine (CReM) per il loro supporto e competenza tecnica nel mantenimento e nella caratterizzazione di iPSC specifiche per il paziente, supportate dalle sovvenzioni NIH NO1 75N9202020C00005 e U01TR001810. Questo lavoro è stato supportato dalle sovvenzioni NIH U01HL148692, U01HL134745, U01HL134766 e R01HL095993 a D.N.K, R01HL139876 a B.R.D, R01 HL139799 a F.H., e Cystic Fibrosis Foundation (CFF) concede CFF 00987G220 e CFF WANG20GO a D.N.K, CFF DAVIS15XX1, DAVIS17XX0, DAVIS19XX0 a B.R.D, CFF SUZUKI19XX0 a S.S, CFF BERICA2010 ad A.B., e CFF HAWKIN20XX2 a F.H.
Materiali
| Name | Company | Catalog Number | Comments |
| 12-well tissue culture treated plate | Corning | 3515 | flat bottom |
| 3-D growth factor reduced Matrigel | Corning | 356230 | |
| A83-01 | ThermoFisher Scientific | 293910 | |
| Cell culture inserts (Transwell) | Corning | 3470 | 6.5mm diameter; 0.4μm pore size |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | |
| Dispase II, Powder | ThermoFisher Scientific | 17105-041 | |
| DMH1 | ThermoFisher Scientific | 412610 | |
| Dulbecco's Modified Eagle Medium/Nutrient Mixture (DMEM):F-12 | ThermoFisher Scientific | 11330-032 | |
| Dulbecco's Phosphate Buffered Saline (PBS) (1X) | Gibco | 14190-144 | |
| Ethylenediaminetetraacetic acid disodium salt solution (EDTA) | Sigma | E7889 | |
| Fetal Bovine Serum (FBS) | Fisher | SH3007003E | |
| Hanks' Balanced Salt Solution (HBSS) | ThermoFisher Scientific | 14175-079 | |
| HEPES | Sigma | H3375 | |
| hESC-qualified Matrigel | Corning | 354277 | |
| Mouse IgG1kappa isotype control, APC-conjugated | Biolegend | 400122 | |
| Mouse monoclonal anti-human CD271/NGFR, APC-conjugated | Biolegend | 345108 | |
| PneumaCult-ALI Medium (ALI Differentiation Medium) | StemCell Technologies | 05001 | |
| PneumaCult-Ex Plus Medium (Basal Cell Base Medium) | StemCell Technologies | 05040 | |
| Primocin | InvivoGen | ant-pm-2 | |
| rhLaminin-521 | ThermoFisher Scientific | A29248 | Final Concentration: 10ug/mL |
| Trypsin-EDTA Solution, 0.05% | Invitrogen | T3924 | |
| Y-27632 | Tocris | 1254 |
Riferimenti
- GBD Chronic Respiratory Disease Collaborators. Prevalence and attributable health burden of chronic respiratory diseases, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. The Lancet. Respiratory Medicine. 8 (6), 585-596 (2020).
- Alysandratos, K. -D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Medicine. 107, 183-206 (2005).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Takahashi, K., et al. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131 (5), 861-872 (2007).
- Berical, A., Lee, R. E., Randell, S. H., Hawkins, F. Challenges facing airway epithelial cell-based therapy for cystic fibrosis. Frontiers in Pharmacology. 10, 74(2019).
- Jacob, A., et al. Derivation of self-renewing lung alveolar epithelial type II cells from human pluripotent stem cells. Nature Protocols. 14 (12), 3303-3332 (2019).
- Gotoh, S., et al. Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Reports. 3 (3), 394-403 (2014).
- Huang, S. X. L., et al. Efficient generation of lung and airway epithelial cells from human pluripotent stem cells. Nature Biotechnology. 32 (1), 84-91 (2013).
- Mou, H., et al. Generation of multipotent lung and airway progenitors from mouse ESCs and patient-specific cystic fibrosis iPSCs. Cell Stem Cell. 10 (4), 385-397 (2012).
- Hawkins, F. J., et al. Derivation of airway basal stem cells from human pluripotent stem cells. Cell Stem Cell. 28 (1), 79-95 (2021).
- Suzuki, S., et al. Differentiation of human pluripotent stem cells into functional airway basal stem cells. STAR Protocols. 2 (3), 100683(2021).
- Rock, J. R., et al. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12771-12775 (2009).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon