Method Article
İnsan Pluripotent Kök Hücrelerinden Hava Yolu Epitel Hücresi Hava-Sıvı Arayüz Kültürlerinin Oluşturulması
Bu Makalede
Özet
İnsan kaynaklı pluripotent kök hücre farklılaşma protokollerindeki son gelişmeler, organa özgü hücre tiplerinin kademeli olarak türetilmesine izin vermektedir. Burada, iPSC türevi hava yolu bazal hücrelerinin bakımı ve genişlemesi ve hava-sıvı arayüz kültürlerinde mukosiliyer bir epitel halinde farklılaşması için ayrıntılı adımlar sunuyoruz.
Özet
Astım, kistik fibroz (KF), primer siliyer diskinezi (PKD) ve viral solunum yolu enfeksiyonları gibi iletken hava yolu hastalıkları tüm dünyada başlıca morbidite ve mortalite nedenlerindendir. İnsan bronşiyal epitel hücrelerini (HBEC'ler) kullanan in vitro platformlar, sağlık ve hastalıkta hava yolu epitelini anlamamızda etkili olmuştur. Nadir genetik hastalıkları veya nadir mutasyonları olan bireylerden HBEC'lere erişim, akciğer araştırmalarında bir darboğazdır.
İndüklenmiş pluripotent kök hücreler (iPSC'ler), somatik hücrelerin "yeniden programlanması" ile kolayca üretilir ve bireysel donörün benzersiz genetik arka planını korur. Son gelişmeler, iPSC'lerin akciğer epitelyal progenitör hücrelerine, alveoler tip 2 hücrelerine ve ayrıca ana hava yolu kök hücreleri olan bazal hücreler aracılığıyla iletken hava yolu epitelinin hücrelerine yönlendirilmiş farklılaşmasına izin vermektedir.
Burada, iPSC türevi hava yolu bazal hücrelerinin (bundan böyle iBC'ler) bakımı ve genişlemesi ile hava-sıvı arayüzü (ALI) kültürlerinde trilineaj farklılaşması için bir protokol özetlenmektedir. iBC'ler, TGF-ß ve BMP sinyal yollarının inhibitörleri ile desteklenmiş birincil bazal hücre ortamında kültürlenmiş hücre dışı matriks damlacıklarında asılı epitel küreleri olarak korunur ve genişletilir. Bu epitel küreleri içindeki iBC'ler anahtar bazal belirteçler TP63 ve NGFR'yi eksprese eder, floresan aktif hücre sıralama (FACS) ile saflaştırılabilir ve standart ALI kültür koşullarında gözenekli membranlar üzerine kaplandığında, fonksiyonel bir hava yolu epiteline farklılaşır. Sağlıklı donörlerden elde edilen ALI kültürleri bazal, sekretuar ve multisiliye hücrelerden oluşur ve epitel bariyer bütünlüğü, hareketli kirpikler ve mukus sekresyonu gösterir. KF veya PCD'li bireylerden türetilen kültürler, disfonksiyonel CFTR aracılı klorür taşınımını veya hareketsiz kirpikleri, ilgili hastalığa neden olan epitel kusurlarını özetler.
Burada, hava yolu hastalıklarının modellenmesi ve anlaşılması için uygulanabilecek insan hücrelerinin üretimi için bir protokol sunuyoruz.
Giriş
Kronik akciğer hastalıkları tüm dünyada büyük bir morbidite ve mortalite yükü oluşturmaktadır1. Astım, kistik fibroz (KF), primer siliyer diskinezi (PKD) ve viral enfeksiyonlar gibi iletken hava yollarını etkileyen durumlar, dünya çapındaki bu yüke katkıda bulunan edinsel ve genetik hem yaygın hem de daha nadir hastalıkları temsil etmektedir. İletken hava yollarının başlıca işlevleri şunlardır: 1) laminer hava akışı için bir kanal görevi görür ve 2) patojenlerin ve döküntülerin mukosiliyer temizlenmesini sağlar. Sekretuar, multisiliye ve bazal hücreler, iletken hava yolunun majör epitel hücre tiplerini temsil eder. Daha nadir görülen epitel hücre tipleri iyonositleri, tutam hücrelerini ve nöroendokrin hücreleri içerir ve başka yerlerde gözden geçirilmiştir2.
Genel olarak, hastalık mekanizmalarını anlamanın ve terapötik yaklaşımları ilerletmenin önündeki en büyük engel, klinik öncesi modellerde kullanım için insan birincil dokusunun tutarlı bir şekilde eksikliği olmuştur. HBEC'ler genellikle insan hava yolu epitel biyolojisinin altın standart in vitro modeli olarak kabul edilir ve özellikle3 CF araştırmasında kilit rol oynamıştır. Bununla birlikte, tipik olarak bronkoskopik biyopsilerden, ameliyattan sonra akciğer dokusundan veya transplantasyon amacıyla reddedilen akciğerlerden izole edilirler. KF ve PCD'nin araştırma öncelikleri de dahil olmak üzere genetik hastalıkları olan bireylerden HBEC'lere erişim nadir ve öngörülemezdir. Hasta kaynaklı hava yolu epitel hücrelerine yönelik bu darboğazın üstesinden gelmek gereklidir. iPSC'ler herhangi bir bireyden kolayca üretilir, donörün benzersiz genetik arka planını korurlar ve hücre kültürü koşullarında çoğalma ve uzun vadede hayatta kalma konusunda olağanüstü bir yeteneğe sahiptirler 4,5,6. Anahtar embriyolojik adımları özetleyerek, iPSC'ler organa özgü hücre tiplerine "yönlendirilmiş farklılaşmaya" uğrarlar. Biz ve diğerleri, iPSC türevi akciğer progenitörleri, alveoler tip 2 hücreleri 7,8 ve hava yolu bazal hücreleri9,10,11,12 dahil olmak üzere iletken hava yolunun hücrelerini üretmek için protokoller geliştirdik.
Hava yolu bazal hücresi, iletken hava yolu13'ün kök hücresidir. Daha önce yayınlanmış çalışmalarda, grubumuz TP63, KRT5 ve NGFR dahil olmak üzere kanonik bazal hücre belirteçlerini ifade eden bir alt küme (iBC'ler) dahil olmak üzere iPSC kaynaklı hava yolu epitel hücreleri üretti. Yetişkin bazal hücre biyolojisinden gelen ipuçlarını takiben, çift SMAD yolağının (TGF-β ve BMP) inhibisyonu NGFR + iBC'lerin11,14'ünün yukarı regülasyonuna yol açar. NGFR + iBC'ler, hücre dışı matriks damlacıklarında tek hücreler olarak yeniden askıya alınır ve bazal hücre ortamında kültürlenir. Bir iBC popülasyonunu korumak ve epitel sferoidleri oluşturmak için kendilerini yeniler; Bununla birlikte, bir oran da bu formatta salgı hücrelerine farklılaşır (3-D kültürü olarak adlandırılır). Aşağıdaki protokolde, bu iBC'leri 3-D kültüründe korumak ve genişletmek için gereken adımları ve fonksiyonel bir 2-D mukosiliyer ALI kültürü oluşturmak için gereken adımları detaylandırıyoruz.
Bu farklılaştırma protokolünün ilk adımları daha önce yayınlanmıştır ve burada gözden geçirilmeyecektir11,12. Bu makale, iBC'lerin genişlemesi ve saflaştırılması ve daha sonra ALI kültüründe fonksiyonel sekretuar ve multisiliye hücrelere farklılaşması üzerine odaklanacaktır.
Protokol
Aşağıdaki adımların her biri, biyogüvenlik seviye 2 laminer akış başlığında steril teknik kullanılarak gerçekleştirilmelidir. Tüm ortamlar, özellikle aksi belirtilmedikçe, hücrelere eklenmeden önce oda sıcaklığına (22 ° C) ısıtılmalıdır. Her santrifüjleme adımı oda sıcaklığında (yaklaşık 22 °C) gerçekleştirilmelidir. Şekil 1 , protokolün şemalarını özetlemektedir.
1. Gerekli ortamların hazırlanması
NOT: Ayrıntılar için Ek Dosya 1'e bakın.
- Bazal Hücre Ortamı
- Baz ortamını üreticinin talimatlarına göre hazırlayın.
- Baz ortamın her 50 mL'sine 5 μL A83-01 (10 mM), 5 μL DMH1 (10 mM), 50 μL Y-27632 (10mM) ve 100 μL Primosin (50 mg / mL) ekleyin. Bundan böyle bu ortam bazal hücre ortamı olarak adlandırılacaktır.
- 4 °C'de 1 aya kadar saklayın.
- ALI Farklılaşma Ortamı
- Ortamı üreticinin talimatlarına göre hazırlayın.
- Her 50 mL'lik ALI Farklılaşma Ortamına 100 μL Primosin (50 mg / mL) ekleyin.
- 1 aya kadar 4 °C'de ışıktan korunarak saklayın.
- Arabelleği Sırala
- Her 50 mL Sıralama Tamponu için, 47,5 mL Hanks Dengeli Tuz Çözeltisi, 1 mL FBS, 200 μL EDTA (500 mM), 1,25 mL HEPES Tamponu (1 M), 50 μL Y-27632 (10 mM) ve 100 μL Primosin (50 mg/mL) birleştirin.
- 0,4 μm gözenek boyutu kullanarak filtre sterilizasyonu.
- 4 °C'de 1 aya kadar saklayın.
- Kriyoprezervasyon Ortamı
- Her 50 mL Kriyoprezervasyon Ortamı için, 45 mL Bazal Hücre Ortamı ve 5 mL dimetil sülfoksit (DMSO) birleştirin.
- 0,4 μm gözenek boyutu kullanarak filtre sterilizasyonu.
- 4 °C'de 1 aya kadar saklayın.
2. Kriyokorunmuş iBC'lerin çözülmesi
- Yeterli hacimde 3-D büyüme faktörü hücre dışı matrisi (bundan böyle 3-D matris olarak anılacaktır) çözdürmek (buz üzerinde). Kullanıma hazır olana kadar buz üzerinde tutun.
NOT: Bir şişeyi çözerken (250.000 hücre içeren), 100-200 μL 3-D matrisi çözün. - iBC'lerin daha önce kriyokorunmuş tek hücreli süspansiyonlarından oluşan bir şişeyi, görünür donmuş ortam kalmayana kadar (1-2 dakika) 37 ° C'lik bir su veya boncuk banyosunda inkübe ederek çözün.
- 5 mL'lik bir serolojik pipet kullanarak, 15 mL'lik bir konik tüpe hücre süspansiyonu ekleyin.
- Hücre süspansiyonuna damla damla 6-10 mL DMEM / F12 ekleyin, hafifçe karıştırın ve hücreleri peletlemek için 5 dakika boyunca 300 x g'de santrifüj yapın.
- Süpernatantı aspire edin ve hücre peletini bir P1000 mikropipet ile 1 mL Bazal Hücre Ortamında yeniden askıya alın. 10 μL'lik bir aliquot'u çıkarın ve bir hücre sayımı gerçekleştirin.
- Hücreleri 5 dakika boyunca 300 x g'de santrifüj yapın. Süpernatantı aspire edin ve hücreleri bir P1000 mikropipet ile daha önce çözülmüş 3-D matriste 4.000 hücre / μL yoğunluğunda yeniden askıya alın.
NOT: 3B matrise kabarcık eklemekten kaçınmak çok önemlidir. Matrisi yavaşça ve dikkatlice pipetleyin. - Bir P200 mikropipet ile, 12 delikli doku kültürü ile muamele edilmiş bir plakanın her bir kuyucuğunun tabanına bir damlacık (25 veya 50 μL) ekleyin. 250.000 dondurulmuş hücreyle başlıyorsa, bu adımda beklenen damlacık sayısı, hücre canlılığına bağlı olarak 3-4 (25 μL damlacık) arasındadır.
- Plakayı yaklaşık 15 dakika boyunca 37 ° C'de inkübe edin ve ardından 5 mL'lik bir serolojik pipet kullanarak damlacığı tamamen batırmak için her bir kuyucuğa yeterli Bazal Hücre Ortamı ekleyin (50 μL için 1,5 mL; 25 μL için 1 mL). Plakayı nemlendirilmiş bir inkübatöre geri koyun.
- Taze Bazal Hücre Ortamı kullanarak hücreleri her 2 günde bir besleyin. Hücre damlacığını rahatsız etmemeye özen göstererek 5 mL serolojik pipet ile kuyunun kenarına taze ortam ekleyin.
NOT: Bu aşamada kaplanan hücrelerin yoğunluğu, bölüm 3'teki iBC'lerin rutin geçişinden 10 kat daha yüksektir.
3. Sferoidlerin ayrışması ve iBC'lerin 3-D kültürde genişlemesi
- Yeterli miktarda 3 boyutlu matrisi (buz üzerinde) çözün. Kullanıma hazır olana kadar buz üzerinde tutun.
NOT: Gerekli 3B matrisin hacmi, kullanıcının kaç hücreye ihtiyaç duyacağına bağlı olarak değişir. - Yaklaşık 5-7 gün sonra, ortamı her bir kuyucuktan aspire edin ve bir P1000 mikropipet ile, matrisin damlacığından ayrışmak için doğrudan sferoidlerin üzerine 1 mL Dispase II (1 U / mL) ekleyin.
- Plakayı 10-15 dakika boyunca 37 °C inkübatöre yerleştirin.
- Bir P1000 mikropipet kullanarak, Dispase'ı 1-2 kez yukarı ve aşağı pipetle pipetleyin ve 3-D matrisin büyük kümelerini parçalayın. Plakayı 30-40 dakika daha 37 ° C'ye geri döndürün ve matrisin tamamen çözünmesine izin verin.
- 3-D matrisin damlacığı artık ışık mikroskobu altında görünmediğinde, serbestçe yüzen sferoidleri 5 mL'lik bir serolojik pipet ucu kullanarak 15 mL'lik bir koniğe ekleyin. Konik başına 10 mL'lik son hacim için DMEM/F12 ekleyin ve sferoidleri peletlemek için 3 dakika boyunca 200 x g'de santrifüj yapın.
- Süpernatantı aspire edin ve ayrışmış her ilk damlacık için 1 mL% 0.05 tripsin (37 ° C) ekleyin (örneğin, dört damlacıkla başlıyorsa, konik şişeye 4 mL tripsin ekleyin).
- 37 ° C'de inkübe edin, sık sık tritüre edin (her 2-3 dakikada bir).
- Birkaç dakikada bir ışık mikroskobu ile değerlendirin. Sferoidlerin çoğunluğu (>% 90) tek hücrelere ayrıldıktan sonra, tripsine 1: 1 hacim oranında% 10 Fetal Sığır Serumu (DMEM / F12'de) ekleyin.
- Hücreleri 40 μm'lik bir hücre süzgecinden süzün ve 5 dakika boyunca 300 x g'de santrifüj yapın.
- Bir hücre sayımı yapın ve hücreleri 400 hücre/μL çözülmüş 3B matris yoğunluğunda eşit şekilde yeniden askıya alın. Hava kabarcıkları sokmaktan kaçının. Aşağı akış uygulaması için gerektiği kadar damlacığı yeniden askıya alın. Her kuyucuk için adım 2.6-2.9'u tekrarlayın.
4. NGFR+ iBC'lerin değerlendirilmesi ve saflaştırılması
- En son geçişten 10-14 gün sonra, sferoidleri 3.2-3.5 adımlarında olduğu gibi tek bir hücre süspansiyonuna ayırın ve bir hücre sayımı yapın.
NOT: Farklı iPSC hatları farklı davranır; bu nedenle, 10-14 gün aralığı farklı iBC'ler için değişebilir. 3-B iBC'lerin 1, 4, 8 ve 14 gün sonra, NGFR+ hücre sıralaması için yeterli olduklarında tipik görünümleri için lütfen Şekil 2'ye bakın. Önerilenden daha erken sıralama (örneğin, Şekil 2C'deki gibi 8. gün), daha az sıklıkta NGFR ifadesine sahip genel olarak daha düşük bir hücre sayısıyla sonuçlanır. Önerilenden daha geç sıralama (örneğin, en son geçişten sonra 14 günden fazla), sıralama sonrası hücre sağkalımının zayıf olmasına yol açar. - Hücreleri Sıralama Tamponunda (ana popülasyon) 1 x 106 hücre / 100 μL yoğunluğunda yeniden askıya alın. Küçük bir aliquot'u (25-50 μL) ayrı bir tüpe (küçük popülasyon) aktarın.
- Ana hücre popülasyonuna konjuge anti-NGFR antikoru (1:100 seyreltme) ekleyin.
- Minör hücre popülasyonuna izotip kontrol antikoru (1:200 seyreltme) ekleyin.
- Hücreleri ışıktan koruyun ve 30 dakika boyunca buz üzerinde tutun, peletlenmeyi önlemek için hücreleri aralıklı olarak (her 5-10 dakikada bir) tritüre edin.
- 30 dakika sonra, Sıralama Arabelleğini her hücre tüpüne 1: 1 oranında ekleyin. Hücreleri 5 dakika boyunca 300 x g'da santrifüj yapın.
- Süper nantantı aspire edin, Sıralama Tamponundaki peletlenmiş hücreleri 10 x 106 hücre / mL yoğunlukta yeniden askıya alın ve canlı veya ölü hücre boyası ekleyin.
- Uygun NGFR+ geçit stratejisini kullanarak (izotip kontrolüne dayanarak, bkz. Şekil 3), gerekli aşağı akış uygulamaları için yeterli sayıda canlı NGFR+ hücresini sıralayın.
NOT: Floresan muhabirlerle (yani, NKX2-1 GFP TP63 tdTomato) iBC'ler kullanılıyorsa, uygun kapı seçimi ve telafisi ile "üçlü pozitif" hücreler (yani, NKX2-1GFP +, TP63 tdTomato +, NGFR +) için sıralama yapılması önerilir (Şekil 3). iBC'lerin bu genişlemesi sırasında, hücrelerin bir kısmı salgı hücrelerine farklılaşır ve çok uluslu hücrelerin çok küçük bir kısmı da tespit edilebilir. Bu popülasyonların her ikisi de NGFR-'dir.
5. Mukosiliyer ALI kültürlerinin oluşturulması
- Apikal odaya 200 μL'lik bir matris ekleyerek (insan embriyonik kök hücre nitelikli matris veya rekombinant insan laminin-521) üreticinin talimatına göre 6,5 mm gözenekli membran ekleri hazırlayın.
- Gerekmeden önce en az 2 saat boyunca 37 ° C'de yerleştirin.
- Kaplama matrisini kesici ucun apikal odasından aspire edin. Bazolateral odaya 500 μL Bazal Hücre Ortamı ekleyin.
- 100-200 μL Bazal Hücre Ortamında en az 30.000 sıralanmış NGFR+ hücresini (adım 4.5'ten itibaren) yeniden askıya alın ve bir P200 mikropipeti kullanarak apikal odaya aktarın. İstediğiniz kadar kuyu (ve mevcut hücreler) için tekrarlayın. Plakayı nemlendirilmiş 37 °C inkübatöre yerleştirin.
- 2-3 gün içinde, apikal ve bazolateral odaları aspire edin ve taze Bazal Hücre Ortamı (apikal için 500 μL, bazolateral için 100 μL) ile besleyin.
- Işık mikroskobu ile apikal odacığı günlük olarak izleyin. Hücreler% >80 oranında aktığında (tipik olarak 3-7 gün), Bazal Hücre Ortamını hem apikal hem de bazolateral odalarda ALI Farklılaşma Ortamı (önceden ısıtılmamış) ile değiştirin. ALI Differentiation Medium ile çalışırken, ortam kaplarını folyoya sarılmış halde tutarak ve mümkün olduğunda tepe lambalarını kapatarak ışıktan koruyun.
- Ertesi gün, ortamı apikal odadan aspire edin, böylece apikal yüzeyi havaya maruz bırakın.
- Bazolateral odadaki ALI Farklılaşma Ortamı ortamını her 2-3 günde bir değiştirin.
- Kültür görünümünü her 1-2 günde bir izleyin. Biriken herhangi bir sıvıyı, hücre tabakasını bozmadan, apikal odadan dikkatlice aspire edin.
- Epitel bütünlüğü için transepitelyal elektrik direncini (TEER) değerlendirin.
NOT: TEER, epitel tabakası bütünlüğünün bir okumasını vermek için havaya maruz kalmayı takip eden günlerde değerlendirilebilir. TEER'i ölçmek için ideal zaman belirlenmemiştir, ancak yüksek kaliteli mukosiliyer farklılaşma ile tutarlı değerler tipik olarak >500 xcm2'dir. - Enkaz veya mukusun çıkarılması gerekiyorsa, apikal odaya nazikçe 100 μL PBS (Ca 2 + veya Mg2 + olmadan) ekleyin. 10 dakika boyunca 37 ° C'de inkübe edin ve ardından PBS'yi dikkatlice aspire edin.
- 7-10 gün havaya maruz kaldıktan sonra, hareketli kirpikler tipik olarak ortaya çıkar ve ışık mikroskobu kullanılarak görülebilir. Planlanan deneye ve okumaya bağlı olarak, hücreler 14-28 gün havaya maruz kaldıktan sonra analiz edilebilir.
NOT: Floresan muhabir hücreler kullanılmışsa ve canlı hücre floresan mikroskobu mevcutsa, hücreler muhabir floresansının yanı sıra ışık mikroskobu ile de izlenebilir.
6. iBC'lerin isteğe bağlı (ancak önerilen) kriyoprezervasyonu.
- En son 3-B kültür geçişinden 10-14 gün sonra, sferoidleri 3.2-3.5 adımlarında olduğu gibi tek hücreli süspansiyona ayırın. Bir hücre sayımı gerçekleştirin.
- Kriyoprezervasyon Ortamında bir kriyovyalde 250.000 hücre / 500 μL yoğunlukta yeniden askıya alın.
- Sıcaklıkta (1 ° C / dak) sabit bir düşüş sağlamak için kriyovalleri bir kaba koyun ve 24-48 saat boyunca -80 ° C'ye aktarın, ardından uzun süreli depolama için -150 ° C'ye aktarın.
NOT: Daha önce NGFR + sıralanmış hücrelerin kriyoprezervasyonunun yanı sıra tekrar kriyoprezervasyon da yapılmıştır, ancak bunlar hücre canlılığı ve fonksiyonel ALI kültürleri oluşturma yeteneği açısından yeterince değerlendirilmemiştir. Özellikle genişletilmiş hücre geçişi ile, iPSC'lerde ve iPSC türevi hücrelerde değiştiği belirtildiğinden, karyotip için değerlendirme yapılması önerilir.
Sonuçlar
Bu protokolü takiben, 200.000 kriyokorunmuş iBC (daha önce normal bir 46XY karyotipe sahip olduğu doğrulandı)11 çözüldü ve 3-D kültürde genişletildi. Beş gün sonra, ortaya çıkan sferoidler ayrıştırıldı, sayıldı ve daha fazla genişleme için tekrar geçti. Yaklaşık 480.000 hücre elde edildi ve 3-D matriste (12 x 50 μL damlacıklar, yoğunluk 400 hücre / μL) yeniden askıya alındı. Her 2-3 günde bir Taze Bazal Hücre Ortamı uygulandı. On gün sonra, hücreler bir kez daha ayrıştı ve sayıldı. Toplam 19.7 x 106 hücre hasat edildi ve FACS'a hazırlandı. 106 hücre APC konjuge IgG1κ izotip kontrolü ile boyandı ve kalan 18.7 x 106 hücre ışıktan korunan 30 dakika boyunca APC konjuge anti-NGFR antikoru ile boyandı (Şekil 3).
NGFR+ geçişi, izotip kontrol hücreleri ile karşılaştırıldıktan sonra yapıldı ve en yüksek eksprese eden NGFR+ hücrelerini toplamak için kasıtlı olarak ayarlandı (Şekil 3). Bu geçit tekniği ile canlı, tek hücrelerin %28'i NGFR+ idi. Daha fazla hücre mevcut olsa da, aşağı akış kültürü için 750.000 hücre toplandı. Sıralanmış hücreler Bazal Hücre Ortamında 50.000 hücre / 100 μL'lik bir konsantrasyonda yeniden askıya alındı. 50.000 hücre daha sonra üreticinin yönergelerine göre insan rekombinant laminin-521 (2 μg / 200 μL) ile kaplanmış olan her 6.5 mm gözenekli membran ekine ekildi. Her bir kesici ucun bazolateral odasına 500 μL Bazal Hücre Ortamı eklendi ve plaka 37 °C nemlendirilmiş bir inkübatöre yerleştirildi. Üç gün sonra, apikal odadaki ortam aspire edildi ve hücreler ışık mikroskobu ile ~% 90 oranında birleşti (Şekil 4B). Bazolateral odadan gelen medya aspire edildi; ALI Farklılaşma Ortamı, apikal (100 μL) ve bazolateral (500 μL) odalara eklendi. Ertesi gün, apikal odadan medya aspire edildi.
Takip eden 21 gün boyunca, hücreler periyodik olarak ışık mikroskobu ile değerlendirildi ve her 2-3 günde bir taze ALI Farklılaşma Ortamı (sadece bazolateral oda) ile beslendi. Bireysel hücreler başlangıçta kolayca tanımlanabilirdi (Şekil 4A), uzun ve iğ şeklinde bir görünüme sahipti ve gevşek bir şekilde paketlenmiş tek katmanlı bir tabaka oluşturdu (Şekil 4B). Sonraki günlerden haftalara kadar, hücreler sıkıca paketlenmiş, yüksek hücresel, epitel tabakası oluşturdu ve 7-10 gün sonra kirpik ve mukus üretiminin dövülmesinin açıkça ortaya çıkması oldu. Örneklerin TEER'i hesaplandı ve primer hücre kontrollerine benzer (700-1600 Ω xcm2 aralığında)11. Daha sonra paraformaldehit ile fiksasyon (gün 21-28) ve diğerlerinin yanı sıra MUC5AC ve asetillenmiş α-tübülin için kanonik hava yolu epitel hücre belirteçleri için immünoetiketleme yapıldı (Şekil 4C). Genel olarak, primer HBEC'lerinkine benzer şekilde hareketli kirpikler, mukus üretimi ve multisiliye ve sekretuar hücrelerin doğrulayıcı immün boyamasını gözlemleyerek, indüklenmiş pluripotent kök hücrelerden hava yolu epitel hücrelerini başarıyla ürettiğimiz sonucuna vardık.
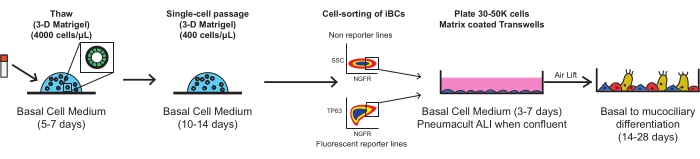
Şekil 1: Protokolün genel şeması. Kriyokorunmuş iBC'ler çözülür, genişletilir ve FACS, gözenekli membran eklerine kaplanmadan önce saflaştırılır ve burada fonksiyonel bir mukosiliyer epitel halinde farklılaşırlar. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Temsili faz kontrast görüntüleri. (A) 1 gün, (B) 4 gün, (C) 8 gün ve (D) 14 gün (sadece NGFR öncesi sıralama) sonrasında 3-D kültürde iBC'lerin olağan görünümünü gösteren temsili faz kontrast görüntüleri. Ölçek çubukları 500 μm'yi temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
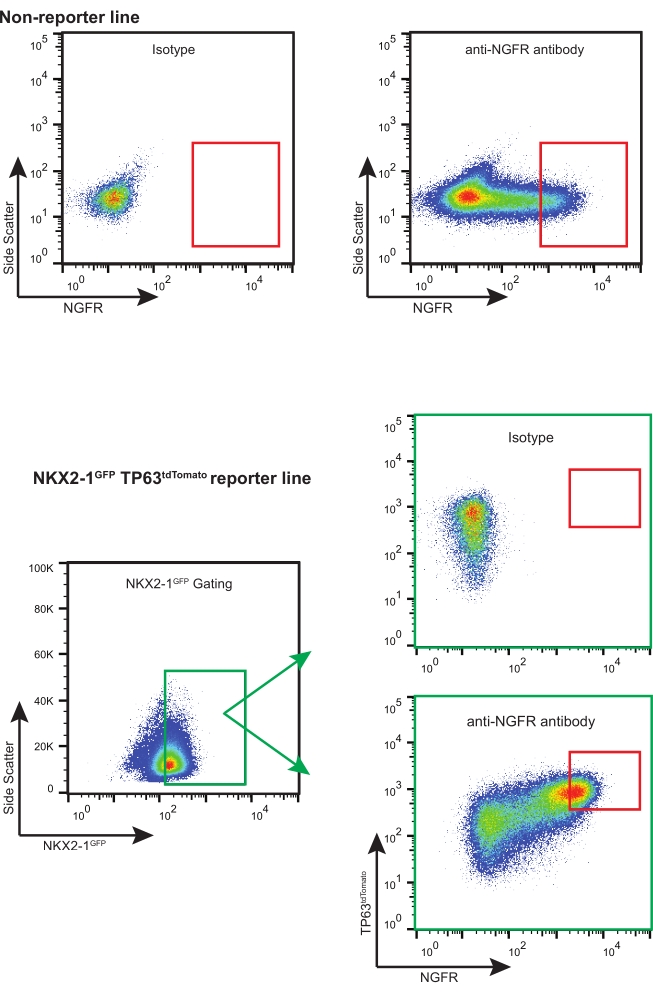
Şekil 3: Temsili FACS arazileri. Muhabir olmayan ve floresan muhabir iBC'ler için temsili FACS arazileri. İzotip kontrollerinin örnekleri gösterilmiştir ve en yüksek ekspresyon yapan NGFR + hücrelerini seçmek için kullanılmıştır. Floresan muhabir içeren iPSC hatları, NKX2-1GFP + TP63tdTomato + NGFR + hücreleri için "üçlü sıralanır". Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
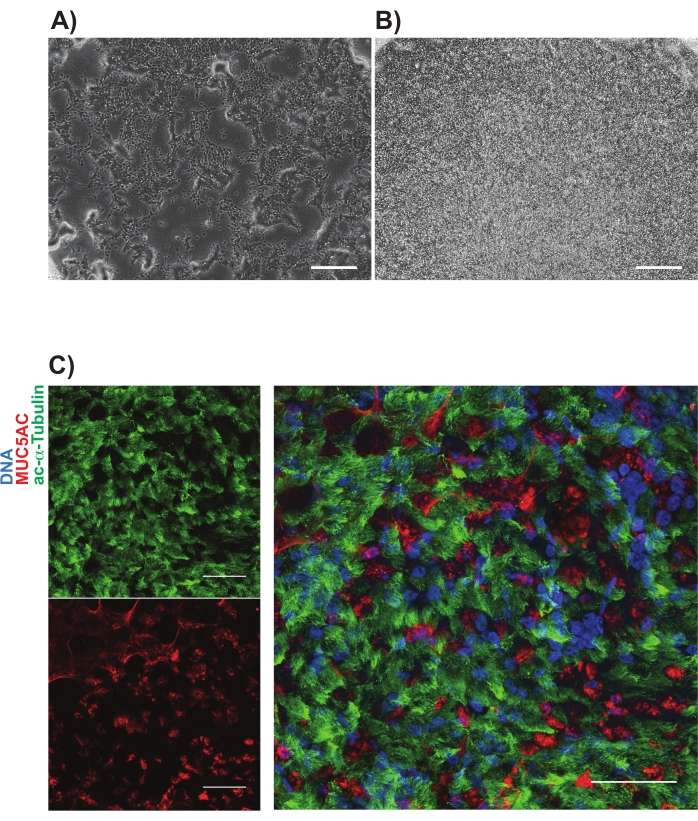
Şekil 4: Gözenekli membranlar üzerindeki iBC kültürlerinin temsili görüntüleri. Faz kontrastlı görüntüler (A) 1 gün ve (B) kaplamadan 3 gün sonra gösterilir. (C)'de gösterilen mukosiliyer kültürlerin temsili immüno-etiketlemesi; asetillenmiş alfa tübülin (yeşil) ve MUC5AC (kırmızı). Ölçek çubukları 25 μm'yi temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: Medya bileşeni tablosu. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
HBEC'ler, hava yolu epitel hastalıklarını incelemek için altın standart hücre tipidir. Sınırlamaları nedeniyle (erişilebilirlik ve genetik olarak manipüle etmenin zorluğu dahil), iBC'lerin ve ALI kültürlerinin türetilmesi için bir protokol oluşturduk. Bu hücreler herhangi bir donörden türetilebilir ve benzersiz genetik geçmişlerini koruyabilir, böylece temel gelişimsel çalışmalara, hastalık modellemesine ve yeni terapötik gelişime izin verir.
Açıklanan protokolün her bir adımı gerekli olsa da, ekstra bahsetmeyi hak eden birkaç tane vardır. İlk olarak, sferoidlerin tek hücrelere ayrışmasını gerektiren her adımda, aşırı pipetlemeden kaçınmak çok önemlidir; enzimatik sindirim (dispase veya tripsin ile) daha iyi hücre sağkalımını desteklerken, aşırı pipetleme önemli hücre ölümüne yol açar. İkincisi, NGFR + iBC'leri saflaştırırken, izotip kontrolünün kullanılması çok önemlidir ve FACS ile en yüksek eksprese eden NGFR + hücrelerini seçmenizi öneririz (Şekil 3). Bu yaklaşım, uygun mukosiliyer farklılaşma ile optimal ALI kültürleri ile sonuçlanır. Son olarak, gözenekli membranların tam olarak protokolde belgelendiği gibi hazırlanması ve tohumlanması, ALI kültürünün hayatta kalması için esastır. Tipik olarak ekleme başına 30.000-60.000 hücre tohumlarken, 20.000 kadar az hücreyle başarı elde ettik. İnsan embriyonik kök hücre nitelikli matris kaplaması kullanılarak başarılı kültürler üretilebilirken, daha yakın zamanda ALI kültürlerinin önemli ölçüde daha yüksek dayanıklılığına sahip insan rekombinant laminin-521'i kullandık.
Çok nadiren, iPSC farklılaşmaları NGFR + iBC'lerin yeterli bir yüzdesini yukarı regüle etmekte başarısız olabilir. Bu durumda, iBC'lerin seri geçişi (3-D kültüründe) zamanla artan bir NGFR frekansına neden olabilir. Bu protokolün sınırlamaları, bu hücreleri üretmek için gereken zamanı, maliyeti ve uzmanlığı içerir. Ek olarak, birçok araştırmacının hava yolu epitelinin daha az yaygın hücre tipleriyle (örneğin, iyonositler, nöroendokrin hücreler) ilgilendiğini biliyoruz. Bu nadir hücre tiplerinden bazılarını tespit etmiş olsak da, birincil HBEC kültürlerinde olduğu gibi, muhtemelen bu hücreleri üretmek için gereken gelişimsel ipuçlarıyla ilgili eksik bilgi nedeniyle, tekrarlanabilir bir şekilde tanımlanmamışlardır.
Yazıldığı gibi, yukarıdaki protokol zaten kriyokorunmuş iBC'lerin çözülmesiyle başlar. Bu kriyoprezervasyondan önceki detaylar daha önce açıklanmış ve bu makalenin kapsamı dışında11,12.
Hava yolu epitelyal ALI kültürü yöntemimiz, hemen hemen her donörden fonksiyonel hava yolu epitel hücrelerinin üretilmesini sağlar. Bu, hastalık modellemesi, ilaç taraması, gelecekteki hücre bazlı tedaviler için kullanılabilecek genetik olarak kontrol edilen değerli hava yolu epitel hücrelerine erişilebilirliği büyük ölçüde arttırır ve ayrıca hava yolu epiteli içindeki gelişimsel modelin anlaşılmasını geliştirir.
Açıklamalar
Yazarların herhangi bir açıklaması yoktur.
Teşekkürler
Hawkins, Kotton ve Davis laboratuvarlarının üyelerine, bu ve diğer projelerle ilgili yıllar boyunca yararlı katkıları için teşekkür ederiz. Ayrıca, Brian Tilton'a (BU Hücre Sıralama Direktörü) özveri ve teknik uzmanlığı için borçluyuz ve Boston Üniversitesi Rejeneratif Tıp Merkezi'nden (CReM) Greg Miller ve Marianne James'e, NIH hibeleri NO1 75N92020C00005 ve U01TR001810 tarafından desteklenen, hastaya özgü iPSC'lerin bakımı ve karakterizasyonu konusundaki destekleri ve teknik uzmanlıkları için minnettarız. Bu çalışma NIH'nin D.N.K.'ye U01HL148692, U01HL134745, U01HL134766 ve R01HL095993, B.R.D.'ye R01HL139876, F.H.'ye R01 HL139799 hibeleri ve Kistik Fibrozis Vakfı (CFF) tarafından desteklenmiştir ve Kistik Fibrozis Vakfı (CFF) D.N.K.'ya CFF 00987G220 ve CFF WANG20GO, CFF DAVIS15XX1, DAVIS17XX0, DAVIS19XX0 ila B.R.D, CFF ZUKI19XX0 ile A.B.'ye, cff BERICA2010'u A.B.'ye, ve CFF HAWKIN20XX2'den F.H.'ye
Malzemeler
| Name | Company | Catalog Number | Comments |
| 12-well tissue culture treated plate | Corning | 3515 | flat bottom |
| 3-D growth factor reduced Matrigel | Corning | 356230 | |
| A83-01 | ThermoFisher Scientific | 293910 | |
| Cell culture inserts (Transwell) | Corning | 3470 | 6.5mm diameter; 0.4μm pore size |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | |
| Dispase II, Powder | ThermoFisher Scientific | 17105-041 | |
| DMH1 | ThermoFisher Scientific | 412610 | |
| Dulbecco's Modified Eagle Medium/Nutrient Mixture (DMEM):F-12 | ThermoFisher Scientific | 11330-032 | |
| Dulbecco's Phosphate Buffered Saline (PBS) (1X) | Gibco | 14190-144 | |
| Ethylenediaminetetraacetic acid disodium salt solution (EDTA) | Sigma | E7889 | |
| Fetal Bovine Serum (FBS) | Fisher | SH3007003E | |
| Hanks' Balanced Salt Solution (HBSS) | ThermoFisher Scientific | 14175-079 | |
| HEPES | Sigma | H3375 | |
| hESC-qualified Matrigel | Corning | 354277 | |
| Mouse IgG1kappa isotype control, APC-conjugated | Biolegend | 400122 | |
| Mouse monoclonal anti-human CD271/NGFR, APC-conjugated | Biolegend | 345108 | |
| PneumaCult-ALI Medium (ALI Differentiation Medium) | StemCell Technologies | 05001 | |
| PneumaCult-Ex Plus Medium (Basal Cell Base Medium) | StemCell Technologies | 05040 | |
| Primocin | InvivoGen | ant-pm-2 | |
| rhLaminin-521 | ThermoFisher Scientific | A29248 | Final Concentration: 10ug/mL |
| Trypsin-EDTA Solution, 0.05% | Invitrogen | T3924 | |
| Y-27632 | Tocris | 1254 |
Referanslar
- GBD Chronic Respiratory Disease Collaborators. Prevalence and attributable health burden of chronic respiratory diseases, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. The Lancet. Respiratory Medicine. 8 (6), 585-596 (2020).
- Alysandratos, K. -. D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Medicine. 107, 183-206 (2005).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Takahashi, K., et al. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131 (5), 861-872 (2007).
- Berical, A., Lee, R. E., Randell, S. H., Hawkins, F. Challenges facing airway epithelial cell-based therapy for cystic fibrosis. Frontiers in Pharmacology. 10, 74 (2019).
- Jacob, A., et al. Derivation of self-renewing lung alveolar epithelial type II cells from human pluripotent stem cells. Nature Protocols. 14 (12), 3303-3332 (2019).
- Gotoh, S., et al. Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Reports. 3 (3), 394-403 (2014).
- Huang, S. X. L., et al. Efficient generation of lung and airway epithelial cells from human pluripotent stem cells. Nature Biotechnology. 32 (1), 84-91 (2013).
- Mou, H., et al. Generation of multipotent lung and airway progenitors from mouse ESCs and patient-specific cystic fibrosis iPSCs. Cell Stem Cell. 10 (4), 385-397 (2012).
- Hawkins, F. J., et al. Derivation of airway basal stem cells from human pluripotent stem cells. Cell Stem Cell. 28 (1), 79-95 (2021).
- Suzuki, S., et al. Differentiation of human pluripotent stem cells into functional airway basal stem cells. STAR Protocols. 2 (3), 100683 (2021).
- Rock, J. R., et al. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12771-12775 (2009).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır