Method Article
ヒト多能性幹細胞からの気道上皮細胞気液界面培養物の生成
要約
ヒト人工多能性幹細胞分化プロトコールにおける最近の進歩は、器官特異的細胞型の段階的な誘導を可能にする。ここでは、気液界面培養におけるiPSC由来気道基底細胞の維持・拡大と粘液繊毛上皮への分化のための詳細な手順を述べる。
要約
喘息、嚢胞性線維症(CF)、原発性毛様体ジスキネジア(PCD)、ウイルス性呼吸器感染症などの伝導気道の疾患は、世界中の罹患率および死亡率の主な原因である。ヒト気管支上皮細胞(HBEC)を用いた インビトロ プラットフォームは、健康および疾患における気道上皮の理解に役立ってきた。まれな遺伝性疾患またはまれな変異を有する個人からのHBECへのアクセスは、肺研究におけるボトルネックである。
人工多能性幹細胞(iPSC)は、体細胞を「リプログラミング」することによって容易に生成され、個々のドナーのユニークな遺伝的背景を保持します。最近の進歩は、主要な気道幹細胞 である基底 細胞を介して肺上皮前駆細胞、肺胞2型細胞、ならびに伝導気道上皮の細胞へのiPSCの指向性分化を可能にする。
ここでは、iPSC由来気道基底細胞(以下iBC)の維持・拡大と、気液界面(ALI)培養における三系統分化のプロトコールを概説する。iBCsは、TGF−ßおよびBMPシグナル伝達経路の阻害剤を添加した初代基底細胞培地中で培養された細胞外マトリックスの液滴中に懸濁した上皮スフェアとして維持および拡張される。これらの上皮スフェア内のiBCは、重要な基礎マーカーTP63およびNGFRを発現し、蛍光活性化細胞ソーティング(FACS)によって精製することができ、標準的なALI培養条件下で多孔性膜上に播種すると、機能的な気道上皮に分化する。健康なドナーに由来するALI培養物は、基底細胞、分泌細胞および増殖細胞で構成され、上皮バリア完全性、運動性繊毛、および粘液分泌を実証する。CFまたはPCDを有する個体に由来する培養物は、機能不全のCFTR媒介性塩化物輸送または不動性繊毛を、それぞれの疾患原因上皮欠損に再現する。
ここでは、気道疾患のモデリングと理解に適用できるヒト細胞の生成のためのプロトコルを提示する。
概要
慢性肺疾患は、世界中の罹患率および死亡率の大きな負担を占めています1.喘息、嚢胞性線維症(CF)、原発性毛様体ジスキネジア(PCD)、およびウイルス感染などの伝導気道に影響を与える状態は、この世界的な負担に寄与する後天性および遺伝的疾患の両方を一般的およびよりまれな疾患の両方を表す。伝導気道の主な機能は、1)空気の層流の導管として機能し、2)病原体および破片の粘液繊毛クリアランスを提供することである。分泌細胞、多繊毛細胞、基底細胞は、伝導気道の主要な上皮細胞型を表す。よりまれな上皮細胞タイプには、イオン細胞、房細胞、および神経内分泌細胞が含まれ、他の場所でレビューされている2。
概して、疾患のメカニズムを理解し、治療アプローチを進歩させる上での主な障壁は、前臨床モデルでの使用のためのヒト一次組織の一貫した欠如であった。HBECは一般に、ヒト気道上皮生物学のゴールドスタンダードのインビトロモデルと考えられており、特にCF研究において重要な役割を果たしてきました3。しかし、それらは典型的には、気管支鏡的生検から、手術後の肺組織から、または移植目的のために拒絶された肺から単離される。CFおよびPCDの研究優先順位を含む遺伝性疾患を有する個人からのHBECへのアクセスは、まれであり、予測不可能である。患者由来気道上皮細胞に対するこのボトルネックを克服することが必要である。iPS細胞は、任意の個体から容易に生成され、ドナーのユニークな遺伝的背景を保持し、細胞培養条件下で増殖および長期間生存する顕著な能力を有する4、5、6。重要な発生学的ステップを繰り返すことによって、iPS細胞は器官特異的細胞型への「指向性分化」を受ける。我々らは、iPSC由来肺前駆細胞、肺胞2型細胞7、8および気道基底細胞9、10、11、12を含む伝導気道の細胞を生成するためのプロトコルを開発しました。
気道基底細胞は、導電性気道13の幹細胞である。以前に発表された研究で、私たちのグループは、TP63、KRT5、およびNGFRを含む標準的な基底細胞マーカーを発現するサブセット(iBC)を含むiPSC由来気道上皮細胞を生成しました。成体基底細胞生物学からの手がかりに続いて、二重SMAD経路(TGF-βおよびBMP)の阻害は、NGFR+ iBCのアップレギュレーションをもたらす11、14。NGFR+ iBCsは、単一細胞として細胞外マトリックスの液滴中に再懸濁され、基礎細胞培地中で培養される。それらはiBC集団を維持するために自己再生し、上皮回転楕円体を形成する。しかし、この形態では分泌細胞にも分化する割合もある(3-D培養と呼ばれる)。以下のプロトコルでは、3-D培養においてこれらのiBCを維持および拡張するステップ、ならびに機能的な2-D粘膜繊毛ALI培養物を生成するために必要なステップを詳述する。
この分化プロトコルの最初のステップは以前に公開されており、ここではレビューされません11,12.この原稿では、iBCの増殖と精製、およびその後のALI培養における機能分泌細胞および増殖細胞への分化に焦点を当てます。
プロトコル
以下の各ステップは、バイオセーフティレベル2層流フード内で滅菌技術を用いて実施されるべきである。すべての培地は、特に特に言及されていない限り、細胞に添加される前に室温(22°C)に加温する必要があります。各遠心分離工程は、室温(約22°C)で実施すべきである。図 1 に、プロトコルの回路 図 の概要を示します。
1. 必要な培地の準備
メモ: 詳細については 、補足ファイル 1 を参照してください。
- 基礎細胞培地
- 製造元の指示に従ってベース培地を調製する。
- ベース培地50 mLごとに、5 μLのA83-01(10 mM)、5 μLのDMH1(10 mM)、50 μLのY-27632(10mM)、および100 μLのプリモシン(50 mg/mL)を加える。以下、この培地を基礎細胞培地と呼ぶ。
- 4°Cで最大1ヶ月間保管してください。
- ALI分化培地
- 製造元の指示に従って培地を準備します。
- ALI分化培地50 mLごとに、100 μLのプリモシン(50 mg/mL)を加える。
- 4°Cで光から保護して最大1ヶ月間保管してください。
- ソートバッファ
- ソートバッファー 50 mL ごとに、47.5 mL のハンクス平衡塩溶液、1 mL の FBS、200 μL の EDTA (500 mM)、1.25 mL の HEPESバッファー (1 M)、50 μL の Y-27632 (10 mM)、および 100 μL のプリモシン (50 mg/mL) を組み合わせてください。
- フィルター滅菌は、孔径0.4 μmで行います。
- 4°Cで最大1ヶ月間保管してください。
- 凍結保存媒体
- 凍結保存培地 50 mL ごとに、45 mL の基礎細胞培地と 5 mL のジメチルスルホキシド (DMSO) を組み合わせます。
- フィルター滅菌は、孔径0.4 μmで行います。
- 4°Cで最大1ヶ月間保管してください。
2. 凍結保存されたiBCの融解
- 十分な量の3-D成長因子を(氷上で)融解し、細胞外マトリックス(以下3-Dマトリックス)を減少させる。使用準備が整うまで氷の上に保管してください。
注: 1 つのバイアル (250,000 個の細胞を含む) を解凍する場合は、100 ~ 200 μL の 3-D マトリックスを融解します。 - 以前に凍結保存したiBCの単細胞懸濁液のバイアルを、目に見える凍結媒体がなくなるまで(1〜2分間)37°Cの水またはビーズ浴中でインキュベートすることによって解凍する。
- 5 mL 血清学的ピペットを使用して、細胞懸濁液を 15 mL 円錐形チューブに加えます。
- 6〜10mLのDMEM/F12を細胞懸濁液に滴下し、穏やかに混合し、300 x g で5分間遠心分離して細胞をペレット化する。
- 上清を吸引し、P1000マイクロピペットで細胞ペレットを1mLの基礎細胞培地に再懸濁する。10μLのアリコートを除去し、細胞数を行う。
- 細胞を300 x g で5分間遠心分離する。上清を吸引し、P1000マイクロピペットで以前に解凍した3Dマトリックスに4,000細胞/μLの密度で細胞を再懸濁する。
メモ: 3-D マトリックスに気泡を追加しないようにすることが重要です。マトリックスをゆっくりと慎重にピペットします。 - P200マイクロピペットを用いて、12ウェル組織培養処理プレートの各ウェルの基部に1液滴(25または50μL)を加える。250,000個の凍結細胞から開始する場合、このステップでの予想される液滴数は、細胞生存率に応じて3〜4個(25μL液滴)の間である。
- プレートを 37 °C で約 15 分間インキュベートした後、5 mL 血清学的ピペットを使用して、液滴を完全に沈めるのに十分な Basal Cell Medium を各ウェルに加えます (50 μL の場合は 1.5 mL、25 μL の場合は 1 mL)。プレートを加湿インキュベーターに戻します。
- 新鮮な基礎細胞培地を用いて2日ごとに細胞を供給。5mL血清学的ピペットでウェルの側面に新鮮な培地を加え、細胞の液滴を乱さないように注意してください。
注:この段階で播種された細胞の密度は、セクション3のiBCの日常的な継代よりも10倍高い。
3. 3次元培養におけるスフェロイドの解離とiBCの拡大
- 十分な量の3-Dマトリックスを(氷上で)解凍します。使用準備が整うまで氷の上に保管してください。
注: 必要な 3-D マトリックスのボリュームは、ユーザーが必要とするセルの数によって異なります。 - 約5〜7日後、各ウェルから培地を吸引し、P1000マイクロピペットを用いて、1mLのDispase II(1U/mL)をスフェロイドに直接加えて、マトリックスの液滴から解離させる。
- プレートを37°Cのインキュベーター内に10〜15分間置く。
- P1000マイクロピペットを用いて、ディスパーゼを1〜2回上下にピペットし、3−Dマトリックスの大きな塊を分割する。プレートをさらに30〜40分間37°Cに戻し、マトリックスが完全に溶解できるようにします。
- 3-D マトリックスの液滴が光学顕微鏡下で見えなくなったら、5 mL 血清学的ピペットチップを使用して、自由に浮遊するスフェロイドを 15 mL 円錐形に追加します。円錐形あたり10mLの最終容量にDMEM/F12を加え、200 x g で3分間遠心分離機でスフェロイドをペレット化します。
- 上清を吸引し、解離した初期液滴ごとに1 mLの0.05%トリプシン(37°C)を加える(例えば、4つの液滴から始める場合は、円錐フラスコに4 mLのトリプシンを加える)。
- 37°Cでインキュベートし、頻繁に(2〜3分ごとに)粉砕する。
- 数分おきに光学顕微鏡で評価します。スフェロイドの大部分(>90%)が単一細胞に解離したら、10%のウシ胎児血清(DMEM/F12)を1:1の体積比でトリプシンに加えます。
- 細胞を40 μmのセルストレーナーでろ過し、300 x g で5分間遠心分離します。
- 細胞数を実行し、解凍した3-Dマトリックスの密度400細胞/μLで細胞を均等に再懸濁する。気泡の導入は避けてください。ダウンストリームアプリケーションに必要な数のドロップレットを再サスペンドします。各ウェルについて、手順 2.6 ~ 2.9 を繰り返します。
4. NGFR+ iBCの評価と精製
- 直近継の10〜14日後、ステップ3.2〜3.5のようにスフェロイドを単一細胞懸濁液に解離させ、細胞数を行う。
メモ: iPSC ラインが異なれば動作も異なります。したがって、10 ~ 14 日の範囲は iBC ごとに異なる場合があります。NGFR+ 細胞選別に適切な 1、4、8、および 14 日後の 3-D iBC の典型的な外観については、 図 2 を参照してください。推奨よりも早くソートすると(例えば、 図2Cのように8日目)、NGFR発現の頻度が低くなり、細胞数が全体的に少なくなります。推奨よりも遅い選別(例えば、直近の継代後14日以上経過)は、選別後の細胞生存率の低下につながります。 - 1 x106 cells/100 μLの密度で細胞をソートバッファー(主要集団)に再懸濁する。小さなアリコート(25〜50μL)を別のチューブ(未成年者集団)に移す。
- コンジュゲート抗NGFR抗体(1:100希釈)を主細胞集団に加える。
- アイソタイプ対照抗体(1:200希釈)をマイナー細胞集団に加える。
- 細胞を光から保護し、30分間氷の上に保ち、断続的に(5〜10分ごとに)細胞を粉砕してペレット化を防止する。
- 30 分後、ソートバッファーを各細胞チューブに 1:1 の比率で加えます。細胞を300 x g で5分間遠心分離する。
- 上清を吸引し、ペレット化した細胞をソートバッファーに10 x106 細胞/mLの密度で再懸濁し、生細胞染色または死細胞染色を加える。
- 適切なNGFR+ゲーティング戦略(アイソタイプ制御に基づく、 図3を参照)を使用して、必要な下流アプリケーションに対して十分な生きたNGFR+細胞をソートします。
注:蛍光レポーター(NKX2-1GFP TP63 tdTomato)とともにiBCを使用する場合は、適切なゲート選択と補償を行い、「トリプルポジティブ」細胞(NKX2-1GFP+、TP63 tdTomato+、NGFR+)を選別することをお勧めします(図3)。iBCのこの拡大の間に、細胞の一部が分泌細胞に分化し、非常に少数の多毛細胞も検出され得る。これらの集団は両方ともNGFR-である。
5. 粘液繊毛ALI培養物の生成
- 製造者の指示に従って、200 μLのマトリックス(ヒト胚性幹細胞修飾マトリックスまたは組換えヒトラミニン-521)を頂端チャンバーに添加して、6.5 mmの多孔性膜インサートを調製する。
- 必要になる前に少なくとも2時間37°Cで置く。
- インサートの頂端チャンバーからコーティングマトリックスを吸引する。500 μLの基底細胞培地を側底チャンバーに加える。
- 少なくとも30,000個の選別されたNGFR+細胞(ステップ4.5から)を100〜200μLの基礎細胞培地に再懸濁し、P200マイクロピペットを使用して頂端チャンバーに移す。必要な数のウェル(および利用可能な細胞)について繰り返します。プレートを加湿した37°Cのインキュベーターに入れる。
- 2〜3日で、頂端および側底チャンバーを吸引し、新鮮な基礎細胞培地(頂端に500 μL、基底側を100 μL)で供給する。
- 毎日、光学顕微鏡で頂端チャンバーを監視します。細胞が>80%コンフルエント(典型的には3〜7日)である場合、根尖および側底チャンバーの両方で基礎細胞培地をALI分化培地(予め加温されていない)と交換する。ALI差別化媒体を使用する場合は、媒体容器をホイルで包んだままにし、可能な場合はオーバーヘッドライトをオフにして、光から保護してください。
- 翌日、頂端チャンバーから培地を吸引し、頂端表面を空気に曝す。
- ALI分化培地培地を2〜3日ごとに側底チャンバーに交換する。
- 1〜2日ごとに培養外観を監視する。細胞層を乱すことなく、頂端室から蓄積された液体を慎重に吸引する。
- 上皮の完全性について経上皮電気抵抗(TEER)を評価する。
注:TEERは、上皮層の完全性の読み出しを得るために、空気曝露後の数日で評価することができる。TEERを測定する理想的な時期は確立されていないが、高品質の粘液繊毛分化と一致する値は典型的には>500 xcm2である。 - 破片または粘液を除去する必要がある場合は、100μL PBS(Ca2+ またはMg2+なし)を頂端チャンバーに穏やかに加える。37°Cで10分間インキュベートし、PBSを注意深く吸引した。
- 空気曝露の7〜10日後、運動性繊毛が典型的に現れ、光学顕微鏡を用いて見ることができる。計画された実験および読み出しに応じて、細胞は空気曝露の14〜28日後に分析することができる。
注:蛍光レポーター細胞が使用されており、生細胞蛍光顕微鏡が利用可能な場合、細胞はレポーター蛍光と同様に光学顕微鏡で追跡することができます。
6. iBCのオプション(ただし推奨)凍結保存
- 最新の3D培養継代の10〜14日後、ステップ3.2〜3.5のようにスフェロイドを単一細胞懸濁液に解離させる。セル数を実行します。
- クライオバイアル中で250,000細胞/500 μLの密度で凍結保存培地に再懸濁する。
- クライオバイアルを容器に入れて温度が安定的に低下(1°C/分)し、-80°Cに24〜48時間移した後、-150°Cに移して長期保存します。
注:以前にNGFR+選別した細胞の凍結保存と凍結保存を繰り返して実施しているが、細胞生存率および機能的なALI培養物を形成する能力について十分に評価されていない。特に細胞継代が延長されると、iPSCおよびiPSC由来細胞で異なることが指摘されているため、核型を評価することが推奨される。
結果
このプロトコールに従って、200,000個の凍結保存されたiBC(正常な46XY核型を有することが以前に確認された)11 を解凍し、3-D培養で増殖させた。5日後、生じた回転楕円体は解離し、数えられ、さらなる膨張のために再び継代された。約480,000個の細胞が得られ、3-Dマトリックス(12 x 50 μLの液滴、密度400細胞/μL)に再懸濁した。新鮮な基礎細胞培地を2〜3日ごとに塗布した。10日後、細胞は再び解離し、計数された。合計19.7 x106個の 細胞を回収し、FACS用に調製した。106 個の細胞をAPC結合IgG1κアイソタイプコントロールで染色し、残りの18.7 x106 個の細胞をAPC結合抗NGFR抗体で30分間染色し、光から保護した(図3)。
NGFR+ゲーティングは、アイソタイプ対照細胞と比較した後に行い、最も高発現しているNGFR+細胞を採取するために意図的に設定した(図3)。このゲーティング技術では、生の単一細胞の28%がNGFR+であった。より多くの細胞が利用可能であったが、下流培養のために750,000個の細胞が収集された。選別した細胞を、50,000細胞/100 μLの濃度で基礎細胞培地に再懸濁し、次いで、製造業者のガイドラインに従ってヒト組換えラミニン-521(2 μg/200 μL)でコーティングされた各6.5 mmの多孔膜インサート上に50,000個の細胞を播種した。500 μLの基礎細胞培地を各インサートの側底チャンバーに添加し、プレートを37°Cの加湿インキュベーターに入れた。3日後、頂端チャンバー内の培地を吸引し、細胞を光学顕微鏡により〜90%コンフルエントにした(図4B)。側底室からのメディアが吸引された。ALI分化培地を頂端(100 μL)および側底(500 μL)チャンバーに添加した。翌日、頂端室からメディアを吸引した。
次の21日間にわたり、細胞を定期的に光学顕微鏡によって評価し、2〜3日ごとに新鮮なALI分化培地(側底チャンバーのみ)を給餌した。個々の細胞は、最初は容易に識別可能であり(図4A)、細長く紡錘形の外観を有し、かつ緩く充填された単分子膜を形成した(図4B)。その後の数日から数週間にわたって、細胞はしっかりと詰まった高度に細胞性の上皮層を形成し、7〜10日後には拍動繊毛および粘液産生の明確な出現があった。サンプルのTEERを計算し、一次細胞対照(700〜1600 Ω xcm2の範囲)と同様である11。パラホルムアルデヒドによるその後の固定(21〜28日目)および正準気道上皮細胞マーカーの免疫標識を、とりわけMUC5ACおよびアセチル化α-チューブリンについて行った(図4C)。全体として、運動性繊毛、粘液産生、および初代HBECと同様の多毛細胞および分泌細胞の確認的免疫染色の観察により、誘導多能性幹細胞から気道上皮細胞を生成することに成功したと結論付けました。
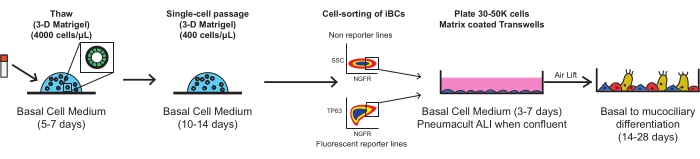
図1:プロトコルの全体的な概略図凍結保存されたiBCは、多孔性膜インサートにメッキする前に解凍、拡張、およびFACS精製され、そこで機能的な粘膜繊毛上皮に分化する。この図の拡大版を表示するには、ここをクリックしてください。

図2:代表的な位相差画像。 (A)1日後、(B)4日後、(C)8日後、および(D)14日後(ちょうどNGFRソート前)の3−D培養におけるiBCsの通常の外観を示す代表的な位相差画像。スケール バーは 500 μm を表します 。この図の拡大版を表示するには、ここをクリックしてください。
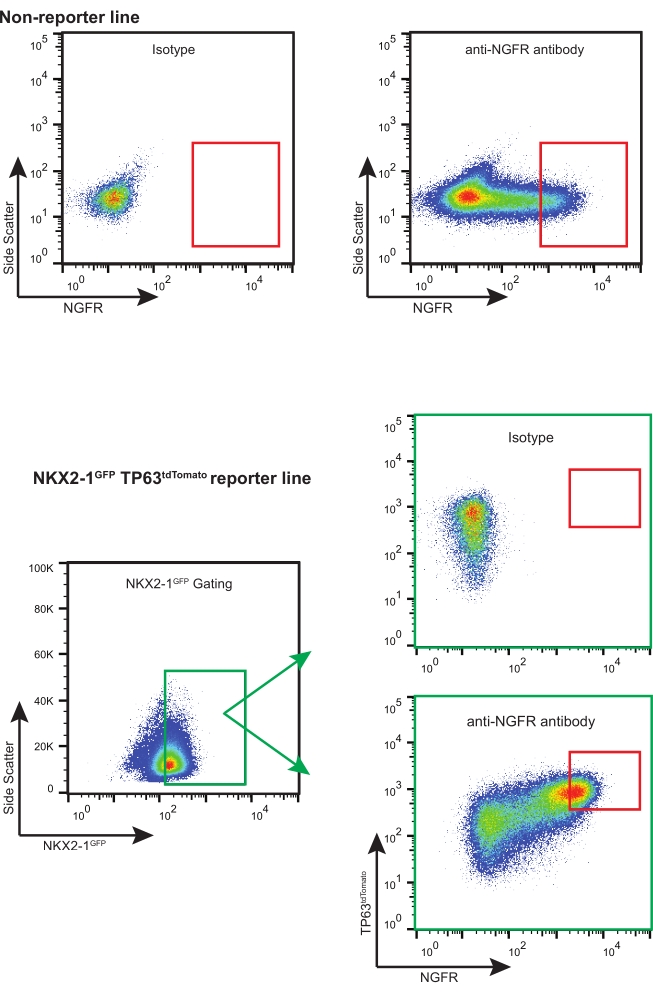
図3:代表的なFACSプロット 代表的なFACSは、非レポーターおよび蛍光レポーターiBCについてプロットする。アイソタイプ対照の例を示し、最も高発現しているNGFR+細胞について選択するために使用した。蛍光レポーター含有iPSC株は、NKX2-1GFP+ TP63 tdTomato + NGFR+細胞に対して「トリプルソート」されています。 この図の拡大版を表示するには、ここをクリックしてください。
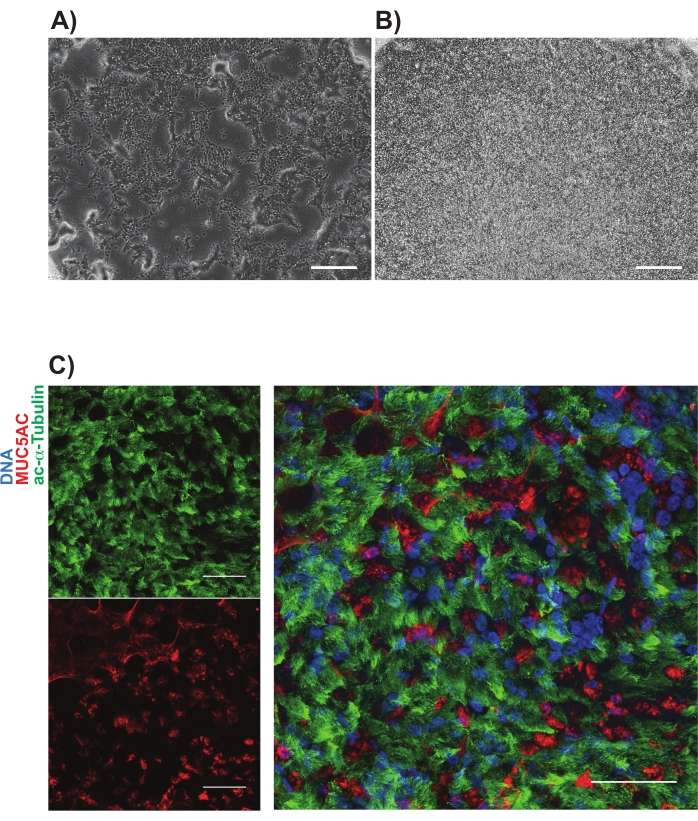
図4:多孔膜上のiBC培養物の代表的な画像。 位相差画像は、(A)めっき後1日目及び (B)めっき後3日目に示されている。(C)に示す粘膜繊毛培養物の代表的な免疫標識;アセチル化アルファチューブリン(緑)およびMUC5AC(赤)。スケール バーは 25 μm を表します 。この図の拡大版を表示するには、ここをクリックしてください。
補足ファイル 1: メディア コンポーネント テーブル。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
HBECは、気道上皮の疾患を研究するためのゴールドスタンダード細胞型である。それらの限界(アクセシビリティと遺伝子操作の難しさを含む)のために、我々はiBCとALIカルチャーの派生のためのプロトコルを作成しました。これらの細胞は、任意のドナーから誘導することができ、独自の遺伝的背景を保持することができるため、基本的な発生研究、疾患モデリング、および新規治療開発が可能になります。
記述されたプロトコルの各ステップは必要ですが、余分な言及に値するものがいくつかあります。第一に、スフェロイドの単一細胞への解離を必要とする各ステップにおいて、過剰なピペッティングを避けることが重要である。酵素消化(ディスパーゼまたはトリプシンによる)は、より良い細胞生存を促進するが、過剰なピペッティングは重大な細胞死をもたらす。第二に、NGFR+ iBCを精製する場合、アイソタイプコントロールの利用が重要であり、FACSでNGFR+細胞を最も多く発現させる細胞を選択することをお勧めします(図3)。このアプローチは、適切な粘液繊毛分化を有する最適なALI培養物をもたらす。最後に、プロトコールに文書化されているように、多孔質膜の調製および播種は、ALI培養生存のための基本である。通常、インサートあたり 30,000 ~ 60,000 個のセルをシードしますが、わずか 20,000 個のセルで成功を収めています。ヒト胚性幹細胞修飾マトリックスコーティングを使用して成功した培養物を生成することができますが、最近ではALI培養の耐久性が有意に高いヒト組換えラミニン-521を使用しています。
ごくまれに、iPSC分化がNGFR+ iBCの適切な割合をアップレギュレートできないことがあります。この場合、iBCの連続継代(3D培養中)は、時間の経過とともにNGFR頻度を増加させる可能性がある。このプロトコルの限界には、これらの細胞を生成するために必要な時間、コスト、および専門知識が含まれます。さらに、多くの研究者が気道上皮のあまり一般的ではない細胞型(例えば、イオン細胞、神経内分泌細胞)に興味を持っていることを認識しています。初代HBEC培養のように、これらの希少な細胞型のいくつかを検出しましたが、これらの細胞を生成するために必要な発生の手がかりに関する不完全な知識のために、再現性よく同定されていません。
書かれているように、上記のプロトコルは、すでに凍結保存されたiBCの解凍から始まります。この凍結保存に先立つ詳細は以前に記載されており、この原稿11,12の範囲を超えている。
当社の気道上皮ALI培養法は、ほぼすべてのドナーから機能的な気道上皮細胞を生成することを可能にします。これにより、疾患モデリング、薬物スクリーニング、将来の細胞ベースの治療に使用できる貴重な遺伝的に制御された気道上皮細胞へのアクセスが大幅に向上し、気道上皮内の発生パターンの理解が向上します。
開示事項
著者らは開示していない。
謝辞
ホーキンス、コットン、デイビスの各研究所のメンバーの皆様には、このプロジェクトやその他のプロジェクトに関して、長年にわたる有益なご意見をいただき、感謝いたします。また、ブライアン・ティルトン(BU細胞選別ディレクター)の献身と技術的専門知識に恩義を感じており、ボストン大学再生医療センター(CReM)のグレッグ・ミラーとマリアンヌ・ジェームズには、NIH助成金NO1 75N92020C00005およびU01TR001810の支援を受けた患者固有のiPSCのメンテナンスと特性評価におけるサポートと技術的専門知識に感謝しています。この研究は、NIH助成金U01HL148692、U01HL134745、U01HL134766、およびR01HL095993からD.N.K.、R01HL139876からB.R.D、R01 HL139799からF.H.、および嚢胞性線維症財団(CFF)がCFF 00987G220およびCFF WANG20GOをD.N.K.、CFF DAVIS15XX1、DAVIS17XX0、DAVIS19XX0からB.R.D、CFF SUZUKI19XX0をS.S.、CFF BERICA2010からA.B.に助成金を支給しました。 CFF HAWKIN20XX2 から F.H.
資料
| Name | Company | Catalog Number | Comments |
| 12-well tissue culture treated plate | Corning | 3515 | flat bottom |
| 3-D growth factor reduced Matrigel | Corning | 356230 | |
| A83-01 | ThermoFisher Scientific | 293910 | |
| Cell culture inserts (Transwell) | Corning | 3470 | 6.5mm diameter; 0.4μm pore size |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | |
| Dispase II, Powder | ThermoFisher Scientific | 17105-041 | |
| DMH1 | ThermoFisher Scientific | 412610 | |
| Dulbecco's Modified Eagle Medium/Nutrient Mixture (DMEM):F-12 | ThermoFisher Scientific | 11330-032 | |
| Dulbecco's Phosphate Buffered Saline (PBS) (1X) | Gibco | 14190-144 | |
| Ethylenediaminetetraacetic acid disodium salt solution (EDTA) | Sigma | E7889 | |
| Fetal Bovine Serum (FBS) | Fisher | SH3007003E | |
| Hanks' Balanced Salt Solution (HBSS) | ThermoFisher Scientific | 14175-079 | |
| HEPES | Sigma | H3375 | |
| hESC-qualified Matrigel | Corning | 354277 | |
| Mouse IgG1kappa isotype control, APC-conjugated | Biolegend | 400122 | |
| Mouse monoclonal anti-human CD271/NGFR, APC-conjugated | Biolegend | 345108 | |
| PneumaCult-ALI Medium (ALI Differentiation Medium) | StemCell Technologies | 05001 | |
| PneumaCult-Ex Plus Medium (Basal Cell Base Medium) | StemCell Technologies | 05040 | |
| Primocin | InvivoGen | ant-pm-2 | |
| rhLaminin-521 | ThermoFisher Scientific | A29248 | Final Concentration: 10ug/mL |
| Trypsin-EDTA Solution, 0.05% | Invitrogen | T3924 | |
| Y-27632 | Tocris | 1254 |
参考文献
- GBD Chronic Respiratory Disease Collaborators. Prevalence and attributable health burden of chronic respiratory diseases, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. The Lancet. Respiratory Medicine. 8 (6), 585-596 (2020).
- Alysandratos, K. -. D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Medicine. 107, 183-206 (2005).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Takahashi, K., et al. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131 (5), 861-872 (2007).
- Berical, A., Lee, R. E., Randell, S. H., Hawkins, F. Challenges facing airway epithelial cell-based therapy for cystic fibrosis. Frontiers in Pharmacology. 10, 74 (2019).
- Jacob, A., et al. Derivation of self-renewing lung alveolar epithelial type II cells from human pluripotent stem cells. Nature Protocols. 14 (12), 3303-3332 (2019).
- Gotoh, S., et al. Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Reports. 3 (3), 394-403 (2014).
- Huang, S. X. L., et al. Efficient generation of lung and airway epithelial cells from human pluripotent stem cells. Nature Biotechnology. 32 (1), 84-91 (2013).
- Mou, H., et al. Generation of multipotent lung and airway progenitors from mouse ESCs and patient-specific cystic fibrosis iPSCs. Cell Stem Cell. 10 (4), 385-397 (2012).
- Hawkins, F. J., et al. Derivation of airway basal stem cells from human pluripotent stem cells. Cell Stem Cell. 28 (1), 79-95 (2021).
- Suzuki, S., et al. Differentiation of human pluripotent stem cells into functional airway basal stem cells. STAR Protocols. 2 (3), 100683 (2021).
- Rock, J. R., et al. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12771-12775 (2009).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved