Method Article
Generación de cultivos de interfaz aire-líquido de células epiteliales de las vías respiratorias a partir de células madre pluripotentes humanas
En este artículo
Resumen
Los avances recientes en los protocolos de diferenciación de células madre pluripotentes inducidas por humanos permiten la derivación gradual de tipos de células específicas de órganos. Aquí, proporcionamos pasos detallados para el mantenimiento y la expansión de las células basales de las vías respiratorias derivadas de iPSC y su diferenciación en un epitelio mucociliar en cultivos de interfaz aire-líquido.
Resumen
Las enfermedades de las vías respiratorias conductoras como el asma, la fibrosis quística (FQ), la discinesia ciliar primaria (PCD) y las infecciones respiratorias virales son las principales causas de morbilidad y mortalidad en todo el mundo. Las plataformas in vitro que utilizan células epiteliales bronquiales humanas (HBEC) han sido fundamentales para nuestra comprensión del epitelio de las vías respiratorias en la salud y la enfermedad. El acceso a los HPBC de personas con enfermedades genéticas raras o mutaciones raras es un cuello de botella en la investigación pulmonar.
Las células madre pluripotentes inducidas (iPSC) se generan fácilmente mediante la "reprogramación" de células somáticas y conservan el trasfondo genético único del donante individual. Los avances recientes permiten la diferenciación dirigida de iPSCs a células progenitoras epiteliales pulmonares, células alveolares tipo 2, así como las células del epitelio conductor de las vías respiratorias a través de células basales, las principales células madre de las vías respiratorias.
Aquí esbozamos un protocolo para el mantenimiento y la expansión de las células basales de las vías respiratorias derivadas de iPSC (en adelante, iBC), así como su diferenciación de trilinaje en cultivos de interfaz aire-líquido (ALI). Los iBC se mantienen y expanden como esferas epiteliales suspendidas en gotas de matriz extracelular cultivadas en un medio primario de células basales suplementado con inhibidores de las vías de señalización TGF-ß y BMP. Los iBC dentro de estas esferas epiteliales expresan marcadores basales clave TP63 y NGFR, pueden purificarse mediante clasificación celular activada por fluorescencia (FACS) y, cuando se chapan en membranas porosas en condiciones de cultivo ALI estándar, diferenciarse en un epitelio funcional de las vías respiratorias. Los cultivos ali derivados de donantes sanos están compuestos de células basales, secretoras y multiciliadas y demuestran integridad de barrera epitelial, cilios móviles y secreción de moco. Los cultivos derivados de individuos con FQ o PCD recapitulan el transporte disfuncional de cloruro mediado por CFTR o los cilios inmóviles, los respectivos defectos epiteliales causantes de la enfermedad.
Aquí, presentamos un protocolo para la generación de células humanas que se puede aplicar para modelar y comprender las enfermedades de las vías respiratorias.
Introducción
Las enfermedades pulmonares crónicas representan una gran carga de morbilidad y mortalidad en todo el mundo1. Las afecciones que afectan las vías respiratorias conductoras, como el asma, la fibrosis quística (FQ), la discinesia ciliar primaria (PCD) y las infecciones virales representan enfermedades comunes y más raras, adquiridas y genéticas, que contribuyen a esta carga mundial. Las principales funciones de las vías respiratorias conductoras son: 1) actuar como un conducto para el flujo laminar de aire, y 2) proporcionar la eliminación mucociliar de patógenos y desechos. Las células secretoras, multiciliadas y basales representan los principales tipos de células epiteliales de la vía aérea conductora. Los tipos de células epiteliales más raras incluyen ionocitos, células de mechón y células neuroendocrinas, y se han revisado en otros lugares2.
En términos generales, una barrera importante para comprender los mecanismos de la enfermedad y avanzar en los enfoques terapéuticos ha sido la falta constante de tejido primario humano para su uso en modelos preclínicos. Los HPBC generalmente se consideran el modelo in vitro estándar de oro de la biología epitelial de las vías respiratorias humanas y han desempeñado un papel clave en la investigación de la FQ en particular3. Sin embargo, generalmente se aíslan de biopsias broncoscópicas, de tejido pulmonar después de la cirugía o de pulmones rechazados para fines de trasplante. El acceso a los HBAC de las personas con enfermedades genéticas, incluidas las prioridades de investigación de la FQ y la PCD, es poco frecuente e impredecible. Es necesario superar este cuello de botella para las células epiteliales de las vías respiratorias derivadas del paciente. Las iPSC se generan fácilmente a partir de cualquier individuo, conservan los antecedentes genéticos únicos del donante y tienen una notable capacidad para proliferar y sobrevivir a largo plazo en condiciones de cultivo celular 4,5,6. Al recapitular los pasos embriologías clave, las iPSC se someten a una "diferenciación dirigida" en tipos de células específicas de órganos. Nosotros y otros hemos desarrollado protocolos para generar progenitores pulmonares derivados de iPSC, células alveolares tipo 2 7,8 y las células de la vía aérea conductora, incluidas las células basales de las vías respiratorias 9,10,11,12.
La célula basal de la vía aérea es la célula madre de la vía aérea conductora13. En un trabajo publicado anteriormente, nuestro grupo ha generado células epiteliales de las vías respiratorias derivadas de iPSC, incluido un subconjunto (iBC) que expresa marcadores canónicos de células basales que incluyen TP63, KRT5 y NGFR. Siguiendo las señales de la biología de las células basales adultas, la inhibición de las vías duales SMAD (TGF-β y BMP) conduce a la regulación al alza de ngfr + iBC11,14. Los NGFR+ iBC se resuspenden como células individuales en gotas de matriz extracelular y se cultivan en un medio de células basales. Se autorrenovan para mantener una población de iBC y forman esferoides epiteliales; sin embargo, una proporción también se diferencia en células secretoras en este formato (denominado cultivo 3D). En el siguiente protocolo, detallamos los pasos para mantener y expandir estos iBC en cultivo 3-D, así como los pasos necesarios para generar un cultivo ALI mucociliar 2-D funcional.
Los pasos iniciales de este protocolo de diferenciación han sido publicados previamente y no serán revisados aquí11,12. Este manuscrito se centrará en la expansión y purificación de los iBC y su posterior diferenciación en células secretoras funcionales y multiciliadas en cultivo ALI.
Protocolo
Cada uno de los siguientes pasos debe realizarse utilizando una técnica estéril en una campana de flujo laminar de nivel 2 de bioseguridad. Todos los medios deben calentarse a temperatura ambiente (22 °C) antes de agregarse a las celdas, excepto cuando se indique específicamente lo contrario. Cada paso de centrifugación debe realizarse a temperatura ambiente (aproximadamente 22 °C). La figura 1 describe los esquemas del protocolo.
1. Preparación de los medios requeridos
NOTA: Consulte el Archivo complementario 1 para obtener más información.
- Medio de células basales
- Prepare el medio base de acuerdo con las instrucciones del fabricante.
- A cada 50 ml del medio base, agregue 5 μL de A83-01 (10 mM), 5 μL de DMH1 (10 mM), 50 μL de Y-27632 (10mM) y 100 μL de Primocina (50 mg/mL). En lo sucesivo, este medio se denomina medio de células basales.
- Conservar a 4 °C durante un máximo de 1 mes.
- Medio de diferenciación ALI
- Prepare el medio de acuerdo con las instrucciones del fabricante.
- Por cada 50 ml de ali diferenciador medio, añadir 100 μL de primocina (50 mg/ml).
- Conservar protegido de la luz a 4 °C durante un máximo de 1 mes.
- Ordenar búfer
- Por cada 50 ml de tampón de clasificación, combine 47,5 ml de solución salina equilibrada de Hanks, 1 ml de FBS, 200 μL de EDTA (500 mM), 1,25 ml de tampón HEPES (1 M), 50 μL de Y-27632 (10 mM) y 100 μL de primocina (50 mg/ml).
- Esterilizar el filtro utilizando un tamaño de poro de 0,4 μm.
- Conservar a 4 °C durante un máximo de 1 mes.
- Medio de criopreservación
- Por cada 50 ml de medio de criopreservación, combine 45 ml de medio de células basales y 5 ml de dimetilsulfóxido (DMSO).
- Esterilizar el filtro utilizando un tamaño de poro de 0,4 μm.
- Conservar a 4 °C durante un máximo de 1 mes.
2. Descongelación de iBC criopreservados
- Descongelar (sobre hielo) un volumen suficiente de factor de crecimiento 3-D reduce la matriz extracelular (en adelante matriz 3-D). Mantener en hielo hasta que esté listo para su uso.
NOTA: Al descongelar un vial (que contiene 250.000 células), descongelar 100-200 μL de matriz 3D. - Descongele un vial de suspensiones unicelulares de iBC previamente criopreservadas incubando en un baño de agua o perlas a 37 °C hasta que no haya medios congelados visibles (1-2 min).
- Usando una pipeta serológica de 5 ml, agregue suspensión celular a un tubo cónico de 15 ml.
- Agregue 6-10 ml de DMEM / F12 gota a gota a la suspensión celular, mezcle suavemente y centrífique a 300 x g durante 5 minutos para granular las células.
- Aspire el sobrenadante y resuspenda el pellet celular en 1 mL de Basal Cell Medium con una micropipeta P1000. Retire una alícuota de 10 μL y realice un recuento de células.
- Centrifugar las células a 300 x g durante 5 min. Aspirar el sobrenadante y resuspendir las células a una densidad de 4.000 células/μL en una matriz 3-D previamente descongelada con una micropipeta P1000.
NOTA: Es fundamental evitar agregar burbujas a la matriz 3D. Pipetear la matriz lenta y cuidadosamente. - Con una micropipeta P200, agregue una gota (25 o 50 μL) a la base de cada pocillo de una placa tratada con cultivo de tejido de 12 pocillos. Si se comienza con 250.000 células congeladas, el número esperado de gotas en este paso es de entre 3-4 (gotas de 25 μL), dependiendo de la viabilidad celular.
- Incubar la placa a 37 °C durante aproximadamente 15 min, y luego agregar suficiente Medio de Células Basales a cada pocillo para sumergir completamente la gota (1.5 mL para 50 μL; 1 mL para 25 μL), usando una pipeta serológica de 5 mL. Devuelva la placa a una incubadora humidificada.
- Alimente las células cada 2 días usando un medio de células basales fresco. Agregue medio fresco al costado del pozo con pipeta serológica de 5 ml, teniendo cuidado de no perturbar la gota de células.
NOTA: La densidad de células chapadas en esta etapa es 10 veces mayor que la pasivación rutinaria de iBC en la sección 3.
3. Disociación de esferoides y expansión de iBCs en cultivo 3-D
- Descongelar (sobre hielo) un volumen suficiente de matriz 3D. Mantener en hielo hasta que esté listo para su uso.
NOTA: El volumen de matriz 3D requerido variará según la cantidad de celdas que el usuario requerirá. - Aproximadamente 5-7 días después, aspire el medio de cada pozo y con una micropipeta P1000, agregue 1 mL de Dispasa II (1 U / mL) directamente sobre los esferoides para disociarse de la gota de la matriz.
- Coloque la placa en una incubadora de 37 °C durante 10-15 min.
- Usando una micropipeta P1000, pipetee el Dispase hacia arriba y hacia abajo 1-2 veces, rompiendo grandes grupos de matriz 3D. Devuelva la placa a 37 °C durante 30-40 minutos adicionales, permitiendo que la matriz se disuelva por completo.
- Cuando la gota de la matriz 3D ya no sea visible bajo el microscopio de luz, agregue los esferoides que flotan libremente a una cónica de 15 ml utilizando una punta de pipeta serológica de 5 ml. Añadir DMEM/F12 para un volumen final de 10 mL por cónico y centrífuga a 200 x g durante 3 min para granular los esferoides.
- Aspire el sobrenadante y agregue 1 ml de tripsina al 0,05% (37 °C) por cada gota inicial disociada (por ejemplo, si comienza con cuatro gotas, agregue 4 ml de tripsina al matraz cónico).
- Incubar a 37 °C, triturando con frecuencia (cada 2-3 min).
- Evalúe con el microscopio de luz cada pocos minutos. Una vez que la mayoría (>90%) de los esferoides se han disociado a células individuales, agregue 10% de suero bovino fetal (en DMEM / F12) a una relación de volumen de 1: 1 a la tripsina.
- Filtre las células a través de un colador de células de 40 μm y centrífuga a 300 x g durante 5 min.
- Realice un recuento de células y resuspenda uniformemente las células a una densidad de 400 células/ μL de matriz 3D descongelada. Evite introducir burbujas de aire. Resusponga tantas gotas como sea necesario para la aplicación posterior. Repita el paso 2.6-2.9 para cada pozo.
4. Evaluación y purificación de NGFR+ iBCs
- Después de 10-14 días del paso más reciente, disocie los esferoides a una suspensión de una sola célula como en los pasos 3.2-3.5 y realice un recuento celular.
NOTA: Las diferentes líneas iPSC se comportan de manera diferente; por lo tanto, el rango de 10-14 días puede variar para diferentes iBC. Consulte la Figura 2 para conocer las apariencias típicas de los iBC 3D después de 1, 4, 8 y 14 días, cuando son adecuados para la clasificación de células NGFR+. La clasificación antes de lo recomendado (por ejemplo, el día 8 como en la Figura 2C), da como resultado un número general de células más bajo con una expresión de NGFR menos frecuente. La clasificación más tarde de lo recomendado (por ejemplo, más de 14 días después del paso más reciente) conduce a una supervivencia celular posterior a la clasificación deficiente. - Resuspendir las células a una densidad de 1 x 106 celdas/100 μL en Sort Buffer (población principal). Transfiera una pequeña alícuota (25-50 μL) a un tubo separado (población menor).
- Añadir anticuerpos conjugados anti-NGFR (dilución 1:100) a la población celular principal.
- Agregue anticuerpos de control de isotipos (dilución 1:200) a la población de células menores.
- Proteja las células de la luz y manténgalas en hielo durante 30 minutos, triturando intermitentemente (cada 5-10 minutos) las células para evitar la peletización.
- Después de 30 minutos, agregue el búfer de clasificación en una proporción de 1: 1 a cada tubo de celdas. Células centrífugas a 300 x g durante 5 min.
- Aspire el sobrenadante, resuspenda las células peletizadas en el Sort Buffer a una densidad de 10 x 106 células/ml, y agregue la tinción de células vivas o muertas.
- Utilizando la estrategia de cierre NGFR+ adecuada (basada en el control de isotipos, consulte la Figura 3), clasifique suficientes células NGFR+ vivas para las aplicaciones posteriores necesarias.
NOTA: Si se utilizan iBC con reporteros fluorescentes (es decir, NKX2-1GFP TP63tdTomato), se recomienda clasificar las células "triple positivas" (es decir, NKX2-1GFP+, TP63tdTomato+, NGFR+), con la selección y compensación de compuerta adecuadas (Figura 3). Durante esta expansión de iBCs, una proporción de células se diferencian en células secretoras y también se puede detectar una proporción muy pequeña de células multiciliadas. Ambas poblaciones son NGFR-.
5. Generación de cultivos mucociliarios ALI
- Prepare insertos de membrana porosa de 6,5 mm agregando una matriz de 200 μL a la cámara apical (matriz calificada para células madre embrionarias humanas o laminina-521 humana recombinante) según las instrucciones del fabricante.
- Colocar a 37 °C durante al menos 2 h antes de que sea necesario.
- Aspire la matriz de recubrimiento desde la cámara apical del inserto. Añadir 500 μL del medio de células basales a la cámara basolateral.
- Resusped al menos 30.000 células NGFR+ clasificadas (a partir del paso 4.5) en un medio de células basales de 100-200 μL y transferirlas a la cámara apical utilizando una micropipeta P200. Repita para tantos pozos como desee (y celdas disponibles). Coloque la placa en una incubadora humidificada a 37 °C.
- En 2-3 días, aspirar cámaras apicales y basolaterales y alimentar con Medio basolateral fresco (500 μL a apical, 100 μL a basolateral).
- Monitoree la cámara apical diariamente con microscopía de luz. Cuando las células estén >80% confluentes (típicamente 3-7 días), reemplace el Medio de Células Basales con el Medio de Diferenciación ALI (no precalentado) en las cámaras apical y basolateral. Cuando trabaje con ALI Differentiation Medium, protéjase de la luz manteniendo los contenedores de medios envueltos en papel de aluminio y apagando las luces superiores cuando sea posible.
- Al día siguiente, aspire el medio desde la cámara apical, exponiendo así la superficie apical al aire.
- Reemplace el medio de diferenciación ALI en la cámara basolateral cada 2-3 días.
- Monitoree la apariencia del cultivo cada 1-2 días. Aspire cuidadosamente cualquier líquido acumulado de la cámara apical, sin perturbar la capa celular.
- Evaluar la resistencia eléctrica transepitelial (TEER) para la integridad epitelial.
NOTA: TEER se puede evaluar en los días posteriores a la exposición al aire para dar una lectura de la integridad de la capa epitelial. No se ha establecido el momento ideal para medir el TEER, aunque los valores consistentes con la diferenciación mucociliar de alta calidad suelen ser >500 x cm2. - Si es necesario eliminar los desechos o el moco, agregue suavemente 100 μL PBS (sin Ca2+ o Mg2+) a la cámara apical. Incubar a 37 °C durante 10 min, y luego aspirar cuidadosamente PBS.
- Después de 7-10 días de exposición al aire, los cilios móviles suelen aparecer y se pueden ver usando microscopía de luz. Dependiendo del experimento planificado y la lectura, las células se pueden analizar después de 14-28 días de exposición al aire.
NOTA: Si se han utilizado células reporteras fluorescentes, y si hay un microscopio fluorescente de células vivas disponible, las células se pueden rastrear con microscopía de luz, así como con fluorescencia de reportero.
6. Criopreservación opcional (pero recomendada) de iBCs
- Después de 10-14 días del paso de cultivo 3-D más reciente, disocie los esferoides a la suspensión unicelular como en los pasos 3.2-3.5. Realice un recuento de celdas.
- Resuspend en Medio de Criopreservación a una densidad de 250.000 células/500 μL en un criovial.
- Coloque los crioviales en un recipiente para garantizar una caída constante de la temperatura (1 ° C / min) y transfiera a -80 ° C durante 24-48 h, seguido de la transferencia a -150 ° C para el almacenamiento a largo plazo.
NOTA: Se ha realizado una criopreservación repetida, así como la criopreservación de células previamente clasificadas con NGFR+, pero estas no se han evaluado adecuadamente para determinar la viabilidad celular y la capacidad de formar cultivos ALI funcionales. Especialmente con el pasaje celular prolongado, se recomienda evaluar el cariotipo, ya que se ha observado que varía en iPSC y células derivadas de iPSC.
Resultados
Siguiendo este protocolo, 200.000 iBC criopreservados (previamente confirmados con un cariotipo 46XY normal)11 fueron descongelados y expandidos en cultivo 3D. Cinco días después, los esferoides resultantes se disociaron, se contaron y se volvieron a pasar para una mayor expansión. Se obtuvieron aproximadamente 480.000 células y se volvieron a suspender en matriz 3D (gotas de 12 x 50 μL, densidad 400 células/μL). Fresh Basal Cell Medium se aplicó cada 2-3 días. Diez días después, las células se disociaron y contaron una vez más. Un total de 19,7 x 106 células fueron cosechadas y preparadas para FACS. 106 células se tiñeron con el control de isotipo IgG1κ conjugado con APC y las 18,7 x 106 células restantes se tiñeron con el anticuerpo anti-NGFR conjugado con APC durante 30 min protegido de la luz (Figura 3).
NgFR+ gating se realizó después de la comparación con las células de control de isotipo y se estableció a propósito para recolectar las células NGFR+ de mayor expresión (Figura 3). Con esta técnica de gating, el 28% de las células individuales vivas eran NGFR+. Si bien había más células disponibles, se recolectaron 750,000 células para el cultivo posterior. Las células clasificadas se resuspendieron en basal Cell Medium a una concentración de 50.000 células/100 μL. Luego se sembraron 50.000 células en cada inserto de membrana porosa de 6,5 mm, que había sido recubierto con laminina-521 recombinante humana (2 μg/200 μL) según las directrices del fabricante. Se añadieron 500 μL de medio de células basales a la cámara basolateral de cada inserto y la placa se colocó en una incubadora humidificada a 37 °C. Tres días después, se aspiraron los medios en la cámara apical y las células fueron ~ 90% confluentes por microscopía de luz (Figura 4B). Se aspiraron los medios de la cámara basolateral; Se agregó ali diferenciador medio a las cámaras apical (100 μL) y basolateral (500 μL). Al día siguiente, los medios de comunicación de la cámara apical fueron aspirados.
Durante los siguientes 21 días, las células fueron evaluadas por microscopía de luz periódicamente y alimentadas con medio de diferenciación ALI fresco (cámara basolateral solamente) cada 2-3 días. Las células individuales fueron inicialmente fácilmente identificables (Figura 4A), tenían una apariencia alargada y en forma de huso, y formaban una monocapa suelta (Figura 4B). Durante los días o semanas posteriores, las células formaron una capa epitelial altamente empaquetada, altamente celular, y después de 7-10 días hubo la clara aparición de cilios y producción de moco. Se calculó el TEER de las muestras y similar a los controles celulares primarios (rango de 700-1600 Ω x cm2)11. Posterior fijación (día 21-28) con paraformaldehído e inmunoetiquetado para marcadores canónicos de células epiteliales de la vía aérea para MUC5AC y acetilado-α-tubulina, entre otros (Figura 4C). En general, con nuestra observación de los cilios móviles, la producción de moco, así como la inmunotinción confirmatoria de células multiciliadas y secretoras que es similar a la de los HBEC primarios, concluimos que generamos con éxito células epiteliales de las vías respiratorias a partir de células madre pluripotentes inducidas.
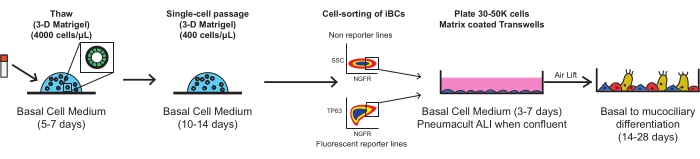
Figura 1: Esquema general del protocolo. Los iBC criopreservados se descongelan, expanden y purifican facS antes del recubrimiento en insertos de membrana porosa, donde se diferencian en un epitelio mucociliar funcional. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Imágenes representativas de contraste de fase. Imágenes de contraste de fase representativas que demuestran la apariencia habitual de iBC en cultivo 3D después de (A) 1 día, (B) 4 días, (C) 8 días y (D) 14 días (solo pre-NGFR). Las barras de escala representan 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
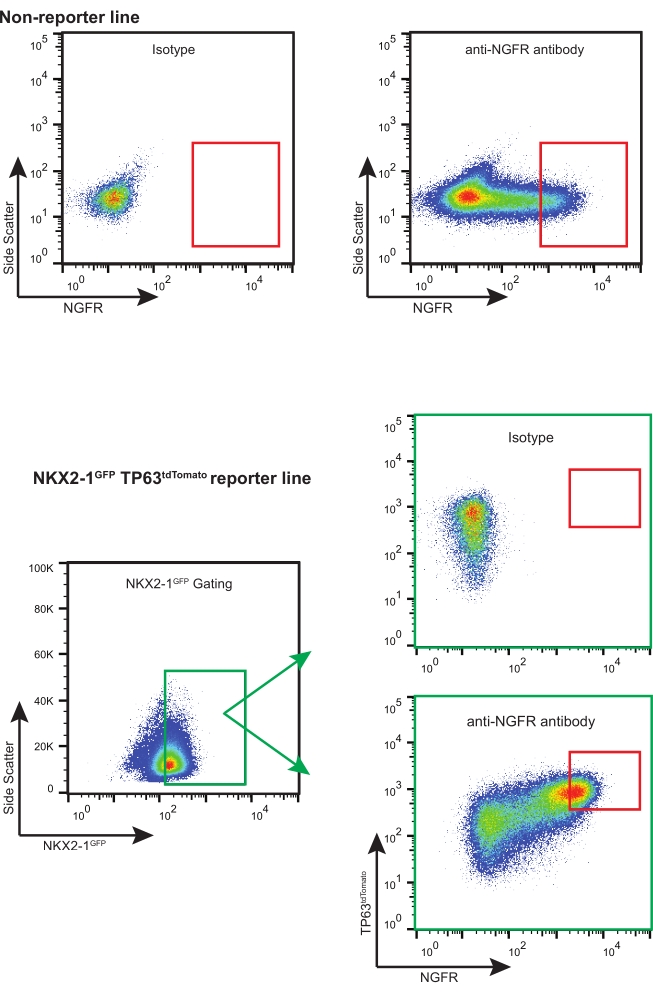
Figura 3: Gráficos FACS representativos. Gráficos representativos de FACS para iBC no reporteros y reporteros fluorescentes. Se muestran ejemplos de controles de isotipo que se utilizaron para seleccionar las células NGFR+ de mayor expresión. Las líneas iPSC que contienen reportero fluorescente están "triplemente clasificadas" para las células NKX2-1GFP+ TP63tdTomato+ NGFR+. Haga clic aquí para ver una versión más grande de esta figura.
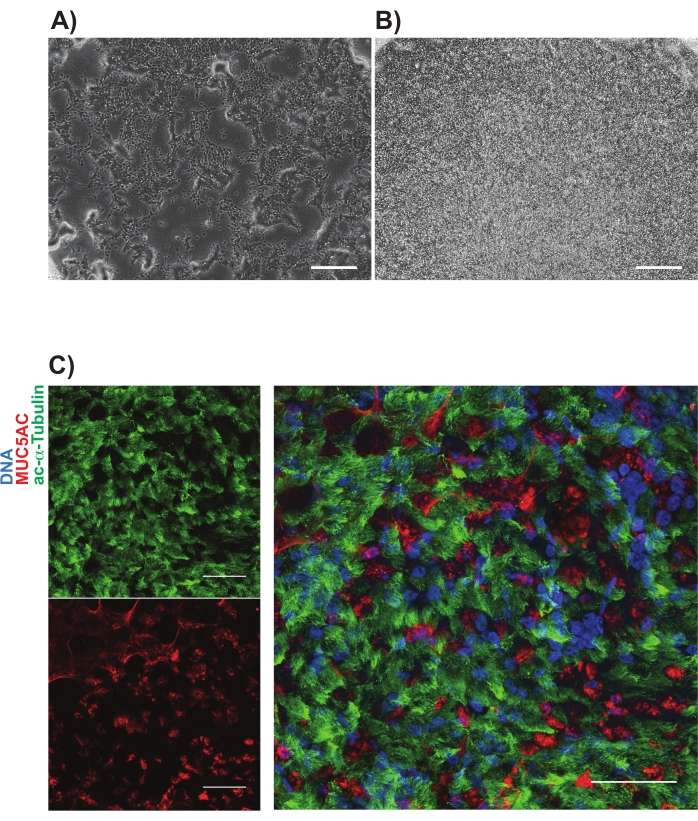
Figura 4: Imágenes representativas de cultivos iBC sobre membranas porosas. Las imágenes de contraste de fase se muestran (A) 1 día y (B) 3 días después del emplatado. Inmunomarcaje representativo de cultivos mucociliares mostrados en (C); tubulina alfa acetilada (verde) y MUC5AC (rojo). Las barras de escala representan 25 μm. Haga clic aquí para ver una versión más grande de esta figura.
Archivo complementario 1: Tabla de componentes multimedia. Haga clic aquí para descargar este archivo.
Discusión
Los HBEC son el tipo de célula estándar de oro para estudiar enfermedades del epitelio de las vías respiratorias. Debido a sus limitaciones (incluyendo accesibilidad y dificultad para manipular genéticamente), hemos generado un protocolo para la derivación de iBCs y cultivos ALI. Estas células pueden derivarse de cualquier donante y conservar su trasfondo genético único, lo que permite estudios básicos de desarrollo, modelado de enfermedades y desarrollo terapéutico novedoso.
Si bien cada paso individual del protocolo descrito es necesario, hay varios que merecen una mención adicional. En primer lugar, en cada paso que requiere la disociación de los esferoides en células individuales, es fundamental evitar el pipeteo excesivo; La digestión enzimática (con dispasa o tripsina) promueve una mejor supervivencia celular, mientras que el pipeteo excesivo conduce a una muerte celular significativa. En segundo lugar, al purificar NGFR+ iBC, la utilización del control de isotipos es crucial y recomendamos seleccionar las células NGFR+ de mayor expresión con FACS (Figura 3). Este enfoque da como resultado cultivos ALI óptimos con diferenciación mucociliar adecuada. Finalmente, la preparación y siembra de membranas porosas precisamente como se documenta en el protocolo es fundamental para la supervivencia del cultivo ALI. Si bien normalmente sembramos de 30,000 a 60,000 células por inserto, hemos tenido éxito con tan solo 20,000 células. Si bien se pueden generar cultivos exitosos utilizando el recubrimiento de matriz calificado para células madre embrionarias humanas, más recientemente hemos utilizado laminina-521 recombinante humana con una durabilidad significativamente mayor de los cultivos ALI.
En muy raras ocasiones, las diferenciaciones de iPSC pueden no regular al alza un porcentaje adecuado de iBC NGFR+. En este caso, el paso en serie de iBC (en cultivo 3D) puede resultar en un aumento de la frecuencia de NGFR con el tiempo. Las limitaciones de este protocolo incluyen el tiempo, el costo y la experiencia necesarios para generar estas células. Además, reconocemos que muchos investigadores están interesados en los tipos de células menos comunes del epitelio de las vías respiratorias (por ejemplo, ionocitos, células neuroendocrinas). Si bien hemos detectado algunos de estos tipos de células más raras, como en los cultivos primarios de HBEC, no se identifican de manera reproducible, probablemente debido a un conocimiento incompleto con respecto a las señales de desarrollo requeridas para generar estas células.
Tal como está escrito, el protocolo anterior comienza con la descongelación de iBC ya criopreservados. Los detalles previos a esta criopreservación están descritos previamente y más allá del alcance de este manuscrito11,12.
Nuestro método de cultivo de ALI epitelial de las vías respiratorias permite la generación de células epiteliales funcionales de las vías respiratorias de casi cualquier donante. Esto aumenta en gran medida la accesibilidad a las preciosas células epiteliales de las vías respiratorias controladas genéticamente que pueden usarse para el modelado de enfermedades, la detección de medicamentos, futuras terapias basadas en células, así como para mejorar la comprensión del patrón de desarrollo dentro del epitelio de las vías respiratorias.
Divulgaciones
Los autores no tienen revelaciones.
Agradecimientos
Agradecemos a los miembros de los laboratorios Hawkins, Kotton y Davis por sus útiles aportes a lo largo de los años con respecto a este y otros proyectos. También estamos en deuda con Brian Tilton (Director de Clasificación celular de BU) por su dedicación y experiencia técnica, y estamos agradecidos con Greg Miller y Marianne James del Centro de Medicina Regenerativa de la Universidad de Boston (CReM) por su apoyo y experiencia técnica en el mantenimiento y caracterización de iPSC específicos del paciente, respaldados por las subvenciones NIH NO1 75N92020C00005 y U01TR001810. Este trabajo fue apoyado por las subvenciones de los NIH U01HL148692, U01HL134745, U01HL134766 y R01HL095993 a D.N.K, R01HL139876 a B.R.D, R01 HL139799 a F.H., y las subvenciones de la Fundación de Fibrosis Quística (CFF) CFF 00987G220 y CFF WANG20GO a D.N.K, CFF DAVIS15XX1, DAVIS17XX0, DAVIS19XX0 a B.R.D, CFF SUZUKI19XX0 a S.S, CFF BERICA2010 a A.B., y CFF HAWKIN20XX2 a F.H.
Materiales
| Name | Company | Catalog Number | Comments |
| 12-well tissue culture treated plate | Corning | 3515 | flat bottom |
| 3-D growth factor reduced Matrigel | Corning | 356230 | |
| A83-01 | ThermoFisher Scientific | 293910 | |
| Cell culture inserts (Transwell) | Corning | 3470 | 6.5mm diameter; 0.4μm pore size |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | |
| Dispase II, Powder | ThermoFisher Scientific | 17105-041 | |
| DMH1 | ThermoFisher Scientific | 412610 | |
| Dulbecco's Modified Eagle Medium/Nutrient Mixture (DMEM):F-12 | ThermoFisher Scientific | 11330-032 | |
| Dulbecco's Phosphate Buffered Saline (PBS) (1X) | Gibco | 14190-144 | |
| Ethylenediaminetetraacetic acid disodium salt solution (EDTA) | Sigma | E7889 | |
| Fetal Bovine Serum (FBS) | Fisher | SH3007003E | |
| Hanks' Balanced Salt Solution (HBSS) | ThermoFisher Scientific | 14175-079 | |
| HEPES | Sigma | H3375 | |
| hESC-qualified Matrigel | Corning | 354277 | |
| Mouse IgG1kappa isotype control, APC-conjugated | Biolegend | 400122 | |
| Mouse monoclonal anti-human CD271/NGFR, APC-conjugated | Biolegend | 345108 | |
| PneumaCult-ALI Medium (ALI Differentiation Medium) | StemCell Technologies | 05001 | |
| PneumaCult-Ex Plus Medium (Basal Cell Base Medium) | StemCell Technologies | 05040 | |
| Primocin | InvivoGen | ant-pm-2 | |
| rhLaminin-521 | ThermoFisher Scientific | A29248 | Final Concentration: 10ug/mL |
| Trypsin-EDTA Solution, 0.05% | Invitrogen | T3924 | |
| Y-27632 | Tocris | 1254 |
Referencias
- GBD Chronic Respiratory Disease Collaborators. Prevalence and attributable health burden of chronic respiratory diseases, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. The Lancet. Respiratory Medicine. 8 (6), 585-596 (2020).
- Alysandratos, K. -. D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Medicine. 107, 183-206 (2005).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Takahashi, K., et al. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131 (5), 861-872 (2007).
- Berical, A., Lee, R. E., Randell, S. H., Hawkins, F. Challenges facing airway epithelial cell-based therapy for cystic fibrosis. Frontiers in Pharmacology. 10, 74 (2019).
- Jacob, A., et al. Derivation of self-renewing lung alveolar epithelial type II cells from human pluripotent stem cells. Nature Protocols. 14 (12), 3303-3332 (2019).
- Gotoh, S., et al. Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Reports. 3 (3), 394-403 (2014).
- Huang, S. X. L., et al. Efficient generation of lung and airway epithelial cells from human pluripotent stem cells. Nature Biotechnology. 32 (1), 84-91 (2013).
- Mou, H., et al. Generation of multipotent lung and airway progenitors from mouse ESCs and patient-specific cystic fibrosis iPSCs. Cell Stem Cell. 10 (4), 385-397 (2012).
- Hawkins, F. J., et al. Derivation of airway basal stem cells from human pluripotent stem cells. Cell Stem Cell. 28 (1), 79-95 (2021).
- Suzuki, S., et al. Differentiation of human pluripotent stem cells into functional airway basal stem cells. STAR Protocols. 2 (3), 100683 (2021).
- Rock, J. R., et al. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12771-12775 (2009).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados