Method Article
Генерация культур взаимодействия эпителиальных клеток дыхательных путей воздух-жидкость из плюрипотентных стволовых клеток человека
В этой статье
Резюме
Последние достижения в протоколах дифференцировки плюрипотентных стволовых клеток, индуцированных человеком, позволяют поэтапно получать орган-специфические типы клеток. Здесь мы предоставляем подробные шаги по поддержанию и расширению базальных клеток дыхательных путей, полученных из iPSC, и их дифференцировке в мукоцилиарный эпителий в культурах воздушно-жидкостного интерфейса.
Аннотация
Заболевания проводящих дыхательных путей, такие как астма, муковисцидоз (МВ), первичная цилиарная дискинезия (ПХД) и вирусные респираторные инфекции, являются основными причинами заболеваемости и смертности во всем мире. Платформы in vitro , использующие эпителиальные клетки бронхов человека (HBEC), сыграли важную роль в нашем понимании эпителия дыхательных путей в здоровье и болезнях. Доступ к ГБЭК от лиц с редкими генетическими заболеваниями или редкими мутациями является узким местом в исследованиях легких.
Индуцированные плюрипотентные стволовые клетки (ИПСК) легко генерируются путем «перепрограммирования» соматических клеток и сохраняют уникальный генетический фон отдельного донора. Последние достижения позволяют проводить направленную дифференцировку ИПСК в эпителиальные клетки-предшественники легких, альвеолярные клетки типа 2, а также клетки проводящего эпителия дыхательных путей через базальные клетки, основные стволовые клетки дыхательных путей.
Здесь мы описываем протокол для поддержания и расширения базальных клеток дыхательных путей, полученных из iPSC (далее iBC), а также их дифференцировки трилинейности в культурах воздушно-жидкостного интерфейса (ALI). iBC поддерживаются и расширяются в виде эпителиальных сфер, взвешенных в каплях внеклеточного матрикса, культивируемых в первичной базальноклеточной среде, дополненной ингибиторами сигнальных путей TGF-ß и BMP. iBC в этих эпителиальных сферах экспрессируют ключевые базальные маркеры TP63 и NGFR, могут быть очищены флуоресцентной активированной сортировкой клеток (FACS) и при нанесении на пористые мембраны в стандартных условиях культуры ALI дифференцируются в функциональный эпителий дыхательных путей. Культуры ALI, полученные от здоровых доноров, состоят из базальных, секреторных и мультицилиалированных клеток и демонстрируют целостность эпителиального барьера, подвижные реснички и секрецию слизи. Культуры, полученные от лиц с муковисцидозом или ПХД, повторяют дисфункциональный CFTR-опосредованный транспорт хлоридов или неподвижные реснички, соответствующие болезнетворные эпителиальные дефекты.
Здесь мы представляем протокол генерации клеток человека, который может быть применен для моделирования и понимания заболеваний дыхательных путей.
Введение
Хронические заболевания легких составляют большое бремя заболеваемости и смертности во всем мире1. Состояния, которые влияют на проводящие дыхательные пути, такие как астма, муковисцидоз (МВ), первичная цилиарная дискинезия (ПХД) и вирусные инфекции, представляют собой как общие, так и более редкие заболевания, приобретенные и генетические, которые способствуют этому глобальному бремени. Основными функциями проводящих дыхательных путей являются: 1) выступать в качестве канала для ламинарного потока воздуха и 2) обеспечивать мукоцилиарный клиренс патогенов и мусора. Секреторные, мультицилиализированные и базальные клетки представляют собой основные типы эпителиальных клеток проводящих дыхательных путей. Более редкие типы эпителиальных клеток включают ионоциты, пучковые клетки и нейроэндокринные клетки и были рассмотрены в другом месте2.
В целом, основным препятствием для понимания механизмов заболевания и продвижения терапевтических подходов было постоянное отсутствие первичной ткани человека для использования в доклинических моделях. ГБЭК, как правило, считаются моделью золотого стандарта in vitro эпителиальной биологии дыхательных путей человека и играют ключевую роль в исследованиях муковисцидоза, в частности3. Тем не менее, они обычно выделяются либо из бронхоскопических биопсий, либо из легочной ткани после операции, либо из легких, отторгнутых для целей трансплантации. Доступ к ГБЭК от лиц с генетическими заболеваниями, включая исследовательские приоритеты ХВ и ПХД, является нечастым и непредсказуемым. Необходимо преодолеть это узкое место для эпителиальных клеток дыхательных путей, полученных от пациента. ИПСК легко генерируются у любого человека, они сохраняют уникальный генетический фон донора и обладают замечательной способностью размножаться и выживать в долгосрочной перспективе в условиях клеточной культуры 4,5,6. Повторяя ключевые эмбриологические стадии, ИПСК подвергаются «направленной дифференцировке» в орган-специфические типы клеток. Мы и другие разработали протоколы для генерации легочных предшественников, полученных из iPSC, альвеолярных клеток типа 2 7,8 и клеток проводящих дыхательных путей, включая базальные клетки дыхательных путей 9,10,11,12.
Базальная клетка дыхательных путей является стволовой клеткой проводящего дыхательногопути 13. В ранее опубликованной работе наша группа сгенерировала эпителиальные клетки дыхательных путей, полученные из iPSC, включая подмножество (iBC), которое экспрессирует канонические маркеры базальных клеток, включая TP63, KRT5 и NGFR. Следуя сигналам из биологии базальноклеточных клеток взрослых, ингибирование двойных путей SMAD (TGF-β и BMP) приводит к повышению регуляции NGFR + iBC11,14. NGFR+ iBC повторно суспендируются в виде одиночных клеток в каплях внеклеточного матрикса и культивируются в базальной клеточной среде. Они самообновляются для поддержания популяции iBC и образуют эпителиальные сфероиды; однако пропорция также дифференцируется в секреторные клетки в этом формате (называемом 3-D культурой). В следующем протоколе мы подробно описываем шаги по поддержанию и расширению этих iBC в 3-D культуре, а также шаги, необходимые для создания функциональной 2-D мукоцилиарной культуры ALI.
Первоначальные шаги этого протокола дифференциации были опубликованы ранее и не будут рассмотрены здесь11,12. Эта рукопись будет сосредоточена на расширении и очистке iBC и их последующей дифференцировке в функциональные секреторные и мультицилиалированные клетки в культуре ALI.
протокол
Каждый из следующих шагов должен быть выполнен с использованием стерильной техники в ламинарной вытяжке уровня биобезопасности 2. Все среды должны быть нагреты до комнатной температуры (22 °C) перед добавлением в ячейки, за исключением случаев, когда специально указано иное. Каждая стадия центрифугирования должна выполняться при комнатной температуре (приблизительно 22 °C). На рисунке 1 показаны схемы протокола.
1. Подготовка необходимых носителей
ПРИМЕЧАНИЕ: Дополнительный файл 1 для получения дополнительной информации.
- Базально-клеточная среда
- Подготовьте базовую среду в соответствии с инструкциями производителя.
- К каждым 50 мл базовой среды добавляют 5 мкл A83-01 (10 мМ), 5 мкл DMH1 (10 мМ), 50 мкл Y-27632 (10 мМ) и 100 мкл Примоцина (50 мг/мл). В дальнейшем эта среда называется базально-клеточной средой.
- Хранить при температуре 4 °C до 1 месяца.
- Среда дифференциации ALI
- Подготовьте среду в соответствии с инструкциями производителя.
- К каждым 50 мл среды дифференцировки ALI добавляют 100 мкл примоцина (50 мг/мл).
- Хранить защищенным от света при температуре 4 °C в течение 1 месяца.
- Буфер сортировки
- На каждые 50 мл сортового буфера комбинируйте 47,5 мл сбалансированного солевого раствора Хэнкса, 1 мл FBS, 200 мкл ЭДТА (500 мМ), 1,25 мл буфера HEPES (1 М), 50 мкл Y-27632 (10 мМ) и 100 мкл примоцина (50 мг/мл).
- Фильтр стерилизуют, используя размер пор 0,4 мкм.
- Хранить при температуре 4 °C до 1 месяца.
- Среда криоконсервации
- На каждые 50 мл криоконсервационной среды комбинируйте 45 мл базально-клеточной среды и 5 мл диметилсульфоксида (ДМСО).
- Фильтр стерилизуют, используя размер пор 0,4 мкм.
- Хранить при температуре 4 °C до 1 месяца.
2. Размораживание криоконсервированных iBC
- Оттаивание (на льду) достаточного объема 3-D фактора роста с уменьшенным внеклеточным матриксом (далее 3-D матрица). Держите на льду до готовности к использованию.
ПРИМЕЧАНИЕ: При размораживании одного флакона (содержащего 250 000 клеток) размораживают 100-200 мкл 3-D матрицы. - Разморозьте флакон с ранее криоконсервированными одноклеточными суспензиями iBC путем инкубации в воде или бисерной ванне с температурой 37 °C до тех пор, пока не останется видимой замороженной среды (1-2 мин).
- Используя серологическую пипетку объемом 5 мл, добавьте клеточную суспензию в коническую трубку объемом 15 мл.
- Добавьте 6-10 мл DMEM/F12 по каплям в клеточную суспензию, аккуратно перемешайте и центрифугируйте при 300 х г в течение 5 мин, чтобы гранулировать клетки.
- Аспирировать супернатант и повторно суспендировать клеточную гранулу в 1 мл базально-клеточной среды с помощью микропипетки P1000. Удалите аликвоту объемом 10 мкл и выполните подсчет клеток.
- Центрифугирование клеток при 300 х г в течение 5 мин. Аспирировать супернатант и повторно суспендировать клетки с плотностью 4000 клеток/мкл в ранее размороженной 3-D матрице с микропипеткой P1000.
ПРИМЕЧАНИЕ: Очень важно избегать добавления пузырьков в 3-D матрицу. Пипетка матрицы медленно и осторожно. - С помощью микропипетки P200 добавьте одну каплю (25 или 50 мкл) к основанию каждой лунки 12-луночной пластины, обработанной культурой ткани. Если начать с 250 000 замороженных клеток, ожидаемое количество капель на этом этапе составляет от 3 до 4 (25 мкл капель), в зависимости от жизнеспособности клеток.
- Инкубируйте пластину при 37 °C в течение приблизительно 15 мин, а затем добавляйте достаточно базальноклеточной среды в каждую лунку, чтобы полностью погрузить каплю (1,5 мл на 50 мкл; 1 мл на 25 мкл), используя серологическую пипетку 5 мл. Верните тарелку в увлажненный инкубатор.
- Подкармливайте клетки каждые 2 дня с использованием свежей базальной среды. Добавьте свежую среду в боковую часть лунки с серологической пипеткой 5 мл, следя за тем, чтобы не потревожить капли клеток.
ПРИМЕЧАНИЕ: Плотность клеток, покрытых на этой стадии, в 10 раз выше, чем обычная пассажная обработка iBC в разделе 3.
3. Диссоциация сфероидов и расширение iBC в 3-D культуре
- Оттаивание (на льду) достаточного объема 3-D матрицы. Держите на льду до готовности к использованию.
ПРИМЕЧАНИЕ: Требуемый объем 3D-матрицы зависит от того, сколько ячеек потребуется пользователю. - Примерно через 5-7 дней аспирируйте среду из каждой лунки и с помощью микропипетки P1000 добавьте 1 мл Диспазы II (1 ЕД/мл) непосредственно на сфероиды, чтобы диссоциировать из капель матрицы.
- Поместите пластину в инкубатор при температуре 37 °C на 10-15 мин.
- Используя микропипетку P1000, пипетку Dispase вверх и вниз 1-2 раза, разбивая большие комки 3-D матрицы. Верните пластину до 37 °C еще на 30-40 мин, позволив матрице полностью раствориться.
- Когда капля 3-D матрицы больше не видна под световым микроскопом, добавьте свободно плавающие сфероиды к конической конической матрице объемом 15 мл с помощью серологического наконечника пипетки объемом 5 мл. Добавьте DMEM/F12 для конечного объема 10 мл на коническую часть и центрифугу при 200 х г в течение 3 мин, чтобы гранулировать сфероиды.
- Аспирировать супернатант и добавить 1 мл 0,05% трипсина (37 °C) на каждую начальную диссоциированную каплю (например, если вы начинаете с четырех капель, добавьте 4 мл трипсина в коническую колбу).
- Инкубировать при 37 °C, часто тритурируя (каждые 2-3 мин).
- Оценивайте с помощью светового микроскопа каждые несколько минут. После того, как большинство (>90%) сфероидов были диссоциированы на отдельные клетки, добавьте 10% фетальной бычьей сыворотки (в DMEM / F12) в объемном соотношении 1: 1 к трипсину.
- Фильтруйте клетки через 40-мкм клеточный сетчатый фильтр и центрифугу при 300 х г в течение 5 мин.
- Выполните подсчет клеток и равномерно повторно суспендируйте клетки при плотности 400 клеток/мкл размороженной 3-D матрицы. Избегайте введения пузырьков воздуха. Повторно суспендируйте столько капель, сколько необходимо для последующего применения. Повторите шаг 2.6-2.9 для каждой скважины.
4. Оценка и очистка NGFR+ iBC
- Через 10-14 дней после последнего прохождения диссоциируют сфероиды на одноклеточную суспензию, как на шагах 3,2-3,5, и выполните подсчет клеток.
ПРИМЕЧАНИЕ: Различные линии iPSC ведут себя по-разному; поэтому диапазон в 10-14 дней может варьироваться для разных иБК. Пожалуйста, обратитесь к рисунку 2 для типичных появлений 3-D iBC через 1, 4, 8 и 14 дней, когда они достаточны для сортировки клеток NGFR+. Сортировка раньше, чем рекомендуется (например, день 8, как показано на рисунке 2C), приводит к общему снижению числа клеток с менее частой экспрессией NGFR. Сортировка позже, чем рекомендуется (например, более чем через 14 дней после последнего прохождения) приводит к плохой выживаемости клеток после сортировки. - Повторное суспендирование клеток при плотности 1 х 106 клеток/100 мкл в буфере сортировки (основная популяция). Переложите небольшую аликвоту (25-50 мкл) в отдельную трубку (незначительную популяцию).
- Добавьте конъюгированное анти-NGFR антитело (разведение 1:100) к основной клеточной популяции.
- Добавьте контрольные антитела изотипа (разведение 1:200) к популяции второстепенных клеток.
- Защитите клетки от света и держите на льду в течение 30 минут, периодически (каждые 5-10 минут) тритурируя клетки, чтобы предотвратить гранулирование.
- Через 30 минут добавьте буфер сортировки в соотношении 1:1 к каждой пробирке ячеек. Центрифужные ячейки при 300 х г в течение 5 мин.
- Аспирируйте супернатант, повторно суспендируйте гранулированные клетки в буфере сортировки с плотностью 10 х 106 клеток / мл и добавьте пятно живых или мертвых клеток.
- Используя соответствующую стратегию NGFR+ (основанную на контроле изотипов, см. Рисунок 3), отсортируйте достаточное количество живых ячеек NGFR+ для необходимых последующих приложений.
ПРИМЕЧАНИЕ: При использовании iBC с флуоресцентными репортерами (т.е. NKX2-1GFP TP63tdTomato) рекомендуется сортировать по «тройным положительным» ячейкам (т.е. NKX2-1GFP+, TP63tdTomato+, NGFR+), с соответствующим выбором и компенсацией затвора (рисунок 3). Во время этого расширения iBC часть клеток дифференцируется в секреторные клетки, и также может быть обнаружена очень небольшая доля мультицилиалированных клеток. Обе эти популяции являются NGFR-.
5. Генерация мукоцилиарных КУЛЬТУР АЛИ
- Подготовьте 6,5 мм пористые мембранные вставки путем добавления матрицы объемом 200 мкл в апикальную камеру (матрица, сертифицированная по эмбриональным стволовым клеткам человека, или рекомбинантный человеческий ламинин-521) в соответствии с инструкцией производителя.
- Поместите при температуре 37 °C не менее чем за 2 ч до необходимости.
- Аспирируйте матрицу покрытия из апикальной камеры вставки. Добавьте 500 мкл базально-клеточной среды в базолатеральную камеру.
- Повторно суспендировать по меньшей мере 30 000 отсортированных клеток NGFR+ (со стадии 4,5) в 100-200 мкл базально-клеточной среде и перенести в апикальную камеру с использованием микропипетки P200. Повторите для любого количества скважин (и доступных ячеек). Поместите пластину в увлажненный инкубатор при температуре 37 °C.
- Через 2-3 дня аспирируют аспиральную и базолатеральную камеры и кормят свежей базально-клеточной средой (500 мкл до апикальной, 100 мкл до базолатеральной).
- Ежедневно контролируйте апикальную камеру с помощью световой микроскопии. Когда клетки >80% сливаются (обычно 3-7 дней), замените базально-клеточную среду на среду дифференцировки ALI (не предварительно нагретую) как в апикальной, так и в базолатеральной камерах. При работе с ALI Differentiation Medium защитите от света, сохраняя контейнеры для носителей, обернутые в фольгу, и выключая верхний свет, когда это возможно.
- На следующий день аспирируйте среду из апикальной камеры, тем самым подвергая апикальную поверхность воздействию воздуха.
- Заменяйте среду дифференцировки ALI в базолатеральной камере каждые 2-3 дня.
- Следите за внешним видом культуры каждые 1-2 дня. Осторожно аспирируйте любую скопившуюся жидкость из апикальной камеры, не нарушая клеточный слой.
- Оцените трансэпителиальное электрическое сопротивление (TEER) для целостности эпителия.
ПРИМЕЧАНИЕ: TEER может быть оценен в дни после воздействия воздуха, чтобы дать показания целостности эпителиального слоя. Идеальное время для измерения TEER не установлено, хотя значения, согласующиеся с высококачественной мукоцилиарной дифференциацией, обычно составляют >500 хсм2. - Если необходимо удалить мусор или слизь, осторожно добавьте 100 мкл PBS (без Ca2+ или Mg2+) в апикальную камеру. Инкубировать при 37 °C в течение 10 мин, а затем тщательно аспирировать PBS.
- После 7-10 дней воздействия воздуха обычно появляются подвижные реснички, которые можно увидеть с помощью световой микроскопии. В зависимости от запланированного эксперимента и считывания, клетки могут быть проанализированы после 14-28 дней воздействия воздуха.
ПРИМЕЧАНИЕ: Если были использованы флуоресцентные репортерные клетки и если доступен флуоресцентный микроскоп с живыми клетками, клетки можно отслеживать с помощью световой микроскопии, а также репортерной флуоресценции.
6. Необязательная (но рекомендуемая) криоконсервация iBC
- Через 10-14 дней последнего прохождения 3-D культуры диссоциируют сфероиды на одноклеточную суспензию, как на этапах 3,2-3,5. Выполните подсчет ячеек.
- Повторное суспендирование в криоконсервационной среде при плотности 250 000 клеток/500 мкл в криовиале.
- Поместите криовиал (криовиалы) в контейнер для обеспечения устойчивого падения температуры (1 °C/мин) и переведите до -80 °C в течение 24-48 ч с последующим переносом до -150 °C для длительного хранения.
ПРИМЕЧАНИЕ: Повторная криоконсервация, а также криоконсервация ранее отсортированных клеток NGFR+, были выполнены, но они не были адекватно оценены на жизнеспособность клеток и способность образовывать функциональные культуры ALI. Особенно при расширенном прохождении клеток рекомендуется оценивать кариотип, поскольку было отмечено, что он варьируется в IPSCs и клетках, полученных из iPSC.
Результаты
Следуя этому протоколу, 200 000 криоконсервированных iBC (ранее подтвержденных как имеющие нормальный кариотип 46XY)11 были разморожены и расширены в 3-D культуре. Пять дней спустя полученные сфероиды были диссоциированы, подсчитаны и снова пройдены для дальнейшего расширения. Приблизительно 480 000 клеток были получены и повторно суспендированы в 3-D матрице (12 х 50 мкл капель, плотность 400 клеток/мкл). Свежую базально-клеточную среду применяли каждые 2-3 дня. Через десять дней клетки снова были разобщены и подсчитаны. В общей сложности было собрано и подготовлено 19,7 х 106 клеток для СУИМ. 106 клеток окрашивали APC-конъюгированным контролем изотипа IgG1κ, а остальные 18,7 x 106 клеток окрашивали APC-конъюгированным анти-NGFR антителом в течение 30 мин, защищенных от света (Рисунок 3).
NGFR+ gating проводили после сравнения с контрольными клетками изотипа и устанавливали специально для сбора самых высоких экспрессирующих клеток NGFR+ (рисунок 3). С помощью этой техники 28% живых одиночных клеток были NGFR +. В то время как было доступно больше клеток, было собрано 750 000 клеток для последующей культуры. Отсортированные клетки повторно суспендировали в базальной клеточной среде в концентрации 50 000 клеток/100 мкл. 50 000 клеток затем сеяли на каждую 6,5 мм пористую мембранную вставку, которая была покрыта человеческим рекомбинантным ламинином-521 (2 мкг/200 мкл) в соответствии с рекомендациями производителя. 500 мкл базально-клеточной среды добавляли в базолатеральную камеру каждой вставки и помещали пластину в увлажненный инкубатор при температуре 37 °C. Три дня спустя среда в апикальной камере была аспирирована, и клетки были ~ 90% сливались с помощью световой микроскопии (рисунок 4B). Среда из базолатеральной камеры была аспирирована; К апикальной (100 мкл) и базолатеральной (500 мкл) камерам добавляли среду дифференцировки ALI. На следующий день СМИ из апикальной камеры были аспирированы.
В течение следующих 21 дня клетки периодически оценивали с помощью световой микроскопии и кормили свежей средой дифференцировки ALI (только базолатеральная камера) каждые 2-3 дня. Отдельные клетки изначально были легко идентифицируемы (рисунок 4А), имели удлиненный и веретенообразный вид и образовывали свободно упакованный монослой (рисунок 4В). В течение последующих дней до недель клетки образовывали плотно упакованный, высококлеточный, эпителиальный слой, а через 7-10 дней наблюдалось явное появление бьющихся ресничек и выработки слизи. TEER образцов были рассчитаны и аналогичны первичным клеткам контроля (диапазон от 700-1600 Ω хсм2)11. Последующую фиксацию (день 21-28) параформальдегидом и иммуномаркировкой для канонических маркеров эпителиальных клеток дыхательных путей проводили для MUC5AC и ацетилированного α-тубулина, среди прочих (рисунок 4C). В целом, с нашим наблюдением за подвижными ресничками, производством слизи, а также подтверждающим иммуноокрашиванием мультицилинированных и секреторных клеток, которое похоже на первичные HBEC, мы пришли к выводу, что мы успешно генерировали эпителиальные клетки дыхательных путей из индуцированных плюрипотентных стволовых клеток.
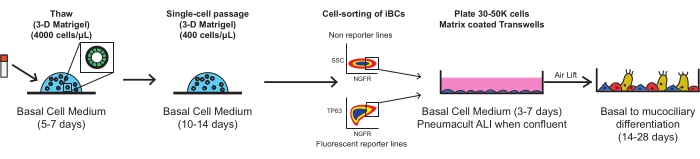
Рисунок 1: Общая схема протокола. Криоконсервированные iBC размораживают, расширяют и очищают FACS перед нанесением покрытия на пористые мембранные вставки, где они дифференцируются в функциональный мукоцилиарный эпителий. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Репрезентативные фазовые контрастные изображения. Репрезентативные фазовые контрастные изображения, демонстрирующие обычный внешний вид iBC в 3-D культуре через (A) 1 день, (B) 4 дня, (C) 8 дней и (D) 14 дней (только до сортировки NGFR). Шкалы представляют 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
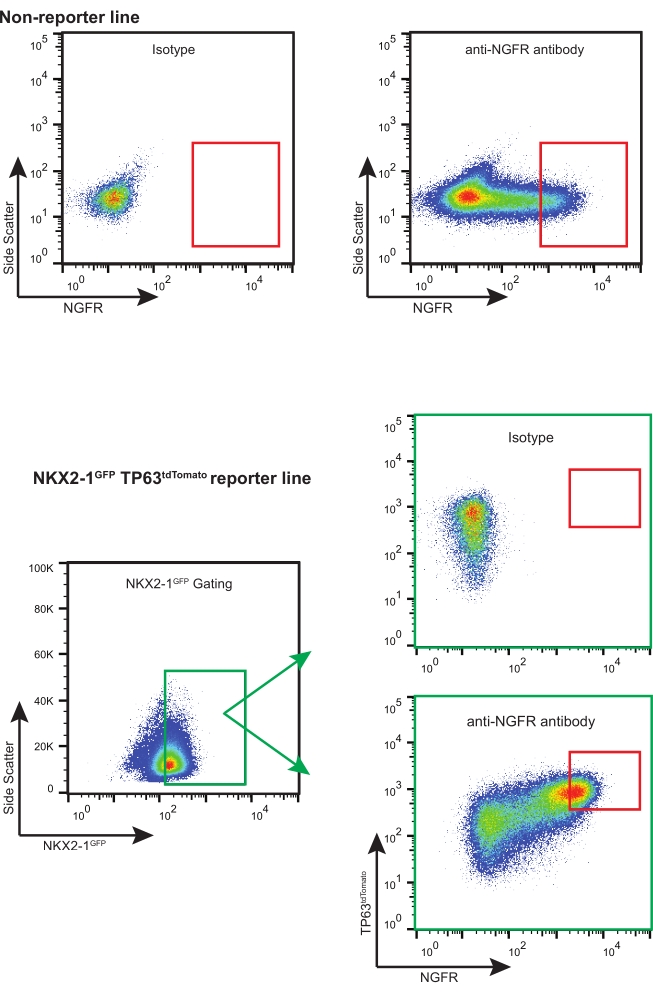
Рисунок 3: Репрезентативные участки СУИМ. Репрезентативные графики FACS для нерепортерных и флуоресцентно-репортерных iBC. Показаны примеры элементов управления изотипами, которые использовались для отбора наиболее экспрессирующих клеток NGFR+. Флуоресцентные репортерные линии iPSC «тройной сортировки» для ячеек NKX2-1GFP+ TP63tdTomato+ NGFR+. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
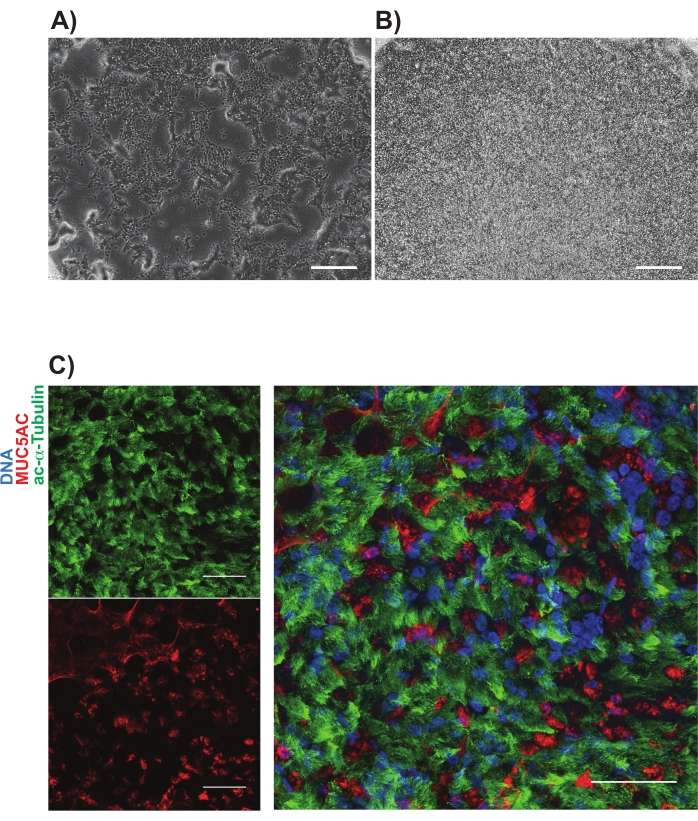
Рисунок 4: Репрезентативные изображения культур iBC на пористых мембранах. Фазоконтрастные изображения показываются (А) через 1 день и (В) через 3 дня после нанесения покрытия. Репрезентативная иммуномаркировка мукоцилиарных культур показана в (С); ацетилированный альфа-тубулин (зеленый) и MUC5AC (красный). Шкалы представляют 25 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Таблица компонентов мультимедиа. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
ГБЭК являются золотым стандартом клеточного типа для изучения заболеваний эпителия дыхательных путей. Из-за их ограничений (включая доступность и сложность генетического манипулирования) мы создали протокол для получения iBC и культур ALI. Эти клетки могут быть получены от любого донора и сохраняют свой уникальный генетический фон, что позволяет проводить фундаментальные исследования развития, моделирование заболеваний и новые терапевтические разработки.
Хотя каждый отдельный шаг описанного протокола необходим, есть несколько, которые заслуживают дополнительного упоминания. Во-первых, на каждом этапе, требующем диссоциации сфероидов на отдельные клетки, крайне важно избегать чрезмерного пипетирования; ферментативное пищеварение (с диспазой или трипсином) способствует лучшей выживаемости клеток, в то время как чрезмерное пипетирование приводит к значительной гибели клеток. Во-вторых, при очистке NGFR+ iBC использование контроля изотипа имеет решающее значение, и мы рекомендуем выбирать наиболее экспрессирующие клетки NGFR+ с FACS (рисунок 3). Такой подход приводит к созданию оптимальных культур ALI с соответствующей мукоцилиарной дифференцировкой. Наконец, подготовка и посев пористых мембран в точности так, как это задокументировано в протоколе, имеет основополагающее значение для выживания культуры ALI. В то время как мы обычно сеем 30 000-60 000 клеток на вставку, у нас был успех всего с 20 000 клеток. В то время как успешные культуры могут быть получены с использованием матричного покрытия, соответствующего человеческим эмбриональным стволовым клеткам, в последнее время мы используем человеческий рекомбинантный ламинин-521 со значительно более высокой долговечностью культур ALI.
Очень редко дифференциация iPSC может не регулировать адекватный процент NGFR+ iBC. В этом случае последовательная передача iBC (в 3D-культуре) может привести к увеличению частоты NGFR с течением времени. Ограничения этого протокола включают время, стоимость и опыт, необходимые для создания этих ячеек. Кроме того, мы признаем, что многих исследователей интересуют менее распространенные типы клеток эпителия дыхательных путей (например, ионоциты, нейроэндокринные клетки). Хотя мы обнаружили некоторые из этих более редких типов клеток, как в первичных культурах HBEC, они не воспроизводимо идентифицированы, вероятно, из-за неполных знаний о сигналах развития, необходимых для генерации этих клеток.
Как написано, приведенный выше протокол начинается с оттаивания уже криоконсервированных иБК. Детали, предшествовавшие этой криоконсервации, описаны ранее и выходят за рамки настоящей рукописи11,12.
Наш метод культивирования эпителия дыхательных путей ALI позволяет генерировать функциональные эпителиальные клетки дыхательных путей практически у любого донора. Это значительно увеличивает доступность драгоценных генетически контролируемых эпителиальных клеток дыхательных путей, которые могут быть использованы для моделирования заболеваний, скрининга лекарств, будущей клеточной терапии, а также для улучшения понимания структуры развития в эпителии дыхательных путей.
Раскрытие информации
Авторы не раскрывают информацию.
Благодарности
Мы благодарим членов лабораторий Хокинса, Коттона и Дэвиса за их полезный вклад на протяжении многих лет в этот и другие проекты. Мы также в долгу перед Брайаном Тилтоном (директор по сортировке клеток BU) за его преданность делу и технический опыт, и мы благодарны Грегу Миллеру и Марианне Джеймс из Центра регенеративной медицины Бостонского университета (CReM) за их поддержку и технический опыт в поддержании и характеристике специфических для пациента IPSC, поддерживаемых грантами NIH NO1 75N92020C0005 и U01TR001810. Эта работа была поддержана грантами NIH U01HL148692, U01HL134745, U01HL134766 и R01HL095993 для D.N.K, R01HL139876 для B.R.D, R01 HL139799 для F.H., и Грантами Фонда муковисцидоза (CFF) CFF 00987G220 и CFF WANG20GO для D.N.K, CFF DAVIS15XX1, DAVIS17XX0, DAVIS19XX0 для B.R.D, CFF SUZUKI19XX0 для S.S, CFF BERICA2010 для A.B., и CFF HAWKIN20XX2 - F.H.
Материалы
| Name | Company | Catalog Number | Comments |
| 12-well tissue culture treated plate | Corning | 3515 | flat bottom |
| 3-D growth factor reduced Matrigel | Corning | 356230 | |
| A83-01 | ThermoFisher Scientific | 293910 | |
| Cell culture inserts (Transwell) | Corning | 3470 | 6.5mm diameter; 0.4μm pore size |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | |
| Dispase II, Powder | ThermoFisher Scientific | 17105-041 | |
| DMH1 | ThermoFisher Scientific | 412610 | |
| Dulbecco's Modified Eagle Medium/Nutrient Mixture (DMEM):F-12 | ThermoFisher Scientific | 11330-032 | |
| Dulbecco's Phosphate Buffered Saline (PBS) (1X) | Gibco | 14190-144 | |
| Ethylenediaminetetraacetic acid disodium salt solution (EDTA) | Sigma | E7889 | |
| Fetal Bovine Serum (FBS) | Fisher | SH3007003E | |
| Hanks' Balanced Salt Solution (HBSS) | ThermoFisher Scientific | 14175-079 | |
| HEPES | Sigma | H3375 | |
| hESC-qualified Matrigel | Corning | 354277 | |
| Mouse IgG1kappa isotype control, APC-conjugated | Biolegend | 400122 | |
| Mouse monoclonal anti-human CD271/NGFR, APC-conjugated | Biolegend | 345108 | |
| PneumaCult-ALI Medium (ALI Differentiation Medium) | StemCell Technologies | 05001 | |
| PneumaCult-Ex Plus Medium (Basal Cell Base Medium) | StemCell Technologies | 05040 | |
| Primocin | InvivoGen | ant-pm-2 | |
| rhLaminin-521 | ThermoFisher Scientific | A29248 | Final Concentration: 10ug/mL |
| Trypsin-EDTA Solution, 0.05% | Invitrogen | T3924 | |
| Y-27632 | Tocris | 1254 |
Ссылки
- GBD Chronic Respiratory Disease Collaborators. Prevalence and attributable health burden of chronic respiratory diseases, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. The Lancet. Respiratory Medicine. 8 (6), 585-596 (2020).
- Alysandratos, K. -. D., Herriges, M. J., Kotton, D. N. Epithelial stem and progenitor cells in lung repair and regeneration. Annual Review of Physiology. 83, 529-550 (2021).
- Fulcher, M. L., Gabriel, S., Burns, K. A., Yankaskas, J. R., Randell, S. H. Well-differentiated human airway epithelial cell cultures. Methods in Molecular Medicine. 107, 183-206 (2005).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Takahashi, K., et al. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131 (5), 861-872 (2007).
- Berical, A., Lee, R. E., Randell, S. H., Hawkins, F. Challenges facing airway epithelial cell-based therapy for cystic fibrosis. Frontiers in Pharmacology. 10, 74 (2019).
- Jacob, A., et al. Derivation of self-renewing lung alveolar epithelial type II cells from human pluripotent stem cells. Nature Protocols. 14 (12), 3303-3332 (2019).
- Gotoh, S., et al. Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Reports. 3 (3), 394-403 (2014).
- Huang, S. X. L., et al. Efficient generation of lung and airway epithelial cells from human pluripotent stem cells. Nature Biotechnology. 32 (1), 84-91 (2013).
- Mou, H., et al. Generation of multipotent lung and airway progenitors from mouse ESCs and patient-specific cystic fibrosis iPSCs. Cell Stem Cell. 10 (4), 385-397 (2012).
- Hawkins, F. J., et al. Derivation of airway basal stem cells from human pluripotent stem cells. Cell Stem Cell. 28 (1), 79-95 (2021).
- Suzuki, S., et al. Differentiation of human pluripotent stem cells into functional airway basal stem cells. STAR Protocols. 2 (3), 100683 (2021).
- Rock, J. R., et al. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12771-12775 (2009).
- Mou, H., et al. Dual SMAD signaling inhibition enables long-term expansion of diverse epithelial basal cells. Cell Stem Cell. 19 (2), 217-231 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены