需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一种简单的坑式检测方案,用于可视化和定量体外碎屑病再吸收
Erratum Notice
摘要
在这里,我们提出了一种简单有效的测定程序,用于使用磷酸钙包被细胞培养板进行再吸收坑测定。
摘要
成熟的破骨细胞是多核细胞,可以通过酸和酶的分泌使骨骼降解。它们在各种疾病(例如骨质疏松症和骨癌)中起着至关重要的作用,因此是重要的研究对象。 在体外,可以通过形成吸收坑来分析它们的活性。在该协议中,我们描述了一种使用磷酸钙(CaP)包被细胞培养板的简单坑测定方法,该方法可以轻松可视化和定量。在存在破骨细胞刺激的情况下,在包被板上培养来自人外周血单核细胞(PBMC)的破骨细胞前体。孵育9天后,固定破骨细胞并进行染色以进行荧光成像,同时将CaP涂层与钙黄绿素复染。为了量化再吸收区域,用5%AgNO3 染色板上的CaP涂层并通过明场成像可视化。使用ImageJ量化了吸收坑区域。
引言
破骨细胞(OCs)是来自造血干细胞(HSC)的组织特异性巨噬细胞,与成骨细胞一起在骨重塑中起关键作用1。性激素诱导的、免疫学的和恶性骨骼疾病在全身或局部破坏骨骼是由于骨碎屑活性过大,包括更年期相关的骨质疏松症2、类风湿性关节炎3、牙周病4、骨髓瘤骨病5 和溶骨性骨转移6。相反,OC形成和功能的缺陷也可引起骨石病7。HSC在巨噬细胞集落刺激因子(M-CSF,基因符号ACP5)刺激下分化为OC祖细胞。在M-CSF和NF-κB配体(RANKL,基因符号TNFSF11)的受体激活剂存在的情况下,OC祖细胞进一步分化为单核OC,随后融合成为多核OCs8,9,10。细胞因子M-CSF和RANKL对于诱导破骨细胞标志物是不可或缺的,并且足以诱导骨细胞标志物,例如降钙素受体(CT),核因子κ B(RANK)的受体激活剂,质子泵V-ATP酶,氯化通道7α亚基(CIC-7),整合素β3,酒石酸抗性酸性磷酸酶(TRAP,基因符号ACP5),溶酶体半胱氨酸蛋白酶酶组织蛋白酶K(CTSK)和基质金属蛋白酶9(MMP9)。活化的OC通过形成具有褶皱边界11,12的肌动蛋白环在骨表面上形成密封区。在密封区内,OC通过质子泵V-ATPase 12,13,MMP914和CTSK15分泌质子介导再吸收,导致间隙的形成。
对于体外实验,OC祖细胞可以通过从小鼠股骨和胫骨16,17中扩增骨髓巨噬细胞,以及通过从血液样品和buffy coat18,19,20中分离人外周血单核细胞(PBMC),或通过分化永生的小鼠单核细胞RAW 264.7 21,22来获得。
在本方案中,我们使用衍生自原代PBMCs的OC在CaP包被细胞培养板中描述破破细胞再吸收测定。这里使用的CaP包被细胞培养板的方法采用并从Patntirapong等人17 和Maria等人21先前描述的方法中改进而来。为了获得OC前体,PBMC通过密度梯度离心分离并如上所述20进行扩增。
研究方案
该协议由当地伦理委员会(批准号287/2020B02)审查和批准。
1.磷酸钙包被细胞培养板的制备
- 钙储备溶液的制备(25 mM CaCl2·2H2O,1.37 mM NaCl,15 mM MgCl2·6H2O在Tris缓冲液中)
- 准备1.0 M Tris缓冲液,并使用1 M HCl将pH调节至7.4。
- 在磁力搅拌器上设置玻璃烧杯,加入100 mL 1.0 M Tris缓冲液。
- 称出0.368克氯化钙2·2H2O、8.0克氯化钠和0.305克MgCl2·6H2O,逐个溶于Tris缓冲液中。
- 使用1 M盐酸盐将pH调节至7.4,并在室温下储存。
- 磷酸盐储备溶液的制备(11.1 mM Na2HPO4·H2O, 42 mM NaHCO3 在 Tris 缓冲液中)
- 在磁力搅拌器上设置玻璃烧杯,加入100 mL 1.0 M Tris缓冲液。
- 称出0.158克Na2HPO4·H2O和0.353克NaHCO3 并逐个溶解在Tris缓冲液中。
- 使用1 M盐酸盐将pH调节至7.4,并在室温下储存。
- 96孔细胞培养板的预钙化
- 通过混合15 mL 1.0 M Tris缓冲液,7.5 mL钙储备溶液(步骤1.1.4)和7.5mL磷酸盐储备溶液(步骤1.2.3),制备30 mL工作溶液。用0.2μm过滤器过滤溶液。
- 准备具有平底的96孔细胞培养板。将300μL磷酸钙溶液移液(步骤1.3.1.)移液到每个孔中。用盖子盖住板,并将板在37°C下孵育3天。
- 磷酸钙溶液的制备(2.25 mM Na2HPO4·H2O, 4 mM 氯化钙2·2H2O, 0.14 M 氯化钠, 50 mM 三分子碱,在 ddH2O 中)
- 在装有磁力搅拌珠的烧杯中,将2 mL 1 M HCl加入40 mL去离子水中,溶解0.016 g Na2HPO4·H2O,0.0295 g CaCl2·2H2O,NaCl 0.409 g,Tris碱0.303 g。
- 使用1 M HCl将pH调节至7.4,加入去离子水以填充体积至50 mL。用0.2μm过滤器过滤溶液。
- 96孔细胞培养板的钙化
- 从预钙化的96孔细胞培养板中吸取预钙化溶液,并向每个孔中加入300μL磷酸钙溶液(步骤1.4.2)。用盖子盖住板并在37°C下孵育1天。
- 将板翻转过来倒出溶液,并用去离子水彻底清洗板三次。立即使用吹风机或压缩的CO 2或N 2气体干燥板,以保持均匀的表面。
- 在干净的工作台上通过紫外线辐射对涂层板进行灭菌1小时。立即使用涂层板或用石蜡膜密封板并将其储存在室温下。
2. 从人外周血中分离多溴联苯
- 在获得献血者的书面知情同意后,从静脉中抽取15毫升血液(道德投票:287/2020B02)。
- 用等体积的PBS稀释15毫升新鲜血液,并通过倒置试管几次或通过将混合物吸入和拉出移液器来混合。
- 准备一个50 mL锥形管,每管含有15 mL密度梯度溶液(例如,Ficoll, 材料表)。倾斜试管并小心地将30 mL稀释的血液样品层到15 mL密度梯度溶液上(稀释的血液样品:密度梯度溶液,1:0.5-1比例)。
注意:覆盖样品时,请注意不要将密度梯度溶液与稀释的血液样品混合。 - 在不带制动器的摆动桶转子中以810× g 在20°C下离心20分钟。
- 抽吸上层,使单核细胞层(淋巴细胞、单核细胞和血小板)在间期不受干扰。
- 小心地将单核细胞层转移到新的50 mL锥形管中。
- 用PBS填充管,混合,并在20°C下以300× g 离心10分钟(从该阶段开始可以使用制动器)。
- 小心地完全去除上清液。将细胞沉淀重悬于50mLPBS中,并在20°C下以300× g 离心10分钟。 小心地完全除去上清液。
- 为了去除血小板,将细胞沉淀重悬于50mLPBS中,并在20°C下以200× g 离心10分钟。 小心地完全除去上清液。
- 将重悬的细胞转移到细胞培养瓶中以扩增OC祖细胞。
3. OC祖细胞的扩增
- 在含有20 ng/mL M-CSF的完全α-MEM(10%FBS,1%笔/链球菌,1%两性霉素B)中重悬PBM。以2.5 x10 5 个细胞/平方厘米的密度接种多溴联苯。通常,从15-20 mL新鲜血液中分离的细胞可以接种在一个75cm2 烧瓶(1.5-2 x 107 个细胞)中。
- 每三天用含有20ng / mL M-CSF的新鲜完全α-MEM喂养细胞,直到附着的细胞达到所需的汇合度。当细胞融合95%时,典型产量为1.5-2 x 106 个细胞/烧瓶。通常,扩展期持续6天。
注意:前体的破骨潜力会随着培养时间的延长而降低。
4. CaP包膜板中破骨细胞生成的诱导
- 为了促进细胞粘附,将CaP包被的板与50μLFBS在37°C培养箱中孵育1小时。
- 要分离OC前体,用PBS洗涤烧瓶两次以除去死细胞或非贴壁细胞。每75cm2烧瓶加入4mL胰蛋白酶(材料表),持续30分钟。
- 加入4 mL完全α-MEM以停止消化,使用细胞刮刀小心地分离细胞并将细胞转移到50 mL管中。
- 使用Neubauer腔室或类似物确定总细胞数。
- 通过以350× g离心7分钟沉淀细胞。将沉淀重悬于含有20ng / mL M-CSF和20 ng / mL RANKL的足够完全α-MEM中,以获得1 x 106 细胞/ mL的浓度。
- 从CaP包被的96孔板和移液器中吸取FBS溶液,每孔200μL细胞悬浮液(2×105 细胞/孔)。
- 将OC前体孵育所需的时间或与实验设计相关的所需试剂一起孵育。通常,在6天后和形成吸收坑时可以观察到大量的大的多核口服避孕药。每三天用新鲜完整的α-MEM培养基喂养细胞,其中含有20 ng / mL M-CSF和20 ng / mL RANKL。
- 在孵育结束时,用PBS洗涤细胞两次,用4%多聚甲醛固定10分钟,然后再次用PBS洗涤。
- 直接使用固定的OC进行荧光染色或储存在4°C。
5. OC和CaP涂层的荧光染色
- 用透化缓冲液(PBS中0.1%Triton)孵育固定细胞5分钟。
- 用100μLAlexaFluor 546标记的鬼球蛋白溶液在PBS中染色肌动蛋白丝30分钟,并吸出染色溶液。加入100μLHoechst 33342染色溶液(PBS中为10μg/ mL)10分钟以染色细胞核。也可以使用 DAPI。
- 用PBS中的100μL10μM钙黄绿素染色CaP包衣10分钟。用PBS清洗三次并拍摄图像。
- 在荧光成像后,可以通过Von Kossa染色使用相同的板来量化再吸收坑面积。为此,用去离子水清洗板两次。
6. 总吸收坑面积的量化
- 要用Von Kossa染色染色CaP涂层,在紫外线辐射下,每孔用50μL5%AgNO3 在去离子水中孵育1小时,直到孔底部的涂层变成棕色。
- 用去离子水清洗板三次,并拍摄明场图像。放大倍率很小的物镜,例如1.25倍物镜,可用于在一张图像中捕获整个孔。这有利于后续的图像分析。可以应用替代方法来捕获井的整个区域。
- 使用 ImageJ 打开图像文件: 文件|开放式|图像|类型 |8 位。使用直线|验证图像右下角的比例单位 分析|设置比例。在"已知距离"一揽子计划中输入长度,在 长度单位中输入新的比例单位,然后选中 "全局"框。
- 列出要分析的测量参数: 分析|设置测量值。在设置测量窗口中,选中面积和限制阈值框。
- 测量凹坑面积: 图像|调整|阈值。在阈值窗口中,选中 深色背景 ,然后单击 自动。坑的区域变为红色。关闭阈值窗口,然后选择 分析|测量。保存结果文件: 文件|另存为。
7. 量化OC数量和大小,以及归一化吸收坑面积
- 使用ImageJ打开破骨细胞的荧光图像并验证刻度单位(参见步骤6.3)。
- 列出要分析的测量参数: 分析|设置测量值。在设置测量值窗口中,选中 面积 框。
- 使用 ROI 管理器和多边形选择概述 OC: 分析|工具|投资回报率经理。单击工具集中的多边形选择,勾勒出一个 OC(具有肌动蛋白环和≥三个细胞核的细胞),然后单击 ROI 管理器 窗口中的 添加 [t] 。重复大纲,直到包括所有 OC。
- 测量 OC 的数量和大小:在 ROI 管理器中选择所有项目,然后单击" 测量"。保存结果文件: 文件|另存为 (图 3e)。
- 测量荧光图像的凹坑区域。打开与步骤7.3中的图像相关的涂层荧光图像并验证刻度单位(参见步骤6.3)。
- 列出要分析的测量参数(请参阅步骤6.4)。选择 图像|调整|阈值。在阈值窗口中,取消选中所有复选框,然后单击 自动。坑的面积变红。关闭 阈值 窗口,然后选择 分析|测量。保存结果文件。
- 按 OC 数计算归一化坑面积。
结果
将细胞培养板底部的磷酸钙包衣分两个包衣步骤进行,包括3天的预钙化和1天的钙化步骤。如图 1所示,在96孔板的底部得到均匀分布的磷酸钙。在执行洗涤步骤后,涂层很好地粘附在底部。
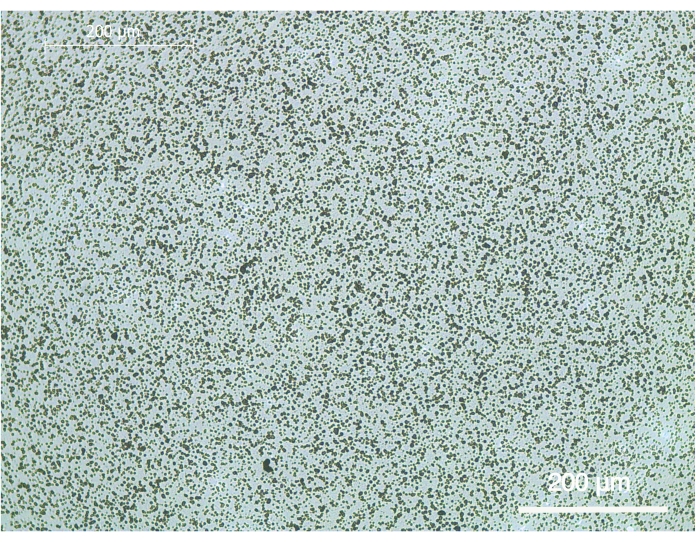
图1:96孔细胞培养板上磷酸钙包衣的代表...
讨论
在这里,我们描述了一种简单可靠的骨碎屑再吸收测定方法,该方法使用从PBMCs 衍生并在体外 扩增的OC。使用过的CaP包被细胞培养板可以使用实验室可用的材料轻松制备和可视化。除了该方案中采用的未分类的PBMCc外,从小鼠单核细胞21 和骨髓巨噬细胞17 产生的OCs也在类似的合成底物上培养用于坑测定,因此这些细胞源可以移动到参考相应文献的这种方?...
披露声明
作者没有什么可透露的。
致谢
这项工作由中国国家留学基金管理委员会(CSC No. 201808440394])资助。W.C.由CSC资助。
材料
| Name | Company | Catalog Number | Comments |
| AgNO3 | SERVA Electrophoresis GmbH | 35110 | Silver nitrate |
| a-MEM | Gibco | 32561-029 | MEM alpha, GlutaMAX, no nucleosides |
| amphotericin B | Biochrom | 03-028-1B | Amphotericin B Solution |
| CaCl2 | Sigma-Aldrich | 21097-50G | Calcium chloride Dihydrate |
| Calcein | Sigma-Aldrich | C0875 | Calcein |
| FBS | Sigma-Aldrich | F7524 | fetal bovine serum |
| Ficoll | Cytiva | 17144002 | Ficoll Paque Plus |
| Fixation buffer | Biolegend | 420801 | Paraformaldehyde |
| HCl | Merk | 1.09057.1000 | Hydrochloric acid |
| Hoechst 33342 | Promokine | PK-CA707-40046 | Hoechst 33342 |
| M-CSF | PeproTech | 300-25 | Recombinant Human M-CSF |
| MgCl2 | Sigma-Aldrich | 7791-18-6 | Magnesium chloride |
| Na2HPO4 | AppliChem GmbH | A2943,0250 | di- Sodium hydrogen phosphate anhydrous |
| NaCl | Merk | S7653-250G | Sodium chloride |
| NaHCO3 | Merk | K15322429 | Bicarbonate of Soda |
| PBS | Lonza | 17-512F | Dulbecco's Phosphate Buffered Saline (1X), DBPS without Calcium and Magnesium |
| Pen-Strep | Lonza | DE17-602E | Penicillin-Streptomycin Mixture |
| Phalloidin-Alexa Fluor 546 | Invitrogen | A22283 | Alexa Fluor 546 Phalloidin |
| RANKL | PeproTech | 310-01 | Recombinant Human sRANK Ligand (E.coli derived) |
| Tris | Sigma-Aldrich | 93362 | Tris(hydroxymethyl)aminomethan |
| Triton X-100 | Sigma-Aldrich | T8787 | Alkyl Phenyl Polyethylene Glycol |
| TrypLE Express | Gibco | 12605010 | Recombinant cell-dissociation enzymes |
参考文献
- Jacome-Galarza, C. E., et al. Developmental origin, functional maintenance and genetic rescue of osteoclasts. Nature. 568 (7753), 541-545 (2019).
- Moller, A. M. J., et al. Aging and menopause reprogram osteoclast precursors for aggressive bone resorption. Bone Research. 8 (1), 1-11 (2020).
- Yokota, K., et al. Characterization and function of tumor necrosis factor and interleukin-6-induced osteoclasts in rheumatoid arthritis. Arthritis Rheumatology. 73 (7), 1145-1154 (2021).
- Teng, Y. T., et al. Functional human T-cell immunity and osteoprotegerin ligand control alveolar bone destruction in periodontal infection. Journal of Clinical Investigation. 106 (6), 59-67 (2000).
- Terpos, E., et al. Soluble receptor activator of nuclear factor kappaB ligand-osteoprotegerin ratio predicts survival in multiple myeloma: proposal for a novel prognostic index. Blood. 102 (3), 1064-1069 (2003).
- Morony, S., et al. Osteoprotegerin inhibits osteolysis and decreases skeletal tumor burden in syngeneic and nude mouse models of experimental bone metastasis. Cancer Research. 61 (11), 4432-4436 (2001).
- Sobacchi, C., Schulz, A., Coxon, F. P., Villa, A., Helfrich, M. H. Osteopetrosis: genetics, treatment and new insights into osteoclast function. Nature Reviews Endocrinology. 9 (9), 522-536 (2013).
- Amarasekara, D. S., et al. Regulation of osteoclast differentiation by cytokine networks. Immune Network. 18 (1), 8 (2018).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), (2020).
- Teitelbaum, S. L. Bone resorption by osteoclasts. Science. 289 (5484), 1504-1508 (2000).
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Baron, R., Neff, L., Louvard, D., Courtoy, P. J. Cell-mediated extracellular acidification and bone resorption: evidence for a low pH in resorbing lacunae and localization of a 100-kD lysosomal membrane protein at the osteoclast ruffled border. Journal of Cell Biology. 101 (6), 2210-2222 (1985).
- Blair, H. C., Teitelbaum, S. L., Ghiselli, R., Gluck, S. Osteoclastic bone resorption by a polarized vacuolar proton pump. Science. 245 (4920), 855-857 (1989).
- Zhu, L., et al. Osteoclast-mediated bone resorption is controlled by a compensatory network of secreted and membrane-tethered metalloproteinases. Science Translational Medicine. 12 (529), 6143 (2020).
- Gowen, M., et al. Cathepsin K knockout mice develop osteopetrosis due to a deficit in matrix degradation but not demineralization. The Journal of Bone and Mineral Research. 14 (10), 1654-1663 (1999).
- Abu-Amer, Y. IL-4 abrogates osteoclastogenesis through STAT6-dependent inhibition of NF-kappaB. Journal of Clinical Investigation. 107 (11), 1375-1385 (2001).
- Patntirapong, S., Habibovic, P., Hauschka, P. V. Effects of soluble cobalt and cobalt incorporated into calcium phosphate layers on osteoclast differentiation and activation. Biomaterials. 30 (4), 548-555 (2009).
- Sorensen, M. G., et al. Characterization of osteoclasts derived from CD14+ monocytes isolated from peripheral blood. The Journal of Bone and Mineral Metabolism. 25 (1), 36-45 (2007).
- Kumar, A., et al. Synergistic effect of biphasic calcium phosphate and platelet-rich fibrin attenuate markers for inflammation and osteoclast differentiation by suppressing NF-kappaB/MAPK signaling pathway in chronic periodontitis. Molecules. 26 (21), 6578 (2021).
- Henriksen, K., Karsdal, M. A., Taylor, A., Tosh, D., Coxon, F. P. Generation of human osteoclasts from peripheral blood. Methods in Molecular Biology. 816, 159-175 (2012).
- Maria, S. M., et al. Reproducible quantification of osteoclastic activity: characterization of a biomimetic calcium phosphate assay. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 102 (5), 903-912 (2014).
- Kong, L., Smith, W., Hao, D. Overview of RAW264.7 for osteoclastogensis study: Phenotype and stimuli. Journal of Cellular and Molecular Medicine. 23 (5), 3077-3087 (2019).
- Li, P., et al. Systemic tumor necrosis factor alpha mediates an increase in peripheral CD11bhigh osteoclast precursors in tumor necrosis factor alpha-transgenic mice. Arthritis & Rheumatology. 50 (1), 265-276 (2004).
- Arai, F., et al. Commitment and differentiation of osteoclast precursor cells by the sequential expression of c-Fms and receptor activator of nuclear factor kappaB (RANK) receptors. Journal of Experimental Medicine. 190 (12), 1741-1754 (1999).
- Xing, L., et al. NF-kappaB p50 and p52 expression is not required for RANK-expressing osteoclast progenitor formation but is essential for RANK- and cytokine-mediated osteoclastogenesis. The Journal of Bone and Mineral Research. 17 (7), 1200-1210 (2002).
- Miyamoto, T., et al. Bifurcation of osteoclasts and dendritic cells from common progenitors. Blood. 98 (8), 2544-2554 (2001).
Erratum
Formal Correction: Erratum: A Simple Pit Assay Protocol to Visualize and Quantify Osteoclastic Resorption In Vitro
Posted by JoVE Editors on 6/10/2024. Citeable Link.
This corrects the article 10.3791/64016
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。