需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一种低成本的透镜水周边植物群落原 位初级生产力 测量方法
摘要
这里介绍的是一种经济高效且可运输的方法/设施,用于在实际 的原位 环境温度和光照条件下测量微生物垫的主要生产力。该实验装置基于广泛可用的材料,可以在各种条件下使用,同时提供基于实验室的模型的优势。
摘要
测量生长季梯度下周生植物原 位 初级生产力,可以阐明环境驱动因素(主要是磷浓度和光照强度)和物种组成对初级生产力的定量影响。初级生产力主要由光强度、温度、养分的可用性以及碳酸盐系统离子种类在真光区各自深度的分布驱动。这是一个复杂的系统,很难在实验室中模拟。这种廉价、可运输且易于建造的浮动驳船可以在实际自然条件下直接精确测量初级生产率。该方法基于使用集成到紧密密封的玻璃罐中的无创氧传感器实时测量初级生产力,从而实现在线氧通量监测并为代谢活动提供新的见解。对微生物垫(或其他底栖生物)的初级生产力总的季节性原 位 测量可以提高目前对控制透镜水域初级生产力动态过程的了解。
引言
初级生产力是本土碳进入形成整个系统食物网的水生系统的唯一途径1。因此,准确估计初级生产力是了解水生生态系统功能的重要一步。沿海地区是初级生产力和生物多样性高的地区。除浮游植物外,周围植物(以下简称微生物垫)和大型藻类被认为对沿海地区的初级生产力有重大贡献2。由于它们无柄的生活方式和显著的空间异质性,初级生产力的量化并非易事。
初级生产力主要由光强度、温度、养分的可用性以及碳酸盐系统离子物种在真光区各自深度的分布驱动3,4。深度显著影响微生物垫的空间分布。微生物群落必须应对高辐射和浅层明显季节性温度变化的不利影响,以及较深的较低光强度。除了深度梯度之外,动态营养相互作用还产生了不同尺度的多种复杂空间模式5。这个复杂的系统在实验室中模拟起来很复杂。推断沿海地区个体初级生产者代谢活动的最准确方法是进行原位实验。
本文介绍的方法基于传统的腔室方法2,6,7,以及可运输且易于建造的低成本浮动驳船。这允许在自然光谱、温度和碳酸盐系统离子种类随深度的不同分布下测量不同深度的初级生产力。该方法基于明暗瓶氧原理,该原理首先用于测量浮游植物的光合作用6,并且仍然常用6,7。它比较了在光线下保存的瓶子中的氧气变化率(包括初级生产力和呼吸的影响)与在黑暗中保存的氧气(仅呼吸)8。该方法使用氧气释放(光合作用)作为初级生产力的代表。测量的变量是生态系统净生产力(NEP,在光照条件下O 2浓度随时间的变化)和生态系统呼吸(RE,在黑暗中O2浓度随时间的变化)。生态系统总生产力(GEP)是计算两者之间的差异(表1)。这里使用术语"生态系统"来表示周生植物由自养和异养生物组成。这种传统腔室方法最显着的改进是使用无创氧光学传感器并优化这种主要浮游方法来测量周生初级生产力。
该技术在测量捷克共和国新出现的采矿后湖泊沿海区的微生物垫的例子中进行了描述 - 米拉达,莫斯特和梅达尔。微生物垫的代谢活性是通过直接在特定深度进行的O2通量的直接原位测量来确定的,研究的群落自然发生。异养和光养活性在配备无创光学氧传感器的封闭玻璃瓶中测量。这些传感器使用光敏染料的荧光检测氧分压。将带有微生物垫的瓶子悬浮并在适当深度的浮动装置上孵育。瓶内的氧气浓度在白天从小船上连续测量。
收集完整微生物垫的样品,并由水肺潜水员放置在指定深度的气密孵化瓶中。每个瓶子都配备了一个非侵入式光学氧微传感器,可随着时间的推移监测O2 的生产率/消耗量。所有测量在每个深度的五个重复暗/亮对中进行。在整个孵育过程中,在各自的深度测量温度和光合有效辐射(PHAR)强度。原 位 孵育6小时后(白天),从瓶中收获微生物垫并干燥。O2 通量归一化为微生物生物质。作为对照,在单独的浅色和深色气密瓶(空白对照)中校正通量的变化,该瓶子含有不含微生物垫生物质的湖水。以下是建造浮动驳船和逐步执行整个实验的详细说明。本文还介绍了在两个深度(1 m和2 m)测量微生物垫的代表性结果,每个深度重复五次。在整个实验过程中,使用数据记录器测量实际温度和光强度。
研究方案
注意:在抽样之前,请根据总体项目需求、统计设计或预期的样本变异量确定复制程度。建议使用五对重复的浅色和深色培养瓶进行精确的统计分析,并考虑潜在的样品损失或破损。所述浮动实验驳船设计为携带五个重复品和一对空白对照;实验驳船的技术图纸见 图1 。
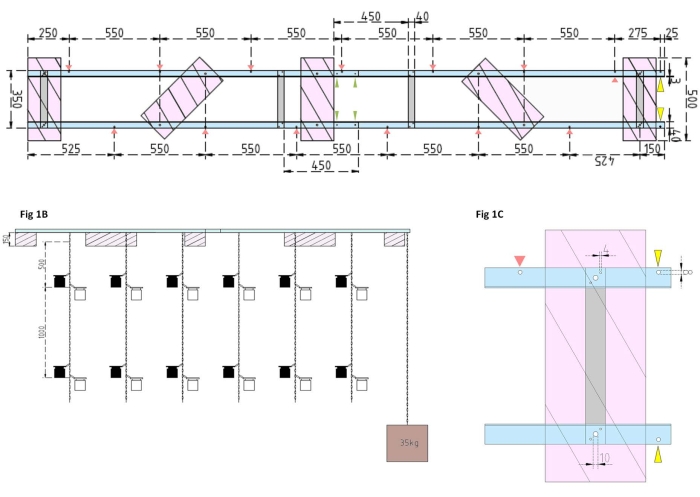
图1:实验驳船和侧浮子的技术图纸 。 (A)顶视图:驳船的框架由四个铝角L型材(蓝色)组成,这些型材由四个铝扁钢(灰色)连接在一起。XPS浮子(粉红色)安装在框架上的两个点上,每个点都位于平行的铝片上。用于孵化瓶的链条使用预钻孔(红色箭头)中的卡扣钩固定在两侧的框架上,它们之间的间隔为 550 毫米。链在1 m和2 m距离处设有卡扣钩,用于孵化瓶连接(根据实验深度选择卡扣位置)。混凝土锚固定在驳船的船头上,其中25毫米的悬垂允许两个预钻孔(黄色箭头)作为锚链和研究船的连接点。框架可通过四个铝角件(绿色箭头)之间的平行接头 轻松 组装或拆卸。(B)侧视图显示了悬挂的链条,悬挂着孵化瓶和混凝土锚(棕色正方形)。(C)侧面XPS浮子:平行铝角L件(蓝色)由垂直铝扁钢(灰色)连接。在横杆部分下方,XPS浮子(粉红色)安装有指示的必要孔尺寸(4 mm)。悬挂的链条用卡扣钩固定在 8 毫米孔(红色箭头)中。在驳船的船头,在悬垂的铝上钻了两个8毫米的孔,一个用于将锚固定在驳船上(黄色箭头),另一个用于将研究船系泊在驳船上(蓝色)。 请点击此处查看此图的大图。
1.实验驳船的建造
注意:浮动驳船由两个相等的部分组成,安装在一起,便于组装/拆卸。所有二手零件都可以在任何爱好市场或销售建筑材料的商店购买。
- 首先,使用四个铝制扁钢(40 mm x 3 mm x 350 mm)、16 个螺钉(4 mm x 15 mm,带六角螺母)和 32 个垫圈(4 mm x 10 mm)将四个铝角 L 型材(40 mm x 40 mm x 3 mm;长度 2,000 mm)连接在一起,组装 驳船的框架 。
注意:扁钢的距离和位置如图 1A的技术图纸所示。浮子与侧扁杆的详细连接如图 1B所示。 - 要 连接框架的两个相等部分,请使用四个带翼形螺母的 4 mm x 15 mm 螺钉和八个 4 mm x 10 mm 垫圈将铝角 L 型材在末端拧在一起(图 1A,绿色箭头)。
- 使用五块挤塑聚苯乙烯 (XPS) 材料 (500 mm x 200 mm x 150 mm)、十个带六角螺母的 10 mm x 170 mm 螺钉和 20 个 10 mm x 50 mm 垫圈制备 五个挤塑聚苯乙烯浮子 (每个 500 mm x 200 mm x 150 mm)。将浮子连接到框架的技术图纸中显示的五个点(图1A)。
- 在框架中钻孔(参见 图 1A 中的红色箭头,标记链条孔的位置和距离)。使用钢制登山扣钩(50 mm x 5 mm)将用于孵化瓶的 12 m 钢链(线径为 3 mm,内链为 5.5 mm x 26 mm)连接到框架中的孔上。为每个链条提供一对卡扣钩(50 mm x 5 mm),用于根据实验设计将孵育瓶安装到所需深度。在这种情况下,他们坐在 1 m 和 2 m 的深度。
- 对于锚,用混凝土填充 15 L 桶。将吊环螺栓插入混凝土中,使其不受干扰地干燥。将 5 m 长的钢链固定在挂钩上。将锚固定在驳船船头的预钻孔上(图 1A、B 中用黄色箭头标记)。
注意:带有组件说明的技术图纸如图 1A-C 所示。图 2 显示了组装好的实验驳船的照片。图3显示了孵育瓶与链条的连接。
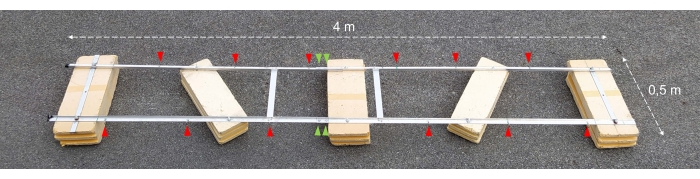
图 2:组装好的实验驳船。 组装好的实验驳船的照片。红色箭头显示了用于连接带有孵化瓶的链条的孔。绿色箭头指向浮子的两半连接在一起的位置。 请点击此处查看此图的大图。

图 3:孵育瓶。 悬挂在 1 m 深度的两对深色和浅色培养瓶的照片。一对瓶子包含仍在石头上生长的完整微生物垫样本(红色箭头)。第二个是空白瓶子,里面有各自深度的湖水。黄色箭头指向附着在孵育瓶内壁上的氧传感器点。 请点击此处查看此图的大图。
2. 现场安装
- 建议使用充气皮划艇放置和进行实验,因为它易于运输。
- 选择一个具有理想深度的地方来锚定浮子。选择深度,使下部培养瓶至少高于底部 2 m,以避免将沉积物干扰到孵化瓶周围的水柱中。
- 将组装好的驳船安装在船尾后面。小心地将船的侧面的锚降低并对齐,使其略微悬挂在水面以下,以便浮子可以轻松地与锚一起拖到所需深度的位置。
- 从船上解开锚,将其降低到底部,然后将驳船固定在锚链上。
- 固定链条,将孵化瓶连接到驳船上。
3. 培养瓶制备
- 使用带气密密封的透明宽颈 0.5 L 瓶。
注意:可以调整瓶子的尺寸,但请记住使用更多的聚苯乙烯板增加驳船的漂浮力。这里描述的驳船可以可靠地运载 24 个 0.5 升玻璃瓶。 - 将氧光学传感器斑点连接到每个瓶子的内壁上。
- 用黑色电工胶带包裹深色处理瓶,在深色处理瓶上添加不透明层。
- 用光学传感器在光斑上切一个小孔。为防止光线进入瓶子,请将孔略小于传感器的直径。
注意:任何阻止光线进入瓶子的不透明层也可以工作。黑色电工胶带的优点是耐磨,在水中不剥落。
4. 样品收集和处理
注意:潜水员在更深的水中手动采集样本。在浅水中,可以通过浮潜或涉水来完成。
- 将孵育瓶放入便携式盒子中。
- 带着盒子潜入相应的深度。避免干扰周围水中的沉积物。
- 小心地用样品填充孵育瓶。尝试尽可能少地干扰样品的生物量,例如,使用长镊子。如果微生物垫生长在固体表面上,例如小石头,请小心地将带有完整生物质的整块石头转移到瓶子中。
注意:当取样垫生长在石头上时,避免收集大石头 - 玻璃瓶在进一步操作过程中可能会破碎。 - 用各自深度的清水填充一对浅色/深色瓶子,作为空白对照。
注意:没有周生菌样品的瓶子可作为确定环境水生物的氧气产生/消耗的对照。它确保计算出的周生植物的净或毛初级生产力是无偏差的。 - 确保所有培养瓶中的水都是干净的,并且不含令人不安的沉淀物。
- 关闭瓶子并将它们带到锚定在浮动驳船上的船上。
5. 衡量初级生产力
注意:坐在船上的人从潜水员手中接过盒子并执行以下步骤。
- 将前两对孵化瓶连接到第一条链上的卡扣上。
- 使用光纤氧仪测量每个瓶子中的初始氧气浓度。将仪表的光缆连接到安装在瓶内的氧传感器上,并立即(在几秒钟内)读取O2 浓度非接触式(通过瓶壁)。记录测量值。
注意:备货时间短;从从潜水员那里取瓶子到初始设置到相应的深度,只需几分钟。 - 之后,立即小心地将带有附加瓶子的链条放回水中。确保孵育瓶放置在与放入其中的生物质取样相同的深度。
- 1小时后从船上进行另一次测量(见下面的注释)。小心地将带有瓶子的每个链条拉入船中,通过将光缆连接到传感器来读取氧气值,然后再次将样品放入水中。
注意:根据样品的O2 生产率/消耗强度调整孵育期间单独测量之间的时间,以避免瓶子过饱和。 - 用所有成对的瓶子重复此过程至少四到五次。
注意:现场实验的整个设置如图 4所示。
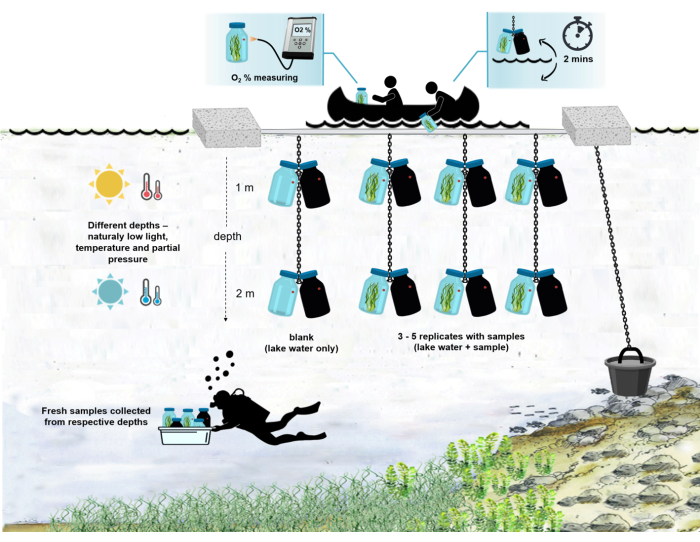
图 4:现场实验设置的模式。 锚定在湖面上的实验驳船的插图。带有微生物垫生物质的孵育瓶(0.5 L)悬挂在两个不同的深度(1 m和2 m)。潜水员将微生物垫样品直接收集到适当深度的培养瓶中。单个瓶子中的氧气浓度是从船上测量的。将瓶子从水中拉出。通过将光缆连接到氧传感器,在几秒钟内测量氧气浓度值。然后将瓶子小心地放回水中。从两个深度测量两对孵育瓶的整个过程需要~2分钟。 请点击此处查看此图的大图。
6. 样品分析
- 测量结束后,直接从瓶子中取样,并将微生物垫的生物质转移到小塑料瓶中。如果垫子生长在固体基质(例如石头)上,请用牙刷或小刀擦洗。
- 在实验室中,通过预先称重的玻璃纤维过滤器进行每次重复过滤,以确定干重9.
7. 数据分析
- 在孵育期间,测量浅色和深色瓶中的氧气浓度,并将其与装满瓶子时水柱中的氧气浓度进行比较。
注意:光瓶中氧气随时间的变化是生态系统总生产力(GEP)和瓶中所有生物(来自环境水和周生群落的自养生物和异养生物)呼吸的综合结果。深色瓶中氧气的减少测量了自养生物和异养生物的呼吸损失。对照(即没有周生植物的瓶子)中氧浓度的变化只是环境水中异养或自养生物的产物。通过减去空白培养瓶中测量的环境水生产力和呼吸来估计周围生菌生产力和呼吸。 - 记下氧饱和度百分比的O2 浓度(即,将氧传感器校准为0%和100%氧饱和度)。在估计主要生产率之前,将原始数据 (
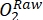 ) 转换为某个合理的单位。
) 转换为某个合理的单位。
注意:在本研究中,根据Benson和Krause10,数据转换为每克有机物(OM)在干重基础上的周围植物质量O2的mmol。- 使用公式 (1) 计算转换:
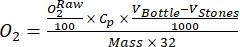 (1)
(1)
其中Cp是O 2在水中的O 2浓度(mg (O 2) L-1),当它被O 2完全饱和时,V瓶是瓶子的体积,单位为mL,VStones是石头占据的体积,单位为mL,是周围植物质量的重量,单位为g,32是O 2的摩尔重量。 - 使用公式 (2) 计算 Cp:
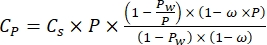 (二)
(二)
其中Cs为标准O2浓度,P为湖面大气压,Pw为湖面水蒸气分压,ω为水密度。 - 当已知湖泊高程(以公里为单位)和湖面水温(t以°C为单位)时,根据先前定义的经验方程(3-6)计算Cs,ω,P和Pw:
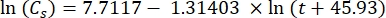 (三)
(三)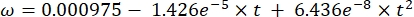 (四)
(四)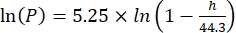 (五)
(五)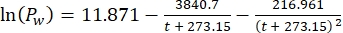 (六)
(六)
注意:从公式(1-6)中可以明显看出,计算出的O2浓度对于浅层最准确。随着深度的增加,计算出的浓度在绝对浓度方面变得更加偏差。当每个湖泊沿深度的氧气浓度变化率已知时,这是最佳的,以便在必要时可以校正绝对O2浓度。一旦计算出O 2浓度,其随时间的变化可用于计算两种不同条件下的两种不同的O2通量。在光照条件下,生态系统净生产力(NEP)与O2浓度随时间的变化成正比(见下文)。这里使用术语"生态系统"来表示周生植物由自养和异养生物组成。在黑暗中,O2浓度随时间的变化与自养和异养生物的呼吸损失总和成正比,从而定义了生态系统呼吸(RE)。NEP和RE之间的差异定义了生态系统总生产力(GEP)。如果群落异养部分的呼吸损失可以忽略不计,GEP就等于生态系统的总生产力。
- 使用公式 (1) 计算转换:
- 通过三阶多项式回归确定O2 浓度随时间的变化率,如公式(7)所示。
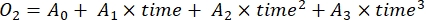 (七)
(七)
其中 A 0 是时间零处的 O 2 浓度,A 1-A2 是多项式回归系数。
注意:使用多项式函数是因为它可以用作任何微分方程的近似值。因此,没有必要知道O2浓度与时间之间的准确功能关系。因此,不需要控制与功能关系相关的任何假设(例如线性)。根据定义,多项式回归的第二项,A 1 定义了 O 2 浓度在时间零的变化率(即瞬时速率),它与 A0 无关,因此与时间零处的绝对 O 2 浓度无关。因此,O 2 通量的估计不受绝对 O2 浓度计算中由深度梯度上的压力变化引起的偏差的影响。A 1 每次(在本研究中为 1 小时)具有单位 O2(mmol g(OM)-1)。- 计算A1,分别计算有和没有暴露在光线下并含有微生物垫生物质的瓶子(即V石>0)和有和没有暴露在光下并含有自由水的对照瓶(即V石= 0)。
注意:将这些不同的回归系数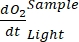 分别分配符号、、
分别分配符号、、 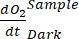
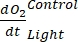 和
和 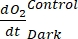 ,生产率 GEP 计算的等式 (8) 可以写为:
,生产率 GEP 计算的等式 (8) 可以写为: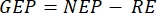 (8.1)
(8.1)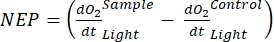 (8.2)
(8.2)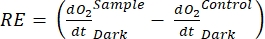 (8.3)
(8.3)
该术语定义了生态系统净生产力(图5A;即净氧生产力),该术语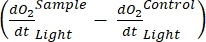
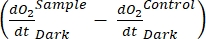 表示自养和异养呼吸的总和(图5B;RE,即假设两种呼吸在黑暗和明亮条件下相似)。
表示自养和异养呼吸的总和(图5B;RE,即假设两种呼吸在黑暗和明亮条件下相似)。 - 从NEP中减去R以获得GEP(图5C)。
注意:等式 (8) 隐式假设 和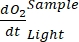
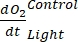 既是正数,
既是正数,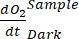
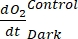 又是负数。如果为正数,请
又是负数。如果为正数,请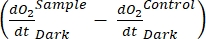 仔细检查原始数据中的异常值。 理论上可能是负的,因为由异养活动引起的呼吸损失可能高于光合活动。
仔细检查原始数据中的异常值。 理论上可能是负的,因为由异养活动引起的呼吸损失可能高于光合活动。 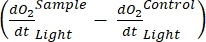
- 计算A1,分别计算有和没有暴露在光线下并含有微生物垫生物质的瓶子(即V石>0)和有和没有暴露在光下并含有自由水的对照瓶(即V石= 0)。
结果
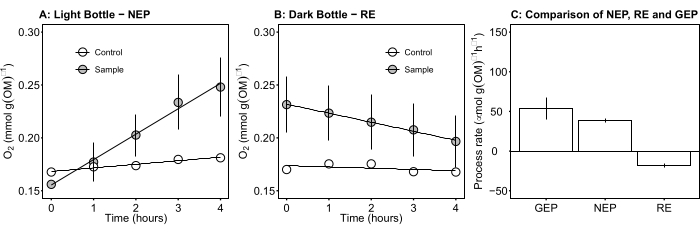
图5:白天微生物垫的净和总生态系统生产力。(A)光瓶-网生态系统生产力:光瓶微生物垫净氧生产力的时间过程数据。在日光下1小时后测量孵育瓶中的氧气浓度变化。灰色圆圈:装有微生物垫样品的瓶子。白色圆圈:只有湖水的空白瓶子。(B)暗瓶呼吸:
讨论
本文中描述的方法基于明暗瓶氧技术的原理,结合使用光学氧传感器测量O2 浓度的无创技术。该系统允许并行测量不同的孵育设置,因为用于测量O2 的光纤可以在瓶子之间快速移动。不同深度的底栖生物群落在生物分类组成和生产力方面可能不同;同时以平行方式测量它们可以节省时间并使结果更加精确,从而能够计算周生植物生长的全深度剖面。集成在摇瓶中的非侵入式氧传感?...
披露声明
作者确认他们没有利益冲突需要披露。
致谢
这项研究得到了捷克科学基金会(GACR 19-05791S)、RVO 67985939和CAS在战略AV 21"土地保护和恢复"计划范围内的支持。非常感谢Ondřej Sihelský在现场拍摄 - 没有他,拍摄将完全是地狱。如果没有与Palivový Kombinát Ústí s.p.和Sokolovská Uhelná公司的密切合作,该项目就不可能实现,这些公司提供了进入所研究地区的通道。
材料
| Name | Company | Catalog Number | Comments |
| Aluminum angle L profile 40 x 40 mm x 3 mm, length 2,000 mm | |||
| Aluminum flat bar 40 x 3 x 350 mm | |||
| Bucket 15 L with concrete infill | |||
| Carabine hook with screw lock 50 x 5 mm | |||
| electric tape black | |||
| Extruded polystyrene (XPS) material 500 x 200 x 150 mm | |||
| Fibox 3 LCD trace | PreSens Precision Sensing GmbH | stand-alone fiber optic oxygen meter | |
| Hondex PS-7 Portable Depth Sounder | Hondex - Honda Electronics | to measures distances through water - to bottom depth measurement; https://www.honda-el.net/industry/ps-7e | |
| KORKEN - glass tight-seal jar 0.5 L | IKEA | incubation bottles; https://www.ikea.com/cz/en/p/korken-jar-with-lid-clear-glass-70213545/ | |
| metal hook | |||
| Oxygen Sensor Spot SP-PSt3-NAU-D5 | PreSens Precision Sensing GmbH | non-invasive optical oxygen sensor for measurements under Real Conditions | |
| SCOUT infantable canoe | GUMOTEX | https://www.gumotexboats.com/en/scout-standard#0000-044667-021-13/11C | |
| Screw 10 x 170 mm with hexagonal nuts | |||
| Screw 4 x 15 mm with hexagonal nuts | |||
| Screw 4 x 15 mm with wing nuts | |||
| Snap hooks 50 x 5 mm | |||
| Steel Carabine hook 50 x 5 mm | |||
| Steel chain with wire diameter 3 mm, inside link 5.5 x 26 mm | |||
| Steel chain, 5 m | |||
| toothbrush | |||
| tweezer | |||
| Washer 10 x 50 mm | |||
| Washer 4 x 10 mm | |||
| Washer 4 x 10 mm |
参考文献
- Blachart, J. L., et al. Potential consequences of climate change for primary production and fish production in large marine ecosystems. Philosophical Transactions of the Royal Society B: Biological Sciences. 367 (1605), 2979-2989 (2012).
- Howarth, R. W., Michaels, A. F., Sala, O. E., Jackson, R. B., Mooney, H. A., Howarth, R. W. The Measurement of primary production in aquatic ecosystems. Methods in Ecosystem Science. , 72-85 (2000).
- Vadenbecouer, Y. E. G., Peterson, M. J., Vander, Z., Kalff, J. Benthic algal production across lake size gradients: Interactions among morphometry, nutrients, and light. Ecology. 89 (9), 2542-2552 (2008).
- Reimer, A., Landmann, G., Kempe, S. Lake Van, eastern Anatolia, hydrochemistry and history. Aquatic Geochemistry. 15 (1), 195-222 (2009).
- Cantonati, M., Lowe, R. L. Lake benthic algae: toward an understanding of their ecology. Freshwater Sciences. 33 (2), 475-486 (2014).
- Gaarder, T., Gran, H. H. Investigation of the production of plankton in the Oslo Fjord. Rapports et Proces-verbaux des Réunions. Conseil International pour l'Éxploration de la Mer. 42, 1-48 (1927).
- Hall, R. O., Thomas, S., Gaiser, E. E., Fahey, T. J., Knapp, A. K. Measuring Freshwater Primary Productivity and Respiration. Principles and Standards for Measuring Primary Productivity. , (2007).
- Howart, R., Michaels, A. Chapter 6 The Measurement of Primary Production in Aquatic Ecosystems. Springer Science and Business Media LLC. , (2000).
- Kopáček, J., Hejzlar, J. Semi-micro determination of total phosphorus in soils, sediments, and organic materials: a simplified perchloric acid digestion procedure. Communications in Soil Science and Plant Analysis. 26 (11-12), 1935-1946 (1995).
- Benson, B. B., Krause, D. The concentration and isotopic fractionation of oxygen dissolved in freshwater and seawater in equilibrium with the atmosphere1. Limnology and Oceanography. 29 (3), 620-632 (1984).
- Dodds, W. K., Biggs, B. J., Lowe, R. L. Photosynthesis-irradiance patterns in benthic microalgae: variations as a function of assemblage thickness and community structure. Journal of Phycology. 35 (1), 42-53 (1999).
- Bott, T. L., et al. An evaluation of techniques for measuring periphyton metabolism in chambers. Canadian Journal of Fisheries and Aquatic Sciences. 54 (3), 715-725 (1997).
- Blankenship, R. E. Structural and functional dynamics of photosynthetic antenna complexes. Proceedings of the National Academy of Sciences. 112 (45), 13751-13752 (2015).
- Hawes, I., Schwartz, A. -. M. Photosynthesis in an extreme shade environment, benthic microbial mats from Lake Hoare, a permanently ice-covered Antarctic lake. Journal of Phycology. 35 (3), 448-459 (1999).
- Aristegui, J., et al. Planktonic primary production and microbial respiration measured by 14C assimilation and dissolved oxygen changes in coastal waters of the Antarctic peninsula during austral summer: Implications for carbon flux studies. Marine Ecology-Progress Series. 132, 191-201 (1996).
- Steemann-Nielsen, C. The use of radioactive carbon (14C) for measuring organic production in the sea. Journal of Experimental Marine Biology and Ecology. 18 (2), 117-140 (1952).
- Sanz-Martín, M., et al. Relationship between carbon-and oxygen-based primary productivity in the Arctic Ocean, svalbard archipelago. Frontiers in Marine Science. 6, 468 (2019).
- Nielsen, E. S. Measurement of the production of organic matter in the sea by means of carbon-14. Nature. 167 (4252), 684-685 (1951).
- Jönsson, B. A 14C-incubation technique for measuring microphytobenthic primary productivity in intact sediment cores. Limnology and Oceanography. 36 (7), 1485-1492 (1991).
- Bender, M. L., et al. A comparison of four methods for determining planktonic community production. Limnology and Oceanography. 32 (5), 1085-1098 (1987).
- Šimek, K., et al. Spatio-temporal patterns of bacterioplankton productivity and community composition related to phytoplankton composition and protistan bacterivory in a dam reservoir. Aquatic Microbial Ecology. 51 (3), 249-262 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。