このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
レンティック水域のペリフィトン群集の その場 一次生産性を低コストに測定する方法
要約
ここでは、実際の in situ 環境温度および光条件下で微生物マットの一次生産性を測定するための費用効果が高く、輸送可能な方法/施設を紹介します。実験セットアップは広く入手可能な材料に基づいており、実験室ベースのモデルの利点を提供しながら、さまざまな条件下で使用できます。
要約
生育期勾配におけるペリフィトンの 原位置 一次生産性を測定することで、一次生産性に対する環境ドライバー(主にリン濃度と光強度)と種組成の定量的影響を解明することができます。一次生産性は、主に光強度によって駆動されます, 温度, 栄養素の利用可能性, および真光帯のそれぞれの深さにおける炭酸塩系のイオン種の分布.実験室でシミュレートすることは非常に難しい複雑なシステムです。この安価で運搬可能で、構築が容易なフローティングバージは、実際の自然条件下で一次生産性を正確に直接測定することができます。この方法論は、密閉されたガラス瓶に統合された非侵襲的酸素センサーを使用して一次生産性をリアルタイムで測定することに基づいており、オンライン酸素フラックスモニタリングを可能にし、代謝活動に関する新しい洞察を提供します。微生物マット(または他の底生生物)の総一次生産性の詳細な季節 的in situ 測定は、レンティック水中の一次生産性ダイナミクスを制御するプロセスに関する現在の知識を向上させることができます。
概要
一次生産は、システム全体の食物網を形成する水系への自生炭素の唯一の侵入です1。したがって、一次生産性の正確な推定は、水生生態系の機能を理解するための重要なステップです。沿岸地帯は、一次生産性と生物多様性の高い地域です。植物プランクトンに加えて、ペリフィトン(以下、微生物マットと呼ぶ)と大型藻類が沿岸域の一次生産性に大きく貢献していると考えられています2。彼らの固着したライフスタイルと著しい空間的不均一性のために、一次生産性の定量化は自明ではありません。
一次生産性は、主に光強度、温度、栄養素の利用可能性、および共光帯3,4のそれぞれの深さにおける炭酸塩系のイオン種の分布によって駆動されます。深さは微生物マットの空間分布に著しく影響します。微生物群集は、浅い深さでの高照射と顕著な季節温度変化の悪影響に対処し、より深い深さではより低い光強度に対処する必要があります。深さ勾配に加えて、動的栄養相互作用は異なるスケールで複数の複雑な空間パターンを生成します5。この複雑なシステムは、実験室でシミュレートするのが複雑です。沿岸域から個々の一次生産者の代謝活性を推測する最も正確な方法は、in situ実験を設定することです。
本稿で紹介する方法論は、従来のチャンバー法2,6,7と、輸送可能で建造が容易な低コストのフローティングバージに基づいています。これにより、自然光スペクトル、温度、および深さに伴う炭酸塩系のイオン種の異なる分布の下で、異なる深さでの一次生産性の測定が可能になります。この方法は、植物プランクトンの光合成を測定するために最初に採用され6、現在でも一般的に使用されている明るいボトル酸素と暗いボトル酸素の原理に基づいています6,7。光の中に保たれたボトル内の酸素の変化率(一次生産性と呼吸の影響を含む)と暗所に保たれたもの(呼吸のみ)を比較します8。この方法は、一次生産性の代理として酸素発生(光合成)を使用します。測定された変数は、正味の生態系生産性(NEP、光条件下での経時的なO2濃度の変化として)および生態系呼吸(RE、暗所での経時的なO2濃度の変化として)である。総生態系生産性(GEP)は、2つの差の計算です(表1)。ここでは「生態系」という用語は、ペリフィトンが独立栄養生物と従属栄養生物で構成されていることを示すために使用されます。この従来のチャンバー法の最も重要な改善点は、非侵襲的酸素光学センサーを使用し、周辺一次生産性を測定するためのこの主にプランクトンの方法を最適化することです。
この技術は、チェコ共和国の新たに出現した採掘後の湖の沿岸域の微生物マットを測定する例で説明されています-ミラダ、モスト、およびメダール。微生物マットの代謝活性は、研究されたコミュニティが自然に発生する特定の深さで直接行われるO2フラックスの直接in situ測定を使用して決定されます。従属栄養活性および光合成活性は、非侵襲的光学酸素センサーを備えた密閉ガラス瓶で測定されます。これらのセンサーは、感光性色素の蛍光を使用して酸素分圧を検出します。微生物マットの入ったボトルを懸濁し、適切な深さのフローティングデバイスでインキュベートします。ボトル内の酸素濃度は、小型ボートから日中連続的に測定されました。
無傷の微生物マットのサンプルが収集され、スキューバダイバーによって指定された深さの気密インキュベーションボトルに入れられます。各ボトルには、O2 の生産性/消費量を経時的に監視する非侵襲的な光学式酸素マイクロセンサーが装備されています。すべての測定は、各深さで5つの反復暗/明ペアで行われます。温度と光合成有効放射(PHAR)強度は、インキュベーション全体を通してそれぞれの深さで測定されます。6時間の in situ インキュベーション(日中)の後、微生物マットをボトルから回収し、乾燥させます。O2 フラックスは微生物バイオマスに正規化されています。対照として、微生物マットバイオマスを含まない湖水を含む明暗気密ボトル(ブランクコントロール)のO2濃度の変化をフラックス補正します。以下は、フローティングバージを構築し、実験全体を段階的に実行するための詳細な手順です。この論文はまた、2つの深さ(1 mと2 m)での微生物マットの測定からの代表的な結果を示し、各深さで5回の反復を行います。実際の温度と光強度は、データロガーを使用して実験全体を通して測定されました。
プロトコル
注:サンプリングする前に、プロジェクト全体のニーズ、統計的設計、または予想されるサンプルの変動量に基づいて、複製の程度を決定します。正確な統計分析と潜在的なサンプルの損失または破損を説明するために、明るいインキュベーションボトルと暗いインキュベーションボトルの5つの複製ペアが推奨されます。記載された浮遊実験バージは、5回の反復と1対のブランクコントロールを運ぶように設計されています。実験用バージの技術図面については、 図1 を参照してください。
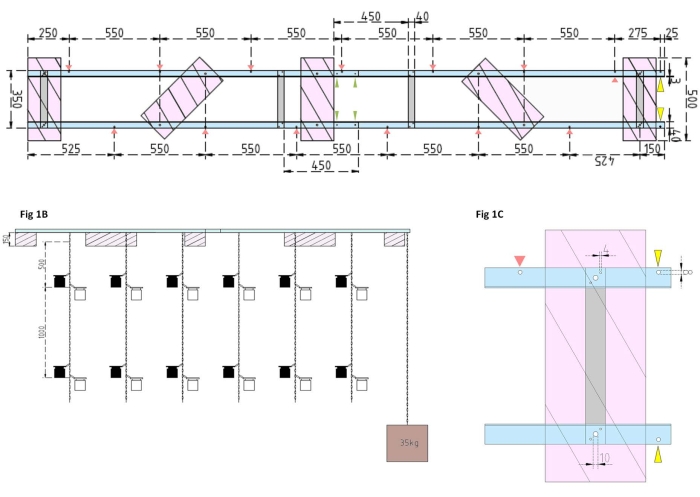
図1:実験用バージとサイドフロートの技術図面 。 (A)上面図:はしけのフレームは、4つのアルミニウムフラットバー(灰色)で結合された4つのアルミニウムアングルLプロファイルピース(青)で構成されています。XPSフロート(ピンク)は、フレームの2点で取り付けられており、それぞれが平行なアルミニウム片に取り付けられています。インキュベーションボトル用のチェーンは、事前に開けられた穴(赤い矢印)にスナップフックを使用して両側のフレームに取り付けられ、それらの間に550 mmの間隔があります。チェーンには、インキュベーションボトルを取り付けるための1 mおよび2 mの距離にスナップフックが設けられました(実験の深さに応じてスナップフックの位置を選択してください)。コンクリートアンカーははしけの船首に固定されており、25 mmの張り出しにより、アンカーのチェーンと調査船の取り付けポイントとして機能する2つの事前に開けられた穴(黄色の矢じり)が可能になります。フレームは、4つのアルミニウムアングルピース(緑色の矢印)間の平行ジョイント を介して 簡単に組み立てまたは分解できます。(B)側面図は、吊り下げられたインキュベーションボトルとコンクリートアンカー(茶色の正方形)を備えた吊り下げられたチェーンを示しています。(C)サイドXPSフロート:平行アルミニウムアングルLピース(青)は、垂直アルミニウムフラットバー(灰色)で結合されています。クロスバーセクションの下に、XPSフロート(ピンク)は、必要な穴サイズ(4 mm)で取り付けられています。吊り下げられたチェーンは、8 mmの穴(赤い矢印)にスナップフックで取り付けられています。はしけの船首には、張り出したアルミニウムに2つの8 mmの穴が開けられており、1つはアンカーをはしけに固定するためのもの(黄色の矢じり)と、調査船をはしけに係留するためのもの(青色)です。 この図の拡大版を表示するには、ここをクリックしてください。
1. 実験用はしけの建造
注意: フローティングバージは、一緒に取り付けられた2つの等しいセクションで構成されており、組み立て/分解が簡単です。すべての中古部品は、趣味の市場や建材を販売する店で購入できます。
- まず、4本のアルミフラットバー(40mm x 3mm x 350mm)、16本のネジ(4mm x 15mm、六角ナット付き)、32本のワッシャー(4mm x 10mm)を使用して、4本のアルミアングルL形(40mm x 40mm x 3mm、長さ2,000mm)を接合して 、はしけのフレームを組み立て ます。
メモ: フラットバーの距離と位置は、 図1Aの技術図面に示されています。サイドフラットバーへのフロートの詳細な取り付けを 図1Bに示します。 - フレームの2つの等しいセクションを結合するには、蝶ナット付きの4 mm x 15 mmネジ4本と4 mm x 10 mmワッシャ8本を使用して、アルミニウムアングルLプロファイルの端をねじ込みます(図1A、緑色の矢印)。
- 5枚の押出ポリスチレン(XPS)材料(500 mm x 200 mm x 150 mm)、六角ナット付きの10 mm x 170 mmネジ10本、および10 mm x 50 mmワッシャー20個を使用して、 5つの押し出しポリスチレンフロート (それぞれ500 mm x 200 mm x 150 mm)を準備します。フロートを技術図面に示されている5点でフレームに取り付けます(図1A)。
- フレームにドリルで穴を開けます(チェーンの穴の位置と距離を示す 図1A の赤い矢印を参照)。インキュベーションボトル用の12mのスチールチェーン(線径3mm、インサイドリンク5.5mm x 26mm)をスチール製のカラビンフック(50mm x 5mm)を使用してフレームの穴に取り付けます。実験計画に従って、インキュベーションボトルを希望の深さに取り付けるためのスナップフックのペア(50 mm x 5 mm)を各チェーンに提供します。この場合、彼らは1 mと2 mの深さに座っていました。
- アンカーには、15 Lのバケツにコンクリートを入れます。コンクリートにアイボルトを挿入し、邪魔されずに乾かします。5 mのスチールチェーンをフックに固定します。はしけの船首にある事前に開けられた穴にアンカーを固定します(図1A、Bの黄色の矢印でマークされています)。
注意: アセンブリの説明を含む技術図面を図1A-Cに示します。図2は、組み立てられた実験用はしけの写真を示しています。図3は、インキュベーションボトルのチェーンへの取り付けを示しています。
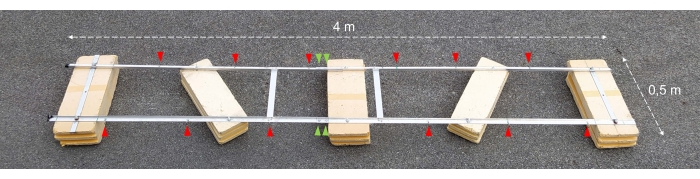
図2:組み立てられた実験用はしけ。 組み立てられた実験用はしけの写真。赤い矢印は、インキュベーションボトルでチェーンを取り付けるための穴を示しています。緑色の矢印は、フロートの2つの半分が結合されている場所を指しています。 この図の拡大版を表示するには、ここをクリックしてください。

図3:インキュベーションボトル。 1 mの深さにぶら下がっている2組の暗いインキュベーションボトルと明るいインキュベーションボトルの写真。1組のボトルには、石の上にまだ成長している無傷の微生物マットのサンプルが含まれています(赤い矢印)。2つ目は、それぞれの深さからの湖の水が入った空のボトルです。黄色の矢印は、インキュベーションボトルの内壁に取り付けられた酸素センサースポットを指しています。 この図の拡大版を表示するには、ここをクリックしてください。
2.現場での設置
- はしけの配置や実験の実施には、持ち運びが簡単なため、インフレータブルカヤックの使用をお勧めします。
- フロートを固定するのに理想的な深さの場所を選択します。インキュベーションボトルの周りの水柱への沈殿物が乱れないように、下部のインキュベーションボトルが底から少なくとも2 m上になるように深さを選択してください。
- 組み立てられたはしけをボートの船尾の後ろに取り付けます。ボートの側面に沿ってアンカーを慎重に下げ、水面からわずかに下にぶら下がるように調整して、フロートをアンカーと一緒に必要な深さのスポットに簡単に牽引できるようにします。
- ボートからアンカーをほどき、底まで下げ、はしけをアンカーチェーンに固定します。
- インキュベーションボトルをはしけに取り付けるためのチェーンを固定します。
3.インキュベーションボトルの準備
- 気密シール付きの透明なワイドネック0.5Lボトルを使用してください。
注意: ボトルのサイズを調整することは可能ですが、ポリスチレンシートを増やしてはしけの浮きを増やすことを忘れないでください。ここで説明するはしけは、24本の0.5Lガラス瓶を確実に運ぶことができます。 - 酸素光学センサースポットを各ボトルの内壁に取り付けます。
- 暗いトリートメントボトルを黒い電気テープで包んで、不透明な層を追加します。
- 光学センサーでスポットに小さな穴を開けます。光がボトルに入るのを防ぐために、穴をセンサーの直径よりわずかに小さくします。
注意: 光がボトルに入るのを防ぐ不透明な層も機能します。黒い電気テープの利点は、摩耗に強く、水中で剥がれないことです。
4. サンプルの採取と取り扱い
注:ダイバーは、より深い水中でサンプルを手動で収集します。浅瀬では、シュノーケリングや水遊びで行うことができます。
- インキュベーションボトルをポータブルボックスに入れます。
- 箱と一緒にそれぞれの深さまで潜ります。周囲の水の堆積物を乱さないでください。
- インキュベーションボトルにサンプルを注意深く満たします。たとえば、長いピンセットを使用して、サンプルのバイオマスをできるだけ乱さないようにしてください。微生物マットが小さな石などの固体表面に成長する場合は、無傷のバイオマスを含む石全体をボトルに慎重に移します。
注:サンプリングマットが石の上に生えるときは、大きな石を集めることは避けてください-ガラス瓶はさらなる操作中に壊れる可能性があります。 - 1組の明るい/暗いボトルに、それぞれの深さからのきれいな水を入れて、空白のコントロールとして機能します。
注:ペリフィトンサンプルを含まないボトルは、周囲の水生物の酸素生成/消費を決定するコントロールとして機能します。それはペリフィトンの計算された正味または総一次生産性が偏りがないことを保証します。 - すべてのインキュベーションボトルの水がきれいで、邪魔な沈殿物が含まれていないことを確認してください。
- ボトルを閉じて、フローティングバージに固定されたボートに持って行きます。
5.一次生産性の測定
注:ボートに座っている人はダイバーから箱を取り、次の手順を実行します。
- 最初の2対のインキュベーションボトルを最初のチェーンのスナップフックに取り付けます。
- 光ファイバー酸素計を使用して、各ボトルの初期酸素濃度を測定します。メーターの光ケーブルをボトル内に取り付けられた酸素センサーに接続し、すぐに(数秒以内に)非接触で(ボトルの壁を通して)O2 濃度を読み出します。測定値を記録します。
注意: 処理時間は短いです。ダイバーからボトルを取り出し、初期設定からそれぞれの深さまで、わずか数分で完了します。 - その直後に、付属のボトルを入れたチェーンを慎重に水に戻します。インキュベーションボトルが、その中に置かれたバイオマスがサンプリングされたのと同じ深さに配置されていることを確認してください。
- 1時間後に船から別の測定を行います(以下の注を参照)。ボトルの入った各チェーンを慎重にボートに引き込み、光ケーブルをセンサーに接続して酸素値を読み取り、サンプルを再び水中に下げます。
注:ボトルの過飽和を避けるために、O2 の生産性/サンプルの消費の強度に応じて、インキュベーション中の個々の測定間の時間を調整してください。 - すべてのボトルペアでこの手順を少なくとも4〜5回繰り返します。
注: 現場での実験の全体的なセットアップを 図 4 に示します。
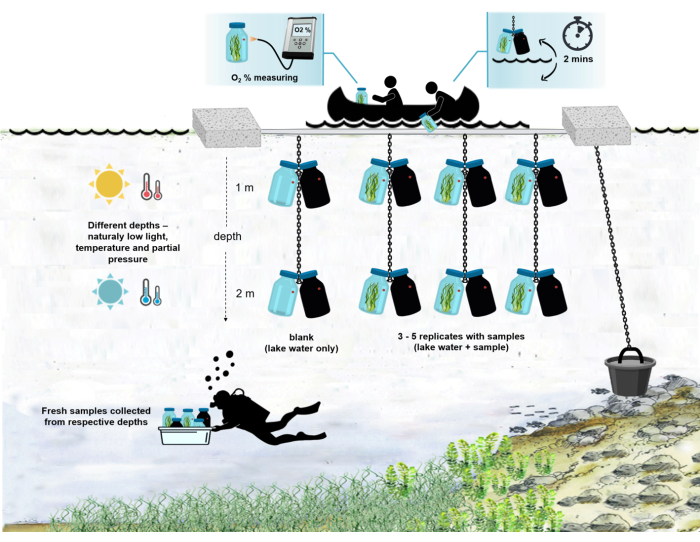
図4:現場での実験セットアップのスキーマ。 湖面に停泊した実験用はしけの図。微生物マットバイオマスを含むインキュベーションボトル(0.5 L)は、2つの異なる深さ(1 mと2 m)に吊るされています。ダイバーは、微生物マットのサンプルを適切な深さのインキュベーションボトルに直接収集しました。個々のボトルの酸素濃度は船から測定されます。ボトルは水から引き出されます。酸素センサーに光ケーブルを接続することにより、酸素濃度値を数秒で測定します。その後、ボトルは慎重に水中に戻されます。2つの深さから2組のインキュベーションボトルを測定する手順全体は~2分かかります。 この図の拡大版を表示するには、ここをクリックしてください。
6. サンプル分析
- 測定終了後、ボトルから直接サンプルを採取し、微生物マットのバイオマスを小さなプラスチックフラスコに移します。マットが固体の基質(石など)で成長する場合は、歯ブラシまたは小さなナイフでこすります。
- 実験室で、各複製物を予め秤量したガラス繊維フィルターを通して濾過し、乾燥重量9を決定した。
7. データ分析
- インキュベーション期間中に、明るいボトルと暗いボトルの酸素濃度を測定し、ボトルが満たされたときの水柱の酸素濃度と比較します。
注:時間の経過に伴うライトボトル内の酸素の変化は、総生態系生産性(GEP)とボトル内のすべての生物(周囲の水と周生生物群集からの独立栄養生物と従属栄養生物)による呼吸を組み合わせた結果です。暗い瓶の中の酸素の減少は、独立栄養生物と従属栄養生物の両方の呼吸損失を測定します。対照(すなわち、ペリフィトンのないボトル)における酸素濃度の変化は、周囲水中の従属栄養生物または独立栄養生物の産物のみである。ペリフィトンの生産性と呼吸は、空のインキュベーションボトルで測定された周囲の水の生産性と呼吸を差し引くことによって推定されました。 - 酸素飽和度でO2 濃度を書き留めます(つまり、酸素センサーを0%および100%の酸素飽和度に校正します)。一次生産性を見積もる前に、生データ(
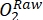 )を妥当な単位に変換します。
)を妥当な単位に変換します。
注:この研究では、BensonとKrause10によると、データは乾燥重量ベースでペリフィトン質量の有機物(OM)1グラムあたりO2のmmolに変換されます。- 式 (1) を使用して変換を計算します。
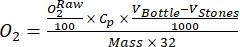 (1)
(1)
ここでCpは水中のO2濃度(mg(O2)L-1)O2で完全に飽和している場合、VボトルはmL単位のボトルの体積であり、VストーンはmL単位の石の占める体積であり、g単位のペリフィトン質量の重量であり、32はO2のモル重量である。 - 式 (2) を使用して Cp を計算します。
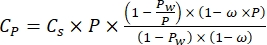 (2)
(2)
ここで、Csは標準O2濃度、Pは湖面の大気圧、Pwは湖面の水蒸気分圧、ωは水密度である。 - 湖の標高(km単位のh)と湖面の水温(t(°C)がわかっている場合、以前に定義された経験式(3-6)からCs、ω、P、およびP wを計算します。
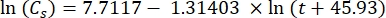 (3)
(3)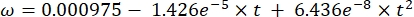 (4)
(4)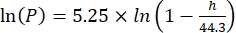 (5)
(5)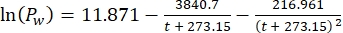 (6)
(6)
注:式(1〜6)から、計算されたO2濃度は浅い深さで最も正確であることは明らかです。深さが増すにつれて、計算された濃度は絶対濃度に関してより偏ります。必要に応じて絶対O2濃度を補正できるように、湖ごとに深さに沿った酸素濃度の変化率がわかっている場合に最適です。一旦O2濃度が計算されると、その経時変化を用いて、2つの異なる条件でのO2の2つの異なるフラックスを計算することができる。光条件下では、正味生態系生産性(NEP)は、経時的なO2濃度の変化に正比例します(下記参照)。ここでは「生態系」という用語は、ペリフィトンが独立栄養生物と従属栄養生物で構成されていることを示すために使用されます。暗所では、経時的なO2濃度の変化は、独立栄養生物と従属栄養生物の呼吸損失の合計に比例するため、生態系呼吸(RE)が定義されます。NEPとREの違いは、総生態系生産性(GEP)を定義します。コミュニティの従属栄養部分の呼吸損失がごくわずかである場合、GEPは生態系の総生産性と等しくなります。
- 式 (1) を使用して変換を計算します。
- 式(7)に示すように3次多項式回帰により経時的なO2濃度の変化率を求める。
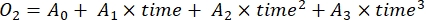 (7)
(7)
ここで、A0は時間ゼロにおけるO2濃度であり、A1−A2は多項式回帰係数である。
注: 多項式関数は、任意の微分方程式の近似として機能するため、使用されます。したがって、O2濃度と時間との正確な機能関係を知る必要はない。したがって、関数関係に関連するいかなる仮定(例えば、線形性)も制御される必要はない。定義により、多項式回帰の第2項であるA1は、時間ゼロにおけるO2濃度の変化率(すなわち、瞬間速度)を定義し、これはA0とは無関係であり、したがって、時間ゼロにおける絶対O2濃度とは無関係である。そのため、O2フラックスの推定値は、深さ勾配を横切る圧力変化によって生じる絶対O2濃度計算のバイアスの影響を受けない。A 1は、時間あたり(この研究では1時間)単位O2(mmol g(OM)-1)を有する。- A 1を計算し、光への曝露の有無にかかわらず微生物マットバイオマスを含むボトル(すなわち、V Stones > 0)と、光への曝露の有無にかかわらず自由水を含む対照ボトル(すなわち、VStones = 0)について別々に計算する。
注:これらの異なる回帰係数表記 、、、およびをそれぞれ割り当てると、
、、、およびをそれぞれ割り当てると、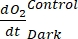
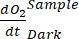
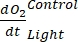 生産性GEP計算の式(8)は次のように記述できます。
生産性GEP計算の式(8)は次のように記述できます。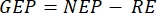 (8.1)
(8.1)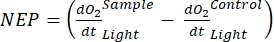 (8.2)
(8.2)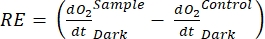 (8.3)
(8.3)
この用語は、正味の生態系生産性(図5A;すなわち、正味酸素生産性)を定義し、この用語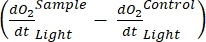
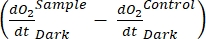 は独立栄養呼吸と従属栄養呼吸の合計を表します(図5B;RE、すなわち、両方の呼吸が暗い条件と明るい条件下で類似していると仮定する)。
は独立栄養呼吸と従属栄養呼吸の合計を表します(図5B;RE、すなわち、両方の呼吸が暗い条件と明るい条件下で類似していると仮定する)。 - NEPからRを減算してGEPを求めます(図5C)。
注: 式 (8) は、と が両方とも正であり、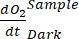 かつ
かつ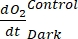 両方とも負であることを暗黙的に前提と
両方とも負であることを暗黙的に前提と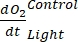 しています
しています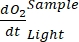 。が陽性の場合は
。が陽性の場合は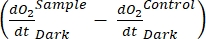 、従属栄養活性によって引き起こされる呼吸損失が光合成活性よりも高くなる可能性があるため、
、従属栄養活性によって引き起こされる呼吸損失が光合成活性よりも高くなる可能性があるため、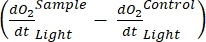 理論的には陰性である可能性がある。
理論的には陰性である可能性がある。
- A 1を計算し、光への曝露の有無にかかわらず微生物マットバイオマスを含むボトル(すなわち、V Stones > 0)と、光への曝露の有無にかかわらず自由水を含む対照ボトル(すなわち、VStones = 0)について別々に計算する。
結果
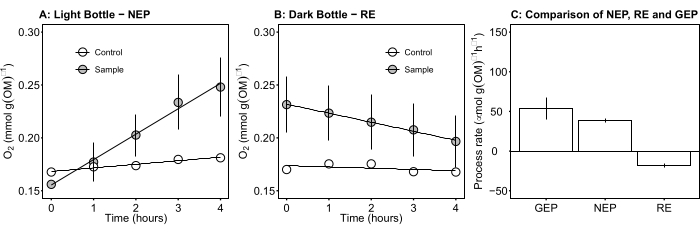
図5:日中の微生物マットの正味および総生態系生産性。(A)ライトボトル-ネット生態系生産性:ライトボトルからの微生物マットの正味酸素生産性の経時変化データ。インキュベーションボトル内の酸素濃度変化は、日中の1時間後に測定されました。灰色の円:微生...
ディスカッション
この論文で説明されている方法論は、光学酸素センサーを使用してO2 濃度を測定する非侵襲的技術を組み合わせた明暗ボトル酸素技術の原理に基づいています。このシステムは、O2 を測定するための光ファイバをボトルからボトルに素早く移動させることができるため、異なるインキュベーション設定の並列測定を可能にする。さまざまな深さの底生生物群集は、分類学的構...
開示事項
著者らは、開示する利益相反がないことを確認しています。
謝辞
この研究は、チェコ科学財団(GACR 19-05791S)、RVO 67985939、および戦略AV 21、土地の節約と回復のプログラム内のCASによってサポートされました。フィールドで撮影してくれたOndřej Sihelskýに感謝します-彼がいなければ、撮影は完全な地獄になっていたでしょう。このプロジェクトは、調査対象地域へのアクセスを提供した企業、PalivovýKombinát Ústí s.p.とSokolovská Uhelnáとの緊密な協力なしには不可能でした。
資料
| Name | Company | Catalog Number | Comments |
| Aluminum angle L profile 40 x 40 mm x 3 mm, length 2,000 mm | |||
| Aluminum flat bar 40 x 3 x 350 mm | |||
| Bucket 15 L with concrete infill | |||
| Carabine hook with screw lock 50 x 5 mm | |||
| electric tape black | |||
| Extruded polystyrene (XPS) material 500 x 200 x 150 mm | |||
| Fibox 3 LCD trace | PreSens Precision Sensing GmbH | stand-alone fiber optic oxygen meter | |
| Hondex PS-7 Portable Depth Sounder | Hondex - Honda Electronics | to measures distances through water - to bottom depth measurement; https://www.honda-el.net/industry/ps-7e | |
| KORKEN - glass tight-seal jar 0.5 L | IKEA | incubation bottles; https://www.ikea.com/cz/en/p/korken-jar-with-lid-clear-glass-70213545/ | |
| metal hook | |||
| Oxygen Sensor Spot SP-PSt3-NAU-D5 | PreSens Precision Sensing GmbH | non-invasive optical oxygen sensor for measurements under Real Conditions | |
| SCOUT infantable canoe | GUMOTEX | https://www.gumotexboats.com/en/scout-standard#0000-044667-021-13/11C | |
| Screw 10 x 170 mm with hexagonal nuts | |||
| Screw 4 x 15 mm with hexagonal nuts | |||
| Screw 4 x 15 mm with wing nuts | |||
| Snap hooks 50 x 5 mm | |||
| Steel Carabine hook 50 x 5 mm | |||
| Steel chain with wire diameter 3 mm, inside link 5.5 x 26 mm | |||
| Steel chain, 5 m | |||
| toothbrush | |||
| tweezer | |||
| Washer 10 x 50 mm | |||
| Washer 4 x 10 mm | |||
| Washer 4 x 10 mm |
参考文献
- Blachart, J. L., et al. Potential consequences of climate change for primary production and fish production in large marine ecosystems. Philosophical Transactions of the Royal Society B: Biological Sciences. 367 (1605), 2979-2989 (2012).
- Howarth, R. W., Michaels, A. F., Sala, O. E., Jackson, R. B., Mooney, H. A., Howarth, R. W. The Measurement of primary production in aquatic ecosystems. Methods in Ecosystem Science. , 72-85 (2000).
- Vadenbecouer, Y. E. G., Peterson, M. J., Vander, Z., Kalff, J. Benthic algal production across lake size gradients: Interactions among morphometry, nutrients, and light. Ecology. 89 (9), 2542-2552 (2008).
- Reimer, A., Landmann, G., Kempe, S. Lake Van, eastern Anatolia, hydrochemistry and history. Aquatic Geochemistry. 15 (1), 195-222 (2009).
- Cantonati, M., Lowe, R. L. Lake benthic algae: toward an understanding of their ecology. Freshwater Sciences. 33 (2), 475-486 (2014).
- Gaarder, T., Gran, H. H. Investigation of the production of plankton in the Oslo Fjord. Rapports et Proces-verbaux des Réunions. Conseil International pour l'Éxploration de la Mer. 42, 1-48 (1927).
- Hall, R. O., Thomas, S., Gaiser, E. E., Fahey, T. J., Knapp, A. K. Measuring Freshwater Primary Productivity and Respiration. Principles and Standards for Measuring Primary Productivity. , (2007).
- Howart, R., Michaels, A. Chapter 6 The Measurement of Primary Production in Aquatic Ecosystems. Springer Science and Business Media LLC. , (2000).
- Kopáček, J., Hejzlar, J. Semi-micro determination of total phosphorus in soils, sediments, and organic materials: a simplified perchloric acid digestion procedure. Communications in Soil Science and Plant Analysis. 26 (11-12), 1935-1946 (1995).
- Benson, B. B., Krause, D. The concentration and isotopic fractionation of oxygen dissolved in freshwater and seawater in equilibrium with the atmosphere1. Limnology and Oceanography. 29 (3), 620-632 (1984).
- Dodds, W. K., Biggs, B. J., Lowe, R. L. Photosynthesis-irradiance patterns in benthic microalgae: variations as a function of assemblage thickness and community structure. Journal of Phycology. 35 (1), 42-53 (1999).
- Bott, T. L., et al. An evaluation of techniques for measuring periphyton metabolism in chambers. Canadian Journal of Fisheries and Aquatic Sciences. 54 (3), 715-725 (1997).
- Blankenship, R. E. Structural and functional dynamics of photosynthetic antenna complexes. Proceedings of the National Academy of Sciences. 112 (45), 13751-13752 (2015).
- Hawes, I., Schwartz, A. -. M. Photosynthesis in an extreme shade environment, benthic microbial mats from Lake Hoare, a permanently ice-covered Antarctic lake. Journal of Phycology. 35 (3), 448-459 (1999).
- Aristegui, J., et al. Planktonic primary production and microbial respiration measured by 14C assimilation and dissolved oxygen changes in coastal waters of the Antarctic peninsula during austral summer: Implications for carbon flux studies. Marine Ecology-Progress Series. 132, 191-201 (1996).
- Steemann-Nielsen, C. The use of radioactive carbon (14C) for measuring organic production in the sea. Journal of Experimental Marine Biology and Ecology. 18 (2), 117-140 (1952).
- Sanz-Martín, M., et al. Relationship between carbon-and oxygen-based primary productivity in the Arctic Ocean, svalbard archipelago. Frontiers in Marine Science. 6, 468 (2019).
- Nielsen, E. S. Measurement of the production of organic matter in the sea by means of carbon-14. Nature. 167 (4252), 684-685 (1951).
- Jönsson, B. A 14C-incubation technique for measuring microphytobenthic primary productivity in intact sediment cores. Limnology and Oceanography. 36 (7), 1485-1492 (1991).
- Bender, M. L., et al. A comparison of four methods for determining planktonic community production. Limnology and Oceanography. 32 (5), 1085-1098 (1987).
- Šimek, K., et al. Spatio-temporal patterns of bacterioplankton productivity and community composition related to phytoplankton composition and protistan bacterivory in a dam reservoir. Aquatic Microbial Ecology. 51 (3), 249-262 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved