Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une méthode peu coûteuse de mesure de la productivité primaire in situ des communautés de périphytons des eaux lentiques
Dans cet article
Résumé
On présente ici une méthode/installation rentable et transportable pour mesurer la productivité primaire des tapis microbiens dans des conditions réelles de température et de lumière ambiantes in situ . L’installation expérimentale est basée sur des matériaux largement disponibles et peut être utilisée dans diverses conditions tout en offrant les avantages des modèles en laboratoire.
Résumé
La mesure de la productivité primaire in situ du périphyton pendant le gradient de la saison de croissance peut élucider l’effet quantitatif des facteurs environnementaux (principalement la concentration de phosphore et l’intensité lumineuse) et de la composition des espèces sur la productivité primaire. La productivité primaire est principalement déterminée par l’intensité lumineuse, la température, la disponibilité des nutriments et la distribution des espèces ioniques du système carbonaté dans les profondeurs respectives de la zone euphotique. C’est un système complexe qui est très difficile à simuler en laboratoire. Cette barge flottante bon marché, transportable et facile à construire permet de mesurer la productivité primaire avec précision, directement dans les conditions naturelles réelles. La méthodologie est basée sur la mesure de la productivité primaire en temps réel à l’aide de capteurs d’oxygène non invasifs intégrés dans des bocaux en verre hermétiquement fermés, permettant une surveillance en ligne du flux d’oxygène et fournissant de nouvelles informations sur les activités métaboliques. Des mesures saisonnières détaillées in situ de la productivité primaire brute de tapis microbiens (ou d’autres organismes benthiques) peuvent améliorer les connaissances actuelles sur les processus contrôlant la dynamique de la productivité primaire dans les eaux lentiques.
Introduction
La productivité primaire est la seule entrée du carbone autochtone dans les systèmes aquatiques qui forment l’ensemble du réseau trophiquedu système 1. Par conséquent, l’estimation précise de la productivité primaire est une étape essentielle pour comprendre le fonctionnement des écosystèmes aquatiques. Les zones littorales sont des zones de productivité primaire et de biodiversité élevées. En plus du phytoplancton, le périphyton (ci-après appelé tapis microbien) et les macroalgues sont supposés contribuer de manière significative à la productivité primaire dans les zones littorales2. En raison de leur mode de vie sessile et de leur grande hétérogénéité spatiale, la quantification de la productivité primaire n’est pas anodine.
La productivité primaire est principalement déterminée par l’intensité lumineuse, la température, la disponibilité des nutriments et la distribution des espèces ioniques du système carbonaté dans les profondeurs respectives des zones euphotiques 3,4. La profondeur influence nettement la distribution spatiale des tapis microbiens. Les communautés microbiennes doivent faire face aux effets néfastes d’une irradiation élevée et de variations saisonnières prononcées de température à faible profondeur et à une intensité lumineuse plus faible à des profondeurs plus élevées. En plus du gradient de profondeur, les interactions trophiques dynamiques génèrent des motifs spatiaux multiples et complexes à différentes échelles5. Ce système complexe est compliqué à simuler en laboratoire. La façon la plus précise de déduire l’activité métabolique des producteurs primaires individuels à partir des zones littorales est de mettre en place des expériences in situ.
La méthodologie présentée dans le présent document est basée sur la méthode traditionnellede la chambre 2,6,7, ainsi que sur une barge flottante transportable et facile à construire à faible coût. Cela permet de mesurer la productivité primaire à différentes profondeurs sous le spectre de la lumière naturelle, la température et la distribution différente des espèces ioniques du système carbonaté avec la profondeur. La méthode est basée sur le principe de l’oxygène en bouteille clair par rapport à l’oxygène foncé, qui a d’abord été utilisé pour mesurer la photosynthèse du phytoplancton 6 et est encore couramment utilisé 6,7. Il compare le taux de variation de l’oxygène dans les bouteilles conservées à la lumière (ce qui inclut les effets de la productivité primaire et de la respiration) avec ceux maintenus dans l’obscurité (respiration seulement)8. La méthode utilise l’évolution de l’oxygène (photosynthèse) comme indicateur de la productivité primaire. Les variables mesurées sont la productivité nette de l’écosystème (NEP, comme un changement de la concentration d’O2 au fil du temps dans des conditions de lumière) et la respiration de l’écosystème (RE, comme un changement de la concentration d’O2 au fil du temps dans l’obscurité). La productivité brute des écosystèmes (BPE) est le calcul de la différence entre les deux (tableau 1). Le terme « écosystème » est utilisé ici pour indiquer que le périphyton est composé d’organismes autotrophes et hétérotrophes. L’amélioration la plus significative de cette méthode traditionnelle en chambre est l’utilisation de capteurs optiques d’oxygène non invasifs et l’optimisation de cette méthode principalement planctonique pour mesurer la productivité primaire périphyte.
La technique est décrite dans l’exemple de la mesure de tapis microbiens dans la zone littorale des lacs post-miniers nouvellement apparus en République tchèque-Milada, Most et Medar. L’activité métabolique des tapis microbiens est déterminée à l’aide de mesures in situ directes des flux d’O2 effectuées directement à des profondeurs spécifiques, où les communautés étudiées se trouvent naturellement. L’activité hétérotrophe et phototrophe est mesurée dans des bouteilles en verre fermées équipées de capteurs optiques d’oxygène non invasifs. Ces capteurs détectent la pression partielle de l’oxygène en utilisant la fluorescence de colorants photosensibles. Les flacons avec tapis microbiens sont suspendus et incubés sur un dispositif flottant aux profondeurs appropriées. La concentration d’oxygène à l’intérieur des bouteilles a été mesurée en continu pendant la période de clarté à partir du petit bateau.
Des échantillons de tapis microbiens intacts sont prélevés et placés dans des bouteilles d’incubation étanches aux gaz à des profondeurs désignées par les plongeurs. Chaque bouteille est équipée d’un microcapteur optique d’oxygène non invasif, qui surveille la productivité/consommation de l’O2 dans le temps. Toutes les mesures sont effectuées en cinq paires sombre/lumière répliquées dans chaque profondeur. La température et l’intensité du rayonnement photosynthétiquement actif (PHAR) sont mesurées à des profondeurs respectives tout au long de l’incubation. Après 6 h d’incubation in situ (heures de clarté), les tapis microbiens sont récoltés dans les bouteilles et séchés. Les flux O2 sont normalisés à la biomasse microbienne. À titre de témoin, les flux sont corrigés en fonction des changements dans la concentration d’O2 dans des bouteilles étanches aux gaz clairs et foncés distinctes (témoins vierges) contenant de l’eau de lac sans biomasse microbienne. Vous trouverez ci-dessous des instructions détaillées pour la construction de la barge flottante et la réalisation de l’ensemble de l’expérience étape par étape. Cet article présente également des résultats représentatifs des mesures de tapis microbiens à deux profondeurs (1 m et 2 m), avec cinq répétitions à chaque profondeur. La température réelle et l’intensité lumineuse ont été mesurées pendant toute l’expérience à l’aide d’enregistreurs de données.
Protocole
REMARQUE : Avant l’échantillonnage, déterminez le degré de réplication en fonction des besoins globaux du projet, de la conception statistique ou de la variabilité prévue de l’échantillon. Cinq paires répliquées de flacons d’incubation clairs et foncés sont suggérées pour une analyse statistique précise et pour tenir compte de la perte ou de la rupture potentielle de l’échantillon. La barge expérimentale flottante décrite est conçue pour transporter cinq répliques plus une paire de commandes à blanc; voir la figure 1 pour un dessin technique de la barge expérimentale.
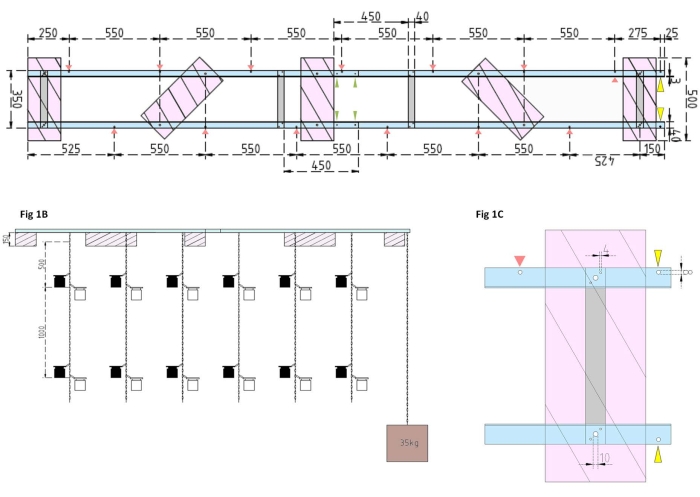
Figure 1 : Dessins techniques de la barge expérimentale et du flotteur latéral. (A) Vue de dessus : le châssis de la barge se compose de quatre pièces de profil en aluminium d’angle L (bleu) qui sont reliées entre elles par quatre barres plates en aluminium (gris). Les flotteurs XPS (roses) sont montés sur le cadre en deux points, chacun sur les pièces d’aluminium parallèles. Des chaînes pour les bouteilles d’incubation sont fixées au cadre des deux côtés à l’aide de mousquetons dans des trous prépercés (flèches rouges) avec 550 mm de séparation entre eux. Les chaînes ont été munies de mousquetons à des distances de 1 m et 2 m pour la fixation des flacons d’incubation (choisir la position des mousquetons en fonction de la profondeur expérimentale). L’ancre en béton est fixée à la proue de la barge, où un porte-à-faux de 25 mm permet de faire deux trous pré-forés (pointes de flèches jaunes) pour servir de point d’attache à la chaîne de l’ancre et au navire de recherche. Le cadre est assemblé ou démonté facilement via les joints parallèles entre les quatre pièces d’angle en aluminium (pointes de flèches vertes). (B) La vue latérale montre les chaînes suspendues avec des bouteilles d’incubation suspendues et une ancre en béton (carré brun). (C) Le flotteur XPS latéral: Les pièces en parallèle en aluminium inclinées L (bleu) sont reliées par des barres plates verticales en aluminium (gris). Sous la section de la barre transversale, le flotteur XPS (rose) est monté avec les tailles de trou nécessaires indiquées (4 mm). Les chaînes suspendues sont fixées avec des mousquetons dans des trous de 8 mm (pointe de flèche rouge). À la proue de la barge, deux trous de 8 mm sont percés dans l’aluminium en surplomb, l’un pour fixer l’ancre à la barge (pointe de flèche jaune) et l’autre pour amarrer le navire de recherche à la barge (bleu). Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Construction de la barge expérimentale
REMARQUE: La barge flottante se compose de deux sections égales montées ensemble, ce qui facilite le montage / le démontage. Toutes les pièces usagées peuvent être achetées dans n’importe quel marché de passe-temps ou magasin vendant des matériaux de construction.
- Tout d’abord, assemblez le cadre de la barge en joignant quatre pièces de profil en aluminium en L (40 mm x 40 mm x 3 mm; longueur de 2 000 mm) à l’aide de quatre barres plates en aluminium (40 mm x 3 mm x 350 mm), 16 vis (4 mm x 15 mm avec écrous hexagonaux) et 32 rondelles (4 mm x 10 mm).
NOTE: La distance et la position des barres plates sont indiquées sur le dessin technique de la figure 1A. La fixation détaillée des flotteurs aux barres plates latérales est illustrée à la figure 1B. - Pour joindre les deux sections égales du cadre, utilisez quatre vis de 4 mm x 15 mm avec des écrous à ailes et huit rondelles de 4 mm x 10 mm pour visser les profilés en aluminium en L ensemble aux extrémités (figure 1A, flèches vertes).
- Utilisez cinq pièces de polystyrène extrudé (XPS) (500 mm x 200 mm x 150 mm), dix vis de 10 mm x 170 mm avec écrous hexagonaux et vingt rondelles de 10 mm x 50 mm pour préparer cinq flotteurs en polystyrène extrudé (500 mm x 200 mm x 150 mm chacun). Fixez les flotteurs au cadre en cinq points indiqués sur le dessin technique (figure 1A).
- Percez des trous dans le cadre (voir les flèches rouges à la figure 1A indiquant la position et les distances des trous pour les chaînes). Fixez les chaînes en acier de 12 m (diamètre du fil de 3 mm, maillon intérieur de 5,5 mm x 26 mm) pour les bouteilles d’incubation aux trous du cadre à l’aide de crochets à carabine en acier (50 mm x 5 mm). Équiper chaque chaîne de paires de mousquetons (50 mm x 5 mm) pour installer les flacons d’incubation à la profondeur souhaitée selon la conception expérimentale. Dans ce cas, ils étaient assis à 1 m et 2 m de profondeur.
- Pour l’ancre, remplissez le seau de 15 L avec du béton. Insérez un boulon à œil dans le béton et laissez-le sécher sans être dérangé. Fixez la chaîne en acier de 5 m au crochet. Fixez l’ancre au trou préforé sur la proue de la barge (marqué par des flèches jaunes à la figure 1A, B).
REMARQUE : Les dessins techniques avec la description de l’assemblage sont présentés à la figure 1A-C. La figure 2 montre la photo de la barge expérimentale assemblée. La figure 3 montre la fixation des flacons d’incubation à la chaîne.
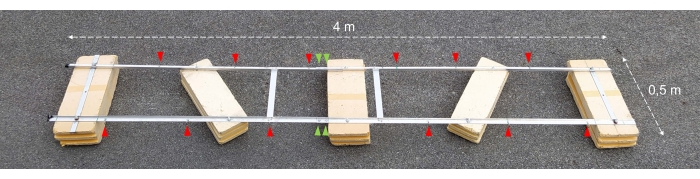
Figure 2 : Barge expérimentale assemblée. Photographie de la barge expérimentale assemblée. Les pointes de flèches rouges montrent les trous pour la fixation des chaînes avec des bouteilles d’incubation. Les pointes de flèches vertes indiquent l’endroit où les deux moitiés du flotteur sont réunies. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Bouteilles d’incubation. Photo de deux paires de flacons d’incubation sombres et clairs suspendus à une profondeur de 1 m. Une paire de bouteilles contient l’échantillon de tapis microbiens intacts qui poussent encore sur la pierre (pointe de flèche rouge). La seconde est la bouteille vierge avec l’eau du lac de la profondeur respective. Une pointe de flèche jaune pointe vers l’endroit du capteur d’oxygène fixé à la paroi interne du flacon d’incubation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Installation sur le terrain
- L’utilisation d’un kayak gonflable est suggérée pour le placement de la barge et la conduite d’expériences car il est facilement transportable.
- Sélectionnez un endroit avec une profondeur idéale pour ancrer le flotteur. Choisissez la profondeur de sorte que les bouteilles d’incubation inférieures soient à au moins 2 m au-dessus du fond pour éviter de perturber les sédiments dans la colonne d’eau autour des bouteilles d’incubation.
- Fixez la barge assemblée derrière la poupe du bateau. Abaissez soigneusement l’ancre le long du côté du bateau et alignez-la de manière à ce qu’elle pend légèrement sous la surface de l’eau afin que le flotteur puisse être facilement remorqué avec l’ancre à l’endroit avec la profondeur requise.
- Détachez l’ancre du bateau, abaissez-la au fond et fixez la barge à la chaîne d’ancre.
- Fixez les chaînes pour attacher les bouteilles d’incubation à la barge.
3. Préparation du flacon d’incubation
- Utilisez les bouteilles transparentes à col large de 0,5 L avec joints étanches aux gaz.
NOTE: Il est possible d’ajuster la taille des bouteilles mais n’oubliez pas d’augmenter la flottaison de la barge avec plus de feuilles de polystyrène. La barge décrite ici peut transporter de manière fiable 24 bouteilles en verre de 0,5 L. - Fixez les spots du capteur optique d’oxygène à la paroi intérieure de chaque bouteille.
- Ajoutez une couche opaque aux flacons de traitement foncés en les enveloppant de ruban électrique noir.
- Percez un petit trou dans l’endroit avec le capteur optique. Pour empêcher la lumière de pénétrer dans la bouteille, faites le trou légèrement plus petit que le diamètre du capteur.
REMARQUE: Toute couche opaque qui empêche la lumière de pénétrer dans la bouteille fonctionnera également. L’avantage du ruban électrique noir est qu’il résiste à l’abrasion et ne se décolle pas dans l’eau.
4. Prélèvement et manipulation des échantillons
NOTE: Les plongeurs effectuent le prélèvement manuel d’échantillons en eau plus profonde. En eau peu profonde, cela peut être fait en plongée en apnée ou en pataugeant.
- Placez les flacons d’incubation dans la boîte portable.
- Plongez avec la boîte à la profondeur respective. Évitez de perturber les sédiments dans l’eau environnante.
- Remplissez soigneusement les flacons d’incubation avec les échantillons. Essayez de perturber le moins possible la biomasse de l’échantillon, par exemple en utilisant une longue pince à épiler. Si les tapis microbiens poussent sur une surface solide, comme une petite pierre, transférez soigneusement la pierre entière avec la biomasse intacte dans la bouteille.
REMARQUE: Évitez de ramasser de grosses pierres lorsque des tapis d’échantillonnage poussent sur des pierres - les bouteilles en verre peuvent être cassées lors de manipulations ultérieures. - Remplissez une paire de bouteilles claires/foncées avec de l’eau propre des profondeurs respectives pour servir de commandes vierges.
NOTE: Les bouteilles sans l’échantillon de périphyton servent de contrôle pour déterminer la production / consommation d’oxygène des organismes d’eau ambiante. Il garantit que la productivité primaire nette ou brute calculée du périphyton est impartiale. - Assurez-vous que l’eau dans toutes les bouteilles d’incubation est propre et ne contient aucun sédiment perturbateur.
- Fermez les bouteilles et apportez-les au bateau ancré à la barge flottante.
5. Mesure de la productivité primaire
REMARQUE: La personne assise dans le bateau prend la boîte du plongeur et effectue les étapes suivantes.
- Fixez les deux premières paires de flacons d’incubation aux mousquetons de la première chaîne.
- Mesurez la concentration initiale d’oxygène dans chaque bouteille à l’aide du compteur d’oxygène à fibre optique. Fixez le câble optique du compteur au capteur d’oxygène monté à l’intérieur de la bouteille et lisez immédiatement (en quelques secondes) la concentration d’O2 sans contact (à travers la paroi de la bouteille). Enregistrez la valeur mesurée.
NOTE: Le temps de traitement est court; De l’enlèvement des bouteilles des plongeurs à la prise initiale à la profondeur respective, cela ne prend que quelques minutes. - Immédiatement après, abaissez soigneusement la chaîne avec les bouteilles attachées dans l’eau. S’assurer que les bouteilles d’incubation sont placées à la même profondeur que la biomasse qui y a été échantillonnée.
- Effectuer une autre mesure à partir du navire après 1 h (voir NOTE ci-dessous). Tirez soigneusement chaque chaîne avec les bouteilles dans le bateau, lisez la valeur d’oxygène en attachant le câble optique au capteur et abaissez à nouveau les échantillons dans l’eau.
NOTE: Ajuster le temps entre les mesures individuelles pendant l’incubation en fonction de l’intensité de la productivité / consommation d’échantillonsO2 pour éviter la sursaturation des bouteilles. - Répétez cette procédure au moins quatre ou cinq fois avec toutes les paires de bouteilles.
REMARQUE: L’ensemble de la configuration de l’expérience sur le terrain est illustré à la figure 4.
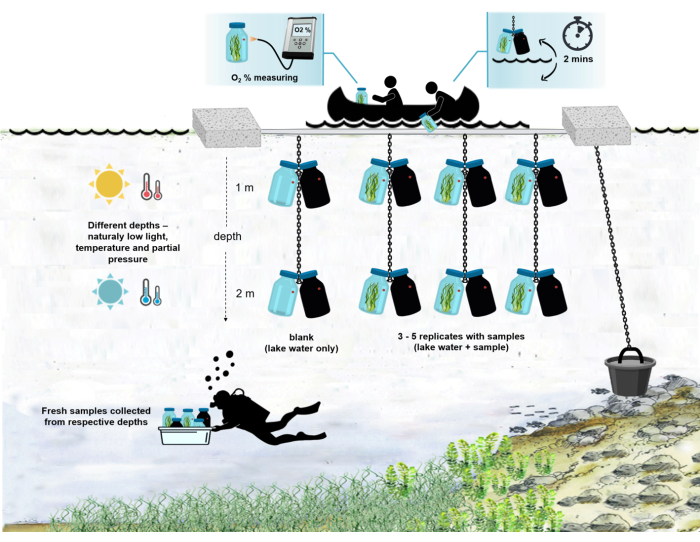
Figure 4 : Schéma de l’installation expérimentale sur le terrain. Illustration de la barge expérimentale ancrée à la surface du lac. Les flacons d’incubation (0,5 L) avec biomasse microbienne sont suspendus à deux profondeurs différentes (1 m et 2 m). Les plongeurs ont prélevé des échantillons de tapis microbiens directement dans les flacons d’incubation aux profondeurs appropriées. La concentration d’oxygène dans les bouteilles individuelles est mesurée à partir du navire. Les bouteilles sont retirées de l’eau. La valeur de concentration en oxygène est mesurée en quelques secondes en attachant un câble optique au capteur d’oxygène. Les bouteilles sont ensuite soigneusement redescendues dans l’eau. L’ensemble de la procédure de mesure de deux paires de flacons d’incubation à deux profondeurs prend ~ 2 min. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Analyses d’échantillons
- Après la fin des mesures, prélevez les échantillons directement dans les bouteilles et transférez la biomasse du tapis microbien dans les petites fioles en plastique. Si les tapis poussent sur des substrats solides (p. ex., des pierres), frottez-les avec une brosse à dents ou un petit couteau.
- En laboratoire, filtrer chaque filtre à travers des filtres en fibre de verre pré-pesés pour déterminer le poids sec9.
7. Analyses des données
- Pendant la période d’incubation, mesurez la concentration d’oxygène dans les bouteilles claires et foncées et comparez-la à la concentration d’oxygène dans la colonne d’eau lorsque les bouteilles sont remplies.
NOTE: Le changement d’oxygène dans la bouteille lumineuse au fil du temps est le résultat combiné de la productivité brute de l’écosystème (BPE) et de la respiration de tous les organismes dans la bouteille (autotrophes et hétérotrophes de l’eau ambiante et de la communauté périphyte). La diminution de l’oxygène dans la bouteille foncée mesure les pertes respiratoires des autotrophes et des hétérotrophes. Le changement de concentration d’oxygène dans le témoin (c.-à-d. bouteilles sans périphyton) n’est que le produit d’organismes hétérotrophes ou autotrophes dans l’eau ambiante. La productivité et la respiration du périphyton ont été estimées en soustrayant la productivité de l’eau ambiante et la respiration mesurées dans des flacons d’incubation vierges. - Notez la concentrationd’O2 en pourcentage de saturation en oxygène (c.-à-d. calibrez les capteurs d’oxygène à 0 % et 100 % de saturation en oxygène). Avant d’estimer la productivité primaire, convertissez les données brutes (
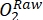 ) en une unité raisonnable.
) en une unité raisonnable.
NOTE: Dans cette étude, les données sont converties en mmol de O2 par gramme de matière organique (MO) de la masse de périphyton à la base du poids sec, selon Benson et Krause10.- Calculez la conversion à l’aide de l’équation (1) :
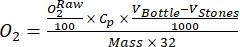 (1)
(1)
Où Cp est la concentration de O2 dans l’eau (mg (O2) L-1) lorsqu’elle est complètement saturée par O2, V Flacon est le volume de la bouteille en mL, VPierres est le volume occupé par la pierre en mL, est le poids de la masse de périphyton en g, et 32 est le poids molaire de O2. - Calculer Cp à l’aide de l’équation (2) :
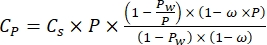 (2)
(2)
Où Cs est la concentration standard de O2, P est la pression atmosphérique à la surface du lac, Pw est la pression partielle de la vapeur d’eau à la surface du lac et ω est la densité de l’eau. - Calculer C s, ω, P et Pw à partir d’équations empiriques définies précédemment (3-6) lorsque l’altitude du lac (h en km) et la température de l’eau à la surface du lac (t en °C) sont connues:
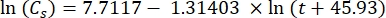 (3)
(3)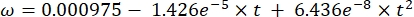 (4)
(4)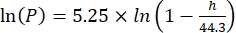 (5)
(5)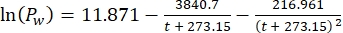 (6)
(6)
NOTE: D’après les équations (1-6), il est évident que la concentration d’O2 calculée est la plus précise pour les faibles profondeurs. Au fur et à mesure que la profondeur augmente, la concentration calculée devient plus biaisée en termes de concentration absolue. Il est optimal lorsque le taux de variation de la concentration en oxygène le long de la profondeur est connu pour chaque lac, de sorte que la concentration absolue d’O2 peut être corrigée si nécessaire. Une fois la concentration d’O2 calculée, son évolution dans le temps peut être utilisée pour calculer deux flux différents d’O2 dans deux conditions différentes. Dans des conditions de lumière, la productivité nette de l’écosystème (NEP) est directement proportionnelle à la variation de la concentration d’O2 au fil du temps (voir ci-dessous). Le terme « écosystème » est utilisé ici pour indiquer que le périphyton est composé d’organismes autotrophes et hétérotrophes. Dans l’obscurité, la variation de la concentration d’O2 au fil du temps est proportionnelle à la somme des pertes respiratoires des organismes autotrophes et hétérotrophes, définissant ainsi la respiration de l’écosystème (ER). La différence entre NEP et RE définit la productivité brute des écosystèmes (GEP). Si les pertes respiratoires de la partie hétérotrophe de la communauté sont négligeables, la BPE devient égale à la productivité brute de l’écosystème.
- Calculez la conversion à l’aide de l’équation (1) :
- Déterminer le taux de variation de la concentration d’O2 au fil du temps par régression polynomiale du troisième degré, comme le montre l’équation (7).
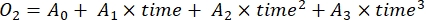 (7)
(7)
Où A 0 est la concentration de O2 au temps zéro et A1-A2 sont des coefficients de régression polynomiale.
Remarque : La fonction polynomiale est utilisée car elle peut servir d’approximation de n’importe quelle équation différentielle. Ainsi, il n’est pas nécessaire de connaître la relation fonctionnelle précise entre la concentrationO2 et le temps. Par conséquent, toute hypothèse associée à la relation fonctionnelle (p. ex. linéarité) n’a pas besoin d’être contrôlée. Par définition, le deuxième terme de régression polynomiale, A 1 définit le taux de variation de la concentration d’O2 au temps zéro (c’est-à-dire le taux instantané), qui est indépendant de A0 et, par conséquent, de la concentration absolue d’O2 au temps zéro. Pour cette raison, l’estimation du flux d’O2 n’est pas affectée par le biais dans les calculs de concentration absolue d’O2 causé par le changement de pression à travers le gradient de profondeur. A 1 a des unitésO2 (mmol g(OM)-1) par temps (1 h dans cette étude).- Calculer A1, calculé séparément pour les bouteilles avec et sans exposition à la lumière et contenant de la biomasse microbienne sur tapis (c.-à-d. V Stones > 0) et pour les bouteilles témoins avec et sans exposition à la lumière et contenant de l’eau libre (c.-à-d. V Stones = 0).
NOTE: En attribuant ces différents coefficients de régression, notations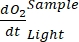 , ,
, , 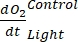 et
et 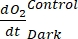 , respectivement,
, respectivement, 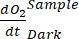 l’équation (8) pour le calcul de la productivité GEP peut être écrit comme suit:
l’équation (8) pour le calcul de la productivité GEP peut être écrit comme suit: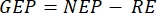 (8.1)
(8.1)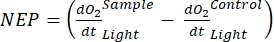 (8.2)
(8.2)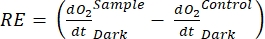 (8.3)
(8.3)
Le terme définit la productivité nette de l’écosystème (figure 5A; c.-à-d. la productivité nette de l’oxygène), et le terme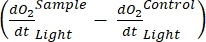
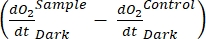 représente la somme de la respiration autotrophe et hétérotrophe (figure 5B; RE, c’est-à-dire en supposant que les deux respirations sont similaires dans des conditions sombres et lumineuses).
représente la somme de la respiration autotrophe et hétérotrophe (figure 5B; RE, c’est-à-dire en supposant que les deux respirations sont similaires dans des conditions sombres et lumineuses). - Soustrayez R de NEP pour obtenir GEP (Figure 5C).
NOTE: L’équation (8) suppose implicitement que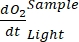 et sont à la fois positifs et et
et sont à la fois positifs et et 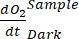
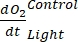
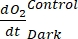 sont tous deux négatifs. Si
sont tous deux négatifs. Si 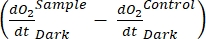 est positif, vérifier attentivement les données brutes pour les valeurs aberrantes. peut être théoriquement négatif parce que les pertes respiratoires causées par l’activité hétérotrophe peuvent être plus élevées que l’activité photosynthétique.
est positif, vérifier attentivement les données brutes pour les valeurs aberrantes. peut être théoriquement négatif parce que les pertes respiratoires causées par l’activité hétérotrophe peuvent être plus élevées que l’activité photosynthétique. 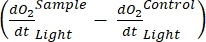
- Calculer A1, calculé séparément pour les bouteilles avec et sans exposition à la lumière et contenant de la biomasse microbienne sur tapis (c.-à-d. V Stones > 0) et pour les bouteilles témoins avec et sans exposition à la lumière et contenant de l’eau libre (c.-à-d. V Stones = 0).
Résultats
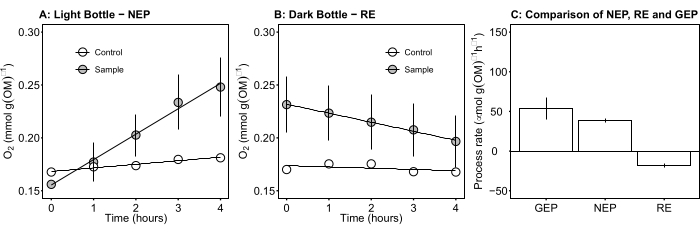
Figure 5 : Productivité écosystémique nette et brute des tapis microbiens pendant la journée. (A) Productivité de l’écosystème des filets de bouteilles légères : données temporelles sur la productivité nette en oxygène des tapis microbiens des bouteilles lumineuses. Le changement de concentration d’oxygène dans les bouteilles d’in...
Discussion
La méthodologie décrite dans cet article est basée sur le principe de la technique de l’oxygène en bouteille claire et foncée en combinaison avec la technique non invasive de mesure de la concentration d’O2 à l’aide de capteurs optiques d’oxygène. Ce système permet la mesure parallèle de différents paramètres d’incubation car la fibre optique pour mesurer O2 peut être déplacée rapidement d’une bouteille à l’autre. Les communautés benthiques de différentes profondeurs p...
Déclarations de divulgation
Les auteurs confirment qu’ils n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Cette étude a été soutenue par la Fondation tchèque des sciences (GACR 19-05791S), RVO 67985939, et par la CAS dans le cadre du programme de la Stratégie AV 21, Sauvegarde et récupération des terres. Un grand merci à Ondřej Sihelský pour avoir pris les photos sur le terrain - sans lui, le tournage aurait été un enfer complet. Le projet ne serait pas possible sans une coopération étroite avec les entreprises, Palivový Kombinát Ústí s.p. et Sokolovská Uhelná, qui ont fourni l’accès aux localités étudiées.
matériels
| Name | Company | Catalog Number | Comments |
| Aluminum angle L profile 40 x 40 mm x 3 mm, length 2,000 mm | |||
| Aluminum flat bar 40 x 3 x 350 mm | |||
| Bucket 15 L with concrete infill | |||
| Carabine hook with screw lock 50 x 5 mm | |||
| electric tape black | |||
| Extruded polystyrene (XPS) material 500 x 200 x 150 mm | |||
| Fibox 3 LCD trace | PreSens Precision Sensing GmbH | stand-alone fiber optic oxygen meter | |
| Hondex PS-7 Portable Depth Sounder | Hondex - Honda Electronics | to measures distances through water - to bottom depth measurement; https://www.honda-el.net/industry/ps-7e | |
| KORKEN - glass tight-seal jar 0.5 L | IKEA | incubation bottles; https://www.ikea.com/cz/en/p/korken-jar-with-lid-clear-glass-70213545/ | |
| metal hook | |||
| Oxygen Sensor Spot SP-PSt3-NAU-D5 | PreSens Precision Sensing GmbH | non-invasive optical oxygen sensor for measurements under Real Conditions | |
| SCOUT infantable canoe | GUMOTEX | https://www.gumotexboats.com/en/scout-standard#0000-044667-021-13/11C | |
| Screw 10 x 170 mm with hexagonal nuts | |||
| Screw 4 x 15 mm with hexagonal nuts | |||
| Screw 4 x 15 mm with wing nuts | |||
| Snap hooks 50 x 5 mm | |||
| Steel Carabine hook 50 x 5 mm | |||
| Steel chain with wire diameter 3 mm, inside link 5.5 x 26 mm | |||
| Steel chain, 5 m | |||
| toothbrush | |||
| tweezer | |||
| Washer 10 x 50 mm | |||
| Washer 4 x 10 mm | |||
| Washer 4 x 10 mm |
Références
- Blachart, J. L., et al. Potential consequences of climate change for primary production and fish production in large marine ecosystems. Philosophical Transactions of the Royal Society B: Biological Sciences. 367 (1605), 2979-2989 (2012).
- Howarth, R. W., Michaels, A. F., Sala, O. E., Jackson, R. B., Mooney, H. A., Howarth, R. W. The Measurement of primary production in aquatic ecosystems. Methods in Ecosystem Science. , 72-85 (2000).
- Vadenbecouer, Y. E. G., Peterson, M. J., Vander, Z., Kalff, J. Benthic algal production across lake size gradients: Interactions among morphometry, nutrients, and light. Ecology. 89 (9), 2542-2552 (2008).
- Reimer, A., Landmann, G., Kempe, S. Lake Van, eastern Anatolia, hydrochemistry and history. Aquatic Geochemistry. 15 (1), 195-222 (2009).
- Cantonati, M., Lowe, R. L. Lake benthic algae: toward an understanding of their ecology. Freshwater Sciences. 33 (2), 475-486 (2014).
- Gaarder, T., Gran, H. H. Investigation of the production of plankton in the Oslo Fjord. Rapports et Proces-verbaux des Réunions. Conseil International pour l'Éxploration de la Mer. 42, 1-48 (1927).
- Hall, R. O., Thomas, S., Gaiser, E. E., Fahey, T. J., Knapp, A. K. Measuring Freshwater Primary Productivity and Respiration. Principles and Standards for Measuring Primary Productivity. , (2007).
- Howart, R., Michaels, A. Chapter 6 The Measurement of Primary Production in Aquatic Ecosystems. Springer Science and Business Media LLC. , (2000).
- Kopáček, J., Hejzlar, J. Semi-micro determination of total phosphorus in soils, sediments, and organic materials: a simplified perchloric acid digestion procedure. Communications in Soil Science and Plant Analysis. 26 (11-12), 1935-1946 (1995).
- Benson, B. B., Krause, D. The concentration and isotopic fractionation of oxygen dissolved in freshwater and seawater in equilibrium with the atmosphere1. Limnology and Oceanography. 29 (3), 620-632 (1984).
- Dodds, W. K., Biggs, B. J., Lowe, R. L. Photosynthesis-irradiance patterns in benthic microalgae: variations as a function of assemblage thickness and community structure. Journal of Phycology. 35 (1), 42-53 (1999).
- Bott, T. L., et al. An evaluation of techniques for measuring periphyton metabolism in chambers. Canadian Journal of Fisheries and Aquatic Sciences. 54 (3), 715-725 (1997).
- Blankenship, R. E. Structural and functional dynamics of photosynthetic antenna complexes. Proceedings of the National Academy of Sciences. 112 (45), 13751-13752 (2015).
- Hawes, I., Schwartz, A. -. M. Photosynthesis in an extreme shade environment, benthic microbial mats from Lake Hoare, a permanently ice-covered Antarctic lake. Journal of Phycology. 35 (3), 448-459 (1999).
- Aristegui, J., et al. Planktonic primary production and microbial respiration measured by 14C assimilation and dissolved oxygen changes in coastal waters of the Antarctic peninsula during austral summer: Implications for carbon flux studies. Marine Ecology-Progress Series. 132, 191-201 (1996).
- Steemann-Nielsen, C. The use of radioactive carbon (14C) for measuring organic production in the sea. Journal of Experimental Marine Biology and Ecology. 18 (2), 117-140 (1952).
- Sanz-Martín, M., et al. Relationship between carbon-and oxygen-based primary productivity in the Arctic Ocean, svalbard archipelago. Frontiers in Marine Science. 6, 468 (2019).
- Nielsen, E. S. Measurement of the production of organic matter in the sea by means of carbon-14. Nature. 167 (4252), 684-685 (1951).
- Jönsson, B. A 14C-incubation technique for measuring microphytobenthic primary productivity in intact sediment cores. Limnology and Oceanography. 36 (7), 1485-1492 (1991).
- Bender, M. L., et al. A comparison of four methods for determining planktonic community production. Limnology and Oceanography. 32 (5), 1085-1098 (1987).
- Šimek, K., et al. Spatio-temporal patterns of bacterioplankton productivity and community composition related to phytoplankton composition and protistan bacterivory in a dam reservoir. Aquatic Microbial Ecology. 51 (3), 249-262 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon