Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Недорогой метод измерения первичной продуктивности in situ перифитонных сообществ ленточных вод
В этой статье
Резюме
Здесь представлен экономически эффективный и транспортабельный метод/установка для измерения первичной продуктивности микробных матов в реальных условиях температуры окружающей среды in situ и освещенности. Экспериментальная установка основана на широко доступных материалах и может использоваться в различных условиях, предлагая преимущества лабораторных моделей.
Аннотация
Измерение первичной продуктивности перифитона in situ в течение градиента вегетационного периода может прояснить количественное влияние экологических факторов (главным образом концентрации фосфора и интенсивности света) и видового состава на первичную продуктивность. Первичная продуктивность в основном определяется интенсивностью света, температурой, доступностью питательных веществ и распределением ионных видов карбонатной системы в соответствующих глубинах эйфотической зоны. Это сложная система, которую очень трудно смоделировать в лаборатории. Эта дешевая, транспортабельная и простая в строительстве плавучая баржа позволяет точно измерять первичную производительность непосредственно в реальных природных условиях. Методология основана на измерении первичной производительности в режиме реального времени с использованием неинвазивных датчиков кислорода, интегрированных в плотно закрытые стеклянные банки, что позволяет осуществлять онлайн-мониторинг потока кислорода и дает новое представление о метаболической деятельности. Подробные сезонные измерения in situ валовой первичной продуктивности микробных матов (или других бентических организмов) могут улучшить современные знания о процессах, контролирующих динамику первичной продуктивности в ленточных водах.
Введение
Первичная продуктивность является единственным попаданием автохтонного углерода в водные системы, образующие всю систему пищевой сети1. Таким образом, точная оценка первичной продуктивности является важным шагом на пути к пониманию функционирования водных экосистем. Прибрежные зоны являются районами с высокой первичной продуктивностью и биоразнообразием. В дополнение к фитопланктону предполагается, что перифитон (далее именуемый микробными матами) и макроводоросли вносят значительный вклад в первичную продуктивность в прибрежных зонах2. Из-за их сидячего образа жизни и значительной пространственной неоднородности количественная оценка первичной продуктивности не является тривиальной.
Первичная продуктивность определяется главным образом интенсивностью света, температурой, наличием питательных веществ и распределением ионных видов карбонатной системы в соответствующих глубинах эуфотических зон 3,4. Глубина заметно влияет на пространственное распределение микробных матов. Микробные сообщества должны справляться с неблагоприятными последствиями высокого облучения и выраженными сезонными колебаниями температуры на небольших глубинах и с меньшей интенсивностью света на больших глубинах. В дополнение к градиенту глубины динамические трофические взаимодействия генерируют множественные и сложные пространственные паттерны в разных масштабах5. Эту сложную систему сложно смоделировать в лаборатории. Наиболее точным способом вывода метаболической активности отдельных первичных производителей из прибрежных зон является проведение экспериментов in situ.
Методология, представленная в данной работе, основана на традиционном камерном методе 2,6,7 вместе с транспортабельной и простой в строительстве недорогой плавучей баржей. Это позволяет измерять первичную продуктивность на разных глубинах при естественном световом спектре, температуре и различном распределении ионных пород карбонатной системы с глубиной. Метод основан на принципе светлого и темного кислорода, который впервые был использован для измерения фотосинтеза фитопланктона6 и до сих пор широко используется 6,7. Он сравнивает скорость изменения кислорода в баллонах, хранящихся на свету (что включает в себя эффекты первичной продуктивности и дыхания) с теми, которые удерживаются в темноте (только дыхание)8. Метод использует эволюцию кислорода (фотосинтез) в качестве прокси для первичной продуктивности. Измеряемыми переменными являются чистая продуктивность экосистемы (НЭП, как изменение концентрацииО2 с течением времени в условиях освещения) и дыхание экосистемы (ВЭ, как изменение концентрацииО2 с течением времени в темноте). Валовая продуктивность экосистем (ГЭП) представляет собой расчет разницы между ними (таблица 1). Термин «экосистема» используется здесь для обозначения того, что перифитон состоит из автотрофных и гетеротрофных организмов. Наиболее значительным улучшением этого традиционного камерного метода является использование неинвазивных оптических датчиков кислорода и оптимизация этого в первую очередь планктонного метода измерения перифитной первичной продуктивности.
Методика описана на примере измерения микробных матов в прибрежной зоне вновь возникших послерудных озер в Чехии – Милада, Мост и Медар. Метаболическую активность микробных матов определяют с помощью прямого измерения in situ потоков O2 , выполняемого непосредственно на определенных глубинах, где естественным образом возникают исследуемые сообщества. Гетеротрофная и фототрофная активность измеряется в закрытых стеклянных баллонах, оснащенных неинвазивными оптическими датчиками кислорода. Эти датчики обнаруживают парциальное давление кислорода с помощью флуоресценции светочувствительных красителей. Флаконы с микробными матами подвешивают и инкубируют на плавающем устройстве на соответствующих глубинах. Концентрация кислорода внутри бутылок непрерывно измерялась в течение светового дня с маленькой лодки.
Образцы неповрежденных микробных матов собираются и помещаются в газонепроницаемые инкубационные баллоны на определенных глубинах аквалангистами. Каждая бутылка оснащена неинвазивным оптическим микросенсором кислорода, который контролирует производительность / потребление O2 с течением времени. Все измерения выполняются в пяти повторяющихся парах темный/светлый на каждой глубине. Температура и интенсивность фотосинтетически активного излучения (PHAR) измеряются на соответствующих глубинах на протяжении всей инкубации. После 6 ч инкубации in situ (световой день) микробные маты собирают из бутылок и сушат. Потоки O2 нормализуются до микробной биомассы. В качестве контроля потоки корректируются на изменения концентрации О2 в отдельных светлых и темных газонепроницаемых баллонах (пустые контрольные элементы), содержащих озерную воду без биомассы микробного мата. Ниже приведены подробные инструкции по строительству плавучей баржи и выполнению всего эксперимента шаг за шагом. В этой статье также представлены репрезентативные результаты измерений микробных матов на двух глубинах (1 м и 2 м), с пятью репликами на каждой глубине. Фактическая температура и интенсивность света измерялись в течение всего эксперимента с помощью регистраторов данных.
протокол
ПРИМЕЧАНИЕ: Перед выборкой определите степень репликации на основе общих потребностей проекта, статистического дизайна или ожидаемой величины изменчивости выборки. Пять реплицированных пар светлых и темных инкубационных бутылок предлагаются для точного статистического анализа и учета потенциальной потери или поломки образца. Описанная плавучая экспериментальная баржа предназначена для перевозки пяти реплик плюс одна пара холостых органов управления; Технический чертеж экспериментальной баржи см. на рисунке 1 .
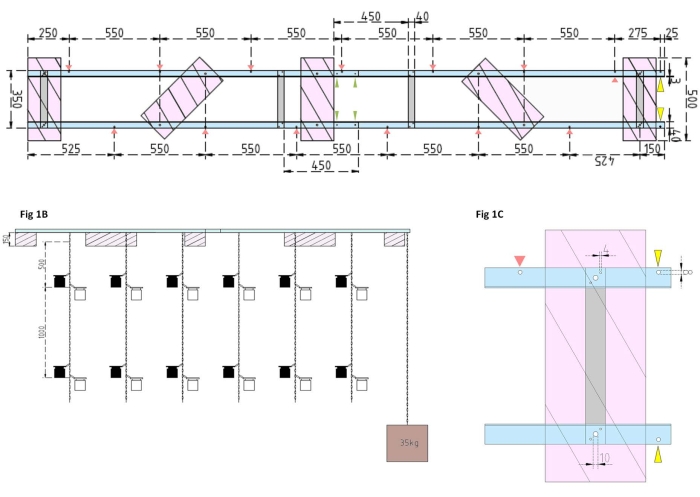
Рисунок 1: Технические чертежи экспериментальной баржи и бокового поплавка. (А) Вид сверху: рама баржи состоит из четырех алюминиевых угловых частей профиля L (синий), которые соединены между собой четырьмя алюминиевыми плоскими стержнями (серый). Поплавки XPS (розовые) крепятся к раме в двух точках, каждая из которых находится на параллельных алюминиевых изделиях. Цепи для инкубационных бутылок крепятся к раме с обеих сторон с помощью защелкивающихся крючков в предварительно просверленных отверстиях (красные стрелки) с расстоянием между ними 550 мм. Цепи были снабжены защелкивающимися крючками на расстоянии 1 м и 2 м для крепления инкубационной бутылки (выбирайте положение защелкивающихся крючков в соответствии с экспериментальной глубиной). Бетонный якорь закреплен на носу баржи, где свес 25 мм позволяет двум предварительно просверленным отверстиям (желтые наконечники стрел) служить точкой крепления для цепи якоря и исследовательского судна. Рама легко собирается или разбирается через параллельные соединения между четырьмя алюминиевыми угловыми частями (зеленые наконечники стрел). (B) Вид сбоку показывает подвесные цепи с подвесными инкубационными бутылками и бетонным якорем (коричневый квадрат). (C) Боковой поплавок XPS: параллельнолюминные уголки L (синие) соединены вертикальными алюминиевыми плоскими стержнями (серый). Ниже поперечного сечения устанавливается поплавок XPS (розовый) с указанием необходимых размеров отверстий (4 мм). Подвесные цепи крепятся защелкивающимися крючками в отверстиях 8 мм (красный наконечник стрелы). В носовой части баржи в нависающем алюминии просверливаются два 8-мм отверстия, одно для закрепления якоря на барже (желтый наконечник стрелы), а другое для швартовки исследовательского судна к барже (синий). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Строительство опытной баржи
ПРИМЕЧАНИЕ: Плавучая баржа состоит из двух равных секций, смонтированных вместе, что позволяет легко собирать/разбирать. Все использованные детали можно приобрести на любом хобби-рынке или в магазине по продаже строительных материалов.
- Сначала соберите раму баржи , соединив четыре алюминиевых угловых L-профиля (40 мм x 40 мм x 3 мм; длина 2000 мм) вместе с помощью четырех алюминиевых плоских стержней (40 мм x 3 мм x 350 мм), 16 винтов (4 мм x 15 мм с шестиугольными гайками) и 32 шайбы (4 мм x 10 мм).
ПРИМЕЧАНИЕ: Расстояние и положение плоских стержней показаны на техническом чертеже на рисунке 1А. Подробное крепление поплавков к боковым плоским стержням показано на рисунке 1B. - Чтобы соединить две равные секции рамы, используйте четыре винта 4 мм x 15 мм с крыльевыми гайками и восемь шайб 4 мм x 10 мм, чтобы скрутить алюминиевые угловые L-профили вместе на концах (рисунок 1A, зеленые стрелки).
- Используйте пять кусков экструдированного полистирольного (XPS) материала (500 мм x 200 мм x 150 мм), десять винтов 10 мм x 170 мм с шестиугольными гайками и двадцать шайб 10 мм x 50 мм для приготовления пяти экструдированных поплавков из полистирола (500 мм x 200 мм x 150 мм каждая). Прикрепите поплавки к раме в пяти точках, показанных на техническом чертеже (рисунок 1А).
- Просверлите отверстия в раме (см. красные стрелки на рисунке 1А , обозначающие положения и расстояния отверстий для цепей). Прикрепите стальные цепи длиной 12 м (диаметр проволоки 3 мм, внутреннее звено 5,5 мм х 26 мм) для инкубационных бутылок к отверстиям в раме с помощью стальных карабиновых крючков (50 мм х 5 мм). Обеспечьте каждую цепочку парами защелкивающихся крючков (50 мм х 5 мм) для установки инкубационных бутылок на нужную глубину в соответствии с экспериментальной конструкцией. При этом они сидели на глубине 1 м и 2 м.
- Для анкера заполните ведро объемом 15 л бетоном. Вставьте глазной болт в бетон и дайте ему высохнуть без помех. Прикрепите 5-метровую стальную цепь к крючку. Закрепите якорь в предварительно просверленном отверстии на носу баржи (обозначено желтыми стрелками на рисунке 1А,В).
ПРИМЕЧАНИЕ: Технические чертежи с описанием сборки показаны на рисунке 1A-C. На рисунке 2 показана фотография собранной экспериментальной баржи. На рисунке 3 показано прикрепление инкубационных бутылок к цепи.
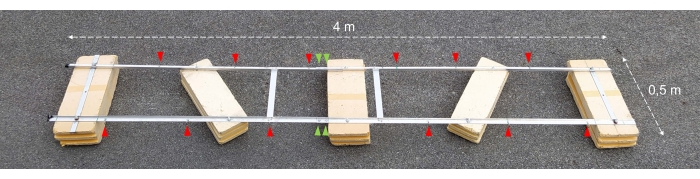
Рисунок 2: Собранная экспериментальная баржа. Фотография собранной экспериментальной баржи. Красные наконечники стрел показывают отверстия для крепления цепочек с инкубационными бутылками. Зеленые наконечники стрелок указывают на то, где две половины поплавка соединены вместе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Инкубационные бутылки. Фото двух пар темных и светлых инкубационных бутылок, висящих на глубине 1 м. Одна пара бутылок содержит образец неповрежденных микробных матов, все еще растущих на камне (красный наконечник стрелы). Второй – пустая бутылка с озерной водой с соответствующей глубины. Желтый наконечник стрелки указывает на пятно датчика кислорода, прикрепленное к внутренней стенке инкубационного флакона. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Установка в полевых условиях
- Для размещения баржи и проведения экспериментов рекомендуется использовать надувную байдарку, так как она легко транспортируется.
- Выберите место с идеальной глубиной для закрепления поплавка. Выбирайте глубину так, чтобы нижние инкубационные бутылки находились не менее чем на 2 м выше дна, чтобы не нарушить осадок в толще воды вокруг инкубационных бутылок.
- Прикрепите собранную баржу за кормой лодки. Осторожно опустите якорь вдоль борта лодки и выровняйте его так, чтобы он висел немного ниже поверхности воды, чтобы поплавок можно было легко буксировать вместе с якорем на место с необходимой глубиной.
- Отвяжите якорь от лодки, опустите его на дно и закрепите баржу на якорной цепи.
- Закрепите цепи для крепления инкубационных бутылок к барже.
3. Подготовка инкубационной бутылки
- Используйте прозрачные бутылки с широким горлышком объемом 0,5 л с газонепроницаемыми уплотнениями.
ПРИМЕЧАНИЕ: Можно регулировать размер бутылок, но не забудьте увеличить плавание баржи с большим количеством листов полистирола. Баржа, описанная здесь, может надежно перевозить 24 стеклянные бутылки объемом 0,5 л. - Прикрепите пятна оптического датчика кислорода к внутренней стенке каждого флакона.
- Добавьте непрозрачный слой к темным флаконам для обработки, обернув их черной электрической лентой.
- Вырежьте крошечное отверстие в месте с помощью оптического датчика. Чтобы предотвратить попадание света в бутылку, сделайте отверстие немного меньше диаметра датчика.
ПРИМЕЧАНИЕ: Любой непрозрачный слой, который предотвращает попадание света в бутылку, также будет работать. Преимущество черной электрической ленты в том, что она устойчива к истиранию и не отслаивается в воде.
4. Сбор и обработка образцов
ПРИМЕЧАНИЕ: Водолазы проводят ручной сбор проб в более глубоких водах. На мелководье это можно сделать с помощью подводного плавания или вброд.
- Поместите инкубационные бутылки в переносную коробку.
- Погружайтесь с коробкой на соответствующую глубину. Избегайте нарушения осадка в окружающей воде.
- Тщательно заполните инкубационные бутылки образцами. Старайтесь как можно меньше нарушать биомассу образца, например, используя длинный пинцет. Если микробные маты растут на твердой поверхности, такой как небольшой камень, осторожно перенесите весь камень с неповрежденной биомассой в бутылку.
ПРИМЕЧАНИЕ: Избегайте сбора больших камней, когда на камнях растут коврики для отбора проб - стеклянные бутылки могут быть разбиты во время дальнейших манипуляций. - Наполните одну пару светлых / темных бутылок чистой водой из соответствующих глубин, чтобы они служили пустыми элементами управления.
ПРИМЕЧАНИЕ: Баллоны без пробы перифитона служат в качестве контроля, определяющего производство/потребление кислорода организмами окружающей воды. Это гарантирует, что расчетная чистая или валовая первичная производительность перифитона является непредвзятой. - Убедитесь, что вода во всех инкубационных бутылках чистая и не содержит беспокоящего осадка.
- Закройте бутылки и поднесите их к лодке, стоящей на якоре на плавучей барже.
5. Измерение первичной производительности
ПРИМЕЧАНИЕ: Человек, сидящий в лодке, берет коробку у дайвера и выполняет следующие шаги.
- Прикрепите первые две пары инкубационных бутылок к защелкам-крючкам на первой цепочке.
- Измерьте начальную концентрацию кислорода в каждом флаконе с помощью волоконно-оптического кислородного измерителя. Прикрепите оптический кабель измерителя к датчику кислорода, установленному внутри баллона, и немедленно (в течение нескольких секунд) бесконтактно считывают концентрациюО2 (через стенку баллона). Запишите измеренное значение.
ПРИМЕЧАНИЕ: Время обработки короткое; от взятия бутылок от дайверов до первоначальной настройки на соответствующую глубину, это занимает всего несколько минут. - Сразу после этого осторожно опустите цепочку с прикрепленными бутылками обратно в воду. Убедитесь, что инкубационные бутылки размещены на той же глубине, на которой была отобрана биомасса, которая была помещена в них.
- Сделайте еще одно измерение с корабля через 1 час (см. ПРИМЕЧАНИЕ ниже). Осторожно потяните каждую цепочку с бутылками в лодку, считайте значение кислорода, прикрепив оптический кабель к датчику, и снова опустите образцы в воду.
ПРИМЕЧАНИЕ: Отрегулируйте время между отдельными измерениями во время инкубации в соответствии с интенсивностьюO2 производительности/потребления образцов, чтобы избежать перенасыщения бутылок. - Повторите эту процедуру по крайней мере четыре или пять раз со всеми парами флаконов.
ПРИМЕЧАНИЕ: Вся настройка эксперимента в полевых условиях показана на рисунке 4.
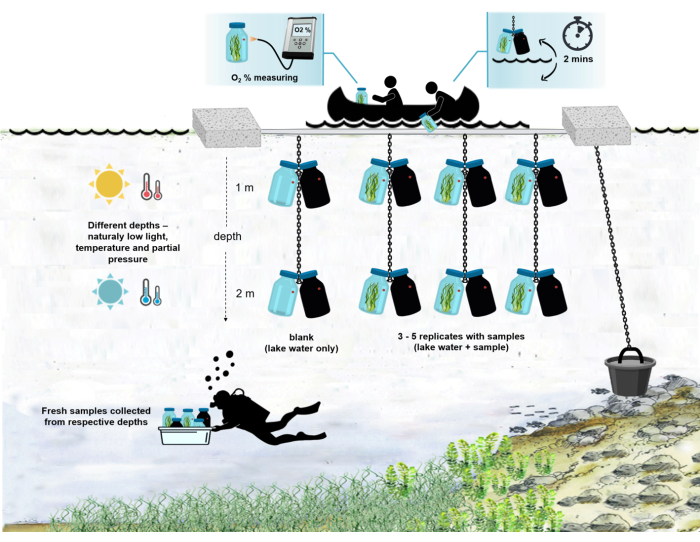
Рисунок 4: Схема экспериментальной установки в полевых условиях. Иллюстрация поставленной на якорь экспериментальной баржи на поверхности озера. Инкубационные бутылки (0,5 л) с биомассой микробного мата подвешивают на двух разных глубинах (1 м и 2 м). Водолазы собирали образцы микробных матов непосредственно в инкубационные бутылки на соответствующих глубинах. Концентрация кислорода в отдельных баллонах измеряется с судна. Бутылки вытаскиваются из воды. Значение концентрации кислорода измеряется через несколько секунд путем подключения оптического кабеля к датчику кислорода. Затем бутылки осторожно опускают обратно в воду. Вся процедура измерения двух пар инкубационных бутылок с двух глубин занимает ~2 мин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Анализ проб
- После окончания измерений возьмите образцы непосредственно из бутылок и перенесите биомассу микробного мата в небольшие пластиковые колбы. Если маты растут на твердых субстратах (например, камнях), протрите их зубной щеткой или небольшим ножом.
- В лаборатории каждый фильтр реплицируют через предварительно взвешенные фильтры из стекловолокна для определения сухого веса9.
7. Анализ данных
- В течение инкубационного периода измерьте концентрацию кислорода в светлом и темном баллонах и сравните ее с концентрацией кислорода в толще воды при наполнении баллонов.
ПРИМЕЧАНИЕ: Изменение содержания кислорода в световом баллоне с течением времени является совокупным результатом валовой продуктивности экосистемы (ГЭП) и дыхания всех организмов в баллоне (автотрофов и гетеротрофов из окружающей воды и перифитного сообщества). Уменьшение кислорода в темном флаконе измеряет дыхательные потери как автотрофов, так и гетеротрофов. Изменение концентрации кислорода в контроле (т.е. в баллонах без перифитона) является лишь продуктом гетеротрофных или автотрофных организмов в окружающей воде. Продуктивность перифитона и дыхание оценивались путем вычитания продуктивности окружающей воды и дыхания, измеренных в пустых инкубационных бутылках. - Запишите концентрацию O2 в процентах насыщения кислородом (т. Е. Откалибруйте датчики кислорода до 0% и 100% насыщения кислородом). Прежде чем оценивать первичную производительность, преобразуйте необработанные данные (
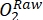 ) в некоторую разумную единицу.
) в некоторую разумную единицу.
ПРИМЕЧАНИЕ: В этом исследовании данные преобразуются в ммоль O2 на грамм органического вещества (OM) перифитонной массы на основе сухого веса, согласно Benson and Krause10.- Рассчитайте преобразование с помощью уравнения (1):
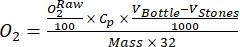 (1)
(1)
Где Cp - концентрация O2 в воде (мг (O2) L-1), когда она полностью насыщена O2, VBottle - объем бутылки в мл, VStones - объем, занимаемый камнем в мл, - вес перифитонной массы в г, а 32 - молярный вес O2. - Вычислить Cp с помощью уравнения (2):
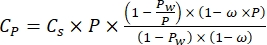 (2)
(2)
Где Cs — стандартная концентрация O2 , P — атмосферное давление на поверхности озера, Pw — парциальное давление водяного пара на поверхности озера, а ω — плотность воды. - Вычислите Cs, ω, P и Pw из ранее определенных эмпирических уравнений (3-6), когда высота озера (h в км) и температура воды на поверхности озера (t в °C) известны:
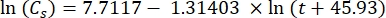 (3)
(3)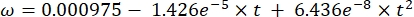 (4)
(4)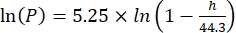 (5)
(5)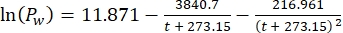 (6)
(6)
ПРИМЕЧАНИЕ: Из уравнений (1-6) очевидно, что рассчитанная концентрация O2 является наиболее точной для небольших глубин. По мере увеличения глубины расчетная концентрация становится более смещенной с точки зрения абсолютной концентрации. Оптимально, когда для каждого озера известна скорость изменения концентрации кислорода вдоль глубины, чтобы при необходимости можно было скорректировать абсолютную концентрациюО2 . После расчета концентрацииО2 ее изменение с течением времени может быть использовано для расчета двух различных потоковО2 при двух различных условиях. В условиях освещения чистая продуктивность экосистем (НЭП) прямо пропорциональна изменению концентрацииО2 с течением времени (см. ниже). Термин «экосистема» используется здесь для обозначения того, что перифитон состоит из автотрофных и гетеротрофных организмов. В темноте изменение концентрацииО2 с течением времени пропорционально сумме дыхательных потерь автотрофных и гетеротрофных организмов, что определяет дыхание экосистемы (РЭ). Разница между НЭП и ВИЭ определяет валовую продуктивность экосистем (ГЭП). Если дыхательные потери гетеротрофной части сообщества незначительны, ГЭП становится равным валовой продуктивности экосистемы.
- Рассчитайте преобразование с помощью уравнения (1):
- Определить скорость изменения концентрацииО2 с течением времени методом полиномиальной регрессии третьей степени, как показано в уравнении (7).
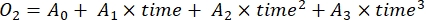 (7)
(7)
Где A0 — концентрация O2 в нулевое время, а A1-A 2 — коэффициенты полиномиальной регрессии.
ПРИМЕЧАНИЕ: Полиномиальная функция используется потому, что она может служить аппроксимацией любого дифференциального уравнения. Таким образом, нет необходимости знать точную функциональную зависимость между концентрациейО2 и временем. Поэтому любое предположение, связанное с функциональной зависимостью (например, линейность), не нуждается в контроле. По определению, второй член полиномиальной регрессии , A1 определяет скорость изменения концентрации O2 в нулевое время (т.е. мгновенную скорость), которая не зависит от A0 и, таким образом, абсолютной концентрацииO2 в нулевое время. По этой причине на оценку потокаО2 не влияет смещение в расчетах абсолютной концентрацииО2 , вызванное изменением давления по градиенту глубины. A1 имеет единицыO2 (ммоль г(ОМ)-1) за раз (1 ч в этом исследовании).- Рассчитать A1, рассчитанное отдельно для бутылок с воздействием света и без него и содержащих микробную матовую биомассу (т.е. VКамней > 0) и для контрольных бутылок с воздействием света и без него и содержащих свободную воду (т.е. VКамни = 0).
ПРИМЕЧАНИЕ: При присвоении этим различным коэффициентам регрессии обозначений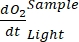
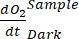 , ,
, , 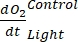 , и
, и 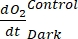 , соответственно, уравнение (8) для расчета производительности GEP может быть записано как:
, соответственно, уравнение (8) для расчета производительности GEP может быть записано как: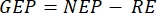 (8.1)
(8.1)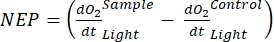 (8.2)
(8.2)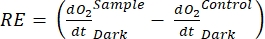 (8.3)
(8.3)
Термин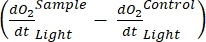 определяет чистую продуктивность экосистемы (рисунок 5A; т.е. чистую производительность кислорода), и термин
определяет чистую продуктивность экосистемы (рисунок 5A; т.е. чистую производительность кислорода), и термин 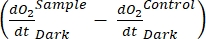 представляет собой сумму автотрофного и гетеротрофного дыхания (рисунок 5B; RE, т.е. предполагая, что оба дыхания похожи в условиях темноты и света).
представляет собой сумму автотрофного и гетеротрофного дыхания (рисунок 5B; RE, т.е. предполагая, что оба дыхания похожи в условиях темноты и света). - Вычтите R из NEP для получения GEP (рисунок 5C).
ПРИМЕЧАНИЕ: Уравнение (8) неявно предполагает, что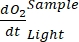 и
и 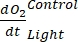 являются как положительными, так и
являются как положительными, так и 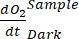
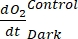 отрицательными. Если
отрицательными. Если 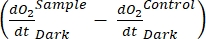 они положительные, тщательно проверьте исходные данные на предмет выбросов,
они положительные, тщательно проверьте исходные данные на предмет выбросов, 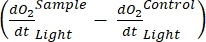 которые теоретически могут быть отрицательными, потому что потери дыхания, вызванные гетеротрофной активностью, могут быть выше, чем фотосинтетическая активность.
которые теоретически могут быть отрицательными, потому что потери дыхания, вызванные гетеротрофной активностью, могут быть выше, чем фотосинтетическая активность.
- Рассчитать A1, рассчитанное отдельно для бутылок с воздействием света и без него и содержащих микробную матовую биомассу (т.е. VКамней > 0) и для контрольных бутылок с воздействием света и без него и содержащих свободную воду (т.е. VКамни = 0).
Результаты
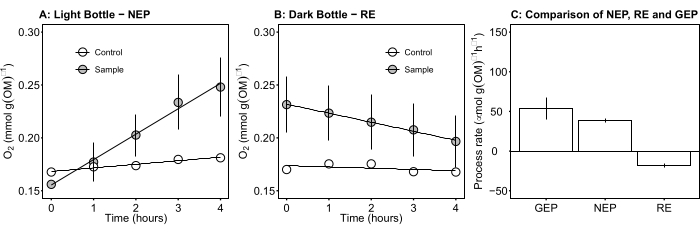
Рисунок 5: Чистая и валовая продуктивность экосистем микробных матов при дневном свете. А) Продуктивность экосистемы "легкая бутылочно-чистая": данные о чистой продуктивности кислорода микро?...
Обсуждение
Методика, описанная в данной работе, основана на принципе метода кислорода в светлом и темном баллоне в сочетании с неинвазивным методом измерения концентрацииО2 с помощью оптических датчиков кислорода. Эта система позволяет параллельно измерять различные настройки инкубации, ?...
Раскрытие информации
Авторы подтверждают, что у них нет конфликта интересов для раскрытия.
Благодарности
Это исследование было поддержано Чешским научным фондом (GACR 19-05791S), RVO 67985939 и CAS в рамках программы Стратегии AV 21, Спасение и восстановление земель. Огромное спасибо Ондржею Сихельскому за съемки в поле - без него съемки были бы полным адом. Проект был бы невозможен без тесного сотрудничества с компаниями Palivový Kombinát Ústí s.p. и Sokolovská Uhelná, которые обеспечили доступ к исследуемым населенным пунктам.
Материалы
| Name | Company | Catalog Number | Comments |
| Aluminum angle L profile 40 x 40 mm x 3 mm, length 2,000 mm | |||
| Aluminum flat bar 40 x 3 x 350 mm | |||
| Bucket 15 L with concrete infill | |||
| Carabine hook with screw lock 50 x 5 mm | |||
| electric tape black | |||
| Extruded polystyrene (XPS) material 500 x 200 x 150 mm | |||
| Fibox 3 LCD trace | PreSens Precision Sensing GmbH | stand-alone fiber optic oxygen meter | |
| Hondex PS-7 Portable Depth Sounder | Hondex - Honda Electronics | to measures distances through water - to bottom depth measurement; https://www.honda-el.net/industry/ps-7e | |
| KORKEN - glass tight-seal jar 0.5 L | IKEA | incubation bottles; https://www.ikea.com/cz/en/p/korken-jar-with-lid-clear-glass-70213545/ | |
| metal hook | |||
| Oxygen Sensor Spot SP-PSt3-NAU-D5 | PreSens Precision Sensing GmbH | non-invasive optical oxygen sensor for measurements under Real Conditions | |
| SCOUT infantable canoe | GUMOTEX | https://www.gumotexboats.com/en/scout-standard#0000-044667-021-13/11C | |
| Screw 10 x 170 mm with hexagonal nuts | |||
| Screw 4 x 15 mm with hexagonal nuts | |||
| Screw 4 x 15 mm with wing nuts | |||
| Snap hooks 50 x 5 mm | |||
| Steel Carabine hook 50 x 5 mm | |||
| Steel chain with wire diameter 3 mm, inside link 5.5 x 26 mm | |||
| Steel chain, 5 m | |||
| toothbrush | |||
| tweezer | |||
| Washer 10 x 50 mm | |||
| Washer 4 x 10 mm | |||
| Washer 4 x 10 mm |
Ссылки
- Blachart, J. L., et al. Potential consequences of climate change for primary production and fish production in large marine ecosystems. Philosophical Transactions of the Royal Society B: Biological Sciences. 367 (1605), 2979-2989 (2012).
- Howarth, R. W., Michaels, A. F., Sala, O. E., Jackson, R. B., Mooney, H. A., Howarth, R. W. The Measurement of primary production in aquatic ecosystems. Methods in Ecosystem Science. , 72-85 (2000).
- Vadenbecouer, Y. E. G., Peterson, M. J., Vander, Z., Kalff, J. Benthic algal production across lake size gradients: Interactions among morphometry, nutrients, and light. Ecology. 89 (9), 2542-2552 (2008).
- Reimer, A., Landmann, G., Kempe, S. Lake Van, eastern Anatolia, hydrochemistry and history. Aquatic Geochemistry. 15 (1), 195-222 (2009).
- Cantonati, M., Lowe, R. L. Lake benthic algae: toward an understanding of their ecology. Freshwater Sciences. 33 (2), 475-486 (2014).
- Gaarder, T., Gran, H. H. Investigation of the production of plankton in the Oslo Fjord. Rapports et Proces-verbaux des Réunions. Conseil International pour l'Éxploration de la Mer. 42, 1-48 (1927).
- Hall, R. O., Thomas, S., Gaiser, E. E., Fahey, T. J., Knapp, A. K. Measuring Freshwater Primary Productivity and Respiration. Principles and Standards for Measuring Primary Productivity. , (2007).
- Howart, R., Michaels, A. Chapter 6 The Measurement of Primary Production in Aquatic Ecosystems. Springer Science and Business Media LLC. , (2000).
- Kopáček, J., Hejzlar, J. Semi-micro determination of total phosphorus in soils, sediments, and organic materials: a simplified perchloric acid digestion procedure. Communications in Soil Science and Plant Analysis. 26 (11-12), 1935-1946 (1995).
- Benson, B. B., Krause, D. The concentration and isotopic fractionation of oxygen dissolved in freshwater and seawater in equilibrium with the atmosphere1. Limnology and Oceanography. 29 (3), 620-632 (1984).
- Dodds, W. K., Biggs, B. J., Lowe, R. L. Photosynthesis-irradiance patterns in benthic microalgae: variations as a function of assemblage thickness and community structure. Journal of Phycology. 35 (1), 42-53 (1999).
- Bott, T. L., et al. An evaluation of techniques for measuring periphyton metabolism in chambers. Canadian Journal of Fisheries and Aquatic Sciences. 54 (3), 715-725 (1997).
- Blankenship, R. E. Structural and functional dynamics of photosynthetic antenna complexes. Proceedings of the National Academy of Sciences. 112 (45), 13751-13752 (2015).
- Hawes, I., Schwartz, A. -. M. Photosynthesis in an extreme shade environment, benthic microbial mats from Lake Hoare, a permanently ice-covered Antarctic lake. Journal of Phycology. 35 (3), 448-459 (1999).
- Aristegui, J., et al. Planktonic primary production and microbial respiration measured by 14C assimilation and dissolved oxygen changes in coastal waters of the Antarctic peninsula during austral summer: Implications for carbon flux studies. Marine Ecology-Progress Series. 132, 191-201 (1996).
- Steemann-Nielsen, C. The use of radioactive carbon (14C) for measuring organic production in the sea. Journal of Experimental Marine Biology and Ecology. 18 (2), 117-140 (1952).
- Sanz-Martín, M., et al. Relationship between carbon-and oxygen-based primary productivity in the Arctic Ocean, svalbard archipelago. Frontiers in Marine Science. 6, 468 (2019).
- Nielsen, E. S. Measurement of the production of organic matter in the sea by means of carbon-14. Nature. 167 (4252), 684-685 (1951).
- Jönsson, B. A 14C-incubation technique for measuring microphytobenthic primary productivity in intact sediment cores. Limnology and Oceanography. 36 (7), 1485-1492 (1991).
- Bender, M. L., et al. A comparison of four methods for determining planktonic community production. Limnology and Oceanography. 32 (5), 1085-1098 (1987).
- Šimek, K., et al. Spatio-temporal patterns of bacterioplankton productivity and community composition related to phytoplankton composition and protistan bacterivory in a dam reservoir. Aquatic Microbial Ecology. 51 (3), 249-262 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены