È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un metodo a basso costo per misurare la produttività primaria in situ delle comunità periphyton delle acque leniche
In questo articolo
Riepilogo
Qui viene presentato un metodo/struttura economica e trasportabile per misurare la produttività primaria dei tappeti microbici in condizioni di temperatura e luce ambientali effettive in situ . La configurazione sperimentale si basa su materiali ampiamente disponibili e può essere utilizzata in varie condizioni, offrendo al contempo i vantaggi dei modelli di laboratorio.
Abstract
Misurare la produttività primaria in situ del periphyton durante il gradiente della stagione di crescita può chiarire l'effetto quantitativo dei fattori ambientali (principalmente concentrazione di fosforo e intensità luminosa) e la composizione delle specie sulla produttività primaria. La produttività primaria è guidata principalmente dall'intensità della luce, dalla temperatura, dalla disponibilità di nutrienti e dalla distribuzione delle specie ioniche del sistema carbonatico nelle rispettive profondità della zona eufotica. È un sistema complesso che è molto difficile da simulare in laboratorio. Questa chiatta galleggiante economica, trasportabile e facile da costruire consente di misurare la produttività primaria in modo accurato, direttamente nelle reali condizioni naturali. La metodologia si basa sulla misurazione della produttività primaria in tempo reale utilizzando sensori di ossigeno non invasivi integrati in barattoli di vetro ermeticamente sigillati, consentendo il monitoraggio online del flusso di ossigeno e fornendo nuove informazioni sulle attività metaboliche. Misurazioni stagionali dettagliate in situ della produttività primaria lorda di tappeti microbici (o altri organismi bentonici) possono migliorare le attuali conoscenze dei processi che controllano la dinamica della produttività primaria nelle acque lentiche.
Introduzione
La produttività primaria è l'unico ingresso di carbonio autoctono nei sistemi acquatici che formano l'intero sistema rete alimentare1. Pertanto, la stima accurata della produttività primaria è un passo essenziale verso la comprensione del funzionamento degli ecosistemi acquatici. Le zone costiere sono aree ad alta produttività primaria e biodiversità. Oltre al fitoplancton, si presume che il periphyton (di seguito denominato tappetini microbici) e le macroalghe contribuiscano in modo significativo alla produttività primaria nelle zone litorali2. A causa del loro stile di vita sessile e della significativa eterogeneità spaziale, la quantificazione della produttività primaria non è banale.
La produttività primaria è guidata principalmente dall'intensità della luce, dalla temperatura, dalla disponibilità di nutrienti e dalla distribuzione delle specie ioniche del sistema carbonatico nelle rispettive profondità delle zone eufotiche 3,4. La profondità influenza notevolmente la distribuzione spaziale dei tappeti microbici. Le comunità microbiche devono far fronte agli effetti negativi dell'elevata irradiazione e delle pronunciate variazioni stagionali di temperatura a basse profondità e con minore intensità luminosa a profondità maggiori. Oltre al gradiente di profondità, le interazioni trofiche dinamiche generano modelli spaziali multipli e complessi a diverse scale5. Questo sistema complesso è complicato da simulare in laboratorio. Il modo più accurato per dedurre l'attività metabolica dei singoli produttori primari dalle zone costiere è quello di impostare esperimenti in situ.
La metodologia introdotta in questo articolo si basa sul metodo tradizionale della camera 2,6,7, insieme a una chiatta galleggiante a basso costo trasportabile e facile da costruire. Ciò consente la misurazione della produttività primaria a diverse profondità sotto lo spettro della luce naturale, la temperatura e la diversa distribuzione delle specie ioniche del sistema carbonatico con la profondità. Il metodo si basa sul principio dell'ossigeno in bottiglia chiaro contro scuro, che è stato impiegato per misurare la fotosintesi del fitoplancton 6 ed è ancora comunemente usato 6,7. Confronta il tasso di variazione dell'ossigeno nelle bombole tenute alla luce (che include gli effetti della produttività primaria e della respirazione) con quelle tenute al buio (solo respirazione)8. Il metodo utilizza l'evoluzione dell'ossigeno (fotosintesi) come proxy per la produttività primaria. Le variabili misurate sono la produttività netta dell'ecosistema (NEP, come variazione della concentrazione di O 2 nel tempo in condizioni di luce) e la respirazione dell'ecosistema (RE, come variazione della concentrazione di O2 nel tempo al buio). La produttività lorda dell'ecosistema (GEP) è il calcolo della differenza tra i due (Tabella 1). Il termine "ecosistema" è usato qui per indicare che il periphyton è composto da organismi autotrofi ed eterotrofi. Il miglioramento più significativo di questo metodo tradizionale a camera è l'utilizzo di sensori ottici ad ossigeno non invasivi e l'ottimizzazione di questo metodo principalmente planctonico per misurare la produttività primaria perifitica.
La tecnica è descritta nell'esempio di misurazione di tappeti microbici nella zona litorale di laghi post-minerari appena emersi nella Repubblica Ceca-Milada, Most e Medar. L'attività metabolica dei tappeti microbici viene determinata utilizzando la misurazione diretta in situ dei flussi di O2 eseguita direttamente a profondità specifiche, dove le comunità studiate si verificano naturalmente. L'attività eterotrofica e fototrofica viene misurata in bottiglie di vetro chiuse dotate di sensori ottici di ossigeno non invasivi. Questi sensori rilevano la pressione parziale dell'ossigeno utilizzando la fluorescenza dei coloranti sensibili alla luce. Le bottiglie con tappetini microbici sono sospese e incubate su un dispositivo galleggiante alle profondità appropriate. La concentrazione di ossigeno all'interno delle bombole è stata misurata continuamente durante il periodo di luce diurna dalla piccola barca.
Campioni di tappeti microbici intatti vengono raccolti e collocati in bombole di incubazione a tenuta di gas a profondità designate dai subacquei. Ogni flacone è dotato di un microsensore ottico di ossigeno non invasivo, che monitora la produttività/consumo di O2 nel tempo. Tutte le misurazioni vengono eseguite in cinque coppie di replica buio/luce in ogni profondità. La temperatura e le intensità della radiazione fotosinteticamente attiva (PHAR) vengono misurate alle rispettive profondità durante l'incubazione. Dopo 6 ore di incubazione in situ (ore diurne), le stuoie microbiche vengono raccolte dalle bottiglie ed essiccate. I flussi di O2 sono normalizzati a biomassa microbica. Come controllo, i flussi vengono corretti per le variazioni della concentrazione di O2 in bottiglie separate a tenuta di gas chiaro e scuro (controlli in bianco) contenenti acqua di lago senza biomassa microbica del tappeto. Di seguito sono riportate istruzioni dettagliate per costruire la chiatta galleggiante ed eseguire l'intero esperimento passo dopo passo. Questo articolo presenta anche risultati rappresentativi delle misurazioni di tappeti microbici a due profondità (1 m e 2 m), con cinque repliche a ciascuna profondità. La temperatura effettiva e l'intensità della luce sono state misurate durante l'intero esperimento utilizzando datalogger.
Access restricted. Please log in or start a trial to view this content.
Protocollo
NOTA: prima del campionamento, determinare il grado di repliche in base alle esigenze complessive del progetto, alla progettazione statistica o alla quantità prevista di variabilità del campione. Cinque coppie replicate di bottiglie di incubazione chiare e scure sono suggerite per un'analisi statistica precisa e per tenere conto della potenziale perdita o rottura del campione. La chiatta sperimentale galleggiante descritta è progettata per trasportare cinque repliche più una coppia di comandi vuoti; vedi figura 1 per un disegno tecnico della chiatta sperimentale.
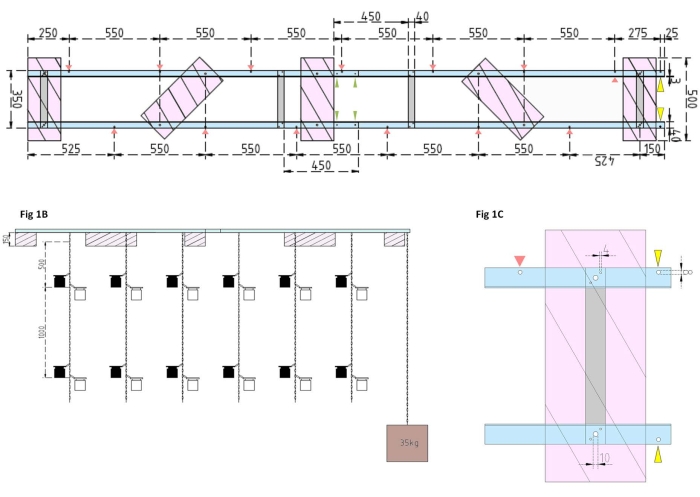
Figura 1: Disegni tecnici della chiatta sperimentale e del galleggiante laterale. (A) Vista dall'alto: il telaio della chiatta è costituito da quattro pezzi di profilo inclinato L in alluminio (blu) uniti tra loro da quattro barre piatte in alluminio (grigio). I galleggianti XPS (rosa) sono montati sul telaio in due punti, ciascuno sui pezzi di alluminio paralleli. Le catene per le bottiglie di incubazione sono fissate al telaio su entrambi i lati utilizzando moschettoni in fori preforati (frecce rosse) con 550 mm di separazione tra loro. Le catene sono state dotate di moschettoni a distanze di 1 m e 2 m per il fissaggio della bottiglia di incubazione (scegliere la posizione dei moschettoni in base alla profondità sperimentale). L'ancora in cemento è fissata alla prua della chiatta, dove uno sbalzo di 25 mm consente due fori preforati (punte di freccia gialle) per fungere da punto di attacco per la catena dell'ancora e la nave di ricerca. Il telaio viene assemblato o smontato facilmente tramite i giunti paralleli tra i quattro pezzi angolari in alluminio (punte di freccia verdi). (B) La vista laterale mostra le catene sospese con bottiglie di incubazione appese e ancoraggio in cemento (quadrato marrone). (C) Il galleggiante laterale XPS: i pezzi paralleli angolari in alluminio L (blu) sono uniti da barre piatte verticali in alluminio (grigio). Sotto la sezione della traversa, il galleggiante XPS (rosa) è montato con le dimensioni dei fori necessarie indicate (4 mm). Le catene sospese sono fissate con moschettoni in fori da 8 mm (punta di freccia rossa). A prua della chiatta, due fori da 8 mm sono praticati nell'alluminio sovrastante, uno per fissare l'ancora alla chiatta (punta di freccia gialla) e un altro per ormeggiare la nave da ricerca alla chiatta (blu). Fare clic qui per visualizzare una versione ingrandita di questa figura.
1. Costruzione della chiatta sperimentale
NOTA: La chiatta galleggiante è composta da due sezioni uguali montate insieme, consentendo un facile montaggio / smontaggio. Tutte le parti usate possono essere acquistate in qualsiasi mercato di hobby o negozio che vende materiali da costruzione.
- Innanzitutto, assemblare il telaio della chiatta unendo quattro pezzi di profilo a L angolare in alluminio (40 mm x 40 mm x 3 mm; lunghezza di 2.000 mm) utilizzando quattro barre piatte in alluminio (40 mm x 3 mm x 350 mm), 16 viti (4 mm x 15 mm con dadi esagonali) e 32 rondelle (4 mm x 10 mm).
NOTA: La distanza e la posizione delle barre piatte sono mostrate nel disegno tecnico della figura 1A. Il fissaggio dettagliato dei galleggianti alle barre piatte laterali è mostrato nella Figura 1B. - Per unire le due sezioni uguali del telaio, utilizzare quattro viti da 4 mm x 15 mm con dadi ad alette e otto rondelle da 4 mm x 10 mm per avvitare i profili a L angolari in alluminio alle estremità (Figura 1A, frecce verdi).
- Utilizzare cinque pezzi di materiale in polistirene estruso (XPS) (500 mm x 200 mm x 150 mm), dieci viti da 10 mm x 170 mm con dadi esagonali e venti rondelle da 10 x 50 mm per preparare cinque galleggianti in polistirene estruso (500 mm x 200 mm x 150 mm ciascuno). Fissate i galleggianti al telaio in cinque punti mostrati nel disegno tecnico (Figura 1A).
- Praticare dei fori nel telaio (vedere le frecce rosse nella Figura 1A che segnano le posizioni e le distanze dei fori per le catene). Fissare le catene in acciaio da 12 m (diametro del filo di 3 mm, maglia interna di 5,5 mm x 26 mm) per le bottiglie di incubazione ai fori nel telaio utilizzando ganci in acciaio carabine (50 mm x 5 mm). Fornire a ciascuna catena coppie di moschettoni (50 mm x 5 mm) per installare le bottiglie di incubazione alla profondità desiderata secondo il design sperimentale. In questo caso, erano seduti a 1 m e 2 m di profondità.
- Per l'ancora, riempire il secchio da 15 L con cemento. Inserire un golfare nel calcestruzzo e lasciarlo asciugare indisturbato. Fissare la catena in acciaio da 5 m al gancio. Fissare l'ancora al foro preforato sulla prua della chiatta (contrassegnato da frecce gialle nella figura 1A,B).
NOTA: i disegni tecnici con la descrizione dell'assieme sono mostrati nella Figura 1A-C. La figura 2 mostra la foto della chiatta sperimentale assemblata. La figura 3 mostra l'attacco delle bottiglie di incubazione alla catena.
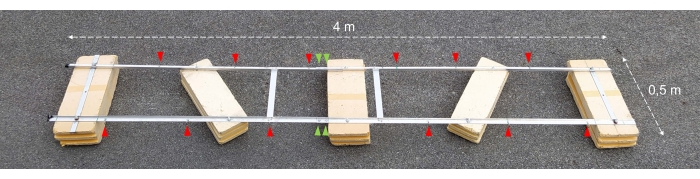
Figura 2: Chiatta sperimentale assemblata. Fotografia della chiatta sperimentale assemblata. Le punte di freccia rosse mostrano i fori per il fissaggio di catene con bottiglie di incubazione. Le punte di freccia verdi indicano dove le due metà del galleggiante sono unite insieme. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Bottiglie di incubazione. Foto di due paia di bottiglie di incubazione scure e chiare appese a una profondità di 1 m. Un paio di bottiglie contiene il campione di tappeti microbici intatti che ancora crescono sulla pietra (punta di freccia rossa). Il secondo è la bottiglia vuota con l'acqua del lago dalla rispettiva profondità. Una punta di freccia gialla indica il punto del sensore di ossigeno attaccato alla parete interna della bottiglia di incubazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Installazione sul campo
- L'uso di un kayak gonfiabile è suggerito per il posizionamento di chiatte e la conduzione di esperimenti in quanto è facilmente trasportabile.
- Selezionare un luogo con una profondità ideale per ancorare il galleggiante. Scegli la profondità in modo che le bottiglie di incubazione inferiori siano almeno 2 m sopra il fondo per evitare di disturbare il sedimento nella colonna d'acqua attorno alle bottiglie di incubazione.
- Attaccare la chiatta assemblata dietro la poppa della barca. Abbassare con attenzione l'ancora lungo il lato della barca e allinearla in modo che penda leggermente sotto la superficie dell'acqua in modo che il galleggiante possa essere facilmente trainato insieme all'ancora nel punto con la profondità richiesta.
- Slegare l'ancora dalla barca, abbassarla sul fondo e fissare la chiatta alla catena dell'ancora.
- Fissare le catene per attaccare le bottiglie di incubazione alla chiatta.
3. Preparazione del flacone di incubazione
- Utilizzare le bottiglie trasparenti a collo largo da 0,5 L con guarnizioni a tenuta di gas.
NOTA: E' possibile regolare le dimensioni delle bottiglie ma ricordarsi di aumentare il galleggiamento della chiatta con più fogli di polistirolo. La chiatta qui descritta può trasportare in modo affidabile 24 bottiglie di vetro da 0,5 litri. - Fissare gli spot del sensore ottico di ossigeno alla parete interna di ogni bottiglia.
- Aggiungere uno strato opaco ai flaconi di trattamento scuri avvolgendoli con nastro adesivo elettrico nero.
- Tagliare un piccolo foro nel punto con il sensore ottico. Per evitare che la luce entri nella bottiglia, rendere il foro leggermente più piccolo del diametro del sensore.
NOTA: anche qualsiasi strato opaco che impedisce alla luce di entrare nella bottiglia funzionerà. Il vantaggio del nastro isolante nero è che resiste all'abrasione e non si stacca in acqua.
4. Raccolta e manipolazione dei campioni
NOTA: I subacquei effettuano la raccolta manuale dei campioni in acque più profonde. In acque poco profonde, può essere fatto facendo snorkeling o guadando.
- Posizionare le bottiglie di incubazione nella scatola portatile.
- Immergiti con la scatola alla rispettiva profondità. Evitare di disturbare i sedimenti nell'acqua circostante.
- Riempire accuratamente le bottiglie di incubazione con i campioni. Cerca di disturbare il meno possibile la biomassa del campione, ad esempio usando pinzette lunghe. Se i tappeti microbici crescono su una superficie solida, come una piccola pietra, trasferire con cura l'intera pietra con biomassa intatta nella bottiglia.
NOTA: evitare di raccogliere pietre di grandi dimensioni quando le stuoie di campionamento crescono sulle pietre: le bottiglie di vetro possono essere rotte durante ulteriori manipolazioni. - Riempire un paio di bottiglie chiare / scure con acqua pulita dalle rispettive profondità per fungere da controlli vuoti.
NOTA: Le bottiglie senza il campione di periphyton servono come controllo che determina la produzione/consumo di ossigeno degli organismi idrici ambientali. Garantisce che la produttività primaria netta o lorda calcolata di periphyton sia imparziale. - Assicurarsi che l'acqua in tutte le bottiglie di incubazione sia pulita e non contenga sedimenti fastidiosi.
- Chiudere le bottiglie e portarle alla barca ancorata alla chiatta galleggiante.
5. Misurare la produttività primaria
NOTA: La persona seduta nella barca prende la scatola dal subacqueo ed esegue i seguenti passaggi.
- Attaccare le prime due paia di bottiglie di incubazione ai moschettoni sulla prima catena.
- Misurare la concentrazione iniziale di ossigeno in ogni bottiglia utilizzando il misuratore di ossigeno a fibre ottiche. Collegare il cavo ottico del misuratore al sensore di ossigeno montato all'interno della bombola e leggere immediatamente (entro pochi secondi) la concentrazione di O2 senza contatto (attraverso la parete della bottiglia). Registrare il valore misurato.
NOTA: Il tempo di gestione è breve; Dal portare le bottiglie dai subacquei all'impostazione iniziale alla rispettiva profondità, bastano pochi minuti. - Subito dopo, abbassare con attenzione la catena con le bottiglie attaccate nell'acqua. Assicurarsi che le bottiglie di incubazione siano posizionate alla stessa profondità in cui è stata campionata la biomassa che è stata posta in esse.
- Effettuare un'altra misurazione dalla nave dopo 1 ora (vedi NOTA sotto). Tirare con attenzione ogni catena con le bottiglie nella barca, leggere il valore dell'ossigeno collegando il cavo ottico al sensore e abbassare nuovamente i campioni nell'acqua.
NOTA: Regolare il tempo tra le singole misurazioni durante l'incubazione in base all'intensità della produttività/consumo di O2 dei campioni per evitare la sovrasaturazione delle bottiglie. - Ripetere questa procedura almeno quattro o cinque volte con tutte le coppie di bottiglie.
NOTA: l'intera configurazione dell'esperimento sul campo è illustrata nella Figura 4.
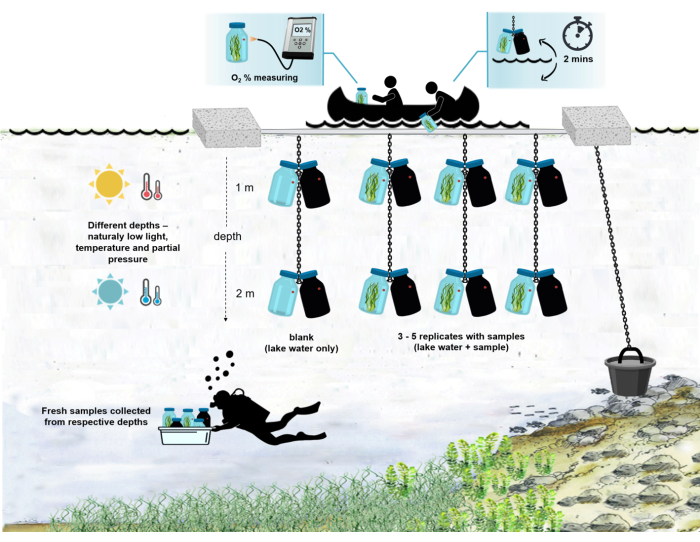
Figura 4: Schema del setup sperimentale sul campo. Illustrazione della chiatta sperimentale ancorata sulla superficie del lago. Le bottiglie di incubazione (0,5 L) con biomassa microbica sono appese a due diverse profondità (1 m e 2 m). I subacquei hanno raccolto campioni di tappeti microbici direttamente nelle bottiglie di incubazione alle profondità appropriate. La concentrazione di ossigeno nelle singole bottiglie viene misurata dalla nave. Le bottiglie vengono tirate fuori dall'acqua. Il valore della concentrazione di ossigeno viene misurato in pochi secondi collegando un cavo ottico al sensore di ossigeno. Le bottiglie vengono quindi accuratamente abbassate nell'acqua. L'intera procedura di misurazione di due paia di bottiglie di incubazione da due profondità richiede ~ 2 min. Fare clic qui per visualizzare una versione più grande di questa figura.
6. Analisi dei campioni
- Dopo la fine delle misurazioni, prelevare i campioni direttamente dalle bottiglie e trasferire la biomassa del tappeto microbico ai piccoli palloni di plastica. Se le stuoie crescono su substrati solidi (ad esempio, pietre), strofinarli con uno spazzolino da denti o un coltellino.
- In laboratorio, filtrare ciascuna replica attraverso filtri in fibra di vetro pre-pesati per determinare il peso a secco9.
7. Analisi dei dati
- Durante il periodo di incubazione, misurare la concentrazione di ossigeno nelle bottiglie chiare e scure e confrontarla con la concentrazione di ossigeno nella colonna d'acqua quando le bottiglie sono riempite.
NOTA: La variazione di ossigeno nella bottiglia luminosa nel tempo è il risultato combinato della produttività lorda dell'ecosistema (GEP) e della respirazione da parte di tutti gli organismi nella bottiglia (autotrofi ed eterotrofi dall'acqua ambiente e dalla comunità perifitica). La diminuzione dell'ossigeno nella bottiglia scura misura le perdite respiratorie sia degli autotrofi che degli eterotrofi. La variazione della concentrazione di ossigeno nel controllo (cioè bottiglie senza periphyton) è solo il prodotto di organismi eterotrofi o autotrofi nell'acqua ambiente. La produttività e la respirazione del periphyton sono state stimate sottraendo la produttività dell'acqua ambiente e la respirazione misurata in bottiglie di incubazione vuote. - Annotare la concentrazione di O2 in percentuale di saturazione di ossigeno (cioè, calibrare i sensori di ossigeno allo 0% e al 100% di saturazione di ossigeno). Prima di stimare la produttività primaria, convertire i dati grezzi (
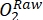 ) in un'unità ragionevole.
) in un'unità ragionevole.
NOTA: In questo studio, i dati vengono convertiti in mmol di O2 per grammo di materia organica (OM) della massa periphyton sulla base del peso secco, secondo Benson e Krause10.- Calcola la conversione usando l'equazione (1):
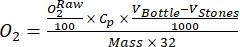 (1)
(1)
Dove Cp è la concentrazione di O 2 in acqua (mg (O 2) L-1) quando è completamente saturato da O 2, V Bottle è il volume della bottiglia in ml, VStones è il volume occupato dalla pietra in mL, è il peso della massa periphyton in g e 32 è il peso molare di O 2. - Calcola Cp usando l'equazione (2):
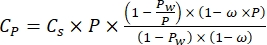 (2)
(2)
Dove Cs è la concentrazione standard di O2, P è la pressione atmosferica sulla superficie del lago, Pw è la pressione parziale del vapore acqueo sulla superficie del lago e ω è la densità dell'acqua. - Calcolare Cs, ω, P e Pw da equazioni empiriche precedentemente definite (3-6) quando l'elevazione del lago (h in km) e la temperatura dell'acqua sulla superficie del lago (t in °C) sono note:
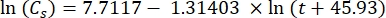 (3)
(3)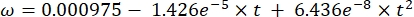 (4)
(4)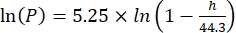 (5)
(5)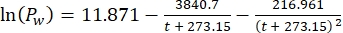 (6)
(6)
NOTA: Dalle equazioni (1-6), è evidente che la concentrazione calcolata di O2 è più accurata per profondità ridotte. All'aumentare della profondità, la concentrazione calcolata diventa più distorta in termini di concentrazione assoluta. È ottimale quando il tasso di variazione della concentrazione di ossigeno lungo la profondità è noto per ciascun lago in modo che la concentrazione assoluta di O2 possa essere corretta se necessario. Una volta calcolata la concentrazione di O 2, la sua variazione nel tempo può essere utilizzata per calcolare due diversi flussi di O2 in due condizioni diverse. In condizioni di luce, la produttività netta dell'ecosistema (NEP) è direttamente proporzionale alla variazione della concentrazione di O2 nel tempo (vedi sotto). Il termine "ecosistema" è usato qui per indicare che il periphyton è composto da organismi autotrofi ed eterotrofi. Al buio, la variazione della concentrazione di O2 nel tempo è proporzionale alla somma delle perdite respiratorie degli organismi autotrofi ed eterotrofi, definendo così la respirazione dell'ecosistema (RE). La differenza tra NEP e RE definisce la produttività lorda dell'ecosistema (GEP). Se le perdite respiratorie della parte eterotrofica della comunità sono trascurabili, GEP diventa uguale alla produttività lorda dell'ecosistema.
- Calcola la conversione usando l'equazione (1):
- Determinare il tasso di variazione della concentrazione di O2 nel tempo mediante regressione polinomiale di terzo grado, come mostrato nell'equazione (7).
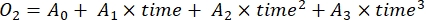 (7)
(7)
Dove A 0 è la concentrazione di O 2 al tempo zero e A 1-A2 sono coefficienti di regressione polinomiale.
NOTA: la funzione polinomiale viene utilizzata perché può servire come approssimazione di qualsiasi equazione differenziale. Pertanto, non è necessario conoscere l'accurata relazione funzionale tra la concentrazione di O2 e il tempo. Pertanto, qualsiasi ipotesi associata alla relazione funzionale (ad esempio, linearità) non ha bisogno di essere controllata. Per definizione, il secondo termine di regressione polinomiale, A 1 definisce il tasso di variazione della concentrazione di O 2 al tempo zero (cioè la velocità istantanea), che è indipendente da A0 e, quindi, dalla concentrazione assoluta di O 2 al tempo zero. Per questo motivo, la stima del flusso di O 2 non è influenzata dalla distorsione nei calcoli della concentrazione assoluta di O2 causata dalla variazione di pressione attraverso il gradiente di profondità. A 1 ha unità O2 (mmol g(OM)-1) per tempo (1 h in questo studio).- Calcolare A1, calcolato separatamente per bottiglie con e senza esposizione alla luce e contenenti biomassa microbica (cioè V Stones > 0) e per bottiglie di controllo con e senza esposizione alla luce e contenenti acqua libera (ad esempio, V Stones = 0).
NOTA: assegnando a questi diversi coefficienti di regressione le notazioni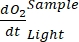 , , , e
, , , e 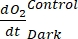 , rispettivamente,
, rispettivamente, 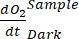
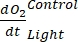 l'equazione (8) per il calcolo GEP della produttività può essere scritta come:
l'equazione (8) per il calcolo GEP della produttività può essere scritta come: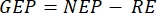 (8.1)
(8.1)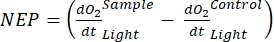 (8.2)
(8.2)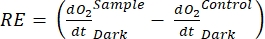 (8.3)
(8.3)
Il termine definisce la produttività netta dell'ecosistema (Figura 5A; cioè la produttività netta dell'ossigeno) e il termine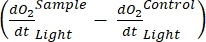
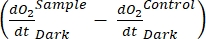 rappresenta la somma della respirazione autotrofica ed eterotrofica (Figura 5B; RE, cioè, supponendo che entrambe le respirazioni siano simili in condizioni di buio e luce).
rappresenta la somma della respirazione autotrofica ed eterotrofica (Figura 5B; RE, cioè, supponendo che entrambe le respirazioni siano simili in condizioni di buio e luce). - Sottrarre R dalla NEP per ottenere GEP (Figura 5C).
NOTA: L'equazione (8) assume implicitamente che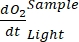 e sono entrambi positivi e e
e sono entrambi positivi e e 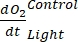
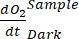 sono
sono 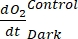 entrambi negativi. Se
entrambi negativi. Se 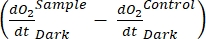 è positivo, controllare attentamente i dati grezzi per i valori anomali.
è positivo, controllare attentamente i dati grezzi per i valori anomali. 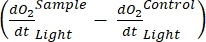 può essere teoricamente negativo perché le perdite respiratorie causate dall'attività eterotrofica possono essere superiori all'attività fotosintetica.
può essere teoricamente negativo perché le perdite respiratorie causate dall'attività eterotrofica possono essere superiori all'attività fotosintetica.
- Calcolare A1, calcolato separatamente per bottiglie con e senza esposizione alla luce e contenenti biomassa microbica (cioè V Stones > 0) e per bottiglie di controllo con e senza esposizione alla luce e contenenti acqua libera (ad esempio, V Stones = 0).
Access restricted. Please log in or start a trial to view this content.
Risultati
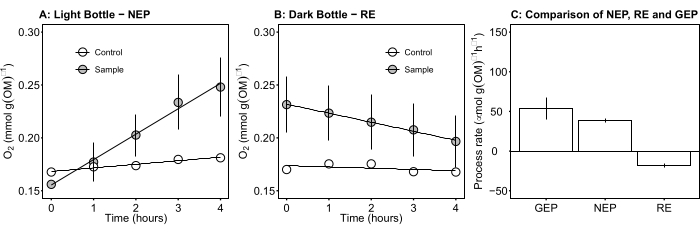
Figura 5: Produttività netta e lorda dell'ecosistema delle stuoie microbiche durante il giorno. (A) Produttività dell'ecosistema della rete di bottiglie leggere: dati relativi al corso temporale della produttività netta dell'ossigeno dei tappeti microbici delle bottiglie luminose. La variazione della concentrazione di ossigeno nelle bottiglie di ...
Access restricted. Please log in or start a trial to view this content.
Discussione
La metodologia descritta in questo articolo si basa sul principio della tecnica dell'ossigeno in bottiglia chiara e scura in combinazione con la tecnica non invasiva di misurazione della concentrazione di O2 utilizzando sensori ottici di ossigeno. Questo sistema consente la misurazione parallela di diverse impostazioni di incubazione poiché la fibra ottica per misurare O2 può essere spostata rapidamente da una bottiglia all'altra. Le comunità bentoniche di varie profondità possono differire nell...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori confermano di non avere conflitti di interesse da rivelare.
Riconoscimenti
Questo studio è stato sostenuto dalla Czech Science Foundation (GACR 19-05791S), RVO 67985939 e dal CAS nell'ambito del programma della strategia AV 21, Land save and recovery. Mille grazie a Ondřej Sihelský per aver scattato le riprese sul campo - senza di lui, le riprese sarebbero state un vero inferno. Il progetto non sarebbe stato possibile senza una stretta collaborazione con le aziende, Palivový Kombinát Ústí s.p. e Sokolovská Uhelná, che hanno fornito l'accesso alle località studiate.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Aluminum angle L profile 40 x 40 mm x 3 mm, length 2,000 mm | |||
| Aluminum flat bar 40 x 3 x 350 mm | |||
| Bucket 15 L with concrete infill | |||
| Carabine hook with screw lock 50 x 5 mm | |||
| electric tape black | |||
| Extruded polystyrene (XPS) material 500 x 200 x 150 mm | |||
| Fibox 3 LCD trace | PreSens Precision Sensing GmbH | stand-alone fiber optic oxygen meter | |
| Hondex PS-7 Portable Depth Sounder | Hondex - Honda Electronics | to measures distances through water - to bottom depth measurement; https://www.honda-el.net/industry/ps-7e | |
| KORKEN - glass tight-seal jar 0.5 L | IKEA | incubation bottles; https://www.ikea.com/cz/en/p/korken-jar-with-lid-clear-glass-70213545/ | |
| metal hook | |||
| Oxygen Sensor Spot SP-PSt3-NAU-D5 | PreSens Precision Sensing GmbH | non-invasive optical oxygen sensor for measurements under Real Conditions | |
| SCOUT infantable canoe | GUMOTEX | https://www.gumotexboats.com/en/scout-standard#0000-044667-021-13/11C | |
| Screw 10 x 170 mm with hexagonal nuts | |||
| Screw 4 x 15 mm with hexagonal nuts | |||
| Screw 4 x 15 mm with wing nuts | |||
| Snap hooks 50 x 5 mm | |||
| Steel Carabine hook 50 x 5 mm | |||
| Steel chain with wire diameter 3 mm, inside link 5.5 x 26 mm | |||
| Steel chain, 5 m | |||
| toothbrush | |||
| tweezer | |||
| Washer 10 x 50 mm | |||
| Washer 4 x 10 mm | |||
| Washer 4 x 10 mm |
Riferimenti
- Blachart, J. L., et al. Potential consequences of climate change for primary production and fish production in large marine ecosystems. Philosophical Transactions of the Royal Society B: Biological Sciences. 367 (1605), 2979-2989 (2012).
- Howarth, R. W., Michaels, A. F. The Measurement of primary production in aquatic ecosystems. Methods in Ecosystem Science. Sala, O. E., Jackson, R. B., Mooney, H. A., Howarth, R. W. , Springer. New York, NY. 72-85 (2000).
- Vadenbecouer, Y. E. G., Peterson, M. J., Vander, Z., Kalff, J. Benthic algal production across lake size gradients: Interactions among morphometry, nutrients, and light. Ecology. 89 (9), 2542-2552 (2008).
- Reimer, A., Landmann, G., Kempe, S. Lake Van, eastern Anatolia, hydrochemistry and history. Aquatic Geochemistry. 15 (1), 195-222 (2009).
- Cantonati, M., Lowe, R. L. Lake benthic algae: toward an understanding of their ecology. Freshwater Sciences. 33 (2), 475-486 (2014).
- Gaarder, T., Gran, H. H. Investigation of the production of plankton in the Oslo Fjord. Rapports et Proces-verbaux des Réunions. Conseil International pour l'Éxploration de la Mer. 42, 1-48 (1927).
- Hall, R. O., Thomas, S., Gaiser, E. E. Measuring Freshwater Primary Productivity and Respiration. Principles and Standards for Measuring Primary Productivity. Fahey, T. J., Knapp, A. K. , Oxford Academic. New York. The Long-Term Ecological Research Network Series (2007).
- Howart, R., Michaels, A. Chapter 6 The Measurement of Primary Production in Aquatic Ecosystems. Springer Science and Business Media LLC. , (2000).
- Kopáček, J., Hejzlar, J. Semi-micro determination of total phosphorus in soils, sediments, and organic materials: a simplified perchloric acid digestion procedure. Communications in Soil Science and Plant Analysis. 26 (11-12), 1935-1946 (1995).
- Benson, B. B., Krause, D. The concentration and isotopic fractionation of oxygen dissolved in freshwater and seawater in equilibrium with the atmosphere1. Limnology and Oceanography. 29 (3), 620-632 (1984).
- Dodds, W. K., Biggs, B. J., Lowe, R. L. Photosynthesis-irradiance patterns in benthic microalgae: variations as a function of assemblage thickness and community structure. Journal of Phycology. 35 (1), 42-53 (1999).
- Bott, T. L., et al. An evaluation of techniques for measuring periphyton metabolism in chambers. Canadian Journal of Fisheries and Aquatic Sciences. 54 (3), 715-725 (1997).
- Blankenship, R. E. Structural and functional dynamics of photosynthetic antenna complexes. Proceedings of the National Academy of Sciences. 112 (45), 13751-13752 (2015).
- Hawes, I., Schwartz, A. -M. Photosynthesis in an extreme shade environment, benthic microbial mats from Lake Hoare, a permanently ice-covered Antarctic lake. Journal of Phycology. 35 (3), 448-459 (1999).
- Aristegui, J., et al. Planktonic primary production and microbial respiration measured by 14C assimilation and dissolved oxygen changes in coastal waters of the Antarctic peninsula during austral summer: Implications for carbon flux studies. Marine Ecology-Progress Series. 132, 191-201 (1996).
- Steemann-Nielsen, C. The use of radioactive carbon (14C) for measuring organic production in the sea. Journal of Experimental Marine Biology and Ecology. 18 (2), 117-140 (1952).
- Sanz-Martín, M., et al. Relationship between carbon-and oxygen-based primary productivity in the Arctic Ocean, svalbard archipelago. Frontiers in Marine Science. 6, 468(2019).
- Nielsen, E. S. Measurement of the production of organic matter in the sea by means of carbon-14. Nature. 167 (4252), 684-685 (1951).
- Jönsson, B. A 14C-incubation technique for measuring microphytobenthic primary productivity in intact sediment cores. Limnology and Oceanography. 36 (7), 1485-1492 (1991).
- Bender, M. L., et al. A comparison of four methods for determining planktonic community production. Limnology and Oceanography. 32 (5), 1085-1098 (1987).
- Šimek, K., et al. Spatio-temporal patterns of bacterioplankton productivity and community composition related to phytoplankton composition and protistan bacterivory in a dam reservoir. Aquatic Microbial Ecology. 51 (3), 249-262 (2008).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon