Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Lentik Suların Perifiton Topluluklarının In Situ Birincil Verimliliğini Ölçmenin Düşük Maliyetli Bir Yöntemi
Bu Makalede
Özet
Burada, gerçek in situ ortam sıcaklığı ve ışık koşulları altında mikrobiyal paspasların birincil verimliliğini ölçmek için uygun maliyetli ve taşınabilir bir yöntem / tesis sunulmaktadır. Deney düzeneği, yaygın olarak bulunan malzemelere dayanmaktadır ve laboratuvar tabanlı modellerin avantajlarını sunarken çeşitli koşullar altında kullanılabilir.
Özet
Büyüme mevsimi gradyanı sırasında perifitonun in situ birincil verimliliğinin ölçülmesi, çevresel faktörlerin (esas olarak fosfor konsantrasyonu ve ışık yoğunluğu) ve tür kompozisyonunun birincil verimlilik üzerindeki nicel etkisini açıklığa kavuşturabilir. Birincil üretkenlik esas olarak ışık yoğunluğu, sıcaklık, besin maddelerinin mevcudiyeti ve karbonat sisteminin iyonik türlerinin öfotik bölgenin ilgili derinliklerindeki dağılımından kaynaklanmaktadır. Laboratuvarda simüle edilmesi çok zor olan karmaşık bir sistemdir. Bu ucuz, taşınabilir ve yapımı kolay yüzer mavna, birincil üretkenliğin gerçek doğal koşullar altında doğrudan doğru bir şekilde ölçülmesini sağlar. Metodoloji, sıkıca kapatılmış cam kavanozlara entegre edilmiş invaziv olmayan oksijen sensörlerini kullanarak birincil üretkenliği gerçek zamanlı olarak ölçmeye dayanır, böylece çevrimiçi oksijen akısı izlemeyi mümkün kılar ve metabolik faaliyetler hakkında yeni bilgiler sağlar. Mikrobiyal paspasların (veya diğer bentik organizmaların) brüt birincil verimliliğinin ayrıntılı mevsimsel in situ ölçümleri, merceksi sularda birincil verimlilik dinamiklerini kontrol eden süreçler hakkındaki mevcut bilgileri artırabilir.
Giriş
Birincil verimlilik, otokton karbonun tüm sistem gıda ağını oluşturan su sistemlerine tek girişidir1. Bu nedenle, birincil verimliliğin doğru bir şekilde tahmin edilmesi, sucul ekosistemlerin işleyişini anlamaya yönelik önemli bir adımdır. Littoral bölgeler, yüksek birincil verimlilik ve biyolojik çeşitlilik alanlarıdır. Fitoplanktona ek olarak, perifitonun (bundan böyle mikrobiyal paspaslar olarak anılacaktır) ve makroalglerin, kıyı bölgelerinde birincil üretkenliğe önemli ölçüde katkıda bulunduğu varsayılmaktadır2. Sapsız yaşam tarzları ve önemli mekansal heterojenlikleri nedeniyle, birincil üretkenliğin nicelleştirilmesi önemsiz değildir.
Birincil üretkenlik esas olarak ışık yoğunluğu, sıcaklık, besin maddelerinin mevcudiyeti ve karbonat sisteminin iyonik türlerinin öfotik bölgelerin ilgili derinliklerinde dağılımı tarafından yönlendirilir 3,4. Derinlik, mikrobiyal paspasların mekansal dağılımını belirgin şekilde etkiler. Mikrobiyal topluluklar, yüksek ışınlamanın olumsuz etkileri ve sığ derinliklerde belirgin mevsimsel sıcaklık değişimleri ve daha büyük derinliklerde daha düşük ışık yoğunluğu ile başa çıkmalıdır. Derinlik gradyanına ek olarak, dinamik trofik etkileşimler farklı ölçeklerde çoklu ve karmaşık uzamsal desenler üretir5. Bu karmaşık sistemin laboratuvarda simüle edilmesi karmaşıktır. Bireysel birincil üreticilerin metabolik aktivitesini littoral bölgelerden çıkarmanın en doğru yolu, yerinde deneyler yapmaktır.
Bu yazıda tanıtılan metodoloji, geleneksel oda yöntemi 2,6,7'ye, taşınabilir ve yapımı kolay düşük maliyetli yüzer bir mavna ile birlikte dayanmaktadır. Bu, doğal ışık spektrumu, sıcaklık ve karbonat sisteminin iyonik türlerinin derinlik ile farklı dağılımı altında farklı derinliklerde birincil verimliliğin ölçülmesini sağlar. Yöntem, ilk olarak fitoplankton fotosentezini ölçmek için kullanılan ve hala yaygın olarak kullanılan 6,7 olan açık ve koyu şişe oksijeniilkesine dayanmaktadır. Işıkta tutulan şişelerdeki oksijen değişim oranını (birincil üretkenlik ve solunumun etkilerini içerir) karanlıkta tutulanlarla (yalnızca solunum)8 karşılaştırır. Yöntem, birincil üretkenlik için bir vekil olarak oksijen evrimini (fotosentez) kullanır. Ölçülen değişkenler net ekosistem üretkenliği (NEP, ışık koşullarında zaman içinde O2 konsantrasyonunda bir değişiklik olarak) ve ekosistem solunumudur (RE, karanlıkta zaman içindeO2 konsantrasyonunda bir değişiklik olarak). Brüt ekosistem verimliliği (GEP), ikisi arasındaki farkın hesaplanmasıdır (Tablo 1). Burada "ekosistem" terimi, perifitonun ototrofik ve heterotrofik organizmalardan oluştuğunu belirtmek için kullanılır. Bu geleneksel oda yönteminin en önemli gelişimi, invaziv olmayan oksijen optik sensörlerinin kullanılması ve perifitik birincil üretkenliğin ölçülmesi için bu öncelikle planktonik yöntemin optimizasyonudur.
Bu teknik, Çek Cumhuriyeti-Milada, Most ve Medar'da yeni ortaya çıkan madencilik sonrası göllerin kıyı bölgesindeki mikrobiyal paspasların ölçülmesi örneğinde açıklanmaktadır. Mikrobiyal paspasların metabolik aktivitesi, incelenen toplulukların doğal olarak meydana geldiği belirli derinliklerde doğrudan gerçekleştirilenO2 akılarının doğrudan yerinde ölçümü kullanılarak belirlenir. Heterotrofik ve fototrofik aktivite, invaziv olmayan optik oksijen sensörleri ile donatılmış kapalı cam şişelerde ölçülür. Bu sensörler, ışığa duyarlı boyaların floresansını kullanarak kısmi oksijen basıncını algılar. Mikrobiyal paspaslı şişeler askıya alınır ve uygun derinliklerde yüzen bir cihazda inkübe edilir. Şişelerin içindeki oksijen konsantrasyonu, küçük tekneden gün ışığı periyodu boyunca sürekli olarak ölçüldü.
Bozulmamış mikrobiyal paspas örnekleri toplanır ve tüplü dalgıçlar tarafından belirlenen derinliklerde gaz geçirmez inkübasyon şişelerine yerleştirilir. Her şişe, zaman içindeO2 üretkenliğini / tüketimini izleyen invaziv olmayan bir optik oksijen mikrosensörü ile donatılmıştır. Tüm ölçümler, her derinlikte beş kopya karanlık / ışık çifti halinde yapılır. Sıcaklık ve fotosentetik olarak aktif radyasyon (PHAR) yoğunlukları, inkübasyon boyunca ilgili derinliklerde ölçülür. 6 saatlik in situ inkübasyondan sonra (gündüz saatleri), mikrobiyal paspaslar şişelerden toplanır ve kurutulur. O2 akıları mikrobiyal biyokütleye normalleştirilir. Bir kontrol olarak, mikrobiyal mat biyokütlesi olmadan göl suyu içeren ayrı açık ve koyu gaz geçirmez şişelerde (boş kontroller) O2 konsantrasyonundaki değişiklikler için akışlar düzeltilir. Aşağıda, yüzen mavnayı inşa etmek ve tüm deneyi adım adım gerçekleştirmek için ayrıntılı talimatlar verilmiştir. Bu makale aynı zamanda iki derinlikte (1 m ve 2 m) mikrobiyal paspasların ölçümlerinden elde edilen temsili sonuçları ve her derinlikte beş kopya sunmaktadır. Gerçek sıcaklık ve ışık yoğunluğu, dataloggerlar kullanılarak tüm deney boyunca ölçüldü.
Protokol
NOT: Örneklemeden önce, genel proje gereksinimlerine, istatistiksel tasarıma veya beklenen örnek değişkenlik miktarına göre çoğaltmaların derecesini belirleyin. Hassas istatistiksel analiz için ve potansiyel numune kaybını veya kırılmasını hesaba katmak için beş adet açık ve koyu renkli inkübasyon şişesi çifti önerilmektedir. Tarif edilen yüzen deneysel mavna, beş kopya artı bir çift boş kontrol taşımak üzere tasarlanmıştır; deneysel mavnanın teknik çizimi için Şekil 1'e bakınız.
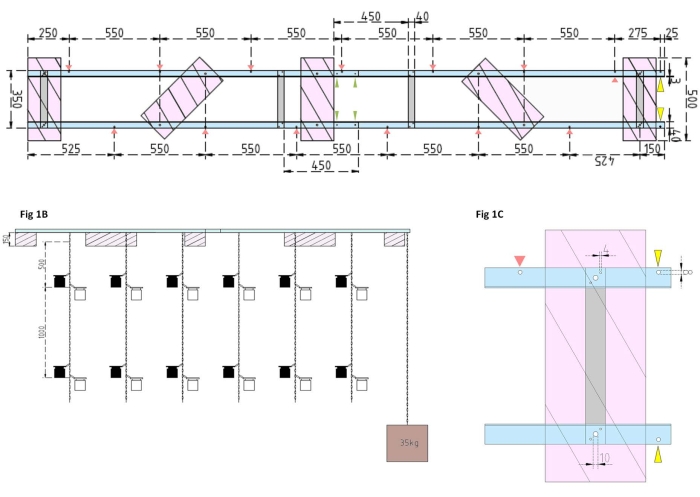
Resim 1: Deneysel mavna ve yan şamandıranın teknik çizimleri. (A) Üstten görünüm: Mavnanın çerçevesi, dört Alüminyum düz çubukla (gri) birleştirilen dört Alüminyum açılı L profil parçasından (mavi) oluşur. XPS şamandıraları (pembe), her biri paralel alüminyum parçalar üzerinde olmak üzere çerçeveye iki noktada monte edilir. Kuluçka şişeleri için zincirler, aralarında 550 mm mesafe bulunan önceden delinmiş deliklerde (kırmızı oklar) çıtçıtlı kancalar kullanılarak her iki taraftaki çerçeveye tutturulur. Zincirlere, kuluçka şişesi bağlantısı için 1 m ve 2 m mesafelerde çıtçıtlı kancalar sağlandı (deneysel derinliğe göre çıtçıtlı kancaların konumunu seçin). Beton ankraj, mavnanın pruvasına sabitlenir, burada 25 mm'lik bir çıkıntı, çapanın zinciri ve araştırma kabı için bir bağlantı noktası olarak hizmet etmek üzere önceden delinmiş iki deliğin (sarı ok uçları) kullanılmasına izin verir. Çerçeve, dört alüminyum açılı parça (yeşil ok uçları) arasındaki paralel bağlantılar aracılığıyla kolayca monte edilir veya sökülür. (B) Yan görünüm, asılı kuluçka şişeleri ve beton ankrajlı (kahverengi kare) asılı zincirleri gösterir. (C) Yan XPS şamandırası: Paralel alüminyum açılı L parçaları (mavi) dikey alüminyum düz çubuklarla (gri) birleştirilir. Enine çubuk bölümünün altında, XPS şamandıra (pembe), gerekli delik boyutları belirtilmiş (4 mm) olacak şekilde monte edilir. Asılı zincirler, 8 mm'lik deliklerde (kırmızı ok ucu) çıtçıtlı kancalarla tutturulmuştur. Mavnanın yayında, biri çapayı mavnaya (sarı ok ucu) sabitlemek için ve diğeri araştırma gemisini mavnaya (mavi) demirlemek için çıkıntılı alüminyuma iki adet 8 mm'lik delik açılır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
1. Deneysel mavnanın yapımı
NOT: Yüzer mavna, birbirine monte edilmiş iki eşit bölümden oluşur ve kolay montaj/sökme sağlar. Kullanılan tüm parçalar herhangi bir hobi pazarından veya yapı malzemeleri satan mağazadan satın alınabilir.
- İlk olarak, dört alüminyum düz çubuk (40 mm x 3 mm x 350 mm), 16 vida (altıgen somunlarla 4 mm x 15 mm) ve 32 pul (4 mm x 10 mm) kullanarak dört alüminyum açılı L profil parçasını (40 mm x 40 mm x 3 mm; uzunluk 2.000 mm) bir araya getirerek mavnanın çerçevesini monte edin .
NOT: Düz çubukların mesafesi ve konumu Şekil 1A'daki teknik resimde gösterilmiştir. Şamandıraların yan yassı çubuklara ayrıntılı bağlantısı Şekil 1B'de gösterilmiştir. - Çerçevenin iki eşit bölümünü birleştirmek için, alüminyum açılı L profillerini uçlarda birbirine vidalamak için kanat somunlu dört adet 4 mm x 15 mm vida ve sekiz adet 4 mm x 10 mm rondela kullanın (Şekil 1A, yeşil oklar).
- Beş adet ekstrüde polistiren (XPS) malzemesi (500 mm x 200 mm x 150 mm), altıgen somunlu on adet 10 mm x 170 mm vida ve beş adet ekstrüde polistiren şamandıra ( her biri 500 mm x 200 mm x 150 mm) hazırlamak için yirmi adet 10 mm x 50 mm rondela kullanın. Şamandıraları teknik çizimde gösterilen beş noktadan çerçeveye takın (Şekil 1A).
- Çerçeveye delikler açın ( Şekil 1A'daki zincirler için deliklerin konumlarını ve mesafelerini gösteren kırmızı oklara bakın). Kuluçka şişeleri için 12 m çelik zincirleri (3 mm'lik tel çapı, 5,5 mm x 26 mm'lik iç bağlantı) çelik karabin kancalar (50 mm x 5 mm) kullanarak çerçevedeki deliklere takın. Kuluçka şişelerini deneysel tasarıma göre istenen derinliğe monte etmek için her zincire çıtçıtlı kanca çiftleri (50 mm x 5 mm) sağlayın. Bu durumda, 1 m ve 2 m derinliklerde oturdular.
- Ankraj için, 15 L'lik kovayı betonla doldurun. Betona bir göz cıvatası yerleştirin ve bozulmadan kurumasını bekleyin. 5 m'lik çelik zinciri kancaya sabitleyin. Ankrajı mavnanın yayı üzerindeki önceden delinmiş deliğe sabitleyin (Şekil 1A,B'de sarı oklarla işaretlenmiştir).
NOT: Montaj tanımını içeren teknik çizimler Şekil 1A-C'de gösterilmiştir. Şekil 2, monte edilmiş deneysel mavnanın fotoğrafını göstermektedir. Şekil 3, inkübasyon şişelerinin zincire tutturulmasını göstermektedir.
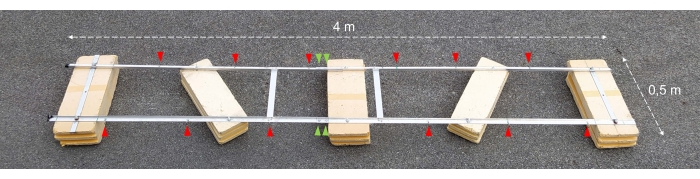
Resim 2: Birleştirilmiş deneysel mavna. Toplanan deneysel mavnanın fotoğrafı. Kırmızı ok uçları, zincirlerin kuluçka şişeleriyle tutturulması için delikleri gösterir. Yeşil ok uçları, şamandıranın iki yarısının bir araya getirildiği yeri işaret eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 3: Kuluçka şişeleri. 1 m derinlikte asılı iki çift karanlık ve hafif kuluçka şişesinin fotoğrafı. Bir çift şişe, taş üzerinde hala büyüyen bozulmamış mikrobiyal paspasların örneğini içerir (kırmızı ok ucu). İkincisi, ilgili derinlikten göl suyu içeren boş şişedir. Sarı bir ok ucu, kuluçka şişesinin iç duvarına tutturulmuş oksijen sensörü noktasına işaret eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2. Sahada kurulum
- Kolayca taşınabildiği için mavna yerleştirme ve deneyler yapmak için şişirilebilir bir kano kullanılması önerilir.
- Şamandırayı sabitlemek için ideal derinliğe sahip bir yer seçin. Derinliği, alt inkübasyon şişelerinin, kuluçka şişelerinin etrafındaki su sütununa tortuyu rahatsız etmesini önlemek için tabandan en az 2 m yukarıda olacak şekilde seçin.
- Birleştirilmiş mavnayı teknenin kıçının arkasına takın. Ankrajı teknenin yan tarafı boyunca dikkatlice indirin ve su yüzeyinin biraz altında asılı kalacak şekilde hizalayın, böylece şamandıra ankrajla birlikte gerekli derinliğe sahip noktaya kolayca çekilebilir.
- Çapayı tekneden çıkarın, dibe indirin ve mavnayı çapa zincirine sabitleyin.
- Kuluçka şişelerini mavnaya bağlamak için zincirleri sabitleyin.
3. Kuluçka şişesi hazırlama
- Gaz geçirmez contalara sahip şeffaf geniş boyunlu 0,5 L şişeleri kullanın.
NOT: Şişelerin boyutunu ayarlamak mümkündür, ancak mavnanın yüzdürülmesini daha fazla polistiren levha ile arttırmayı da unutmayın. Burada tarif edilen mavna, 24 adet 0,5 L cam şişeyi güvenilir bir şekilde taşıyabilir. - Oksijen optik sensör noktalarını her şişenin iç duvarına takın.
- Koyu renkli tedavi şişelerine siyah elektrik bandı ile sararak opak bir tabaka ekleyin.
- Optik sensör ile noktadaki küçük bir deliği kesin. Işığın şişeye girmesini önlemek için, deliği sensörün çapından biraz daha küçük yapın.
NOT: Işığın şişeye girmesini engelleyen herhangi bir opak tabaka da çalışacaktır. Siyah elektrik bandının avantajı, aşınmaya karşı dayanıklı olması ve suda soyulmamasıdır.
4. Numune toplama ve işleme
NOT: Dalgıçlar, numunelerin manuel olarak toplanmasını daha derin sularda gerçekleştirir. Sığ sularda, şnorkelle yüzerek veya bisiklete binerek yapılabilir.
- Kuluçka şişelerini portatif kutuya yerleştirin.
- Kutuyla ilgili derinliğe dalın. Çevredeki sudaki tortuyu rahatsız etmekten kaçının.
- Kuluçka şişelerini numunelerle dikkatlice doldurun. Numunenin biyokütlesini, örneğin uzun cımbız kullanarak mümkün olduğunca az rahatsız etmeye çalışın. Mikrobiyal paspaslar küçük bir taş gibi katı bir yüzeyde büyürse, tüm taşı sağlam biyokütle ile şişeye dikkatlice aktarın.
NOT: Numune alma paspasları taşların üzerinde büyürken büyük taşları toplamaktan kaçının - cam şişeler daha fazla manipülasyon sırasında kırılabilir. - Boş kontroller olarak kullanılmak üzere bir çift açık / koyu şişeyi ilgili derinliklerden temiz suyla doldurun.
NOT: Perifiton numunesi olmayan şişeler, ortam suyu organizmalarının oksijen üretimini/tüketimini belirleyen bir kontrol görevi görür. Perifitonun hesaplanan net veya brüt birincil verimliliğinin tarafsız olmasını sağlar. - Tüm kuluçka şişelerindeki suyun temiz olduğundan ve rahatsız edici tortu içermediğinden emin olun.
- Şişeleri kapatın ve yüzen mavnaya demirli tekneye getirin.
5. Birincil üretkenliğin ölçülmesi
NOT: Teknede oturan kişi kutuyu dalgıçtan alır ve aşağıdaki adımları uygular.
- İlk iki çift inkübasyon şişesini ilk zincirdeki çıtçıtlı kancalara takın.
- Fiber optik oksijen ölçeri kullanarak her şişedeki ilk oksijen konsantrasyonunu ölçün. Ölçüm cihazının optik kablosunu şişenin içine monte edilmiş oksijen sensörüne takın ve hemen (birkaç saniye içinde)O2 konsantrasyonunu temassız (şişe duvarından geçirin) okuyun. Ölçülen değeri kaydedin.
NOT: Kullanım süresi kısadır; şişeleri dalgıçlardan ilk ayara ve ilgili derinliğe götürmekten, sadece birkaç dakika sürer. - Hemen sonra, bağlı şişelerle zinciri dikkatlice suya indirin. Kuluçka şişelerinin, içine yerleştirilen biyokütlenin örneklendiği derinlikte yerleştirildiğinden emin olun.
- 1 saat sonra gemiden başka bir ölçüm yapın (aşağıdaki NOTA bakın). Şişeleri olan her zinciri dikkatlice tekneye çekin, optik kabloyu sensöre takarak oksijen değerini okuyun ve numuneleri tekrar suya indirin.
NOT: Şişelerin aşırı doygunluğunu önlemek için inkübasyon sırasında bireysel ölçümler arasındaki süreyi, numunelerinO2 üretkenliğinin/tüketiminin yoğunluğuna göre ayarlayın. - Bu prosedürü tüm şişe çiftleriyle en az dört veya beş kez tekrarlayın.
NOT: Alandaki deneyin tüm kurulumu Şekil 4'te gösterilmiştir.
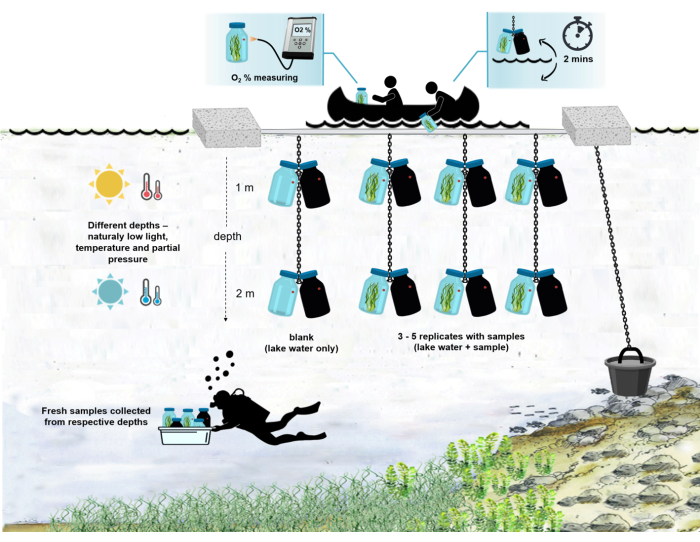
Şekil 4: Alandaki deney düzeneğinin şeması. Göl yüzeyindeki demirli deneysel mavnanın illüstrasyonu. Mikrobiyal mat biyokütleli kuluçka şişeleri (0,5 L) iki farklı derinliğe (1 m ve 2 m) asılır. Dalgıçlar, mikrobiyal paspas örneklerini doğrudan inkübasyon şişelerine uygun derinliklerde topladılar. Tek tek şişelerdeki oksijen konsantrasyonu gemiden ölçülür. Şişeler sudan çıkarılır. Oksijen konsantrasyon değeri, oksijen sensörüne optik bir kablo takılarak birkaç saniye içinde ölçülür. Şişeler daha sonra dikkatlice suya indirilir. İki çift inkübasyon şişesini iki derinlikten ölçme prosedürünün tamamı ~ 2 dakika sürer. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
6. Numune analizleri
- Ölçümlerin bitiminden sonra, numuneleri doğrudan şişelerden alın ve mikrobiyal paspasın biyokütlesini küçük plastik şişelere aktarın. Paspaslar katı yüzeylerde (örneğin taşlar) büyürse, bunları bir diş fırçası veya küçük bir bıçakla ovalayın.
- Laboratuvarda, kuru ağırlığı belirlemek için her bir replikayı önceden tartılmış cam elyaf filtrelerden filtreleyin9.
7. Veri analizleri
- Kuluçka döneminde, açık ve koyu renkli şişelerdeki oksijen konsantrasyonunu ölçün ve şişeler doldurulduğunda su sütunundaki oksijen konsantrasyonu ile karşılaştırın.
NOT: Işık şişesindeki oksijenin zaman içindeki değişimi, brüt ekosistem üretkenliğinin (GEP) ve şişedeki tüm organizmaların (ortam suyundan ve perifitik topluluktan ototroflar ve heterotroflar) solunumun birleşik sonucudur. Karanlık şişedeki oksijendeki azalma, hem ototrofların hem de heterotrofların solunum kayıplarını ölçer. Kontroldeki oksijen konsantrasyonundaki değişim (yani, perifitonsuz şişeler) sadece ortam suyundaki heterotrofik veya ototrofik organizmaların ürünüdür. Perifiton verimliliği ve solunum, boş inkübasyon şişelerinde ölçülen ortam suyu verimliliği ve solunumu çıkarılarak tahmin edildi. - Yüzde oksijen doygunluğundakiO2 konsantrasyonuna dikkat edin (yani, oksijen sensörlerini% 0 ve% 100 oksijen doygunluğuna kalibre edin). Birincil üretkenliği tahmin etmeden önce, ham verileri (
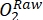 ) makul bir birime dönüştürün.
) makul bir birime dönüştürün.
NOT: Bu çalışmada, Benson ve Krause10'a göre, veriler kuru ağırlık bazında perifiton kütlesinin gramı organik madde (OM) başınaO2 mmol'e dönüştürülmüştür.- Denklemi kullanarak dönüşümü hesaplayın (1):
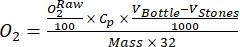 (1)
(1)
C p, O2 tarafından tamamen doyurulduğunda sudakiO2 konsantrasyonudur (mg (O2) L-1), V Şişe, mL'deki şişenin hacmidir, VTaşları, mL'deki taşın kapladığı hacimdir, perifiton kütlesinin g cinsinden ağırlığıdır ve 32,O2'nin molar ağırlığıdır. - C p'yi denklem (2) kullanarak hesaplayın:
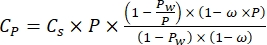 (2)
(2)
Cs standartO2 konsantrasyonu, P göl yüzeyindeki atmosferik basınç, Pw göl yüzeyindeki su buharının kısmi basıncı ve ω su yoğunluğudur. - Cs, ω, P ve Pw'yi, göl yüksekliği (km cinsinden h) ve göl yüzeyindeki su sıcaklığı (°C cinsinden t) bilindiğinde, daha önce tanımlanmış ampirik denklemlerden (3-6) hesaplayın:
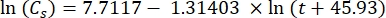 (3)
(3)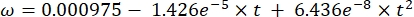 (4)
(4)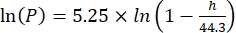 (5)
(5)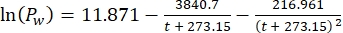 (6)
(6)
NOT: Denklemlerden (1-6), hesaplananO2 konsantrasyonunun sığ derinlikler için en doğru olduğu açıktır. Derinlik arttıkça, hesaplanan konsantrasyon mutlak konsantrasyon açısından daha önyargılı hale gelir. Derinlik boyunca oksijen konsantrasyonunun değişim hızı her göl için bilindiğinde en uygunudur, böylece gerekirse mutlakO2 konsantrasyonu düzeltilebilir. O2 konsantrasyonu hesaplandıktan sonra, zaman içindeki değişimi, iki farklı koşulda iki farklıO2 akışını hesaplamak için kullanılabilir. Işık koşulları altında, net ekosistem verimliliği (NEP), zaman içindeO2 konsantrasyonundaki değişimle doğru orantılıdır (aşağıya bakınız). Burada "ekosistem" terimi, perifitonun ototrofik ve heterotrofik organizmalardan oluştuğunu belirtmek için kullanılır. Karanlıkta, zaman içindeO2 konsantrasyonundaki değişim, ototrofik ve heterotrofik organizmaların solunum kayıplarının toplamı ile orantılıdır, böylece ekosistem solunumunu (RE) tanımlar. NEP ve RE arasındaki fark, brüt ekosistem verimliliğini (GEP) tanımlar. Toplumun heterotrofik kısmının solunum kayıpları ihmal edilebilir düzeydeyse, GEP brüt ekosistem verimliliğine eşit hale gelir.
- Denklemi kullanarak dönüşümü hesaplayın (1):
- Denklemde (7) gösterildiği gibi, üçüncü derece polinom regresyonu ileO2 konsantrasyonunun zaman içindeki değişim oranını belirleyin.
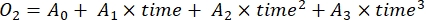 (7)
(7)
Burada A 0, sıfır zamanındaO2 konsantrasyonudur ve A 1-A2, polinom regresyonunun katsayılarıdır.
NOT: Polinom fonksiyonu, herhangi bir diferansiyel denklemin bir yaklaşımı olarak hizmet edebileceği için kullanılır. Bu nedenle,O2 konsantrasyonu ve zaman arasındaki doğru fonksiyonel ilişkiyi bilmek gerekli değildir. Bu nedenle, işlevsel ilişkiyle ilişkili herhangi bir varsayımın (örneğin, doğrusallık) kontrol edilmesi gerekmez. Tanım olarak, polinom regresyonunun ikinci terimi olan A 1, A0'dan ve dolayısıyla sıfır zamanındaki mutlak O2 konsantrasyonundan bağımsız olan sıfır zamanındakiO2 konsantrasyonunun değişim oranını (yani, anlık hız) tanımlar. Bu nedenle, O2 akısının tahmini, derinlik gradyanı boyunca basınç değişiminin neden olduğu mutlakO2 konsantrasyon hesaplamalarındaki önyargıdan etkilenmez. A 1, zaman başına (bu çalışmada 1 saat)O2 (mmol g (OM)-1) birimlerine sahiptir.- Işığa maruz kalan ve olmayan ve mikrobiyal mat biyokütlesi içeren şişeler (yani, V Taşları > 0) ve ışığa maruz kalan ve olmayan ve serbest su içeren kontrol şişeleri (yani, VTaşları = 0) için ayrı ayrı hesaplanan A 1'i hesaplayın.
NOT: Bu farklı regresyon katsayıları gösterimleri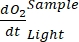 atanan , , ,
atanan , , , 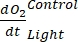 ve
ve 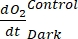 ,
, 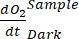 verimlilik GEP hesaplaması için denklem (8) şu şekilde yazılabilir:
verimlilik GEP hesaplaması için denklem (8) şu şekilde yazılabilir: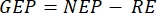 (8.1)
(8.1)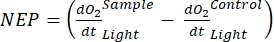 (8.2)
(8.2)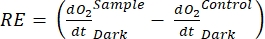 (8.3)
(8.3)
Terim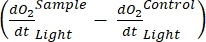 net ekosistem verimliliğini tanımlar (Şekil 5A; yani net oksijen verimliliği) ve terim
net ekosistem verimliliğini tanımlar (Şekil 5A; yani net oksijen verimliliği) ve terim 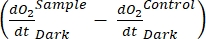 ototrofik ve heterotrofik solunumun toplamını temsil eder (Şekil 5B; RE, yani her iki solunumun da karanlık ve aydınlık koşullar altında benzer olduğunu varsayarsak).
ototrofik ve heterotrofik solunumun toplamını temsil eder (Şekil 5B; RE, yani her iki solunumun da karanlık ve aydınlık koşullar altında benzer olduğunu varsayarsak). - GEP'yi elde etmek için NEP'den R'yi çıkarın (Şekil 5C).
NOT: Denklem (8) dolaylı olarak hem pozitif hem de negatif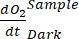
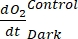 olduğunu
olduğunu 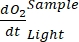
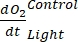 varsayar. Pozitifse
varsayar. Pozitifse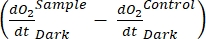 , ham verileri aykırı değerler için dikkatlice kontrol edin . teorik olarak negatif olabilir, çünkü heterotrofik aktivitenin neden olduğu solunum kayıpları fotosentetik aktiviteden daha yüksek olabilir.
, ham verileri aykırı değerler için dikkatlice kontrol edin . teorik olarak negatif olabilir, çünkü heterotrofik aktivitenin neden olduğu solunum kayıpları fotosentetik aktiviteden daha yüksek olabilir. 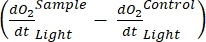
- Işığa maruz kalan ve olmayan ve mikrobiyal mat biyokütlesi içeren şişeler (yani, V Taşları > 0) ve ışığa maruz kalan ve olmayan ve serbest su içeren kontrol şişeleri (yani, VTaşları = 0) için ayrı ayrı hesaplanan A 1'i hesaplayın.
Sonuçlar
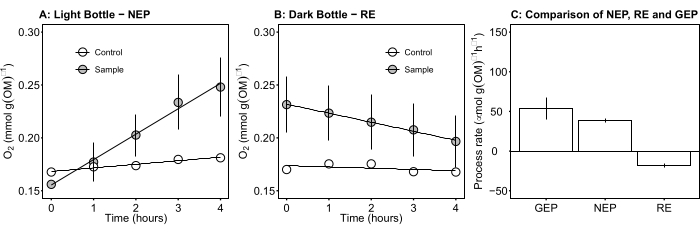
Şekil 5: Gün ışığında mikrobiyal paspasların net ve brüt ekosistem verimliliği. (A) Işık şişesi-net ekosistem verimliliği: Işık şişelerinden mikrobiyal paspasların net oksijen verimliliğinin zaman çizelgesi verileri. Kuluçka şişelerindeki oksijen konsantrasyonu değişimi, gün ışığında 1 saat sonra ölçüldü. Gri dai...
Tartışmalar
Bu makalede açıklanan metodoloji, optik oksijen sensörleri kullanılarakO2 konsantrasyonunu ölçmenin noninvaziv tekniği ile birlikte açık ve koyu şişe oksijen tekniğinin prensibine dayanmaktadır. Bu sistem,O2'yi ölçmek için optik fiber şişeden şişeye hızlı bir şekilde taşınabildiğinden, farklı inkübasyon ayarlarının paralel olarak ölçülmesini sağlar. Çeşitli derinliklerden gelen bentik topluluklar taksonomik kompozisyon ve üretkenlikte farklılık gösterebilir; a...
Açıklamalar
Yazarlar, açıklayacak çıkar çatışmaları olmadığını doğrulamaktadır.
Teşekkürler
Bu çalışma, Çek Bilim Vakfı (GACR 19-05791S), RVO 67985939 ve CAS tarafından Strateji AV 21, Arazi tasarrufu ve kurtarma programı kapsamında desteklenmiştir. Ondřej Sihelský'ye sahada çekim yaptığı için çok teşekkürler - o olmasaydı, çekimler tam bir cehennem olurdu. Proje, incelenen bölgelere erişim sağlayan Palivový Kombinát Ústí s.p. ve Sokolovská Uhelná şirketleriyle sıkı işbirliği olmadan mümkün olmazdı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Aluminum angle L profile 40 x 40 mm x 3 mm, length 2,000 mm | |||
| Aluminum flat bar 40 x 3 x 350 mm | |||
| Bucket 15 L with concrete infill | |||
| Carabine hook with screw lock 50 x 5 mm | |||
| electric tape black | |||
| Extruded polystyrene (XPS) material 500 x 200 x 150 mm | |||
| Fibox 3 LCD trace | PreSens Precision Sensing GmbH | stand-alone fiber optic oxygen meter | |
| Hondex PS-7 Portable Depth Sounder | Hondex - Honda Electronics | to measures distances through water - to bottom depth measurement; https://www.honda-el.net/industry/ps-7e | |
| KORKEN - glass tight-seal jar 0.5 L | IKEA | incubation bottles; https://www.ikea.com/cz/en/p/korken-jar-with-lid-clear-glass-70213545/ | |
| metal hook | |||
| Oxygen Sensor Spot SP-PSt3-NAU-D5 | PreSens Precision Sensing GmbH | non-invasive optical oxygen sensor for measurements under Real Conditions | |
| SCOUT infantable canoe | GUMOTEX | https://www.gumotexboats.com/en/scout-standard#0000-044667-021-13/11C | |
| Screw 10 x 170 mm with hexagonal nuts | |||
| Screw 4 x 15 mm with hexagonal nuts | |||
| Screw 4 x 15 mm with wing nuts | |||
| Snap hooks 50 x 5 mm | |||
| Steel Carabine hook 50 x 5 mm | |||
| Steel chain with wire diameter 3 mm, inside link 5.5 x 26 mm | |||
| Steel chain, 5 m | |||
| toothbrush | |||
| tweezer | |||
| Washer 10 x 50 mm | |||
| Washer 4 x 10 mm | |||
| Washer 4 x 10 mm |
Referanslar
- Blachart, J. L., et al. Potential consequences of climate change for primary production and fish production in large marine ecosystems. Philosophical Transactions of the Royal Society B: Biological Sciences. 367 (1605), 2979-2989 (2012).
- Howarth, R. W., Michaels, A. F., Sala, O. E., Jackson, R. B., Mooney, H. A., Howarth, R. W. The Measurement of primary production in aquatic ecosystems. Methods in Ecosystem Science. , 72-85 (2000).
- Vadenbecouer, Y. E. G., Peterson, M. J., Vander, Z., Kalff, J. Benthic algal production across lake size gradients: Interactions among morphometry, nutrients, and light. Ecology. 89 (9), 2542-2552 (2008).
- Reimer, A., Landmann, G., Kempe, S. Lake Van, eastern Anatolia, hydrochemistry and history. Aquatic Geochemistry. 15 (1), 195-222 (2009).
- Cantonati, M., Lowe, R. L. Lake benthic algae: toward an understanding of their ecology. Freshwater Sciences. 33 (2), 475-486 (2014).
- Gaarder, T., Gran, H. H. Investigation of the production of plankton in the Oslo Fjord. Rapports et Proces-verbaux des Réunions. Conseil International pour l'Éxploration de la Mer. 42, 1-48 (1927).
- Hall, R. O., Thomas, S., Gaiser, E. E., Fahey, T. J., Knapp, A. K. Measuring Freshwater Primary Productivity and Respiration. Principles and Standards for Measuring Primary Productivity. , (2007).
- Howart, R., Michaels, A. Chapter 6 The Measurement of Primary Production in Aquatic Ecosystems. Springer Science and Business Media LLC. , (2000).
- Kopáček, J., Hejzlar, J. Semi-micro determination of total phosphorus in soils, sediments, and organic materials: a simplified perchloric acid digestion procedure. Communications in Soil Science and Plant Analysis. 26 (11-12), 1935-1946 (1995).
- Benson, B. B., Krause, D. The concentration and isotopic fractionation of oxygen dissolved in freshwater and seawater in equilibrium with the atmosphere1. Limnology and Oceanography. 29 (3), 620-632 (1984).
- Dodds, W. K., Biggs, B. J., Lowe, R. L. Photosynthesis-irradiance patterns in benthic microalgae: variations as a function of assemblage thickness and community structure. Journal of Phycology. 35 (1), 42-53 (1999).
- Bott, T. L., et al. An evaluation of techniques for measuring periphyton metabolism in chambers. Canadian Journal of Fisheries and Aquatic Sciences. 54 (3), 715-725 (1997).
- Blankenship, R. E. Structural and functional dynamics of photosynthetic antenna complexes. Proceedings of the National Academy of Sciences. 112 (45), 13751-13752 (2015).
- Hawes, I., Schwartz, A. -. M. Photosynthesis in an extreme shade environment, benthic microbial mats from Lake Hoare, a permanently ice-covered Antarctic lake. Journal of Phycology. 35 (3), 448-459 (1999).
- Aristegui, J., et al. Planktonic primary production and microbial respiration measured by 14C assimilation and dissolved oxygen changes in coastal waters of the Antarctic peninsula during austral summer: Implications for carbon flux studies. Marine Ecology-Progress Series. 132, 191-201 (1996).
- Steemann-Nielsen, C. The use of radioactive carbon (14C) for measuring organic production in the sea. Journal of Experimental Marine Biology and Ecology. 18 (2), 117-140 (1952).
- Sanz-Martín, M., et al. Relationship between carbon-and oxygen-based primary productivity in the Arctic Ocean, svalbard archipelago. Frontiers in Marine Science. 6, 468 (2019).
- Nielsen, E. S. Measurement of the production of organic matter in the sea by means of carbon-14. Nature. 167 (4252), 684-685 (1951).
- Jönsson, B. A 14C-incubation technique for measuring microphytobenthic primary productivity in intact sediment cores. Limnology and Oceanography. 36 (7), 1485-1492 (1991).
- Bender, M. L., et al. A comparison of four methods for determining planktonic community production. Limnology and Oceanography. 32 (5), 1085-1098 (1987).
- Šimek, K., et al. Spatio-temporal patterns of bacterioplankton productivity and community composition related to phytoplankton composition and protistan bacterivory in a dam reservoir. Aquatic Microbial Ecology. 51 (3), 249-262 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır