Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine kostengünstige Methode zur Messung der In-situ-Primärproduktivität von Periphytongemeinschaften linsenförmiger Wässer
In diesem Artikel
Zusammenfassung
Hier wird eine kostengünstige und transportable Methode/Einrichtung zur Messung der Primärproduktivität mikrobieller Matten unter tatsächlichen in situ Umgebungstemperatur- und Lichtbedingungen vorgestellt. Der Versuchsaufbau basiert auf weit verbreiteten Materialien und kann unter verschiedenen Bedingungen eingesetzt werden, während er die Vorteile von Labormodellen bietet.
Zusammenfassung
Die Messung der in situ Primärproduktivität von Periphyton während des Vegetationsperiodengradienten kann den quantitativen Effekt von Umwelttreibern (hauptsächlich Phosphorkonzentration und Lichtintensität) und Artenzusammensetzung auf die Primärproduktivität aufklären. Die Primärproduktivität wird hauptsächlich durch Lichtintensität, Temperatur, Verfügbarkeit von Nährstoffen und Verteilung der ionischen Spezies des Karbonatsystems in den jeweiligen Tiefen der euphotischen Zone bestimmt. Es ist ein komplexes System, das im Labor sehr schwer zu simulieren ist. Dieser billige, transportable und einfach zu bauende schwimmende Lastkahn ermöglicht die genaue Messung der Primärproduktivität direkt unter den tatsächlichen natürlichen Bedingungen. Die Methodik basiert auf der Messung der Primärproduktivität in Echtzeit mit nicht-invasiven Sauerstoffsensoren, die in dicht verschlossenen Gläsern integriert sind, was eine Online-Überwachung des Sauerstoffflusses ermöglicht und neue Einblicke in metabolische Aktivitäten liefert. Detaillierte saisonale in situ Messungen der Bruttoprimärproduktivität von mikrobiellen Matten (oder anderen benthischen Organismen) können das aktuelle Wissen über die Prozesse verbessern, die die Dynamik der Primärproduktivität in lentischen Gewässern steuern.
Einleitung
Die Primärproduktivität ist der einzige Eintrag von autochthonem Kohlenstoff in die aquatischen Systeme, die das gesamte Nahrungsnetz1 bilden. Daher ist die genaue Schätzung der Primärproduktivität ein wesentlicher Schritt zum Verständnis der Funktionsweise aquatischer Ökosysteme. Küstenzonen sind Gebiete mit hoher Primärproduktivität und biologischer Vielfalt. Neben Phytoplankton wird angenommen, dass Periphyton (im Folgenden mikrobielle Matten genannt) und Makroalgen signifikant zur Primärproduktivität in den Küstenzonenbeitragen 2. Aufgrund ihrer sessilen Lebensweise und signifikanten räumlichen Heterogenität ist die Quantifizierung der Primärproduktivität nicht trivial.
Die Primärproduktivität wird hauptsächlich durch Lichtintensität, Temperatur, Verfügbarkeit von Nährstoffen und Verteilung der ionischen Spezies des Karbonatsystems in den jeweiligen Tiefen der euphotischen Zonenbestimmt 3,4. Die Tiefe beeinflusst deutlich die räumliche Verteilung der mikrobiellen Matten. Mikrobielle Gemeinschaften müssen mit den negativen Auswirkungen hoher Einstrahlung und ausgeprägter saisonaler Temperaturschwankungen in geringer Tiefe und mit geringerer Lichtintensität in größeren Tiefen zurechtkommen. Zusätzlich zum Tiefengradienten erzeugen dynamische trophische Interaktionen multiple und komplexe räumliche Muster auf verschiedenen Skalen5. Dieses komplexe System lässt sich kompliziert im Labor simulieren. Der genaueste Weg, um die metabolische Aktivität einzelner Primärproduzenten aus Küstenzonen abzuleiten, ist der Aufbau von In-situ-Experimenten.
Die in diesem Papier vorgestellte Methodik basiert auf der traditionellen Kammermethode 2,6,7 zusammen mit einem transportablen und einfach zu bauenden kostengünstigen schwimmenden Lastkahn. Dies ermöglicht die Messung der Primärproduktivität in verschiedenen Tiefen unter dem natürlichen Lichtspektrum, der Temperatur und der unterschiedlichen Verteilung der ionischen Spezies des Karbonatsystems mit der Tiefe. Die Methode basiert auf dem Prinzip des hellen versus dunklen Flaschensauerstoffs, der zuerst zur Messung der Phytoplankton-Photosyntheseeingesetzt wurde 6 und immer noch häufig verwendetwird 6,7. Es vergleicht die Änderungsrate des Sauerstoffs in Flaschen, die im Licht aufbewahrt werden (einschließlich der Auswirkungen der Primärproduktivität und Atmung), mit denen, die im Dunkeln gehalten werden (nur Atmung)8. Die Methode verwendet die Sauerstoffevolution (Photosynthese) als Proxy für die Primärproduktivität. Die gemessenen Größen sind die Netto-Ökosystemproduktivität (NEP, als Änderung der O2-Konzentration im Laufe der Zeit bei Lichtverhältnissen) und die Ökosystematmung (RE, als Änderung derO2-Konzentration über die Zeit im Dunkeln). Die Bruttoökosystemproduktivität (GEP) ist die Berechnung der Differenz zwischen den beiden (Tabelle 1). Der Begriff "Ökosystem" wird hier verwendet, um zu bezeichnen, dass das Periphyton aus autotrophen und heterotrophen Organismen besteht. Die bedeutendste Verbesserung dieser traditionellen Kammermethode ist die Verwendung nichtinvasiver optischer Sauerstoffsensoren und die Optimierung dieser primär planktonischen Methode zur Messung der periphytischen Primärproduktivität.
Die Technik wird am Beispiel der Messung mikrobieller Matten in der Küstenzone neu entstandener Bergbaufolgeseen in der Tschechischen Republik - Milada, Most und Medar - beschrieben. Die metabolische Aktivität mikrobieller Matten wird durch direkte in situ Messung vonO2-Flüssen bestimmt, die direkt in bestimmten Tiefen durchgeführt wird, wo die untersuchten Gemeinschaften natürlich vorkommen. Die heterotrophe und phototrophe Aktivität wird in geschlossenen Glasflaschen gemessen, die mit nichtinvasiven optischen Sauerstoffsensoren ausgestattet sind. Diese Sensoren erfassen den Sauerstoffpartialdruck anhand der Fluoreszenz lichtempfindlicher Farbstoffe. Die Flaschen mit mikrobiellen Matten werden aufgehängt und auf einer schwimmenden Vorrichtung in den entsprechenden Tiefen inkubiert. Die Sauerstoffkonzentration in den Flaschen wurde während der Tageslichtperiode kontinuierlich von dem kleinen Boot aus gemessen.
Proben intakter mikrobieller Matten werden gesammelt und von Tauchern in gasdichte Inkubationsflaschen in bestimmten Tiefen gelegt. Jede Flasche ist mit einem nicht-invasiven optischen Sauerstoff-Mikrosensor ausgestattet, der die Produktivität/den Verbrauch von O2 im Laufe der Zeit überwacht. Alle Messungen werden in fünf nachgebildeten Dunkel-Hell-Paaren in jeder Tiefe durchgeführt. Die Temperaturintensitäten und die Intensitäten der photosynthetisch aktiven Strahlung (PHAR) werden während der gesamten Inkubation in entsprechenden Tiefen gemessen. Nach 6 h In-situ-Inkubation (Tageslichtstunden) werden die mikrobiellen Matten aus den Flaschen geerntet und getrocknet. O2-Flüsse werden zu mikrobieller Biomasse normalisiert. Als Kontrolle werden die Flussmittel um Änderungen der O2-Konzentration in getrennten hellen und dunklen gasdichten Flaschen (Blindkontrollen) korrigiert, die Seewasser ohne mikrobielle Mattenbiomasse enthalten. Im Folgenden finden Sie detaillierte Anweisungen zum Bau des schwimmenden Lastkahns und zur Durchführung des gesamten Experiments Schritt für Schritt. Diese Arbeit präsentiert auch repräsentative Ergebnisse aus den Messungen von mikrobiellen Matten in zwei Tiefen (1 m und 2 m) mit fünf Replikaten in jeder Tiefe. Die tatsächliche Temperatur und Lichtintensität wurden während des gesamten Experiments mit Datenloggern gemessen.
Protokoll
HINWEIS: Bestimmen Sie vor der Stichprobe den Grad der Replikationen basierend auf den allgemeinen Projektanforderungen, dem statistischen Design oder der erwarteten Menge an Stichprobenvariabilität. Fünf Replikatpaare von hellen und dunklen Inkubationsflaschen werden für eine präzise statistische Analyse und zur Berücksichtigung potenzieller Probenverluste oder -brüche vorgeschlagen. Die beschriebene schwimmende Versuchsbarge ist für fünf Replikate plus ein Paar Blankokontrollen ausgelegt; siehe Abbildung 1 für eine technische Zeichnung des Versuchskahns.
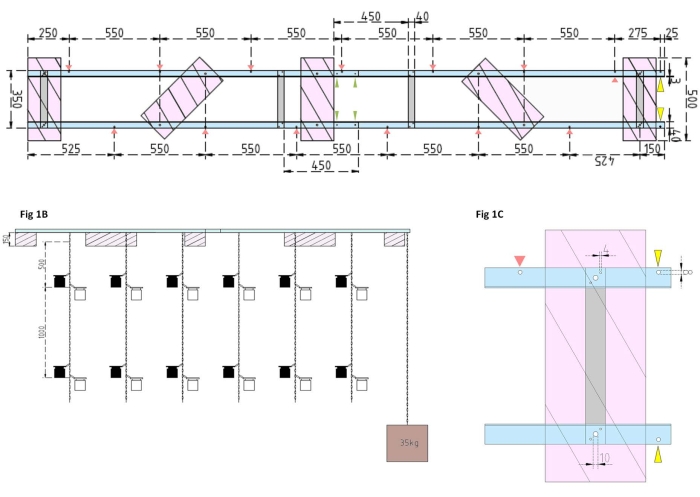
Abbildung 1: Technische Zeichnungen des Versuchskahns und des Seitenschwimmers. (A) Draufsicht: Der Rahmen des Lastkahns besteht aus vier Aluminiumwinkel-L-Profilteilen (blau), die durch vier Aluminium-Flachstangen (grau) miteinander verbunden sind. XPS-Schwimmer (rosa) sind an zwei Punkten am Rahmen montiert, jeweils auf den parallelen Aluminiumteilen. Ketten für Inkubationsflaschen werden beidseitig mit Karabinerhaken in vorgebohrten Löchern (rote Pfeile) mit einem Abstand von 550 mm am Rahmen befestigt. Die Ketten wurden mit Karabinerhaken in 1 m und 2 m Entfernung für die Befestigung der Inkubationsflasche versehen (wählen Sie die Position der Karabinerhaken entsprechend der experimentellen Tiefe). Der Betonanker ist am Bug des Lastkahns befestigt, wo ein Überhang von 25 mm zwei vorgebohrte Löcher (gelbe Pfeilspitzen) ermöglicht, die als Befestigungspunkt für die Ankerkette und das Forschungsschiff dienen. Über die parallelen Verbindungen zwischen den vier Aluminium-Winkelstücken (grüne Pfeilspitzen) lässt sich der Rahmen einfach auf- oder abbauen. (B) Die Seitenansicht zeigt die hängenden Ketten mit hängenden Inkubationsflaschen und Betonanker (braunes Quadrat). (C) Der seitliche XPS-Schwimmer: Parallelaluminium-Winkel-L-Teile (blau) werden durch vertikale Aluminium-Flachstäbe (grau) verbunden. Unterhalb des Querbalkenabschnitts wird der XPS-Schwimmer (rosa) mit den erforderlichen Lochgrößen (4 mm) montiert. Die aufgehängten Ketten werden mit Karabinerhaken in 8 mm Löchern (rote Pfeilspitze) befestigt. Am Bug des Lastkahns werden zwei 8 mm große Löcher in das überhängende Aluminium gebohrt, eines zur Sicherung des Ankers am Lastkahn (gelbe Pfeilspitze) und ein weiteres zum Festmachen des Forschungsschiffes am Lastkahn (blau). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
1. Bau des Versuchskahns
HINWEIS: Die schwimmende Barge besteht aus zwei gleichen Abschnitten, die zusammen montiert sind, was eine einfache Montage / Demontage ermöglicht. Alle gebrauchten Teile können auf jedem Hobbymarkt oder Baustoffgeschäft erworben werden.
- Setzen Sie zunächst den Rahmen des Lastkahns zusammen , indem Sie vier Aluminiumwinkel-L-Profilstücke (40 mm x 40 mm x 3 mm; Länge 2.000 mm) mit vier Aluminium-Flachstangen (40 mm x 3 mm x 350 mm), 16 Schrauben (4 mm x 15 mm mit Sechskantmuttern) und 32 Unterlegscheiben (4 mm x 10 mm) zusammenfügen.
HINWEIS: Der Abstand und die Position der flachen Stäbe sind in der technischen Zeichnung in Abbildung 1A dargestellt. Die detaillierte Befestigung der Schwimmer an den seitlichen Flachstangen ist in Abbildung 1B dargestellt. - Um die beiden gleichen Teile des Rahmens zu verbinden, verwenden Sie vier 4 mm x 15 mm Schrauben mit Flügelmuttern und acht 4 mm x 10 mm Unterlegscheiben, um die Aluminiumwinkel-L-Profile an den Enden zusammenzuschrauben (Abbildung 1A, grüne Pfeile).
- Verwenden Sie fünf Stück extrudiertes Polystyrol (XPS) (500 mm x 200 mm x 150 mm), zehn 10 mm x 170 mm Schrauben mit Sechskantmuttern und zwanzig 10 mm x 50 mm Unterlegscheiben, um fünf extrudierte Polystyrolschwimmer (jeweils 500 mm x 200 mm x 150 mm) herzustellen. Befestigen Sie die Gleitkommakörper an fünf in der technischen Zeichnung gezeigten Punkten am Rahmen (Abbildung 1A).
- Bohren Sie Löcher in den Rahmen (siehe rote Pfeile in Abbildung 1A, die die Positionen und Abstände der Löcher für die Ketten markieren). Befestigen Sie die 12 m langen Stahlketten (Drahtdurchmesser 3 mm, Innenglied 5,5 mm x 26 mm) für die Inkubationsflaschen mit Stahlkarabinakhaken (50 mm x 5 mm) an den Löchern im Rahmen. Versehen Sie jede Kette mit Karabinerhaken (50 mm x 5 mm), um die Inkubationsflaschen entsprechend dem Versuchsdesign in die gewünschte Tiefe zu bringen. In diesem Fall saßen sie in 1 m und 2 m Tiefe.
- Für den Anker füllen Sie den 15 L Eimer mit Beton. Stecken Sie eine Ringschraube in den Beton und lassen Sie ihn ungestört trocknen. Befestigen Sie die 5 m lange Stahlkette am Haken. Befestigen Sie den Anker am vorgebohrten Loch am Bug des Lastkahns (in Abbildung 1A,B durch gelbe Pfeile gekennzeichnet).
HINWEIS: Technische Zeichnungen mit der Montagebeschreibung sind in Abbildung 1A-C dargestellt. Abbildung 2 zeigt das Foto des zusammengebauten Versuchskahns. Abbildung 3 zeigt die Befestigung der Inkubationsflaschen an der Kette.
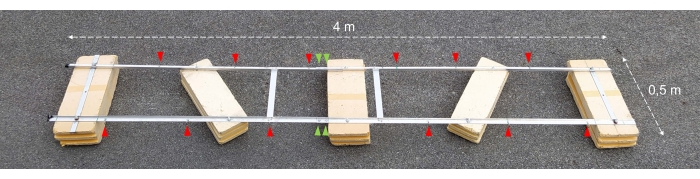
Abbildung 2: Zusammengebauter Versuchskahn. Foto des zusammengebauten Versuchskahns. Rote Pfeilspitzen zeigen die Löcher für die Befestigung von Ketten mit Inkubationsflaschen. Die grünen Pfeilspitzen zeigen dorthin, wo die beiden Hälften des Schwimmers miteinander verbunden sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Inkubationsflaschen. Foto von zwei Paaren dunkler und heller Inkubationsflaschen, die in einer Tiefe von 1 m hängen. Ein Flaschenpaar enthält die Probe intakter mikrobieller Matten, die noch auf dem Stein wachsen (rote Pfeilspitze). Die zweite ist die leere Flasche mit dem Seewasser aus der jeweiligen Tiefe. Eine gelbe Pfeilspitze zeigt auf den Sauerstoffsensor-Spot, der an der Innenwand der Inkubationsflasche angebracht ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. Installation im Feld
- Die Verwendung eines aufblasbaren Kajaks wird für die Platzierung von Lastkähnen und die Durchführung von Experimenten empfohlen, da es leicht zu transportieren ist.
- Wählen Sie einen Ort mit einer idealen Tiefe, um den Schwimmer zu verankern. Wählen Sie die Tiefe so, dass sich die unteren Inkubationsflaschen mindestens 2 m über dem Boden befinden, um das Sediment in der Wassersäule um die Inkubationsflaschen herum nicht zu stören.
- Befestigen Sie den zusammengebauten Lastkahn hinter dem Heck des Bootes. Senken Sie den Anker vorsichtig an der Seite des Bootes und richten Sie ihn so aus, dass er leicht unter der Wasseroberfläche hängt, so dass der Schwimmer leicht zusammen mit dem Anker an die Stelle mit der erforderlichen Tiefe gezogen werden kann.
- Lösen Sie den Anker vom Boot, senken Sie ihn auf den Boden und befestigen Sie den Lastkahn an der Ankerkette.
- Sichern Sie die Ketten zur Befestigung der Inkubationsflaschen am Lastkahn.
3. Vorbereitung der Inkubationsflasche
- Verwenden Sie die transparenten 0,5-L-Flaschen mit breitem Hals und gasdichten Verschlüssen.
HINWEIS: Es ist möglich, die Größe der Flaschen anzupassen, aber denken Sie daran, die Fließfähigkeit des Lastkahns auch mit mehr Styroporplatten zu erhöhen. Die hier beschriebene Barge kann zuverlässig 24 0,5 L Glasflaschen transportieren. - Befestigen Sie die optischen Sauerstoffsensorspots an der Innenwand jeder Flasche.
- Fügen Sie den dunklen Behandlungsflaschen eine undurchsichtige Schicht hinzu, indem Sie sie mit schwarzem Klebeband umwickeln.
- Schneiden Sie mit dem optischen Sensor ein winziges Loch in die Stelle. Um zu verhindern, dass Licht in die Flasche eindringt, machen Sie das Loch etwas kleiner als den Durchmesser des Sensors.
HINWEIS: Jede undurchsichtige Schicht, die verhindert, dass Licht in die Flasche eindringt, funktioniert ebenfalls. Der Vorteil von schwarzem Klebeband ist, dass es abriebfest ist und sich nicht in Wasser ablöst.
4. Probenentnahme und Handhabung
HINWEIS: Taucher führen die manuelle Entnahme von Proben in tieferem Wasser durch. Im flachen Wasser kann dies durch Schnorcheln oder Waten erfolgen.
- Legen Sie die Inkubationsflaschen in die tragbare Box.
- Tauchen Sie mit der Box in die jeweilige Tiefe. Vermeiden Sie es, das Sediment im umgebenden Wasser zu stören.
- Füllen Sie die Inkubationsflaschen vorsichtig mit den Proben. Versuchen Sie, die Biomasse der Probe so wenig wie möglich zu stören, zum Beispiel durch die Verwendung einer langen Pinzette. Wenn die mikrobiellen Matten auf einer festen Oberfläche, wie einem kleinen Stein, wachsen, übertragen Sie vorsichtig den ganzen Stein mit intakter Biomasse in die Flasche.
HINWEIS: Vermeiden Sie es, große Steine zu sammeln, wenn Probenahmematten auf Steinen wachsen - die Glasflaschen können bei weiterer Manipulation zerbrochen werden. - Füllen Sie ein Paar Hell-Dunkel-Flaschen mit sauberem Wasser aus den jeweiligen Tiefen, um als leere Kontrollen zu dienen.
HINWEIS: Die Flaschen ohne die Periphyton-Probe dienen als Kontrolle zur Bestimmung der Sauerstoffproduktion / des Sauerstoffverbrauchs von Umgebungswasserorganismen. Es stellt sicher, dass die berechnete Netto- oder Bruttoprimärproduktivität von Periphyton unverzerrt ist. - Stellen Sie sicher, dass das Wasser in allen Inkubationsflaschen sauber ist und keine störenden Sedimente enthält.
- Schließen Sie die Flaschen und bringen Sie sie zum Boot, das am schwimmenden Lastkahn verankert ist.
5. Messung der Primärproduktivität
HINWEIS: Die Person, die im Boot sitzt, nimmt die Box vom Taucher und führt die folgenden Schritte aus.
- Befestigen Sie die ersten beiden Paar Inkubationsflaschen an den Karabinerhaken an der ersten Kette.
- Messen Sie die anfängliche Sauerstoffkonzentration in jeder Flasche mit dem faseroptischen Sauerstoffmessgerät. Befestigen Sie das optische Kabel des Messgeräts an dem in der Flasche montierten Sauerstoffsensor und lesen Sie sofort (innerhalb weniger Sekunden) dieO2-Konzentration berührungslos (durch die Flaschenwand) aus. Notieren Sie den Messwert.
HINWEIS: Die Bearbeitungszeit ist kurz; Von der Entnahme der Flaschen von den Tauchern bis zur ersten Einstellung auf die jeweilige Tiefe dauert es nur wenige Minuten. - Unmittelbar danach senken Sie die Kette mit den angebrachten Flaschen vorsichtig zurück ins Wasser. Stellen Sie sicher, dass die Inkubationsflaschen in der gleichen Tiefe platziert werden, in der die Biomasse beprobt wurde, die in sie gegeben wurde.
- Führen Sie nach 1 h eine weitere Messung vom Schiff aus durch (siehe HINWEIS unten). Ziehen Sie jede Kette mit den Flaschen vorsichtig in das Boot, lesen Sie den Sauerstoffwert ab, indem Sie das optische Kabel am Sensor befestigen, und senken Sie die Proben wieder ins Wasser.
HINWEIS: Passen Sie die Zeit zwischen den einzelnen Messungen während der Inkubation entsprechend der Intensität derO2-Produktivität /des Verbrauchs der Proben an, um eine Übersättigung der Flaschen zu vermeiden. - Wiederholen Sie diesen Vorgang mindestens vier- oder fünfmal mit allen Flaschenpaaren.
HINWEIS: Der gesamte Aufbau des Experiments im Feld ist in Abbildung 4 dargestellt.
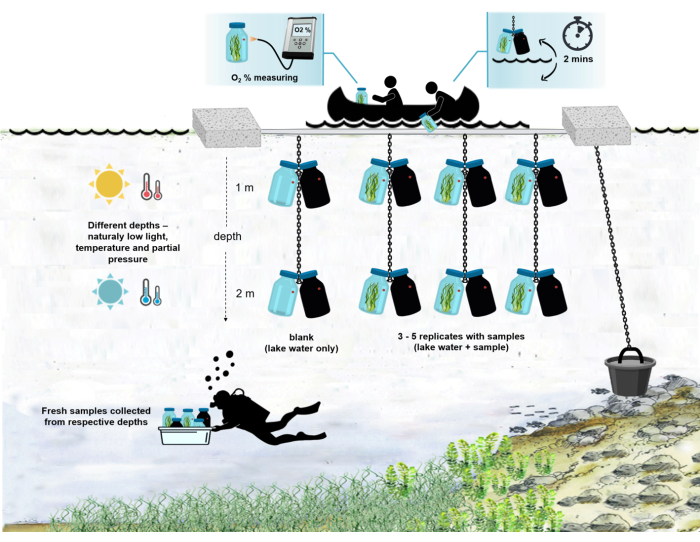
Abbildung 4: Schema des Versuchsaufbaus im Feld. Illustration des verankerten Versuchskahns auf der Seeoberfläche. Die Inkubationsflaschen (0,5 L) mit mikrobieller Mattenbiomasse werden in zwei verschiedenen Tiefen (1 m und 2 m) aufgehängt. Die Taucher sammelten Proben von mikrobiellen Matten direkt in den Inkubationsflaschen in den entsprechenden Tiefen. Die Sauerstoffkonzentration in einzelnen Flaschen wird vom Schiff aus gemessen. Die Flaschen werden aus dem Wasser gezogen. Der Sauerstoffkonzentrationswert wird in wenigen Sekunden gemessen, indem ein optisches Kabel an die Sauerstoffsonde angeschlossen wird. Die Flaschen werden dann vorsichtig wieder ins Wasser gesenkt. Der gesamte Vorgang der Messung von zwei Paaren von Inkubationsflaschen aus zwei Tiefen dauert ~2 min. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
6. Probenanalysen
- Nach dem Ende der Messungen entnehmen Sie die Proben direkt aus den Flaschen und übertragen die Biomasse der mikrobiellen Matte auf die kleinen Kunststoffkolben. Wenn die Matten auf festen Untergründen (z. B. Steinen) wachsen, schrubben Sie sie mit einer Zahnbürste oder einem kleinen Messer.
- Filtern Sie im Labor jedes Replikat durch vorgewogene Glasfaserfilter, um das Trockengewicht zu bestimmen9.
7. Datenanalysen
- Messen Sie während der Inkubationszeit die Sauerstoffkonzentration in den hellen und dunklen Flaschen und vergleichen Sie sie mit der Sauerstoffkonzentration in der Wassersäule beim Befüllen der Flaschen.
HINWEIS: Die Veränderung des Sauerstoffs in der leichten Flasche im Laufe der Zeit ist das kombinierte Ergebnis der Bruttoökosystemproduktivität (GEP) und der Atmung aller Organismen in der Flasche (Autotrophe und Heterotrophe aus dem Umgebungswasser und der periphytischen Gemeinschaft). Die Abnahme des Sauerstoffs in der dunklen Flasche misst die Atemverluste sowohl von Autotrophen als auch von Heterotrophen. Die Änderung der Sauerstoffkonzentration in der Kontrolle (d.h. Flaschen ohne Periphyton) ist nur das Produkt heterotropher oder autotropher Organismen im umgebenden Wasser. Die Produktivität und Atmung der Periphytonen wurden geschätzt, indem die Produktivität und Atmung des Umgebungswassers abgezogen wurden, die in leeren Inkubationsflaschen gemessen wurden. - Notieren Sie dieO2-Konzentration in Prozent Sauerstoffsättigung (d. H. Kalibrieren Sie die Sauerstoffsensoren auf 0% und 100% Sauerstoffsättigung). Bevor Sie die primäre Produktivität schätzen, konvertieren Sie die Rohdaten (
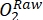 ) in eine vernünftige Einheit.
) in eine vernünftige Einheit.
HINWEIS: In dieser Studie werden die Daten gemäß Benson und Krause10 in MMOL von O2 pro Gramm organischer Substanz (OM) der Periphytonmasse auf der Trockengewichtsbasis umgewandelt.- Berechnen Sie die Umrechnung mit Gleichung (1):
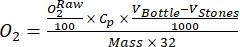 (1)
(1)
Dabei istCP O2-Konzentration in Wasser (mg (O2) L-1), wenn es vollständig mit O2 gesättigt ist, V-Flasche ist das Volumen der Flasche in ml, V-Steine ist das vom Stein eingenommene Volumen in ml, ist das Gewicht der Periphytonmasse in g und 32 ist das Molgewicht von O2. - Berechnen Sie Cp mit Gleichung (2):
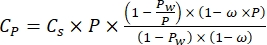 (2)
(2)
Dabei ist Cs die StandardkonzentrationO2, P der atmosphärische Druck an der Seeoberfläche, Pw der Partialdruck des Wasserdampfes an der Seeoberfläche und ω die Wasserdichte. - Berechnen Sie Cs, ω, P und Pw aus zuvor definierten empirischen Gleichungen (3-6), wenn die Seehöhe (h in km) und die Wassertemperatur an der Seeoberfläche (t in °C) bekannt sind:
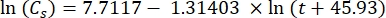 (3)
(3)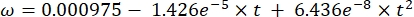 (4)
(4)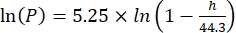 (5)
(5)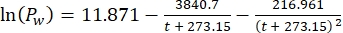 (6)
(6)
ANMERKUNG: Aus den Gleichungen (1-6) geht hervor, dass die berechneteO2-Konzentration für geringe Tiefen am genauesten ist. Mit zunehmender Tiefe wird die berechnete Konzentration in Bezug auf die absolute Konzentration verzerrt. Es ist optimal, wenn die Änderungsrate der Sauerstoffkonzentration entlang der Tiefe für jeden See bekannt ist, so dass die absoluteO2-Konzentration bei Bedarf korrigiert werden kann. Sobald die O2-Konzentration berechnet ist, kann ihre Änderung im Laufe der Zeit verwendet werden, um zwei verschiedene Flüsse vonO2 unter zwei verschiedenen Bedingungen zu berechnen. Unter Lichtbedingungen ist die Netto-Ökosystemproduktivität (NEP) direkt proportional zur Änderung derO2-Konzentration im Laufe der Zeit (siehe unten). Der Begriff "Ökosystem" wird hier verwendet, um zu bezeichnen, dass das Periphyton aus autotrophen und heterotrophen Organismen besteht. Im Dunkeln ist die Änderung derO2-Konzentration im Laufe der Zeit proportional zur Summe der respiratorischen Verluste autotropher und heterotropher Organismen und definiert somit die Ökosystematmung (RE). Der Unterschied zwischen NEP und RE definiert die Brutto-Ökosystemproduktivität (GEP). Wenn die Atemverluste des heterotrophen Teils der Gemeinschaft vernachlässigbar sind, wird GEP gleich der Bruttoproduktivität des Ökosystems.
- Berechnen Sie die Umrechnung mit Gleichung (1):
- Bestimmen Sie die Änderungsrate derO2-Konzentration über die Zeit durch Polynomregression dritten Grades, wie in Gleichung (7) gezeigt.
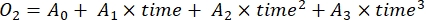 (7)
(7)
Dabei ist A 0 die O2-Konzentration zum Zeitpunkt Null und A 1-A2 sind Koeffizienten der Polynomregression.
HINWEIS: Die Polynomfunktion wird verwendet, da sie als Näherung an jede Differentialgleichung dienen kann. Daher ist es nicht notwendig, die genaue funktionelle Beziehung zwischenO2-Konzentration und Zeit zu kennen. Daher müssen Annahmen, die mit der funktionalen Beziehung verbunden sind (z. B. Linearität), nicht kontrolliert werden. Definitionsgemäß definiert der zweite Term der Polynomregression, A 1, die Änderungsrate der O2-Konzentration zum Zeitpunkt Null (d. h. die sofortige Rate), die unabhängig von A0 und damit die absolute O2-Konzentration zum Zeitpunkt Null ist. Aus diesem Grund wird die Schätzung des O2-Flusses nicht durch die Verzerrung der absolutenO2-Konzentrationsberechnungen beeinflusst, die durch Druckänderung über den Tiefengradienten verursacht wird. A 1 hat die EinheitO2 (mmol g(OM)-1) pro Zeit (1 h in dieser Studie).- Berechnen Sie A1, getrennt berechnet für Flaschen mit und ohne Lichtexposition, die mikrobielle Mattenbiomasse enthalten (d. h. V-Steine > 0) und für Kontrollflaschen mit und ohne Lichteinwirkung und mit freiem Wasser (d. h. V-Steine = 0).
ANMERKUNG: Durch Zuweisen dieser verschiedenen Regressionskoeffizienten Notationen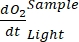 , ,
, , 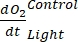 und
und 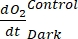 ,
, 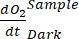 kann die Gleichung (8) für die Produktivitäts-GEP-Berechnung wie folgt geschrieben werden:
kann die Gleichung (8) für die Produktivitäts-GEP-Berechnung wie folgt geschrieben werden: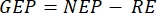 (8.1)
(8.1)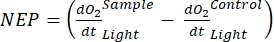 (8.2)
(8.2)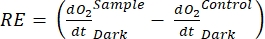 (8.3)
(8.3)
Der Begriff definiert die Netto-Ökosystemproduktivität (Abbildung 5A; d. h. die Nettosauerstoffproduktivität), und der Begriff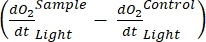
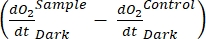 stellt die Summe der autotrophen und heterotrophen Atmung dar (Abbildung 5B; RE, d.h. unter der Annahme, dass beide Atmungen unter dunklen und hellen Bedingungen ähnlich sind).
stellt die Summe der autotrophen und heterotrophen Atmung dar (Abbildung 5B; RE, d.h. unter der Annahme, dass beide Atmungen unter dunklen und hellen Bedingungen ähnlich sind). - Subtrahieren Sie R von NEP, um GEP zu erhalten (Abbildung 5C).
ANMERKUNG: Gleichung (8) geht implizit davon aus, dass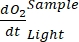 und
und 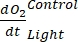 sowohl positiv als auch
sowohl positiv als auch 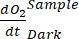 negativ
negativ 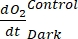 sind. Wenn
sind. Wenn 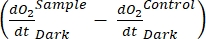 positiv ist, überprüfen Sie die Rohdaten sorgfältig auf Ausreißer . kann theoretisch negativ sein, da die durch heterotrophe Aktivität verursachten Atemverluste höher sein können als die photosynthetische Aktivität.
positiv ist, überprüfen Sie die Rohdaten sorgfältig auf Ausreißer . kann theoretisch negativ sein, da die durch heterotrophe Aktivität verursachten Atemverluste höher sein können als die photosynthetische Aktivität. 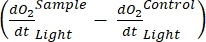
- Berechnen Sie A1, getrennt berechnet für Flaschen mit und ohne Lichtexposition, die mikrobielle Mattenbiomasse enthalten (d. h. V-Steine > 0) und für Kontrollflaschen mit und ohne Lichteinwirkung und mit freiem Wasser (d. h. V-Steine = 0).
Ergebnisse
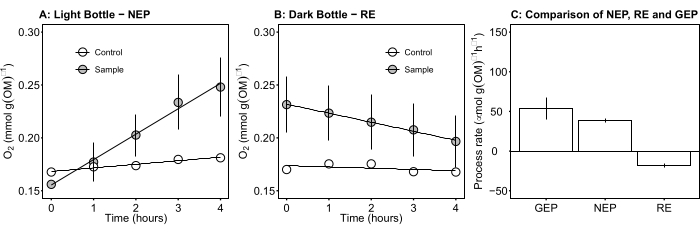
Abbildung 5: Netto- und Bruttoökosystemproduktivität mikrobieller Matten bei Tageslicht. (A) Light bottle-net ecosystem productivity: time course data of net oxygen productivity of microbial mats from the light bottles. Die Änderung der Sauerstoffkonzentration in Inkubationsflaschen wurde nach 1 h bei Tageslicht gemessen. Graue Kreise: Flaschen m...
Diskussion
Die in dieser Arbeit beschriebene Methodik basiert auf dem Prinzip der hellen und dunklen Flaschensauerstofftechnik in Kombination mit der nichtinvasiven Technik der Messung derO2-Konzentration mit optischen Sauerstoffsensoren. Dieses System ermöglicht die parallele Messung verschiedener Inkubationseinstellungen, da die optische Faser zur Messung vonO2 schnell von Flasche zu Flasche bewegt werden kann. Die benthischen Gemeinschaften aus verschiedenen Tiefen können sich in taxonomischer Zusammenset...
Offenlegungen
Die Autoren bestätigen, dass sie keine Interessenkonflikte offenzulegen haben.
Danksagungen
Diese Studie wurde von der Tschechischen Wissenschaftsstiftung (GACR 19-05791S), RVO 67985939 und vom CAS im Rahmen des Programms der Strategie AV 21, Landrettung und Wiederherstellung, unterstützt. Vielen Dank an Ondřej Sihelský für die Aufnahmen im Feld - ohne ihn wären die Dreharbeiten die Hölle gewesen. Das Projekt wäre nicht möglich ohne eine enge Zusammenarbeit mit den Unternehmen Palivový Kombinát Ústí s.p. und Sokolovská Uhelná, die den Zugang zu den untersuchten Orten ermöglichten.
Materialien
| Name | Company | Catalog Number | Comments |
| Aluminum angle L profile 40 x 40 mm x 3 mm, length 2,000 mm | |||
| Aluminum flat bar 40 x 3 x 350 mm | |||
| Bucket 15 L with concrete infill | |||
| Carabine hook with screw lock 50 x 5 mm | |||
| electric tape black | |||
| Extruded polystyrene (XPS) material 500 x 200 x 150 mm | |||
| Fibox 3 LCD trace | PreSens Precision Sensing GmbH | stand-alone fiber optic oxygen meter | |
| Hondex PS-7 Portable Depth Sounder | Hondex - Honda Electronics | to measures distances through water - to bottom depth measurement; https://www.honda-el.net/industry/ps-7e | |
| KORKEN - glass tight-seal jar 0.5 L | IKEA | incubation bottles; https://www.ikea.com/cz/en/p/korken-jar-with-lid-clear-glass-70213545/ | |
| metal hook | |||
| Oxygen Sensor Spot SP-PSt3-NAU-D5 | PreSens Precision Sensing GmbH | non-invasive optical oxygen sensor for measurements under Real Conditions | |
| SCOUT infantable canoe | GUMOTEX | https://www.gumotexboats.com/en/scout-standard#0000-044667-021-13/11C | |
| Screw 10 x 170 mm with hexagonal nuts | |||
| Screw 4 x 15 mm with hexagonal nuts | |||
| Screw 4 x 15 mm with wing nuts | |||
| Snap hooks 50 x 5 mm | |||
| Steel Carabine hook 50 x 5 mm | |||
| Steel chain with wire diameter 3 mm, inside link 5.5 x 26 mm | |||
| Steel chain, 5 m | |||
| toothbrush | |||
| tweezer | |||
| Washer 10 x 50 mm | |||
| Washer 4 x 10 mm | |||
| Washer 4 x 10 mm |
Referenzen
- Blachart, J. L., et al. Potential consequences of climate change for primary production and fish production in large marine ecosystems. Philosophical Transactions of the Royal Society B: Biological Sciences. 367 (1605), 2979-2989 (2012).
- Howarth, R. W., Michaels, A. F., Sala, O. E., Jackson, R. B., Mooney, H. A., Howarth, R. W. The Measurement of primary production in aquatic ecosystems. Methods in Ecosystem Science. , 72-85 (2000).
- Vadenbecouer, Y. E. G., Peterson, M. J., Vander, Z., Kalff, J. Benthic algal production across lake size gradients: Interactions among morphometry, nutrients, and light. Ecology. 89 (9), 2542-2552 (2008).
- Reimer, A., Landmann, G., Kempe, S. Lake Van, eastern Anatolia, hydrochemistry and history. Aquatic Geochemistry. 15 (1), 195-222 (2009).
- Cantonati, M., Lowe, R. L. Lake benthic algae: toward an understanding of their ecology. Freshwater Sciences. 33 (2), 475-486 (2014).
- Gaarder, T., Gran, H. H. Investigation of the production of plankton in the Oslo Fjord. Rapports et Proces-verbaux des Réunions. Conseil International pour l'Éxploration de la Mer. 42, 1-48 (1927).
- Hall, R. O., Thomas, S., Gaiser, E. E., Fahey, T. J., Knapp, A. K. Measuring Freshwater Primary Productivity and Respiration. Principles and Standards for Measuring Primary Productivity. , (2007).
- Howart, R., Michaels, A. Chapter 6 The Measurement of Primary Production in Aquatic Ecosystems. Springer Science and Business Media LLC. , (2000).
- Kopáček, J., Hejzlar, J. Semi-micro determination of total phosphorus in soils, sediments, and organic materials: a simplified perchloric acid digestion procedure. Communications in Soil Science and Plant Analysis. 26 (11-12), 1935-1946 (1995).
- Benson, B. B., Krause, D. The concentration and isotopic fractionation of oxygen dissolved in freshwater and seawater in equilibrium with the atmosphere1. Limnology and Oceanography. 29 (3), 620-632 (1984).
- Dodds, W. K., Biggs, B. J., Lowe, R. L. Photosynthesis-irradiance patterns in benthic microalgae: variations as a function of assemblage thickness and community structure. Journal of Phycology. 35 (1), 42-53 (1999).
- Bott, T. L., et al. An evaluation of techniques for measuring periphyton metabolism in chambers. Canadian Journal of Fisheries and Aquatic Sciences. 54 (3), 715-725 (1997).
- Blankenship, R. E. Structural and functional dynamics of photosynthetic antenna complexes. Proceedings of the National Academy of Sciences. 112 (45), 13751-13752 (2015).
- Hawes, I., Schwartz, A. -. M. Photosynthesis in an extreme shade environment, benthic microbial mats from Lake Hoare, a permanently ice-covered Antarctic lake. Journal of Phycology. 35 (3), 448-459 (1999).
- Aristegui, J., et al. Planktonic primary production and microbial respiration measured by 14C assimilation and dissolved oxygen changes in coastal waters of the Antarctic peninsula during austral summer: Implications for carbon flux studies. Marine Ecology-Progress Series. 132, 191-201 (1996).
- Steemann-Nielsen, C. The use of radioactive carbon (14C) for measuring organic production in the sea. Journal of Experimental Marine Biology and Ecology. 18 (2), 117-140 (1952).
- Sanz-Martín, M., et al. Relationship between carbon-and oxygen-based primary productivity in the Arctic Ocean, svalbard archipelago. Frontiers in Marine Science. 6, 468 (2019).
- Nielsen, E. S. Measurement of the production of organic matter in the sea by means of carbon-14. Nature. 167 (4252), 684-685 (1951).
- Jönsson, B. A 14C-incubation technique for measuring microphytobenthic primary productivity in intact sediment cores. Limnology and Oceanography. 36 (7), 1485-1492 (1991).
- Bender, M. L., et al. A comparison of four methods for determining planktonic community production. Limnology and Oceanography. 32 (5), 1085-1098 (1987).
- Šimek, K., et al. Spatio-temporal patterns of bacterioplankton productivity and community composition related to phytoplankton composition and protistan bacterivory in a dam reservoir. Aquatic Microbial Ecology. 51 (3), 249-262 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten