需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在 3D 类器官中模拟口腔-食管鳞状细胞癌
* 这些作者具有相同的贡献
摘要
该协议描述了生成和表征鼠口腔 - 食管3D类器官的关键步骤,这些类器官代表通过化学致癌引起的正常,癌前和鳞状细胞癌病变。
摘要
食管鳞状细胞癌(ESCC)在世界范围内普遍存在,每年占所有食管癌病例的90%,是所有人类鳞状细胞癌中最致命的。尽管最近在确定伴随ESCC启动和发展的分子变化方面取得了进展,但患者的预后仍然很差。这些分子变化的功能注释是必要的下一步,并且需要既能捕获ESCC的分子特征,又可以轻松且廉价地操作功能注释的模型。用烟草烟雾模拟物4-硝基喹啉1-氧化物(4NQO)处理的小鼠可预测地形成ESCC和食管癌前发育。值得注意的是,4NQO病变也出现在口腔中,最常见于舌头以及前胃,它们都共享分层鳞状上皮。然而,这些小鼠不能简单地操纵进行功能假设检验,因为生成同基因小鼠模型是时间和资源密集型的。在这里,我们通过从用4NQO处理的小鼠中生成单细胞衍生的三维(3D)类器官来克服这一限制,以表征小鼠ESCC或体 外肿瘤前细胞。这些类器官捕获了ESCC和食管癌前增生的显着特征,可以廉价快速地用于形成等基因模型,并可用于同源移植实验。我们演示了如何从正常,肿瘤前和SCC鼠食管组织中生成3D类器官,并维持和冷冻保存这些类器官。这些多功能类器官的应用非常广泛,包括利用基因工程小鼠和通过流式细胞术或免疫组织化学进一步表征,使用CRISPR技术生成同基因类器官系,以及药物筛选或同源移植。我们相信,广泛采用该议定书中展示的技术将加速该领域的进展,以应对ESCC的严重负担。
引言
食管鳞状细胞癌 (ESCC) 是人类鳞状细胞癌中最致命的,因为它诊断较晚、治疗耐药和转移1,2。ESCC 起源于分层鳞状上皮,其排列在食管的管腔表面。鳞状上皮由增殖性基底细胞和基底上细胞层内的分化细胞组成。在生理条件下,基底细胞表达标记物,如p63,Sox2和细胞角蛋白K5和K14,而分化的细胞表达K4,K13和IVL。基底细胞本身是异质的,包括由K153 和CD734等标记物定义的推定干细胞。在体内平衡中,基底细胞在基底上细胞层内经历有丝分裂后终末分化,而分化的细胞迁移并脱屑到腔内以完成上皮更新。让人联想到它们的起源细胞,ESCC在不同程度上显示出鳞状细胞分化。ESCC 通常伴有多灶性组织学前体病变,称为上皮内瘤变 (IEN) 或异型增生,包括非典型基底细胞。除了上皮变化外,ESCC还显示上皮下隔室内的组织重塑,其中发生癌症相关成纤维细胞(CAFs)的活化和免疫/炎症细胞的募集以促进肿瘤的微环境。
ESCC的发病机制涉及遗传改变和环境危险因素暴露。关键的遗传病变包括肿瘤抑制基因TP53和CDKN2A(p16INK4A)的失活以及CCND1(细胞周期蛋白D1)和EGFR癌基因的活化,最终导致细胞周期检查点功能受损,异常增殖以及在与暴露于环境致癌物相关的遗传毒性应激下存活。事实上,遗传变化与行为和环境风险因素密切相关,最常见的是烟草和酒精的使用。烟草烟雾中含有乙醛等人类致癌物质,乙醛也是酒精的主要代谢产物。乙醛诱导DNA加合物和链间DNA交联,导致DNA损伤和DNA突变和染色体不稳定的积累。鉴于过量的有丝分裂刺激和癌基因激活引起的异常增殖,应对遗传毒性应激的机制促进了食管上皮细胞的恶性转化,包括抗氧化剂的激活、自噬和上皮-间充质转化(EMT)。有趣的是,这些细胞保护功能通常在以高CD44(CD44H)表达为特征的ESCC癌症干细胞(CSC)中被激活,并具有肿瘤起始,侵袭,转移和治疗耐药的能力5,6,7。
ESCC已在细胞培养和啮齿动物模型8,9中建模。在过去的三十年中,已经开发出强大的ESCC基因工程小鼠模型。这些包括CCND1和EGFR转基因小鼠10,11和p53和p120Ctn敲除小鼠12,13。然而,单个基因改变通常不会导致快速发作的ESCC。通过使用食道致癌物克服了这一挑战,这些致癌物很好地概括了ESCC14中的人类遗传病变。例如,4-硝基喹啉-1-氧化物(4NQO)加速CCND1转基因小鼠ESCC的发育15。近年来,在细胞谱系可追溯小鼠模型3,4中研究了假定的食管上皮干细胞,祖细胞及其各自的命运。此外,这些细胞谱系可追溯的小鼠已被用于探索ESCC的起源细胞以及这些细胞如何通过常规组织学和基于组学的分子表征产生CD44HCSCs7。
与这些小鼠模型相关的一个新兴领域是细胞培养技术在三维(3D)类器官系统中分析活ESCC和前体细胞的新应用,其中原始组织的结构在体外重现7,8,9。这些 3D 类器官从从小鼠组织中分离的单细胞悬液中快速生长,包括原发性和转移性肿瘤(例如淋巴结、肺和肝脏病变)。将细胞包埋在基底膜提取物(BME)中,并用明确的无血清细胞培养基进料。3D类器官在7-10天内生长,所得的球形结构适合传代培养,冷冻保存和测定,用于分析各种细胞特性和功能,包括CSC标志物,EMT,自噬,增殖,分化和凋亡细胞死亡。
这些方法可广泛应用于从任何分层鳞状上皮组织建立的3D类器官培养物,例如头颈部粘膜(口腔,舌头,咽部和喉部)甚至前胃。头颈部黏膜与食管相邻,两种组织具有相似的组织组织、功能和对疾病的易感性。头颈部鳞状细胞癌(HNSCC)和ESCC都有遗传病变和生活方式相关的环境危险因素,如烟草和酒精暴露。强调这种相似性,用烟草烟雾模拟4NQO处理的小鼠很容易发展HNSCC和ESCC。鉴于下面描述的方案可以很容易地应用于HNSCC建模,我们提供了从这些病变建立3D类器官培养物的具体说明。
在本文中,我们提供了用于生成小鼠食管3D类器官(MEO)的详细方案,这些类器官代表在用4NQO治疗的小鼠中发展的正常,癌前和ESCC病变。可以使用各种小鼠品系,包括常见的实验室品系,如C57BL / 6和细胞谱系可追溯以及其他基因工程衍生物。我们强调关键步骤,包括分离正常或患病的小鼠食管上皮,制备单细胞悬浮液,培养和监测生长中的3D类器官,传代培养,冷冻保存以及后续分析的处理,包括形态学和其他应用。
研究方案
小鼠实验是根据法规和动物协议#AABB1502计划和进行的,由哥伦比亚大学机构动物护理和使用委员会审查和批准。小鼠被饲养在适当的动物护理设施中,以确保对小鼠的人道待遇,并为小鼠提供适当的兽医护理,并为实验室人员提供实验室安全培训。
1.用4NQO治疗小鼠诱导食管IEN和ESCC病变(时间考虑:长达28周)
注意:为了产生代表肿瘤性食管病变的MEO,将小鼠置于4NQO介导的化学致癌作用中,如Tang等人先前描述的那样14。正常/非肿瘤性MEO由未经治疗的小鼠产生。
- 小 鼠
- 每个笼子容纳四到五只小鼠,并在开始实验之前将它们适应动物设施至少1周。为了减少年龄相关疾病导致整个28周实验过早终止的可能性,从8周龄至16周龄的小鼠开始。
注意:在本协议中使用了重约20-30g的C57BL / 6小鼠。对于较短的实验,可以使用老年小鼠。雄性或雌性小鼠是可以接受的。对照(不治疗,见第1.3.1节)小鼠必须在年龄和性别上匹配。
- 每个笼子容纳四到五只小鼠,并在开始实验之前将它们适应动物设施至少1周。为了减少年龄相关疾病导致整个28周实验过早终止的可能性,从8周龄至16周龄的小鼠开始。
- 含4NQO的饮用水的制备
- 在乙丙二醇中制备1 mg/mL 4NQO储备溶液(材料表)。将 100 mg 4NQO 溶解到 100 mL 99.9% 乙丙二醇中,置于覆盖有密封膜的 500 mL 玻璃烧杯中。在室温(RT)下使用磁力搅拌器以800rpm充分混合30分钟。储存在4°C。
- 将 900 mL 高压灭菌的去离子水加入 100 mL 的 1 mg/mL 4NQO 储备溶液中,并在覆盖有密封膜的 2 L 塑料量筒中倒置混合。1 L 100 μg/mL 4NQO 在 10% 乙丙二醇中的体积将用于两个配备 500 mL 饮水瓶的小鼠笼。
注意:值得注意的是,4NQO是一种合成化学致癌物,可能导致癌症。戴上丁腈手套和长袖实验室外套,并穿露趾鞋。考虑适当的眼睛防护、面部防护和头罩。对于废物处理,4NQO应按照环境健康和安全危险废物管理的机构指南放置在有标签的容器中。
- 4NQO治疗和监测
- 连接水瓶,并通过饮用水随意向 小鼠施用 4NQO16周。使用10%(w / v)丙二醇作为载体(无处理)对照。
注意:较短的4NQO治疗可用于诱导IEN。 - 每周补充一次水。
- 每周将每只小鼠放入实验室天平上的塑料容器中称重。
- 在16周4NQO治疗期结束时,在4NQO后观察期开始给小鼠定期饮水长达12周(图1)。
- 每天监测小鼠是否有痛苦的迹象(例如,活动能力受损、驼背习惯和孤僻行为)、吞咽困难和脱水。此外,每周评估小鼠体重或食物和液体摄入量的变化。如果体重比初始体重下降10%以上,则用液体膳食补充剂喂养小鼠。
注意:液体膳食补充剂难治性体重减轻可能表明ESCC,体重减轻超过20%的小鼠应被安乐死。重要的是,MEO可以从过早安乐死的小鼠中产生。请注意,没有遗传修饰的C57BL / 6小鼠通常不会出现发病迹象或具有可见的ESCC病变,直到4NQO后观察期结束。
- 连接水瓶,并通过饮用水随意向 小鼠施用 4NQO16周。使用10%(w / v)丙二醇作为载体(无处理)对照。
- 动物制备
- 在充满CO2的CO2室中以每分钟置换30%-70%的腔室体积的流速对小鼠实施安乐死。确认颈椎脱位死亡。
- 使用21 G针将鼠标的四肢和鼻子仰卧位固定在解剖平台上。
- 用70%乙醇消毒小鼠的腹面。
- 解剖(时间考虑:0.5小时)
- 通过捏住中腹皮毛和皮肤来打开皮肤,以确保它从下面的内脏中释放出来。使用手术剪刀从下腹部到下巴做一个颅尾腹中线切口。
- 从中线切口开始,使用手术剪刀进行放射状切口,延伸到小鼠两侧的四肢。将皮瓣打开。
- 要暴露颈气管,请使用解剖剪刀将唾液腺分开中线。气管位于腺体深处。
- 要暴露胸气管,请切除胸骨。
- 用镊子轻轻捏住并提起腹膜,并用剪刀沿胸腔将腹膜颅尾和横向分开。
- 轻轻地将肝脏从横膈膜的尾表面缩回,并用剪刀在胸骨切口处的横膈膜上做一个小切口,特别是在剑突的背表面。这会将肺和心脏从内脏胸膜中释放出来。
- 将胸腔与胸内容物分开。将剪刀插入横膈膜的切口,然后颅骨解剖到颈带。在解剖过程中,紧贴胸骨背表面,以避免损伤下面的器官。确保夹层平面位于气管前方。
- 用剪刀剪断胸骨两侧的肋骨,然后取下胸骨。确保胸部内容物暴露在外。
- 暴露腹部食管。用镊子握住胃窦,轻轻地向前提起胃。用剪刀解剖胃和食道上的脾脏、胰腺和肠系膜。
- 暴露胸食管(图2)。
- 轻轻抬起气管立即尾部至甲状腺软骨,并用虹膜剪刀解剖气管背侧的食道。
- 用虹膜剪刀将甲状腺软骨处的气管分开。
- 通过沿尾部方向仔细解剖,将气管从食道的其余部分剥离。
- 用气管一起取出肺、心脏和胸腺。解剖和分割主动脉和腔静脉时,注意避免对食道造成损伤。
- 用剪刀将幽门处的胃分开。
- 用镊子夹住胃窦并解剖颅骨,将食道与椎骨分开。
- 在甲状腺软骨水平处分裂食道,并 集体收获食道和胃(图3)。
- 通过在贲门处划分食道来分离胃和食道(图4,顶部面板,红线)。
- 解剖食道外表面的任何筋膜。要保留用于组织学的样本(可选),请取出一半的食管并用剪刀纵向分开。将剩余的完整食道放入冰上的冷PBS中。
- 沿着较大的曲率打开胃,并用PBS充分清洗。分开前胃,用冷PBS清洗。将前胃放在冰上的冷PBS中。
- 要收获舌头,请取下鼻子上的 21 G 针,然后用镊子拔出舌头。尽可能长时间地割断舌头。将舌头放在冰上的冷PBS中。
2. 小鼠食管类器官(MEO)培养的建立
注意:该协议也可用于建立鼠舌类器官培养物,并添加在胰蛋白酶消化之前切碎舌组织的步骤。请参阅步骤 2.2.3 中的注释。
- 试剂的制备
注意:试剂列表可在 材料表中找到。除非另有说明,否则请根据制造商的说明准备和储存储备溶液。- 确保本协议中使用的基底膜基质(BME)的一次性等分试样储存在-20°C直至使用之日,随后在冰上或2-8°C下解冻,并在不使用时始终保持在冰上。
- 将 250 mg 大豆胰蛋白酶抑制剂 (STI) 溶解在 1,000 mL PBS(250 mg/mL 储备浓度)中,并对其进行过滤灭菌 (0.22 μm)。将50mL等分试样分配到锥形管中,并在4°C下储存长达6个月。
- 制备小鼠类器官培养基 (MOM):用 1 mM N-乙酰基-L-半胱氨酸 (NAC)、2% R-Spondin 和 Noggin 条件培养基 (RN CM)、1 x N-2 补充剂、1x B-27 补充剂、10 mM HEPES、1x 抗生素-抗真菌剂、1 x GlutaMAX 补充剂和 100 ng/mL 小鼠表皮生长因子 (mEGF) 补充高级 DMEM/F12。一次准备MOM 500 mL,将其分成50 mL等分试样,并储存在2-8°C直至准备使用。使用前加入 0.5 μg/mL 两性霉素 B 和 10 μM Y-27632。
- 使用前,将MOM,0.25%胰蛋白酶和大豆胰蛋白酶抑制剂(STI)在水浴或珠浴中预热至37°C。
- 从解剖的小鼠组织中分离角质形成细胞(时间考虑:2小时)
- 将食管组织转移到PBS中的500μL分散酶中(总共2.5-5单位),并在37°C和800rpm下在热混合器中孵育10分钟。
- 将组织转移到培养皿中,并使用镊子小心地从上皮上去除肌肉层(图4)。
注意:此步骤也可以由经验丰富的研究人员在孵育之前执行。 - 将上皮细胞转移到含有500μL0.25%胰蛋白酶的微量离心管中,并在37°C和800rpm下在热混合器中孵育10分钟。
注意:如果起始材料是舌组织,请在加入胰蛋白酶之前,用无菌手术刀将组织切成小块,大小约为 1-2 mm2 。 - 以2,000 x g 短暂离心5-10秒以沉淀组织。准备带有 100 μm 细胞过滤器的 50 mL 锥形管。使用圆周运动将组织/细胞悬液通过具有宽孔尖端的过滤器转移。
- 通过过滤器加入 3 mL STI,使用圆周运动进行洗涤。
- 用 1 mL 结核菌素注射器柱塞的底座擦洗过滤器以推动细胞通过。
- 用3mL PBS清洗过滤器3-5次,在洗涤之间用注射器底部擦洗过滤器。
- 在4°C下以300× g 离心管10分钟以沉淀细胞。
- 除去上清液,在管中留下1mL溶液。
- 将沉淀重悬于剩余的 1 mL 中,并通过 70 μm 细胞过滤器将细胞悬液转移到新的 50 mL 锥形管中。
- 在4°C下以300× g 离心管10分钟以沉淀细胞。
- 将沉淀重悬于 100 μL MOM 中;根据需要调整音量。通过台盼蓝排除进行自动细胞计数。
- 初始细胞悬液的接种(时间考虑:<1小时)
- 在37°C培养箱中预热24孔细胞培养板。
- 在 75% (v/v) BME/MOM 中接种 5,000 个活细胞,每孔总体积为 50 μL。根据以下示例计算,最大化接种的孔数,并在BME中为一个额外的孔准备足够的细胞。
注意:冷冻保存培养基(FBS中的10%DMSO)中任何多余的细胞,最大浓度为1 x 106 个细胞/ mL。将冷冻管储存在-80°C的冷冻容器中过夜。 将它们转移到气相液氮中长期储存。 - 在微量离心管中,首先在MOM中制备适当的细胞稀释液,然后在电镀前使用宽口径尖端加入BME。
- 使用200 μL宽口径的吸头,将50 μL液滴缓慢添加到孔的中心,避免吸头与孔的底部或侧面接触(图5)。注意不要用太大的力将液体从尖端排出,否则圆顶会变平。
- 让BME在37°C,5%CO2,95%相对湿度(RH)培养箱中固化30分钟。
- 每孔小心地加入 500 μL MOM,补充 0.5 μg/mL 两性霉素 B 和 10 μM Y-27632。
注意:在整个初始原代培养过程中将两性霉素添加到所有 MOM 中。仅在传代当天(第 0 天)为所有传代添加 Y-27632。 - 在第 3-4 天更换 MOM,然后每 2-3 天更换一次,直到准备好通过。
- 在第7-10天,对类器官进行成像,并通过将形成的类器官数量除以最初接种的细胞数量来测量类器官形成率(OFR)。
计算示例: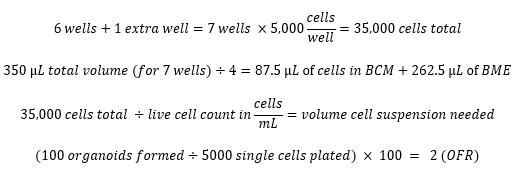
- 小鼠食管类器官(MEO)的传代和冷冻保存(时间考虑:<1.5小时)
- 解冻并保持BME在冰上。使用前在水浴或珠浴中将MOM,0.05%胰蛋白酶和STI预热至37°C。在37°C培养箱中预热24孔细胞培养板。
- 使用宽口径微量移液器吸头,将类器官与上清液一起收集BME圆顶。通过上下移液破坏 BME。
注意:将含有相同样品的孔合并到单个微量离心管中。 - 以2,000 x g 短暂离心10-15秒以沉淀类器官。取出并弃去上清液。
- 轻轻移开沉淀,并将沉淀重悬于500μL的0.05%胰蛋白酶中。
- 将管在37°C和800rpm的热混合器中孵育10分钟。
- 用 600 μL STI 灭活胰蛋白酶。
- 将管在4°C下以300× g 离心5分钟以沉淀细胞。
- 取出并弃去上清液。将细胞沉淀重悬于 100 μL MOM 中。通过台盼蓝排除进行自动细胞计数。
注意:音量可根据需要进行调整。 - 将 2,000-5,000 个活细胞接种在 75% (v/v) BME/MOM 中,每孔总体积为 50 μL。根据前面提到的示例计算,最大化接种的孔数,并在BME中为一个额外的孔准备足够的细胞。
注意:冷冻保存培养基(FBS中的10%DMSO)中任何多余的细胞,最大浓度为1 x 106 个细胞/ mL。将冷冻管储存在-80°C的冷冻容器中过夜。 将它们转移到气相液氮中长期储存。 - 在微量离心管中,首先在MOM中制备适当的细胞稀释液,然后在电镀前使用宽口径尖端加入BME。
- 使用 200 μL 宽孔径吸头,将 50 μL 液滴缓慢添加到孔中心,避免吸头与孔底部或侧面接触。注意不要用太大的力将液体从尖端排出,否则圆顶会变平。
- 将板在37°C,5%CO2,95%RH培养箱中孵育30分钟。
- 每孔小心地加入 500 μL MOM,并补充 10 μM Y-27632。
注意:仅在传代当天(第 0 天)添加 Y-27632。在更换介质期间无需添加它。不再需要添加两性霉素 B。 - 在第 3-4 天更换 MOM,然后每 2-3 天更换一次,直到准备好通过。
- 在第7-10天,对类器官进行成像,并测量OFR值。
- 小鼠食管类器官(MEO)的解冻和恢复(时间考虑:<1小时)
- 解冻并保持BME在冰上。在37°C培养箱中预热24孔细胞培养板。
- 在 15 mL 锥形管中制备 10 mL 冷或室温 MOM 或 PBS。
- 在37°C水浴或珠浴中解冻冷冻管约30秒至1分钟或直到留下小冰丸。
- 使用预润湿的移液器吸头,以滴滴方式将细胞悬液缓慢转移到含有MOM或PBS的管中。
- 将管离心300× g 和4°C5分钟以沉淀细胞。
- 取出并弃去上清液。将细胞沉淀重悬于 100 μL MOM 中;根据需要调整音量。通过台盼蓝排除进行自动细胞计数。
- 将 5,000-10,000 个活细胞接种在 75% (v/v) BME/MOM 中,每孔总体积为 50 μL。根据前面提到的示例计算,最大化接种的孔数,并在BME中为一个额外的孔准备足够的细胞。
- 继续执行小鼠食管类器官(MEO)传代和冷冻保存方案的其余步骤(参见步骤2.4.11)。
3.石蜡包埋用类器官的制备(时间考虑:<1小时[加上试剂制备1.5小时])
- 使用宽口径微量移液器吸头,每个微量离心管收集三个孔。将BME圆顶中的类器官与上清液一起收集。通过上下移液破坏 BME。
- 以2,000 x g 短暂离心10-15秒以沉淀类器官。取出并弃去上清液。
- 轻轻移开沉淀,并将沉淀重悬于 300 μL 4% 多聚甲醛 (PFA) 中。
- 将类器官在4°C下固定过夜。
- 以2,000 x g 短暂离心10-15秒以沉淀类器官。尽可能多地去除并丢弃PFA。
- 轻轻移开沉淀,并将沉淀重悬于 500 μL PBS 中。
注意:固定类器官可以在4°C下储存长达2周,然后再进行下一步。 - 准备 50 mL 琼脂凝胶原液(2% 琼脂加 2.5% 明胶)。
注意:由于孵育时间,提前准备琼脂凝胶原液,然后进行高压灭菌循环。- 将 1 g 杆菌琼脂和 1.25 g 明胶重悬于 150 mL 可高压灭菌玻璃烧杯中的 50 mL 水中。
- 旋转悬浮液,让它在室温下静置 30-60 分钟。
- 在121°C高压灭菌20分钟。
- 稍微冷却,将 5 mL 等分试样分装在 15 mL 锥形管中。
- 在室温下储存长达 6 个月。
- 通过倒置微量离心管架并用密封膜覆盖表面来准备嵌入表面。使用相应的类器官 ID 标记。
- 将试管以300× g 离心5分钟以沉淀类器官。取出并弃去上清液。
- 同时,通过将含有琼脂凝胶的 15 mL 锥形管放入含有 100 mL 水的 150 mL 玻璃烧杯中并在最高功率设置下微波 1-2 分钟或直到水开始沸腾并且琼脂凝胶处于液态,从而液化琼脂凝胶。
注意:在微波之前松开装有琼脂凝胶的锥形管的盖子。 - 将含有类器官沉淀的微量离心管部分浸入温水中,而不将任何水引入微量离心管中。
- 通过在管侧面添加 50 μL 琼脂来小心地覆盖类器官沉淀。
- 在不干扰沉淀的情况下(不要重悬,保持沉淀完整),将琼脂凝胶液滴中的沉淀转移到包埋表面上的密封膜上。
- 用额外的 50 μL 液体琼脂凝胶重复步骤 3.12 和步骤 3.13,以收集任何剩余的类器官沉淀,并小心地添加到相同的凝胶液滴中。
- 将含有类器官沉淀的液滴在4°C下孵育45分钟。
- 使用镊子,小心地将含有类器官颗粒的液滴转移到标记的病理盒中。
- 将盒式磁带在4°C的70%乙醇中储存长达1个月。
- 通过常规组织学处理进行石蜡包埋以制备石蜡块。
结果
该协议描述了根据特定的治疗方案从正常食管组织或来自4NQO处理的小鼠的ESCC肿瘤组织产生小鼠食管类器官(MEO)的过程,该方案包括在饮用水中施用16周的4NQO,然后是10周至12周的观察期(图1)。然后将小鼠安乐死以解剖舌头或食道组织(图2 和 图3)。我们描述了一种从完整食道中分离上皮层的方法(图4?...
讨论
此处描述的协议中,生成和分析MEO有几个关键步骤和注意事项。为了确保MEO实验的可重复性和严谨性,生物学和技术重复都很重要。对于生物学重复,每个实验条件通常有两到三只携带ESCC的独立小鼠就足够了。然而,适当的生物学重复次数可能会有所不同,具体取决于单个研究中要测试的参数。例如,目前尚不清楚从没有肉眼可见病变或组织学IEN和ESCC病变的4NQO处理小鼠中检测到肿瘤类器官的早?...
披露声明
作者声明不存在利益冲突。
致谢
我们感谢哥伦比亚大学赫伯特欧文综合癌症中心的共享资源(流式细胞术,分子病理学和共聚焦和专业显微镜)的技术支持。我们感谢Alan Diehl博士,Adam J. Bass博士和Kwok-Kin Wong博士(NCI P01食管癌发生机制)以及Rustgi和Nakagawa实验室的成员进行了有益的讨论。这项研究得到了以下NIH资助的支持:P01CA098101(H.N.和A.K.R.),R01DK114436(H.N.),R01AA026297(H.N.),L30CA264714(SF),DE031112-01(F.M.H.),KL2TR001874(F.M.H.),3R01CA255298-01S1(J.G.),2L30DK126621-02
(J.G.)R01CA266978 (C.L.), R01DK132251 (C.L.), R01DE031873 (C.L.), P30DK132710 (C.M. 和 H.N.), 和 P30CA013696 (AKR)。H.N.和C.L.是哥伦比亚大学赫伯特欧文综合癌症中心多PI飞行员奖的获得者。H.N.是范可尼贫血研究基金奖的获得者。F.M.H.是马克癌症研究基金会奖(20-60-51-MOME)和美国癌症研究协会奖的获得者。J.G.是美国胃肠病学协会(AGA)奖的获得者。
材料
| Name | Company | Catalog Number | Comments |
| 0.05% trypsin-EDTA | Thermo Fisher Scientific | 25-300-120 | |
| 0.25% trypsin-EDTA | Thermo Fisher Scientific | 25-200-114 | |
| 0.4% Trypan Blue | Thermo Fisher Scientific | T10282 | |
| 1 mL tuberculin syringe without needle | BD | 309659 | |
| 1.5 mL microcentrifuge tube | Thermo Fisher Scientific | 05-408-129 | |
| 100 µm cell strainer | Thermo Fisher Scientific | 22363549 | |
| 15 mL conical tubes | Thermo Fisher Scientific | 14-959-53A | |
| 200 µL wide bore micropipette tips | Thermo Fisher Scientific | 212361A | |
| 21 G needles | BD | 305167 | |
| 24 well plate | Thermo Fisher Scientific | 12-556-006 | |
| 4-Nitroquinoline-1-oxide (4NQO) | Tokyo Chemical Industry | NO250 | |
| 50 mL conical tubes | Thermo Fisher Scientific | 12-565-270 | |
| 6 well plate | Thermo Fisher Scientific | 12556004 | |
| 70 µm cell strainer | Thermo Fisher Scientific | 22363548 | |
| 99.9% ethylene propylene glycol | SK picglobal | ||
| Advanced DMEM/F12 | Thermo Fisher Scientific | 12634028 | |
| Amphotericin B | Gibco, Thermo Fisher Scientific | 15290018 | Stock concentration 250 µg/mL, final concentration 0.5 µg/mL |
| Antibiotic-Antimycotic | Thermo Fisher Scientific | 15240062 | Stock concentration 100x, final concentration 1x |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | Stock concentration 50x, final concentration 1x |
| Bacto agar | BD | 214010 | |
| CO2 incubator, e.g.Heracell 150i | Thermo Fisher Scientific | 51026406 | or equivalent |
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | AMQAX1000 | or equivalent |
| Cryovials | Thermo Fisher Scientific | 03-337-7D | |
| DietGel 76A | Clear H2O | 72-07-5022 | |
| Dimethyl sulfoxide (DMSO) | MilliporeSigma | D4540 | |
| Dispase | Corning | 354235 | Stock concentration 50 U/mL, final concentration 2.5–5 U/mL |
| Dissecting scissors | VWR | 25870-002 | |
| Dulbecco's phosphate-buffered saline (PBS) | Thermo Fisher Scientific | 14190250 | Stock concentration 1x |
| Fetal bovine serum (FBS) | HyClone | SH30071.03 | |
| Forceps | VWR | 82027-386 | |
| Freezing container | Corning | 432002 | or equivalent |
| Gelatin | Thermo Fisher Scientific | G7-500 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | Stock concentration 100x, final concentration 1x |
| HEPES | Thermo Fisher Scientific | 15630080 | Stock concentration 1 M, final concentration 10 mM |
| Hot plate/stirrer | Corning | PC-420D | or equivalent |
| Lab Armor bead bath (or water bath) | VWR | 89409-222 | or equivalent |
| Laboratory balance | Ohaus | 71142841 | or equivalent |
| Matrigel basement membrane extract (BME) | Corning | 354234 | |
| Microcentrifuge Minispin | Eppendorf | 22620100 | or equivalent |
| Microcentrifuge tube rack | Southern Labware | 0061 | |
| N-2 supplement | Thermo Fisher Scientific | 17502048 | Stock concentration 100x, final concentration 1x |
| N-acetylcysteine (NAC) | Sigma-Aldrich | A9165 | Stock concentration 0.5 M, final concentration 1 mM |
| Parafilm M wrap | Thermo Fisher Scientific | S37440 | |
| Paraformaldehyde (PFA) | MilliporeSigma | 158127-500G | |
| Pathology cassette | Thermo Fisher Scientific | 22-272416 | |
| Phase-contrast microscope | Nikon | or equivalent | |
| Recombinant mouse epidermal growth factor (mEGF) | Peprotech | 315-09-1mg | Stock concentration 500 ng/µL, final concentration 100 ng/mL |
| RN cell-conditioned medium expressing R-Spondin1 and Noggin (RN CM) | N/A | N/A | Available through the Organoid and Cell Culture Core upon request, final concentration 2% |
| Sorval ST 16R centrifuge | Thermo Fisher Scientific | 75004380 | or equivalent |
| Soybean trypsin inhibitor (STI) | MilliporeSigma | T9128 | Stock concentration 250 µg/mL |
| ThermoMixer C | Thermo Fisher Scientific | 14-285-562 PM | or equivalent |
| Y-27632 | Selleck Chemicals | S1049 | Stock concentration 10 mM, final concentration 10 µM |
参考文献
- Rustgi, A. K., El-Serag, H. B. Esophageal carcinoma. The New England Journal of Medicine. 371 (26), 2499-2509 (2014).
- Dotto, G. P., Rustgi, A. K. Squamous cell cancers: A unified perspective on biology and genetics. Cancer Cell. 29 (5), 622-637 (2016).
- Giroux, V., et al. Long-lived keratin 15+ esophageal progenitor cells contribute to homeostasis and regeneration. The Journal of Clinical Investigation. 127 (6), 2378-2391 (2017).
- DeWard, A. D., Cramer, J., Lagasse, E. Cellular heterogeneity in the mouse esophagus implicates the presence of a nonquiescent epithelial stem cell population. Cell Reports. 9 (2), 701-711 (2014).
- Kinugasa, H., et al. Mitochondrial SOD2 regulates epithelial-mesenchymal transition and cell populations defined by differential CD44 expression. Oncogene. 34 (41), 5229-5239 (2015).
- Whelan, K. A., et al. Autophagy supports generation of cells with high CD44 expression via modulation of oxidative stress and Parkin-mediated mitochondrial clearance. Oncogene. 36 (34), 4843-4858 (2017).
- Natsuizaka, M., et al. Interplay between Notch1 and Notch3 promotes EMT and tumor initiation in squamous cell carcinoma. Nature Communications. 8 (1), 1758 (2017).
- Whelan, K. A., Muir, A. B., Nakagawa, H. Esophageal 3D culture systems as modeling tools in esophageal epithelial pathobiology and personalized medicine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 461-478 (2018).
- Sachdeva, U. M., et al. Understanding the cellular origin and progression of esophageal cancer using esophageal organoids. Cancer Letters. 509, 39-52 (2021).
- Nakagawa, H., et al. The targeting of the cyclin D1 oncogene by an Epstein-Barr virus promoter in transgenic mice causes dysplasia in the tongue, esophagus and forestomach. Oncogene. 14 (10), 1185-1190 (1997).
- Andl, C. D., et al. Epidermal growth factor receptor mediates increased cell proliferation, migration, and aggregation in esophageal keratinocytes in vitro and in vivo. The Journal of Biological Chemistry. 278 (3), 1824-1830 (2003).
- Opitz, O. G., et al. A mouse model of human oral-esophageal cancer. The Journal of Clinical Investigation. 110 (6), 761-769 (2002).
- Stairs, D. B., et al. Deletion of p120-catenin results in a tumor microenvironment with inflammation and cancer that establishes it as a tumor suppressor gene. Cancer Cell. 19 (4), 470-483 (2011).
- Tang, X. -. H., Knudsen, B., Bemis, D., Tickoo, S., Gudas, L. J. Oral cavity and esophageal carcinogenesis modeled in carcinogen-treated mice. Clinical Cancer Research. 10, 301-313 (2004).
- Fong, L. Y. Y., Mancini, R., Nakagawa, H., Rustgi, A. K., Huebner, K. Combined cyclin D1 overexpression and zinc deficiency disrupts cell cycle and accelerates mouse forestomach carcinogenesis. Cancer Research. 63 (14), 4244-4252 (2003).
- Zheng, B., et al. A new murine esophageal organoid culture method and organoid-based model of esophageal squamous cell neoplasia. iScience. 24 (12), 103440 (2021).
- Hisha, H., et al. Establishment of a novel lingual organoid culture system: generation of organoids having mature keratinized epithelium from adult epithelial stem cells. Scientific Reports. 3, 3224 (2013).
- Kalabis, J., et al. Isolation and characterization of mouse and human esophageal epithelial cells in 3D organotypic culture. Nature Protocols. 7 (2), 235-246 (2012).
- Nguyen, N., et al. TGF-β1 alters esophageal epithelial barrier function by attenuation of claudin-7 in eosinophilic esophagitis. Mucosal Immunology. 11 (2), 415-426 (2018).
- Sherrill, J. D., et al. Analysis and expansion of the eosinophilic esophagitis transcriptome by RNA sequencing. Genes and Immunity. 15 (6), 361-369 (2014).
- Ruffner, M. A., et al. Toll-like receptor 2 stimulation augments esophageal barrier integrity. Allergy. 74 (12), 2449-2460 (2019).
- Kabir, M. F., et al. Single cell transcriptomic analysis reveals cellular diversity of murine esophageal epithelium. Nature Communications. 13 (1), 1-15 (2022).
- Shimonosono, M., et al. Alcohol metabolism enriches squamous cell carcinoma cancer stem cells that survive oxidative stress via autophagy. Biomolecules. 11 (10), 1479 (2021).
- Flashner, S., Yan, K. S., Nakagawa, H. 3D organoids: An untapped platform for studying host-microbiome interactions in esophageal cancers. Microorganisms. 9 (11), 2182 (2021).
- Liu, K., et al. Sox2 cooperates with inflammation-mediated stat3 activation in the malignant transformation of foregut basal progenitor cells. Cell Stem Cell. 12 (3), 304-315 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。