Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
3D Organoidlerde Oral-Özofagus Skuamöz Hücreli Karsinomun Modellenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, kimyasal karsinogenez yoluyla indüklenen normal, preneoplastik ve skuamöz hücreli karsinom lezyonlarını temsil eden murin oral-özofagus 3D organoidlerini üretmek ve karakterize etmek için anahtar adımları açıklamaktadır.
Özet
Özofagus skuamöz hücreli karsinomu (ESCC) dünya çapında yaygındır ve her yıl tüm özofagus kanseri vakalarının% 90'ını oluşturur ve tüm insan skuamöz hücreli karsinomlarının en ölümcül olanıdır. ESKİT başlangıcı ve gelişimine eşlik eden moleküler değişikliklerin tanımlanmasındaki son gelişmelere rağmen, hasta prognozu kötüdür. Bu moleküler değişikliklerin işlevsel ek açıklaması gerekli bir sonraki adımdır ve hem ESCC'nin moleküler özelliklerini yakalayan hem de işlevsel ek açıklama için kolayca ve ucuz bir şekilde manipüle edilebilen modeller gerektirir. Tütün dumanı mimetik 4-nitrokinolin 1-oksit (4NQO) ile tedavi edilen fareler öngörülebilir şekilde ESCC ve özofagus preneoplazisi oluşturur. Not olarak, 4NQO lezyonları ayrıca ağız boşluğunda, en yaygın olarak dilde ve ayrıca tabakalı skuamöz epiteli paylaşan ön midede ortaya çıkar. Bununla birlikte, bu fareler fonksiyonel hipotez testi için basitçe manipüle edilemez, çünkü izojenik fare modelleri üretmek zaman ve kaynak yoğundur. Burada, murin ESCC veya preneoplastik hücreleri ex vivo olarak karakterize etmek için 4NQO ile muamele edilmiş farelerden tek hücreli türetilmiş üç boyutlu (3D) organoidler üreterek bu sınırlamanın üstesinden geliyoruz. Bu organoidler, ESCC ve özofagus preneoplazisinin göze çarpan özelliklerini yakalar, izojenik modeller oluşturmak için ucuz ve hızlı bir şekilde kullanılabilir ve sinjenik transplantasyon deneyleri için kullanılabilir. Normal, preneoplastik ve SCC murin özofagus dokusundan 3D organoidlerin nasıl üretileceğini ve bu organoidlerin nasıl korunacağını ve kriyoproteksiyonunu gösteriyoruz. Bu çok yönlü organoidlerin uygulamaları geniştir ve genetiği değiştirilmiş farelerin kullanımını ve akış sitometrisi veya immünohistokimya ile daha fazla karakterizasyonu, CRISPR teknolojilerini kullanarak izojenik organoid hatlarının oluşturulmasını ve ilaç taramasını veya sinjenik transplantasyonu içerir. Bu protokolde gösterilen tekniklerin yaygın olarak benimsenmesinin, ESCC'nin ağır yüküyle mücadele etmek için bu alandaki ilerlemeyi hızlandıracağına inanıyoruz.
Giriş
Özofagus skuamöz hücreli karsinomu (ESKK), geç tanısı, tedaviye direnci ve metastazı nedeniyle insan skuamöz hücreli karsinomlarının en ölümcül olanıdır 1,2. ESCC, yemek borusunun luminal yüzeyini kaplayan tabakalı skuamöz epitelden kaynaklanır. Skuamöz epitel, proliferatif bazal hücrelerden ve suprabazal hücre tabakasındaki farklılaşmış hücrelerden oluşur. Fizyolojik koşullar altında, bazal hücreler p63, Sox2 ve sitokeratin K5 ve K14 gibi belirteçleri eksprese ederken, farklılaşmış hücreler K4, K13 ve IVL'yi eksprese eder. Bazal hücrelerin kendileri heterojendir ve K153 ve CD734 gibi belirteçlerle tanımlanan varsayılan kök hücreleri içerir. Homeostazda, bazal hücreler suprabazal hücre tabakası içinde post-mitotik terminal farklılaşmasına uğrarken, farklılaşmış hücreler epitel yenilenmesini tamamlamak için lümene göç eder ve deskuamat eder. Menşe hücrelerini anımsatan ESCC, değişen derecelerde skuamöz hücre farklılaşması gösterir. ESCC sıklıkla intraepitelyal neoplazi (IEN) veya displazi olarak bilinen ve atipik bazaloid hücrelerden oluşan multifokal histolojik öncül lezyonlar eşlik eder. Epitel değişikliklerine ek olarak, ESCC, kanserle ilişkili fibroblastların (CAF'ler) aktivasyonunun ve tümörü teşvik eden mikro çevreyi teşvik etmek için bağışıklık / enflamatuar hücrelerin işe alınmasının gerçekleştiği subepitel bölmesinde doku yeniden şekillenmesini gösterir.
ESCC'nin patogenezi genetik değişiklikleri ve çevresel risk faktörlerine maruz kalmayı içerir. Anahtar genetik lezyonlar arasında tümör baskılayıcı genler TP53 ve CDKN2A'nın (p16INK4A) inaktivasyonu ve CCND1 (siklin D1) ve EGFR onkogenlerinin aktivasyonu yer alır ve bunlar bozulmuş hücre döngüsü kontrol noktası fonksiyonu, anormal proliferasyon ve çevresel kanserojenlere maruz kalmaya bağlı genotoksik stres altında sağkalım ile sonuçlanır. Gerçekten de, genetik değişiklikler davranışsal ve çevresel risk faktörleriyle, en yaygın olarak tütün ve alkol kullanımıyla yakından etkileşime girer. Tütün dumanı, aynı zamanda alkolün ana metaboliti olan asetaldehit gibi insan kanserojenleri içerir. Asetaldehit, DNA adduktlarını ve interstrand DNA çapraz bağlarını indükleyerek DNA hasarına ve DNA mutasyonlarının birikmesine ve kromozomal instabiliteye yol açar. Aşırı mitojenik uyaranlar ve onkogen aktivasyonundan kaynaklanan anormal proliferasyon göz önüne alındığında, özofagus epitel hücrelerinin malign transformasyonu, antioksidanların aktivasyonu, otofaji ve epitelyal-mezenkimal geçiş (EMT) dahil olmak üzere genotoksik stresle başa çıkma mekanizmaları ile kolaylaştırılmıştır. İlginçtir ki, bu sitoprotektif fonksiyonlar sıklıkla yüksek CD44 (CD44H) ekspresyonu ile karakterize edilen ve tümör başlatma, invazyon, metastaz ve tedavi direnci yeteneklerine sahip ESCC kanser kök hücrelerinde (CSC'ler) aktive edilir 5,6,7.
ESCC, hücre kültüründe ve kemirgen modellerindemodellenmiştir 8,9. Son otuz yılda, ESCC'nin sağlam genetik olarak tasarlanmış fare modelleri geliştirilmiştir. Bunlar arasında CCND1 ve EGFR transgenik fareler 10,11 ve p53 ve p120Ctn nakavt fareleri 12,13 bulunur. Bununla birlikte, tek genetik değişiklikler tipik olarak hızlı başlangıçlı ESCC ile sonuçlanmaz. Bu zorluk, ESCC14'teki insan genetik lezyonlarını iyi özetleyen özofagus kanserojenlerin kullanımı ile aşılmıştır. Örneğin, 4-nitrokinolin-1-oksit (4NQO), CCND1 transgenik farelerde ESCC gelişimini hızlandırır15. Son yıllarda, varsayılan özofagus epitel kök hücreleri, progenitör hücreler ve bunların kaderleri, hücre soyundan izlenebilir fare modellerinde araştırılmıştır 3,4. Ayrıca, bu hücre soyu izlenebilir fareler, ESCC'nin menşe hücrelerini ve bu hücrelerin geleneksel histoloji ve omik tabanlı molekülerkarakterizasyon 7 yoluyla CD44H CSC'lere nasıl yol açtığını araştırmak için kullanılmıştır.
Bu fare modelleriyle ilgili ortaya çıkan bir alan, orijinal dokuların mimarisinin ex vivo 7,8,9 olarak özetlendiği üç boyutlu (3D) bir organoid sistemde canlı ESCC ve öncü hücreleri analiz etmek için hücre kültürü tekniklerinin yeni uygulamasıdır. Bu 3D organoidler, primer ve metastatik tümörler (örneğin, lenf nodu, akciğer ve karaciğer lezyonları) dahil olmak üzere murin dokularından izole edilen tek hücreli bir süspansiyondan hızla büyür. Hücreler bazal membran ekstraktına (BME) gömülür ve iyi tanımlanmış serumsuz bir hücre kültürü ortamı ile beslenir. 3D organoidler 7-10 gün içinde büyür ve ortaya çıkan küresel yapılar, CSC belirteçleri, EMT, otofaji, proliferasyon, farklılaşma ve apoptotik hücre ölümü dahil olmak üzere çeşitli hücresel özellikleri ve fonksiyonları analiz etmek için alt kültür, kriyoprezervasyon ve tahliller için uygundur.
Bu yöntemler, baş ve boyun mukozası (ağız boşluğu, dil, farenks ve gırtlak) ve hatta ön mide gibi herhangi bir tabakalı skuamöz epitel dokusundan oluşturulan 3D organoid kültürlere geniş çapta uygulanabilir. Baş ve boyun mukozası yemek borusu ile bitişiktir ve iki doku benzer doku organizasyonunu, işlevini ve hastalığa duyarlılığını paylaşır. Hem baş hem boyun skuamöz hücreli karsinom (HNSCC) hem de ESCC, genetik lezyonları ve tütün ve alkol maruziyeti gibi yaşam tarzıyla ilgili çevresel risk faktörlerini paylaşır. Bu benzerliğin altını çizerek, tütün dumanı mimetik 4NQO ile tedavi edilen fareler hem HNSCC hem de ESCC'yi kolayca geliştirir. Aşağıda açıklanan protokollerin HNSCC'nin modellenmesinde uygulanabilmesinin kolaylığı göz önüne alındığında, bu lezyonlardan 3D organoid kültürlerin oluşturulması için özel talimatlar içermektedir.
Burada, 4NQO ile tedavi edilen farelerde gelişen normal, preneoplastik ve ESCC lezyonlarını temsil eden murin özofagus 3D organoidleri (MEO'lar) üretmek için ayrıntılı protokoller sunuyoruz. C57BL/6 gibi yaygın laboratuvar suşları ve hücre soyu izlenebilir ve diğer genetiği değiştirilmiş türevleri de dahil olmak üzere çeşitli fare suşları kullanılabilir. Normal veya hastalıklı murin özofagus epitelinin izolasyonu, tek hücreli süspansiyonların hazırlanması, büyüyen 3D organoidlerin yetiştirilmesi ve izlenmesi, alt kültür, kriyoprezervasyon ve morfoloji ve diğer uygulamalar dahil olmak üzere sonraki analizler için işleme dahil olmak üzere kilit adımları vurguluyoruz.
Protokol
Murin deneyleri, yönetmeliklere uygun olarak ve hayvan protokolü #AABB1502 kapsamında planlanmış ve gerçekleştirilmiş, Columbia Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından gözden geçirilmiş ve onaylanmıştır. Fareler, farelerin insancıl muamelesini sağlayan ve fareler için uygun veteriner bakımı ve laboratuvar personeli için laboratuvar güvenliği eğitimi sağlayan uygun bir hayvan bakım tesisine yerleştirildi.
1. Özofagus IEN ve ESCC lezyonlarını indüklemek için farelerin 4NQO ile tedavisi (zaman değerlendirmesi: 28 haftaya kadar)
NOT: Neoplastik özofagus lezyonlarını temsil eden MEO'lar üretmek için, fareler Tang ve ark.14 tarafından daha önce tarif edildiği gibi 4NQO aracılı kimyasal karsinogeneze tabi tutulur. Normal/neoplastik olmayan MEO'lar tedavi edilmemiş farelerden üretilir.
- Fare
- Kafes başına dört ila beş fareyi barındırın ve bir deneye başlamadan önce en az 1 hafta boyunca hayvan tesisine alıştırın. Yaşa bağlı bozuklukların 28 haftalık deneyin erken sonlandırılmasına neden olma olasılığını azaltmak için, 8 haftalıktan 16 haftalığa kadar olan farelerle başlayın.
NOT: Bu protokolde yaklaşık 20-30 g ağırlığındaki C57BL/6 fareler kullanılmıştır. Daha kısa deneyler için, yaşlı fareler kullanılabilir. Erkek veya dişi fareler kabul edilebilir. Kontrol (tedavi yok, bakınız bölüm 1.3.1) fareler yaş ve cinsiyet olarak eşleştirilmelidir.
- Kafes başına dört ila beş fareyi barındırın ve bir deneye başlamadan önce en az 1 hafta boyunca hayvan tesisine alıştırın. Yaşa bağlı bozuklukların 28 haftalık deneyin erken sonlandırılmasına neden olma olasılığını azaltmak için, 8 haftalıktan 16 haftalığa kadar olan farelerle başlayın.
- 4NQO içeren içme suyunun hazırlanması
- Etilen propilen glikolde 1 mg/mL 4NQO stok çözeltisi hazırlayın (Malzeme Tablosu). 100 mg 4NQO'yu, sızdırmazlık filmi ile kaplı 500 mL'lik bir cam beherde 100 mL% 99.9 etilen propilen glikol içinde çözün. Oda sıcaklığında (RT) 800 rpm'de manyetik bir karıştırıcı kullanarak 30 dakika boyunca iyice karıştırın. 4 °C'de saklayın.
- 100 mL 1 mg/mL 4NQO stok çözeltisine 900 mL otoklavlanmış deiyonize su ekleyin ve sızdırmazlık filmi ile kaplanmış 2 L'lik plastik dereceli bir silindirde ters çevirerek karıştırın. % 10 etilen propilen glikol içinde 1 L 100 μg / mL 4NQO hacmi, 500 mL'lik bir içme şişesi ile donatılmış iki fare kafesine hizmet edecektir.
DİKKAT: Not olarak, 4NQO kansere neden olabilecek sentetik bir kimyasal kanserojendir. Nitril eldivenler ve uzun kollu bir laboratuvar önlüğü ile kullanın ve kapalı burunlu ayakkabılar giyin. Uygun göz koruması, yüz koruması ve baş örtüsünü düşünün. Atık bertarafı için 4NQO, çevre sağlığı ve güvenliği tarafından tehlikeli atık yönetimi için kurumsal yönergelere uygun olarak etiketli bir kaba yerleştirilmelidir.
- 4NQO ile tedavi ve izleme
- İçme şişesini takın ve 4NQO'yu içme suyu ad libitum yoluyla farelere 16 hafta boyunca uygulayın. Araç kontrolü olarak %10 (w/v) propilen glikol kullanın (tedavi yok).
NOT: IEN'i indüklemek için daha kısa süreli 4NQO tedavisi kullanılabilir. - Suyu haftada bir kez doldurun.
- Her fareyi laboratuvar terazisindeki plastik bir kaba koyarak haftalık olarak tartın.
- 16 haftalık 4NQO tedavi süresinin sonunda, farelere 4NQO sonrası gözlem süresi boyunca 12 haftaya kadar düzenli içme suyu vermeye başlayın (Şekil 1).
- Fareleri günlük olarak sıkıntı belirtileri (örneğin, bozulmuş hareketlilik, kambur habitus ve geri çekilmiş davranış), disfaji ve dehidrasyon açısından izleyin. Ek olarak, fareleri vücut ağırlığındaki veya yiyecek ve sıvı alımındaki değişiklikler için haftalık olarak değerlendirin. Vücut ağırlığı ilk vücut ağırlığından% 10'dan fazla düşerse, fareleri sıvı bir diyet takviyesi ile besleyin.
NOT: Sıvı diyet takviyelerine dirençli vücut ağırlığı kaybı ESCC'nin göstergesi olabilir ve vücut ağırlığının% 20'sinden fazlasını kaybeden fareler ötenazi yapılmalıdır. Önemli olarak, MEO'lar erken ötenazi yapılmış farelerden üretilebilir. Genetik modifikasyonları olmayan C57BL/6 farelerin tipik olarak morbidite belirtileri göstermediğini veya 4NQO sonrası gözlem periyodunun sonuna kadar görünür ESCC lezyonlarına sahip olmadığını unutmayın.
- İçme şişesini takın ve 4NQO'yu içme suyu ad libitum yoluyla farelere 16 hafta boyunca uygulayın. Araç kontrolü olarak %10 (w/v) propilen glikol kullanın (tedavi yok).
- Hayvan hazırlama
- Fareleri, CO2 ile doldurulmuş bir CO2 odasında, dakikada oda hacminin% 30-70'ini değiştiren bir akış hızında ötenazi yapın. Servikal çıkık ile ölümü onaylayın.
- Sırtüstü pozisyonda farenin uzuvlarını ve burnunu 21 G iğne kullanarak diseksiyon platformuna sabitleyin.
- Farenin ventral yüzeyini% 70 etanol ile dezenfekte edin.
- Diseksiyon (zaman değerlendirmesi: 0,5 saat)
- Aşağıdaki iç organlardan salınmasını sağlamak için orta karın kürkünü ve cildi sıkıştırarak cildi açın. Alt karın bölgesinden çeneye kraniyokaudal, ventral orta hat insizyonu yapmak için cerrahi makası kullanın.
- Orta hat insizyonundan başlayarak, farenin her iki tarafındaki uzuvlara uzanan radyal kesikler yapmak için cerrahi makas kullanın. Flay cilt kapakları açın.
- Servikal trakeayı açığa çıkarmak için, tükürük bezlerini orta hatta bölmek için diseksiyon makası kullanın. Trakea bezlerin derinliklerinde bulunur.
- Torasik trakeayı açığa çıkarmak için sternumu çıkarın.
- Peritonu forseps ile hafifçe sıkıştırın ve kaldırın ve peritonu, göğüs kafesi boyunca kraniyoaudal ve lateral olarak bölmek için makas kullanın.
- Karaciğeri diyaframın kaudal yüzeyinden yavaşça geri çekin ve sternal çentikteki diyaframda, özellikle ksifoid işlemin dorsal yüzeyinde küçük bir kesi yapmak için makas kullanın. Bu, akciğeri ve kalbi viseral plevradan serbest bırakır.
- Göğüs kafesini torasik içerikten ayırın. Diyaframdaki insizyona makas yerleştirin ve servikal kuşağa kraniyal olarak diseke edin. Bu diseksiyon sırasında, aşağıdaki organlara zarar vermemek için sternumun dorsal yüzeyine yakından tutun. Diseksiyon düzleminin trakeanın önünde olduğundan emin olun.
- Sternumun her iki tarafındaki kaburgaları makas kullanarak kesin ve sternumu çıkarın. Torasik içeriğin açığa çıktığından emin olun.
- Karın yemek borusunu açığa çıkarın. Antrumu forseps ile tutarak mideyi önden yavaşça kaldırın. Dalağı, pankreası ve mezenteri mide ve yemek borusundan makasla diseke edin.
- Torasik özofagusu açığa çıkarın (Şekil 2).
- Trakeayı derhal kaudal olarak tiroid kıkırdağına yavaşça kaldırın ve iris makası kullanarak trakeanın dorsal tarafının yemek borusunu diseke edin.
- Tiroid kıkırdağındaki trakeayı iris makası ile bölün.
- Trakeayı özofagusun geri kalanından kaudal yönde dikkatli bir diseksiyonla soyun.
- Akciğeri, kalbi ve timusu trakea ile topluca çıkarın. Aort ve vena kavayı diseke ederken ve bölerken yemek borusuna zarar vermemeye özen gösterin.
- Mideyi pilorda makasla bölün.
- Antrumu forseps ile tutarak ve kraniyal olarak diseksiyon yaparak yemek borusunu omurdan ayırın.
- Yemek borusunu tiroid kıkırdağı seviyesinde bölün ve yemek borusu ile mideyi topluca toplayın (Şekil 3).
- Kardiyadaki yemek borusunu bölerek mide ve yemek borusunu ayırın (Şekil 4, üst panel, kırmızı çizgi).
- Yemek borusunun dış yüzeyindeki herhangi bir fasyayı diseke edin. Histoloji için bir örnek ayırmak için (isteğe bağlı), yemek borusunun yarısını çıkarın ve uzunlamasına makasla bölün. Kalan sağlam yemek borusunu buz üzerinde soğuk PBS'ye yerleştirin.
- Mideyi daha büyük eğrilik boyunca açın ve PBS ile yeterince yıkayın. Ön mideyi ayırın ve soğuk PBS ile yıkayın. Ön mideyi buz üzerinde soğuk PBS'ye yerleştirin.
- Dili hasat etmek için, burun üzerindeki 21 G iğnesini çıkarın ve dili cımbızla çekin. Dili mümkün olduğunca uzun süre kesin. Dili buz üzerinde soğuk PBS'ye yerleştirin.
2. Murin özofagus organoid (MEO) kültürünün oluşturulması
NOT: Bu protokol, tripsinizasyondan önce dil dokusunun kıyıldığı bir adımın eklenmesiyle bir murin dili organoid kültürü oluşturmak için de kullanılabilir. Adım 2.2.3'teki nota bakın.
- Reaktiflerin hazırlanması
NOT: Reaktiflerin bir listesi Malzeme Tablosunda bulunabilir. Aksi belirtilmedikçe, stok çözümlerini üreticinin talimatlarına göre hazırlayın ve saklayın.- Bu protokolde kullanılan bazal membran matrisinin (BME) tek kullanımlık alikotlarının kullanım gününe kadar -20 ° C'de saklandığından, daha sonra buz üzerinde veya 2-8 ° C'de çözüldüğünden ve kullanılmadığında her zaman buz üzerinde tutulduğundan emin olun.
- 250 mg soya fasulyesi tripsin inhibitörünü (CYBE) 1.000 mL PBS (250 mg/mL stok konsantrasyonu) içinde çözün ve filtreleyerek sterilize edin (0.22 μm). Konik tüplere 50 mL alikot dağıtın ve 4 ° C'de 6 aya kadar saklayın.
- Fare organoid ortamını (MOM) hazırlayın: 1 mM N-asetil-L-sistein (NAC),% 2 R-Spondin ve Noggin şartlandırılmış ortam (RN CM), 1x N-2 takviyesi, 1x B-27 takviyesi, 10 mM HEPES, 1x antibiyotik-antimikotik, 1x GlutaMAX takviyesi ve 100 ng / mL fare epidermal büyüme faktörü (mEGF) ile gelişmiş DMEM / F12 takviyesi yapın. MOM 500 mL'yi bir seferde hazırlayın, 50 mL aliquots'a bölün ve kullanıma hazır olana kadar 2-8 ° C'de saklayın. Kullanımdan hemen önce 0,5 μg/mL amfoterisin B ve 10 μM Y-27632 ekleyin.
- Kullanmadan önce MOM,% 0.25 tripsin ve soya fasulyesi tripsin inhibitörünü (CYBE) bir su veya boncuk banyosunda 37 ° C'ye ısıtın.
- Keratinositlerin disseke edilmiş fare dokusundan izolasyonu (zaman değerlendirmesi: 2 saat)
- Özofagus dokusunu PBS'de 500 μL dispaza (toplam 2.5-5 ünite) aktarın ve 37 ° C ve 800 rpm'de 10 dakika boyunca bir termomikserde inkübe edin.
- Dokuyu bir kültür kabına aktarın ve forseps kullanarak kas tabakasını epitelden dikkatlice çıkarın (Şekil 4).
NOT: Bu adım, dispaz ile inkübasyondan önce deneyimli bir araştırmacı tarafından da gerçekleştirilebilir. - Epiteli 500 μL% 0.25 tripsin içeren bir mikrosantrifüj tüpüne aktarın ve 37 ° C ve 800 rpm'de 10 dakika boyunca bir termomikserde inkübe edin.
NOT: Başlangıç materyali dil dokusu ise, tripsin eklemeden önce dokuyu steril bir neşterle yaklaşık 1-2mm2 boyutunda daha küçük parçalara bölün. - Dokuyu pelet etmek için 2.000 x g'de 5-10 s boyunca kısaca santrifüj. 100 μm hücre süzgeci ile 50 mL'lik bir konik tüp hazırlayın. Doku/hücre süspansiyonunu dairesel hareketler kullanarak geniş bir delik ucu ile süzgeçten geçirin.
- Yıkamak için dairesel hareketler kullanarak süzgeçten 3 mL STI ekleyin.
- Hücreleri itmek için süzgeci 1 mL'lik bir tüberkülin şırınga pistonunun tabanıyla ovalayın.
- Süzgeci 3 mL PBS ile 3-5 kez yıkayın, süzgeci yıkamalar arasında şırınganın tabanıyla yıkayın.
- Hücreleri pelet haline getirmek için tüpü 300 x g'de 4 ° C'de 10 dakika boyunca santrifüj edin.
- Tüpte 1 mL çözelti bırakarak süpernatanı çıkarın.
- Peletin kalan 1 mL'de yeniden askıya alınması ve hücre süspansiyonunun 70 μm'lik bir hücre süzgecinden yeni bir 50 mL konik tüpe aktarılması.
- Hücreleri pelet haline getirmek için tüpü 300 x g'de 4 ° C'de 10 dakika boyunca santrifüj edin.
- Peletin 100 μL MOM'da yeniden askıya alınması; Ses seviyesini gerektiği gibi ayarlayın. Tripan mavisi dışlama ile otomatik hücre sayımı gerçekleştirin.
- İlk hücre süspansiyonunun tohumlanması (zaman değerlendirmesi: <1 saat)
- 24 delikli bir hücre kültürü plakasını 37 ° C'lik bir inkübatörde önceden ısıtın.
- Kuyu başına 50 μL toplam hacim ile %75 (v/v) BME/MOM cinsinden 5.000 canlı hücreyi plakalayın. Kaplanmış kuyucuk sayısını en üst düzeye çıkarın ve aşağıdaki örnek hesaplamalara göre BME'de fazladan bir kuyu için yeterli hücre hazırlayın.
NOT: Kriyoprezervasyon ortamındaki fazla hücreleri (FBS'de %10 DMSO) maksimum 1 x 106 hücre/mL konsantrasyonda kriyoprotekte edin. Kriyovyalleri gece boyunca -80 ° C'de dondurucu bir kapta saklayın. Uzun süreli depolama için buhar fazlı sıvı azota aktarın. - Bir mikrosantrifüj tüpünde, önce MOM'da uygun bir hücre seyreltmesi hazırlayın ve ardından kaplamadan hemen önce geniş bir delik ucu kullanarak BME ekleyin.
- 200 μL genişliğinde bir delik ucu kullanarak, kuyunun ortasına yavaşça 50 μL'lik bir damlacık ekleyin ve uç ile kuyunun alt veya yanları arasındaki teması önleyin (Şekil 5). Sıvıyı uçtan atmak için çok fazla güç kullanmamaya dikkat edin, aksi takdirde kubbe düzleşir.
- BME'nin 37 °C, %5 CO2, %95 bağıl nem (RH) inkübatöründe 30 dakika boyunca katılaşmasına izin verin.
- 0.5 μg / mL amfoterisin B ve 10 μM Y-27632 ile desteklenmiş kuyucuk başına dikkatlice 500 μL MOM ekleyin.
NOT: İlk birincil kültür boyunca tüm MOM'a amfoterisin ekleyin. Tüm pasajlar için Y-27632'yi yalnızca geçiş gününde (0. gün) ekleyin. - MOM'u 3-4. günlerde ve daha sonra geçmeye hazır olana kadar her 2-3 günde bir değiştirin.
- 7-10. günlerde, organoidleri görüntüleyin ve başlangıçta tohumlanan hücrelerin sayısına göre oluşan organoid sayısını bölerek organoid oluşum hızını (OFR) ölçün.
Örnek hesaplamalar: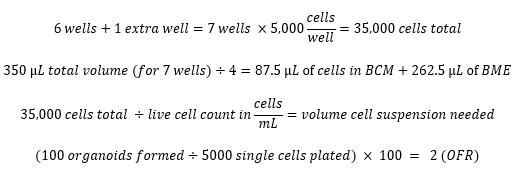
- Murin özofagus organoidlerinin (MEO'lar) depassajı ve kriyoprezervasyonu (zaman değerlendirmesi: <1.5 saat)
- BME'yi çözün ve buz üzerinde tutun. Kullanmadan önce MOM,% 0.05 tripsin ve STI'yı bir su veya boncuk banyosunda 37 ° C'ye ısıtın. 24 delikli bir hücre kültürü plakasını 37 ° C'lik bir inkübatörde önceden ısıtın.
- Geniş delikli bir mikropipet ucu kullanarak, BME kubbesindeki organoidleri süpernatan ile birlikte toplayın. Yukarı ve aşağı pipetleme yaparak BME'yi bozun.
NOT: Aynı numuneleri içeren kuyucukları tek bir mikrosantrifüj tüpünde birleştirin. - Organoidleri pelet haline getirmek için 2.000 x g'de 10-15 s boyunca kısaca santrifüj. Supernatan'ı çıkarın ve atın.
- Peletleri yavaşça yerinden çıkarın ve peleti% 0.05 tripsin 500 μL'de yeniden askıya alın.
- Tüpleri bir termomikserde 37 ° C'de ve 800 rpm'de 10 dakika boyunca inkübe edin.
- Tripsini 600 μL CYBE ile etkisiz hale getirin.
- Hücreleri pelet haline getirmek için tüpü 300 x g'de 4 ° C'de 5 dakika boyunca santrifüj edin.
- Supernatan'ı çıkarın ve atın. Hücre peletini 100 μL MOM'da yeniden askıya alın. Tripan mavisi dışlama ile otomatik hücre sayımı gerçekleştirin.
NOT: Ses seviyesi gerektiği gibi ayarlanabilir. - Kuyu başına 50 μL toplam hacim ile% 75 (v / v) BME / MOM içinde 2.000-5.000 canlı hücreyi plakalayın. Kaplanmış kuyucuk sayısını en üst düzeye çıkarın ve daha önce bahsedilen örnek hesaplamalara göre BME'de fazladan bir kuyu için yeterli hücre hazırlayın.
NOT: Kriyoprezervasyon ortamındaki fazla hücreleri (FBS'de %10 DMSO) maksimum 1 x 106 hücre/mL konsantrasyonda kriyoprotekte edin. Kriyovyalleri gece boyunca -80 ° C'de dondurucu bir kapta saklayın. Uzun süreli depolama için buhar fazlı sıvı azota aktarın. - Bir mikrosantrifüj tüpünde, önce MOM'da uygun bir hücre seyreltmesi hazırlayın ve ardından kaplamadan hemen önce geniş bir delik ucu kullanarak BME ekleyin.
- 200 μL genişliğinde bir delik ucu kullanarak, kuyunun ortasına yavaşça 50 μL'lik bir damlacık ekleyin ve uç ile kuyunun alt veya yanları arasındaki teması önleyin. Sıvıyı uçtan atmak için çok fazla güç kullanmamaya dikkat edin, aksi takdirde kubbe düzleşir.
- Plakayı 37 ° C,% 5 CO,% 2,95 RH inkübatörde 30 dakika boyunca inkübe edin.
- 10 μM Y-27632 ile desteklenmiş kuyucuk başına dikkatlice 500 μL MOM ekleyin.
NOT: Y-27632'yi yalnızca geçiş gününde (0. gün) ekleyin. Medya değişiklikleri sırasında eklemek gereksizdir. Amfoterisin B eklenmesi artık gerekli değildir. - MOM'u 3-4. günlerde ve daha sonra geçmeye hazır olana kadar her 2-3 günde bir değiştirin.
- 7-10. günlerde, organoidleri görüntüleyin ve OFR'yi ölçün.
- Murin özofagus organoidlerinin (MEO'lar) çözülmesi ve iyileşmesi (zaman değerlendirmesi: <1 saat)
- BME'yi çözün ve buz üzerinde tutun. 24 delikli bir hücre kültürü plakasını 37 ° C'lik bir inkübatörde önceden ısıtın.
- 15 mL'lik bir konik tüpte 10 mL soğuk veya RT MOM veya PBS hazırlayın.
- Bir kriyovyal 37 ° C'lik bir su banyosunda veya boncuk banyosunda yaklaşık 30 s ila 1 dakika boyunca veya küçük bir buz topağı kalana kadar çözün.
- Önceden ıslatılmış bir pipet ucu ile, hücre süspansiyonunu yavaşça MOM veya PBS içeren tüpe damla şeklinde aktarın.
- Hücreleri pelet haline getirmek için tüpü 300 x g ve 4 ° C boyunca 5 dakika boyunca santrifüj edin.
- Supernatan'ı çıkarın ve atın. Hücre peletini 100 μL MOM'da yeniden askıya alın; Ses seviyesini gerektiği gibi ayarlayın. Tripan mavisi dışlama ile otomatik hücre sayımı gerçekleştirin.
- Kuyu başına 50 μL toplam hacim ile% 75 (v / v) BME / MOM içinde 5.000-10.000 canlı hücreyi plakalayın. Kaplanmış kuyucuk sayısını en üst düzeye çıkarın ve daha önce bahsedilen örnek hesaplamalara göre BME'de fazladan bir kuyu için yeterli hücre hazırlayın.
- Murin özofagus organoidlerinin (MEO) geçişi ve kriyoprezervasyonu için protokolün kalan adımlarıyla devam edin (bkz. adım 2.4.11).
3. Parafin gömme için organoidlerin hazırlanması (zaman değerlendirmesi: <1 saat [artı reaktif hazırlığı için 1,5 saat])
- Geniş delikli bir mikropipet ucu kullanarak, mikrosantrifüj tüpü başına üç kuyucuk toplayın. BME kubbesindeki organoidleri süpernatan ile birlikte toplayın. Yukarı ve aşağı pipetleme yaparak BME'yi bozun.
- Organoidleri pelet haline getirmek için 2.000 x g'de 10-15 s boyunca kısaca santrifüj. Supernatan'ı çıkarın ve atın.
- Peletleri yavaşça yerinden çıkarın ve peleti 300 μL% 4 paraformaldehit (PFA) içinde yeniden askıya alın.
- Organoidleri gece boyunca 4 ° C'de sabitleyin.
- Organoidleri pelet haline getirmek için 2.000 x g'de 10-15 s boyunca kısaca santrifüj. Mümkün olduğunca fazla PFA'yı çıkarın ve atın.
- Peletleri yavaşça yerinden çıkarın ve peletleri 500 μL PBS içinde yeniden askıya alın.
NOT: Sabit organoidler, bir sonraki adıma geçmeden önce 2 haftaya kadar 4 ° C'de saklanabilir. - 50 mL'lik bir agar jeli stoğu hazırlayın (% 2 agar artı% 2.5 jelatin).
NOT: Kuluçka süresi nedeniyle agar jel stoğunu önceden hazırlayın, ardından otoklav döngüsünü gerçekleştirin.- 150 mL otoklavlanabilir cam kapta 50 mL suda 1 g Bacto-agar ve 1.25 g jelatini tekrar askıya alın.
- Süspansiyonu döndürün ve RT'de 30-60 dakika bekletin.
- 121 °C'de 20 dakika otoklav.
- Hafifçe soğutun ve 15 mL konik tüplerde 5 mL alikot dağıtın.
- RT'de 6 aya kadar saklayın.
- Bir mikrosantrifüj tüp rafını ters çevirerek ve yüzeyi bir sızdırmazlık filmi tabakası ile kaplayarak bir gömme yüzeyi hazırlayın. İlgili organoid kimlik(ler)i ile etiketleyin.
- Organoidleri pelet haline getirmek için tüpü 300 x g'de 5 dakika boyunca santrifüjleyin. Supernatan'ı çıkarın ve atın.
- Bu arada, agar jelini içeren 15 mL'lik bir konik tüpü 100 mL su içeren 150 mL'lik bir cam kabın içine yerleştirerek ve 1-2 dakika boyunca veya su kaynamaya başlayana ve agar jeli sıvı halde olana kadar en yüksek güç ayarında mikrodalgada dalgalandırarak agar jelini sıvılaştırın.
DİKKAT: Mikrodalgadan önce agar jelini içeren konik tüpün kapağını gevşetin. - Organoid pelet içeren mikrosantrifüj tüpünü, mikrosantrifüj tüpüne herhangi bir su sokmadan kısmen ılık suya batırın.
- Tüpün yan tarafına 50 μL agar ekleyerek organoid peleti dikkatlice yerleştirin.
- Pelet rahatsız etmeden (yeniden askıya almayın, pelet bozulmadan tutun), peleti agar jel damlacığındaki gömme yüzeyindeki sızdırmazlık filmine aktarın.
- Kalan organoid peletleri toplamak için adım 3.12 ve adım 3.13'ü ilave 50 μL sıvı agar jeli ile tekrarlayın ve aynı jel damlacığına dikkatlice ekleyin.
- Organoid pelet içeren damlacığı 4 ° C'de 45 dakika boyunca inkübe edin.
- Forseps kullanarak, organoid pelet içeren damlacığı etiketli bir patoloji kasetine dikkatlice aktarın.
- Kaseti 4 °C'de %70 etanol içinde 1 aya kadar saklayın.
- Parafin blokları hazırlamak için rutin histolojik işlem yoluyla parafin gömme işlemine devam edin.
Sonuçlar
Bu protokol, içme suyunda uygulanan 16 haftalık 4NQO'dan oluşan spesifik bir tedavi rejimine göre normal özofagus dokusundan veya 4NQO ile tedavi edilen farelerden ESCC tümör dokusundan murin özofagus organoidleri (MEO'lar) üretme sürecini ve ardından 10 hafta ila 12 haftalık bir gözlem süresini tanımlar (Şekil 1). Fareler daha sonra dilin veya özofagus dokusunun diseksiyonu için ötenazi yapılır (Şekil 2 ve Şekil 3
Tartışmalar
Burada açıklanan protokollerde MEO'ların oluşturulması ve analizi için birkaç kritik adım ve husus vardır. MEO deneylerinde tekrarlanabilirliği ve titizliği sağlamak için, biyolojik ve teknik kopyaların her ikisi de önemlidir. Biyolojik replikalar için, ESCC taşıyan iki ila üç bağımsız fare genellikle deneysel koşul başına yeterlidir. Bununla birlikte, uygun biyolojik replika sayısı, bireysel çalışmalarda test edilecek parametrelere bağlı olarak değişebilir. Örneğin, makroskopik olara...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Teknik destek için Columbia Üniversitesi'ndeki Herbert Irving Kapsamlı Kanser Merkezi'ndeki Ortak Kaynaklara (Akış Sitometrisi, Moleküler Patoloji ve Konfokal ve Özel Mikroskopi) teşekkür ederiz. Dr. Alan Diehl, Adam J. Bass ve Kwok-Kin Wong'a (NCI P01 Özofagus Karsinogenezinin Mekanizmaları) ve Rustgi ve Nakagawa laboratuvarlarının üyelerine yararlı tartışmalar için teşekkür ederiz. Bu çalışma aşağıdaki NIH Hibeleri ile desteklenmiştir: P01CA098101 (H.N. ve A.K.R.), R01DK114436 (H.N.), R01AA026297 (H.N.), L30CA264714 (S.F.), DE031112-01 (F.M.H.), KL2TR001874 (F.M.H.),3R01CA255298-01S1 (J.G.), 2L30DK126621-02
(J.G.) R01CA266978 (C.L.), R01DK132251 (C.L.), R01DE031873 (C.L.), P30DK132710 (C.M. ve H.N.) ve P30CA013696 (AKR.) H.N. ve C.L., Columbia Üniversitesi Herbert Irving Kapsamlı Kanser Merkezi Multi-PI Pilot Ödülü'nü aldı. H.N., Fanconi Anemi Araştırma Fonu Ödülü'nün sahibidir. F.M.H., Mark Vakfı Kanser Araştırma Ödülü (20-60-51-MOME) ve Amerikan Kanser Araştırmaları Derneği Ödülü'nün sahibidir. J.G., Amerikan Gastroenteroloji Derneği (AGA) ödülünün sahibidir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.05% trypsin-EDTA | Thermo Fisher Scientific | 25-300-120 | |
| 0.25% trypsin-EDTA | Thermo Fisher Scientific | 25-200-114 | |
| 0.4% Trypan Blue | Thermo Fisher Scientific | T10282 | |
| 1 mL tuberculin syringe without needle | BD | 309659 | |
| 1.5 mL microcentrifuge tube | Thermo Fisher Scientific | 05-408-129 | |
| 100 µm cell strainer | Thermo Fisher Scientific | 22363549 | |
| 15 mL conical tubes | Thermo Fisher Scientific | 14-959-53A | |
| 200 µL wide bore micropipette tips | Thermo Fisher Scientific | 212361A | |
| 21 G needles | BD | 305167 | |
| 24 well plate | Thermo Fisher Scientific | 12-556-006 | |
| 4-Nitroquinoline-1-oxide (4NQO) | Tokyo Chemical Industry | NO250 | |
| 50 mL conical tubes | Thermo Fisher Scientific | 12-565-270 | |
| 6 well plate | Thermo Fisher Scientific | 12556004 | |
| 70 µm cell strainer | Thermo Fisher Scientific | 22363548 | |
| 99.9% ethylene propylene glycol | SK picglobal | ||
| Advanced DMEM/F12 | Thermo Fisher Scientific | 12634028 | |
| Amphotericin B | Gibco, Thermo Fisher Scientific | 15290018 | Stock concentration 250 µg/mL, final concentration 0.5 µg/mL |
| Antibiotic-Antimycotic | Thermo Fisher Scientific | 15240062 | Stock concentration 100x, final concentration 1x |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | Stock concentration 50x, final concentration 1x |
| Bacto agar | BD | 214010 | |
| CO2 incubator, e.g.Heracell 150i | Thermo Fisher Scientific | 51026406 | or equivalent |
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | AMQAX1000 | or equivalent |
| Cryovials | Thermo Fisher Scientific | 03-337-7D | |
| DietGel 76A | Clear H2O | 72-07-5022 | |
| Dimethyl sulfoxide (DMSO) | MilliporeSigma | D4540 | |
| Dispase | Corning | 354235 | Stock concentration 50 U/mL, final concentration 2.5–5 U/mL |
| Dissecting scissors | VWR | 25870-002 | |
| Dulbecco's phosphate-buffered saline (PBS) | Thermo Fisher Scientific | 14190250 | Stock concentration 1x |
| Fetal bovine serum (FBS) | HyClone | SH30071.03 | |
| Forceps | VWR | 82027-386 | |
| Freezing container | Corning | 432002 | or equivalent |
| Gelatin | Thermo Fisher Scientific | G7-500 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | Stock concentration 100x, final concentration 1x |
| HEPES | Thermo Fisher Scientific | 15630080 | Stock concentration 1 M, final concentration 10 mM |
| Hot plate/stirrer | Corning | PC-420D | or equivalent |
| Lab Armor bead bath (or water bath) | VWR | 89409-222 | or equivalent |
| Laboratory balance | Ohaus | 71142841 | or equivalent |
| Matrigel basement membrane extract (BME) | Corning | 354234 | |
| Microcentrifuge Minispin | Eppendorf | 22620100 | or equivalent |
| Microcentrifuge tube rack | Southern Labware | 0061 | |
| N-2 supplement | Thermo Fisher Scientific | 17502048 | Stock concentration 100x, final concentration 1x |
| N-acetylcysteine (NAC) | Sigma-Aldrich | A9165 | Stock concentration 0.5 M, final concentration 1 mM |
| Parafilm M wrap | Thermo Fisher Scientific | S37440 | |
| Paraformaldehyde (PFA) | MilliporeSigma | 158127-500G | |
| Pathology cassette | Thermo Fisher Scientific | 22-272416 | |
| Phase-contrast microscope | Nikon | or equivalent | |
| Recombinant mouse epidermal growth factor (mEGF) | Peprotech | 315-09-1mg | Stock concentration 500 ng/µL, final concentration 100 ng/mL |
| RN cell-conditioned medium expressing R-Spondin1 and Noggin (RN CM) | N/A | N/A | Available through the Organoid and Cell Culture Core upon request, final concentration 2% |
| Sorval ST 16R centrifuge | Thermo Fisher Scientific | 75004380 | or equivalent |
| Soybean trypsin inhibitor (STI) | MilliporeSigma | T9128 | Stock concentration 250 µg/mL |
| ThermoMixer C | Thermo Fisher Scientific | 14-285-562 PM | or equivalent |
| Y-27632 | Selleck Chemicals | S1049 | Stock concentration 10 mM, final concentration 10 µM |
Referanslar
- Rustgi, A. K., El-Serag, H. B. Esophageal carcinoma. The New England Journal of Medicine. 371 (26), 2499-2509 (2014).
- Dotto, G. P., Rustgi, A. K. Squamous cell cancers: A unified perspective on biology and genetics. Cancer Cell. 29 (5), 622-637 (2016).
- Giroux, V., et al. Long-lived keratin 15+ esophageal progenitor cells contribute to homeostasis and regeneration. The Journal of Clinical Investigation. 127 (6), 2378-2391 (2017).
- DeWard, A. D., Cramer, J., Lagasse, E. Cellular heterogeneity in the mouse esophagus implicates the presence of a nonquiescent epithelial stem cell population. Cell Reports. 9 (2), 701-711 (2014).
- Kinugasa, H., et al. Mitochondrial SOD2 regulates epithelial-mesenchymal transition and cell populations defined by differential CD44 expression. Oncogene. 34 (41), 5229-5239 (2015).
- Whelan, K. A., et al. Autophagy supports generation of cells with high CD44 expression via modulation of oxidative stress and Parkin-mediated mitochondrial clearance. Oncogene. 36 (34), 4843-4858 (2017).
- Natsuizaka, M., et al. Interplay between Notch1 and Notch3 promotes EMT and tumor initiation in squamous cell carcinoma. Nature Communications. 8 (1), 1758 (2017).
- Whelan, K. A., Muir, A. B., Nakagawa, H. Esophageal 3D culture systems as modeling tools in esophageal epithelial pathobiology and personalized medicine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 461-478 (2018).
- Sachdeva, U. M., et al. Understanding the cellular origin and progression of esophageal cancer using esophageal organoids. Cancer Letters. 509, 39-52 (2021).
- Nakagawa, H., et al. The targeting of the cyclin D1 oncogene by an Epstein-Barr virus promoter in transgenic mice causes dysplasia in the tongue, esophagus and forestomach. Oncogene. 14 (10), 1185-1190 (1997).
- Andl, C. D., et al. Epidermal growth factor receptor mediates increased cell proliferation, migration, and aggregation in esophageal keratinocytes in vitro and in vivo. The Journal of Biological Chemistry. 278 (3), 1824-1830 (2003).
- Opitz, O. G., et al. A mouse model of human oral-esophageal cancer. The Journal of Clinical Investigation. 110 (6), 761-769 (2002).
- Stairs, D. B., et al. Deletion of p120-catenin results in a tumor microenvironment with inflammation and cancer that establishes it as a tumor suppressor gene. Cancer Cell. 19 (4), 470-483 (2011).
- Tang, X. -. H., Knudsen, B., Bemis, D., Tickoo, S., Gudas, L. J. Oral cavity and esophageal carcinogenesis modeled in carcinogen-treated mice. Clinical Cancer Research. 10, 301-313 (2004).
- Fong, L. Y. Y., Mancini, R., Nakagawa, H., Rustgi, A. K., Huebner, K. Combined cyclin D1 overexpression and zinc deficiency disrupts cell cycle and accelerates mouse forestomach carcinogenesis. Cancer Research. 63 (14), 4244-4252 (2003).
- Zheng, B., et al. A new murine esophageal organoid culture method and organoid-based model of esophageal squamous cell neoplasia. iScience. 24 (12), 103440 (2021).
- Hisha, H., et al. Establishment of a novel lingual organoid culture system: generation of organoids having mature keratinized epithelium from adult epithelial stem cells. Scientific Reports. 3, 3224 (2013).
- Kalabis, J., et al. Isolation and characterization of mouse and human esophageal epithelial cells in 3D organotypic culture. Nature Protocols. 7 (2), 235-246 (2012).
- Nguyen, N., et al. TGF-β1 alters esophageal epithelial barrier function by attenuation of claudin-7 in eosinophilic esophagitis. Mucosal Immunology. 11 (2), 415-426 (2018).
- Sherrill, J. D., et al. Analysis and expansion of the eosinophilic esophagitis transcriptome by RNA sequencing. Genes and Immunity. 15 (6), 361-369 (2014).
- Ruffner, M. A., et al. Toll-like receptor 2 stimulation augments esophageal barrier integrity. Allergy. 74 (12), 2449-2460 (2019).
- Kabir, M. F., et al. Single cell transcriptomic analysis reveals cellular diversity of murine esophageal epithelium. Nature Communications. 13 (1), 1-15 (2022).
- Shimonosono, M., et al. Alcohol metabolism enriches squamous cell carcinoma cancer stem cells that survive oxidative stress via autophagy. Biomolecules. 11 (10), 1479 (2021).
- Flashner, S., Yan, K. S., Nakagawa, H. 3D organoids: An untapped platform for studying host-microbiome interactions in esophageal cancers. Microorganisms. 9 (11), 2182 (2021).
- Liu, K., et al. Sox2 cooperates with inflammation-mediated stat3 activation in the malignant transformation of foregut basal progenitor cells. Cell Stem Cell. 12 (3), 304-315 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır