Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelado del carcinoma de células escamosas oral-esofágico en organoides 3D
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe los pasos clave para generar y caracterizar organoides 3D oralesesofágicos murinos que representan lesiones de carcinoma de células escamosas normales, preneoplásicas y escamosas inducidas a través de carcinogénesis química.
Resumen
El carcinoma de células escamosas de esófago (ESCC) es prevalente en todo el mundo, representa el 90% de todos los casos de cáncer de esófago cada año, y es el más mortal de todos los carcinomas de células escamosas humanas. A pesar del progreso reciente en la definición de los cambios moleculares que acompañan al inicio y desarrollo de ESCC, el pronóstico del paciente sigue siendo malo. La anotación funcional de estos cambios moleculares es el siguiente paso necesario y requiere modelos que capturen las características moleculares de ESCC y puedan manipularse de manera fácil y económica para la anotación funcional. Los ratones tratados con el humo de tabaco mimético 4-nitroquinolina 1-óxido (4NQO) forman previsiblemente ESCC y preneoplasia esofágica. Cabe destacar que las lesiones 4NQO también surgen en la cavidad oral, más comúnmente en la lengua, así como en el estómago anterior, que comparten el epitelio escamoso estratificado. Sin embargo, estos ratones no pueden ser simplemente manipulados para pruebas de hipótesis funcionales, ya que la generación de modelos de ratón isogénicos requiere mucho tiempo y recursos. Aquí, superamos esta limitación mediante la generación de organoides tridimensionales (3D) derivados de células individuales de ratones tratados con 4NQO para caracterizar ESCC murino o células preneoplásicas ex vivo. Estos organoides capturan las características sobresalientes de ESCC y preneoplasia esofágica, pueden aprovecharse de manera económica y rápida para formar modelos isogénicos y pueden utilizarse para experimentos de trasplante singénico. Demostramos cómo generar organoides 3D a partir de tejido esofágico murino normal, preneoplásico y SCC y mantener y criopreservar estos organoides. Las aplicaciones de estos organoides versátiles son amplias e incluyen la utilización de ratones genéticamente modificados y una mayor caracterización por citometría de flujo o inmunohistoquímica, la generación de líneas organoides isogénicas utilizando tecnologías CRISPR y la detección de fármacos o el trasplante singénico. Creemos que la adopción generalizada de las técnicas demostradas en este protocolo acelerará el progreso en este campo para combatir la grave carga de ESCC.
Introducción
El carcinoma de células escamosas de esófago (CCE) es el más mortal de los carcinomas de células escamosas humanas, debido a su diagnóstico tardío, resistencia al tratamiento y metástasis 1,2. ESCC surge del epitelio escamoso estratificado, que recubre la superficie luminal del esófago. El epitelio escamoso está compuesto por células basales proliferativas y células diferenciadas dentro de la capa de células suprabasales. En condiciones fisiológicas, las células basales expresan marcadores como p63, Sox2 y citoqueratina K5 y K14, mientras que las células diferenciadas expresan K4, K13 e IVL. Las células basales en sí mismas son heterogéneas e incluyen células madre putativas definidas por marcadores como K153 y CD734. En la homeostasis, las células basales experimentan una diferenciación terminal postmitótica dentro de la capa de células suprabasales, mientras que las células diferenciadas migran y descaman en la luz para completar la renovación epitelial. Con reminiscencias de sus células de origen, ESCC muestra una diferenciación de células escamosas en diversos grados. El ESCC a menudo se acompaña de lesiones precursoras histológicas multifocales, conocidas como neoplasia intraepitelial (IEN) o displasia, que comprenden células basaloides atípicas. Además de los cambios epiteliales, el ESCC muestra la remodelación tisular dentro del compartimiento subepitelial, donde se produce la activación de fibroblastos asociados al cáncer (CAF) y el reclutamiento de células inmunes / inflamatorias para fomentar el microambiente promotor de tumores.
La patogénesis de ESCC implica cambios genéticos y exposición a factores de riesgo ambientales. Las lesiones genéticas clave incluyen la inactivación de los genes supresores de tumores TP53 y CDKN2A (p16INK4A) y la activación de los oncogenes CCND1 (ciclina D1) y EGFR, que culminan en una función deteriorada del punto de control del ciclo celular, proliferación aberrante y supervivencia bajo estrés genotóxico relacionado con la exposición a carcinógenos ambientales. De hecho, los cambios genéticos interactúan estrechamente con los factores de riesgo conductuales y ambientales, más comúnmente el consumo de tabaco y alcohol. El humo del tabaco contiene carcinógenos humanos como el acetaldehído, que también es el principal metabolito del alcohol. El acetaldehído induce aductos de ADN y enlaces cruzados de ADN entre hebras, lo que lleva al daño del ADN y la acumulación de mutaciones en el ADN e inestabilidad cromosómica. Dados los estímulos mitogénicos excesivos y la proliferación aberrante de la activación del oncogén, la transformación maligna de las células epiteliales esofágicas se ve facilitada por mecanismos para hacer frente al estrés genotóxico, incluida la activación de antioxidantes, la autofagia y la transición epitelial-mesenquimal (EMT). Curiosamente, estas funciones citoprotectoras a menudo se activan en las células madre del cáncer ESCC (CSC) que se caracterizan por una alta expresión de CD44 (CD44H) y tienen las capacidades de iniciación tumoral, invasión, metástasis y resistencia a la terapia 5,6,7.
El ESCC ha sido modelado en cultivo celular y en modelos de roedores 8,9. En las últimas tres décadas, se han desarrollado modelos robustos de ratón genéticamente modificados de ESCC. Estos incluyen ratones transgénicos CCND1 y EGFR 10,11 y ratones knockout p53 y p120Ctn 12,13. Sin embargo, los cambios genéticos individuales no suelen dar lugar a ESCC de inicio rápido. Este desafío ha sido superado con el uso de carcinógenos esofágicos que recapitulan bien las lesiones genéticas humanas en ESCC14. Por ejemplo, el óxido de 4-nitroquinolina-1 (4NQO) acelera el desarrollo de ESCC en ratones transgénicos CCND1 15. En los últimos años, las células madre epiteliales esofágicas putativas, las células progenitoras y sus respectivos destinos han sido investigados en modelos de ratón rastreables por linaje celular 3,4. Además, estos ratones rastreables por linaje celular se han utilizado para explorar las células de origen de ESCC y cómo tales células dan lugar a CD44H CSCs a través de histología convencional y caracterización molecular basada en ómicas7.
Un área emergente relacionada con estos modelos de ratón es la aplicación novedosa de técnicas de cultivo celular para analizar células vivas de ESCC y precursoras en un sistema organoide tridimensional (3D) en el que la arquitectura de los tejidos originales se recapitula ex vivo 7,8,9. Estos organoides 3D se cultivan rápidamente a partir de una suspensión unicelular aislada de tejidos murinos, incluidos tumores primarios y metastásicos (por ejemplo, lesiones de ganglios linfáticos, pulmones y hígado). Las células se incrustan en extracto de membrana basal (BME) y se alimentan con un medio de cultivo celular libre de suero bien definido. Los organoides 3D crecen en 7-10 días, y las estructuras esféricas resultantes son susceptibles de subcultivo, criopreservación y ensayos para analizar una variedad de propiedades y funciones celulares, incluidos marcadores CSC, EMT, autofagia, proliferación, diferenciación y muerte celular apoptótica.
Estos métodos se pueden aplicar ampliamente a cultivos de organoides 3D establecidos a partir de cualquier tejido epitelial escamoso estratificado, como la mucosa de la cabeza y el cuello (cavidad oral, lengua, faringe y laringe) e incluso el anteestómago. La mucosa de la cabeza y el cuello son contiguas con el esófago, y los dos tejidos comparten una organización, función y susceptibilidad tisulares similares a la enfermedad. Tanto el carcinoma de células escamosas de cabeza y cuello (HNSCC) como el ESCC comparten lesiones genéticas y factores de riesgo ambientales relacionados con el estilo de vida, como la exposición al tabaco y al alcohol. Subrayando esta similitud, los ratones tratados con el mimético del humo del tabaco 4NQO desarrollan fácilmente tanto HNSCC como ESCC. Dada la facilidad con la que los protocolos descritos a continuación se pueden aplicar para modelar HNSCC, incluimos instrucciones específicas para establecer cultivos de organoides 3D a partir de estas lesiones.
En este documento, proporcionamos protocolos detallados para generar organoides 3D esofágicos murinos (MEO) que representan lesiones normales, preneoplásicas y ESCC que se desarrollan en ratones tratados con 4NQO. Se pueden utilizar varias cepas de ratón, incluidas cepas comunes de laboratorio como C57BL / 6 y trazables por linaje celular y otros derivados genéticamente modificados. Enfatizamos los pasos clave, incluido el aislamiento del epitelio esofágico murino normal o enfermo, la preparación de suspensiones unicelulares, el cultivo y monitoreo de los organoides 3D en crecimiento, el subcultivo, la criopreservación y el procesamiento para análisis posteriores, incluida la morfología y otras aplicaciones.
Protocolo
Los experimentos murinos fueron planeados y realizados de acuerdo con las regulaciones y bajo el protocolo animal #AABB1502, revisado y aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Columbia. Los ratones fueron alojados en un centro de cuidado de animales adecuado que garantiza el trato humano de los ratones y proporciona atención veterinaria adecuada para los ratones y capacitación en seguridad de laboratorio para el personal del laboratorio.
1. Tratamiento de ratones con 4NQO para inducir lesiones esofágicas IEN y ESCC (tiempo considerado: hasta 28 semanas)
NOTA: Para generar MEOs que representen lesiones esofágicas neoplásicas, los ratones son sometidos a carcinogénesis química mediada por 4NQO como se describió previamente por Tang et al.14. Las MEO normales/no neoplásicas se generan a partir de ratones no tratados.
- Ratón
- Aloje de cuatro a cinco ratones por jaula y aclimatérelos a la instalación para animales durante al menos 1 semana antes de comenzar un experimento. Para reducir la posibilidad de que los trastornos relacionados con la edad resulten en la terminación prematura del experimento completo de 28 semanas, comience con ratones de 8 semanas a 16 semanas de edad.
NOTA: En este protocolo se utilizaron ratones C57BL/6 que pesaban aproximadamente 20-30 g. Para experimentos más cortos, se pueden usar ratones más viejos. Los ratones machos o hembras son aceptables. Los ratones control (sin tratamiento, ver sección 1.3.1) deben ser emparejados en edad y sexo.
- Aloje de cuatro a cinco ratones por jaula y aclimatérelos a la instalación para animales durante al menos 1 semana antes de comenzar un experimento. Para reducir la posibilidad de que los trastornos relacionados con la edad resulten en la terminación prematura del experimento completo de 28 semanas, comience con ratones de 8 semanas a 16 semanas de edad.
- Preparación de agua potable que contiene 4NQO
- Prepare 1 mg/ml de solución madre de 4NQO en etilenpropilenglicol (tabla de materiales). Disuelva 100 mg de 4NQO en 100 ml de 99,9% de etileno propilenglicol en un vaso de precipitados de vidrio de 500 ml cubierto con una película de sellado. Mezclar bien a temperatura ambiente (RT) con un agitador magnético a 800 rpm durante 30 min. Conservar a 4 °C.
- Agregue 900 ml de agua desionizada esterilizada en autoclave a 100 ml de solución madre 4NQO de 1 mg/ml y mezcle por inversión en un cilindro graduado de plástico de 2 L cubierto con una película de sellado. Un volumen de 1 L de 100 μg/mL 4NQO en 10% de etileno propilenglicol servirá a dos jaulas de ratón equipadas con una botella de 500 ml.
PRECAUCIÓN: Cabe destacar que 4NQO es un carcinógeno químico sintético que puede causar cáncer. Manéjelo con guantes de nitrilo y una bata de laboratorio de manga larga, y use zapatos cerrados. Considere la protección adecuada para los ojos, la protección facial y la cubierta de la cabeza. Para la eliminación de residuos, 4NQO debe colocarse en un contenedor etiquetado de acuerdo con las directrices institucionales para la gestión de residuos peligrosos por salud y seguridad ambiental.
- Tratamiento con 4NQO y monitorización
- Conecte la botella de bebida y administre 4NQO a través del agua potable ad libitum a los ratones durante 16 semanas. Use propilenglicol al 10% (p/v) como vehículo (sin tratamiento) de control.
NOTA: Se pueden utilizar duraciones más cortas del tratamiento con 4NQO para inducir la IEN. - Rellene el agua una vez por semana.
- Pese cada ratón semanalmente colocándolo en un recipiente de plástico en una balanza de laboratorio.
- Al final del período de tratamiento 4NQO de 16 semanas, comience a dar a los ratones agua potable regular durante el período de observación posterior a 4NQO durante un máximo de 12 semanas (Figura 1).
- Controle a los ratones diariamente para detectar signos de angustia (por ejemplo, movilidad deteriorada, hábito encorvado y comportamiento retraído), disfagia y deshidratación. Además, evalúe a los ratones semanalmente para detectar cambios en el peso corporal o la ingesta de alimentos y líquidos. Si el peso corporal disminuye en más del 10% del peso corporal inicial, alimente a los ratones con un suplemento dietético líquido.
NOTA: Una pérdida de peso corporal refractaria a los suplementos dietéticos líquidos puede ser indicativa de ESCC, y los ratones que pierden más del 20% de su peso corporal deben ser sacrificados. Es importante destacar que los MEO se pueden generar a partir de ratones sacrificados prematuramente. Tenga en cuenta que los ratones C57BL/6 sin modificaciones genéticas no suelen mostrar signos de morbilidad o tienen lesiones visibles de ESCC hasta el final del período de observación posterior a 4NQO.
- Conecte la botella de bebida y administre 4NQO a través del agua potable ad libitum a los ratones durante 16 semanas. Use propilenglicol al 10% (p/v) como vehículo (sin tratamiento) de control.
- Preparación animal
- Eutanasia de los ratones en una cámara deCO2 llena de CO2 a un caudal que desplaza el 30% -70% del volumen de la cámara por minuto. Confirmar la muerte por luxación cervical.
- Fije las extremidades y la nariz del ratón en posición supina a la plataforma de disección con agujas de 21 G.
- Desinfecte la superficie ventral del ratón con etanol al 70%.
- Disección (tiempo considerado: 0,5 h)
- Abra la piel pellizcando el pelaje abdominal medio y la piel para asegurarse de que se libere de las vísceras de abajo. Use las tijeras quirúrgicas para hacer una incisión craneocaudal en la línea media ventral desde la parte inferior del abdomen hasta la barbilla.
- Comenzando en la incisión de la línea media, use tijeras quirúrgicas para hacer cortes radiales que se extiendan a las extremidades a ambos lados del ratón. Desollar la piel se abre.
- Para exponer la tráquea cervical, use las tijeras de disección para dividir las glándulas salivales en la línea media. La tráquea se encuentra profundamente en las glándulas.
- Para exponer la tráquea torácica, retire el esternón.
- Pellizque y levante suavemente el peritoneo con fórceps, y use tijeras para dividir el peritoneo craneocaudal y lateralmente a lo largo de la caja torácica.
- Retraiga suavemente el hígado de la superficie caudal del diafragma y use tijeras para hacer una pequeña incisión en el diafragma en la muesca esternal, específicamente en la superficie dorsal del proceso xifoides. Esto libera el pulmón y el corazón de la pleura visceral.
- Separe la caja torácica del contenido torácico. Inserte tijeras en la incisión en el diafragma y diseccione cranealmente hasta la faja cervical. Durante esta disección, adhiérase estrechamente a la superficie dorsal del esternón para evitar daños a los órganos inferiores. Asegúrese de que el plano de disección sea anterior a la tráquea.
- Corte las costillas a ambos lados del esternón con tijeras y retire el esternón. Asegúrese de que el contenido torácico esté expuesto.
- Exponer el esófago abdominal. Levante suavemente el estómago anteriormente sosteniendo el antro con fórceps. Diseccionar el bazo, el páncreas y el mesenterio del estómago y el esófago con tijeras.
- Exponer el esófago torácico (Figura 2).
- Levante suavemente la tráquea inmediatamente caudal al cartílago tiroides y disecte el esófago del lado dorsal de la tráquea con tijeras de iris.
- Divida la tráquea en el cartílago tiroides con tijeras de iris.
- Despegue la tráquea del resto del esófago mediante una disección cuidadosa en la dirección caudal.
- Retire el pulmón, el corazón y el timo en masa con la tráquea. Tenga cuidado de evitar daños en el esófago al diseccionar y dividir la aorta y la vena cava.
- Divide el estómago en el píloro con tijeras.
- Separe el esófago de la vértebra sujetando el antro con fórceps y diseccionando cranealmente.
- Divida el esófago a nivel del cartílago tiroides y recolecte el esófago y el estómago en masa (Figura 3).
- Separe el estómago y el esófago dividiendo el esófago en el cardias (Figura 4, panel superior, línea roja).
- Diseccionar cualquier fascia en la superficie externa del esófago. Para reservar una muestra para histología (opcional), retire la mitad del esófago y divida longitudinalmente con tijeras. Coloque el esófago intacto restante en PBS frío sobre hielo.
- Abra el estómago a lo largo de la curvatura mayor y lávese con PBS lo suficiente. Separe el estómago anterior y lávese con PBS frío. Coloque el anteestómago en PBS frío sobre hielo.
- Para cosechar la lengua, retire la aguja 21 G en la nariz y saque la lengua con pinzas. Corta la lengua el mayor tiempo posible. Coloque la lengua en PBS frío sobre hielo.
2. Establecimiento de cultivo de organoides esofágicos murinos (MEO)
NOTA: Este protocolo también se puede utilizar para establecer un cultivo de organoides de lengua murina con la adición de un paso en el que se pica el tejido de la lengua antes de la tripsinización. Consulte la nota del paso 2.2.3.
- Preparación de reactivos
NOTA: Se puede encontrar una lista de reactivos en la Tabla de materiales. Prepare y almacene las soluciones madre de acuerdo con las instrucciones del fabricante, a menos que se indique lo contrario.- Asegúrese de que las alícuotas de un solo uso de la matriz de membrana basal (BME) utilizadas en este protocolo se almacenen a -20 °C hasta el día de su uso, se descongelen posteriormente en hielo o a 2-8 °C, y se mantengan en hielo en todo momento cuando no estén en uso.
- Disuelva 250 mg de inhibidor de tripsina de soja (ITS) en 1.000 ml de PBS (concentración madre de 250 mg / ml) y filtre-esterilice (0,22 μm). Dispensar 50 ml de alícuotas en tubos cónicos y conservar durante un máximo de 6 meses a 4 °C.
- Prepare el medio organoide de ratón (MOM): Complemente DMEM / F12 avanzado con 1 mM de N-acetil-L-cisteína (NAC), 2% de R-Spondin y medio condicionado de Noggin (RN CM), 1x suplemento de N-2, 1x suplemento de B-27, 10 mM de HEPES, 1x antibiótico-antimicótico, 1x suplemento de GlutaMAX y 100 ng / ml de factor de crecimiento epidérmico de ratón (mEGF). Prepare el MOM 500 ml a la vez, divídalo en alícuotas de 50 ml y guárdelo a 2-8 °C hasta que esté listo para usar. Agregue 0.5 μg/mL de anfotericina B y 10 μM Y-27632 justo antes de usar.
- Precaliente el MOM, la tripsina al 0,25% y el inhibidor de la tripsina de soja (ITS) a 37 °C en un baño de agua o perlas antes de su uso.
- Aislamiento de queratinocitos del tejido de ratón disecado (tiempo considerado: 2 h)
- Transfiera el tejido esofágico a 500 μL de dispasa en PBS (2.5-5 unidades en total) e incube en un termomezclador durante 10 min a 37 °C y 800 rpm.
- Transfiera el tejido a una placa de cultivo y retire con cuidado la capa muscular del epitelio con fórceps (Figura 4).
NOTA: Este paso también puede ser realizado por un investigador experimentado antes de la incubación con dispase. - Transfiera el epitelio a un tubo de microcentrífuga que contenga 500 μL de tripsina al 0,25% e incube en un termomezclador durante 10 min a 37 °C y 800 rpm.
NOTA: Si el material de partida es tejido de la lengua, picar el tejido con un bisturí estéril en trozos más pequeños, aproximadamente 1-2 mm2 de tamaño, antes de agregar la tripsina. - Centrifugar brevemente durante 5-10 s a 2.000 x g para granular el tejido. Prepare un tubo cónico de 50 ml con un filtro celular de 100 μm. Transfiera la suspensión de tejido/célula a través del filtro con una punta de diámetro ancho mediante movimientos circulares.
- Agregue 3 ml de ITS a través del filtro, usando movimientos circulares para lavar.
- Frote el colador con la base de un émbolo de jeringa de tuberculina de 1 ml para empujar las células.
- Lave el colador con 3 ml de PBS 3-5 veces, frotando el colador con la base de la jeringa entre lavados.
- Centrifugar el tubo a 300 x g durante 10 min a 4 °C para granular las células.
- Retire el sobrenadante, dejando 1 ml de solución en el tubo.
- Vuelva a suspender el pellet en el 1 ml restante y transfiera la suspensión celular a través de un filtro celular de 70 μm a un nuevo tubo cónico de 50 ml.
- Centrifugar el tubo a 300 x g durante 10 min a 4 °C para granular las células.
- Resuspender el pellet en 100 μL de MOM; Ajuste el volumen según sea necesario. Realice un recuento automatizado de células mediante la exclusión de azul de tripano.
- Siembra de la suspensión celular inicial (tiempo considerado: <1 h)
- Precaliente una placa de cultivo celular de 24 pocillos en una incubadora a 37 °C.
- Placa 5.000 células viables en 75% (v/v) BME/MOM con 50 μL de volumen total por pocillo. Maximice el número de pocillos chapados y prepare suficientes celdas en BME para un pozo adicional de acuerdo con los cálculos de ejemplo a continuación.
NOTA: Cariopreserve cualquier exceso de células en el medio de criopreservación (10% DMSO en FBS) a una concentración máxima de 1 x 106 células/ml. Conservar los crioviales en un recipiente de congelación durante la noche a -80 °C. Transfiéralos a nitrógeno líquido en fase de vapor para su almacenamiento a largo plazo. - En un tubo de microcentrífuga, prepare primero una dilución celular apropiada en MOM y luego agregue BME usando una punta de diámetro ancho justo antes del recubrimiento.
- Usando una punta de 200 μL de ancho, agregue lentamente una gota de 50 μL al centro del pozo, evitando el contacto entre la punta y el fondo o los lados del pozo (Figura 5). Tenga cuidado de no usar demasiada fuerza para expulsar el líquido de la punta, o la cúpula se aplanará.
- Deje que el BME se solidifique durante 30 minutos en una incubadora de 37 °C, 5% deCO2, 95% de humedad relativa (HR).
- Añadir cuidadosamente 500 μL de MOM por pocillo suplementado con 0,5 μg/ml de anfotericina B y 10 μM Y-27632.
NOTA: Agregue anfotericina a toda la MOM durante el cultivo primario inicial. Agregue Y-27632 solo el día de paso (día 0) para todos los pasajes. - Cambie el MOM en los días 3-4 y luego cada 2-3 días después de eso hasta que esté listo para pasar.
- En los días 7-10, obtenga una imagen de los organoides y mida la tasa de formación de organoides (OFR) dividiendo el número de organoides formados por el número de células inicialmente sembradas.
Ejemplos de cálculos: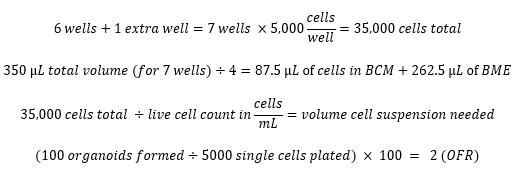
- Paso y criopreservación de organoides esofágicos murinos (MEO) (consideración de tiempo: <1.5 h)
- Descongele y mantenga el BME en hielo. Precaliente MOM, tripsina al 0,05% e ITS a 37 °C en un baño de agua o cuentas antes de su uso. Precaliente una placa de cultivo celular de 24 pocillos en una incubadora a 37 °C.
- Usando una punta de micropipeta de diámetro ancho, recoger los organoides en la cúpula BME junto con el sobrenadante. Interrumpa el BME pipeteando hacia arriba y hacia abajo.
NOTA: Combine los pocillos que contienen muestras idénticas en un solo tubo de microcentrífuga. - Centrifugar brevemente durante 10-15 s a 2.000 x g para granular los organoides. Retire y deseche el sobrenadante.
- Desalojar suavemente el pellet y resuspender el pellet en 500 μL de tripsina al 0,05%.
- Incubar el/los tubo(s) en un termomezclador a 37 °C y 800 rpm durante 10 min.
- Inactivar la tripsina con 600 μL de ITS.
- Centrifugar el tubo a 300 x g durante 5 min a 4 °C para granular las células.
- Retire y deseche el sobrenadante. Resuspender el pellet celular en 100 μL de MOM. Realice un recuento automatizado de células mediante la exclusión de azul de tripano.
NOTA: El volumen se puede ajustar según sea necesario. - Placa 2.000-5.000 células viables en 75% (v/v) BME/MOM con 50 μL de volumen total por pocillo. Maximice el número de pocillos chapados y prepare suficientes celdas en BME para un pozo adicional de acuerdo con los cálculos de ejemplo mencionados anteriormente.
NOTA: Cariopreserve cualquier exceso de células en el medio de criopreservación (10% DMSO en FBS) a una concentración máxima de 1 x 106 células/ml. Conservar los crioviales en un recipiente de congelación durante la noche a -80 °C. Transfiéralos a nitrógeno líquido en fase de vapor para su almacenamiento a largo plazo. - En un tubo de microcentrífuga, prepare primero una dilución celular apropiada en MOM y luego agregue BME usando una punta de diámetro ancho justo antes del recubrimiento.
- Usando una punta de 200 μL de ancho, agregue lentamente una gota de 50 μL al centro del pozo, evitando el contacto entre la punta y el fondo o los lados del pozo. Tenga cuidado de no usar demasiada fuerza para expulsar el líquido de la punta, o la cúpula se aplanará.
- Incubar la placa durante 30 min en una incubadora de 37 °C, 5% CO 2,95% HR.
- Añadir cuidadosamente 500 μL de MOM por pocillo suplementado con 10 μM Y-27632.
NOTA: Agregue Y-27632 solo el día de la aprobación (día 0). No es necesario agregarlo durante los cambios de medios. Ya no es necesario agregar anfotericina B. - Cambie el MOM en los días 3-4 y luego cada 2-3 días después de eso hasta que esté listo para pasar.
- En los días 7-10, tome imágenes de los organoides y mida el OFR.
- Descongelación y recuperación de los organoides esofágicos murinos (MEO) (tiempo considerado: <1 h)
- Descongele y mantenga el BME en hielo. Precaliente una placa de cultivo celular de 24 pocillos en una incubadora a 37 °C.
- Prepare 10 ml de frío o RT MOM o PBS en un tubo cónico de 15 ml.
- Descongele un criovial en un baño de agua a 37 °C o en un baño de cuentas durante aproximadamente 30 s a 1 min o hasta que quede una pequeña bolita de hielo.
- Con una punta de pipeta prehumedecida, transfiera lentamente la suspensión celular al tubo que contiene MOM o PBS gota a gota.
- Centrifugar el tubo durante 300 x g y 4 °C durante 5 min para granular las células.
- Retire y deseche el sobrenadante. Resuspender el pellet celular en 100 μL de MOM; Ajuste el volumen según sea necesario. Realice un recuento automatizado de células mediante la exclusión de azul de tripano.
- Placa 5.000-10.000 células viables en 75% (v/v) BME/MOM con 50 μL de volumen total por pocillo. Maximice el número de pocillos chapados y prepare suficientes celdas en BME para un pozo adicional de acuerdo con los cálculos de ejemplo mencionados anteriormente.
- Continuar con los pasos restantes del protocolo para el paso y la criopreservación de organoides esofágicos murinos (MEO) (ver paso 2.4.11).
3. Preparación de organoides para la incrustación de parafina (tiempo considerado: <1 h [más 1,5 h para la preparación del reactivo])
- Usando una punta de micropipeta de diámetro ancho, recoja tres pocillos por tubo de microcentrífuga. Recoge los organoides en la cúpula BME junto con el sobrenadante. Interrumpa el BME pipeteando hacia arriba y hacia abajo.
- Centrifugar brevemente durante 10-15 s a 2.000 x g para granular los organoides. Retire y deseche el sobrenadante.
- Desaloje suavemente el pellet y vuelva a suspenderlo en 300 μL de paraformaldehído al 4% (PFA).
- Fijar los organoides durante la noche a 4 °C.
- Centrifugar brevemente durante 10-15 s a 2.000 x g para granular los organoides. Retire y deseche la mayor cantidad de PFA posible.
- Desaloje suavemente el pellet y vuelva a suspenderlo en 500 μL de PBS.
NOTA: Los organoides fijos pueden almacenarse a 4 °C durante un máximo de 2 semanas antes de continuar con el siguiente paso. - Prepare un stock de 50 ml de gel de agar (2% de agar más 2,5% de gelatina).
NOTA: Prepare el caldo de gel de agar con anticipación, debido al tiempo de incubación, seguido de la realización del ciclo de autoclave.- Resuspender 1 g de Bacto-agar y 1,25 g de gelatina en 50 ml de agua en un vaso de precipitados de vidrio esterilizable en autoclave de 150 ml.
- Agite la suspensión y déjela reposar durante 30-60 minutos en RT.
- Autoclave durante 20 min a 121 °C.
- Enfriar ligeramente y dispensar 5 mL de alícuotas en tubos cónicos de 15 mL.
- Almacene hasta por 6 meses en RT.
- Prepare una superficie de incrustación invirtiendo un bastidor de tubos de microcentrífuga y cubriendo la superficie con una lámina de película de sellado. Etiqueta con la(s) identificación(es) del organoide correspondiente(s).
- Centrifugar el tubo a 300 x g durante 5 min para granular los organoides. Retire y deseche el sobrenadante.
- Mientras tanto, licua el gel de agar colocando un tubo cónico de 15 ml que contiene el gel de agar en un vaso de precipitados de vidrio de 150 ml que contiene 100 ml de agua y calentar en el microondas en el ajuste de potencia más alta durante 1-2 minutos o hasta que el agua comience a hervir y el gel de agar esté en estado líquido.
PRECAUCIÓN: Afloje la tapa del tubo cónico que contiene el gel de agar antes de cocinar en el microondas. - Sumergir parcialmente el tubo de microcentrífuga que contiene el pellet organoide en el agua tibia sin introducir agua en el tubo de microcentrífuga.
- Superponga cuidadosamente el pellet de organoide agregando 50 μL de agar por el costado del tubo.
- Sin alterar el pellet (no lo vuelva a suspender, manténgalo intacto), transfiera el pellet en la gota de gel de agar a la película de sellado en la superficie de incrustación.
- Repita los pasos 3.12 y 3.13 con 50 μL adicionales de gel de agar líquido para recoger cualquier gránulo de organoide restante, y agregue cuidadosamente a la misma gota de gel.
- Incubar la gota que contiene el pellet organoide durante 45 min a 4 °C.
- Usando fórceps, transfiera cuidadosamente la gota que contiene el pellet organoide a un casete de patología marcado.
- Guarde el casete en etanol al 70% a 4 °C durante un máximo de 1 mes.
- Proceda con la incorporación de parafina a través del procesamiento histológico de rutina para preparar bloques de parafina.
Resultados
Este protocolo describe el proceso de generación de organoides esofágicos murinos (MEO) a partir de tejido esofágico normal o tejido tumoral ESCC de ratones tratados con 4NQO de acuerdo con un régimen de tratamiento específico que consiste en 16 semanas de 4NQO administradas en agua potable, seguido de un período de observación de 10 semanas a 12 semanas (Figura 1). Luego, los ratones son sacrificados para la disección de la lengua o el tejido esofágico (Figura ...
Discusión
Hay varios pasos y consideraciones críticos para la generación y el análisis de MEO en los protocolos descritos aquí. Para garantizar la reproducibilidad y el rigor en los experimentos MEO, las réplicas biológicas y técnicas son importantes. Para las réplicas biológicas, dos o tres ratones independientes que portan ESCC son generalmente suficientes por condición experimental. Sin embargo, el número apropiado de réplicas biológicas puede variar dependiendo de los parámetros que se probarán en estudios indiv...
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Agradecemos a los Recursos Compartidos (Citometría de Flujo, Patología Molecular y Microscopía Confocal y Especializada) en el Centro Oncológico Integral Herbert Irving de la Universidad de Columbia por su apoyo técnico. Agradecemos a los doctores Alan Diehl, Adam J. Bass y Kwok-Kin Wong (NCI P01 Mechanisms of Esophageal Carcinogenesis) y a los miembros de los laboratorios Rustgi y Nakagawa por sus útiles conversaciones. Este estudio fue apoyado por las siguientes subvenciones de los NIH: P01CA098101 (H.N. y A.K.R.), R01DK114436 (H.N.), R01AA026297 (H.N.), L30CA264714 (S.F.), DE031112-01 (F.M.H.), KL2TR001874 (F.M.H.),3R01CA255298-01S1 (J.G.), 2L30DK126621-02
(J.G.) R01CA266978 (C.L.), R01DK132251 (C.L.), R01DE031873 (C.L.), P30DK132710 (C.M. y H.N.) y P30CA013696 (A.K.R.). H.N. y C.L. han recibido el premio Herbert Irving Comprehensive Cancer Center Multi-PI Pilot Award de la Universidad de Columbia. H.N. recibió el Premio del Fondo de Investigación de la Anemia de Fanconi. F.M.H. recibió el Premio de la Fundación Mark para la Investigación del Cáncer (20-60-51-MOME) y un Premio de la Asociación Americana para la Investigación del Cáncer. J.G. recibió el premio de la Asociación Americana de Gastroenterología (AGA).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.05% trypsin-EDTA | Thermo Fisher Scientific | 25-300-120 | |
| 0.25% trypsin-EDTA | Thermo Fisher Scientific | 25-200-114 | |
| 0.4% Trypan Blue | Thermo Fisher Scientific | T10282 | |
| 1 mL tuberculin syringe without needle | BD | 309659 | |
| 1.5 mL microcentrifuge tube | Thermo Fisher Scientific | 05-408-129 | |
| 100 µm cell strainer | Thermo Fisher Scientific | 22363549 | |
| 15 mL conical tubes | Thermo Fisher Scientific | 14-959-53A | |
| 200 µL wide bore micropipette tips | Thermo Fisher Scientific | 212361A | |
| 21 G needles | BD | 305167 | |
| 24 well plate | Thermo Fisher Scientific | 12-556-006 | |
| 4-Nitroquinoline-1-oxide (4NQO) | Tokyo Chemical Industry | NO250 | |
| 50 mL conical tubes | Thermo Fisher Scientific | 12-565-270 | |
| 6 well plate | Thermo Fisher Scientific | 12556004 | |
| 70 µm cell strainer | Thermo Fisher Scientific | 22363548 | |
| 99.9% ethylene propylene glycol | SK picglobal | ||
| Advanced DMEM/F12 | Thermo Fisher Scientific | 12634028 | |
| Amphotericin B | Gibco, Thermo Fisher Scientific | 15290018 | Stock concentration 250 µg/mL, final concentration 0.5 µg/mL |
| Antibiotic-Antimycotic | Thermo Fisher Scientific | 15240062 | Stock concentration 100x, final concentration 1x |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | Stock concentration 50x, final concentration 1x |
| Bacto agar | BD | 214010 | |
| CO2 incubator, e.g.Heracell 150i | Thermo Fisher Scientific | 51026406 | or equivalent |
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | AMQAX1000 | or equivalent |
| Cryovials | Thermo Fisher Scientific | 03-337-7D | |
| DietGel 76A | Clear H2O | 72-07-5022 | |
| Dimethyl sulfoxide (DMSO) | MilliporeSigma | D4540 | |
| Dispase | Corning | 354235 | Stock concentration 50 U/mL, final concentration 2.5–5 U/mL |
| Dissecting scissors | VWR | 25870-002 | |
| Dulbecco's phosphate-buffered saline (PBS) | Thermo Fisher Scientific | 14190250 | Stock concentration 1x |
| Fetal bovine serum (FBS) | HyClone | SH30071.03 | |
| Forceps | VWR | 82027-386 | |
| Freezing container | Corning | 432002 | or equivalent |
| Gelatin | Thermo Fisher Scientific | G7-500 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | Stock concentration 100x, final concentration 1x |
| HEPES | Thermo Fisher Scientific | 15630080 | Stock concentration 1 M, final concentration 10 mM |
| Hot plate/stirrer | Corning | PC-420D | or equivalent |
| Lab Armor bead bath (or water bath) | VWR | 89409-222 | or equivalent |
| Laboratory balance | Ohaus | 71142841 | or equivalent |
| Matrigel basement membrane extract (BME) | Corning | 354234 | |
| Microcentrifuge Minispin | Eppendorf | 22620100 | or equivalent |
| Microcentrifuge tube rack | Southern Labware | 0061 | |
| N-2 supplement | Thermo Fisher Scientific | 17502048 | Stock concentration 100x, final concentration 1x |
| N-acetylcysteine (NAC) | Sigma-Aldrich | A9165 | Stock concentration 0.5 M, final concentration 1 mM |
| Parafilm M wrap | Thermo Fisher Scientific | S37440 | |
| Paraformaldehyde (PFA) | MilliporeSigma | 158127-500G | |
| Pathology cassette | Thermo Fisher Scientific | 22-272416 | |
| Phase-contrast microscope | Nikon | or equivalent | |
| Recombinant mouse epidermal growth factor (mEGF) | Peprotech | 315-09-1mg | Stock concentration 500 ng/µL, final concentration 100 ng/mL |
| RN cell-conditioned medium expressing R-Spondin1 and Noggin (RN CM) | N/A | N/A | Available through the Organoid and Cell Culture Core upon request, final concentration 2% |
| Sorval ST 16R centrifuge | Thermo Fisher Scientific | 75004380 | or equivalent |
| Soybean trypsin inhibitor (STI) | MilliporeSigma | T9128 | Stock concentration 250 µg/mL |
| ThermoMixer C | Thermo Fisher Scientific | 14-285-562 PM | or equivalent |
| Y-27632 | Selleck Chemicals | S1049 | Stock concentration 10 mM, final concentration 10 µM |
Referencias
- Rustgi, A. K., El-Serag, H. B. Esophageal carcinoma. The New England Journal of Medicine. 371 (26), 2499-2509 (2014).
- Dotto, G. P., Rustgi, A. K. Squamous cell cancers: A unified perspective on biology and genetics. Cancer Cell. 29 (5), 622-637 (2016).
- Giroux, V., et al. Long-lived keratin 15+ esophageal progenitor cells contribute to homeostasis and regeneration. The Journal of Clinical Investigation. 127 (6), 2378-2391 (2017).
- DeWard, A. D., Cramer, J., Lagasse, E. Cellular heterogeneity in the mouse esophagus implicates the presence of a nonquiescent epithelial stem cell population. Cell Reports. 9 (2), 701-711 (2014).
- Kinugasa, H., et al. Mitochondrial SOD2 regulates epithelial-mesenchymal transition and cell populations defined by differential CD44 expression. Oncogene. 34 (41), 5229-5239 (2015).
- Whelan, K. A., et al. Autophagy supports generation of cells with high CD44 expression via modulation of oxidative stress and Parkin-mediated mitochondrial clearance. Oncogene. 36 (34), 4843-4858 (2017).
- Natsuizaka, M., et al. Interplay between Notch1 and Notch3 promotes EMT and tumor initiation in squamous cell carcinoma. Nature Communications. 8 (1), 1758 (2017).
- Whelan, K. A., Muir, A. B., Nakagawa, H. Esophageal 3D culture systems as modeling tools in esophageal epithelial pathobiology and personalized medicine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 461-478 (2018).
- Sachdeva, U. M., et al. Understanding the cellular origin and progression of esophageal cancer using esophageal organoids. Cancer Letters. 509, 39-52 (2021).
- Nakagawa, H., et al. The targeting of the cyclin D1 oncogene by an Epstein-Barr virus promoter in transgenic mice causes dysplasia in the tongue, esophagus and forestomach. Oncogene. 14 (10), 1185-1190 (1997).
- Andl, C. D., et al. Epidermal growth factor receptor mediates increased cell proliferation, migration, and aggregation in esophageal keratinocytes in vitro and in vivo. The Journal of Biological Chemistry. 278 (3), 1824-1830 (2003).
- Opitz, O. G., et al. A mouse model of human oral-esophageal cancer. The Journal of Clinical Investigation. 110 (6), 761-769 (2002).
- Stairs, D. B., et al. Deletion of p120-catenin results in a tumor microenvironment with inflammation and cancer that establishes it as a tumor suppressor gene. Cancer Cell. 19 (4), 470-483 (2011).
- Tang, X. -. H., Knudsen, B., Bemis, D., Tickoo, S., Gudas, L. J. Oral cavity and esophageal carcinogenesis modeled in carcinogen-treated mice. Clinical Cancer Research. 10, 301-313 (2004).
- Fong, L. Y. Y., Mancini, R., Nakagawa, H., Rustgi, A. K., Huebner, K. Combined cyclin D1 overexpression and zinc deficiency disrupts cell cycle and accelerates mouse forestomach carcinogenesis. Cancer Research. 63 (14), 4244-4252 (2003).
- Zheng, B., et al. A new murine esophageal organoid culture method and organoid-based model of esophageal squamous cell neoplasia. iScience. 24 (12), 103440 (2021).
- Hisha, H., et al. Establishment of a novel lingual organoid culture system: generation of organoids having mature keratinized epithelium from adult epithelial stem cells. Scientific Reports. 3, 3224 (2013).
- Kalabis, J., et al. Isolation and characterization of mouse and human esophageal epithelial cells in 3D organotypic culture. Nature Protocols. 7 (2), 235-246 (2012).
- Nguyen, N., et al. TGF-β1 alters esophageal epithelial barrier function by attenuation of claudin-7 in eosinophilic esophagitis. Mucosal Immunology. 11 (2), 415-426 (2018).
- Sherrill, J. D., et al. Analysis and expansion of the eosinophilic esophagitis transcriptome by RNA sequencing. Genes and Immunity. 15 (6), 361-369 (2014).
- Ruffner, M. A., et al. Toll-like receptor 2 stimulation augments esophageal barrier integrity. Allergy. 74 (12), 2449-2460 (2019).
- Kabir, M. F., et al. Single cell transcriptomic analysis reveals cellular diversity of murine esophageal epithelium. Nature Communications. 13 (1), 1-15 (2022).
- Shimonosono, M., et al. Alcohol metabolism enriches squamous cell carcinoma cancer stem cells that survive oxidative stress via autophagy. Biomolecules. 11 (10), 1479 (2021).
- Flashner, S., Yan, K. S., Nakagawa, H. 3D organoids: An untapped platform for studying host-microbiome interactions in esophageal cancers. Microorganisms. 9 (11), 2182 (2021).
- Liu, K., et al. Sox2 cooperates with inflammation-mediated stat3 activation in the malignant transformation of foregut basal progenitor cells. Cell Stem Cell. 12 (3), 304-315 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados