É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelagem do carcinoma epidermóide orco-esofágico em organoides 3D
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve os principais passos para gerar e caracterizar organoides 3D oro-esofágicos murinos que representam lesões normais, pré-neoplásicas e de carcinoma espinocelular induzidas por carcinogênese química.
Resumo
O carcinoma epidermóide de esôfago (CEC) é prevalente em todo o mundo, responsável por 90% de todos os casos de câncer de esôfago a cada ano, e é o mais mortal de todos os carcinomas de células escamosas humanos. Apesar dos recentes progressos na definição das alterações moleculares que acompanham o início e o desenvolvimento do CEC, o prognóstico dos pacientes permanece ruim. A anotação funcional dessas alterações moleculares é o próximo passo necessário e requer modelos que capturam as características moleculares do CEC e podem ser manipulados de forma rápida e barata para anotação funcional. Camundongos tratados com o 4-óxido de nitroquinolina 1-óxido mimético da fumaça do tabaco (4NQO) previsivelmente formam CEC e pré-neoplasia esofágica. Vale ressaltar que as lesões de 4NQO também surgem na cavidade oral, mais comumente na língua, bem como no pré-estômago, que compartilham o epitélio escamoso estratificado. No entanto, esses camundongos não podem ser simplesmente manipulados para testes de hipóteses funcionais, já que a geração de modelos isogênicos em camundongos consome muito tempo e recursos. Neste estudo, superamos essa limitação gerando organoides tridimensionais (3D) derivados de células únicas a partir de camundongos tratados com 4NQO para caracterizar células murinas ESCC ou células pré-neoplásicas ex vivo. Esses organoides capturam as características salientes do CEC e da pré-neoplasia esofágica, podem ser aproveitados de forma barata e rápida para formar modelos isogênicos e podem ser utilizados para experimentos de transplante singênico. Demonstramos como gerar organoides 3D a partir de tecido esofágico murino normal, pré-neoplásico e CEC e manter e criopreservar esses organoides. As aplicações desses organoides versáteis são amplas e incluem o uso de camundongos geneticamente modificados e posterior caracterização por citometria de fluxo ou imunohistoquímica, a geração de linhagens organoides isogênicas usando tecnologias CRISPR e triagem de drogas ou transplante singênico. Acreditamos que a adoção generalizada das técnicas demonstradas neste protocolo acelerará o progresso neste campo para combater a grave carga de CEC.
Introdução
O carcinoma epidermóide de esôfago (CEC) é o mais letal dos carcinomas epidermóides humanos, devido ao seu diagnóstico tardio, resistência à terapia e metástase1,2. O CEC origina-se do epitélio escamoso estratificado, que reveste a superfície luminal do esôfago. O epitélio escamoso é composto por células basais proliferativas e células diferenciadas dentro da camada celular suprabasal. Em condições fisiológicas, as células basais expressam marcadores como p63, Sox2 e citoqueratinas K5 e K14, enquanto as células diferenciadas expressam K4, K13 e IVL. As próprias células basais são heterogêneas e incluem células-tronco putativas definidas por marcadores como K153 e CD734. Na homeostase, as células basais sofrem diferenciação terminal pós-mitótica dentro da camada celular suprabasal, enquanto as células diferenciadas migram e descamam para o lúmen para completa renovação epitelial. Lembrando suas células de origem, o CEC exibe diferenciação celular escamosa em graus variados. O CEC é frequentemente acompanhado por lesões precursoras histológicas multifocais, conhecidas como neoplasia intraepitelial (IEE) ou displasia, compreendendo células basaloides atípicas. Além das alterações epiteliais, o CEC exibe remodelação tecidual dentro do compartimento subepitelial, onde ocorre a ativação de fibroblastos associados ao câncer (CAFs) e o recrutamento de células imunes/inflamatórias para promover o microambiente promotor do tumor.
A patogênese do CEC envolve alterações genéticas e exposição a fatores de risco ambientais. As principais lesões genéticas incluem a inativação dos genes supressores tumorais TP53 e CDKN2A (p16INK4A) e a ativação dos oncogenes CCND1 (ciclina D1) e EGFR, que culminam em comprometimento da função do ponto de verificação do ciclo celular, proliferação aberrante e sobrevivência sob estresse genotóxico relacionado à exposição a carcinógenos ambientais. De fato, as alterações genéticas interagem estreitamente com fatores de risco comportamentais e ambientais, mais comumente o uso de tabaco e álcool. A fumaça do tabaco contém carcinógenos humanos, como o acetaldeído, que também é o principal metabólito do álcool. O acetaldeído induz adutos de DNA e ligações cruzadas de DNA interstrand, levando a danos no DNA e ao acúmulo de mutações no DNA e instabilidade cromossômica. Diante do excesso de estímulos mitogênicos e da proliferação aberrante da ativação de oncogenes, a transformação maligna das células epiteliais esofágicas é facilitada por mecanismos de enfrentamento do estresse genotóxico, incluindo a ativação de antioxidantes, autofagia e transição epitélio-mesenquimal (EMT). Curiosamente, essas funções citoprotetoras são frequentemente ativadas em células-tronco de câncer (CSCs) ESCC, que se caracterizam por alta expressão de CD44 (CD44H) e têm a capacidade de iniciar tumores, invasão, metástase e resistência àterapia5,6,7.
O CEC foi modelado em cultura celular e em modelos deroedores8,9. Nas últimas três décadas, modelos robustos de camundongos geneticamente modificados de CEC foram desenvolvidos. Estes incluem camundongos transgênicos CCND1 e EGFR 10,11 e p53 e camundongos knockout p120Ctn 12,13. No entanto, alterações genéticas isoladas normalmente não resultam em CEC de início rápido. Esse desafio tem sido superado com o uso de carcinógenos esofágicos que recapitulam bem as lesões genéticas humanas noCEC14. Por exemplo, o óxido de 4-nitroquinolina-1 (4NQO) acelera o desenvolvimento de CEC em camundongos transgênicos CCND1 15. Nos últimos anos, células-tronco epiteliais esofágicas putativas, células progenitoras e seus respectivos destinos têm sido investigados em modelos de linhagem celular rastreávelem camundongos3,4. Além disso, esses camundongos rastreáveis por linhagem celular têm sido utilizados para explorar as células de origem do CEC e como tais células dão origem às CSCs CD44H via histologia convencional e caracterização molecular baseada em ômica7.
Uma área emergente relacionada a esses modelos murinos é a nova aplicação de técnicas de cultura celular para analisar CEC vivos e células precursoras em um sistema organoide tridimensional (3D) no qual a arquitetura dos tecidos originais é recapitulada exvivo7,8,9. Esses organoides 3D são rapidamente cultivados a partir de uma suspensão unicelular isolada de tecidos murinos, incluindo tumores primários e metastáticos (por exemplo, lesões linfonodais, pulmonares e hepáticas). As células são incluídas em extrato da membrana basal (BME) e alimentadas com um meio de cultura celular livre de soro bem definido. Os organoides 3D crescem dentro de 7-10 dias, e as estruturas esféricas resultantes são passíveis de subcultura, criopreserva e ensaios para analisar uma variedade de propriedades e funções celulares, incluindo marcadores CSC, EMT, autofagia, proliferação, diferenciação e morte celular apoptótica.
Esses métodos podem ser amplamente aplicados a culturas organoides 3D estabelecidas a partir de qualquer tecido epitelial escamoso estratificado, como a mucosa da cabeça e pescoço (cavidade oral, língua, faringe e laringe) e até mesmo o pré-estômago. A mucosa da cabeça e pescoço é contígua ao esôfago, e os dois tecidos compartilham organização, função e suscetibilidade tecidual semelhantes à doença. Tanto o carcinoma espinocelular de cabeça e pescoço (CECP) quanto o CEC compartilham lesões genéticas e fatores de risco ambientais relacionados ao estilo de vida, como exposição ao tabaco e ao álcool. Ressaltando essa semelhança, camundongos tratados com o mimético de fumaça de tabaco 4NQO prontamente desenvolvem CEC de cabeça e pescoço. Dada a facilidade com que os protocolos descritos a seguir podem ser aplicados na modelagem do CEC de cabeça e pescoço, incluímos instruções específicas para o estabelecimento de culturas organoides 3D a partir dessas lesões.
Neste artigo, fornecemos protocolos detalhados para a geração de organoides 3D esofágicos murinos (MEOs) representando lesões normais, pré-neoplásicas e CEC que se desenvolvem em camundongos tratados com 4NQO. Várias cepas de camundongos podem ser utilizadas, incluindo cepas comuns de laboratório como C57BL/6 e linhagens celulares rastreáveis e outros derivados geneticamente modificados. Enfatizamos as principais etapas, incluindo o isolamento do epitélio esofágico murino normal ou doente, a preparação de suspensões unicelulares, o cultivo e monitoramento dos organoides 3D em crescimento, a subcultura, a criopreserva e o processamento para análises subsequentes, incluindo morfologia e outras aplicações.
Protocolo
Os experimentos murinos foram planejados e realizados de acordo com os regulamentos e sob protocolo animal #AABB1502, revisados e aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Columbia. Os camundongos foram alojados em uma instalação de cuidados com animais adequada que garante o tratamento humano dos camundongos e fornece cuidados veterinários apropriados para os camundongos e treinamento de segurança de laboratório para o pessoal do laboratório.
1. Tratamento de camundongos com 4NQO para induzir lesões de IEN esofágico e CEC (consideração de tempo: até 28 semanas)
NOTA: Para gerar MEOs representando lesões neoplásicas do esôfago, os camundongos são submetidos à carcinogênese química mediada pela 4NQO, conforme descrito anteriormente por Tang et al.14. MEOs normais/não neoplásicas são gerados a partir de camundongos não tratados.
- Mouses
- Acomode de quatro a cinco camundongos por gaiola e aclimate-os ao biotério por pelo menos 1 semana antes de iniciar um experimento. Para reduzir a possibilidade de que distúrbios relacionados à idade resultem no término prematuro do experimento completo de 28 semanas, comece com camundongos de 8 semanas a 16 semanas.
NOTA: Camundongos C57BL/6 pesando aproximadamente 20-30 g foram utilizados neste protocolo. Para experimentos mais curtos, camundongos mais velhos podem ser usados. Camundongos machos ou fêmeas são aceitáveis. Os ratinhos de controlo (sem tratamento, ver secção 1.3.1) devem ser combinados em idade e sexo.
- Acomode de quatro a cinco camundongos por gaiola e aclimate-os ao biotério por pelo menos 1 semana antes de iniciar um experimento. Para reduzir a possibilidade de que distúrbios relacionados à idade resultem no término prematuro do experimento completo de 28 semanas, comece com camundongos de 8 semanas a 16 semanas.
- Preparação de água potável contendo 4NQO
- Preparar 1 mg/mL de solução-mãe de 4NQO em etilenopropilenoglicol (Tabela de Materiais). Dissolver 100 mg de 4NQO em 100 mL de etilenopropilenoglicol a 99,9% em um copo de vidro de 500 mL coberto com filme selante. Misturar cuidadosamente à temperatura ambiente (RT) utilizando um agitador magnético a 800 rpm durante 30 minutos. Conservar a 4 °C.
- Adicionar 900 mL de água deionizada autoclavada a 100 mL de solução-estoque 4NQO 1 mg/mL e misturar por inversão em um cilindro graduado de plástico de 2 L coberto com filme de vedação. Um volume de 1 L de 100 μg/mL de 4NQO em etilenopropilenoglicol a 10% servirá duas gaiolas de camundongos equipadas com um frasco de 500 mL.
CUIDADO: Vale ressaltar que o 4NQO é um carcinógeno químico sintético que pode causar câncer. Manuseie com luvas de nitrilo e jaleco de manga comprida e use sapatos fechados. Considere a proteção adequada dos olhos, proteção facial e cobertura da cabeça. Para o descarte de resíduos, o 4NQO deve ser colocado em um recipiente rotulado de acordo com as diretrizes institucionais para a gestão de resíduos perigosos por meio da saúde e segurança ambiental.
- Tratamento com 4NQO e monitoramento
- Anexe a garrafa de beber e administre 4NQO através da água potável ad libitum aos ratos durante 16 semanas. Use 10% (p/v) de propilenoglicol como veículo (sem tratamento) de controle.
NOTA: Durações mais curtas do tratamento com 4NQO podem ser usadas para induzir o IEN. - Reabasteça a água uma vez por semana.
- Pese cada rato semanalmente, colocando-o num recipiente de plástico numa balança de laboratório.
- No final do período de tratamento de 16 semanas com 4NQO, comece a administrar água potável regular aos camundongos durante o período de observação pós-4NQO por até 12 semanas (Figura 1).
- Monitore os camundongos diariamente em busca de sinais de sofrimento (por exemplo, mobilidade prejudicada, habitus curvado e comportamento retraído), disfagia e desidratação. Além disso, avalie os camundongos semanalmente quanto a mudanças no peso corporal ou na ingestão de alimentos e líquidos. Se o peso corporal cair mais de 10% do peso corporal inicial, alimente os ratos com um suplemento dietético líquido.
NOTA: Uma perda de peso corporal refratária a suplementos dietéticos líquidos pode ser indicativa de CEC, e ratos que perdem mais de 20% de seu peso corporal devem ser eutanasiados. É importante ressaltar que os MEOs podem ser gerados a partir de camundongos eutanasiados prematuramente. Observe que camundongos C57BL/6 sem modificações genéticas normalmente não apresentam sinais de morbidade ou apresentam lesões visíveis de CEC até o final do período de observação pós-4NQO.
- Anexe a garrafa de beber e administre 4NQO através da água potável ad libitum aos ratos durante 16 semanas. Use 10% (p/v) de propilenoglicol como veículo (sem tratamento) de controle.
- Preparo animal
- Eutanasiar os camundongos em uma câmara de CO 2 preenchida com CO2 a uma taxa de fluxo que desloca 30%-70% do volume da câmara por minuto. Confirmar óbito por luxação cervical.
- Fixar os membros e o nariz do camundongo na posição supina à plataforma de dissecção com agulhas 21G.
- Desinfetar a superfície ventral do rato com etanol a 70%.
- Dissecção (consideração de tempo: 0,5 h)
- Abra a pele beliscando o pelo e a pele do abdômen médio para garantir que ela seja liberada das vísceras abaixo. Use a tesoura cirúrgica para fazer uma incisão craniocaudal, ventral da linha média do abdome inferior até o queixo.
- A partir da incisão mediana, use uma tesoura cirúrgica para fazer cortes radiais que se estendem até os membros de ambos os lados do rato. Abrir os retalhos cutâneos.
- Para expor a traqueia cervical, use a tesoura dissecante para dividir as glândulas salivares na linha média. A traqueia fica profundamente nas glândulas.
- Para expor a traqueia torácica, remova o esterno.
- Aperte e levante suavemente o peritônio com pinça e use tesoura para dividir o peritônio craniocaudal e lateralmente ao longo da caixa torácica.
- Retrair suavemente o fígado da superfície caudal do diafragma e usar tesoura para fazer uma pequena incisão no diafragma na fúrcula esternal, especificamente na superfície dorsal do processo xifoide. Isso libera o pulmão e o coração da pleura visceral.
- Separe a caixa torácica do conteúdo torácico. Inserir tesoura na incisão no diafragma e dissecar cranialmente a cintura cervical. Durante esta dissecção, aderir firmemente à superfície dorsal do esterno para evitar danos aos órgãos abaixo. Certifique-se de que o plano de dissecção é anterior à traqueia.
- Corte as costelas de cada lado do esterno usando uma tesoura e retire o esterno. Certifique-se de que o conteúdo torácico esteja exposto.
- Expor o esôfago abdominal. Levante suavemente o estômago anteriormente segurando o antro com pinças. Disseque o baço, pâncreas e mesentério do estômago e esôfago com tesoura.
- Expor o esôfago torácico (Figura 2).
- Levante suavemente a traqueia imediatamente caudal à cartilagem tireóidea e disseque o esôfago do lado dorsal da traqueia usando tesoura de íris.
- Divida a traqueia na cartilagem tireoide com uma tesoura de íris.
- Descascar a traqueia do restante do esôfago através de dissecção cuidadosa no sentido caudal.
- Remova o pulmão, o coração e o timo em massa com a traqueia. Tome cuidado para evitar danos ao esôfago ao dissecar e dividir a aorta e a veia cava.
- Divida o estômago no piloro com uma tesoura.
- Separe o esôfago da vértebra segurando o antro com pinça e dissecando cranialmente.
- Divida o esôfago ao nível da cartilagem tireoide e retire o esôfago e o estômago em massa (Figura 3).
- Separe o estômago e o esôfago dividindo o esôfago na cárdia (Figura 4, painel superior, linha vermelha).
- Disseque qualquer fáscia na superfície externa do esôfago. Para reservar uma amostra para histologia (opcional), remova metade do esôfago e divida longitudinalmente com tesoura. Coloque o esôfago intacto restante em PBS frio sobre gelo.
- Abra o estômago ao longo da curvatura maior e lave com PBS suficientemente. Separe o pré-estômago e lave com PBS frio. Coloque o estômago anterior em PBS frio sobre gelo.
- Para colher a língua, retire a agulha 21 G no nariz e puxe a língua com uma pinça. Corte a língua o maior tempo possível. Coloque a língua em PBS fria sobre gelo.
2. Estabelecimento da cultura organoide esofágica murina (MEO)
NOTA: Este protocolo também pode ser usado para estabelecer uma cultura organoide de língua murina com a adição de uma etapa na qual o tecido da língua é picado antes da tripsinização. Veja a nota na etapa 2.2.3.
- Preparação de reagentes
NOTA: Uma lista de reagentes pode ser encontrada na Tabela de materiais. Preparar e armazenar as soluções-mãe de acordo com as instruções do fabricante, salvo indicação em contrário.- Certifique-se de que as alíquotas de uso único da matriz de membrana basal (EMB) utilizadas neste protocolo sejam armazenadas a -20 °C até o dia do uso, sejam posteriormente descongeladas no gelo ou a 2-8 °C e mantidas no gelo o tempo todo quando não estiverem em uso.
- Dissolver 250 mg de inibidor de tripsina (IST) de soja em 1.000 mL de PBS (concentração estoque de 250 mg/mL) e filtrar-esterilizar (0,22 μm). Dispensar alíquotas de 50 mL em tubos cônicos e armazenar por até 6 meses a 4 °C.
- Prepare o meio organoide de camundongo (MOM): Suplemento avançado DMEM/F12 com 1 mM N-acetil-L-cisteína (NAC), 2% R-Spondin e meio condicionado Noggin (RN CM), 1x suplemento N-2, 1x suplemento B-27, 10 mM HEPES, 1x antibiótico-antimicótico, 1x suplemento GlutaMAX e 100 ng/mL de fator de crescimento epidérmico de camundongo (mEGF). Prepare o MOM 500 mL de cada vez, divida em alíquotas de 50 mL e armazene a 2-8 °C até ficar pronto para uso. Adicionar 0,5 μg/mL de anfotericina B e 10 μM Y-27632 imediatamente antes do uso.
- Pré-aquecer o MOM, tripsina a 0,25% e inibidor de tripsina de soja (IST) a 37 °C em água ou banho de contas antes do uso.
- Isolamento de queratinócitos do tecido dissecado de camundongos (consideração de tempo: 2 h)
- Transferir o tecido esofágico para 500 μL de dispase em PBS (2,5-5 unidades no total) e incubar em um termomisturador por 10 min a 37 °C e 800 rpm.
- Transfira o tecido para uma placa de cultura e remova cuidadosamente a camada muscular do epitélio com pinça (Figura 4).
NOTA: Esta etapa também pode ser realizada por um pesquisador experiente antes da incubação com dispase. - Transferir o epitélio para um tubo de microcentrífuga contendo 500 μL de tripsina a 0,25% e incubar em um termomisturador por 10 min a 37 °C e 800 rpm.
NOTA: Se o material de partida for tecido lingual, pice o tecido com um bisturi estéril em pedaços menores, aproximadamente 1-2 mm2 de tamanho, antes de adicionar a tripsina. - Centrifugar brevemente por 5-10 s a 2.000 x g para pellet o tecido. Preparar um tubo cônico de 50 mL com um filtro de células de 100 μm. Transfira a suspensão tecido/célula através do filtro com uma ponta de furo larga usando movimentos circulares.
- Adicionar 3 mL de IST através do filtro, usando movimentos circulares para lavar.
- Esfregue o filtro com a base de um êmbolo de seringa tuberculínica de 1 mL para empurrar as células.
- Lave o filtro com 3 mL de PBS 3-5 vezes, esfregando o filtro com a base da seringa entre as lavagens.
- Centrifugar o tubo a 300 x g durante 10 minutos a 4 °C para pellet das células.
- Retire o sobrenadante, deixando 1 mL de solução no tubo.
- Ressuspender o pellet no 1 mL restante e transferir a suspensão celular através de um filtro celular de 70 μm para um novo tubo cônico de 50 mL.
- Centrifugar o tubo a 300 x g durante 10 minutos a 4 °C para pellet das células.
- Ressuspender o pellet em 100 μL de MOM; Ajuste o volume conforme necessário. Execute uma contagem de células automatizada por exclusão azul de tripano.
- Semeadura da suspensão celular inicial (consideração de tempo: <1 h)
- Pré-aquecer uma placa de cultura celular de 24 poços em uma incubadora de 37 °C.
- Placa de 5.000 células viáveis em 75% (v/v) de BME/MOM com 50 μL de volume total por poço. Maximize o número de poços banhados e prepare células suficientes no BME para um poço extra de acordo com os cálculos de exemplo abaixo.
NOTA: Criopreservar qualquer excesso de células no meio de criopreservação (10% DMSO em FBS) a uma concentração máxima de 1 x 106 células/mL. Conservar os crióscimos num recipiente de congelação durante a noite a -80 °C. Transfira-os para nitrogênio líquido em fase vapor para armazenamento a longo prazo. - Em um tubo de microcentrífuga, prepare uma diluição celular apropriada em MOM primeiro e, em seguida, adicione BME usando uma ponta de furo largo imediatamente antes de revestir.
- Com uma ponta de 200 μL de largura, adicione lentamente uma gota de 50 μL ao centro do poço, evitando o contato entre a ponta e o fundo ou as laterais do poço (Figura 5). Tenha cuidado para não usar muita força para expelir o líquido da ponta, ou a cúpula vai achatar.
- Permitir que o BME se solidifique por 30 min em uma incubadora de 37 °C, 5% CO2, 95% de umidade relativa (UR).
- Adicionar cuidadosamente 500 μL de MOM por poço suplementado com 0,5 μg/mL de anfotericina B e 10 μM Y-27632.
NOTA: Adicione anfotericina a todo o MOM durante toda a cultura primária inicial. Adicione Y-27632 apenas no dia da passagem (dia 0) para todas as passagens. - Mude a MOM nos dias 3-4 e, em seguida, a cada 2-3 dias depois disso até estar pronto para a passagem.
- Nos dias 7-10, faça imagens dos organoides e meça a taxa de formação de organoides (RLO) dividindo o número de organoides formados pelo número de células inicialmente semeadas.
Exemplos de cálculos: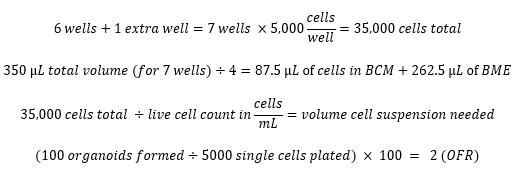
- Passaging e criopreservação de organoides esofágicos murinos (MEOs) (consideração de tempo: <1,5 h)
- Descongele e mantenha o BME no gelo. Pré-aquecer MOM, tripsina a 0,05% e IST a 37 °C em banho de água ou miçanga antes do uso. Pré-aquecer uma placa de cultura celular de 24 poços em uma incubadora de 37 °C.
- Usando uma ponta de micropipeta de furo largo, colete os organoides na cúpula da BME junto com o sobrenadante. Interrompa o BME pipetando para cima e para baixo.
NOTA: Combinar os poços contendo amostras idênticas em um único tubo de microcentrífuga. - Centrifugar brevemente por 10-15 s a 2.000 x g para pellet os organoides. Retire e descarte o sobrenadante.
- Deslocar suavemente o pellet e ressuspendê-lo em 500 μL de tripsina a 0,05%.
- Incubar o(s) tubo(s) num termomisturador a 37 °C e 800 rpm durante 10 min.
- Inativar a tripsina com 600 μL de IST.
- Centrifugar o tubo a 300 x g durante 5 minutos a 4 °C para pellet das células.
- Retire e descarte o sobrenadante. Ressuspender a pastilha celular em 100 μL de MOM. Execute uma contagem de células automatizada por exclusão azul de tripano.
NOTA: O volume pode ser ajustado conforme necessário. - Placa 2.000-5.000 células viáveis em 75% (v/v) de BME/MOM com 50 μL de volume total por poço. Maximize o número de poços banhados e prepare células suficientes no BME para um poço extra de acordo com os cálculos de exemplo mencionados anteriormente.
NOTA: Criopreservar qualquer excesso de células no meio de criopreservação (10% DMSO em FBS) a uma concentração máxima de 1 x 106 células/mL. Conservar os crióscimos num recipiente de congelação durante a noite a -80 °C. Transfira-os para nitrogênio líquido em fase vapor para armazenamento a longo prazo. - Em um tubo de microcentrífuga, prepare uma diluição celular apropriada em MOM primeiro e, em seguida, adicione BME usando uma ponta de furo largo imediatamente antes de revestir.
- Usando uma ponta de furo de 200 μL de largura, adicione lentamente uma gota de 50 μL ao centro do poço, evitando o contato entre a ponta e o fundo ou as laterais do poço. Tenha cuidado para não usar muita força para expelir o líquido da ponta, ou a cúpula vai achatar.
- Incubar a placa por 30 min em uma incubadora a 37 °C, 5% CO 2,95% RH.
- Adicione cuidadosamente 500 μL de MOM por poço suplementado com 10 μM Y-27632.
NOTA: Adicione Y-27632 somente no dia da passagem (dia 0). É desnecessário adicioná-lo durante as alterações de mídia. A adição de anfotericina B não é mais necessária. - Mude a MOM nos dias 3-4 e, em seguida, a cada 2-3 dias depois disso até estar pronto para a passagem.
- Nos dias 7-10, faça a imagem dos organoides e meça o RLO.
- Descongelamento e recuperação dos organoides murinos do esôfago (MEOs) (consideração de tempo: <1 h)
- Descongele e mantenha o BME no gelo. Pré-aquecer uma placa de cultura celular de 24 poços em uma incubadora de 37 °C.
- Preparar 10 mL de frio ou RT MOM ou PBS em um tubo cônico de 15 mL.
- Descongelar um criovial em banho-maria ou banho de contas a 37 °C por aproximadamente 30 s a 1 min ou até que reste uma pequena pelota de gelo.
- Com uma ponta de pipeta pré-molhada, transfira lentamente a suspensão da célula para o tubo contendo MOM ou PBS de forma gota a gota.
- Centrifugar o tubo para 300 x g e 4 °C por 5 min para pellet as células.
- Retire e descarte o sobrenadante. Ressuspender o pellet celular em 100 μL de MOM; Ajuste o volume conforme necessário. Execute uma contagem de células automatizada por exclusão azul de tripano.
- Placa 5.000-10.000 células viáveis em 75% (v/v) BME/MOM com 50 μL de volume total por poço. Maximize o número de poços banhados e prepare células suficientes na BME para um poço extra de acordo com cálculos de exemplo mencionados anteriormente.
- Continuar com as restantes etapas do protocolo de passagem e criopreservação de organoides esofágicos murinos (MEO) (ver passo 2.4.11).
3. Preparação de organoides para inclusão em parafina (consideração de tempo: <1 h [mais 1,5 h para preparação de reagentes])
- Usando uma ponta de micropipeta de furo largo, colete três poços por tubo de microcentrífuga. Coletar os organoides na cúpula BME juntamente com o sobrenadante. Interrompa o BME pipetando para cima e para baixo.
- Centrifugar brevemente por 10-15 s a 2.000 x g para pellet os organoides. Retire e descarte o sobrenadante.
- Deslocar suavemente o pellet e ressuspendê-lo em 300 μL de paraformaldeído (PFA) a 4%.
- Fixar os organoides durante a noite a 4 °C.
- Centrifugar brevemente por 10-15 s a 2.000 x g para pellet os organoides. Remova e descarte o máximo de PFA possível.
- Deslocar suavemente o pellet e ressuspendê-lo em 500 μL de PBS.
NOTA: Os organoides fixos podem ser armazenados a 4 °C por até 2 semanas antes de prosseguir para a próxima etapa. - Preparar um caldo de 50 mL de gel de ágar (2% de ágar mais 2,5% de gelatina).
OBS: Preparar o estoque de gel de ágar com antecedência, devido ao tempo de incubação, seguido da realização do ciclo de autoclave.- Ressuspender 1 g de Bacto-ágar e 1,25 g de gelatina em 50 mL de água em copo de vidro autoclavável de 150 mL.
- Gire a suspensão e deixe-a descansar por 30-60 min no RT.
- Autoclave por 20 min a 121 °C.
- Arrefecer ligeiramente e distribuir alíquotas de 5 ml em tubos cónicos de 15 ml.
- Armazene por até 6 meses na RT.
- Prepare uma superfície de incorporação invertendo um rack de tubo de microcentrífuga e cobrindo a superfície com uma folha de filme de vedação. Etiqueta com o(s) ID(s) organoide(s) correspondente(s).
- Centrifugar o tubo a 300 x g por 5 min para pellet os organoides. Retire e descarte o sobrenadante.
- Enquanto isso, liquefaça o gel de ágar colocando um tubo cônico de 15 mL contendo o gel de ágar em um copo de vidro de 150 mL contendo 100 mL de água e microondulando na configuração de maior potência por 1-2 min ou até que a água comece a ferver e o gel de ágar esteja em estado líquido.
CUIDADO: Solte a tampa do tubo cônico contendo o gel de ágar antes de fazer micro-ondas. - Submergir parcialmente o tubo de microcentrífuga contendo o pellet organoide na água morna sem introduzir água no tubo de microcentrífuga.
- Sobreponha cuidadosamente o pellet organoide adicionando 50 μL de ágar na lateral do tubo.
- Sem perturbar o pellet (não ressuspenda, mantenha o pellet intacto), transfira o pellet na gota de gel de ágar para a película de vedação na superfície de incorporação.
- Repetir os passos 3.12 e 3.13 com mais 50 μL de gel de ágar líquido para recolher qualquer pastilha organoide restante e adicionar cuidadosamente à mesma gota de gel.
- Incubar a gota contendo o pellet organoide durante 45 min a 4 °C.
- Usando pinças, transfira cuidadosamente a gota que contém a pastilha organoide para um de patologia marcado.
- Conservar a em etanol a 70% a 4 °C durante um período máximo de 1 mês.
- Proceder à incorporação de parafina através de processamento histológico de rotina para preparar blocos de parafina.
Resultados
Este protocolo descreve o processo de geração de organoides esofágicos murinos (MEOs) a partir de tecido esofágico normal ou tecido tumoral ESCC de camundongos tratados com 4NQO de acordo com um regime de tratamento específico que consiste em 16 semanas de 4NQO administradas em água potável, seguidas por um período de observação de 10 semanas a 12 semanas (Figura 1). Os camundongos são então eutanasiados para a dissecção da língua ou tecido esofágico (Figura
Discussão
Existem várias etapas e considerações críticas para a geração e análise de MEOs nos protocolos aqui descritos. Para garantir a reprodutibilidade e o rigor nas experiências MEO, as réplicas biológicas e técnicas são importantes. Para réplicas biológicas, dois a três camundongos independentes portadores de CEC são geralmente suficientes por condição experimental. No entanto, o número adequado de réplicas biológicas pode variar dependendo dos parâmetros a serem testados em estudos individuais. Por exem...
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Agradecemos aos Recursos Compartilhados (Citometria de Fluxo, Patologia Molecular e Microscopia Confocal e Especializada) do Herbert Irving Comprehensive Cancer Center da Columbia University pelo suporte técnico. Agradecemos aos Drs. Alan Diehl, Adam J. Bass e Kwok-Kin Wong (NCI P01 Mechanisms of Esophageal Carcinogenesis) e aos membros dos laboratórios Rustgi e Nakagawa pelas discussões úteis. Este estudo foi apoiado pelos seguintes NIH Grants: P01CA098101 (H.N. e A.K.R.), R01DK114436 (H.N.), R01AA026297 (H.N.), L30CA264714 (S.F.), DE031112-01 (F.M.H.), KL2TR001874 (F.M.H.),3R01CA255298-01S1 (J.G.), 2L30DK126621-02
(J.G.) R01CA266978 (C.L.), R01DK132251 (C.L.), R01DE031873 (C.L.), P30DK132710 (C.M. e H.N.) e P30CA013696 (A.K.R.). H.N. e C.L. receberam o Prêmio Piloto Multi-PI do Centro Abrangente de Câncer Herbert Irving da Universidade de Columbia. H.N. recebeu o Prêmio Fanconi Anemia Research Fund. F.M.H. recebeu o Prêmio da Fundação Mark para Pesquisa do Câncer (20-60-51-MOME) e um Prêmio da Associação Americana para Pesquisa do Câncer. J.G. recebeu o prêmio da American Gastroenterological Association (AGA).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.05% trypsin-EDTA | Thermo Fisher Scientific | 25-300-120 | |
| 0.25% trypsin-EDTA | Thermo Fisher Scientific | 25-200-114 | |
| 0.4% Trypan Blue | Thermo Fisher Scientific | T10282 | |
| 1 mL tuberculin syringe without needle | BD | 309659 | |
| 1.5 mL microcentrifuge tube | Thermo Fisher Scientific | 05-408-129 | |
| 100 µm cell strainer | Thermo Fisher Scientific | 22363549 | |
| 15 mL conical tubes | Thermo Fisher Scientific | 14-959-53A | |
| 200 µL wide bore micropipette tips | Thermo Fisher Scientific | 212361A | |
| 21 G needles | BD | 305167 | |
| 24 well plate | Thermo Fisher Scientific | 12-556-006 | |
| 4-Nitroquinoline-1-oxide (4NQO) | Tokyo Chemical Industry | NO250 | |
| 50 mL conical tubes | Thermo Fisher Scientific | 12-565-270 | |
| 6 well plate | Thermo Fisher Scientific | 12556004 | |
| 70 µm cell strainer | Thermo Fisher Scientific | 22363548 | |
| 99.9% ethylene propylene glycol | SK picglobal | ||
| Advanced DMEM/F12 | Thermo Fisher Scientific | 12634028 | |
| Amphotericin B | Gibco, Thermo Fisher Scientific | 15290018 | Stock concentration 250 µg/mL, final concentration 0.5 µg/mL |
| Antibiotic-Antimycotic | Thermo Fisher Scientific | 15240062 | Stock concentration 100x, final concentration 1x |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | Stock concentration 50x, final concentration 1x |
| Bacto agar | BD | 214010 | |
| CO2 incubator, e.g.Heracell 150i | Thermo Fisher Scientific | 51026406 | or equivalent |
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | AMQAX1000 | or equivalent |
| Cryovials | Thermo Fisher Scientific | 03-337-7D | |
| DietGel 76A | Clear H2O | 72-07-5022 | |
| Dimethyl sulfoxide (DMSO) | MilliporeSigma | D4540 | |
| Dispase | Corning | 354235 | Stock concentration 50 U/mL, final concentration 2.5–5 U/mL |
| Dissecting scissors | VWR | 25870-002 | |
| Dulbecco's phosphate-buffered saline (PBS) | Thermo Fisher Scientific | 14190250 | Stock concentration 1x |
| Fetal bovine serum (FBS) | HyClone | SH30071.03 | |
| Forceps | VWR | 82027-386 | |
| Freezing container | Corning | 432002 | or equivalent |
| Gelatin | Thermo Fisher Scientific | G7-500 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | Stock concentration 100x, final concentration 1x |
| HEPES | Thermo Fisher Scientific | 15630080 | Stock concentration 1 M, final concentration 10 mM |
| Hot plate/stirrer | Corning | PC-420D | or equivalent |
| Lab Armor bead bath (or water bath) | VWR | 89409-222 | or equivalent |
| Laboratory balance | Ohaus | 71142841 | or equivalent |
| Matrigel basement membrane extract (BME) | Corning | 354234 | |
| Microcentrifuge Minispin | Eppendorf | 22620100 | or equivalent |
| Microcentrifuge tube rack | Southern Labware | 0061 | |
| N-2 supplement | Thermo Fisher Scientific | 17502048 | Stock concentration 100x, final concentration 1x |
| N-acetylcysteine (NAC) | Sigma-Aldrich | A9165 | Stock concentration 0.5 M, final concentration 1 mM |
| Parafilm M wrap | Thermo Fisher Scientific | S37440 | |
| Paraformaldehyde (PFA) | MilliporeSigma | 158127-500G | |
| Pathology cassette | Thermo Fisher Scientific | 22-272416 | |
| Phase-contrast microscope | Nikon | or equivalent | |
| Recombinant mouse epidermal growth factor (mEGF) | Peprotech | 315-09-1mg | Stock concentration 500 ng/µL, final concentration 100 ng/mL |
| RN cell-conditioned medium expressing R-Spondin1 and Noggin (RN CM) | N/A | N/A | Available through the Organoid and Cell Culture Core upon request, final concentration 2% |
| Sorval ST 16R centrifuge | Thermo Fisher Scientific | 75004380 | or equivalent |
| Soybean trypsin inhibitor (STI) | MilliporeSigma | T9128 | Stock concentration 250 µg/mL |
| ThermoMixer C | Thermo Fisher Scientific | 14-285-562 PM | or equivalent |
| Y-27632 | Selleck Chemicals | S1049 | Stock concentration 10 mM, final concentration 10 µM |
Referências
- Rustgi, A. K., El-Serag, H. B. Esophageal carcinoma. The New England Journal of Medicine. 371 (26), 2499-2509 (2014).
- Dotto, G. P., Rustgi, A. K. Squamous cell cancers: A unified perspective on biology and genetics. Cancer Cell. 29 (5), 622-637 (2016).
- Giroux, V., et al. Long-lived keratin 15+ esophageal progenitor cells contribute to homeostasis and regeneration. The Journal of Clinical Investigation. 127 (6), 2378-2391 (2017).
- DeWard, A. D., Cramer, J., Lagasse, E. Cellular heterogeneity in the mouse esophagus implicates the presence of a nonquiescent epithelial stem cell population. Cell Reports. 9 (2), 701-711 (2014).
- Kinugasa, H., et al. Mitochondrial SOD2 regulates epithelial-mesenchymal transition and cell populations defined by differential CD44 expression. Oncogene. 34 (41), 5229-5239 (2015).
- Whelan, K. A., et al. Autophagy supports generation of cells with high CD44 expression via modulation of oxidative stress and Parkin-mediated mitochondrial clearance. Oncogene. 36 (34), 4843-4858 (2017).
- Natsuizaka, M., et al. Interplay between Notch1 and Notch3 promotes EMT and tumor initiation in squamous cell carcinoma. Nature Communications. 8 (1), 1758 (2017).
- Whelan, K. A., Muir, A. B., Nakagawa, H. Esophageal 3D culture systems as modeling tools in esophageal epithelial pathobiology and personalized medicine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 461-478 (2018).
- Sachdeva, U. M., et al. Understanding the cellular origin and progression of esophageal cancer using esophageal organoids. Cancer Letters. 509, 39-52 (2021).
- Nakagawa, H., et al. The targeting of the cyclin D1 oncogene by an Epstein-Barr virus promoter in transgenic mice causes dysplasia in the tongue, esophagus and forestomach. Oncogene. 14 (10), 1185-1190 (1997).
- Andl, C. D., et al. Epidermal growth factor receptor mediates increased cell proliferation, migration, and aggregation in esophageal keratinocytes in vitro and in vivo. The Journal of Biological Chemistry. 278 (3), 1824-1830 (2003).
- Opitz, O. G., et al. A mouse model of human oral-esophageal cancer. The Journal of Clinical Investigation. 110 (6), 761-769 (2002).
- Stairs, D. B., et al. Deletion of p120-catenin results in a tumor microenvironment with inflammation and cancer that establishes it as a tumor suppressor gene. Cancer Cell. 19 (4), 470-483 (2011).
- Tang, X. -. H., Knudsen, B., Bemis, D., Tickoo, S., Gudas, L. J. Oral cavity and esophageal carcinogenesis modeled in carcinogen-treated mice. Clinical Cancer Research. 10, 301-313 (2004).
- Fong, L. Y. Y., Mancini, R., Nakagawa, H., Rustgi, A. K., Huebner, K. Combined cyclin D1 overexpression and zinc deficiency disrupts cell cycle and accelerates mouse forestomach carcinogenesis. Cancer Research. 63 (14), 4244-4252 (2003).
- Zheng, B., et al. A new murine esophageal organoid culture method and organoid-based model of esophageal squamous cell neoplasia. iScience. 24 (12), 103440 (2021).
- Hisha, H., et al. Establishment of a novel lingual organoid culture system: generation of organoids having mature keratinized epithelium from adult epithelial stem cells. Scientific Reports. 3, 3224 (2013).
- Kalabis, J., et al. Isolation and characterization of mouse and human esophageal epithelial cells in 3D organotypic culture. Nature Protocols. 7 (2), 235-246 (2012).
- Nguyen, N., et al. TGF-β1 alters esophageal epithelial barrier function by attenuation of claudin-7 in eosinophilic esophagitis. Mucosal Immunology. 11 (2), 415-426 (2018).
- Sherrill, J. D., et al. Analysis and expansion of the eosinophilic esophagitis transcriptome by RNA sequencing. Genes and Immunity. 15 (6), 361-369 (2014).
- Ruffner, M. A., et al. Toll-like receptor 2 stimulation augments esophageal barrier integrity. Allergy. 74 (12), 2449-2460 (2019).
- Kabir, M. F., et al. Single cell transcriptomic analysis reveals cellular diversity of murine esophageal epithelium. Nature Communications. 13 (1), 1-15 (2022).
- Shimonosono, M., et al. Alcohol metabolism enriches squamous cell carcinoma cancer stem cells that survive oxidative stress via autophagy. Biomolecules. 11 (10), 1479 (2021).
- Flashner, S., Yan, K. S., Nakagawa, H. 3D organoids: An untapped platform for studying host-microbiome interactions in esophageal cancers. Microorganisms. 9 (11), 2182 (2021).
- Liu, K., et al. Sox2 cooperates with inflammation-mediated stat3 activation in the malignant transformation of foregut basal progenitor cells. Cell Stem Cell. 12 (3), 304-315 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados