A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מידול קרצינומה של תאי קשקש אוראליים-ושטיים באורגנואידים תלת-ממדיים
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר את השלבים העיקריים ליצירה ולאפיון אורגנואידים תלת-ממדיים אוראליים-ושטיים המייצגים נגעים נורמליים, פרה-נאופלסטיים ונגעי קרצינומה של תאי קשקש הנגרמים באמצעות קרצינוגנזה כימית.
Abstract
קרצינומה של תאי קשקש בוושט (ESCC) נפוצה ברחבי העולם, ומהווה 90% מכלל מקרי סרטן הוושט מדי שנה, והיא הקטלנית ביותר מבין כל קרצינומות תאי הקשקש האנושיים. למרות ההתקדמות האחרונה בהגדרת השינויים המולקולריים המלווים את ההתחלה וההתפתחות של ESCC, הפרוגנוזה של המטופלים נותרה גרועה. הביאור הפונקציונלי של שינויים מולקולריים אלה הוא השלב הבא ההכרחי ודורש מודלים שגם לוכדים את התכונות המולקולריות של ESCC וגם ניתנים למניפולציה בקלות ובזול לביאור פונקציונלי. עכברים שטופלו בעשן טבק מחקה תחמוצת 4-nitroquinoline 1-oxide (4NQO) באופן צפוי יוצרים ESCC ופרנאופלזיה של הוושט. יש לציין כי נגעים 4NQO מתעוררים גם בחלל הפה, לרוב בלשון, כמו גם בקדמת הבטן, אשר כולם חולקים את אפיתל הקשקש המרובד. עם זאת, לא ניתן פשוט לתמרן עכברים אלה לבדיקת השערות פונקציונליות, מכיוון שיצירת מודלים של עכברים איזוגניים דורשת זמן ומשאבים. כאן, אנו מתגברים על מגבלה זו על ידי יצירת אורגנואידים תלת-ממדיים (תלת-ממדיים) שמקורם בתא יחיד מעכברים שטופלו ב-4NQO כדי לאפיין תאי ESCC (ESCC) או תאים פרה-נאופלסטיים ex vivo. אורגנואידים אלה לוכדים את התכונות הבולטות של ESCC ופרנאופלזיה של הוושט, ניתן למנף אותם בזול ובמהירות ליצירת מודלים איזוגניים, וניתן להשתמש בהם לניסויי השתלה סינגניים. אנו מדגימים כיצד ליצור אורגנואידים תלת-ממדיים מרקמת ושט רגילה, פרנאופלסטית ו-SCC מורין ולתחזק ולשמר בהקפאה אורגנואידים אלה. היישומים של אורגנואידים מגוונים אלה הם רחבים וכוללים שימוש בעכברים מהונדסים גנטית ואפיון נוסף על ידי ציטומטריית זרימה או אימונוהיסטוכימיה, יצירת קווי אורגנואידים איזוגניים באמצעות טכנולוגיות CRISPR, וסינון תרופות או השתלות סינגניות. אנו מאמינים כי האימוץ הנרחב של הטכניקות המוצגות בפרוטוקול זה יאיץ את ההתקדמות בתחום זה כדי להילחם בנטל החמור של ESCC.
Introduction
קרצינומה של תאי קשקש בוושט (ESCC) היא הקטלנית ביותר מבין קרצינומות תאי הקשקש האנושיים, בשל האבחנה המאוחרת שלה, עמידות לטיפול וגרורות 1,2. ESCC נובע מאפיתל קשקשי מרובד, אשר מצפה את פני השטח הלומינליים של הוושט. אפיתל הקשקש מורכב מתאי בסיס מתרבים ותאים ממוינים בתוך שכבת התא העל-בסיסי. בתנאים פיזיולוגיים, תאי בסיס מבטאים סמנים כגון p63, Sox2 וציטוקרטין K5 ו-K14, בעוד שתאים ממוינים מבטאים K4, K13 ו-IVL. תאי הבסיס עצמם הם הטרוגניים וכוללים תאי גזע משוערים המוגדרים על ידי סמנים כגון K153 ו- CD734. בהומאוסטזיס, תאי הבסיס עוברים התמיינות טרמינלית פוסט-מיטוטית בתוך שכבת התא העל-בסיסית, בעוד שתאים ממוינים נודדים ומתפרקים לתוך הלומן כדי להשלים את חידוש האפיתל. ESCC, המזכיר את תאי המוצא שלהם, מציג התמיינות תאי קשקש בדרגות שונות. ESCC מלווה לעתים קרובות בנגעים מקדימים היסטולוגיים מולטיפוקליים, המכונים ניאופלזיה תוך-אפיתליאלית (IEN) או דיספלזיה, הכוללים תאים בזלואידים לא טיפוסיים. בנוסף לשינויים באפיתל, ESCC מציג עיצוב מחדש של רקמות בתוך התא התת-אפיתליאלי, שם ההפעלה של פיברובלסטים הקשורים לסרטן (CAFs) וגיוס תאים חיסוניים/דלקתיים מתרחשים כדי לטפח את המיקרו-סביבה המקדמת גידולים.
הפתוגנזה של ESCC כרוכה בשינויים גנטיים וחשיפה לגורמי סיכון סביבתיים. נגעים גנטיים עיקריים כוללים את השבתת הגנים מדכאי הגידול TP53 ו- CDKN2A (p16INK4A) והפעלת האונקוגנים CCND1 (ציקלין D1) ו- EGFR, אשר מגיעים לשיאם בתפקוד לקוי של מחסום מחזור התא, התפשטות חריגה והישרדות תחת לחץ גנוטוקסי הקשור לחשיפה לחומרים מסרטנים סביבתיים. ואכן, שינויים גנטיים מקיימים אינטראקציה הדוקה עם גורמי סיכון התנהגותיים וסביבתיים, לרוב שימוש בטבק ובאלכוהול. עשן טבק מכיל חומרים מסרטנים בבני אדם כגון אצטאלדהיד, שהוא גם המטבוליט העיקרי של אלכוהול. אצטאלדהיד גורם לצינורות DNA ולהצלבות DNA בין-גדיליות, מה שמוביל לנזק לדנ"א ולהצטברות מוטציות DNA וחוסר יציבות כרומוזומלית. בהינתן גירויים מיטוגניים מוגזמים והתפשטות חריגה מהפעלת אונקוגנים, הטרנספורמציה הממאירה של תאי אפיתל הוושט מתאפשרת על ידי מנגנונים להתמודדות עם לחץ גנוטוקסי, כולל הפעלת נוגדי חמצון, אוטופגיה ומעבר אפיתל-מזנכימלי (EMT). באופן מעניין, פונקציות ציטוטופרוטקטיביות אלה מופעלות לעתים קרובות בתאי גזע סרטניים ESCC (CSC) המאופיינים בביטוי CD44 גבוה (CD44H) ויש להם את היכולות של ייזום גידול, פלישה, גרורות ועמידות לטיפול 5,6,7.
ESCC עוצב בתרבית תאים ובמודלים של מכרסמים 8,9. בשלושת העשורים האחרונים פותחו מודלים חזקים של עכברים מהונדסים גנטית של ESCC. אלה כוללים עכברים טרנסגניים CCND1 ו-EGFR 10,11 ועכברי נוקאאוט p53 ו-p120Ctn 12,13. עם זאת, שינויים גנטיים בודדים אינם גורמים בדרך כלל להתפרצות מהירה של ESCC. אתגר זה כבר להתגבר על ידי השימוש של מסרטנים הוושט כי לשחזר היטב את הנגעים הגנטיים האנושיים ESCC14. לדוגמה, 4-nitroquinoline-1-oxide (4NQO) מאיץ את התפתחות ESCC בעכברים טרנסגניים CCND1 15. בשנים האחרונות, תאי גזע אפיתליאליים משוערים של הוושט, תאי אב, וגורלם בהתאמה נחקרו במודלים עכבריים 3,4 הניתנים למעקב אחר שושלת תאים. יתר על כן, עכברים אלה שניתן לעקוב אחר שושלת תאים אלה שימשו לחקר תאי המקור של ESCC וכיצד תאים כאלה יוצרים CSCs CD44H באמצעות היסטולוגיה קונבנציונלית ואפיון מולקולרי מבוסס אומיקס7.
תחום מתפתח אחד הקשור למודלים עכבריים אלה הוא היישום החדש של טכניקות תרבית תאים לניתוח תאי ESCC חיים ותאים מקדימים במערכת אורגנואידים תלת-ממדית (3D) שבה הארכיטקטורה של הרקמות המקוריות משוחזרת ex vivo 7,8,9. אורגנואידים תלת-ממדיים אלה גדלים במהירות מתרחיף חד-תאי המבודד מרקמות מורין, כולל גידולים ראשוניים וגרורתיים (למשל, בלוטות לימפה, ריאות ונגעים בכבד). התאים מוטמעים בתמצית קרום מרתף (BME) ומוזנים בתווך תרבית תאים מוגדר היטב ללא סרום. האורגנואידים התלת-ממדיים גדלים תוך 7-10 ימים, והמבנים הכדוריים המתקבלים מתאימים לתת-תרבית, שימור בהקפאה ובדיקות לניתוח מגוון תכונות ותפקודים תאיים, כולל סמני CSC, EMT, אוטופגיה, התפשטות, התמיינות ומוות תאים אפופטוטיים.
שיטות אלה יכולות להיות מיושמות באופן נרחב על תרביות אורגנואידים תלת-ממדיות שנוצרו מכל רקמת אפיתל קשקשית מרובדת, כגון רירית הראש והצוואר (חלל הפה, הלשון, הלוע והגרון) ואפילו הקיבה הקדמית. רירית הראש והצוואר רציפה עם הוושט, ושתי הרקמות חולקות ארגון רקמות, תפקוד ורגישות דומים למחלות. הן קרצינומה של תאי קשקש בראש ובצוואר (HNSCC) והן ESCC חולקים נגעים גנטיים וגורמי סיכון סביבתיים הקשורים לאורח חיים, כגון חשיפה לטבק ולאלכוהול. כדי להדגיש את הדמיון הזה, עכברים שטופלו בעשן טבק מחקה 4NQO מפתחים בקלות גם HNSCC וגם ESCC. בהתחשב בקלות שבה ניתן ליישם את הפרוטוקולים המתוארים להלן על מידול HNSCC, אנו כוללים הוראות ספציפיות להקמת תרביות אורגנואידים תלת ממדיות מנגעים אלה.
כאן, אנו מספקים פרוטוקולים מפורטים ליצירת אורגנואידים תלת-ממדיים של הוושט (MEOs) המייצגים נגעים נורמליים, פרנאופלסטיים ו-ESCC המתפתחים בעכברים שטופלו ב-4NQO. ניתן להשתמש בזני עכברים שונים, כולל זני מעבדה נפוצים כגון C57BL/6 ומעקב אחר שושלת תאים ונגזרות מהונדסות-גנטית אחרות. אנו מדגישים את שלבי המפתח, כולל בידוד של אפיתל ושט מורין רגיל או חולה, הכנת תרחיפים חד-תאיים, טיפוח וניטור של אורגנואידים תלת-ממדיים גדלים, תת-תרבית, שימור קריוגני ועיבוד לניתוחים הבאים, כולל מורפולוגיה ויישומים אחרים.
Protocol
ניסויי המורין תוכננו ובוצעו בהתאם לתקנות ותחת פרוטוקול בעלי חיים #AABB1502, נבדקו ואושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת קולומביה. העכברים שוכנו במתקן ראוי לטיפול בבעלי חיים המבטיח טיפול הומני בעכברים ומספק טיפול וטרינרי הולם לעכברים והדרכות בטיחות מעבדה לאנשי המעבדה.
1. טיפול בעכברים עם 4NQO לגרימת נגעי IEN ו-ESCC בוושט (שיקול זמן: עד 28 שבועות)
הערה: כדי ליצור MEOs המייצגים נגעים ניאופלסטיים בוושט, העכברים נתונים למסרטן כימי בתיווך 4NQO כפי שתואר קודם לכן על ידי Tang et al.14. MEOs רגילים/לא ניאופלסטיים נוצרים מעכברים לא מטופלים.
- עכברים
- אכסנו ארבעה עד חמישה עכברים בכל כלוב, והכניסו אותם למתקן לבעלי חיים למשך שבוע לפחות לפני תחילת הניסוי. כדי להפחית את האפשרות שהפרעות הקשורות לגיל גורמות לסיום מוקדם מדי של הניסוי המלא בן 28 השבועות, התחילו עם עכברים בני 8 שבועות עד 16 שבועות.
הערה: עכברי C57BL/6 במשקל של כ-20-30 גרם שימשו בפרוטוקול זה. לניסויים קצרים יותר, ניתן להשתמש בעכברים מבוגרים יותר. עכברים זכרים או נקבות מקובלים. קבוצת ביקורת (ללא טיפול, ראה סעיף 1.3.1) יש להתאים עכברים לגיל ולמין.
- אכסנו ארבעה עד חמישה עכברים בכל כלוב, והכניסו אותם למתקן לבעלי חיים למשך שבוע לפחות לפני תחילת הניסוי. כדי להפחית את האפשרות שהפרעות הקשורות לגיל גורמות לסיום מוקדם מדי של הניסוי המלא בן 28 השבועות, התחילו עם עכברים בני 8 שבועות עד 16 שבועות.
- הכנת מי שתייה המכילים 4NQO
- הכינו 1 מ"ג/מ"ל תמיסת מלאי 4NQO באתילן פרופילן גליקול (טבלה של חומרים). יש להמיס 100 מ"ג של 4NQO ב-100 מ"ל של 99.9% אתילן פרופילן גליקול בכד זכוכית בנפח 500 מ"ל המכוסה בסרט איטום. ערבבו היטב בטמפרטורת החדר (RT) באמצעות מערבל מגנטי במהירות 800 סל"ד למשך 30 דקות. יש לאחסן בטמפרטורה של 4°C.
- הוסף 900 מ"ל של מים נטולי יונים, ל- 100 מ"ל של 1 מ"ג/מ"ל תמיסת מלאי 4NQO, וערבב בהיפוך גליל מדורג מפלסטיק 2 ליטר מכוסה בסרט איטום. נפח של 1 ליטר של 100 מיקרוגרם/מ"ל 4NQO ב-10% אתילן פרופילן גליקול ישרת שני כלובי עכברים המצוידים בבקבוק שתייה של 500 מ"ל.
זהירות: יש לציין כי 4NQO הוא חומר כימי סינתטי מסרטן שעלול לגרום לסרטן. יש להצטייד בכפפות ניטריל ובמעיל מעבדה עם שרוולים ארוכים, ולנעול נעליים סגורות. שקלו הגנה מתאימה לעיניים, הגנה על הפנים וכיסוי ראש. לסילוק פסולת, יש להניח 4NQO במיכל מסומן בהתאם להנחיות מוסדיות לטיפול בפסולת מסוכנת על ידי בריאות ובטיחות סביבתית.
- טיפול עם 4NQO וניטור
- חברו את בקבוק השתייה, ותנו 4NQO דרך מי השתייה ad libitum לעכברים במשך 16 שבועות. יש להשתמש בפרופילן גליקול 10% (w/v) כאמצעי בקרה לרכב (ללא טיפול).
הערה: ניתן להשתמש במשכי זמן קצרים יותר של טיפול 4NQO כדי לגרום ל- IEN. - מלאו את המים פעם בשבוע.
- שקלו כל עכבר מדי שבוע על ידי הנחתו במיכל פלסטיק על איזון מעבדה.
- בסוף תקופת הטיפול ב-4NQO שנמשכה 16 שבועות, התחילו לתת לעכברים מי שתייה באופן קבוע במהלך תקופת התצפית שלאחר ה-4NQO למשך עד 12 שבועות (איור 1).
- עקבו אחר העכברים מדי יום לאיתור סימני מצוקה (למשל, ניידות לקויה, הביטוס כפוף והתנהגות נסוגה), דיספגיה והתייבשות. בנוסף, להעריך את העכברים מדי שבוע עבור שינויים במשקל הגוף או צריכת מזון ונוזלים. אם משקל הגוף יורד ביותר מ -10% ממשקל הגוף הראשוני, להאכיל את העכברים עם תוסף תזונה נוזלי.
הערה: אובדן משקל גוף עמיד לתוספי תזונה נוזליים עשוי להצביע על ESCC, ויש להרדים עכברים שמאבדים יותר מ-20% ממשקל גופם. חשוב לציין, MEOs יכולים להיווצר מעכברים שהומתו בטרם עת. שימו לב כי עכברי C57BL/6 ללא שינוי גנטי אינם מראים בדרך כלל סימני תחלואה או שיש להם נגעי ESCC גלויים עד סוף תקופת ההשגחה שלאחר 4NQO.
- חברו את בקבוק השתייה, ותנו 4NQO דרך מי השתייה ad libitum לעכברים במשך 16 שבועות. יש להשתמש בפרופילן גליקול 10% (w/v) כאמצעי בקרה לרכב (ללא טיפול).
- הכנת בעלי חיים
- הרדימו את העכברים בתא CO2 מלא ב-CO2 בקצב זרימה שמחליף 30%-70% מנפח התא לדקה. לאשר מוות על ידי נקע צוואר הרחם.
- הצמד את הגפיים והאף של העכבר במצב שכיבה לפלטפורמת הדיסקציה באמצעות מחטי 21 G.
- לחטא את משטח הגחון של העכבר עם 70% אתנול.
- דיסקציה (שיקול זמן: 0.5 שעות)
- פתחו את העור על ידי צביטת הפרווה האמצעית והעור כדי להבטיח שהוא משתחרר מהקרביים שמתחת. השתמש במספריים הכירורגיים כדי לבצע חתך גולגולתי, קו האמצע הגחוני מהבטן התחתונה לסנטר.
- החל מהחתך בקו האמצע, השתמש במספריים כירורגיים כדי לבצע חתכים רדיאליים המשתרעים על הגפיים משני צידי העכבר. פתח את דשי העור.
- כדי לחשוף את קנה הנשימה הצווארי, השתמש במספריים לנתח כדי לחלק את בלוטות הרוק בקו האמצע. קנה הנשימה נמצא עמוק בתוך הבלוטות.
- כדי לחשוף את קנה הנשימה החזי, להסיר את עצם החזה.
- צבטו בעדינות והרימו את הצפק במלקחיים, והשתמשו במספריים כדי לחלק את הצפק באופן קרניוקולי ולרוחב לאורך כלוב הצלעות.
- משכו בעדינות את הכבד מהמשטח הקאודלי של הסרעפת, והשתמשו במספריים כדי לבצע חתך קטן בסרעפת בחריץ עצם החזה, במיוחד במשטח הגבי של תהליך הקסיפואיד. זה משחרר את הריאה והלב מן הצדר הקרביים.
- יש להפריד את כלוב הצלעות מתכולת בית החזה. מכניסים מספריים לחתך בסרעפת, ומנתחים גולגולת לחגורת צוואר הרחם. במהלך דיסקציה זו, לדבוק היטב על פני השטח הגבי של עצם החזה כדי למנוע נזק לאיברים שמתחת. ודא כי מישור הדיסקציה הוא קדמי לקנה הנשימה.
- חותכים את הצלעות משני צדי עצם החזה באמצעות מספריים, ומסירים את עצם החזה. יש לוודא שתוכן בית החזה חשוף.
- לחשוף את הוושט הבטן. בעדינות להרים את הבטן הקדמית על ידי החזקת אנטרום עם מלקחיים. נתחו את הטחול, הלבלב והמזנטריה מהקיבה והוושט בעזרת מספריים.
- חשפו את הוושט החזי (איור 2).
- הרימו בעדינות את קנה הנשימה מיד לסחוס בלוטת התריס, ונתחו את הוושט של הצד הגבי של קנה הנשימה באמצעות מספריים של הקשתית.
- מחלקים את קנה הנשימה בסחוס בלוטת התריס בעזרת מספריים של הקשתית.
- מקלפים את קנה הנשימה משארית הוושט באמצעות דיסקציה זהירה בכיוון הקאודלי.
- הוציאו את הריאה, הלב ובלוטת התימוס בהמוניהם בעזרת קנה הנשימה. יש להקפיד להימנע מנזק לוושט בעת ניתוח וחלוקה של אבי העורקים והווריד הנבוב.
- מחלקים את הבטן בפילורוס עם מספריים.
- להפריד את הוושט מן החוליה על ידי החזקת האנטרום עם מלקחיים לנתח גולגולת.
- חלקו את הוושט לרמה של סחוס בלוטת התריס, וקצרו את הוושט והקיבה בהמוניהם (איור 3).
- הפרידו בין הקיבה לוושט על-ידי חלוקת הוושט בקרדיה (איור 4, פאנל עליון, קו אדום).
- יש לנתח כל פאשיה על פני השטח החיצוניים של הוושט. כדי להזמין מדגם עבור היסטולוגיה (אופציונלי), להסיר מחצית הוושט לפצל אורך עם מספריים. מניחים את שארית הוושט השלמה ב-PBS קר על קרח.
- פתח את הבטן לאורך העקמומיות הגדולה יותר, ושטוף עם PBS מספיק. יש להפריד את הבטן הקדמית ולשטוף עם PBS קר. מניחים את הבטן הקדמית ב-PBS קר על קרח.
- כדי לקצור את הלשון, להסיר את מחט 21 G על האף, ולשלוף את הלשון עם פינצטה. חותכים את הלשון זמן רב ככל האפשר. מניחים את הלשון ב-PBS קר על קרח.
2. הקמת תרבית אורגנואידים של הוושט (MEO)
הערה: פרוטוקול זה יכול לשמש גם כדי לבסס תרבית אורגנואידים של לשון מורין עם תוספת של שלב שבו רקמת הלשון נטחנת לפני טריפסיניזציה. ראה הערה בשלב 2.2.3.
- הכנת ריאגנטים
הערה: ניתן למצוא רשימה של ריאגנטים בטבלת החומרים. הכן ואחסן את פתרונות המלאי בהתאם להוראות היצרן אלא אם צוין אחרת.- יש לוודא כי האליציטוטים החד-פעמיים של מטריצת קרום המרתף (BME) המשמשים בפרוטוקול זה מאוחסנים בטמפרטורה של -20°C עד ליום השימוש, מופשרים לאחר מכן על קרח או בטמפרטורה של 2-8°C, ונשמרים על קרח בכל עת כאשר אינם בשימוש.
- להמיס 250 מ"ג של מעכב טריפסין סויה (STI) ב-1,000 מ"ל של PBS (ריכוז מלאי של 250 מ"ג/מ"ל), ולסנן-לעקר (0.22 מיקרומטר) אותו. מוציאים 50 מ"ל aliquots לתוך צינורות חרוטיים, ולאחסן עד 6 חודשים ב 4 ° C.
- הכן את מדיום האורגנואיד של העכבר (MOM): תוסף DMEM/F12 מתקדם עם 1 mM N-אצטיל-L-ציסטאין (NAC), 2% R-Spondin ו- Noggin מותנה בינוני (RN CM), תוסף N-2 1x, תוסף B-27 1x, HEPES 10 mM, 1x אנטיביוטיקה-אנטימיקוטית, 1x תוסף GlutaMAX ו- 100 ng/mL גורם גדילה אפידרמיס עכבר (mEGF). הכינו את MOM 500 מ"ל בכל פעם, חלקו אותו ל 50 מ"ל aliquots, ואחסנו ב 2-8 ° C עד מוכן לשימוש. יש להוסיף 0.5 מיקרוגרם/מ"ל אמפוטריצין B ו-10 מיקרומטר Y-27632 ממש לפני השימוש.
- חממו מראש את ה-MOM, 0.25% טריפסין ומעכב טריפסין מפולי סויה (STI) ל-37°C באמבט מים או חרוזים לפני השימוש.
- בידוד קרטינוציטים מרקמת העכבר המנותחת (שיקול זמן: 2 שעות)
- מעבירים את רקמת הוושט ל-500 מיקרוליטר של דיספאס ב-PBS (2.5-5 יחידות בסך הכל), ודגרים בתרמומיקסר למשך 10 דקות ב-37°C וב-800 סל"ד.
- העבירו את הרקמה לצלחת תרבית, והסירו בזהירות את שכבת השריר מהאפיתל באמצעות מלקחיים (איור 4).
הערה: שלב זה יכול להתבצע גם על ידי חוקר מנוסה לפני הדגירה עם dispase. - מעבירים את האפיתל לצינור מיקרוצנטריפוגה המכיל 500 μL של 0.25% טריפסין, ודגורים בתרמומיסר למשך 10 דקות ב-37°C וב-800 סל"ד.
הערה: אם חומר המוצא הוא רקמת לשון, טחנו את הרקמה באזמל סטרילי לחתיכות קטנות יותר, בגודל של כ-1-2 מ"מ2 , לפני הוספת הטריפסין. - צנטריפוגה קצרה עבור 5-10 שניות ב 2,000 x גרם כדי pellet את הרקמה. הכינו צינור חרוטי של 50 מ"ל עם מסננת תאים של 100 מיקרומטר. מעבירים את מתלה הרקמה/תא דרך המסננת עם קצה משעמם רחב בתנועות סיבוביות.
- הוסף 3 מ"ל של STI דרך המסננת, באמצעות תנועות סיבוביות כדי לשטוף.
- לשפשף את המסננת עם הבסיס של מזרק שחפת 1 מ"ל כדי לדחוף את התאים דרך.
- לשטוף את המסננת עם 3 מ"ל של PBS 3-5 פעמים, לקרצף את המסננת עם הבסיס של המזרק בין שטיפות.
- צנטריפוגה את הצינור ב 300 x גרם במשך 10 דקות ב 4 ° C כדי pellet את התאים.
- הסר את supernatant, משאיר 1 מ"ל של פתרון בצינור.
- השהה מחדש את הגלולה ב -1 מ"ל הנותרים, והעבר את תרחיף התא דרך מסננת תאים של 70 מיקרומטר לתוך צינור חרוטי חדש של 50 מ"ל.
- צנטריפוגה את הצינור ב 300 x גרם במשך 10 דקות ב 4 ° C כדי pellet את התאים.
- להשעות את הגלולה ב 100 μL של MOM; כוונן את עוצמת הקול לפי הצורך. בצע ספירת תאים אוטומטית על-ידי אי-הכללה של כחול טריפאן.
- זריעה של השעיית התא הראשונית (שיקול זמן: <1 שעות)
- מחממים מראש צלחת תרבית תאים של 24 בארות באינקובטור של 37 מעלות צלזיוס.
- צלחת 5,000 תאים קיימא ב 75% (v/v) BME/MOM עם נפח כולל של 50 μL לכל באר. למקסם את מספר הבארות מצופות ולהכין מספיק תאים BME עבור באר אחת נוספת על פי חישובי דוגמה להלן.
הערה: Cryopreserve כל התאים העודפים במדיום ההקפאה (10% DMSO ב- FBS) בריכוז מרבי של 1 x 106 תאים/מ"ל. אחסנו את הקריובלים במיכל הקפאה למשך הלילה בטמפרטורה של -80°C. העבירו אותם לחנקן נוזלי בשלב האדים לאחסון לטווח ארוך. - בצינור מיקרוצנטריפוגה, הכינו תחילה דילול תאים מתאים ב-MOM, ולאחר מכן הוסיפו BME באמצעות קצה בור רחב ממש לפני הציפוי.
- בעזרת קצה בור ברוחב 200 μL, הוסיפו באיטיות טיפה של 50 μL למרכז הבאר, תוך הימנעות ממגע בין הקצה לתחתית או לצידי הבאר (איור 5). היזהרו לא להשתמש בכוח רב מדי כדי לגרש את הנוזל מהקצה, אחרת הכיפה תשתטח.
- אפשר ל-BME להתמצק למשך 30 דקות באינקובטור של 37°C, 5% CO2, 95% לחות יחסית (RH).
- בזהירות להוסיף 500 μL של MOM לכל באר בתוספת 0.5 מיקרוגרם / מ"ל אמפוטריצין B ו 10 μM Y-27632.
הערה: הוסף אמפוטריצין לכל MOM במהלך התרבות הראשונית הראשונית. הוסף Y-27632 רק ביום המעבר (יום 0) לכל המעברים. - החליפו את ה-MOM בימים 3-4 ולאחר מכן כל 2-3 ימים עד למעבר מוכן.
- בימים 7-10, דמיינו את האורגנואידים, ומדדו את קצב היווצרות האורגנואידים (OFR) על ידי חלוקת מספר האורגנואידים שנוצרו במספר התאים שנזרעו בתחילה.
חישובים לדוגמה: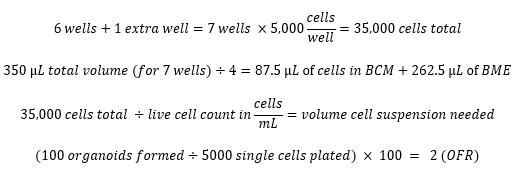
- מעבר ושימור בהקפאה של אורגנואידים של הוושט (MEOs) (שיקול זמן: <1.5 שעות)
- הפשירו ושמרו את ה-BME על קרח. יש לחמם מראש את MOM, 0.05% טריפסין ו-STI ל-37°C באמבט מים או חרוזים לפני השימוש. מחממים מראש צלחת תרבית תאים של 24 בארות באינקובטור של 37 מעלות צלזיוס.
- בעזרת קצה מיקרופיפטה רחב משעמם, אספו את האורגנואידים בכיפת ה-BME יחד עם הסופר-נטנט. לשבש את BME על ידי pipeting למעלה ולמטה.
הערה: שלב את הבארות המכילות דגימות זהות לצינור מיקרוצנטריפוגה יחיד. - צנטריפוגה קצרה עבור 10-15 שניות ב 2,000 x גרם כדי לגלול את האורגנואידים. הסר והשליך את הסופר-נטנט.
- עקרו בעדינות את הכדור, והשהו מחדש את הגלולה ב-500 מיקרוליטר של 0.05% טריפסין.
- יש לדגור על הצינור(ות) בתרמומיקסר בטמפרטורה של 37°C ו-800 סל"ד למשך 10 דקות.
- להשבית את הטריפסין עם 600 μL של STI.
- צנטריפוגה את הצינור ב 300 x גרם במשך 5 דקות ב 4 ° C כדי pellet את התאים.
- הסר והשליך את הסופר-נטנט. להשעות מחדש את גלולת התא ב 100 μL של MOM. בצע ספירת תאים אוטומטית על-ידי אי-הכללה של כחול טריפאן.
הערה: ניתן לכוונן את עוצמת הקול לפי הצורך. - צלחת 2,000-5,000 תאים קיימא ב 75% (v/v) BME/MOM עם נפח כולל של 50 μL לכל באר. למקסם את מספר הבארות מצופות ולהכין מספיק תאים BME עבור באר אחת נוספת על פי חישובי דוגמה שהוזכרו לעיל.
הערה: Cryopreserve כל התאים העודפים במדיום ההקפאה (10% DMSO ב- FBS) בריכוז מרבי של 1 x 106 תאים/מ"ל. אחסנו את הקריובלים במיכל הקפאה למשך הלילה בטמפרטורה של -80°C. העבירו אותם לחנקן נוזלי בשלב האדים לאחסון לטווח ארוך. - בצינור מיקרוצנטריפוגה, הכינו תחילה דילול תאים מתאים ב-MOM, ולאחר מכן הוסיפו BME באמצעות קצה בור רחב ממש לפני הציפוי.
- בעזרת קצה בור ברוחב 200 μL, מוסיפים באיטיות טיפה של 50 μL למרכז הבאר, תוך הימנעות ממגע בין הקצה לתחתית או לצידי הבאר. היזהרו לא להשתמש בכוח רב מדי כדי לגרש את הנוזל מהקצה, אחרת הכיפה תשתטח.
- לדגור על הצלחת במשך 30 דקות ב 37 ° C, 5% CO 2,95% CH אינקובטור.
- בזהירות להוסיף 500 μL של MOM לכל תוספת היטב עם 10 μM Y-27632.
הערה: יש להוסיף Y-27632 רק ביום המעבר (יום 0). אין צורך להוסיף אותו במהלך השינויים במדיה. הוספת אמפוטריצין B אינה נחוצה עוד. - החליפו את ה-MOM בימים 3-4 ולאחר מכן כל 2-3 ימים עד למעבר מוכן.
- בימים 7-10, דמיינו את האורגנואידים, ומדדו את ה-OFR.
- הפשרה והתאוששות של אורגנואידים הוושט (MEOs) (שיקול זמן: <1 שעות)
- הפשירו ושמרו את ה-BME על קרח. מחממים מראש צלחת תרבית תאים של 24 בארות באינקובטור של 37 מעלות צלזיוס.
- הכינו 10 מ"ל של קור או RT MOM או PBS בצינור חרוטי 15 מ"ל.
- הפשירו קריוביאל באמבט מים בטמפרטורה של 37 מעלות צלזיוס או באמבט חרוזים למשך כ-30 שניות עד דקה אחת או עד שנשארת גלולת קרח קטנה.
- בעזרת קצה צינור שהורטב מראש, העבירו באיטיות את תרחיף התא לצינור המכיל MOM או PBS בצורה טיפתית.
- צנטריפוגה את הצינור עבור 300 x גרם ו 4 ° C במשך 5 דקות כדי pellet את התאים.
- הסר והשליך את הסופר-נטנט. להשעות מחדש את גלולת התא ב 100 μL של MOM; כוונן את עוצמת הקול לפי הצורך. בצע ספירת תאים אוטומטית על-ידי אי-הכללה של כחול טריפאן.
- צלחת 5,000-10,000 תאים קיימא ב 75% (v/v) BME/MOM עם נפח כולל של 50 μL לכל באר. למקסם את מספר הבארות מצופות ולהכין מספיק תאים BME עבור באר אחת נוספת על פי חישובים לדוגמה שהוזכרו לעיל.
- המשך בשלבים הנותרים של הפרוטוקול להעברה והקפאה של אורגנואידים של הוושט (MEO) (ראה שלב 2.4.11).
3. הכנת אורגנואידים להטמעת פרפין (שיקול זמן: <שעה [ועוד שעה וחצי להכנת ריאגנטי])
- באמצעות קצה מיקרופיפטה רחב, לאסוף שלוש בארות לכל צינור מיקרוצנטריפוגה. אספו את האורגנואידים בכיפת ה-BME יחד עם הסופרנטנט. לשבש את BME על ידי pipeting למעלה ולמטה.
- צנטריפוגה קצרה עבור 10-15 שניות ב 2,000 x גרם כדי לגלול את האורגנואידים. הסר והשליך את הסופר-נטנט.
- יש לעקור בעדינות את הכדורית, ולהשהות מחדש את הגלולה ב-300 מיקרוליטר של 4% פרפורמלדהיד (PFA).
- תקן את האורגנואידים למשך הלילה ב 4 °C (75 °F).
- צנטריפוגה קצרה עבור 10-15 שניות ב 2,000 x גרם כדי לגלול את האורגנואידים. יש להסיר ולהשליך כמה שיותר PFA.
- עקרו בעדינות את הכדור, והשעו מחדש את הגלולה ב-500 מיקרוליטר של PBS.
הערה: ניתן לאחסן אורגנואידים קבועים בטמפרטורה של 4°C למשך עד שבועיים לפני שממשיכים לשלב הבא. - הכינו ציר של 50 מ"ל של ג'ל אגר (2% אגר בתוספת 2.5% ג'לטין).
הערה: הכינו את מלאי אגר ג'ל מראש, בשל זמן הדגירה, ואחריו ביצוע מחזור autoclave.- Resuspend 1 גרם של Bacto-agar ו 1.25 גרם של ג'לטין ב 50 מ"ל של מים ב 150 מ"ל autoclavable זכוכית beakker.
- סובבו את המתלים, והניחו לו לשבת במשך 30-60 דקות ב-RT.
- Autoclave במשך 20 דקות ב 121 ° C.
- מצננים מעט ומחלקים 5 מ"ל aliquots ב 15 מ"ל צינורות חרוטיים.
- אחסן עד 6 חודשים ב- RT.
- הכינו משטח הטבעה על ידי היפוך מתלה צינור מיקרוצנטריפוגה וכיסוי המשטח ביריעה של סרט איטום. תווית עם מזהי האורגנואידים המתאימים.
- צנטריפוגה את הצינור ב 300 x גרם במשך 5 דקות כדי pellet את האורגנואידים. הסר והשליך את הסופר-נטנט.
- בינתיים, לנזול את ג'ל האגר על ידי הנחת צינור חרוטי 15 מ"ל המכיל את ג'ל האגר לתוך זכוכית 150 מ"ל המכילה 100 מ"ל מים וגלי מיקרו על הגדרת העוצמה הגבוהה ביותר למשך 1-2 דקות או עד שהמים מתחילים לרתוח וג'ל האגר במצב נוזלי.
אזהרה: יש לשחרר את מכסה הצינורית החרוטית המכילה את ג'ל האגר לפני השימוש במיקרו. - יש לטבול חלקית את צינור המיקרוצנטריפוגה המכיל את גלולת האורגנואיד לתוך המים החמים מבלי להכניס מים לצינור המיקרוצנטריפוגה.
- בזהירות לכסות את גלולת אורגנואיד על ידי הוספת 50 μL של אגר בצד של הצינור.
- מבלי להפריע לגלולה (אין להשהות מחדש, לשמור על שלמות הכדור), להעביר את הגלולה בטיפת אגר ג'ל לסרט האיטום על משטח ההטבעה.
- חזור על שלב 3.12 ושלב 3.13 עם 50 μL נוספים של ג'ל אגר נוזלי כדי לאסוף כל גלולת אורגנואיד שנותרה, והוסף בזהירות לאותה טיפת ג'ל.
- לדגור על הטיפה המכילה את גלולת האורגנואיד במשך 45 דקות ב 4 ° C.
- בעזרת מלקחיים, מעבירים בזהירות את הטיפה המכילה את גלולת האורגנואיד לקלטת פתולוגיה מסומנת.
- אחסנו את הקלטת באתנול 70% בטמפרטורה של 4°C למשך עד חודש אחד.
- המשך עם הטמעת פרפין באמצעות עיבוד היסטולוגי שגרתי להכנת קוביות פרפין.
תוצאות
פרוטוקול זה מתאר את התהליך של יצירת אורגנואידים של הוושט (MEOs) מרקמת ושט רגילה או מרקמת גידול ESCC מעכברים שטופלו ב-4NQO בהתאם למשטר טיפול ספציפי המורכב מ-16 שבועות של 4NQO הניתנים במי שתייה, ולאחר מכן תקופת תצפית של 10 שבועות עד 12 שבועות (איור 1). לאחר מכן מרדימים את העכברים לצורך נתיח...
Discussion
ישנם מספר שלבים ושיקולים קריטיים ליצירה וניתוח של MEOs בפרוטוקולים המתוארים כאן. כדי להבטיח יכולת שחזור וקפדנות בניסויי MEO, שכפולים ביולוגיים וטכניים חשובים שניהם. עבור שכפולים ביולוגיים, שניים עד שלושה עכברים עצמאיים הנושאים ESCC מספיקים בדרך כלל לכל תנאי ניסוי. עם זאת, המספר המתאים של שכפול...
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
אנו מודים למשאבים המשותפים (ציטומטריית זרימה, פתולוגיה מולקולרית ומיקרוסקופיה קונפוקלית ומיוחדת) במרכז הסרטן המקיף ע"ש הרברט אירווינג באוניברסיטת קולומביה על התמיכה הטכנית. אנו מודים לד"ר אלן דיהל, אדם ג'יי בס וד"ר קווק-קין וונג (NCI P01 Mechanisms of Esophageal Carcinogenesis) ולחברי מעבדות Rustgi ו-Nakagawa על דיונים מועילים. מחקר זה נתמך על ידי מענקי NIH הבאים: P01CA098101 (H.N. ו- A.K.R.), R01DK114436 (H.N.), R01AA026297 (H.N.), L30CA264714 (S.F.), DE031112-01 (F.M.H.), KL2TR001874 (F.M.H.),3R01CA255298-01S1 (J.G.), 2L30DK126621-02
(י.ג.) R01CA266978 (C.L.), R01DK132251 (C.L.), R01DE031873 (C.L.), P30DK132710 (C.M. ו-H.N.) ו-P30CA013696 (A.K.R). H.N. ו- C.L. זכו בפרס הפיילוט Multi-PI של מרכז הסרטן המקיף ע"ש הרברט אירווינג באוניברסיטת קולומביה. H.N. הוא חתן פרס קרן המחקר פאנקוני אנמיה. פ.מ.ה. זכה בפרס קרן מארק לחקר הסרטן (20-60-51-MOME) ובפרס האגודה האמריקאית לחקר הסרטן. J.G. הוא חתן פרס האגודה הגסטרואנטרולוגית האמריקאית (AGA).
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% trypsin-EDTA | Thermo Fisher Scientific | 25-300-120 | |
| 0.25% trypsin-EDTA | Thermo Fisher Scientific | 25-200-114 | |
| 0.4% Trypan Blue | Thermo Fisher Scientific | T10282 | |
| 1 mL tuberculin syringe without needle | BD | 309659 | |
| 1.5 mL microcentrifuge tube | Thermo Fisher Scientific | 05-408-129 | |
| 100 µm cell strainer | Thermo Fisher Scientific | 22363549 | |
| 15 mL conical tubes | Thermo Fisher Scientific | 14-959-53A | |
| 200 µL wide bore micropipette tips | Thermo Fisher Scientific | 212361A | |
| 21 G needles | BD | 305167 | |
| 24 well plate | Thermo Fisher Scientific | 12-556-006 | |
| 4-Nitroquinoline-1-oxide (4NQO) | Tokyo Chemical Industry | NO250 | |
| 50 mL conical tubes | Thermo Fisher Scientific | 12-565-270 | |
| 6 well plate | Thermo Fisher Scientific | 12556004 | |
| 70 µm cell strainer | Thermo Fisher Scientific | 22363548 | |
| 99.9% ethylene propylene glycol | SK picglobal | ||
| Advanced DMEM/F12 | Thermo Fisher Scientific | 12634028 | |
| Amphotericin B | Gibco, Thermo Fisher Scientific | 15290018 | Stock concentration 250 µg/mL, final concentration 0.5 µg/mL |
| Antibiotic-Antimycotic | Thermo Fisher Scientific | 15240062 | Stock concentration 100x, final concentration 1x |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | Stock concentration 50x, final concentration 1x |
| Bacto agar | BD | 214010 | |
| CO2 incubator, e.g.Heracell 150i | Thermo Fisher Scientific | 51026406 | or equivalent |
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | AMQAX1000 | or equivalent |
| Cryovials | Thermo Fisher Scientific | 03-337-7D | |
| DietGel 76A | Clear H2O | 72-07-5022 | |
| Dimethyl sulfoxide (DMSO) | MilliporeSigma | D4540 | |
| Dispase | Corning | 354235 | Stock concentration 50 U/mL, final concentration 2.5–5 U/mL |
| Dissecting scissors | VWR | 25870-002 | |
| Dulbecco's phosphate-buffered saline (PBS) | Thermo Fisher Scientific | 14190250 | Stock concentration 1x |
| Fetal bovine serum (FBS) | HyClone | SH30071.03 | |
| Forceps | VWR | 82027-386 | |
| Freezing container | Corning | 432002 | or equivalent |
| Gelatin | Thermo Fisher Scientific | G7-500 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | Stock concentration 100x, final concentration 1x |
| HEPES | Thermo Fisher Scientific | 15630080 | Stock concentration 1 M, final concentration 10 mM |
| Hot plate/stirrer | Corning | PC-420D | or equivalent |
| Lab Armor bead bath (or water bath) | VWR | 89409-222 | or equivalent |
| Laboratory balance | Ohaus | 71142841 | or equivalent |
| Matrigel basement membrane extract (BME) | Corning | 354234 | |
| Microcentrifuge Minispin | Eppendorf | 22620100 | or equivalent |
| Microcentrifuge tube rack | Southern Labware | 0061 | |
| N-2 supplement | Thermo Fisher Scientific | 17502048 | Stock concentration 100x, final concentration 1x |
| N-acetylcysteine (NAC) | Sigma-Aldrich | A9165 | Stock concentration 0.5 M, final concentration 1 mM |
| Parafilm M wrap | Thermo Fisher Scientific | S37440 | |
| Paraformaldehyde (PFA) | MilliporeSigma | 158127-500G | |
| Pathology cassette | Thermo Fisher Scientific | 22-272416 | |
| Phase-contrast microscope | Nikon | or equivalent | |
| Recombinant mouse epidermal growth factor (mEGF) | Peprotech | 315-09-1mg | Stock concentration 500 ng/µL, final concentration 100 ng/mL |
| RN cell-conditioned medium expressing R-Spondin1 and Noggin (RN CM) | N/A | N/A | Available through the Organoid and Cell Culture Core upon request, final concentration 2% |
| Sorval ST 16R centrifuge | Thermo Fisher Scientific | 75004380 | or equivalent |
| Soybean trypsin inhibitor (STI) | MilliporeSigma | T9128 | Stock concentration 250 µg/mL |
| ThermoMixer C | Thermo Fisher Scientific | 14-285-562 PM | or equivalent |
| Y-27632 | Selleck Chemicals | S1049 | Stock concentration 10 mM, final concentration 10 µM |
References
- Rustgi, A. K., El-Serag, H. B. Esophageal carcinoma. The New England Journal of Medicine. 371 (26), 2499-2509 (2014).
- Dotto, G. P., Rustgi, A. K. Squamous cell cancers: A unified perspective on biology and genetics. Cancer Cell. 29 (5), 622-637 (2016).
- Giroux, V., et al. Long-lived keratin 15+ esophageal progenitor cells contribute to homeostasis and regeneration. The Journal of Clinical Investigation. 127 (6), 2378-2391 (2017).
- DeWard, A. D., Cramer, J., Lagasse, E. Cellular heterogeneity in the mouse esophagus implicates the presence of a nonquiescent epithelial stem cell population. Cell Reports. 9 (2), 701-711 (2014).
- Kinugasa, H., et al. Mitochondrial SOD2 regulates epithelial-mesenchymal transition and cell populations defined by differential CD44 expression. Oncogene. 34 (41), 5229-5239 (2015).
- Whelan, K. A., et al. Autophagy supports generation of cells with high CD44 expression via modulation of oxidative stress and Parkin-mediated mitochondrial clearance. Oncogene. 36 (34), 4843-4858 (2017).
- Natsuizaka, M., et al. Interplay between Notch1 and Notch3 promotes EMT and tumor initiation in squamous cell carcinoma. Nature Communications. 8 (1), 1758 (2017).
- Whelan, K. A., Muir, A. B., Nakagawa, H. Esophageal 3D culture systems as modeling tools in esophageal epithelial pathobiology and personalized medicine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 461-478 (2018).
- Sachdeva, U. M., et al. Understanding the cellular origin and progression of esophageal cancer using esophageal organoids. Cancer Letters. 509, 39-52 (2021).
- Nakagawa, H., et al. The targeting of the cyclin D1 oncogene by an Epstein-Barr virus promoter in transgenic mice causes dysplasia in the tongue, esophagus and forestomach. Oncogene. 14 (10), 1185-1190 (1997).
- Andl, C. D., et al. Epidermal growth factor receptor mediates increased cell proliferation, migration, and aggregation in esophageal keratinocytes in vitro and in vivo. The Journal of Biological Chemistry. 278 (3), 1824-1830 (2003).
- Opitz, O. G., et al. A mouse model of human oral-esophageal cancer. The Journal of Clinical Investigation. 110 (6), 761-769 (2002).
- Stairs, D. B., et al. Deletion of p120-catenin results in a tumor microenvironment with inflammation and cancer that establishes it as a tumor suppressor gene. Cancer Cell. 19 (4), 470-483 (2011).
- Tang, X. -. H., Knudsen, B., Bemis, D., Tickoo, S., Gudas, L. J. Oral cavity and esophageal carcinogenesis modeled in carcinogen-treated mice. Clinical Cancer Research. 10, 301-313 (2004).
- Fong, L. Y. Y., Mancini, R., Nakagawa, H., Rustgi, A. K., Huebner, K. Combined cyclin D1 overexpression and zinc deficiency disrupts cell cycle and accelerates mouse forestomach carcinogenesis. Cancer Research. 63 (14), 4244-4252 (2003).
- Zheng, B., et al. A new murine esophageal organoid culture method and organoid-based model of esophageal squamous cell neoplasia. iScience. 24 (12), 103440 (2021).
- Hisha, H., et al. Establishment of a novel lingual organoid culture system: generation of organoids having mature keratinized epithelium from adult epithelial stem cells. Scientific Reports. 3, 3224 (2013).
- Kalabis, J., et al. Isolation and characterization of mouse and human esophageal epithelial cells in 3D organotypic culture. Nature Protocols. 7 (2), 235-246 (2012).
- Nguyen, N., et al. TGF-β1 alters esophageal epithelial barrier function by attenuation of claudin-7 in eosinophilic esophagitis. Mucosal Immunology. 11 (2), 415-426 (2018).
- Sherrill, J. D., et al. Analysis and expansion of the eosinophilic esophagitis transcriptome by RNA sequencing. Genes and Immunity. 15 (6), 361-369 (2014).
- Ruffner, M. A., et al. Toll-like receptor 2 stimulation augments esophageal barrier integrity. Allergy. 74 (12), 2449-2460 (2019).
- Kabir, M. F., et al. Single cell transcriptomic analysis reveals cellular diversity of murine esophageal epithelium. Nature Communications. 13 (1), 1-15 (2022).
- Shimonosono, M., et al. Alcohol metabolism enriches squamous cell carcinoma cancer stem cells that survive oxidative stress via autophagy. Biomolecules. 11 (10), 1479 (2021).
- Flashner, S., Yan, K. S., Nakagawa, H. 3D organoids: An untapped platform for studying host-microbiome interactions in esophageal cancers. Microorganisms. 9 (11), 2182 (2021).
- Liu, K., et al. Sox2 cooperates with inflammation-mediated stat3 activation in the malignant transformation of foregut basal progenitor cells. Cell Stem Cell. 12 (3), 304-315 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved