È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modellazione del carcinoma a cellule squamose orale-esofagea in organoidi 3D
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive i passaggi chiave per generare e caratterizzare organoidi 3D orali-esofagei murini che rappresentano lesioni da carcinoma a cellule squamose normali, preneoplastiche e squamose indotte tramite carcinogenesi chimica.
Abstract
Il carcinoma esofageo a cellule squamose (ESCC) è prevalente in tutto il mondo, rappresentando il 90% di tutti i casi di cancro esofageo ogni anno ed è il più mortale di tutti i carcinomi a cellule squamose umane. Nonostante i recenti progressi nella definizione dei cambiamenti molecolari che accompagnano l'inizio e lo sviluppo dell'ESCC, la prognosi del paziente rimane sfavorevole. L'annotazione funzionale di questi cambiamenti molecolari è il passo successivo necessario e richiede modelli che catturino le caratteristiche molecolari dell'ESCC e possano essere manipolati in modo semplice ed economico per l'annotazione funzionale. I topi trattati con il fumo di tabacco mimetico 4-nitrochinolina 1-ossido (4NQO) formano prevedibilmente ESCC e preneoplasia esofagea. Da notare che le lesioni 4NQO insorgono anche nella cavità orale, più comunemente nella lingua, così come nel prestomaco, che condividono tutti l'epitelio squamoso stratificato. Tuttavia, questi topi non possono essere semplicemente manipolati per il test di ipotesi funzionali, poiché la generazione di modelli murini isogeni richiede molto tempo e risorse. Qui, superiamo questa limitazione generando organoidi tridimensionali (3D) derivati da singole cellule da topi trattati con 4NQO per caratterizzare ESCC murino o cellule preneoplastiche ex vivo. Questi organoidi catturano le caratteristiche salienti dell'ESCC e della preneoplasia esofagea, possono essere sfruttati in modo economico e rapido per formare modelli isogeni e possono essere utilizzati per esperimenti di trapianto singeneico. Dimostriamo come generare organoidi 3D da tessuto esofageo murino normale, preneoplastico e SCC e mantenere e crioconservare questi organoidi. Le applicazioni di questi organoidi versatili sono ampie e includono l'utilizzo di topi geneticamente modificati e l'ulteriore caratterizzazione mediante citometria a flusso o immunoistochimica, la generazione di linee di organoidi isogeneici utilizzando le tecnologie CRISPR e lo screening farmacologico o il trapianto singeneico. Riteniamo che l'adozione diffusa delle tecniche dimostrate in questo protocollo accelererà i progressi in questo campo per combattere il grave onere dell'ESCC.
Introduzione
Il carcinoma esofageo a cellule squamose (ESCC) è il più letale dei carcinomi a cellule squamose umane, a causa della sua diagnosi tardiva, della resistenza alla terapia e delle metastasi 1,2. L'ESCC nasce dall'epitelio squamoso stratificato, che riveste la superficie luminale dell'esofago. L'epitelio squamoso è composto da cellule basali proliferative e cellule differenziate all'interno dello strato cellulare soprabasale. In condizioni fisiologiche, le cellule basali esprimono marcatori come p63, Sox2 e citocheratina K5 e K14, mentre le cellule differenziate esprimono K4, K13 e IVL. Le cellule basali stesse sono eterogenee e includono cellule staminali putative definite da marcatori come K153 e CD734. Nell'omeostasi, le cellule basali subiscono una differenziazione terminale post-mitotica all'interno dello strato cellulare soprabasale, mentre le cellule differenziate migrano e si desquamano nel lume per completare il rinnovamento epiteliale. Ricordando le loro cellule di origine, ESCC mostra la differenziazione delle cellule squamose a vari livelli. L'ESCC è spesso accompagnata da lesioni precursori istologiche multifocali, note come neoplasia intraepiteliale (IEN) o displasia, comprendenti cellule basaloidi atipiche. Oltre ai cambiamenti epiteliali, ESCC mostra il rimodellamento tissutale all'interno del compartimento subepiteliale, dove avviene l'attivazione dei fibroblasti associati al cancro (CAF) e il reclutamento di cellule immunitarie / infiammatorie per favorire il microambiente che promuove il tumore.
La patogenesi dell'ESCC comporta cambiamenti genetici ed esposizione a fattori di rischio ambientali. Le lesioni genetiche chiave includono l'inattivazione dei geni oncosoppressori TP53 e CDKN2A (p16INK4A) e l'attivazione degli oncogeni CCND1 (ciclina D1) e EGFR, che culminano nella compromissione della funzione del checkpoint del ciclo cellulare, nella proliferazione aberrante e nella sopravvivenza sotto stress genotossico correlato all'esposizione ad agenti cancerogeni ambientali. In effetti, i cambiamenti genetici interagiscono strettamente con i fattori di rischio comportamentali e ambientali, più comunemente l'uso di tabacco e alcol. Il fumo di tabacco contiene agenti cancerogeni per l'uomo come l'acetaldeide, che è anche il principale metabolita dell'alcol. L'acetaldeide induce addotti del DNA e legami incrociati del DNA tra filamenti, portando a danni al DNA e all'accumulo di mutazioni del DNA e instabilità cromosomica. Dati gli eccessivi stimoli mitogenici e la proliferazione aberrante dall'attivazione dell'oncogene, la trasformazione maligna delle cellule epiteliali esofagee è facilitata da meccanismi per far fronte allo stress genotossico, tra cui l'attivazione di antiossidanti, l'autofagia e la transizione epiteliale-mesenchimale (EMT). È interessante notare che queste funzioni citoprotettive sono spesso attivate nelle cellule staminali tumorali ESCC (CSC) che sono caratterizzate da un'elevata espressione di CD44 (CD44H) e hanno le capacità di inizio del tumore, invasione, metastasi e resistenza alla terapia 5,6,7.
L'ESCC è stato modellato in coltura cellulare e in roditori modello 8,9. Negli ultimi tre decenni, sono stati sviluppati robusti modelli murini geneticamente modificati di ESCC. Questi includono topi transgenici CCND1 e EGFR 10,11 e topi knockout p53 e p120Ctn 12,13. Tuttavia, i singoli cambiamenti genetici non provocano in genere ESCC a insorgenza rapida. Questa sfida è stata superata con l'uso di agenti cancerogeni esofagei che ricapitolano bene le lesioni genetiche umane in ESCC14. Ad esempio, la 4-nitrochinolina-1-ossido (4NQO) accelera lo sviluppo di ESCC nei topi transgenici CCND1 15. Negli ultimi anni, le cellule staminali epiteliali esofagee putative, le cellule progenitrici e i loro rispettivi destini sono stati studiati in modelli murini tracciabili dalla linea cellulare 3,4. Inoltre, questi topi tracciabili dalla linea cellulare sono stati utilizzati per esplorare le cellule di origine dell'ESCC e come tali cellule danno origine alle CSC CD44H attraverso l'istologia convenzionale e la caratterizzazione molecolare basata sull'omiche7.
Un'area emergente correlata a questi modelli murini è la nuova applicazione di tecniche di coltura cellulare per analizzare ESCC vivi e cellule precursori in un sistema organoide tridimensionale (3D) in cui l'architettura dei tessuti originali è ricapitolata ex vivo 7,8,9. Questi organoidi 3D sono rapidamente cresciuti da una sospensione unicellulare isolata da tessuti mrini, compresi i tumori primari e metastatici (ad esempio, lesioni linfonodali, polmonari ed epatiche). Le cellule sono incorporate nell'estratto di membrana basale (BME) e alimentate con un mezzo di coltura cellulare privo di siero ben definito. Gli organoidi 3D crescono entro 7-10 giorni e le strutture sferiche risultanti sono suscettibili di sottocoltura, crioconservazione e saggi per analizzare una varietà di proprietà e funzioni cellulari, tra cui marcatori CSC, EMT, autofagia, proliferazione, differenziazione e morte cellulare apoptotica.
Questi metodi possono essere ampiamente applicati a colture di organoidi 3D stabilite da qualsiasi tessuto epiteliale squamoso stratificato, come la mucosa della testa e del collo (cavità orale, lingua, faringe e laringe) e persino il prestomaco. La mucosa della testa e del collo sono contigue all'esofago e i due tessuti condividono organizzazione, funzione e suscettibilità alle malattie dei tessuti simili. Sia il carcinoma a cellule squamose della testa che del collo (HNSCC) e l'ESCC condividono lesioni genetiche e fattori di rischio ambientali legati allo stile di vita come l'esposizione al tabacco e all'alcol. Sottolineando questa somiglianza, i topi trattati con il fumo di tabacco mimetico 4NQO sviluppano prontamente sia HNSCC che ESCC. Data la facilità con cui i protocolli descritti di seguito possono essere applicati alla modellazione HNSCC, includiamo istruzioni specifiche per stabilire colture di organoidi 3D da queste lesioni.
Qui, forniamo protocolli dettagliati per la generazione di organoidi 3D esofagei murini (MEO) che rappresentano lesioni normali, preneoplastiche e ESCC che si sviluppano in topi trattati con 4NQO. Possono essere utilizzati vari ceppi di topo, compresi ceppi di laboratorio comuni come C57BL / 6 e derivati tracciabili e altri derivati geneticamente modificati tracciabili dalla linea cellulare. Sottolineiamo i passaggi chiave, tra cui l'isolamento dell'epitelio esofageo murino normale o malato, la preparazione di sospensioni unicellulari, la coltivazione e il monitoraggio degli organoidi 3D in crescita, la sottocoltura, la crioconservazione e l'elaborazione per analisi successive, compresa la morfologia e altre applicazioni.
Protocollo
Gli esperimenti murini sono stati pianificati ed eseguiti in conformità con i regolamenti e secondo il protocollo animale #AABB1502, rivisti e approvati dal Comitato istituzionale per la cura e l'uso degli animali della Columbia University. I topi sono stati ospitati in un'adeguata struttura di cura degli animali che garantisce il trattamento umano dei topi e fornisce cure veterinarie appropriate per i topi e formazione sulla sicurezza di laboratorio per il personale di laboratorio.
1. Trattamento di topi con 4NQO per indurre lesioni esofagee IEN ed ESCC (considerazione del tempo: fino a 28 settimane)
NOTA: Per generare MEO che rappresentano lesioni esofagee neoplastiche, i topi sono sottoposti a carcinogenesi chimica mediata da 4NQO come precedentemente descritto da Tang et al.14. I MEO normali/non neoplastici sono generati da topi non trattati.
- Topi
- Ospitare da quattro a cinque topi per gabbia e acclimatarli alla struttura per animali per almeno 1 settimana prima di iniziare un esperimento. Per ridurre la possibilità che i disturbi legati all'età comportino la conclusione prematura dell'intero esperimento di 28 settimane, iniziare con topi di 8 settimane a 16 settimane.
NOTA: in questo protocollo sono stati utilizzati topi C57BL/6 del peso di circa 20-30 g. Per esperimenti più brevi, possono essere utilizzati topi più anziani. I topi maschi o femmine sono accettabili. I topi di controllo (nessun trattamento, vedere paragrafo 1.3.1) devono essere abbinati per età e sesso.
- Ospitare da quattro a cinque topi per gabbia e acclimatarli alla struttura per animali per almeno 1 settimana prima di iniziare un esperimento. Per ridurre la possibilità che i disturbi legati all'età comportino la conclusione prematura dell'intero esperimento di 28 settimane, iniziare con topi di 8 settimane a 16 settimane.
- Preparazione di acqua potabile contenente 4NQO
- Preparare 1 mg/mL di soluzione madre di 4NQO in glicole etilene propilenico (Tabella dei materiali). Sciogliere 100 mg di 4NQO in 100 mL di glicole etilene propilenico al 99,9% in un becher di vetro da 500 mL ricoperto di pellicola sigillante. Mescolare accuratamente a temperatura ambiente (RT) utilizzando un agitatore magnetico a 800 giri/min per 30 minuti. Conservare a 4 °C.
- Aggiungere 900 mL di acqua deionizzata autoclavata a 100 mL di soluzione madre 4NQO da 1 mg/mL e miscelare per inversione in un cilindro graduato di plastica da 2 L ricoperto di pellicola sigillante. Un volume di 1 L di 100 μg/mL 4NQO in glicole etilene propilenico al 10% servirà due gabbie per topi dotate di un beverino da 500 ml.
ATTENZIONE: Da notare, 4NQO è un cancerogeno chimico sintetico che può causare il cancro. Maneggiare con guanti in nitrile e un camice da laboratorio a maniche lunghe e indossare scarpe chiuse. Considera un'adeguata protezione degli occhi, protezione del viso e copertura della testa. Per lo smaltimento dei rifiuti, 4NQO deve essere collocato in un contenitore etichettato in conformità con le linee guida istituzionali per la gestione dei rifiuti pericolosi in base alla salute e alla sicurezza ambientale.
- Trattamento con 4NQO e monitoraggio
- Attaccare il biberon e somministrare 4NQO tramite l'acqua potabile ad libitum ai topi per 16 settimane. Utilizzare il glicole propilenico al 10% (p/v) come veicolo (nessun trattamento) di controllo.
NOTA: durate più brevi del trattamento con 4NQO possono essere utilizzate per indurre IEN. - Riempire l'acqua una volta alla settimana.
- Pesare ogni topo settimanalmente mettendolo in un contenitore di plastica su una bilancia da laboratorio.
- Alla fine del periodo di trattamento 4NQO di 16 settimane, iniziare a dare ai topi acqua potabile regolare durante il periodo di osservazione post-4NQO per un massimo di 12 settimane (Figura 1).
- Monitorare quotidianamente i topi per segni di angoscia (ad esempio, mobilità ridotta, habitus curvo e comportamento ritirato), disfagia e disidratazione. Inoltre, valutare i topi settimanalmente per i cambiamenti nel peso corporeo o nell'assunzione di cibo e liquidi. Se il peso corporeo dovesse diminuire di oltre il 10% rispetto al peso corporeo iniziale, nutrire i topi con un integratore alimentare liquido.
NOTA: Una perdita di peso corporeo refrattario agli integratori alimentari liquidi può essere indicativa di ESCC e i topi che perdono più del 20% del loro peso corporeo dovrebbero essere eutanasiati. È importante sottolineare che i MEO possono essere generati da topi eutanasizzati prematuramente. Si noti che i topi C57BL/6 senza modificazioni genetiche in genere non mostrano segni di morbilità o hanno lesioni ESCC visibili fino alla fine del periodo di osservazione post-4NQO.
- Attaccare il biberon e somministrare 4NQO tramite l'acqua potabile ad libitum ai topi per 16 settimane. Utilizzare il glicole propilenico al 10% (p/v) come veicolo (nessun trattamento) di controllo.
- Preparazione degli animali
- Eutanasia i topi in una camera CO 2 riempita con CO2 ad una velocità di flusso che sposta il 30% -70% del volume della camera al minuto. Confermare la morte per lussazione cervicale.
- Appuntare gli arti e il naso del topo in posizione supina alla piattaforma di dissezione usando aghi da 21 G.
- Disinfettare la superficie ventrale del topo con etanolo al 70%.
- Dissezione (considerazione del tempo: 0,5 h)
- Aprire la pelle pizzicando la pelliccia addominale centrale e la pelle per assicurarsi che venga rilasciata dai visceri sottostanti. Utilizzare le forbici chirurgiche per effettuare un'incisione craniocaudale della linea mediana ventrale dall'addome inferiore al mento.
- A partire dall'incisione della linea mediana, utilizzare le forbici chirurgiche per eseguire tagli radiali che si estendono agli arti su entrambi i lati del mouse. Aprire i lembi della pelle.
- Per esporre la trachea cervicale, utilizzare le forbici da dissezione per dividere le ghiandole salivari sulla linea mediana. La trachea si trova in profondità nelle ghiandole.
- Per esporre la trachea toracica, rimuovere lo sterno.
- Pizzicare delicatamente e sollevare il peritoneo con una pinza e usare le forbici per dividere il peritoneo craniocaudalmente e lateralmente lungo la gabbia toracica.
- Ritrarre delicatamente il fegato dalla superficie caudale del diaframma e usare le forbici per fare una piccola incisione nel diaframma nella tacca sternale, in particolare sulla superficie dorsale del processo xifoideo. Questo rilascia il polmone e il cuore dalla pleura viscerale.
- Separare la gabbia toracica dal contenuto toracico. Inserire le forbici nell'incisione nel diaframma e sezionare cranialmente alla cintura cervicale. Durante questa dissezione, aderire strettamente alla superficie dorsale dello sterno per evitare danni agli organi sottostanti. Assicurarsi che il piano di dissezione sia anteriore alla trachea.
- Tagliare le costole su entrambi i lati dello sterno usando le forbici e rimuovere lo sterno. Assicurarsi che il contenuto toracico sia esposto.
- Esporre l'esofago addominale. Sollevare delicatamente lo stomaco anteriormente tenendo l'antro con una pinza. Sezionare la milza, il pancreas e il mesentere dallo stomaco e dall'esofago con le forbici.
- Esporre l'esofago toracico (Figura 2).
- Sollevare delicatamente la trachea immediatamente caudale alla cartilagine tiroidea e sezionare l'esofago del lato dorsale della trachea usando le forbici dell'iride.
- Dividere la trachea sulla cartilagine tiroidea con le forbici dell'iride.
- Staccare la trachea dal resto dell'esofago con un'attenta dissezione nella direzione caudale.
- Rimuovere il polmone, il cuore e il timo in massa con la trachea. Fare attenzione ad evitare danni all'esofago quando si seziona e si divide l'aorta e la vena cava.
- Dividere lo stomaco al piloro con le forbici.
- Separare l'esofago dalla vertebra tenendo l'antro con una pinza e sezionando cranialmente.
- Dividere l'esofago a livello della cartilagine tiroidea e raccogliere l'esofago e lo stomaco in massa (Figura 3).
- Separare lo stomaco e l'esofago dividendo l'esofago al cardias (Figura 4, pannello superiore, linea rossa).
- Sezionare qualsiasi fascia sulla superficie esterna dell'esofago. Per riservare un campione per l'istologia (opzionale), rimuovere metà dell'esofago e dividere longitudinalmente con le forbici. Posizionare l'esofago intatto rimanente in PBS freddo sul ghiaccio.
- Aprire lo stomaco lungo la curvatura maggiore e lavare sufficientemente con PBS. Separare il prestomaco e lavare con PBS freddo. Posizionare il prestomaco in PBS freddo su ghiaccio.
- Per raccogliere la lingua, rimuovere l'ago da 21 G sul naso ed estrarre la lingua con una pinzetta. Tagliare la lingua il più a lungo possibile. Mettere la lingua in PBS freddo sul ghiaccio.
2. Istituzione della coltura di organoidi esofagei murini (MEO)
NOTA: Questo protocollo può anche essere utilizzato per stabilire una coltura organoide della lingua murina con l'aggiunta di un passaggio in cui il tessuto della lingua viene tritato prima della tripsinizzazione. Vedere la nota al punto 2.2.3.
- Preparazione dei reagenti
NOTA: Un elenco dei reagenti può essere trovato nella tabella dei materiali. Preparare e conservare le soluzioni madre secondo le istruzioni del fabbricante, salvo diversa indicazione.- Assicurarsi che le aliquote monouso della matrice a membrana basale (BME) utilizzate in questo protocollo siano conservate a -20 °C fino al giorno dell'uso, siano successivamente scongelate sul ghiaccio o a 2-8 °C e siano mantenute sul ghiaccio in ogni momento quando non sono in uso.
- Sciogliere 250 mg di inibitore della tripsina di soia (STI) in 1.000 ml di PBS (concentrazione madre di 250 mg/ml) e filtrare (0,22 μm). Erogare 50 mL di aliquote in tubi conici e conservare fino a 6 mesi a 4 °C.
- Preparare il mezzo organoide di topo (MOM): Integrare DMEM / F12 avanzato con 1 mM N-acetil-L-cisteina (NAC), 2% R-spondina e Noggin mezzo condizionato (RN CM), 1x integratore N-2, 1x integratore B-27, 10 mM HEPES, 1x antibiotico-antimicotico, 1x integratore GlutaMAX e 100 ng / mL fattore di crescita epidermico del topo (mEGF). Preparare il MOM 500 mL alla volta, dividerlo in aliquote da 50 mL e conservare a 2-8 °C fino al momento dell'uso. Aggiungere 0,5 μg/mL di amfotericina B e 10 μM di Y-27632 appena prima dell'uso.
- Preriscaldare il MOM, la tripsina allo 0,25% e l'inibitore della tripsina di soia (STI) a 37 °C in un bagno di acqua o perline prima dell'uso.
- Isolamento dei cheratinociti dal tessuto di topo sezionato (considerazione del tempo: 2 ore)
- Trasferire il tessuto esofageo in 500 μL di dispasi in PBS (2,5-5 unità totali) e incubare in un termomiscelatore per 10 minuti a 37 °C e 800 giri/min.
- Trasferire il tessuto in un piatto di coltura e rimuovere con cura lo strato muscolare dall'epitelio usando una pinza (Figura 4).
NOTA: Questo passaggio può essere eseguito anche da un ricercatore espertoprima dell'incubazione con dispase. - Trasferire l'epitelio in una provetta da microcentrifuga contenente 500 μL di tripsina allo 0,25% e incubare in un termomiscelatore per 10 minuti a 37 °C e 800 giri/min.
NOTA: Se il materiale di partenza è il tessuto della lingua, tritare il tessuto con un bisturi sterile in pezzi più piccoli, di circa 1-2 mm2 , prima di aggiungere la tripsina. - Centrifugare brevemente per 5-10 s a 2.000 x g per pellettare il tessuto. Preparare un tubo conico da 50 mL con un filtro cellulare da 100 μm. Trasferire la sospensione di tessuto/cellula attraverso il filtro con una punta a foro largo utilizzando movimenti circolari.
- Aggiungere 3 mL di STI attraverso il filtro, usando movimenti circolari per lavare.
- Strofinare il filtro con la base di uno stantuffo della siringa della tubercolina da 1 mL per spingere le cellule attraverso.
- Lavare il colino con 3 ml di PBS 3-5 volte, strofinando il colino con la base della siringa tra un lavaggio e l'altro.
- Centrifugare il tubo a 300 x g per 10 minuti a 4 °C per pellettare le celle.
- Rimuovere il surnatante, lasciando 1 mL di soluzione nel tubo.
- Risospendere il pellet nel restante 1 ml e trasferire la sospensione cellulare attraverso un filtro cellulare da 70 μm in un nuovo tubo conico da 50 ml.
- Centrifugare il tubo a 300 x g per 10 minuti a 4 °C per pellettare le celle.
- Risospendere il pellet in 100 μL di MOM; Regolare il volume secondo necessità. Eseguire un conteggio automatico delle celle mediante l'esclusione del blu tripano.
- Semina della sospensione cellulare iniziale (considerazione del tempo: <1 h)
- Preriscaldare una piastra di coltura cellulare a 24 pozzetti in un incubatore a 37 °C.
- Piastra 5.000 cellule vitali in BME/MOM al 75% (v/v) con 50 μL di volume totale per pozzetto. Massimizzare il numero di pozzetti placcati e preparare abbastanza celle in BME per un pozzo in più secondo i calcoli di esempio riportati di seguito.
NOTA: Crioconservare eventuali cellule in eccesso nel mezzo di crioconservazione (10% DMSO in FBS) ad una concentrazione massima di 1 x 106 cellule/ml. Conservare i crioviali in un contenitore frigorifero per una notte a -80 °C. Trasferirli in azoto liquido in fase vapore per la conservazione a lungo termine. - In una provetta per microcentrifuga, preparare prima una diluizione cellulare appropriata in MOM, quindi aggiungere BME utilizzando una punta a foro largo appena prima della placcatura.
- Utilizzando una punta larga 200 μL, aggiungere lentamente una goccia da 50 μL al centro del pozzetto, evitando il contatto tra la punta e il fondo o i lati del pozzetto (Figura 5). Fai attenzione a non usare troppa forza per espellere il liquido dalla punta, o la cupola si appiattirà.
- Lasciare solidificare il BME per 30 minuti in un incubatore a 37 °C, 5% CO2, 95% di umidità relativa (RH).
- Aggiungere con cautela 500 μL di MOM per pozzetto integrato con 0,5 μg/mL di amfotericina B e 10 μM di Y-27632.
NOTA: Aggiungere amfotericina a tutti i MOM durante la cultura primaria iniziale. Aggiungi Y-27632 solo il giorno di passaggio (giorno 0) per tutti i passaggi. - Cambia la MOM nei giorni 3-4 e poi ogni 2-3 giorni fino a quando non è pronto per il passaggio.
- Nei giorni 7-10, immagina gli organoidi e misura il tasso di formazione degli organoidi (OFR) dividendo il numero di organoidi formati per il numero di cellule inizialmente seminate.
Esempi di calcoli: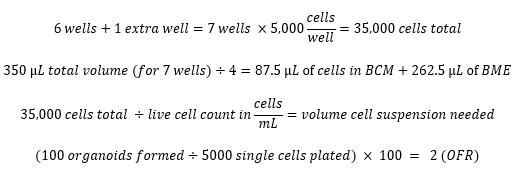
- Passaggio e crioconservazione di organoidi esofagei murini (MEO) (considerazione del tempo: <1,5 ore)
- Scongelare e mantenere il BME sul ghiaccio. Preriscaldare MOM, 0,05% tripsina e STI a 37 °C in un bagno d'acqua o di perline prima dell'uso. Preriscaldare una piastra di coltura cellulare a 24 pozzetti in un incubatore a 37 °C.
- Utilizzando una punta a micropipetta ad ampio foro, raccogliere gli organoidi nella cupola BME insieme al surnatante. Interrompere il BME con pipettaggio su e giù.
NOTA: Combinare i pozzetti contenenti campioni identici in un'unica provetta per microcentrifuga. - Centrifugare brevemente per 10-15 s a 2.000 x g per pellettare gli organoidi. Rimuovere e scartare il surnatante.
- Rimuovere delicatamente il pellet e risospendere il pellet in 500 μL di tripsina allo 0,05%.
- Incubare il/i tubo/i in un termomiscelatore a 37 °C e 800 giri/min per 10 minuti.
- Inattivare la tripsina con 600 μL di STI.
- Centrifugare il tubo a 300 x g per 5 minuti a 4 °C per pellettare le celle.
- Rimuovere e scartare il surnatante. Risospendere il pellet cellulare in 100 μL di MOM. Eseguire un conteggio automatico delle celle mediante l'esclusione del blu tripano.
NOTA: il volume può essere regolato secondo necessità. - Piastra 2.000-5.000 cellule vitali in BME/MOM al 75% (v/v) con 50 μL di volume totale per pozzetto. Massimizzare il numero di pozzetti placcati e preparare abbastanza celle in BME per un pozzo in più secondo i calcoli di esempio menzionati in precedenza.
NOTA: Crioconservare eventuali cellule in eccesso nel mezzo di crioconservazione (10% DMSO in FBS) ad una concentrazione massima di 1 x 106 cellule/ml. Conservare i crioviali in un contenitore frigorifero per una notte a -80 °C. Trasferirli in azoto liquido in fase vapore per la conservazione a lungo termine. - In una provetta per microcentrifuga, preparare prima una diluizione cellulare appropriata in MOM, quindi aggiungere BME utilizzando una punta a foro largo appena prima della placcatura.
- Utilizzando una punta larga 200 μL, aggiungere lentamente una goccia da 50 μL al centro del pozzetto, evitando il contatto tra la punta e il fondo o i lati del pozzetto. Fai attenzione a non usare troppa forza per espellere il liquido dalla punta, o la cupola si appiattirà.
- Incubare la piastra per 30 minuti in un incubatore a 37 °C, 5% CO 2,95% RH.
- Aggiungere con cautela 500 μL di MOM per pozzetto integrato con 10 μM Y-27632.
NOTA: aggiungere Y-27632 solo il giorno del passaggio (giorno 0). Non è necessario aggiungerlo durante le modifiche dei supporti. L'aggiunta di amfotericina B non è più necessaria. - Cambia la MOM nei giorni 3-4 e poi ogni 2-3 giorni fino a quando non è pronto per il passaggio.
- Nei giorni 7-10, immagina gli organoidi e misura l'OFR.
- Scongelamento e recupero degli organoidi esofagei murini (MEO) (considerazione del tempo: <1 h)
- Scongelare e mantenere il BME sul ghiaccio. Preriscaldare una piastra di coltura cellulare a 24 pozzetti in un incubatore a 37 °C.
- Preparare 10 ml di freddo o RT MOM o PBS in un tubo conico da 15 ml.
- Scongelare un criovial in un bagno d'acqua a 37 °C o in un bagno di perline per circa 30 secondi a 1 minuto o fino a quando rimane un piccolo pellet di ghiaccio.
- Con una punta del pipet pre-bagnata, trasferire lentamente la sospensione cellulare al tubo contenente MOM o PBS in modo goccia a goccia.
- Centrifugare il tubo per 300 x g e 4 °C per 5 minuti per pellettare le celle.
- Rimuovere e scartare il surnatante. Risospendere il pellet cellulare in 100 μL di MOM; Regolare il volume secondo necessità. Eseguire un conteggio automatico delle celle mediante l'esclusione del blu tripano.
- Piastra 5.000-10.000 cellule vitali in BME/MOM al 75% (v/v) con 50 μL di volume totale per pozzetto. Massimizzare il numero di pozzetti placcati e preparare abbastanza celle in BME per un pozzo in più secondo i calcoli di esempio menzionati in precedenza.
- Continuare con le restanti fasi del protocollo per il passaggio e la crioconservazione degli organoidi esofagei murini (MEO) (vedi punto 2.4.11).
3. Preparazione di organoidi per l'incorporazione di paraffina (considerazione del tempo: <1 h [più 1,5 ore per la preparazione del reagente])
- Utilizzando una punta di micropipetta a foro largo, raccogliere tre pozzetti per provetta di microcentrifuga. Raccogli gli organoidi nella cupola BME insieme al surnatante. Interrompere il BME con pipettaggio su e giù.
- Centrifugare brevemente per 10-15 s a 2.000 x g per pellettare gli organoidi. Rimuovere e scartare il surnatante.
- Rimuovere delicatamente il pellet e risospendere il pellet in 300 μL di paraformaldeide (PFA) al 4%.
- Fissare gli organoidi per una notte a 4 °C.
- Centrifugare brevemente per 10-15 s a 2.000 x g per pellettare gli organoidi. Rimuovere ed eliminare quanto più PFA possibile.
- Rimuovere delicatamente il pellet e risospendere il pellet in 500 μL di PBS.
NOTA: Gli organoidi fissi possono essere conservati a 4 °C per un massimo di 2 settimane prima di procedere alla fase successiva. - Preparare una scorta di 50 ml di gel di agar (2% di agar più 2,5% di gelatina).
NOTA: Preparare il brodo di gel di agar in anticipo, a causa del tempo di incubazione, seguito dall'esecuzione del ciclo di autoclave.- Risospendere 1 g di bacto-agar e 1,25 g di gelatina in 50 ml di acqua in un becher di vetro autoclavabile da 150 ml.
- Ruotare la sospensione e lasciarla riposare per 30-60 minuti a RT.
- Autoclave per 20 min a 121 °C.
- Raffreddare leggermente ed erogare 5 mL di aliquote in provette coniche da 15 ml.
- Conservare per un massimo di 6 mesi su RT.
- Preparare una superficie di incorporamento capovolgendo un rack di tubi per microcentrifuga e coprendo la superficie con un foglio di pellicola sigillante. Etichetta con l'ID organoide corrispondente.
- Centrifugare il tubo a 300 x g per 5 minuti per pellettare gli organoidi. Rimuovere e scartare il surnatante.
- Nel frattempo, liquefare il gel di agar posizionando un tubo conico da 15 mL contenente il gel di agar in un becher di vetro da 150 mL contenente 100 mL di acqua e cuocendo al microonde con l'impostazione di massima potenza per 1-2 minuti o fino a quando l'acqua inizia a bollire e il gel di agar è allo stato liquido.
ATTENZIONE: Allentare il tappo del tubo conico contenente il gel di agar prima di cuocere al microonde. - Immergere parzialmente il tubo della microcentrifuga contenente il pellet organoide nell'acqua calda senza introdurre acqua nel tubo della microcentrifuga.
- Sovrapporre con attenzione il pellet organoide aggiungendo 50 μL di agar lungo il lato del tubo.
- Senza disturbare il pellet (non risospendere, mantenere intatto il pellet), trasferire il pellet nella goccia di gel di agar al film sigillante sulla superficie di incorporazione.
- Ripetere il punto 3.12 e il passaggio 3.13 con altri 50 μL di gel di agar liquido per raccogliere qualsiasi pellet organoide rimanente e aggiungere con attenzione alla stessa goccia di gel.
- Incubare la goccia contenente il pellet organoide per 45 minuti a 4 °C.
- Usando una pinza, trasferire con attenzione la goccia contenente il pellet organoide in una cassetta patologica etichettata.
- Conservare la cassetta in etanolo al 70% a 4 °C per un massimo di 1 mese.
- Procedere con l'incorporazione di paraffina tramite elaborazione istologica di routine per preparare blocchi di paraffina.
Risultati
Questo protocollo descrive il processo di generazione di organoidi esofagei murini (MEO) da tessuto esofageo normale o tessuto tumorale ESCC da topi trattati con 4NQO secondo un regime di trattamento specifico costituito da 16 settimane di 4NQO somministrato in acqua potabile, seguito da un periodo di osservazione da 10 settimane a 12 settimane (Figura 1). I topi vengono quindi eutanizzati per la dissezione della lingua o del tessuto esofageo (Figura 2 e
Discussione
Ci sono diversi passaggi critici e considerazioni per la generazione e l'analisi dei MEO nei protocolli qui descritti. Per garantire la riproducibilità e il rigore negli esperimenti MEO, le repliche biologiche e tecniche sono entrambe importanti. Per le repliche biologiche, due o tre topi indipendenti portatori di ESCC sono generalmente sufficienti per condizione sperimentale. Tuttavia, il numero appropriato di repliche biologiche può variare a seconda dei parametri da testare nei singoli studi. Ad esempio, non è attu...
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Ringraziamo le risorse condivise (citometria a flusso, patologia molecolare e microscopia confocale e specializzata) presso l'Herbert Irving Comprehensive Cancer Center della Columbia University per il supporto tecnico. Ringraziamo i dottori Alan Diehl, Adam J. Bass e Kwok-Kin Wong (NCI P01 Mechanisms of Esophageal Carcinogenesis) e i membri dei laboratori Rustgi e Nakagawa per le utili discussioni. Questo studio è stato supportato dai seguenti NIH Grants: P01CA098101 (H.N. e A.K.R.), R01DK114436 (H.N.), R01AA026297 (H.N.), L30CA264714 (S.F.), DE031112-01 (F.M.H.), KL2TR001874 (F.M.H.),3R01CA255298-01S1 (J.G.), 2L30DK126621-02
(G.J.) R01CA266978 (C.L.), R01DK132251 (C.L.), R01DE031873 (C.L.), P30DK132710 (C.M. e H.N.) e P30CA013696 (A.K.R.). H.N. e C.L. hanno ricevuto il premio pilota multi-PI della Columbia University Herbert Irving Comprehensive Cancer Center. H.N. ha ricevuto il Fanconi Anemia Research Fund Award. F.M.H. ha ricevuto il premio The Mark Foundation for Cancer Research Award (20-60-51-MOME) e un American Association for Cancer Research Award. J.G. ha ricevuto il premio American Gastroenterological Association (AGA).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.05% trypsin-EDTA | Thermo Fisher Scientific | 25-300-120 | |
| 0.25% trypsin-EDTA | Thermo Fisher Scientific | 25-200-114 | |
| 0.4% Trypan Blue | Thermo Fisher Scientific | T10282 | |
| 1 mL tuberculin syringe without needle | BD | 309659 | |
| 1.5 mL microcentrifuge tube | Thermo Fisher Scientific | 05-408-129 | |
| 100 µm cell strainer | Thermo Fisher Scientific | 22363549 | |
| 15 mL conical tubes | Thermo Fisher Scientific | 14-959-53A | |
| 200 µL wide bore micropipette tips | Thermo Fisher Scientific | 212361A | |
| 21 G needles | BD | 305167 | |
| 24 well plate | Thermo Fisher Scientific | 12-556-006 | |
| 4-Nitroquinoline-1-oxide (4NQO) | Tokyo Chemical Industry | NO250 | |
| 50 mL conical tubes | Thermo Fisher Scientific | 12-565-270 | |
| 6 well plate | Thermo Fisher Scientific | 12556004 | |
| 70 µm cell strainer | Thermo Fisher Scientific | 22363548 | |
| 99.9% ethylene propylene glycol | SK picglobal | ||
| Advanced DMEM/F12 | Thermo Fisher Scientific | 12634028 | |
| Amphotericin B | Gibco, Thermo Fisher Scientific | 15290018 | Stock concentration 250 µg/mL, final concentration 0.5 µg/mL |
| Antibiotic-Antimycotic | Thermo Fisher Scientific | 15240062 | Stock concentration 100x, final concentration 1x |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | Stock concentration 50x, final concentration 1x |
| Bacto agar | BD | 214010 | |
| CO2 incubator, e.g.Heracell 150i | Thermo Fisher Scientific | 51026406 | or equivalent |
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | AMQAX1000 | or equivalent |
| Cryovials | Thermo Fisher Scientific | 03-337-7D | |
| DietGel 76A | Clear H2O | 72-07-5022 | |
| Dimethyl sulfoxide (DMSO) | MilliporeSigma | D4540 | |
| Dispase | Corning | 354235 | Stock concentration 50 U/mL, final concentration 2.5–5 U/mL |
| Dissecting scissors | VWR | 25870-002 | |
| Dulbecco's phosphate-buffered saline (PBS) | Thermo Fisher Scientific | 14190250 | Stock concentration 1x |
| Fetal bovine serum (FBS) | HyClone | SH30071.03 | |
| Forceps | VWR | 82027-386 | |
| Freezing container | Corning | 432002 | or equivalent |
| Gelatin | Thermo Fisher Scientific | G7-500 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | Stock concentration 100x, final concentration 1x |
| HEPES | Thermo Fisher Scientific | 15630080 | Stock concentration 1 M, final concentration 10 mM |
| Hot plate/stirrer | Corning | PC-420D | or equivalent |
| Lab Armor bead bath (or water bath) | VWR | 89409-222 | or equivalent |
| Laboratory balance | Ohaus | 71142841 | or equivalent |
| Matrigel basement membrane extract (BME) | Corning | 354234 | |
| Microcentrifuge Minispin | Eppendorf | 22620100 | or equivalent |
| Microcentrifuge tube rack | Southern Labware | 0061 | |
| N-2 supplement | Thermo Fisher Scientific | 17502048 | Stock concentration 100x, final concentration 1x |
| N-acetylcysteine (NAC) | Sigma-Aldrich | A9165 | Stock concentration 0.5 M, final concentration 1 mM |
| Parafilm M wrap | Thermo Fisher Scientific | S37440 | |
| Paraformaldehyde (PFA) | MilliporeSigma | 158127-500G | |
| Pathology cassette | Thermo Fisher Scientific | 22-272416 | |
| Phase-contrast microscope | Nikon | or equivalent | |
| Recombinant mouse epidermal growth factor (mEGF) | Peprotech | 315-09-1mg | Stock concentration 500 ng/µL, final concentration 100 ng/mL |
| RN cell-conditioned medium expressing R-Spondin1 and Noggin (RN CM) | N/A | N/A | Available through the Organoid and Cell Culture Core upon request, final concentration 2% |
| Sorval ST 16R centrifuge | Thermo Fisher Scientific | 75004380 | or equivalent |
| Soybean trypsin inhibitor (STI) | MilliporeSigma | T9128 | Stock concentration 250 µg/mL |
| ThermoMixer C | Thermo Fisher Scientific | 14-285-562 PM | or equivalent |
| Y-27632 | Selleck Chemicals | S1049 | Stock concentration 10 mM, final concentration 10 µM |
Riferimenti
- Rustgi, A. K., El-Serag, H. B. Esophageal carcinoma. The New England Journal of Medicine. 371 (26), 2499-2509 (2014).
- Dotto, G. P., Rustgi, A. K. Squamous cell cancers: A unified perspective on biology and genetics. Cancer Cell. 29 (5), 622-637 (2016).
- Giroux, V., et al. Long-lived keratin 15+ esophageal progenitor cells contribute to homeostasis and regeneration. The Journal of Clinical Investigation. 127 (6), 2378-2391 (2017).
- DeWard, A. D., Cramer, J., Lagasse, E. Cellular heterogeneity in the mouse esophagus implicates the presence of a nonquiescent epithelial stem cell population. Cell Reports. 9 (2), 701-711 (2014).
- Kinugasa, H., et al. Mitochondrial SOD2 regulates epithelial-mesenchymal transition and cell populations defined by differential CD44 expression. Oncogene. 34 (41), 5229-5239 (2015).
- Whelan, K. A., et al. Autophagy supports generation of cells with high CD44 expression via modulation of oxidative stress and Parkin-mediated mitochondrial clearance. Oncogene. 36 (34), 4843-4858 (2017).
- Natsuizaka, M., et al. Interplay between Notch1 and Notch3 promotes EMT and tumor initiation in squamous cell carcinoma. Nature Communications. 8 (1), 1758 (2017).
- Whelan, K. A., Muir, A. B., Nakagawa, H. Esophageal 3D culture systems as modeling tools in esophageal epithelial pathobiology and personalized medicine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 461-478 (2018).
- Sachdeva, U. M., et al. Understanding the cellular origin and progression of esophageal cancer using esophageal organoids. Cancer Letters. 509, 39-52 (2021).
- Nakagawa, H., et al. The targeting of the cyclin D1 oncogene by an Epstein-Barr virus promoter in transgenic mice causes dysplasia in the tongue, esophagus and forestomach. Oncogene. 14 (10), 1185-1190 (1997).
- Andl, C. D., et al. Epidermal growth factor receptor mediates increased cell proliferation, migration, and aggregation in esophageal keratinocytes in vitro and in vivo. The Journal of Biological Chemistry. 278 (3), 1824-1830 (2003).
- Opitz, O. G., et al. A mouse model of human oral-esophageal cancer. The Journal of Clinical Investigation. 110 (6), 761-769 (2002).
- Stairs, D. B., et al. Deletion of p120-catenin results in a tumor microenvironment with inflammation and cancer that establishes it as a tumor suppressor gene. Cancer Cell. 19 (4), 470-483 (2011).
- Tang, X. -. H., Knudsen, B., Bemis, D., Tickoo, S., Gudas, L. J. Oral cavity and esophageal carcinogenesis modeled in carcinogen-treated mice. Clinical Cancer Research. 10, 301-313 (2004).
- Fong, L. Y. Y., Mancini, R., Nakagawa, H., Rustgi, A. K., Huebner, K. Combined cyclin D1 overexpression and zinc deficiency disrupts cell cycle and accelerates mouse forestomach carcinogenesis. Cancer Research. 63 (14), 4244-4252 (2003).
- Zheng, B., et al. A new murine esophageal organoid culture method and organoid-based model of esophageal squamous cell neoplasia. iScience. 24 (12), 103440 (2021).
- Hisha, H., et al. Establishment of a novel lingual organoid culture system: generation of organoids having mature keratinized epithelium from adult epithelial stem cells. Scientific Reports. 3, 3224 (2013).
- Kalabis, J., et al. Isolation and characterization of mouse and human esophageal epithelial cells in 3D organotypic culture. Nature Protocols. 7 (2), 235-246 (2012).
- Nguyen, N., et al. TGF-β1 alters esophageal epithelial barrier function by attenuation of claudin-7 in eosinophilic esophagitis. Mucosal Immunology. 11 (2), 415-426 (2018).
- Sherrill, J. D., et al. Analysis and expansion of the eosinophilic esophagitis transcriptome by RNA sequencing. Genes and Immunity. 15 (6), 361-369 (2014).
- Ruffner, M. A., et al. Toll-like receptor 2 stimulation augments esophageal barrier integrity. Allergy. 74 (12), 2449-2460 (2019).
- Kabir, M. F., et al. Single cell transcriptomic analysis reveals cellular diversity of murine esophageal epithelium. Nature Communications. 13 (1), 1-15 (2022).
- Shimonosono, M., et al. Alcohol metabolism enriches squamous cell carcinoma cancer stem cells that survive oxidative stress via autophagy. Biomolecules. 11 (10), 1479 (2021).
- Flashner, S., Yan, K. S., Nakagawa, H. 3D organoids: An untapped platform for studying host-microbiome interactions in esophageal cancers. Microorganisms. 9 (11), 2182 (2021).
- Liu, K., et al. Sox2 cooperates with inflammation-mediated stat3 activation in the malignant transformation of foregut basal progenitor cells. Cell Stem Cell. 12 (3), 304-315 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon