Method Article
一种构建1型糖尿病大鼠伤口模型的方案
摘要
链脲佐菌素诱导的雄性SD大鼠糖尿病伤口模型是目前研究I型糖尿病伤口愈合的最广泛使用的模型。此协议描述了用于构建此模型的方法。它还提出并解决了潜在的挑战,并检查了糖尿病伤口的进展和血管生成特征。
摘要
单次高剂量链脲佐菌素注射,然后在大鼠背部进行全层皮肤切除是构建1型糖尿病伤口动物模型的常用方法。然而,操作不当会导致大鼠模型不稳定和高死亡率。不幸的是,关于1型糖尿病伤口建模的现有指南很少,而且缺乏细节,也没有提供具体的参考策略。因此,该协议详细介绍了构建1型糖尿病伤口模型的完整程序,并分析了糖尿病伤口的进展和血管生成特征。1型糖尿病伤口建模涉及以下步骤:链脲佐菌素注射液的制备,1型糖尿病的诱导以及伤口模型的构建。在损伤后第7天和第14天测量伤口面积,提取大鼠皮肤组织进行组织病理学和免疫荧光分析。结果显示,55 mg/kg链脲佐菌素诱发的1型糖尿病与较低的死亡率和高成功率有关。诱导5周后血糖水平相对稳定。第7天和第14天糖尿病创面愈合率显著低于正常创面(p < 0.05),但第14天均能达到90%以上。与正常组相比,第14天糖尿病创面表皮层闭合不完全,上皮再形成延迟,血管生成显著降低(p < 0.01)。基于该方案构建的1型糖尿病伤口模型具有慢性伤口愈合的特点,包括与正常大鼠伤口相比,闭合不良,上皮再化延迟和血管生成减少。
引言
1型糖尿病(T1DM)是一种慢性代谢性疾病,其特征是高血糖和胰腺β细胞破坏1。T1DM伤口是一种慢性不愈合的伤口,也是人类糖尿病最常见和最具破坏性的并发症2,3。动物模型是研究伤口愈合过程中的病理变化以及潜在治疗剂的安全性和有效性的最合适原型4。与其他类型相比,雄性Sprague-Dawley(SD)大鼠对链脲佐菌素(STZ)更敏感,并且表现出较低的相关死亡率,使它们在糖尿病伤口研究中很受欢迎5,6。
已经描述了许多构建T1DM伤口模型的方法。关于T1DM模型,研究主要集中在STZ注射方法对糖尿病诱导成功率的影响7,8。但是,建模过程受到同一步骤不一致操作的影响。在一项研究中,大鼠在注射STZ之前禁食18小时;注射STZ后1周血糖水平高于16.67 mmol/L的大鼠被认为是糖尿病,3周后引入糖尿病伤口9。相反,在相关研究中,Zhu等人在STZ注射前禁食大鼠12 h;注射后72 h血糖水平高于16.7 mmol/L的大鼠被认为是糖尿病,4周后10引入糖尿病伤口。总体而言,STZ注射方案,糖尿病诊断标准和伤口引入时间不一致。
在伤口建模方面,在大多数研究中,在成功诱导糖尿病后切除背侧皮肤的全厚度以构建T1DM伤口11,12,13。虽然该模型易患大鼠皮肤挛缩,但它是伤口愈合研究中最常用的模型,因为它劳动强度低且价格便宜14,15.然而,缺乏对这种全层切除技术的方法指导研究。此外,现有研究中没有关于伤口大小和位置的统一标准12,16。伤口的大小和位置可以间接影响实验设计的一致性和结果的科学有效性。因此,迫切需要一个T1DM诱导和伤口建模的标准协议作为研究人员的参考。本研究的目的是可视化T1DM伤口建模的特定方案,可用作T1DM伤口研究的参考。
研究方案
该方案是在《赫尔辛基宣言》之后进行的,所有动物实验均经成都中医药大学管理委员会批准(备案号2021-13)。
1.链脲佐菌素注射液的制备
- 选择15只SD雄性特异性无病原体(SPF)大鼠,年龄为8周,体重220克±20克。使用简单的随机化方法,将大鼠分为糖尿病组(n = 10)和正常组(n = 5)。
- 测量大鼠的初始重量,并通过施用55mg / kg确定STZ的剂量。
注意:根据预先实验,55 mg / kg是最佳STZ剂量。 - 准确称量STZ粉末,并将其放入防光容器中。
- 加入适量的0.1mol/L柠檬酸钠缓冲液(pH 4.5),将STZ溶解至1%的浓度。
注意:使用前,柠檬酸钠缓冲液必须在4°C冰箱中预冷2小时。STZ溶液的制备必须确保无菌。 - 使用药物振荡器摇晃30秒。放入冰盒中,放在一边。
注意:注射应在15分钟内使用。
2. T1DM模型的归纳
- 在STZ注射之前,将大鼠禁食18小时,并允许自由饮水。
- 进行腹膜内注射1%STZ溶液。
- 抓住大鼠,露出腹部皮肤和注射部位(连接两条大腿根部和腹部中线的线的交点)。
- 使用浸泡在75%酒精中的棉球(顺时针和逆时针一次)对注射部位消毒两次。将老鼠的头放在腹部下方。
- 将针头平行于腹部中线以45°的角度插入,刺穿皮肤后,将针角减小至30°,然后将针头插入2-3毫米。轻轻拉动针塞,确保没有血液或液体被吸入注射器。注射STZ溶液,拔出针头,用棉签止血。
注意:如果将黄色液体拉回注射器,则针头可能已穿透膀胱,如果抽出深绿色液体,则针头可能已穿透大肠或盲肠。无论哪种情况,都应立即取出针头。动物应由兽医人员进行评估。
- 在STZ诱导后第3天和第7天上午09:00测量休闲(非禁食或空腹)血糖水平。
注意:随机测量血糖的时间是固定的。在此协议中,它固定在上午 09:00。但是,这不是唯一使用的时间。通过针刺从尾静脉收集的血液比从断尾采集的血液更不容易受到组织液的影响,因此血糖值更准确。- 使用大鼠固定器固定大鼠(图1)。
- 找到尾静脉的位置。使用浸泡在75%酒精中的棉球对大鼠尾巴进行两次消毒。
- 穿刺尾静脉诱导出血,并使用血糖仪测量血糖。用棉签止血。
注意:STZ注射后第7天葡萄糖水平高于16.7 mmol/L被认为是T1DM。
- 每周称量大鼠,并测量血糖水平和其他参数,包括饮食、饮水量和尿量。
- STZ诱导后正常喂养动物8周。
3. 伤口模型的构建
- 在伤口建模前1天用电动剃须刀剃除大鼠。大鼠背侧 5 cm x 5 cm 的剃光区域通常是理想的。
- 用温暖的生理盐水棉球擦拭剃光区域,使其干燥,然后涂抹脱毛膏5分钟。用纱布清洁该区域,并用温热的生理盐水清洗任何残留的脱毛膏。
- 称量大鼠,并根据35mg / kg标准计算所需的奈布妥剂量。使用生理盐水将宁布妥溶解至浓度为3%。其他全身麻醉剂,如氯胺酮/甲苯噻嗪或异氟醚可用于此手术。请与机构动物护理和使用委员会合作,以确保什么是最好的。
注意:为确保功效,溶液应新鲜制备,宁布妥粉末和溶液应避光。 - 麻醉前将大鼠禁食12小时。腹膜内注射麻醉剂。使用四环素眼膏或一般眼部润滑剂,以防止麻醉后眼睛干燥。
注意:当大鼠的肌肉相对放松,眼球运动消失,呼吸规律,对疼痛刺激的反应很小时,麻醉被认为是适度的。 - 使用浸有碘(一次顺时针和一次逆时针)和75%酒精(交替轮)的棉球对背部皮肤进行两次消毒。
- 干燥后,用直径为20毫米的圆形活检打孔器切割皮肤。
- 用无菌镊子撑开皮肤,然后使用无菌手术剪刀沿着冲孔切割痕迹去除全层皮肤。用生理盐水棉球止血。
注意:伤口的上缘应位于下肩胛骨边界下方5-10毫米,大鼠脊柱右侧/左侧5-10毫米(图2)。当构建两个伤口时,伤口沿着脊柱对称。 - 使用凡士林纱布覆盖伤口,并用纱布和用橡胶胶带固定的透气绷带包裹伤口。皮下注射卡洛芬(5 mg/kg),每日一次,以缓解术后疼痛。每天更换一次伤口绷带(使用卡洛芬缓解疼痛)。
注意:绷带完成后观察大鼠的运动和呼吸是否有任何异常,并确保透气绷带适当收紧。 - 在伤口下放一把尺子,用数码相机拍摄伤口,直到第14天。根据第14天根据机构动物护理和使用指南对大鼠实施安乐死。从伤口边缘切开伤口皮肤组织5毫米。将组织样本分成两部分,用PBS洗涤以去除可见的血迹,然后用4%多聚甲醛溶液固定。
4. 使用ImageJ软件计算伤口面积
- 打开软件后点击 文件 按钮,然后下拉并单击 打开 打开 伤口图片。
- 选择 直线 工具,然后沿着伤口图片中的标尺绘制一条 1 厘米的直线。
- 单击分析菜单中的设置比例命令,然后将已知距离设置为 1。
- 选择 "手绘选择 "工具,然后在图片上勾勒伤口的轮廓。
- 单击"分析"菜单中的"测量"命令,并在结果弹出后读取"面积"值。
5. 苏木精和伊红(H&E)染色
- 从固定剂中取出皮肤组织,在通风橱中用手术刀将其切成薄片,然后将其放入脱水盒中。
- 将脱水盒放入脱水机中,并按照以下步骤使组织脱水:75%酒精4小时;85%酒精2小时;90%酒精2小时;95%酒精1小时;无水乙醇I和II各30分钟;酒精苯5-10分钟;二甲苯I和II各5-10分钟;和蜡I,II和III各1小时。
- 将纸巾嵌入蜡中。在冷冻台上冷却-20°,并整齐地纠正蜡块。
- 使用石蜡切片机将蜡块纵向切割成 3 μm 厚的切片。
- 依次将切片浸泡在二甲苯I和II中各20分钟,无水乙醇I和II各浸泡5分钟,自来水浸泡5分钟。
- 用苏木精染色剂淹没组织3-5分钟,0.5%盐酸水溶液分化,0.5%氨水溶液恢复蓝色,并用水冲洗。
- 用85%和95%的酒精使组织切片脱水。用伊红染色溶液淹没组织5分钟。
注意:通常,伊红染色需要30秒至2分钟,时间可以根据染色结果和要求进行调整。 - 用以下溶液依次脱水切片:无水乙醇I,无水乙醇II,无水乙醇III,二甲苯I和二甲苯II,每次5分钟。最后,用中性香脂覆盖载玻片。
- 在显微镜下以40x,20x和10x检查H&E染色的组织,并拍照以保留每张载玻片的代表性图像。
6. CD31免疫荧光染色
- 将组织切片浸泡在二甲苯I和II中各15分钟,无水乙醇I和II各浸泡5分钟,85%酒精浸泡5分钟,75%酒精浸泡5分钟,并用蒸馏水冲洗。
- 抗原修复
- 将合适的10 mM柠檬酸缓冲液,pH 6.0添加到微波炉容器中,将其加热至高沸腾,然后将载玻片放入其中。
- 在中火上煮8分钟,停止8分钟,然后再次用中低火煮沸7分钟。
- 让载玻片冷却,将它们放入PBS(pH 7.4)中,并使用脱色摇床洗涤三次,每次5分钟。
- 在圆圈中滴加5%山羊血清,孵育30分钟。
- 轻轻摇下封盖溶液(5%山羊血清),并将兔抗CD31抗体(使用PBS以1:200的比例稀释)滴加到切片上。将切片放入湿箱中,并在 4°C 下孵育过夜。
- 在脱色摇床上用PBS(pH 7.4)洗涤载玻片三次,每次5分钟。轻轻摇动切片使其干燥,然后用一滴圆形的 FITC 标记的山羊抗兔 IgG 覆盖它们。在室温下在黑暗中孵育50分钟。
- 在脱色摇床上用PBS(pH 7.4)洗涤载玻片三次,每次5分钟。用轻微摇动风干切片,并加入DAPI染色溶液。在室温下在黑暗中孵育切片10分钟。
- 干燥切片后,用PepPen在组织周围画圆圈(以防止抗体丢失),向圆圈中加入自发荧光猝灭剂(0.3%苏丹黑B)5分钟,然后在流水下冲洗10分钟。
- 在脱色摇床上用PBS(pH 7.4)洗涤载玻片三次,每次5分钟。稍微摇动切片,并用防淬灭安装剂密封。
- 在荧光显微镜下以40x,20x和10x观察和拍摄切片。
注意:DAPI 紫外激发波长为 330-380 nm,发射波长为 420 nm(蓝光)。FITC激发波长为465-495nm,发射波长为515-555nm(绿光)。
7. 统计分析
- 使用 SPSS 收集和分析数据。
- 将数据报告为平均值±标准差。
- 使用独立样本 t 检验分析糖尿病组和正常组之间的差异。
- 将统计显著性设置为 **p < 0.01 和 *p < 0.05。
结果
共有10只SD大鼠接受单次STZ腹膜内注射以诱导T1DM模型。一只大鼠过早死亡(10%),但所有大鼠(100%)都诱发了糖尿病。注射STZ3 d后,所有大鼠的血糖水平均高于16.7 mmol/L,诱导后5周血糖水平稳定(图3A)。STZ注射后糖尿病组的体重逐渐增加,但在第3周下降,然后从第4周开始再次缓慢增加(图3B)。相比之下,正常组大鼠体重稳步增加,糖尿病诱导后3天的平均体重高于糖尿病组(图3B)。糖尿病大鼠均表现出口渴、多尿和体重减轻的典型症状,与Hao等人的发现相似17。
在受伤后第7天和第14天,宏观分析显示,正常组大鼠的再上皮化比糖尿病组更明显(图4A)。定量结果显示,第7天和第14天,糖尿病组伤口愈合率显著低于正常组(p < 0.01)。然而,在第14天,糖尿病组的伤口愈合率也可能超过90%(p < 0.05, 图4B)。这表明T1DM伤口模型的特征是闭合不良,但未达到人类糖尿病伤口中慢性不愈合的程度。
与正常组相比,伤口愈合第14天的H&E染色显示,糖尿病组的伤口表皮不完整,角质形成细胞增殖缓慢,再上皮化延迟。糖尿病伤口显示毛囊和皮脂腺部分脱落。可见毛细血管也较少(图5)。
糖尿病引起内皮细胞功能障碍、细胞外基质蛋白糖基化和血管去神经支配18.这些并发症导致糖尿病伤口的伤口血管生成低于正常水平18。血管生成是伤口愈合所必需的,伤口血管生成经常通过CD31免疫染色进行分析(图6A)19,20。基于CD31表达的平均光密度(AOD),正常伤口部位的血管生成明显高于糖尿病组(p < 0.01, 图6B)。
图1:被固定器固定的大鼠图片。 请点击此处查看此图的大图。
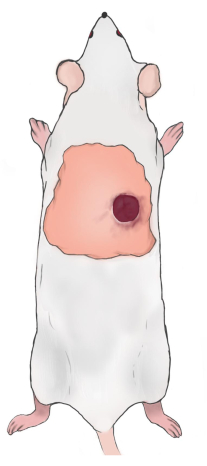
图2:大鼠伤口位置图。 请点击此处查看此图的大图。
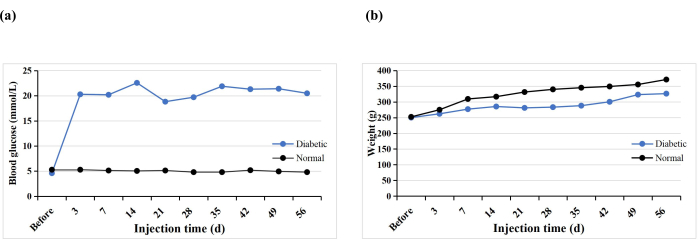
图3:实验大鼠的血糖水平和体重。 请点击此处查看此图的大图。
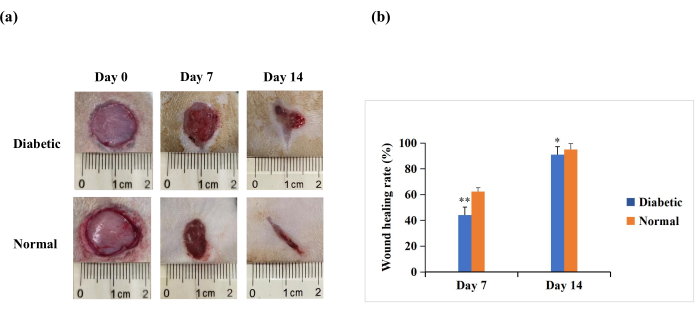
图4:实验大鼠背部的全层皮肤伤口(直径20毫米)。 (A)第0天,第7天和第14天伤口的宏观外观。用数码相机拍摄第0天、第7天和第14天的伤口形态学图像。(B)使用ImageJ软件测量伤口面积,并用于计算伤口愈合率。伤口愈合率(%)计算如下:(初始伤口面积-指定时间点的伤口面积)/初始伤口面积×100。这些值表示为平均值±标准偏差 (n = 14)。统计学意义设定为** p < 0.01和* p < 0.05。 请点击此处查看此图的大图。
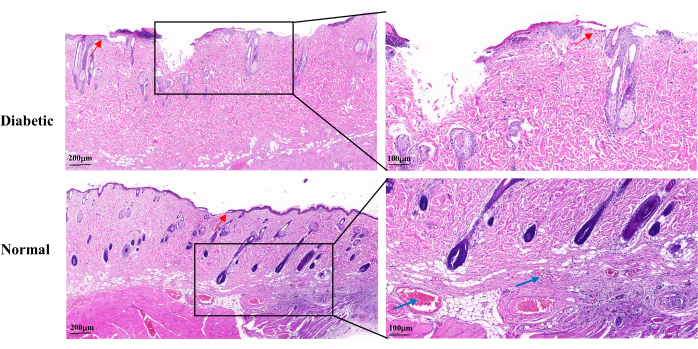
图5:伤口建立后第14天的代表性组织病理学H&E图像。 蓝色箭头表示毛细血管。红色箭头显示角质形成细胞的增殖。左刻度:一巴= 200 μm;右刻度:一巴 = 100 μm。 请点击此处查看此图的大图。
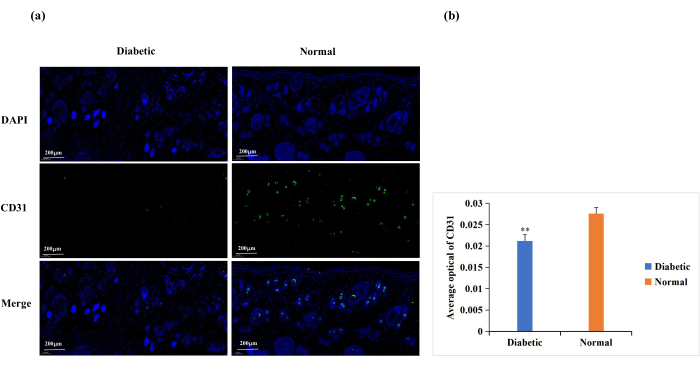
图6:CD31表达的免疫荧光染色分析。 CD31水平用于确定血管生成状态。(A)糖尿病和正常组CD31免疫荧光染色的代表性图像。使用Image-Pro Plus 6.0软件计算每个皮肤样品的积分光密度(IOD)值和像素面积(AREA)。还推导出了平均光密度(AOD)值(AOD = IOD/AREA)。AOD值与CD31的阳性表达成正比。(B)糖尿病组和正常组CD31阳性表达的定量比较。数据以标准偏差±平均值表示** p < 0.01。刻度:一巴 = 200 μm。 请点击此处查看此图的大图。
讨论
该协议阐明了T1DM伤口建模中存在争议的操作。这项工作解决了对STZ注射方案,T1DM诱导成功标准,血糖稳定时间以及伤口位置和大小的关注。此外,还阐明了T1DM伤口愈合评估的病理特征和可测量参数。
大鼠在STZ注射前禁食18小时,以避免葡萄糖或其类似物与β细胞的竞争性结合,这可能会影响STZ的功效。诱导T1DM最常用的方法是单次高剂量的STZ,它通过破坏胰岛和减少胰岛素分泌来增加血糖21。实验前试验表明,高成功率和低死亡率的最佳STZ剂量为55mg / kg,低于先前研究中报告的最佳剂量22,23,24。在该方案中,使用55mg / kg STZ的单次腹膜内注射诱导T1DM。
注射STZ后3天血糖水平均高于16.7 mmol/L。然而,STZ注射后第7天的血糖水平高于16.7 mmol/L是成功T1DM建模的推荐标准,因为胰岛损伤的程度因大鼠而异,适当延长诊断时间可以降低假阴性率。此外,STZ注射后5周血糖波动稳定,在此期间大鼠体重逐渐增加,与先前的发现一致25,26。这表明T1DM模型中的血糖水平应稳定至少6周,并且6周后大鼠体重的增加降低了伤口建模期间的死亡率。因此,该协议在STZ注射后8周进行了伤口建模。
糖尿病患者在伤口后第7天和第14天的伤口闭合率明显低于正常伤口组,表明愈合缓慢。此外,糖尿病患者的伤口再上皮化和血管生成明显低于正常组。这表明T1DM伤口模型的伤口愈合和再上皮化延迟比正常大鼠慢,这可能与伤口血管生成减少的病理变化有关。然而,在第14天,T1DM伤口愈合率也在90%以上,这与人类糖尿病伤口的慢性不愈合特征不同。这可能是因为啮齿动物伤口愈合的生理机制与人类不同27。因此,最佳伤口直径至少为20毫米,足以让时间评估干预措施在糖尿病伤口研究中的疗效。伤口位置应避开肩胛骨和脊柱,因为这两个部位的连续运动可能会破坏伤口愈合。
总之,使用该方案的方法构建T1DM伤口模型是有效的。该方案复制了慢性糖尿病伤口的一些特征,例如与正常大鼠伤口相比,伤口愈合较慢,再上皮化延迟以及血管生成减少。然而,尚不清楚该模型是否可以复制糖尿病伤口的其他慢性表型。此外,该协议描述了最基本和广泛使用的方法,该方法不考虑大鼠皮肤收缩的问题。未来的研究可以将伤口夹板的使用纳入该协议或探索慢性糖尿病伤口的其他模型,这将是未来研究人员面临的重大挑战。
披露声明
所有作者声明本手稿没有利益冲突。
致谢
这项研究得到了中国国家自然科学基金(82104877)的资助。
材料
| Name | Company | Catalog Number | Comments |
| Antifade mounting medium | Southern Biotechnology Associates, Inc. | 0100-01 | |
| AutoFluo Quencher | Servicebio Technology co., Ltd. | G1221 | |
| Automatic slide stainer | Thermo Fisher Scientific Inc. | Varistain™ Gemini ES | |
| CD31 | Servicebio Technology co., Ltd. | GB11063-2 | |
| Citrate antigen retrieval solution | Servicebio Technology co., Ltd. | G1201 | |
| Cover glass | Citotest Labware Manufacturing Co., Ltd. | 10212432C | |
| DAPI | Servicebio Technology co., Ltd. | G1012 | |
| Decolorization shaker | Scilogex | S1010E | |
| Depilatory cream | Guangzhou Ruixin Biotechnology Co., Ltd. | — | |
| Dimethyl benzene | Chengdu Kelong Chemical Co., Ltd. | 64-17-5 | |
| Drug oscillator | Shenzhen Jiashi Technology Co., Ltd. | VM-370 | |
| Electric razor | Shanghai Flyco Electrical Appliance Co., Ltd. | FC5908 | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd. | JB-P5 | |
| Ethanol absolute | Chengdu Kelong Chemical Co., Ltd. | 1330-20-7 | |
| Fitc-labeled goat anti-rabbit IgG | Servicebio Technology co., Ltd. | GB22303 | |
| Goat serum | Thermo Fisher Scientific Inc. | 16210064 | |
| Hematoxylin and eosin staining solution | Beijing Regan Biotechnology Co., Ltd. | DH0020 | |
| Image J software | National Institutes of Health | — | |
| Microwave oven | Midea Group Co., Ltd. | M1-L213B | |
| Mini centrifuge | Scilogex | D1008 | |
| Neutral balsam | Sinopharm Chemical Reagent Co., Ltd | 10004160 | |
| PBS buffer | Biosharp | G4202 | |
| Portable blood glucose meter | Sinocare Inc. | GA-3 | |
| Rapid tissue processor | Thermo Fisher Scientific Inc. | STP420 ES | |
| Rat fixator | Globalebio (Beijing) Technology co., Ltd | GEGD-Q10G1 | |
| Slicing machine | Thermo Fisher Scientific Inc. | HM325 | |
| Slides glass | Citotest Labware Manufacturing Co., Ltd. | 80312-3181 | |
| sodium citrate buffer | Beijing Solarbio Science & Technology Co., Ltd. | c1013 | |
| Streptozotocin | Sigma | 57654595 |
参考文献
- Zimmet, P., Alberti, K. G., Shaw, J. Global and societal implications of the diabetes epidemic. Nature. 414 (6865), 782-787 (2001).
- Grennan, D. Diabetic foot ulcers. Journal of the American Medical Association. 321 (1), 114(2019).
- Eming, S. A., Martin, P., Tomic-Canic, M. Wound repair and regeneration: Mechanisms, signaling, and translation. Science Translational Medicine. 6 (265), 265sr6(2014).
- Patel, S., Srivastava, S., Singh, M. R., Singh, D. Mechanistic insight into diabetic wounds: Pathogenesis, molecular targets and treatment strategies to pace wound healing. Biomedicine & Pharmacotherapy. 112, 108615(2019).
- Deeds, M. C., et al. Single dose streptozotocin-induced diabetes: Considerations for study design in islet transplantation models. Laboratory Animals. 45 (3), 131-140 (2011).
- Chao, P. C., et al. Investigation of insulin resistance in the popularly used four rat models of type-2 diabetes. Biomedicine & Pharmacotherapy. 101, 155-161 (2018).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Current Protocols. 1 (4), e78(2021).
- Wu, J., Yan, L. J. Streptozotocin-induced type 1 diabetes in rodents as a model for studying mitochondrial mechanisms of diabetic β cell glucotoxicity. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy. 8, 181-188 (2015).
- Yang, J., Chen, Z., Pan, D., Li, H., Shen, J. Umbilical cord-derived mesenchymal stem cell-derived exosomes combined pluronic F127 hydrogel promote chronic diabetic wound healing and complete skin regeneration. International Journal of Nanomedicine. 15, 5911-5926 (2020).
- Zhu, Y., Wang, Y., Jia, Y., Xu, J., Chai, Y. Roxadustat promotes angiogenesis through HIF-1α/VEGF/VEGFR2 signaling and accelerates cutaneous wound healing in diabetic rats. Wound Repair and Regeneration. 27 (4), 324-334 (2019).
- Shao, Z., et al. Wound microenvironment self-adaptive hydrogel with efficient angiogenesis for promoting diabetic wound healing. Bioactive Materials. 20, 561-573 (2022).
- Asfour, H. Z., et al. Enhanced healing efficacy of an optimized gabapentin-melittin nanoconjugate gel-loaded formulation in excised wounds of diabetic rats. Drug Delivery. 29 (1), 1892-1902 (2022).
- Wei, L., et al. Mesenchymal stem cells promote wound healing and effects on expression of matrix metalloproteinases-8 and 9 in the wound tissue of diabetic rats. Stem Cells and Development. 32 (1-2), 25-31 (2022).
- Pastar, I., et al. Preclinical models for wound-healing studies. In Skin Tissue Models., edited by. , Academic Press. Cambridge, MA. 223-253 (2018).
- Yang, R. H., et al. Epidermal stem cells (ESCs) accelerate diabetic wound healing via the Notch signalling pathway. Bioscience Reports. 36 (4), e00364(2016).
- Suliman Maashi, M., Felemban, S. G., Almasmoum, H. A., Jarahian, M. Nicaraven-loaded electrospun wound dressings promote diabetic wound healing via proangiogenic and immunomodulatory functions: A preclinical investigation. Drug Delivery and Translational Research. 13 (1), 222-236 (2023).
- Hao, M., Ding, C., Sun, S., Peng, X., Liu, W. Chitosan/sodium alginate/velvet antler blood peptides hydrogel promotes diabetic wound healing via regulating angiogenesis, inflammatory response and skin flora. Journal of Inflammation Research. 15, 4921-4938 (2022).
- Kolluru, G. K., Bir, S. C., Kevil, C. G. Endothelial dysfunction and diabetes: Effects on angiogenesis, vascular remodeling, and wound healing. International Journal of Vascular Medicine. 2012, 918267(2012).
- Okonkwo, U. A., DiPietro, L. A. Diabetes and wound angiogenesis. International Journal of Molecular Sciences. 18 (7), 1419(2017).
- Yi, C., et al. Targeted inhibition of endothelial calpain delays wound healing by reducing inflammation and angiogenesis. Cell Death & Disease. 11 (7), 533(2020).
- Goodson 3rd, W. H., Hung, T. K. Studies of wound healing in experimental diabetes mellitus. Journal of Surgical Research. 22 (3), 221-227 (1977).
- Luippold, G., Klein, T., Mark, M., Empagliflozin Grempler, R. a novel potent and selective SGLT-2 inhibitor, improves glycaemic control alone and in combination with insulin in streptozotocin-induced diabetic rats, a model of type 1 diabetes mellitus. Diabetes, Obesity & Metabolism. 14 (7), 601-607 (2012).
- Sayed, N., et al. Effect of dapagliflozin alone and in combination with insulin in a rat model of type 1 diabetes. The Journal of Veterinary Medical Science. 82 (4), 467-474 (2020).
- Han, Y., et al. Human umbilical cord mesenchymal stem cells implantation accelerates cutaneous wound healing in diabetic rats via the Wnt signaling pathway. European Journal of Medical Research. 24 (1), 10(2019).
- Ansell, D. M., Marsh, C., Walker, L., Hardman, M. J., Holden, K. Evaluating STZ-induced impaired wound healing in rats. Journal of Investigative Dermatology. 138 (4), 994-997 (2018).
- Liu, Y., et al. Human umbilical cord-derived mesenchymal stem cells not only ameliorate blood glucose but also protect vascular endothelium from diabetic damage through a paracrine mechanism mediated by MAPK/ERK signaling. Stem Cell Research & Therapy. 13 (1), 258(2022).
- Zindle, J. K., Wolinsky, E., Bogie, K. M. A review of animal models from 2015 to 2020 for preclinical chronic wounds relevant to human health. Journal of Tissue Viability. 30 (3), 291-300 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。