Method Article
Tip 1 Diyabetin Sıçan Yara Modelini Oluşturmak İçin Bir Protokol
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Erkek SD sıçanlarda streptozotosin ile indüklenen diyabetik yara modeli şu anda tip I diabetes mellitusta yara iyileşmesini incelemek için en yaygın kullanılan modeldir. Bu protokol, bu modeli oluşturmak için kullanılan yöntemleri açıklar. Ayrıca potansiyel zorlukları sunar ve ele alır ve diyabetik yaraların ilerlemesini ve anjiyojenik özelliklerini inceler.
Özet
Tek bir yüksek dozda streptozotosin enjeksiyonu ve ardından sıçanların dorsumunda tam kalınlıkta deri eksizyonu, tip 1 diyabetik yaraların hayvan modellerini oluşturmak için yaygın bir yöntemdir. Bununla birlikte, yanlış manipülasyon, sıçanlarda model instabilitesine ve yüksek mortaliteye yol açabilir. Ne yazık ki, tip 1 diyabetik yara modellemesi ile ilgili mevcut az sayıda kılavuz vardır ve bunlar ayrıntıdan yoksundur ve spesifik referans stratejileri sunmamaktadır. Bu nedenle, bu protokol tip 1 diyabetik yara modeli oluşturmak için tüm prosedürü detaylandırır ve diyabetik yaraların ilerlemesini ve anjiyojenik özelliklerini analiz eder. Tip 1 diyabetik yara modellemesi aşağıdaki adımları içerir: streptozotosin enjeksiyonunun hazırlanması, tip 1 diabetes mellitusun indüksiyonu ve yara modelinin yapımı. Yara alanı yaralanmadan sonraki 7. ve 14. günde ölçüldü ve sıçanların deri dokuları histopatolojik ve immünofloresan analizi için çıkarıldı. Sonuçlar, 55 mg/kg streptozotosin ile indüklenen tip 1 diabetes mellitusun daha düşük mortalite ve yüksek başarı oranı ile ilişkili olduğunu ortaya koymuştur. Kan şekeri seviyeleri, 5 haftalık indüksiyondan sonra nispeten stabildi. Diyabetik yara iyileşme hızı 7. ve 14. günde normal yaralardan anlamlı derecede düşüktü (p < 0.05), ancak her ikisi de 14. günde %90'ın üzerine çıkabiliyordu. Normal grupla karşılaştırıldığında, 14. günde diyabetik yaraların epidermal tabaka kapanması eksikti ve yeniden epitelizasyonu geciktirdi ve anjiyogenezi anlamlı olarak düşürdü (p < 0.01). Bu protokole dayalı olarak oluşturulan tip 1 diyabetik yara modeli, normal sıçan yaralarına kıyasla zayıf kapanma, gecikmiş yeniden epitelizasyon ve azalmış anjiyogenez gibi kronik yara iyileşmesi özelliklerine sahiptir.
Giriş
Tip 1 diabetes mellitus (T1DM), hiperglisemi ve pankreas β hücrelerinin yıkımı ile karakterize kronik metabolik bir hastalıktır1. T1DM yarası, kronik iyileşmeyen bir yaradır ve insanlarda diyabetin en yaygın ve yıkıcı komplikasyonudur 2,3. Hayvan modelleri, yara iyileşmesi sırasındaki patolojik değişiklikleri ve potansiyel terapötik ajanların güvenliğini ve etkinliğini incelemek için en uygun prototiplerdir4. Diğer tiplerle karşılaştırıldığında, erkek Sprague-Dawley (SD) sıçanları streptozotosine (STZ) karşı daha duyarlıdır ve daha düşük ilişkili ölüm oranı gösterir, bu da onları diyabetik yara araştırmalarında popüler hale getirir 5,6.
T1DM yara modellerinin oluşturulması için çok sayıda yöntem tanımlanmıştır. T1DM modeli ile ilgili olarak, çalışmalar öncelikle STZ enjeksiyon yönteminin diyabet indüksiyonunun başarı oranı üzerindeki etkisine odaklanmıştır 7,8. Bununla birlikte, modelleme süreci aynı adımın tutarsız çalışmasından muzdariptir. Bir çalışmada, sıçanlar STZ enjeksiyonundan önce 18 saat boyunca oruç tuttular; STZ enjeksiyonundan 1 hafta sonra kan şekeri 16.67 mmol/L'den yüksek olan sıçanlar diyabetik olarak kabul edildi ve diyabetik yara 3 hafta sonra tanıtıldı9. Tersine, ilgili bir çalışmada, Zhu ve ark. STZ enjeksiyonundan önce 12 saat boyunca sıçanları oruç tuttular; Enjeksiyondan 72 saat sonra kan şekeri seviyesi 16.7 mmol / L'den yüksek olan sıçanlar diyabetik olarak kabul edildi ve diyabetik yara 4 hafta sonra tanıtıldı10. Genel olarak, STZ enjeksiyon protokollerinde, diyabet tanı kriterlerinde ve yara giriş sürelerinde tutarsızlıklar vardır.
Yara modellemesi açısından, çoğu çalışmada, dorsal derinin tam kalınlığı, başarılı diyabet indüksiyonundan sonra T1DM yaralarını oluşturmak için eksize edilir11,12,13. Bu model sıçanlarda cilt kontraktürüne duyarlı olmasına rağmen, yara iyileşmesi araştırmalarında en sık kullanılan modeldir, çünkü daha az emek yoğun ve ucuzdur14,15. Bununla birlikte, bu tam kalınlıkta eksizyon tekniği ile ilgili yöntem rehberliğinde araştırmalar eksiktir. Ayrıca, mevcut çalışmalarda yara büyüklüğü ve yeri12,16 ile ilgili tek tip standartlar bulunmamaktadır. Yaranın büyüklüğü ve yeri, deneysel tasarımın tutarlılığını ve sonuçların bilimsel geçerliliğini dolaylı olarak etkileyebilir. Bu nedenle, araştırmacılar için referans olarak T1DM indüksiyonu ve yara modellemesi için standart bir protokole acil ihtiyaç vardır. Bu çalışmanın amacı, T1DM yara modellemesi için T1DM yara çalışmalarında referans olarak kullanılabilecek spesifik bir protokolü görselleştirmektir.
Protokol
Protokol, Helsinki Deklarasyonu'nu takiben gerçekleştirildi ve tüm hayvan deneyleri, Chengdu Geleneksel Çin Tıbbı Üniversitesi'nden Yönetim Komitesi tarafından onaylandı (Kayıt No. 2021-13).
1. Streptozotosin enjeksiyonunun hazırlanması
- 8 haftalık ve 220 g ila 20 g ağırlığında 15 SD erkeğe özgü patojensiz (SPF) sıçan ± seçin. Basit randomizasyon yöntemini kullanarak, sıçanları diyabetik bir gruba (n = 10) ve normal bir gruba (n = 5) bölün.
- Sıçanların başlangıç ağırlığını ölçün ve 55 mg / kg uygulama yoluyla STZ dozajını belirleyin.
NOT: Ön deneylere dayanarak, 55 mg / kg en uygun STZ dozudur. - STZ tozunu doğru bir şekilde tartın ve ışık geçirmez bir kaba koyun.
- STZ'yi %1'lik bir konsantrasyona eritmek için uygun miktarda 0.1 mol/L sodyum sitrat tamponu (pH 4.5) ekleyin.
NOT: Sodyum sitrat tamponu, kullanılmadan önce 4 °C'lik bir buzdolabında 2 saat önceden soğutulmalıdır. STZ çözeltisinin hazırlanması steriliteyi sağlamalıdır. - Bir ilaç osilatör kullanarak 30 saniye çalkalayın. Bir buz kutusuna koyun ve bir kenara koyun.
NOT: Enjeksiyon 15 dakika içinde kullanılmalıdır.
2. T1DM modelinin indüksiyonu
- STZ enjeksiyonundan önce, sıçanları 18 saat boyunca oruç tutun ve suya serbest erişime izin verin.
- % 1 STZ çözeltisinin intraperitoneal enjeksiyonunu gerçekleştirin.
- Sıçanı kavrayın ve karın derisini ve enjeksiyon bölgesini (iki uyluğun köklerini ve karın orta hattını birbirine bağlayan çizginin kesişimi) ortaya çıkarın.
- Enjeksiyon bölgesini% 75 alkole batırılmış bir pamuk topu kullanarak iki kez dezenfekte edin (bir kez saat yönünde ve bir kez saat yönünün tersine). Sıçanın kafasını karnın altına yerleştirin.
- İğneyi karın orta hattına paralel olarak 45 ° 'lik bir açıyla yerleştirin ve cildi deldikten sonra, iğne açısını 30 ° 'ye düşürün ve ardından iğneyi 2-3 mm yerleştirin. İğne tapasını yavaşça çekin, şırıngaya kan veya sıvı emilmediğinden emin olun. STZ çözeltisini enjekte edin, iğneyi çıkarın ve kanamayı pamuklu çubukla durdurun.
NOT: Şırıngaya sarı bir sıvı geri çekilirse, iğne mesaneye nüfuz etmiş olabilir ve koyu yeşil bir sıvı çekilirse, iğne kalın bağırsağa veya caecum'a nüfuz etmiş olabilir. Her iki durumda da, iğne derhal çıkarılmalıdır. Hayvan veteriner personeli tarafından değerlendirilmelidir.
- STZ indüksiyonundan sonraki 3. gün ve 7. günde saat 09: 00'da rahat (açlık yapmayan veya açlık yapmayan) kan şekeri seviyelerini ölçün.
NOT: Rastgele kan şekeri ölçümü için zaman sabittir. Bu protokolde saat 09:00'da sabitlenmiştir. Ancak, kullanılan tek zaman bu değildir. Bir iğne delinmesi ile kaudal damardan toplanan kan, doku sıvısına kesilmiş bir kuyruktan alınan kandan daha az hassastır, bu nedenle kan şekeri değerleri daha doğrudur.- Bir sıçan fiksatörü kullanarak sıçanı hareketsiz hale getirin (Şekil 1).
- Kaudal venin yerini bulun. Sıçanın kuyruğunu% 75 alkole batırılmış bir pamuk topu kullanarak iki kez dezenfekte edin.
- Kanamayı indüklemek için kaudal veni delin ve bir glukometre kullanarak kan şekerini ölçün. Kanamayı pamuklu çubukla durdurun.
NOT: STZ enjeksiyonundan sonraki 7. günde 16.7 mmol / L'den daha yüksek bir glikoz seviyesi T1DM olarak kabul edilir.
- Sıçanları haftalık olarak tartın ve kan şekeri seviyelerini ve diyet, su alımı ve idrar çıkışı gibi diğer parametreleri ölçün.
- STZ indüksiyonundan sonra 8 hafta boyunca hayvanları normal şekilde besleyin.
3. Yara modelinin yapımı
- Yara modellemeden 1 gün önce fareleri elektrikli tıraş bıçağı ile tıraş edin. Sıçanın dorsum tarafında 5 cm x 5 cm'lik traşlı bir alan genellikle idealdir.
- Tıraş edilen bölgeyi ılık normal tuzlu pamuk topu ile silin, kurumasını bekleyin ve ardından 5 dakika boyunca tüy dökücü krem uygulayın. Alanı gazlı bezle temizleyin ve kalan tüy dökücü kremleri ılık normal tuzlu suyla yıkayın.
- Sıçanları tartın ve 35 mg / kg standardına göre gerekli Nembutal dozunu hesaplayın. Nembutal'ı normal salin kullanarak% 3'lük bir konsantrasyona kadar çözün. Bu prosedür için ketamin / ksilazin veya izofluran gibi diğer genel anestezikler kullanılabilir. Lütfen en iyi olanı sağlamak için Kurumsal Hayvan Bakımı ve Kullanımı Komiteleri ile birlikte çalışın.
NOT: Etkinliği sağlamak için, çözelti taze olarak hazırlanmalı ve Nembutal tozu ve çözeltisi ışıktan korunmalıdır. - Anesteziden önce sıçanları 12 saat boyunca hızlılaştırın. Anesteziyi intraperitoneal olarak enjekte edin. Anestezi uygulamasından sonra göz kuruluğunu önlemek için tetrasiklin göz merhemi veya genel bir göz kayganlaştırıcı kullanın.
NOT: Sıçanın kasları nispeten gevşediğinde, göz hareketleri kaybolduğunda, solunum düzenli olduğunda ve ağrılı uyaranlara verilen tepki küçük olduğunda anestezi ılımlı olarak kabul edildi. - İyota batırılmış pamuk topları (bir kez saat yönünde ve bir kez saat yönünün tersine) ve% 75 alkol (alternatif turlar) kullanarak sırt cildini iki kez dezenfekte edin.
- Kuruduktan sonra, cildi 20 mm çapında dairesel biyopsi zımbasıyla kesin.
- Cildi steril forsepslerle çadırlayın ve ardından zımba kesim izleri boyunca tam kalınlıktaki cildi çıkarmak için steril cerrahi makas kullanın. Kanamayı normal bir tuzlu pamuk topu ile durdurun.
NOT: Yaranın üst sınırı, alt skapuler sınırın 5-10 mm altında ve sıçanın omurgasının sağında/solunda 5-10 mm olmalıdır (Şekil 2). İki yara inşa edildiğinde yaralar omurga boyunca simetriktir. - Yaraları örtmek için vazelin gazlı bez kullanın ve bunları lastik bantla yerinde tutulan bir gazlı bez ve nefes alabilen bandajla sarın. Postoperatif ağrıyı hafifletmek için günde bir kez karprofeni deri altından (5 mg / kg) enjekte edin. Yara bandajını günde bir kez değiştirin (ağrı kesici için karprofen kullanımı).
NOT: Bandaj tamamlandıktan sonra herhangi bir anormallik için sıçanın hareketini ve solunumunu gözlemleyin ve nefes alabilen bandajın uygun şekilde sıkı olduğundan emin olun. - Yaranın altına bir cetvel yerleştirin ve 14. güne kadar yarayı bir dijital kamera ile fotoğraflayın. Sıçanları 14. günde kurumsal hayvan bakımı ve kullanım kurallarına göre ötenazi yapın. Yara derisi dokusunu yara kenarından 5 mm kesin. Doku örneğini iki parçaya bölün, görünür kan lekelerini çıkarmak için PBS ile yıkayın ve% 4 paraformaldehit çözeltisi ile sabitleyin.
4. ImageJ yazılımı ile yara bölgesinin hesaplanması
- Yazılımı açtıktan sonra Dosya düğmesine tıklayın ve ardından yara resimlerini açmak için aşağı açılır ve Aç'a tıklayın.
- Düz aracını seçin ve yara resimlerinde cetvel boyunca 1 cm'lik düz bir çizgi çizin.
- Analiz menüsündeki Ölçeği Ayarla komutuna tıklayın ve Bilinen mesafeyi 1 olarak ayarlayın.
- Freehand seçimleri aracını seçin ve resimdeki yaranın ana hatlarını çizin.
- Analiz menüsündeki Ölçü komutuna tıklayın ve sonuç açıldıktan sonra Alan değerini okuyun.
5. Hematoksilin ve eozin (H &E) boyama
- Cilt dokusunu fiksatiften çıkarın, duman başlığında bir neşterle ince bölümlere ayırın ve bir dehidrasyon kasetine yerleştirin.
- Dehidrasyon kasetini bir dehidrasyon makinesine koyun ve dokuları aşağıdaki adımlarda dehidrate edin: 4 saat boyunca% 75 alkol; 2 saat boyunca% 85 alkol; 2 saat boyunca% 90 alkol; 1 saat boyunca% 95 alkol; her biri 30 dakika boyunca susuz etanol I ve II; 5-10 dakika boyunca alkol benzen; her biri 5-10 dakika boyunca ksilen I ve II; ve her biri 1 saat boyunca balmumu I, II ve III.
- Dokuları balmumuna gömün. Dondurucu bir masada -20 ° C'de soğutun ve balmumu bloğunu düzgünce düzeltin.
- Bir parafin kesitleme makinesi kullanarak balmumu bloklarını uzunlamasına 3 μm kalınlığında bölümlere ayırın.
- Bölümü sırayla her biri 20 dakika boyunca ksilen I ve II'ye, her biri 5 dakika susuz etanol I ve II'ye ve 5 dakika boyunca musluk suyuna batırın.
- Dokuları 3-5 dakika boyunca hematoksilin boyası,% 0.5 sulu hidroklorik asit çözeltisi farklılaşması,% 0.5 sulu amonyak çözeltisi ile maviye geri döndürün ve su ile durulayın.
- Doku kesitlerini% 85 ve% 95 alkol ile dehidrate edin. Dokuları 5 dakika boyunca eozin boyama çözeltisi ile doldurun.
NOT: Normalde, eozin boyama 30 s ila 2 dakika sürer ve süre boyama sonuçlarına ve gereksinimlerine göre ayarlanabilir. - Bölümleri aşağıdaki çözeltilerle sırayla dehidrate edin: susuz etanol I, susuz etanol II, susuz etanol III, ksilen I ve ksilen II, her biri 5 dakika boyunca. Son olarak, cam slaytları nötr balsam ile örtün.
- H & E boyalı dokuları mikroskop altında 40x, 20x ve 10x'te inceleyin ve her slaydın temsili görüntülerini korumak için fotoğraf çekin.
6. CD31 immünofloresan boyama
- Doku bölümlerini her biri 15 dakika boyunca ksilen I ve II'ye, her biri 5 dakika susuz etanol I ve II'ye, 5 dakika boyunca% 85 alkole ve 5 dakika boyunca% 75 alkole batırın ve damıtılmış suyla durulayın.
- Antijen onarımı
- Bir mikrodalga fırın kabına uygun bir 10 mM sitrik asit pH 6.0 tamponu ekleyin, yüksek kaynamaya ısıtın ve ardından cam sürgüyü içine yerleştirin.
- Orta ateşte 8 dakika kaynatın, 8 dakika bekletin ve sonra 7 dakika boyunca orta-düşük ateşte tekrar kaynatın.
- Slaytların soğumasını bekleyin, PBS'ye (pH 7.4) yerleştirin ve bir renk çözme çalkalayıcı kullanarak her biri 5 dakika boyunca üç kez yıkayın.
- Daireye% 5 keçi serumu damla damla ekleyin ve 30 dakika boyunca inkübe edin.
- Kapatma solüsyonunu (% 5 keçi serumu) yavaşça çalkalayın ve bölümlere damla damla tavşan anti-CD31 antikoru (PBS kullanılarak 1:200 oranında seyreltilmiş) ekleyin. Bölümleri ıslak bir kutuya yerleştirin ve gece boyunca 4 ° C'de inkübe edin.
- Slaytları PBS (pH 7.4) ile her biri 5 dakika boyunca bir renk çözücü çalkalayıcıda üç kez yıkayın. Bölümleri kurutmak için hafifçe çalkalayın ve ardından dairesel bir damla FITC etiketli keçi anti-tavşan IgG ile örtün. Karanlıkta 50 dakika oda sıcaklığında inkübe edin.
- Slaytları PBS (pH 7.4) ile her biri 5 dakika boyunca bir renk çözücü çalkalayıcıda üç kez yıkayın. Bölümleri hafif çalkalayarak hava ile kurutun ve DAPI boyama çözeltisi ekleyin. Bölümleri karanlıkta oda sıcaklığında 10 dakika inkübe edin.
- Bölümleri kuruttuktan sonra, PepPen ile dokunun etrafına daireler çizin (antikor kaybını önlemek için), dairelere 5 dakika boyunca bir otofloresan söndürme maddesi (% 0.3 Sudan Siyah B) ekleyin ve daha sonra 10 dakika boyunca akan su altında durulayın.
- Slaytları PBS (pH 7.4) ile her biri 5 dakika boyunca bir renk çözücü çalkalayıcıda üç kez yıkayın. Bölümleri hafifçe sallayın ve bir antifade montaj ortamı ile kapatın.
- Bölümleri floresan mikroskobu altında 40x, 20x ve 10x'te gözlemleyin ve fotoğraflayın.
NOT: DAPI UV uyarma dalga boyu 330-380 nm ve emisyon dalga boyu 420 nm'dir (mavi ışık). FITC uyarma dalga boyu 465-495 nm ve emisyon dalga boyu 515-555 nm'dir (yeşil ışık).
7. İstatistiksel analiz
- SPSS kullanarak verileri toplayın ve analiz edin.
- Verileri ortalama ± standart sapma olarak raporlayın.
- Diyabetik ve normal gruplar arasındaki farkları analiz etmek için bağımsız bir örneklem t-testi kullanın.
- İstatistiksel anlamlılığı **p < 0,01 ve *p < 0,05 olarak ayarlayın.
Sonuçlar
Toplam 10 SD sıçan, T1DM modelini indüklemek için tek bir STZ intraperitoneal enjeksiyon aldı. Bir sıçan erken öldü (% 10), ancak tüm sıçanlarda diyabet indüklendi (% 100). STZ enjeksiyonundan 3 gün sonra, tüm sıçanların kan şekeri seviyeleri 16.7 mmol / L'den yüksekti ve kan şekeri seviyeleri indüksiyondan 5 hafta sonra stabilize edildi (Şekil 3A). Diyabetik grubun ağırlığı STZ enjeksiyonundan sonra kademeli olarak artmış, ancak 3. haftada azalmış ve daha sonra 4. haftadan itibaren yavaş yavaş tekrar artmıştır (Şekil 3B). Buna karşılık, normal gruptaki sıçanların ağırlığı istikrarlı bir şekilde artmıştır ve diyabet indüksiyonundan 3 gün sonra ortalama ağırlıkları diyabetik grubunkinden daha yüksekti (Şekil 3B). Diyabetik sıçanların hepsi, Hao ve ark.17'nin bulgularına benzer şekilde, susuzluk, poliüri ve kilo kaybının tipik semptomlarını sergiledi.
Yaralanmadan sonraki 7. ve 14. günlerde, makroskopik analiz, normal gruptaki sıçanlarda yeniden epitelizasyonun diyabetik gruba göre daha belirgin olduğunu ortaya koymuştur (Şekil 4A). Kantitatif sonuçlar, diyabetik grupta yara iyileşme hızının 7. gün ve 14. günde normal gruba göre anlamlı derecede düşük olduğunu ortaya koymuştur (p < 0.01). Bununla birlikte, 14. günde, diyabetik grupta yara iyileşme oranları da %90'ın üzerinde olabilir (p < 0.05, Şekil 4B). Bu, T1DM yara modelinin zayıf kapanma ile karakterize olduğunu, ancak insan diyabetik yaralarında görülen kronik iyileşmeme derecesine kadar olmadığını göstermektedir.
Yara iyileşmesinin 14. gününde H&E boyaması diyabetik grupta normal gruba göre eksik yara epidermisi, keratinositlerin yavaş proliferasyonu ve gecikmiş re-epitelizasyon saptandı. Diyabetik yaralarda kıl köklerinin ve yağ bezlerinin kısmi kaybı görüldü. Ayrıca daha az görünür kılcal damar vardı (Şekil 5).
Diyabet endotel hücre disfonksiyonuna, hücre dışı matriks proteinlerinin glikozilasyonuna ve vasküler denervasyona neden olur18. Bu komplikasyonlar diyabetik yaralarda normalden daha düşük yara anjiyogenezi ile sonuçlanır18. Anjiyogenez yara iyileşmesi için gereklidir ve yara anjiyogenezi sıklıkla CD31 immün boyama ile analiz edilir (Şekil 6A)19,20. CD31 ekspresyonunun ortalama optik yoğunluğuna (AOD) dayanarak, yara bölgesindeki anjiyogenez normalde, diyabetik gruba göre anlamlı derecede yüksekti (p < 0.01, Şekil 6B).
Resim 1: Fiksatörler tarafından hareketsiz hale getirilen sıçanların resmi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
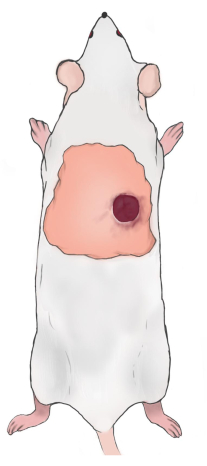
Şekil 2: Sıçan yara yerinin diyagramı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
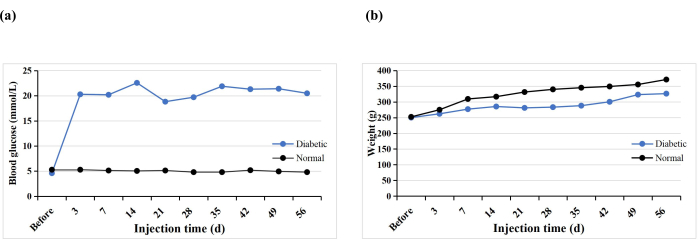
Şekil 3: Deney sıçanlarının kan şekeri seviyeleri ve ağırlıkları. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
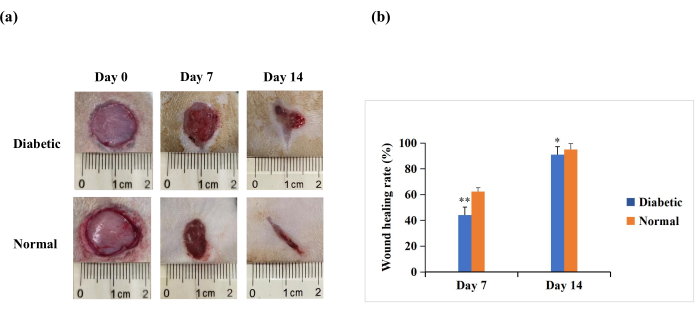
Şekil 4: Deney sıçanlarının sırtlarında tam kalınlıkta deri yaraları (20 mm çapında). (A) Yaraların 0. gün, 7. gün ve 14. günde makroskopik görünümü. 0. gün, 7. gün ve 14. gündeki yara morfolojisi görüntüleri dijital kamera ile çekildi. (B) Yara alanı ImageJ yazılımı kullanılarak ölçüldü ve yara iyileşme hızını hesaplamak için kullanıldı. Yara iyileşme oranı (%) şu şekilde hesaplandı: (ilk yara alanı − belirtilen zaman noktasındaki yara alanı)/başlangıç yara alanı × 100. Değerler ortalama ± SD (n = 14) olarak sunulur. İstatistiksel anlamlılık ** p < 0.01 ve * p < 0.05 olarak belirlendi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
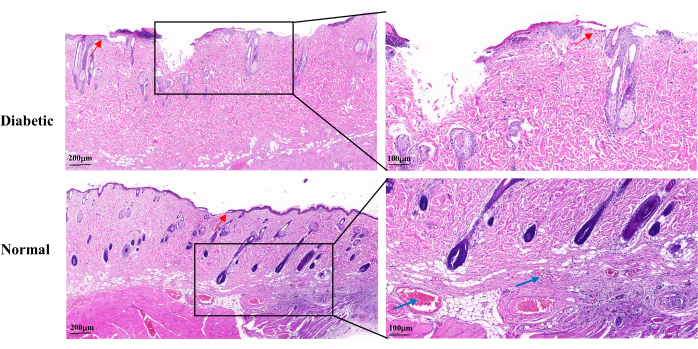
Şekil 5: Yara oluştuktan sonraki 14. günde temsili histopatolojik H&E görüntüleri. Mavi oklar kılcal damarları gösterir. Kırmızı oklar keratinositlerin çoğalmasını gösterir. Sol ölçek: bir çubuk = 200 μm; Sağ ölçek: bir çubuk = 100 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
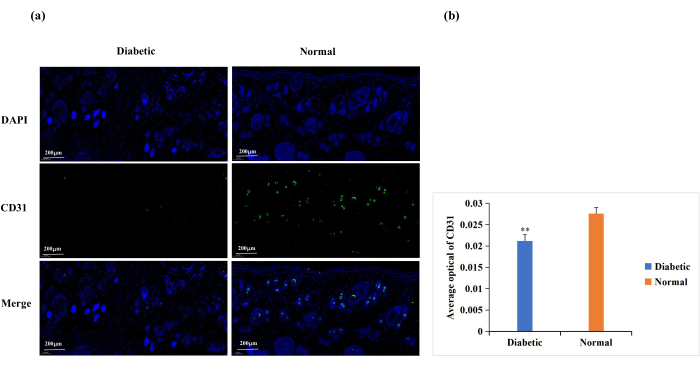
Şekil 6: CD31 ekspresyonu için immünofloresan boyama analizi. Anjiyogenezin durumunu belirlemek için CD31 düzeyleri kullanıldı. (A) Diyabetik ve normal gruplarda CD31 immünofloresan boyamasının temsili görüntüleri. Her cilt örneği için entegre optik yoğunluk (IOD) değeri ve piksel alanı (AREA) Image-Pro Plus 6.0 yazılımı ile hesaplanmıştır. Ortalama optik yoğunluk (AOD) değeri (AOD = IOD / AREA) da türetilmiştir. AOD değeri CD31'in pozitif ekspresyonu ile doğru orantılıydı. (B) Diyabetik ve normal gruplarda CD31 pozitif ekspresyonunun kantitatif karşılaştırması. Veriler SD'± ortalama olarak sunulmuştur. ** p < 0.01. Ölçek: bir çubuk = 200 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, T1DM yara modellemesindeki tartışmalı operasyonları açıklığa kavuşturmaktadır. Bu çalışmada STZ enjeksiyon protokolleri, T1DM indüksiyon başarı kriterleri, kan şekeri stabilizasyon süresi, yara yeri ve büyüklüğü ile ilgili endişeler ele alınmıştır. Ayrıca, T1DM yara iyileşmesi değerlendirmesi için patolojik özellikler ve ölçülebilir parametreler açıklığa kavuşturulmuştur.
Sıçanlar, STZ'nin etkinliğini etkileyebilecek glikozun veya analoglarının β hücrelere rekabetçi bağlanmasını önlemek için STZ enjeksiyonundan önce 18 saat boyunca oruç tuttular. T1DM'yi indüklemek için en yaygın kullanılan yöntem, adacıklara zarar vererek ve insülin sekresyonunu azaltarak kan şekerini artıran tek bir yüksek doz STZ'dir21. Deney öncesi çalışmalar, yüksek başarı oranı ve düşük mortalite oranı için optimal STZ dozunun 55 mg / kg olduğunu ve bunun önceki çalışmalarda bildirilen optimal dozlardan daha düşük olduğunu ortaya koymuştur22,23,24. Bu protokolde, 55 mg/kg STZ'lik tek bir intraperitoneal enjeksiyon kullanılarak T1DM indüklendi.
Kan şekeri seviyeleri, STZ enjeksiyonundan 3 gün sonra 16.7 mmol / L'den yüksekti. Bununla birlikte, STZ enjeksiyonundan sonraki 7. günde 16.7 mmol / L'den daha yüksek bir kan şekeri seviyesi, başarılı T1DM modellemesi için önerilen kriterdir, çünkü adacık hasarının derecesi sıçanlar arasında değişir ve teşhis süresinin uygun bir şekilde uzatılması yanlış negatif oranı azaltabilir. Ek olarak, kan şekeri dalgalanmaları STZ enjeksiyonundan 5 hafta sonra stabilize edildi ve sıçanlar bu süre zarfında önceki bulgularla tutarlı olarak yavaş yavaş kilo aldılar25,26. Bu, T1DM modelindeki kan şekeri seviyesinin en az 6 hafta boyunca stabilize edilmesi gerektiğini ve 6 hafta sonra sıçan ağırlığındaki bir artışın yara modellemesi sırasında ölüm oranlarını azalttığını göstermektedir. Bu nedenle, bu protokol STZ enjeksiyonundan 8 hafta sonra yara modellemesi yaptı.
Yaralanmadan sonraki 7. ve 14. günlerde yara kapanma oranı, diyabetikte normal yara grubuna göre anlamlı derecede düşüktü ve bu da yavaş iyileşmeyi gösteriyordu. Ayrıca, yara reepitelizasyonu ve anjiyogenez diyabetiklerde normal gruba göre anlamlı derecede düşüktü. Bu, T1DM yara modelinin normal sıçanlara göre daha yavaş yara iyileşmesi ve gecikmiş yeniden epitelizasyon gösterdiğini göstermektedir, bu da azalmış yara anjiyogenezinin patolojik değişiklikleriyle ilişkili olabilir. Bununla birlikte, 14. günde, T1DM yara iyileşme oranı da% 90'ın üzerindeydi, bu da insan diyabetik yaralarının kronik iyileşmeme özelliğinden farklıydı. Bunun nedeni, kemirgenlerin yara iyileşmesi için fizyolojik mekanizmalarının insanlarınkinden farklı olması olabilir27. Sonuç olarak, en iyi yara çapı en az 20 mm'dir, bu da diyabetik bir yara çalışmasında bir müdahalenin etkinliğini değerlendirmek için zaman tanıyacak kadar büyüktür. Yara yeri skapula ve omurgadan kaçınmalıdır, çünkü bu iki bölgedeki sürekli hareket yara iyileşmesini bozabilir.
Sonuç olarak, bu protokol yöntemi kullanılarak T1DM yara modelinin oluşturulması etkilidir. Protokol, normal sıçan yaralarına kıyasla daha yavaş yara iyileşmesi, gecikmiş yeniden epitelizasyon ve azalmış anjiyogenez gibi kronik diyabetik yaraların bazı özelliklerini çoğaltır. Bununla birlikte, modelin diyabetik yaraların diğer kronik fenotiplerini çoğaltıp çoğaltamayacağı bilinmemektedir. Ayrıca, bu protokol, sıçanlarda cilt kasılması sorununu hesaba katmayan en temel ve yaygın olarak kullanılan yöntemi tanımlamaktadır. Gelecekteki araştırmalar, yara atellerinin kullanımını bu protokole dahil edebilir veya gelecekte araştırmacılar için önemli bir zorluk olacak olan kronik diyabetik yaraların ek modellerini keşfedebilir.
Açıklamalar
Tüm yazarlar bu yazının çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (82104877) tarafından finansal olarak desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Antifade mounting medium | Southern Biotechnology Associates, Inc. | 0100-01 | |
| AutoFluo Quencher | Servicebio Technology co., Ltd. | G1221 | |
| Automatic slide stainer | Thermo Fisher Scientific Inc. | Varistain™ Gemini ES | |
| CD31 | Servicebio Technology co., Ltd. | GB11063-2 | |
| Citrate antigen retrieval solution | Servicebio Technology co., Ltd. | G1201 | |
| Cover glass | Citotest Labware Manufacturing Co., Ltd. | 10212432C | |
| DAPI | Servicebio Technology co., Ltd. | G1012 | |
| Decolorization shaker | Scilogex | S1010E | |
| Depilatory cream | Guangzhou Ruixin Biotechnology Co., Ltd. | — | |
| Dimethyl benzene | Chengdu Kelong Chemical Co., Ltd. | 64-17-5 | |
| Drug oscillator | Shenzhen Jiashi Technology Co., Ltd. | VM-370 | |
| Electric razor | Shanghai Flyco Electrical Appliance Co., Ltd. | FC5908 | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd. | JB-P5 | |
| Ethanol absolute | Chengdu Kelong Chemical Co., Ltd. | 1330-20-7 | |
| Fitc-labeled goat anti-rabbit IgG | Servicebio Technology co., Ltd. | GB22303 | |
| Goat serum | Thermo Fisher Scientific Inc. | 16210064 | |
| Hematoxylin and eosin staining solution | Beijing Regan Biotechnology Co., Ltd. | DH0020 | |
| Image J software | National Institutes of Health | — | |
| Microwave oven | Midea Group Co., Ltd. | M1-L213B | |
| Mini centrifuge | Scilogex | D1008 | |
| Neutral balsam | Sinopharm Chemical Reagent Co., Ltd | 10004160 | |
| PBS buffer | Biosharp | G4202 | |
| Portable blood glucose meter | Sinocare Inc. | GA-3 | |
| Rapid tissue processor | Thermo Fisher Scientific Inc. | STP420 ES | |
| Rat fixator | Globalebio (Beijing) Technology co., Ltd | GEGD-Q10G1 | |
| Slicing machine | Thermo Fisher Scientific Inc. | HM325 | |
| Slides glass | Citotest Labware Manufacturing Co., Ltd. | 80312-3181 | |
| sodium citrate buffer | Beijing Solarbio Science & Technology Co., Ltd. | c1013 | |
| Streptozotocin | Sigma | 57654595 |
Referanslar
- Zimmet, P., Alberti, K. G., Shaw, J. Global and societal implications of the diabetes epidemic. Nature. 414 (6865), 782-787 (2001).
- Grennan, D. Diabetic foot ulcers. Journal of the American Medical Association. 321 (1), 114 (2019).
- Eming, S. A., Martin, P., Tomic-Canic, M. Wound repair and regeneration: Mechanisms, signaling, and translation. Science Translational Medicine. 6 (265), 265sr6 (2014).
- Patel, S., Srivastava, S., Singh, M. R., Singh, D. Mechanistic insight into diabetic wounds: Pathogenesis, molecular targets and treatment strategies to pace wound healing. Biomedicine & Pharmacotherapy. 112, 108615 (2019).
- Deeds, M. C., et al. Single dose streptozotocin-induced diabetes: Considerations for study design in islet transplantation models. Laboratory Animals. 45 (3), 131-140 (2011).
- Chao, P. C., et al. Investigation of insulin resistance in the popularly used four rat models of type-2 diabetes. Biomedicine & Pharmacotherapy. 101, 155-161 (2018).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Current Protocols. 1 (4), e78 (2021).
- Wu, J., Yan, L. J. Streptozotocin-induced type 1 diabetes in rodents as a model for studying mitochondrial mechanisms of diabetic β cell glucotoxicity. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy. 8, 181-188 (2015).
- Yang, J., Chen, Z., Pan, D., Li, H., Shen, J. Umbilical cord-derived mesenchymal stem cell-derived exosomes combined pluronic F127 hydrogel promote chronic diabetic wound healing and complete skin regeneration. International Journal of Nanomedicine. 15, 5911-5926 (2020).
- Zhu, Y., Wang, Y., Jia, Y., Xu, J., Chai, Y. Roxadustat promotes angiogenesis through HIF-1α/VEGF/VEGFR2 signaling and accelerates cutaneous wound healing in diabetic rats. Wound Repair and Regeneration. 27 (4), 324-334 (2019).
- Shao, Z., et al. Wound microenvironment self-adaptive hydrogel with efficient angiogenesis for promoting diabetic wound healing. Bioactive Materials. 20, 561-573 (2022).
- Asfour, H. Z., et al. Enhanced healing efficacy of an optimized gabapentin-melittin nanoconjugate gel-loaded formulation in excised wounds of diabetic rats. Drug Delivery. 29 (1), 1892-1902 (2022).
- Wei, L., et al. Mesenchymal stem cells promote wound healing and effects on expression of matrix metalloproteinases-8 and 9 in the wound tissue of diabetic rats. Stem Cells and Development. 32 (1-2), 25-31 (2022).
- Pastar, I., et al. . Preclinical models for wound-healing studies. In Skin Tissue Models., edited by. , 223-253 (2018).
- Yang, R. H., et al. Epidermal stem cells (ESCs) accelerate diabetic wound healing via the Notch signalling pathway. Bioscience Reports. 36 (4), e00364 (2016).
- Suliman Maashi, M., Felemban, S. G., Almasmoum, H. A., Jarahian, M. Nicaraven-loaded electrospun wound dressings promote diabetic wound healing via proangiogenic and immunomodulatory functions: A preclinical investigation. Drug Delivery and Translational Research. 13 (1), 222-236 (2023).
- Hao, M., Ding, C., Sun, S., Peng, X., Liu, W. Chitosan/sodium alginate/velvet antler blood peptides hydrogel promotes diabetic wound healing via regulating angiogenesis, inflammatory response and skin flora. Journal of Inflammation Research. 15, 4921-4938 (2022).
- Kolluru, G. K., Bir, S. C., Kevil, C. G. Endothelial dysfunction and diabetes: Effects on angiogenesis, vascular remodeling, and wound healing. International Journal of Vascular Medicine. 2012, 918267 (2012).
- Okonkwo, U. A., DiPietro, L. A. Diabetes and wound angiogenesis. International Journal of Molecular Sciences. 18 (7), 1419 (2017).
- Yi, C., et al. Targeted inhibition of endothelial calpain delays wound healing by reducing inflammation and angiogenesis. Cell Death & Disease. 11 (7), 533 (2020).
- Goodson 3rd, W. H., Hung, T. K. Studies of wound healing in experimental diabetes mellitus. Journal of Surgical Research. 22 (3), 221-227 (1977).
- Luippold, G., Klein, T., Mark, M., Empagliflozin Grempler, R. a novel potent and selective SGLT-2 inhibitor, improves glycaemic control alone and in combination with insulin in streptozotocin-induced diabetic rats, a model of type 1 diabetes mellitus. Diabetes, Obesity & Metabolism. 14 (7), 601-607 (2012).
- Sayed, N., et al. Effect of dapagliflozin alone and in combination with insulin in a rat model of type 1 diabetes. The Journal of Veterinary Medical Science. 82 (4), 467-474 (2020).
- Han, Y., et al. Human umbilical cord mesenchymal stem cells implantation accelerates cutaneous wound healing in diabetic rats via the Wnt signaling pathway. European Journal of Medical Research. 24 (1), 10 (2019).
- Ansell, D. M., Marsh, C., Walker, L., Hardman, M. J., Holden, K. Evaluating STZ-induced impaired wound healing in rats. Journal of Investigative Dermatology. 138 (4), 994-997 (2018).
- Liu, Y., et al. Human umbilical cord-derived mesenchymal stem cells not only ameliorate blood glucose but also protect vascular endothelium from diabetic damage through a paracrine mechanism mediated by MAPK/ERK signaling. Stem Cell Research & Therapy. 13 (1), 258 (2022).
- Zindle, J. K., Wolinsky, E., Bogie, K. M. A review of animal models from 2015 to 2020 for preclinical chronic wounds relevant to human health. Journal of Tissue Viability. 30 (3), 291-300 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır