Method Article
Un protocolo para construir un modelo de herida de rata de diabetes tipo 1
* Estos autores han contribuido por igual
En este artículo
Resumen
El modelo de herida diabética inducida por estreptozotocina en ratas SD macho es actualmente el modelo más utilizado para estudiar la cicatrización de heridas en la diabetes mellitus tipo I. Este protocolo describe los métodos utilizados para construir este modelo. También presenta y aborda posibles desafíos y examina la progresión y las características angiogénicas de las heridas diabéticas.
Resumen
Una sola dosis alta de inyección de estreptozotocina seguida de escisión de piel de espesor total en el dorso de ratas es un método común para construir modelos animales de heridas diabéticas tipo 1. Sin embargo, la manipulación inadecuada puede conducir a la inestabilidad del modelo y una alta mortalidad en ratas. Desafortunadamente, existen pocas guías sobre el modelado de heridas diabéticas tipo 1, y carecen de detalles y no presentan estrategias de referencia específicas. Por lo tanto, este protocolo detalla el procedimiento completo para construir un modelo de herida diabética tipo 1 y analiza la progresión y las características angiogénicas de las heridas diabéticas. El modelado de heridas diabéticas tipo 1 implica los siguientes pasos: preparación de la inyección de estreptozotocina, inducción de diabetes mellitus tipo 1 y construcción del modelo de herida. El área de la herida se midió el día 7 y el día 14 después de la herida, y se extrajeron los tejidos de la piel de las ratas para el análisis histopatológico y de inmunofluorescencia. Los resultados revelaron que la diabetes mellitus tipo 1 inducida por 55 mg/kg de estreptozotocina se asoció con una menor mortalidad y una alta tasa de éxito. Los niveles de glucosa en sangre fueron relativamente estables después de 5 semanas de inducción. La tasa de cicatrización de heridas diabéticas fue significativamente menor que la de las heridas normales en el día 7 y el día 14 (p < 0,05), pero ambas pudieron alcanzar más del 90% el día 14. En comparación con el grupo normal, el cierre de la capa epidérmica de las heridas diabéticas en el día 14 fue incompleto y tuvo una reepitelización retardada y una angiogénesis significativamente menor (p < 0,01). El modelo de herida diabética tipo 1 construido en base a este protocolo tiene las características de cicatrización crónica de heridas, incluyendo un cierre deficiente, reepitelización retardada y disminución de la angiogénesis en comparación con las heridas normales de rata.
Introducción
La diabetes mellitus tipo 1 (DM1) es una enfermedad metabólica crónica caracterizada por hiperglucemia y destrucción de células β pancreáticas1. Una herida de DM1 es una herida crónica que no cicatriza y la complicación más común y devastadora de la diabetes en humanos 2,3. Los modelos animales son los prototipos más apropiados para estudiar los cambios patológicos durante la cicatrización de heridas y la seguridad y eficacia de los posibles agentes terapéuticos4. En comparación con otros tipos, las ratas macho Sprague-Dawley (SD) son más sensibles a la estreptozotocina (STZ) y muestran una menor tasa de mortalidad relacionada, lo que las hace populares en la investigación de heridas diabéticas 5,6.
Se han descrito numerosos métodos para construir modelos de heridas de DMT1. En cuanto al modelo de DMT1, los estudios se han centrado principalmente en el efecto del método de inyección STZ sobre la tasa de éxito de la inducción de diabetes 7,8. Sin embargo, el proceso de modelado sufre de la operación inconsistente de este mismo paso. En un estudio, las ratas ayunaron durante 18 h antes de la inyección STZ; ratas con niveles de glucosa en sangre superiores a 16,67 mmol / L 1 semana después de la inyección STZ se consideraron diabéticas, y la herida diabética se introdujo después de 3 semanas9. Por el contrario, en un estudio relacionado, Zhu et al. ayunaron ratas durante 12 h antes de la inyección STZ; Las ratas con niveles de glucosa en sangre superiores a 16,7 mmol / L a las 72 h después de la inyección se consideraron diabéticas, y la herida diabética se introdujo después de 4 semanas10. En general, hay inconsistencias en los protocolos de inyección STZ, los criterios de diagnóstico de diabetes y los tiempos de introducción de la herida.
En términos de modelado de heridas, en la mayoría de los estudios, el espesor total de la piel dorsal se extirpa para construir heridas de DMT1 después de la inducción exitosa de diabetes11,12,13. Aunque este modelo es susceptible a la contractura cutánea en ratas, es el modelo más utilizado en la investigación de la cicatrización de heridas porque requiere menos mano de obra y es barato14,15. Sin embargo, falta investigación guiada por métodos sobre esta técnica de escisión de espesor completo. Además, no existen estándares uniformes en los estudios existentes sobre el tamaño y la localización de la herida12,16. El tamaño y la ubicación de la herida pueden afectar indirectamente la consistencia del diseño experimental y la validez científica de los resultados. Por lo tanto, existe una necesidad urgente de un protocolo estándar para la inducción de DMT1 y el modelado de heridas como referencia para los investigadores. El objetivo de este estudio es visualizar un protocolo específico para el modelado de heridas de DMT1 que pueda usarse como referencia para estudios de heridas de DMT1.
Protocolo
El protocolo se llevó a cabo siguiendo la Declaración de Helsinki, y todos los experimentos con animales fueron aprobados por el Comité de Gestión de la Universidad de Medicina Tradicional China de Chengdu (Registro No. 2021-13).
1. Preparación de la inyección de estreptozotocina
- Seleccione 15 ratas SD macho libres de patógenos específicos (SPF) de 8 semanas de edad y con un peso de 220 g ± 20 g. Usando el método de aleatorización simple, divida las ratas en un grupo diabético (n = 10) y un grupo normal (n = 5).
- Medir el peso inicial de las ratas, y determinar la dosis de STZ mediante la administración de 55 mg/kg.
NOTA: Según los experimentos previos, 55 mg / kg es la dosis óptima de STZ. - Pese el polvo STZ con precisión y colóquelo en un recipiente a prueba de luz.
- Añadir una cantidad adecuada de tampón de citrato de sodio 0,1 mol/L (pH 4,5) para disolver la ZST hasta una concentración del 1 %.
NOTA: El tampón de citrato de sodio debe enfriarse previamente durante 2 h en una nevera a 4 °C antes de su uso. La preparación de la solución STZ debe asegurar la esterilidad. - Agitar durante 30 s con un oscilador de drogas. Colóquelo en una nevera y déjelo a un lado.
NOTA: La inyección debe usarse dentro de los 15 minutos.
2. Inducción del modelo T1DM
- Antes de la inyección STZ, ayune las ratas durante 18 h y permita el libre acceso al agua.
- Realizar una inyección intraperitoneal de solución STZ al 1%.
- Agarre a la rata y exponga la piel abdominal y el sitio de inyección (la intersección de la línea que conecta las raíces de los dos muslos y la línea media del abdomen).
- Desinfecte el lugar de la inyección dos veces con una bola de algodón empapada en alcohol al 75% (una vez en el sentido de las agujas del reloj y otra en el sentido contrario a las agujas del reloj). Coloque la cabeza de la rata debajo del abdomen.
- Inserte la aguja paralela a la línea media abdominal en un ángulo de 45°, y después de perforar la piel, reduzca el ángulo de la aguja a 30° y luego inserte la aguja 2-3 mm. Tire suavemente del tapón de la aguja, asegurándose de que no se aspire sangre o líquido en la jeringa. Inyecte la solución STZ, saque la aguja y detenga el sangrado con un hisopo de algodón.
NOTA: Si se introduce un líquido amarillo en la jeringa, la aguja puede haber penetrado en la vejiga, y si se extrae un líquido verde oscuro, la aguja podría haber penetrado en el intestino grueso o el ciego. En cualquier caso, la aguja debe retirarse inmediatamente. El animal debe ser evaluado por personal veterinario.
- Mida los niveles de glucosa en sangre casuales (sin ayuno o en ayunas) a las 09:00 am del día 3 y al día 7 después de la inducción STZ.
NOTA: El tiempo para la medición aleatoria de la glucosa en sangre es fijo. En este protocolo, se fija a las 09:00 am. Sin embargo, no es el único tiempo utilizado. La sangre extraída de la vena caudal mediante una punción con aguja es menos susceptible al líquido tisular que la sangre extraída de una cola cortada, por lo que los valores de glucosa en sangre son más precisos.- Inmovilizar a la rata usando un fijador de ratas (Figura 1).
- Encuentra la ubicación de la vena caudal. Desinfecte la cola de la rata dos veces con una bola de algodón empapada en alcohol al 75%.
- Perforar la vena caudal para inducir el sangrado y medir la glucosa en sangre con un glucómetro. Detenga el sangrado con un hisopo de algodón.
NOTA: Un nivel de glucosa superior a 16,7 mmol/L en el día 7 después de la inyección de STZ se considera DMT1.
- Pese las ratas semanalmente y mida los niveles de glucosa en sangre y otros parámetros, incluida la dieta, la ingesta de agua y la producción de orina.
- Alimente a los animales normalmente durante 8 semanas después de la inducción STZ.
3. Construcción del modelo de herida
- Afeite a las ratas con una máquina de afeitar eléctrica 1 día antes del modelado de heridas. Un área afeitada de 5 cm x 5 cm en el lado dorso de la rata es generalmente ideal.
- Limpie el área afeitada con una bola de algodón salino normal tibia, deje que se seque y luego aplique crema depilatoria durante 5 minutos. Limpie el área con una gasa y lave cualquier crema depilatoria residual con solución salina normal tibia.
- Pesar las ratas y calcular la dosis requerida de Nembutal basada en el estándar de 35 mg / kg. Disuelva el Nembutal usando solución salina normal a una concentración del 3%. Para este procedimiento se pueden usar otros anestésicos generales como ketamina/xilazina o isoflurano. Por favor, trabaje con los Comités Institucionales de Cuidado y Uso de Animales para garantizar qué es lo mejor.
NOTA: Para garantizar la eficacia, la solución debe estar recién preparada, y el polvo y la solución de Nembutal deben protegerse de la luz. - Ayunar las ratas durante 12 h antes de la anestesia. Inyecte la anestesia por vía intraperitoneal. Use ungüento ocular de tetraciclina o un lubricante general para los ojos para prevenir la sequedad ocular después de la administración de anestesia.
NOTA: La anestesia se consideró moderada cuando los músculos de la rata estaban relativamente relajados, los movimientos oculares desaparecieron, la respiración fue regular y la respuesta a estímulos dolorosos fue pequeña. - Desinfecte la piel dorsal dos veces con bolas de algodón empapadas en yodo (una vez en el sentido de las agujas del reloj y una vez en el sentido contrario a las agujas del reloj) y alcohol al 75% (rondas alternativas).
- Después del secado, corte la piel con un punzón de biopsia circular de 20 mm de diámetro.
- Coloque la piel en una tienda de campaña con fórceps estériles y luego use tijeras quirúrgicas estériles para eliminar la piel de espesor total a lo largo de las marcas de corte de punzón. Detenga el sangrado con una bola de algodón salina normal.
NOTA: El borde superior de la herida debe estar 5-10 mm por debajo del borde escapular inferior y 5-10 mm a la derecha/izquierda de la columna vertebral de la rata (Figura 2). Las heridas son simétricas a lo largo de la columna vertebral cuando se construyen dos heridas. - Use una gasa de vaselina para cubrir las heridas y envuélvalas con una gasa y un vendaje transpirable que se mantiene en su lugar con cinta de goma. Inyecte carprofeno por vía subcutánea (5 mg/kg) una vez al día para aliviar el dolor postoperatorio. Cambie el vendaje de la herida una vez al día (uso de carprofeno para aliviar el dolor).
NOTA: Observe el movimiento y la respiración de la rata para detectar cualquier anomalía después de completar el vendaje y asegúrese de que el vendaje transpirable esté bien apretado. - Coloque una regla debajo de la herida y fotografíe la herida con una cámara digital hasta el día 14. Eutanasia a las ratas el día 14 de acuerdo con las pautas institucionales de cuidado y uso de animales. Corte el tejido de la piel de la herida a 5 mm del borde de la herida. Divida la muestra de tejido en dos partes, lávelas con PBS para eliminar las manchas de sangre visibles y luego fíjelas con una solución de paraformaldehído al 4%.
4. Cálculo del área de la herida con el software ImageJ
- Haga clic en el botón Archivo después de abrir el software, y luego despliegue y haga clic en Abrir para abrir las imágenes de la herida.
- Seleccione la herramienta Recta y dibuje una línea recta de 1 cm a lo largo de la regla en las imágenes de la herida.
- Haga clic en el comando Definir escala en el menú Analizar y establezca la distancia conocida en 1.
- Seleccione la herramienta Selecciones a mano alzada y esboce el contorno de la herida en la imagen.
- Haga clic en el comando Medir en el menú Analizar y lea el valor Área después de que aparezca el resultado .
5. Tinción de hematoxilina y eosina (H&E)
- Retire el tejido de la piel del fijador, córtelo en secciones delgadas con un bisturí en una campana extractora y colóquelo en un casete de deshidratación.
- Coloque el casete de deshidratación en una máquina de deshidratación y deshidrate los tejidos en los siguientes pasos: alcohol al 75% durante 4 h; 85% de alcohol durante 2 h; 90% de alcohol durante 2 h; 95% de alcohol durante 1 h; etanol anhidro I y II durante 30 min cada uno; alcohol benceno durante 5-10 min; xileno I y II durante 5-10 min cada uno; y cera I, II y III durante 1 h cada una.
- Incruste los tejidos en cera. Enfríe a -20 ° en una mesa de congelación y corrija el bloque de cera cuidadosamente.
- Corte los bloques de cera longitudinalmente utilizando una máquina seccionadora de parafina en secciones de 3 μm de espesor.
- Remoje secuencialmente la sección en xileno I y II durante 20 minutos cada uno, etanol anhidro I y II durante 5 minutos cada uno, y agua del grifo durante 5 minutos.
- Inunde los tejidos con tinción de hematoxilina durante 3-5 minutos, diferenciación de solución acuosa de ácido clorhídrico al 0,5%, solución acuosa de amoníaco al 0,5% de nuevo a azul, y enjuague con agua.
- Deshidratar las secciones de tejido con 85% y 95% de alcohol. Inunde los tejidos con solución de tinción de eosina durante 5 minutos.
NOTA: Normalmente, la tinción con eosina tarda de 30 s a 2 min, y el tiempo se puede ajustar de acuerdo con los resultados y requisitos de la tinción. - Deshidratar las secciones secuencialmente con las siguientes soluciones: etanol anhidro I, etanol anhidro II, etanol anhidro III, xileno I y xileno II, cada uno durante 5 min. Finalmente, cubra los portaobjetos de vidrio con bálsamo neutro.
- Examine los tejidos teñidos con H&E bajo el microscopio a 40x, 20x y 10x, y tome fotografías para conservar imágenes representativas de cada portaobjetos.
6. Tinción de inmunofluorescencia CD31
- Remoje las secciones de tejido en xileno I y II durante 15 minutos cada una, etanol anhidro I y II durante 5 minutos cada una, 85% de alcohol durante 5 minutos y 75% de alcohol durante 5 minutos, y enjuague con agua destilada.
- Reparación de antígenos
- Agregue un tampón de ácido cítrico adecuado de 10 mM de pH 6.0 a un recipiente de horno de microondas, caliéntelo a ebullición alta y luego coloque la diapositiva de vidrio en él.
- Hervir durante 8 minutos a fuego medio, detener durante 8 minutos y luego hervir de nuevo a fuego medio-bajo durante 7 minutos.
- Deje que los portaobjetos se enfríen, colóquelos en PBS (pH 7.4) y lávelos tres veces durante 5 minutos cada uno con un agitador de decoloración.
- Agregue 5% de suero de cabra gota a gota en el círculo e incube durante 30 minutos.
- Agite suavemente la solución de cierre (suero de cabra al 5%) y agregue el anticuerpo anti-CD31 de conejo (diluido usando PBS en una proporción de 1:200) gota a gota sobre las secciones. Coloque las secciones en una caja húmeda e incube durante la noche a 4 ° C.
- Lave las diapositivas tres veces con PBS (pH 7.4) en una coctelera de decoloración durante 5 minutos cada una. Agite ligeramente las secciones para secarlas, y luego cúbralas con una gota circular de IgG anti-conejo de cabra etiquetada con FITC. Incubar a temperatura ambiente durante 50 minutos en la oscuridad.
- Lave las diapositivas tres veces con PBS (pH 7.4) en una coctelera de decoloración durante 5 minutos cada una. Seque al aire las secciones con una ligera agitación y agregue la solución de tinción DAPI. Incubar las secciones en la oscuridad durante 10 minutos a temperatura ambiente.
- Después de secar las secciones, dibuje círculos alrededor del tejido con el PepPen (para evitar la pérdida de anticuerpos), agregue un agente de extinción de autofluorescencia (0,3% Sudan Black B) a los círculos durante 5 minutos y, a continuación, enjuáguelos con agua corriente durante 10 minutos.
- Lave las diapositivas tres veces con PBS (pH 7.4) en una coctelera de decoloración durante 5 minutos cada una. Agite ligeramente las secciones y séllelas con un medio de montaje antidecoloración.
- Observe y fotografíe las secciones bajo un microscopio de fluorescencia a 40x, 20x y 10x.
NOTA: La longitud de onda de excitación UV DAPI es 330-380 nm, y la longitud de onda de emisión es 420 nm (luz azul). La longitud de onda de excitación FITC es 465-495 nm, y la longitud de onda de emisión es 515-555 nm (luz verde).
7. Análisis estadístico
- Recopile y analice los datos utilizando SPSS.
- Reporte los datos como media ± desviación estándar.
- Utilice una prueba t de muestras independientes para analizar las diferencias entre los grupos diabético y normal.
- Establezca la significación estadística en **p < 0,01 y *p < 0,05.
Resultados
Un total de 10 ratas SD recibieron una sola inyección intraperitoneal STZ para inducir el modelo T1DM. Una rata murió prematuramente (10%), pero se indujo diabetes en todas las ratas (100%). Después de 3 días de inyección STZ, los niveles de glucosa en sangre de todas las ratas fueron superiores a 16,7 mmol / L, y los niveles de glucosa en sangre se estabilizaron 5 semanas después de la inducción (Figura 3A). El peso del grupo diabético aumentó gradualmente después de la inyección de STZ, pero disminuyó en la semana 3 y luego aumentó lentamente de nuevo a partir de la semana 4 (Figura 3B). En contraste, el peso de las ratas en el grupo normal aumentó constantemente, y su peso promedio 3 días después de la inducción de la diabetes fue mayor que el del grupo diabético (Figura 3B). Todas las ratas diabéticas exhibieron síntomas típicos de sed, poliuria y pérdida de peso, similares a los hallazgos de Hao et al.17.
El día 7 y el día 14 después de la herida, el análisis macroscópico reveló que la reepitelización fue más pronunciada en ratas del grupo normal que en el grupo diabético (Figura 4A). Los resultados cuantitativos revelaron que la tasa de cicatrización de heridas fue significativamente menor en el grupo diabético que en el grupo normal el día 7 y el día 14 (p < 0,01). Sin embargo, en el día 14, las tasas de cicatrización de heridas también podrían estar por encima del 90% en el grupo diabético (p < 0,05, Figura 4B). Esto sugiere que el modelo de herida de DM1 se caracteriza por un cierre deficiente, pero no en la medida de la no cicatrización crónica observada en las heridas diabéticas humanas.
La tinción de H&E en el día 14 de cicatrización de la herida reveló una epidermis de herida incompleta, una proliferación lenta de queratinocitos y una reepitelización retardada en el grupo diabético en comparación con el grupo normal. Las heridas diabéticas mostraron pérdida parcial de los folículos pilosos y glándulas sebáceas. También había menos capilares visibles (Figura 5).
La diabetes causa disfunción de las células endoteliales, glicosilación de las proteínas de la matriz extracelular y denervación vascular18. Estas complicaciones resultan en angiogénesis de la herida inferior a la normal en heridas diabéticas18. La angiogénesis es necesaria para la cicatrización de heridas, y la angiogénesis de la herida se analiza frecuentemente mediante inmunotinción CD31 (Figura 6A)19,20. Con base en la densidad óptica promedio (AOD) de la expresión de CD31, la angiogénesis en el sitio de la herida fue significativamente mayor en el grupo normal que en el diabético (p < 0,01, Figura 6B).
Figura 1: Imagen de ratas inmovilizadas por fijadores. Haga clic aquí para ver una versión más grande de esta figura.
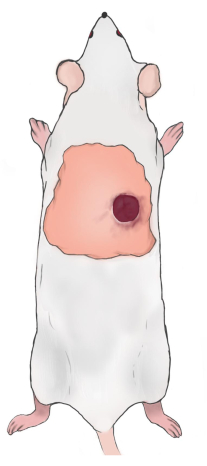
Figura 2: Diagrama de la ubicación de la herida de rata. Haga clic aquí para ver una versión más grande de esta figura.
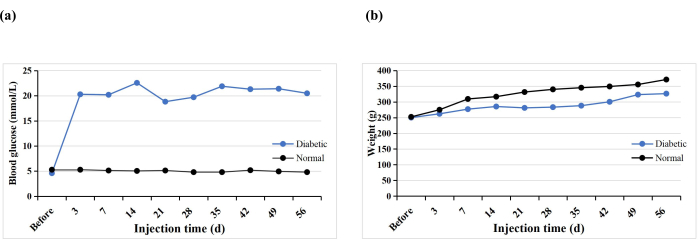
Figura 3: Niveles de glucosa en sangre y pesos de las ratas experimentales. Haga clic aquí para ver una versión más grande de esta figura.
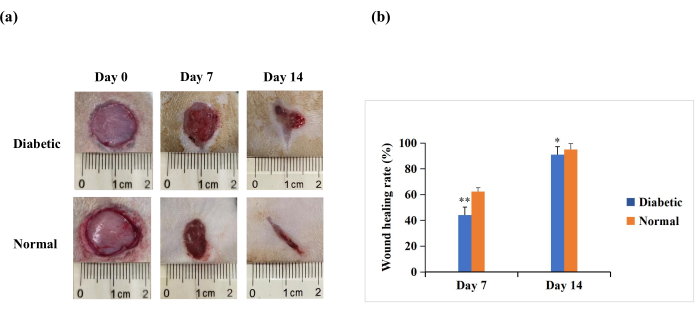
Figura 4: Heridas cutáneas de espesor total (20 mm de diámetro) en la espalda de las ratas experimentales. (A) La apariencia macroscópica de las heridas en el día 0, día 7 y día 14. Las imágenes de morfología de la herida en el día 0, día 7 y día 14 fueron capturadas con una cámara digital. (B) El área de la herida se midió utilizando el software ImageJ y se utilizó para calcular la tasa de cicatrización de la herida. La tasa de cicatrización de la herida (%) se calculó de la siguiente manera: (área de la herida inicial - área de la herida en el punto de tiempo indicado) / área de la herida inicial × 100. Los valores se presentan como media ± DE (n = 14). La significación estadística se fijó en ** p < 0,01 y * p < 0,05. Haga clic aquí para ver una versión más grande de esta figura.
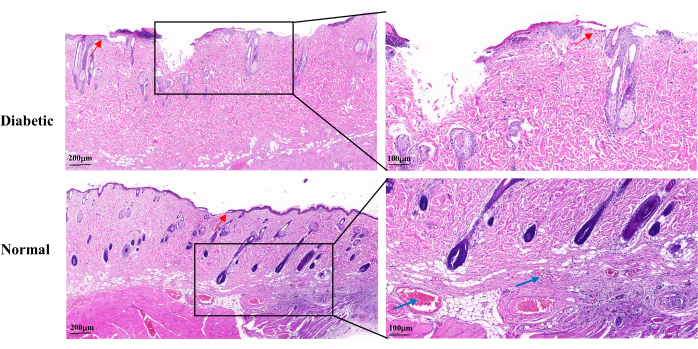
Figura 5: Imágenes histopatológicas representativas de H&E en el día 14 después del establecimiento de la herida. Las flechas azules indican capilares. Las flechas rojas muestran la proliferación de queratinocitos. Escala izquierda: una barra = 200 μm; Escala derecha: una barra = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
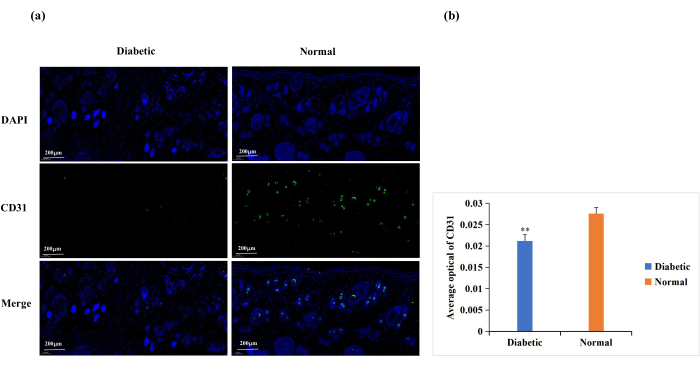
Figura 6: Análisis de tinción por inmunofluorescencia para la expresión de CD31. Se utilizaron niveles de CD31 para determinar el estado de angiogénesis. (A) Imágenes representativas de tinción de inmunofluorescencia CD31 en los grupos diabético y normal. El valor de densidad óptica integrada (IOD) y el área de píxeles (AREA) para cada muestra de piel se calcularon con el software Image-Pro Plus 6.0. También se derivó el valor de densidad óptica media (AOD = IOD/AREA). El valor de AOD fue directamente proporcional a la expresión positiva de CD31. (B) Comparación cuantitativa de la expresión positiva de CD31 en los grupos diabético y normal. Los datos se presentan como media ± DE. ** p < 0,01. Escala: una barra = 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo aclara las operaciones disputadas en el modelado de heridas T1DM. Las preocupaciones sobre los protocolos de inyección STZ, los criterios de éxito de la inducción de DMT1, el tiempo de estabilización de la glucosa en sangre y la ubicación y el tamaño de la herida se han abordado en este trabajo. Además, se han aclarado las características patológicas y los parámetros medibles para la evaluación de la cicatrización de heridas con DMT1.
Las ratas ayunaron durante 18 h antes de la inyección de STZ para evitar la unión competitiva de la glucosa o sus análogos a las células β, lo que podría afectar la eficacia de STZ. El método más utilizado para inducir DMT1 es una dosis única alta de STZ, que aumenta la glucosa en sangre al dañar los islotes y disminuir la secreción de insulina21. Los ensayos pre-experimentales revelaron que la dosis óptima de STZ para una alta tasa de éxito y una baja tasa de mortalidad fue de 55 mg/kg, que es inferior a las dosis óptimas reportadas en estudios previos22,23,24. En este protocolo, la DMT1 fue inducida mediante una única inyección intraperitoneal de 55 mg/kg STZ.
Los niveles de glucosa en sangre fueron todos superiores a 16,7 mmol / L 3 días después de la inyección STZ. Sin embargo, un nivel de glucosa en sangre superior a 16,7 mmol / L en el día 7 después de la inyección STZ es el criterio recomendado para el modelado exitoso de DMT1, porque la extensión del daño de los islotes varía entre las ratas, y una extensión adecuada del tiempo de diagnóstico puede reducir la tasa de falsos negativos. Además, las fluctuaciones de glucosa en sangre se estabilizaron 5 semanas después de la inyección STZ, y las ratas aumentaron gradualmente de peso durante este período, de acuerdo con los hallazgos previos25,26. Esto indica que el nivel de glucosa en sangre en el modelo de DMT1 debe estabilizarse durante al menos 6 semanas, y un aumento en el peso de la rata después de 6 semanas reduce las tasas de mortalidad durante el modelado de la herida. Por lo tanto, este protocolo realizó el modelado de heridas 8 semanas después de la inyección STZ.
La tasa de cierre de la herida en el día 7 y el día 14 después de la herida fue significativamente menor en el grupo diabético que en el grupo de herida normal, lo que indica una cicatrización lenta. Además, la reepitelización de la herida y la angiogénesis fueron significativamente menores en el grupo diabético que en el normal. Esto demuestra que el modelo de herida T1DM muestra una cicatrización más lenta de la herida y una reepitelización retardada que en ratas normales, lo que puede estar relacionado con los cambios patológicos de la angiogénesis reducida de la herida. Sin embargo, en el día 14, la tasa de cicatrización de heridas de DMT1 también fue superior al 90%, que es diferente de la característica crónica de no cicatrización de las heridas diabéticas humanas. Esto podría deberse a que los mecanismos fisiológicos de los roedores para la cicatrización de heridas difieren de los de los humanos27. En consecuencia, el mejor diámetro de la herida es de al menos 20 mm, que es lo suficientemente grande como para dar tiempo a evaluar la eficacia de una intervención en un estudio de herida diabética. La ubicación de la herida debe evitar la escápula y la columna vertebral, ya que el movimiento continuo en estos dos sitios podría interrumpir la cicatrización de la herida.
En conclusión, la construcción del modelo de herida DMT1 utilizando el método de este protocolo es efectiva. El protocolo replica algunas de las características de las heridas diabéticas crónicas, como una cicatrización más lenta de las heridas, un retraso en la reepitelización y una angiogénesis reducida en comparación con las heridas normales de rata. Sin embargo, se desconoce si el modelo puede replicar otros fenotipos crónicos de heridas diabéticas. Además, este protocolo describe el método más fundamental y ampliamente utilizado, que no tiene en cuenta el problema de la contracción de la piel en ratas. La investigación futura puede incorporar el uso de férulas de heridas en este protocolo o explorar modelos adicionales de heridas diabéticas crónicas, lo que será un desafío importante para los investigadores en el futuro.
Divulgaciones
Todos los autores declaran que este manuscrito no tiene conflictos de intereses.
Agradecimientos
Este estudio fue apoyado financieramente por la Fundación Nacional de Ciencias Naturales de China (82104877).
Materiales
| Name | Company | Catalog Number | Comments |
| Antifade mounting medium | Southern Biotechnology Associates, Inc. | 0100-01 | |
| AutoFluo Quencher | Servicebio Technology co., Ltd. | G1221 | |
| Automatic slide stainer | Thermo Fisher Scientific Inc. | Varistain™ Gemini ES | |
| CD31 | Servicebio Technology co., Ltd. | GB11063-2 | |
| Citrate antigen retrieval solution | Servicebio Technology co., Ltd. | G1201 | |
| Cover glass | Citotest Labware Manufacturing Co., Ltd. | 10212432C | |
| DAPI | Servicebio Technology co., Ltd. | G1012 | |
| Decolorization shaker | Scilogex | S1010E | |
| Depilatory cream | Guangzhou Ruixin Biotechnology Co., Ltd. | — | |
| Dimethyl benzene | Chengdu Kelong Chemical Co., Ltd. | 64-17-5 | |
| Drug oscillator | Shenzhen Jiashi Technology Co., Ltd. | VM-370 | |
| Electric razor | Shanghai Flyco Electrical Appliance Co., Ltd. | FC5908 | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd. | JB-P5 | |
| Ethanol absolute | Chengdu Kelong Chemical Co., Ltd. | 1330-20-7 | |
| Fitc-labeled goat anti-rabbit IgG | Servicebio Technology co., Ltd. | GB22303 | |
| Goat serum | Thermo Fisher Scientific Inc. | 16210064 | |
| Hematoxylin and eosin staining solution | Beijing Regan Biotechnology Co., Ltd. | DH0020 | |
| Image J software | National Institutes of Health | — | |
| Microwave oven | Midea Group Co., Ltd. | M1-L213B | |
| Mini centrifuge | Scilogex | D1008 | |
| Neutral balsam | Sinopharm Chemical Reagent Co., Ltd | 10004160 | |
| PBS buffer | Biosharp | G4202 | |
| Portable blood glucose meter | Sinocare Inc. | GA-3 | |
| Rapid tissue processor | Thermo Fisher Scientific Inc. | STP420 ES | |
| Rat fixator | Globalebio (Beijing) Technology co., Ltd | GEGD-Q10G1 | |
| Slicing machine | Thermo Fisher Scientific Inc. | HM325 | |
| Slides glass | Citotest Labware Manufacturing Co., Ltd. | 80312-3181 | |
| sodium citrate buffer | Beijing Solarbio Science & Technology Co., Ltd. | c1013 | |
| Streptozotocin | Sigma | 57654595 |
Referencias
- Zimmet, P., Alberti, K. G., Shaw, J. Global and societal implications of the diabetes epidemic. Nature. 414 (6865), 782-787 (2001).
- Grennan, D. Diabetic foot ulcers. Journal of the American Medical Association. 321 (1), 114(2019).
- Eming, S. A., Martin, P., Tomic-Canic, M. Wound repair and regeneration: Mechanisms, signaling, and translation. Science Translational Medicine. 6 (265), 265sr6(2014).
- Patel, S., Srivastava, S., Singh, M. R., Singh, D. Mechanistic insight into diabetic wounds: Pathogenesis, molecular targets and treatment strategies to pace wound healing. Biomedicine & Pharmacotherapy. 112, 108615(2019).
- Deeds, M. C., et al. Single dose streptozotocin-induced diabetes: Considerations for study design in islet transplantation models. Laboratory Animals. 45 (3), 131-140 (2011).
- Chao, P. C., et al. Investigation of insulin resistance in the popularly used four rat models of type-2 diabetes. Biomedicine & Pharmacotherapy. 101, 155-161 (2018).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Current Protocols. 1 (4), e78(2021).
- Wu, J., Yan, L. J. Streptozotocin-induced type 1 diabetes in rodents as a model for studying mitochondrial mechanisms of diabetic β cell glucotoxicity. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy. 8, 181-188 (2015).
- Yang, J., Chen, Z., Pan, D., Li, H., Shen, J. Umbilical cord-derived mesenchymal stem cell-derived exosomes combined pluronic F127 hydrogel promote chronic diabetic wound healing and complete skin regeneration. International Journal of Nanomedicine. 15, 5911-5926 (2020).
- Zhu, Y., Wang, Y., Jia, Y., Xu, J., Chai, Y. Roxadustat promotes angiogenesis through HIF-1α/VEGF/VEGFR2 signaling and accelerates cutaneous wound healing in diabetic rats. Wound Repair and Regeneration. 27 (4), 324-334 (2019).
- Shao, Z., et al. Wound microenvironment self-adaptive hydrogel with efficient angiogenesis for promoting diabetic wound healing. Bioactive Materials. 20, 561-573 (2022).
- Asfour, H. Z., et al. Enhanced healing efficacy of an optimized gabapentin-melittin nanoconjugate gel-loaded formulation in excised wounds of diabetic rats. Drug Delivery. 29 (1), 1892-1902 (2022).
- Wei, L., et al. Mesenchymal stem cells promote wound healing and effects on expression of matrix metalloproteinases-8 and 9 in the wound tissue of diabetic rats. Stem Cells and Development. 32 (1-2), 25-31 (2022).
- Pastar, I., et al. Preclinical models for wound-healing studies. In Skin Tissue Models., edited by. , Academic Press. Cambridge, MA. 223-253 (2018).
- Yang, R. H., et al. Epidermal stem cells (ESCs) accelerate diabetic wound healing via the Notch signalling pathway. Bioscience Reports. 36 (4), e00364(2016).
- Suliman Maashi, M., Felemban, S. G., Almasmoum, H. A., Jarahian, M. Nicaraven-loaded electrospun wound dressings promote diabetic wound healing via proangiogenic and immunomodulatory functions: A preclinical investigation. Drug Delivery and Translational Research. 13 (1), 222-236 (2023).
- Hao, M., Ding, C., Sun, S., Peng, X., Liu, W. Chitosan/sodium alginate/velvet antler blood peptides hydrogel promotes diabetic wound healing via regulating angiogenesis, inflammatory response and skin flora. Journal of Inflammation Research. 15, 4921-4938 (2022).
- Kolluru, G. K., Bir, S. C., Kevil, C. G. Endothelial dysfunction and diabetes: Effects on angiogenesis, vascular remodeling, and wound healing. International Journal of Vascular Medicine. 2012, 918267(2012).
- Okonkwo, U. A., DiPietro, L. A. Diabetes and wound angiogenesis. International Journal of Molecular Sciences. 18 (7), 1419(2017).
- Yi, C., et al. Targeted inhibition of endothelial calpain delays wound healing by reducing inflammation and angiogenesis. Cell Death & Disease. 11 (7), 533(2020).
- Goodson 3rd, W. H., Hung, T. K. Studies of wound healing in experimental diabetes mellitus. Journal of Surgical Research. 22 (3), 221-227 (1977).
- Luippold, G., Klein, T., Mark, M., Empagliflozin Grempler, R. a novel potent and selective SGLT-2 inhibitor, improves glycaemic control alone and in combination with insulin in streptozotocin-induced diabetic rats, a model of type 1 diabetes mellitus. Diabetes, Obesity & Metabolism. 14 (7), 601-607 (2012).
- Sayed, N., et al. Effect of dapagliflozin alone and in combination with insulin in a rat model of type 1 diabetes. The Journal of Veterinary Medical Science. 82 (4), 467-474 (2020).
- Han, Y., et al. Human umbilical cord mesenchymal stem cells implantation accelerates cutaneous wound healing in diabetic rats via the Wnt signaling pathway. European Journal of Medical Research. 24 (1), 10(2019).
- Ansell, D. M., Marsh, C., Walker, L., Hardman, M. J., Holden, K. Evaluating STZ-induced impaired wound healing in rats. Journal of Investigative Dermatology. 138 (4), 994-997 (2018).
- Liu, Y., et al. Human umbilical cord-derived mesenchymal stem cells not only ameliorate blood glucose but also protect vascular endothelium from diabetic damage through a paracrine mechanism mediated by MAPK/ERK signaling. Stem Cell Research & Therapy. 13 (1), 258(2022).
- Zindle, J. K., Wolinsky, E., Bogie, K. M. A review of animal models from 2015 to 2020 for preclinical chronic wounds relevant to human health. Journal of Tissue Viability. 30 (3), 291-300 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados