Method Article
Um Protocolo para a Construção de um Modelo de Ferida em Rato de Diabetes Tipo 1
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O modelo de feridas diabéticas induzidas por estreptozotocina em ratos machos com SD é atualmente o modelo mais amplamente utilizado para estudar a cicatrização de feridas no diabetes mellitus tipo I. Este protocolo descreve os métodos usados para construir este modelo. Também apresenta e aborda potenciais desafios e examina a progressão e as características angiogênicas das feridas diabéticas.
Resumo
Uma única dose alta de injeção de estreptozotocina seguida de excisão de pele de espessura total no dorso de ratos é um método comum para a construção de modelos animais de feridas diabéticas tipo 1. No entanto, a manipulação inadequada pode levar à instabilidade do modelo e alta mortalidade em ratos. Infelizmente, existem poucas diretrizes existentes sobre a modelagem de feridas diabéticas tipo 1, que carecem de detalhes e não apresentam estratégias de referência específicas. Portanto, este protocolo detalha o procedimento completo para a construção de um modelo de ferida diabética tipo 1 e analisa a progressão e as características angiogênicas das feridas diabéticas. A modelagem da ferida diabética tipo 1 envolve as seguintes etapas: preparação da injeção de estreptozotocina, indução do diabetes mellitus tipo 1 e construção do modelo da ferida. A área da ferida foi medida no 7º e 14º dia após a ferida, e os tecidos cutâneos dos ratos foram extraídos para análise histopatológica e de imunofluorescência. Os resultados revelaram que o diabetes mellitus tipo 1 induzido por estreptozotocina 55 mg/kg foi associado a menor mortalidade e alta taxa de sucesso. Os níveis de glicose no sangue estavam relativamente estáveis após 5 semanas da indução. A taxa de cicatrização de feridas diabéticas foi significativamente menor do que a de feridas normais no dia 7 e no dia 14 (p < 0,05), mas ambas puderam atingir mais de 90% no dia 14. Em comparação com o grupo normal, o fechamento da camada epidérmica das feridas diabéticas no 14º dia foi incompleto, com retardo na reepitelização e angiogênese significativamente menor (p < 0,01). O modelo de ferida diabética tipo 1 construído com base nesse protocolo apresenta as características da cicatrização crônica de feridas, incluindo mau fechamento, retardo na reepitelização e diminuição da angiogênese em comparação com feridas normais em ratos.
Introdução
O diabetes mellitus tipo 1 (DM1) é uma doença metabólica crônica caracterizada por hiperglicemia e destruiçãodas células β pancreáticas1. A ferida do DM1 é uma ferida crônica que não cicatriza e a complicação mais comum e devastadora do diabetes em humanos 2,3. Modelos animais são os protótipos mais apropriados para estudar as alterações patológicas durante a cicatrização de feridas e a segurança e eficácia de potenciais agentes terapêuticos4. Comparados a outros tipos, ratos machos da raça Sprague-Dawley (SD) são mais sensíveis à estreptozotocina (STZ) e apresentam menor taxa de mortalidade relacionada, tornando-os populares na pesquisa de feridas diabéticas 5,6.
Inúmeros métodos para a construção de modelos de feridas com DM1 têm sido descritos. Em relação ao modelo de DM1, os estudos têm focado principalmente no efeito do método de injeção de STZ na taxa de sucesso da indução do diabetes 7,8. No entanto, o processo de modelagem sofre com a operação inconsistente dessa mesma etapa. Em um estudo, os ratos jejuaram por 18 h antes da injeção de STZ; ratos com glicemia superior a 16,67 mmol/L 1 semana após a injeção de STZ foram considerados diabéticos, e a ferida diabética foi introduzida após 3 semanas9. Por outro lado, em um estudo relacionado, Zhu et al., jejuaram ratos por 12 h antes da injeção de STZ; ratos com glicemia superior a 16,7 mmol/L 72 h após a injeção foram considerados diabéticos, e a ferida diabética foi introduzida após 4 semanas10. Em geral, há inconsistências nos protocolos de injeção de STZ, critérios de diagnóstico de diabetes e tempos de introdução da ferida.
Em termos de modelagem de feridas, na maioria dos estudos, toda a espessura da pele dorsal é excisada para a construção de feridas de DM1 após indução bem-sucedida do diabetes11,12,13. Embora esse modelo seja suscetível à contratura cutânea em ratos, é o modelo mais comumente utilizado em pesquisas de cicatrização de feridas, pois é menos trabalhoso e barato14,15. No entanto, faltam pesquisas guiadas por métodos sobre essa técnica de excisão de espessura total. Além disso, não existem padrões uniformes nos estudos existentes quanto ao tamanho e localização dasferidas12,16. O tamanho e a localização da ferida podem afetar indiretamente a consistência do desenho experimental e a validade científica dos resultados. Portanto, há uma necessidade urgente de um protocolo padrão para indução de DM1 e modelagem de feridas como referência para os pesquisadores. O objetivo deste estudo é visualizar um protocolo específico para modelagem de feridas com DM1 que possa ser utilizado como referência para estudos de feridas com DM1.
Protocolo
O protocolo foi conduzido seguindo a Declaração de Helsinque, e todos os experimentos com animais foram aprovados pelo Comitê de Gestão da Universidade de Medicina Tradicional Chinesa de Chengdu (Registro nº 2021-13).
1. Preparo da injeção de estreptozotocina
- Selecionar 15 ratos SD machos específicos livres de patógenos (SPF) com 8 semanas de idade e pesando 220 g ± 20 g. Usando o método de randomização simples, dividir os ratos em um grupo diabético (n = 10) e um grupo normal (n = 5).
- Medir o peso inicial dos ratos e determinar a dose de STZ através da administração de 55 mg/kg.
NOTA: Com base em pré-experimentos, 55 mg/kg é a dose ideal de STZ. - Pese o pó STZ com precisão e coloque-o em um recipiente à prova de luz.
- Adicionar uma quantidade adequada de tampão citrato de sódio 0,1 mol/L (pH 4,5) para dissolver a STZ até uma concentração de 1 %.
NOTA: O tampão citrato de sódio deve ser pré-arrefecido durante 2 h num frigorífico a 4 °C antes da utilização. A preparação da solução STZ deve assegurar a esterilidade. - Agite por 30 s usando um oscilador de drogas. Coloque em uma caixa de gelo e reserve.
NOTA: A injeção deve ser utilizada no prazo de 15 minutos.
2. Indução do modelo de DM1
- Antes da injeção de STZ, jejuar os ratos por 18 h e permitir livre acesso à água.
- Realizar uma injeção intraperitoneal de solução de STZ a 1%.
- Segure o rato e exponha a pele abdominal e o local da injeção (a intersecção da linha que liga as raízes das duas coxas e a linha média do abdómen).
- Desinfetar o local de injeção duas vezes usando uma bola de algodão embebida em álcool 75% (uma vez no sentido horário e uma vez no sentido anti-horário). Coloque a cabeça do rato abaixo do abdômen.
- Insira a agulha paralela à linha média abdominal em um ângulo de 45° e, depois de perfurar a pele, reduza o ângulo da agulha para 30° e, em seguida, insira a agulha 2-3 mm. Puxe suavemente o tampão da agulha, garantindo que nenhum sangue ou líquido seja sugado para dentro da seringa. Injete a solução STZ, retire a agulha e pare o sangramento com um cotonete.
NOTA: Se um líquido amarelo for puxado de volta para a seringa, a agulha pode ter penetrado na bexiga e, se um líquido verde-escuro for arrastado, a agulha pode ter penetrado no intestino grosso ou no ceco. Em ambos os casos, a agulha deve ser removida imediatamente. O animal deve ser avaliado por pessoal veterinário.
- Medir os níveis casuais (sem jejum ou jejum) de glicemia às 09:00 horas do dia 3 e do dia 7 após a indução da STZ.
NOTA: O tempo para a medição aleatória da glicose no sangue é fixo. Neste protocolo, é fixado às 09h00. No entanto, não é o único tempo utilizado. O sangue coletado da veia caudal por punção com agulha é menos suscetível ao fluido tecidual do que o sangue retirado de uma cauda cortada, de modo que os valores de glicose no sangue são mais precisos.- Imobilizar o rato com fixador (Figura 1).
- Encontre a localização da veia caudal. Desinfete a cauda do rato duas vezes usando uma bola de algodão embebida em álcool 75%.
- Puncione a veia caudal para induzir sangramento e meça a glicemia usando um glicosímetro. Pare o sangramento com um cotonete.
NOTA: Um nível de glicose superior a 16,7 mmol/L no dia 7 após a injeção de STZ é considerado DM1.
- Pesar os ratos semanalmente e medir os níveis de glicose no sangue e outros parâmetros, incluindo dieta, ingestão de água e produção de urina.
- Alimentar os animais normalmente durante 8 semanas após a indução de STZ.
3. Construção do modelo da ferida
- Faça a barba dos ratos com uma navalha elétrica 1 dia antes da modelagem da ferida. Uma área raspada de 5 cm x 5 cm no dorso do rato é geralmente ideal.
- Limpe a área raspada com uma bola de algodão salina normal morna, deixe secar e, em seguida, aplique creme depilatório por 5 min. Limpe a área com gaze e lave qualquer creme depilatório residual com soro fisiológico normal morno.
- Pesar os ratos e calcular a dose necessária de Nembutal com base no padrão de 35 mg/kg. Dissolver o Nembutal usando soro fisiológico normal até uma concentração de 3%. Outros anestésicos gerais, como cetamina/xilazina ou isoflurano, podem ser utilizados para esse procedimento. Por favor, trabalhe com os Comitês Institucionais de Cuidados e Uso de Animais para garantir o que é melhor.
NOTA: Para garantir a eficácia, a solução deve ser preparada na hora e o pó e a solução de Nembutal devem ser protegidos da luz. - Jejuar os ratos por 12 h antes da anestesia. Injetar a anestesia por via intraperitoneal. Use pomada ocular de tetraciclina ou um lubrificante geral para os olhos para evitar o ressecamento dos olhos após a administração da anestesia.
OBS: A anestesia foi considerada moderada quando a musculatura do rato estava relativamente relaxada, os movimentos oculares desapareceram, a respiração foi regular e a resposta aos estímulos dolorosos foi pequena. - Desinfetar a pele dorsal duas vezes usando bolas de algodão embebidas em iodo (uma vez no sentido horário e outra no sentido anti-horário) e álcool 75% (rodadas alternativas).
- Após a secagem, cortar a pele com um punch de biópsia circular de 20 mm de diâmetro.
- Tenda a pele com pinças estéreis e, em seguida, use tesoura cirúrgica estéril para remover a pele de espessura total ao longo das marcas de corte de perfuração. Pare o sangramento com uma bola de algodão salina normal.
NOTA: A borda superior da ferida deve estar 5-10 mm abaixo da borda escapular inferior e 5-10 mm à direita/esquerda da coluna vertebral do rato (Figura 2). As feridas são simétricas ao longo da coluna vertebral quando duas feridas são construídas. - Use gaze vaselina para cobrir as feridas e envolva-as com uma gaze e atadura respirável mantida no lugar com fita adesiva de borracha. Injetar carprofeno por via subcutânea (5 mg/kg) uma vez ao dia para aliviar a dor pós-operatória. Troque o curativo da ferida uma vez ao dia (uso de carprofeno para alívio da dor).
NOTA: Observe o movimento e a respiração do rato para quaisquer anormalidades após o curativo ser concluído, e certifique-se de que o curativo respirável está adequadamente apertado. - Coloque uma régua sob a ferida e fotografe a ferida com uma câmera digital até o 14º dia. Eutanásia dos ratos no dia 14 de acordo com as diretrizes institucionais de cuidados e uso dos animais. Corte o tecido cutâneo da ferida a 5 mm da borda da ferida. Divida a amostra de tecido em duas partes, lave-as com PBS para remover manchas de sangue visíveis e, em seguida, fixe-as com solução de paraformaldeído a 4%.
4. Cálculo da área da ferida com o software ImageJ
- Clique no botão Arquivo depois de abrir o software e, em seguida, solte e clique em Abrir para abrir as imagens da ferida.
- Selecione a ferramenta Reto e desenhe uma linha reta de 1 cm ao longo da régua nas imagens da ferida.
- Clique no comando Definir escala no menu Analisar e defina a distância conhecida como 1.
- Selecione a ferramenta Seleções à mão livre e esboce o contorno da ferida na imagem.
- Clique no comando Medir no menu Analisar e leia o valor da área depois que o resultado aparecer.
5. Coloração para hematoxilina e eosina (H&E)
- Retire o tecido cutâneo do fixador, corte-o em seções finas com bisturi em um exaustor e coloque-o em um de desidratação.
- Coloque o de desidratação em uma máquina de desidratação e desidrate os tecidos nas seguintes etapas: álcool 75% por 4 h; álcool a 85% por 2 h; álcool a 90% por 2 h; álcool a 95% por 1 h; etanol anidro I e II por 30 min cada; álcool benzeno por 5-10 min; xileno I e II por 5-10 min cada; e cera I, II e III por 1 h cada.
- Incorpore os tecidos em cera. Resfriar a -20° em uma mesa de congelamento e corrigir o bloco de cera ordenadamente.
- Cortar os blocos de cera longitudinalmente usando uma máquina de secção em parafina em seções de 3 μm de espessura.
- Mergulhe sequencialmente a seção em xileno I e II por 20 min cada, etanol anidro I e II por 5 min cada, e água da torneira por 5 min.
- Inundar os tecidos com coloração de hematoxilina por 3-5 min, diferenciação de solução aquosa de ácido clorídrico a 0,5%, solução aquosa de amônia a 0,5% de volta ao azul e enxaguar com água.
- Desidratar os cortes de tecido com álcool a 85% e 95%. Inundar os tecidos com solução corante de eosina por 5 min.
NOTA: Normalmente, a coloração de eosina leva de 30 s a 2 min, e o tempo pode ser ajustado de acordo com os resultados e requisitos da coloração. - Desidratar sequencialmente os cortes com as seguintes soluções: etanol anidro I, etanol anidro II, etanol anidro III, xileno I e xileno II, cada um por 5 min. Por fim, cubra as lâminas de vidro com bálsamo neutro.
- Examine os tecidos corados com H&E sob o microscópio a 40x, 20x e 10x e tire fotos para reter imagens representativas de cada lâmina.
6. Coloração por imunofluorescência CD31
- Mergulhe os cortes de tecido em xileno I e II por 15 min cada, etanol anidro I e II por 5 min cada, álcool 85% por 5 min e álcool 75% por 5 min, e enxágue com água destilada.
- Reparo de antígeno
- Adicione um tampão de ácido cítrico adequado de 10 mM de pH 6,0 a um recipiente de forno de micro-ondas, aqueça-o até ferver no alto e, em seguida, coloque a lâmina de vidro nele.
- Ferva por 8 min em fogo médio, pare por 8 min e ferva novamente em fogo médio-baixo por 7 min.
- Deixe as lâminas esfriar, coloque-as em PBS (pH 7,4) e lave-as três vezes por 5 min cada uma usando um agitador de descoloração.
- Adicione 5% de soro de cabra no círculo e incube por 30 min.
- Agite suavemente a solução de fecho (soro de cabra a 5%) e adicione o anticorpo anti-CD31 de coelho (diluído com PBS numa proporção de 1:200) gota a gota sobre as secções. Coloque as seções em uma caixa úmida e incube durante a noite a 4°C.
- Lave as lâminas três vezes com PBS (pH 7,4) em um agitador de descoloração por 5 min cada. Agite levemente as seções para secá-las e, em seguida, cubra-as com uma gota circular de IgG anticoelho de cabra marcada com FITC. Incubar à temperatura ambiente durante 50 minutos na escuridão.
- Lave as lâminas três vezes com PBS (pH 7,4) em um agitador de descoloração por 5 min cada. Seque ao ar as seções com leve agitação e adicione a solução de coloração DAPI. Incubar as secções no escuro durante 10 minutos à temperatura ambiente.
- Depois de secar os cortes, desenhe círculos ao redor do tecido com o PepPen (para evitar a perda de anticorpos), adicione um agente de têmpera de autofluorescência (0,3% Sudan Black B) aos círculos por 5 min e, em seguida, enxágue-os em água corrente por 10 min.
- Lave as lâminas três vezes com PBS (pH 7,4) em um agitador de descoloração por 5 min cada. Agite ligeiramente as secções e sela-as com um meio de montagem antifade.
- Observe e fotografe os cortes em microscópio de fluorescência a 40x, 20x e 10x.
NOTA: O comprimento de onda de excitação UV DAPI é de 330-380 nm, e o comprimento de onda de emissão é de 420 nm (luz azul). O comprimento de onda de excitação FITC é de 465-495 nm, e o comprimento de onda de emissão é de 515-555 nm (luz verde).
7. Análise estatística
- Colete e analise os dados usando SPSS.
- Relate os dados como média ± desvio padrão.
- Use um teste t para amostras independentes para analisar as diferenças entre os grupos diabéticos e normais.
- Significância estatística definida em **p < 0,01 e *p < 0,05.
Resultados
Um total de 10 ratos SD recebeu uma única injeção intraperitoneal de STZ para induzir o modelo de DM1. Um rato morreu prematuramente (10%), mas diabetes foi induzido em todos os ratos (100%). Após 3 dias da injeção de STZ, os níveis glicêmicos de todos os ratos foram superiores a 16,7 mmol/L, e os níveis de glicose sanguínea estabilizaram 5 semanas após a indução (Figura 3A). O peso do grupo diabético aumentou gradualmente após a injeção de STZ, mas diminuiu na semana 3 e depois aumentou lentamente novamente a partir da semana 4 (Figura 3B). Em contraste, o peso dos ratos do grupo normal aumentou de forma constante, e seu peso médio 3 dias após a indução do diabetes foi maior do que o do grupo diabético (Figura 3B). Todos os ratos diabéticos apresentaram sintomas típicos de sede, poliúria e perda de peso, semelhantes aos achados de Hao et al.17.
No 7º e 14º dia após a ferida, a análise macroscópica revelou que a reepitelização foi mais pronunciada nos ratos do grupo normal do que no grupo diabético (Figura 4A). Os resultados quantitativos revelaram que a taxa de cicatrização foi significativamente menor no grupo diabético do que no grupo normal no 7º e 14º dia (p < 0,01). Entretanto, no 14º dia, as taxas de cicatrização também puderam estar acima de 90% no grupo diabético (p < 0,05, Figura 4B). Isso sugere que o modelo de feridas com DM1 é caracterizado por mau fechamento, mas não na extensão da não cicatrização crônica observada em feridas diabéticas humanas.
A coloração H&E no 14º dia de cicatrização revelou epiderme incompleta, proliferação lenta de queratinócitos e reepitelização retardada no grupo diabético em comparação com o grupo normal. As feridas diabéticas apresentaram perda parcial dos folículos pilosos e glândulas sebáceas. Havia também menos capilares visíveis (Figura 5).
O diabetes causa disfunção das células endoteliais, glicosilação das proteínas da matriz extracelular e desnervação vascular18. Essas complicações resultam em angiogênese da ferida abaixo do normal em feridas diabéticas18. A angiogênese é necessária para a cicatrização de feridas, e a angiogênese da ferida é frequentemente analisada pela imunomarcação para CD31 (Figura 6A)19,20. Com base na densidade óptica média (DAO) da expressão de CD31, a angiogênese no local da ferida foi significativamente maior no grupo normal do que no grupo diabético (p < 0,01, Figura 6B).
Figura 1: Imagem de ratos imobilizados por fixadores. Clique aqui para ver uma versão maior desta figura.
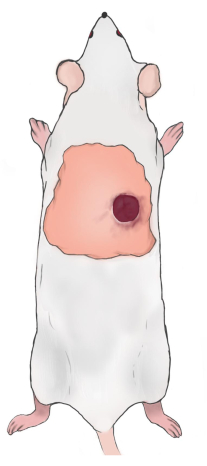
Figura 2: Diagrama da localização da ferida no rato. Clique aqui para ver uma versão maior desta figura.
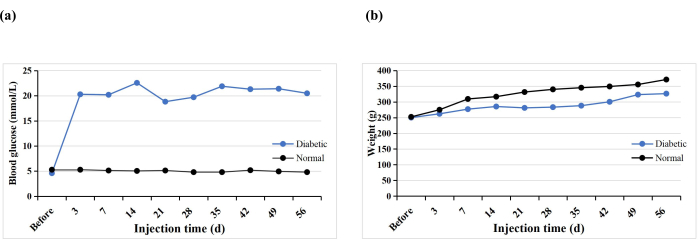
Figura 3: Glicemia e pesos dos ratos experimentais. Clique aqui para ver uma versão maior desta figura.
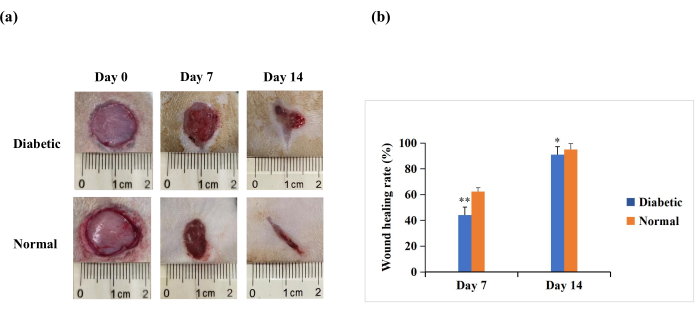
Figura 4: Feridas cutâneas de espessura total (20 mm de diâmetro) no dorso dos ratos experimentais. (A) O aspecto macroscópico das feridas no dia 0, dia 7 e dia 14. As imagens da morfologia da ferida nos dias 0, 7 e 14 foram capturadas com uma câmera fotográfica digital. (B) A área da ferida foi medida pelo software ImageJ e utilizada para calcular a taxa de cicatrização das feridas. A taxa de cicatrização (%) foi calculada da seguinte forma: (área inicial da ferida − área da ferida no momento indicado)/área inicial da ferida × 100. Os valores são apresentados como média ± DP (n = 14). A significância estatística foi estabelecida em ** p < 0,01 e * p < 0,05. Clique aqui para ver uma versão maior desta figura.
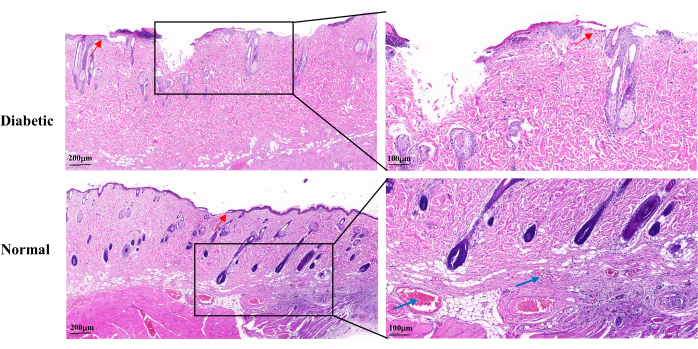
Figura 5: Imagens histopatológicas representativas de H&E no 14º dia após o estabelecimento da ferida. As setas azuis indicam capilares. As setas vermelhas mostram a proliferação de queratinócitos. Escala esquerda: uma barra = 200 μm; Escala direita: uma barra = 100 μm. Clique aqui para ver uma versão maior desta figura.
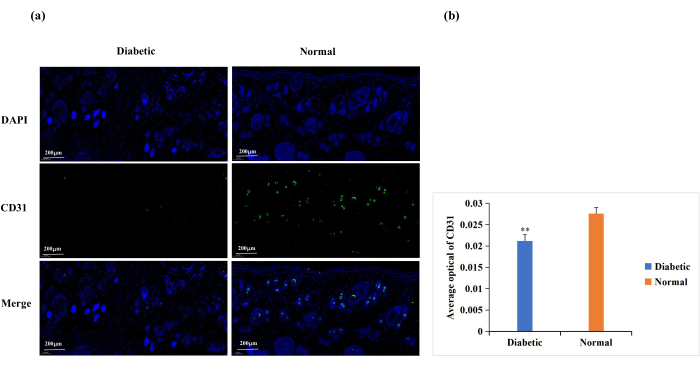
Figura 6: Análise da coloração por imunofluorescência para a expressão de CD31. Os níveis de CD31 foram usados para determinar o estado de angiogênese. (A) Imagens representativas da coloração de imunofluorescência CD31 nos grupos diabético e normal. O valor da densidade óptica integrada (IOD) e a área do pixel (AREA) para cada amostra de pele foram calculados com o software Image-Pro Plus 6.0. O valor médio de densidade óptica (DAO) (DAO = IOD/ÁREA) também foi derivado. O valor de DAO foi diretamente proporcional à expressão positiva de CD31. (B) Comparação quantitativa da expressão CD31 positiva nos grupos diabético e normal. Os dados são apresentados como média ± DP.** p < 0,01. Escala: uma barra = 200 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo esclarece as operações contestadas na modelagem de feridas de DM1. Preocupações sobre os protocolos de injeção de STZ, critérios de sucesso de indução de DM1, tempo de estabilização da glicemia, localização e tamanho da ferida foram abordadas neste trabalho. Além disso, as características patológicas e os parâmetros mensuráveis para a avaliação da cicatrização de feridas no DM1 foram esclarecidos.
Os ratos permaneceram em jejum por 18 h antes da injeção de STZ para evitar a ligação competitiva da glicose ou de seus análogos às células β, o que poderia afetar a eficácia da STZ. O método mais comumente utilizado para induzir DM1 é uma dose única alta de STZ, que aumenta a glicemia por danificar as ilhotas e diminuir a secreção de insulina21. Ensaios pré-experimentais revelaram que a dose ótima de STZ para uma alta taxa de sucesso e baixa taxa de mortalidade foi de 55 mg/kg, que é menor do que as doses ideais relatadas em estudos anteriores22,23,24. Nesse protocolo, o DM1 foi induzido com injeção única intraperitoneal de 55 mg/kg STZ.
Os níveis de glicose no sangue foram todos superiores a 16,7 mmol/L 3 dias após a injeção de STZ. No entanto, um nível de glicose no sangue superior a 16,7 mmol/L no dia 7 após a injeção de STZ é o critério recomendado para a modelagem bem-sucedida do DM1, pois a extensão do dano às ilhotas varia entre os ratos, e uma extensão apropriada do tempo de diagnóstico pode reduzir a taxa de falso-negativos. Além disso, as flutuações da glicemia estabilizaram-se 5 semanas após a injeção de STZ, e os ratos gradualmente ganharam peso durante esse período, consistente com achados prévios25,26. Isso indica que o nível de glicose no sangue no modelo de DM1 deve ser estabilizado por pelo menos 6 semanas, e um aumento no peso do rato após 6 semanas reduz as taxas de mortalidade durante a modelagem da ferida. Assim, esse protocolo realizou a modelagem da ferida 8 semanas após a injeção de STZ.
A taxa de fechamento da ferida no 7º e 14º dia após a ferida foi significativamente menor no grupo diabético do que no grupo com ferida normal, indicando cicatrização lenta. Além disso, a reepitelização da ferida e a angiogênese foram significativamente menores no grupo diabético do que no grupo normal. Isso demonstra que o modelo de ferida com DM1 apresenta cicatrização mais lenta e reepitelização retardada do que em ratos normais, o que pode estar relacionado às alterações patológicas da redução da angiogênese da ferida. No entanto, no 14º dia, a taxa de cicatrização de feridas no DM1 também estava acima de 90%, o que é diferente da característica crônica não cicatrizante das feridas diabéticas humanas. Isso pode ocorrer porque os mecanismos fisiológicos dos roedores para a cicatrização de feridas diferem daqueles dos humanos27. Consequentemente, o melhor diâmetro da ferida é de pelo menos 20 mm, o que é grande o suficiente para dar tempo para avaliar a eficácia de uma intervenção em um estudo de ferida diabética. A localização da ferida deve evitar a escápula e a coluna vertebral, pois o movimento contínuo nesses dois locais pode atrapalhar a cicatrização da ferida.
Conclui-se que a construção do modelo de feridas com DM1 utilizando o método deste protocolo é eficaz. O protocolo replica algumas das características das feridas diabéticas crônicas, como cicatrização mais lenta, reepitelização retardada e angiogênese reduzida em comparação com feridas normais em ratos. No entanto, não se sabe se o modelo pode replicar outros fenótipos crônicos de feridas diabéticas. Além disso, este protocolo descreve o método mais fundamental e amplamente utilizado, que não dá conta da questão da contração da pele em ratos. Pesquisas futuras podem incorporar o uso de talas de feridas nesse protocolo ou explorar modelos adicionais de feridas diabéticas crônicas, o que será um desafio significativo para os pesquisadores no futuro.
Divulgações
Todos os autores declaram não haver conflitos de interesse.
Agradecimentos
Este estudo foi financiado pela Fundação Nacional de Ciências Naturais da China (82104877).
Materiais
| Name | Company | Catalog Number | Comments |
| Antifade mounting medium | Southern Biotechnology Associates, Inc. | 0100-01 | |
| AutoFluo Quencher | Servicebio Technology co., Ltd. | G1221 | |
| Automatic slide stainer | Thermo Fisher Scientific Inc. | Varistain™ Gemini ES | |
| CD31 | Servicebio Technology co., Ltd. | GB11063-2 | |
| Citrate antigen retrieval solution | Servicebio Technology co., Ltd. | G1201 | |
| Cover glass | Citotest Labware Manufacturing Co., Ltd. | 10212432C | |
| DAPI | Servicebio Technology co., Ltd. | G1012 | |
| Decolorization shaker | Scilogex | S1010E | |
| Depilatory cream | Guangzhou Ruixin Biotechnology Co., Ltd. | — | |
| Dimethyl benzene | Chengdu Kelong Chemical Co., Ltd. | 64-17-5 | |
| Drug oscillator | Shenzhen Jiashi Technology Co., Ltd. | VM-370 | |
| Electric razor | Shanghai Flyco Electrical Appliance Co., Ltd. | FC5908 | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd. | JB-P5 | |
| Ethanol absolute | Chengdu Kelong Chemical Co., Ltd. | 1330-20-7 | |
| Fitc-labeled goat anti-rabbit IgG | Servicebio Technology co., Ltd. | GB22303 | |
| Goat serum | Thermo Fisher Scientific Inc. | 16210064 | |
| Hematoxylin and eosin staining solution | Beijing Regan Biotechnology Co., Ltd. | DH0020 | |
| Image J software | National Institutes of Health | — | |
| Microwave oven | Midea Group Co., Ltd. | M1-L213B | |
| Mini centrifuge | Scilogex | D1008 | |
| Neutral balsam | Sinopharm Chemical Reagent Co., Ltd | 10004160 | |
| PBS buffer | Biosharp | G4202 | |
| Portable blood glucose meter | Sinocare Inc. | GA-3 | |
| Rapid tissue processor | Thermo Fisher Scientific Inc. | STP420 ES | |
| Rat fixator | Globalebio (Beijing) Technology co., Ltd | GEGD-Q10G1 | |
| Slicing machine | Thermo Fisher Scientific Inc. | HM325 | |
| Slides glass | Citotest Labware Manufacturing Co., Ltd. | 80312-3181 | |
| sodium citrate buffer | Beijing Solarbio Science & Technology Co., Ltd. | c1013 | |
| Streptozotocin | Sigma | 57654595 |
Referências
- Zimmet, P., Alberti, K. G., Shaw, J. Global and societal implications of the diabetes epidemic. Nature. 414 (6865), 782-787 (2001).
- Grennan, D. Diabetic foot ulcers. Journal of the American Medical Association. 321 (1), 114(2019).
- Eming, S. A., Martin, P., Tomic-Canic, M. Wound repair and regeneration: Mechanisms, signaling, and translation. Science Translational Medicine. 6 (265), 265sr6(2014).
- Patel, S., Srivastava, S., Singh, M. R., Singh, D. Mechanistic insight into diabetic wounds: Pathogenesis, molecular targets and treatment strategies to pace wound healing. Biomedicine & Pharmacotherapy. 112, 108615(2019).
- Deeds, M. C., et al. Single dose streptozotocin-induced diabetes: Considerations for study design in islet transplantation models. Laboratory Animals. 45 (3), 131-140 (2011).
- Chao, P. C., et al. Investigation of insulin resistance in the popularly used four rat models of type-2 diabetes. Biomedicine & Pharmacotherapy. 101, 155-161 (2018).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Current Protocols. 1 (4), e78(2021).
- Wu, J., Yan, L. J. Streptozotocin-induced type 1 diabetes in rodents as a model for studying mitochondrial mechanisms of diabetic β cell glucotoxicity. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy. 8, 181-188 (2015).
- Yang, J., Chen, Z., Pan, D., Li, H., Shen, J. Umbilical cord-derived mesenchymal stem cell-derived exosomes combined pluronic F127 hydrogel promote chronic diabetic wound healing and complete skin regeneration. International Journal of Nanomedicine. 15, 5911-5926 (2020).
- Zhu, Y., Wang, Y., Jia, Y., Xu, J., Chai, Y. Roxadustat promotes angiogenesis through HIF-1α/VEGF/VEGFR2 signaling and accelerates cutaneous wound healing in diabetic rats. Wound Repair and Regeneration. 27 (4), 324-334 (2019).
- Shao, Z., et al. Wound microenvironment self-adaptive hydrogel with efficient angiogenesis for promoting diabetic wound healing. Bioactive Materials. 20, 561-573 (2022).
- Asfour, H. Z., et al. Enhanced healing efficacy of an optimized gabapentin-melittin nanoconjugate gel-loaded formulation in excised wounds of diabetic rats. Drug Delivery. 29 (1), 1892-1902 (2022).
- Wei, L., et al. Mesenchymal stem cells promote wound healing and effects on expression of matrix metalloproteinases-8 and 9 in the wound tissue of diabetic rats. Stem Cells and Development. 32 (1-2), 25-31 (2022).
- Pastar, I., et al. Preclinical models for wound-healing studies. In Skin Tissue Models., edited by. , Academic Press. Cambridge, MA. 223-253 (2018).
- Yang, R. H., et al. Epidermal stem cells (ESCs) accelerate diabetic wound healing via the Notch signalling pathway. Bioscience Reports. 36 (4), e00364(2016).
- Suliman Maashi, M., Felemban, S. G., Almasmoum, H. A., Jarahian, M. Nicaraven-loaded electrospun wound dressings promote diabetic wound healing via proangiogenic and immunomodulatory functions: A preclinical investigation. Drug Delivery and Translational Research. 13 (1), 222-236 (2023).
- Hao, M., Ding, C., Sun, S., Peng, X., Liu, W. Chitosan/sodium alginate/velvet antler blood peptides hydrogel promotes diabetic wound healing via regulating angiogenesis, inflammatory response and skin flora. Journal of Inflammation Research. 15, 4921-4938 (2022).
- Kolluru, G. K., Bir, S. C., Kevil, C. G. Endothelial dysfunction and diabetes: Effects on angiogenesis, vascular remodeling, and wound healing. International Journal of Vascular Medicine. 2012, 918267(2012).
- Okonkwo, U. A., DiPietro, L. A. Diabetes and wound angiogenesis. International Journal of Molecular Sciences. 18 (7), 1419(2017).
- Yi, C., et al. Targeted inhibition of endothelial calpain delays wound healing by reducing inflammation and angiogenesis. Cell Death & Disease. 11 (7), 533(2020).
- Goodson 3rd, W. H., Hung, T. K. Studies of wound healing in experimental diabetes mellitus. Journal of Surgical Research. 22 (3), 221-227 (1977).
- Luippold, G., Klein, T., Mark, M., Empagliflozin Grempler, R. a novel potent and selective SGLT-2 inhibitor, improves glycaemic control alone and in combination with insulin in streptozotocin-induced diabetic rats, a model of type 1 diabetes mellitus. Diabetes, Obesity & Metabolism. 14 (7), 601-607 (2012).
- Sayed, N., et al. Effect of dapagliflozin alone and in combination with insulin in a rat model of type 1 diabetes. The Journal of Veterinary Medical Science. 82 (4), 467-474 (2020).
- Han, Y., et al. Human umbilical cord mesenchymal stem cells implantation accelerates cutaneous wound healing in diabetic rats via the Wnt signaling pathway. European Journal of Medical Research. 24 (1), 10(2019).
- Ansell, D. M., Marsh, C., Walker, L., Hardman, M. J., Holden, K. Evaluating STZ-induced impaired wound healing in rats. Journal of Investigative Dermatology. 138 (4), 994-997 (2018).
- Liu, Y., et al. Human umbilical cord-derived mesenchymal stem cells not only ameliorate blood glucose but also protect vascular endothelium from diabetic damage through a paracrine mechanism mediated by MAPK/ERK signaling. Stem Cell Research & Therapy. 13 (1), 258(2022).
- Zindle, J. K., Wolinsky, E., Bogie, K. M. A review of animal models from 2015 to 2020 for preclinical chronic wounds relevant to human health. Journal of Tissue Viability. 30 (3), 291-300 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados