Method Article
Un protocole pour la construction d’un modèle de plaie de rat du diabète de type 1
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le modèle de plaie diabétique induite par la streptozotocine chez les rats SD mâles est actuellement le modèle le plus largement utilisé pour étudier la cicatrisation des plaies dans le diabète sucré de type I. Ce protocole décrit les méthodes utilisées pour construire ce modèle. Il présente et aborde également les défis potentiels et examine la progression et les caractéristiques angiogéniques des plaies diabétiques.
Résumé
Une seule dose élevée d’injection de streptozotocine suivie d’une excision cutanée de pleine épaisseur sur le dos de rats est une méthode courante pour construire des modèles animaux de plaies diabétiques de type 1. Cependant, une manipulation inappropriée peut entraîner une instabilité du modèle et une mortalité élevée chez les rats. Malheureusement, il existe peu de lignes directrices sur la modélisation des plaies diabétiques de type 1, et elles manquent de détails et ne présentent pas de stratégies de référence spécifiques. Par conséquent, ce protocole détaille la procédure complète de construction d’un modèle de plaie diabétique de type 1 et analyse la progression et les caractéristiques angiogéniques des plaies diabétiques. La modélisation des plaies diabétiques de type 1 implique les étapes suivantes: préparation de l’injection de streptozotocine, induction du diabète sucré de type 1 et construction du modèle de plaie. La zone de la plaie a été mesurée le jour 7 et le jour 14 après la blessure, et les tissus cutanés des rats ont été extraits pour une analyse histopathologique et immunofluorescence. Les résultats ont révélé que le diabète sucré de type 1 induit par 55 mg / kg de streptozotocine était associé à une mortalité plus faible et à un taux de réussite élevé. La glycémie était relativement stable après 5 semaines d’induction. Le taux de cicatrisation des plaies diabétiques était significativement inférieur à celui des plaies normales au jour 7 et au jour 14 (p < 0,05), mais les deux pouvaient atteindre plus de 90% le jour 14. Par rapport au groupe normal, la fermeture de la couche épidermique des plaies diabétiques au jour 14 était incomplète et avait retardé la réépithélialisation et une angiogenèse significativement plus faible (p < 0,01). Le modèle de plaie diabétique de type 1 construit sur la base de ce protocole présente les caractéristiques de la cicatrisation chronique des plaies, notamment une mauvaise fermeture, une réépithélialisation retardée et une angiogenèse réduite par rapport aux plaies normales chez le rat.
Introduction
Le diabète sucré de type 1 (DT1) est une maladie métabolique chronique caractérisée par une hyperglycémie et la destruction des β-cellules pancréatiques1. Une plaie DT1 est une plaie chronique qui ne guérit pas et la complication la plus courante et la plus dévastatrice du diabète chez l’homme 2,3. Les modèles animaux sont les prototypes les plus appropriés pour étudier les changements pathologiques au cours de la cicatrisation des plaies et la sécurité et l’efficacité des agents thérapeutiques potentiels4. Comparativement aux autres types, les rats Sprague-Dawley (SD) mâles sont plus sensibles à la streptozotocine (STZ) et présentent un taux de mortalité lié plus faible, ce qui les rend populaires dans la recherche sur les plaies diabétiques 5,6.
De nombreuses méthodes de construction de modèles de plaies DT1 ont été décrites. En ce qui concerne le modèle DT1, les études ont principalement porté sur l’effet de la méthode d’injection STZ sur le taux de réussite de l’induction du diabète 7,8. Cependant, le processus de modélisation souffre du fonctionnement incohérent de cette même étape. Dans une étude, des rats ont jeûné pendant 18 heures avant l’injection de STZ; les rats dont la glycémie était supérieure à 16,67 mmol/L 1 semaine après l’injection de STZ ont été jugés diabétiques, et la plaie diabétique a été introduite après 3 semaines9. Inversement, dans une étude connexe, Zhu et al. ont jeûné des rats pendant 12 heures avant l’injection de STZ; les rats dont la glycémie était supérieure à 16,7 mmol/L 72 h après l’injection ont été considérés comme diabétiques, et la plaie diabétique a été introduite après 4 semaines10. Dans l’ensemble, il existe des incohérences dans les protocoles d’injection de STZ, les critères de diagnostic du diabète et les délais d’introduction des plaies.
En termes de modélisation des plaies, dans la plupart des études, toute l’épaisseur de la peau dorsale est excisée pour construire des plaies DT1 après une induction réussie du diabète11,12,13. Bien que ce modèle soit sensible aux contractures cutanées chez les rats, c’est le modèle le plus couramment utilisé dans la recherche sur la cicatrisation des plaies car il nécessite moins de main-d’œuvre et est bon marché14,15. Néanmoins, la recherche guidée par la méthode sur cette technique d’excision pleine épaisseur fait défaut. De plus, il n’existe pas de normes uniformes dans les études existantes concernant la taille et l’emplacement des plaies12,16. La taille et l’emplacement de la plaie peuvent affecter indirectement la cohérence de la conception expérimentale et la validité scientifique des résultats. Par conséquent, il existe un besoin urgent d’un protocole standard pour l’induction du DT1 et la modélisation des plaies comme référence pour les chercheurs. L’objectif de cette étude est de visualiser un protocole spécifique pour la modélisation des plaies DT1 qui peut être utilisé comme référence pour les études de plaies DT1.
Protocole
Le protocole a été mené conformément à la Déclaration d’Helsinki et toutes les expériences sur les animaux ont été approuvées par le Comité de gestion de l’Université de médecine traditionnelle chinoise de Chengdu (numéro d’enregistrement 2021-13).
1. Préparation de l’injection de streptozotocine
- Sélectionner 15 rats mâles exempts d’agents pathogènes spécifiques (FPS) âgés de 8 semaines et pesant 220 g ± 20 g. En utilisant la méthode de randomisation simple, divisez les rats en un groupe diabétique (n = 10) et un groupe normal (n = 5).
- Mesurer le poids initial des rats et déterminer la dose de STZ par l’administration de 55 mg / kg.
NOTE: D’après les expériences préalables, 55 mg / kg est la dose optimale de STZ. - Pesez la poudre STZ avec précision et placez-la dans un récipient à l’épreuve de la lumière.
- Ajouter une quantité appropriée de tampon de citrate de sodium à 0,1 mol/L (pH 4,5) pour dissoudre la STZ à une concentration de 1 %.
REMARQUE : Le tampon de citrate de sodium doit être prérefroidi pendant 2 h dans un réfrigérateur à 4 °C avant utilisation. La préparation de la solution STZ doit assurer la stérilité. - Agiter pendant 30 s à l’aide d’un oscillateur médicamenteux. Placer dans une glacière et réserver.
NOTE: L’injection doit être utilisée dans les 15 minutes.
2. Induction du modèle DT1
- Avant l’injection STZ, jeûnez les rats pendant 18 h et permettez un libre accès à l’eau.
- Effectuer une injection intrapéritonéale de solution STZ à 1%.
- Saisissez le rat et exposez la peau abdominale et le site d’injection (l’intersection de la ligne reliant les racines des deux cuisses et la ligne médiane de l’abdomen).
- Désinfectez le site d’injection deux fois à l’aide d’une boule de coton imbibée d’alcool à 75 % (une fois dans le sens des aiguilles d’une montre et une fois dans le sens inverse des aiguilles d’une montre). Placez la tête du rat sous l’abdomen.
- Insérez l’aiguille parallèlement à la ligne médiane abdominale à un angle de 45°, et après avoir percé la peau, réduisez l’angle de l’aiguille à 30°, puis insérez l’aiguille de 2-3 mm. Tirez doucement le bouchon de l’aiguille, en vous assurant qu’aucun sang ou liquide n’est aspiré dans la seringue. Injectez la solution STZ, retirez l’aiguille et arrêtez le saignement avec un coton-tige.
REMARQUE: Si un liquide jaune est aspiré dans la seringue, l’aiguille peut avoir pénétré dans la vessie, et si un liquide vert foncé est aspiré, l’aiguille pourrait avoir pénétré dans le gros intestin ou le caecum. Dans les deux cas, l’aiguille doit être retirée immédiatement. L’animal doit être évalué par le personnel vétérinaire.
- Mesurez les niveaux de glycémie occasionnelle (non à jeun ou à jeun) à 09h00 le jour 3 et le jour 7 après l’induction STZ.
REMARQUE: Le temps de mesure aléatoire de la glycémie est fixe. Dans ce protocole, il est fixé à 09h00. Cependant, ce n’est pas le seul temps utilisé. Le sang prélevé dans la veine caudale par une ponction à l’aiguille est moins sensible au liquide tissulaire que le sang prélevé sur une queue sectionnée, de sorte que les valeurs de glycémie sont plus précises.- Immobiliser le rat à l’aide d’un fixateur à rats (Figure 1).
- Trouvez l’emplacement de la veine caudale. Désinfectez la queue du rat deux fois à l’aide d’une boule de coton imbibée d’alcool à 75%.
- Percez la veine caudale pour provoquer des saignements et mesurez la glycémie à l’aide d’un glucomètre. Arrêtez le saignement avec un coton-tige.
REMARQUE : Un taux de glucose supérieur à 16,7 mmol/L le jour 7 après l’injection de STZ est considéré comme un DT1.
- Pesez les rats chaque semaine et mesurez la glycémie et d’autres paramètres, y compris l’alimentation, la consommation d’eau et la production d’urine.
- Nourrissez les animaux normalement pendant 8 semaines après l’induction de STZ.
3. Construction du modèle de plaie
- Rasez les rats avec un rasoir électrique 1 jour avant le modelage de la plaie. Une zone rasée de 5 cm x 5 cm du côté dorsum du rat est généralement idéale.
- Essuyez la zone rasée avec une boule de coton salée normale et chaude, laissez-la sécher, puis appliquez de la crème dépilatoire pendant 5 minutes. Nettoyez la zone avec de la gaze et lavez toute crème dépilatoire résiduelle avec une solution saline chaude normale.
- Peser les rats et calculer la dose requise de Nembutal en fonction de la norme de 35 mg/kg. Dissoudre le Nembutal en utilisant une solution saline normale à une concentration de 3%. D’autres anesthésiques généraux tels que la kétamine/xylazine ou l’isoflurane peuvent être utilisés pour cette procédure. Veuillez travailler avec les comités institutionnels de soin et d’utilisation des animaux pour vous assurer de ce qui est le mieux.
REMARQUE: Pour assurer l’efficacité, la solution doit être fraîchement préparée et la poudre et la solution de Nembutal doivent être protégées de la lumière. - Jeûnez les rats pendant 12 heures avant l’anesthésie. Injectez l’anesthésie par voie intrapéritonéale. Utilisez une pommade oculaire à la tétracycline ou un lubrifiant général pour les yeux pour prévenir la sécheresse oculaire après l’administration de l’anesthésie.
NOTE: L’anesthésie était considérée comme modérée lorsque les muscles du rat étaient relativement détendus, que les mouvements oculaires disparaissaient, que la respiration était régulière et que la réponse aux stimuli douloureux était faible. - Désinfectez la peau dorsale deux fois à l’aide de boules de coton imbibées d’iode (une fois dans le sens des aiguilles d’une montre et une fois dans le sens inverse) et d’alcool à 75% (ronds alternatifs).
- Après séchage, coupez la peau avec un poinçon de biopsie circulaire de 20 mm de diamètre.
- Tendez la peau avec des pinces stériles, puis utilisez des ciseaux chirurgicaux stériles pour enlever la peau pleine épaisseur le long des marques de coupure de poinçon. Arrêtez le saignement avec une boule de coton saline normale.
REMARQUE : Le bord supérieur de la plaie doit être de 5 à 10 mm sous le bord inférieur du scapulaire et de 5 à 10 mm à droite/gauche de la colonne vertébrale du rat (Figure 2). Les plaies sont symétriques le long de la colonne vertébrale lorsque deux plaies sont construites. - Utilisez de la gaze de vaseline pour couvrir les plaies et enveloppez-les avec une gaze et un bandage respirant maintenu en place avec du ruban en caoutchouc. Injectez du carprofène par voie sous-cutanée (5 mg/kg) une fois par jour pour soulager la douleur postopératoire. Changez le pansement une fois par jour (utilisation de carprofène pour soulager la douleur).
REMARQUE: Observez les mouvements et la respiration du rat pour toute anomalie une fois le bandage terminé, et assurez-vous que le pansement respirant est suffisamment serré. - Placez une règle sous la plaie et photographiez la plaie avec un appareil photo numérique jusqu’au jour 14. Euthanasier les rats au jour 14 conformément aux lignes directrices institutionnelles sur le soin et l’utilisation des animaux. Coupez le tissu cutané de la plaie à 5 mm du bord de la plaie. Divisez l’échantillon de tissu en deux parties, lavez-les avec du PBS pour éliminer les taches de sang visibles, puis fixez-les avec une solution de paraformaldéhyde à 4%.
4. Calcul de la surface de la plaie avec le logiciel ImageJ
- Cliquez sur le bouton Fichier après avoir ouvert le logiciel, puis cliquez sur Ouvrir pour ouvrir les images de la plaie.
- Sélectionnez l’outil Droit et tracez une ligne droite de 1 cm le long de la règle dans les images de la bobine.
- Cliquez sur la commande Définir l’échelle dans le menu Analyser et définissez la distance connue sur 1.
- Sélectionnez l’outil Sélections à main levée et esquissez le contour de la blessure sur l’image.
- Cliquez sur la commande Mesure dans le menu Analyser et lisez la valeur Zone après l’affichage du résultat.
5. Coloration à l’hématoxyline et à l’éosine (H & E)
- Retirez le tissu cutané du fixateur, coupez-le en fines sections avec un scalpel dans une hotte et placez-le dans une cassette de déshydratation.
- Mettez la cassette de déshydratation dans une machine de déshydratation et déshydratez les tissus en procédant comme suit: alcool à 75% pendant 4 heures; 85% d’alcool pendant 2 h; 90% d’alcool pendant 2 h; 95% d’alcool pendant 1 h; éthanol anhydre I et II pendant 30 min chacun; alcool benzène pendant 5-10 min; xylène I et II pendant 5-10 min chacun; et cire I, II et III pendant 1 h chacune.
- Incorporer les tissus dans de la cire. Laisser refroidir à -20° sur une table de congélation et corriger soigneusement le bloc de cire.
- Couper les blocs de cire longitudinalement à l’aide d’une machine de sectionnement de paraffine en sections de 3 μm d’épaisseur.
- Faire tremper séquentiellement la section dans les xylènes I et II pendant 20 minutes chacune, dans l’éthanol anhydre I et II pendant 5 minutes chacun et dans l’eau du robinet pendant 5 minutes.
- Inonder les tissus avec une coloration à l’hématoxyline pendant 3-5 min, une différenciation de la solution d’acide chlorhydrique aqueux à 0,5%, une solution aqueuse d’ammoniac à 0,5% en bleu et rincer à l’eau.
- Déshydrater les sections de tissu avec 85% et 95% d’alcool. Inonder les tissus avec une solution de coloration à l’éosine pendant 5 min.
REMARQUE: Normalement, la coloration à l’éosine prend 30 s à 2 min, et le temps peut être ajusté en fonction des résultats et des exigences de coloration. - Déshydrater les sections séquentiellement avec les solutions suivantes: éthanol anhydre I, éthanol anhydre II, éthanol anhydre III, xylène I et xylène II, chacun pendant 5 min. Enfin, recouvrez les lames de verre avec du baume neutre.
- Examinez les tissus colorés H&E au microscope à 40x, 20x et 10x, et prenez des photos pour conserver des images représentatives de chaque lame.
6. Coloration par immunofluorescence CD31
- Faire tremper les coupes de tissus dans le xylène I et II pendant 15 min chacune, l’éthanol anhydre I et II pendant 5 min chacune, 85% d’alcool pendant 5 min et 75% d’alcool pendant 5 min, et rincer à l’eau distillée.
- Réparation de l’antigène
- Ajouter un tampon approprié d’acide citrique de 10 mM de pH 6,0 dans un récipient pour four à micro-ondes, le porter à ébullition à feu vif, puis y placer la lame de verre.
- Faire bouillir pendant 8 min à feu moyen, arrêter pendant 8 min, puis faire bouillir à nouveau à feu moyen-doux pendant 7 min.
- Laissez refroidir les lames, placez-les dans du PBS (pH 7,4) et lavez-les trois fois pendant 5 minutes chacune à l’aide d’un agitateur de décoloration.
- Ajouter 5% de sérum de chèvre goutte à goutte dans le cercle et incuber pendant 30 min.
- Secouer doucement la solution de fermeture (sérum de chèvre à 5%) et ajouter l’anticorps anti-CD31 de lapin (dilué à l’aide de PBS dans un rapport de 1:200) goutte à goutte sur les sections. Placer les sections dans une boîte humide et incuber pendant la nuit à 4°C.
- Laver les lames trois fois avec du PBS (pH 7,4) sur un agitateur de décoloration pendant 5 min chacune. Secouez légèrement les sections pour les sécher, puis recouvrez-les d’une goutte circulaire d’IgG anti-lapin de chèvre étiquetée FITC. Incuber à température ambiante pendant 50 min dans l’obscurité.
- Laver les lames trois fois avec du PBS (pH 7,4) sur un agitateur de décoloration pendant 5 min chacune. Sécher les sections à l’air libre en agitant légèrement et ajouter une solution de coloration DAPI. Incuber les sections dans l’obscurité pendant 10 min à température ambiante.
- Après avoir séché les sections, dessinez des cercles autour du tissu avec le PepPen (pour éviter la perte d’anticorps), ajoutez un agent de trempe par autofluorescence (0,3% de Sudan Black B) aux cercles pendant 5 min, puis rincez-les à l’eau courante pendant 10 min.
- Laver les lames trois fois avec du PBS (pH 7,4) sur un agitateur de décoloration pendant 5 min chacune. Secouez légèrement les sections et scellez-les avec un support de montage anti-décoloration.
- Observez et photographiez les coupes au microscope à fluorescence à 40x, 20x et 10x.
REMARQUE: La longueur d’onde d’excitation UV DAPI est de 330-380 nm et la longueur d’onde d’émission est de 420 nm (lumière bleue). La longueur d’onde d’excitation FITC est de 465-495 nm et la longueur d’onde d’émission est de 515-555 nm (lumière verte).
7. Analyse statistique
- Collectez et analysez les données à l’aide de SPSS.
- Déclarez les données sous forme de moyenne ± d’écart-type.
- Utilisez un test t d’échantillons indépendant pour analyser les différences entre les groupes diabétique et normal.
- Définissez la signification statistique à **p < 0,01 et *p < 0,05.
Résultats
Au total, 10 rats SD ont reçu une seule injection intrapéritonéale de STZ pour induire le modèle DT1. Un rat est mort prématurément (10%), mais le diabète a été induit chez tous les rats (100%). Après 3 jours d’injection de STZ, la glycémie de tous les rats était supérieure à 16,7 mmol/L, et la glycémie s’est stabilisée 5 semaines après l’induction (figure 3A). Le poids du groupe diabétique a augmenté progressivement après l’injection de STZ, mais a diminué au cours de la semaine 3, puis a augmenté lentement à partir de la semaine 4 (Figure 3B). En revanche, le poids des rats du groupe normal augmentait régulièrement et leur poids moyen 3 jours après l’induction du diabète était supérieur à celui du groupe diabétique (Figure 3B). Les rats diabétiques présentaient tous des symptômes typiques de soif, de polyurie et de perte de poids, similaires aux résultats de Hao et al.17.
Au jour 7 et au jour 14 après la blessure, l’analyse macroscopique a révélé que la réépithélialisation était plus prononcée chez les rats du groupe normal que dans le groupe diabétique (Figure 4A). Les résultats quantitatifs ont révélé que le taux de cicatrisation des plaies était significativement plus faible dans le groupe diabétique que dans le groupe normal aux jours 7 et 14 (p < 0,01). Cependant, au jour 14, les taux de cicatrisation des plaies pourraient également être supérieurs à 90% dans le groupe diabétique (p < 0,05, Figure 4B). Cela suggère que le modèle de plaie DT1 est caractérisé par une mauvaise fermeture, mais pas dans la mesure de la non-guérison chronique observée dans les plaies diabétiques humaines.
La coloration H & E au jour 14 de la cicatrisation de la plaie a révélé un épiderme incomplet de la plaie, une prolifération lente des kératinocytes et une réépithélialisation retardée dans le groupe diabétique par rapport au groupe normal. Les plaies diabétiques ont montré une perte partielle des follicules pileux et des glandes sébacées. Il y avait également moins de capillaires visibles (Figure 5).
Le diabète provoque un dysfonctionnement des cellules endothéliales, une glycosylation des protéines de la matrice extracellulaire et une dénervation vasculaire18. Ces complications entraînent une angiogenèse des plaies diabétiquesinférieure à la normale 18. L’angiogenèse est nécessaire à la cicatrisation des plaies, et l’angiogenèse des plaies est fréquemment analysée par immunomarquage CD31 (Figure 6A)19,20. Sur la base de la densité optique moyenne (AOD) de l’expression de CD31, l’angiogenèse au site de la plaie était significativement plus élevée dans le groupe normal que dans le groupe diabétique (p < 0,01, figure 6B).
Figure 1 : Image de rats immobilisés par des fixateurs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
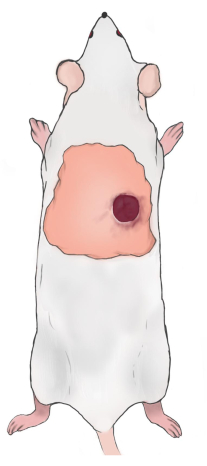
Figure 2 : Schéma de l’emplacement de la blessure du rat. Veuillez cliquer ici pour voir une version agrandie de cette figure.
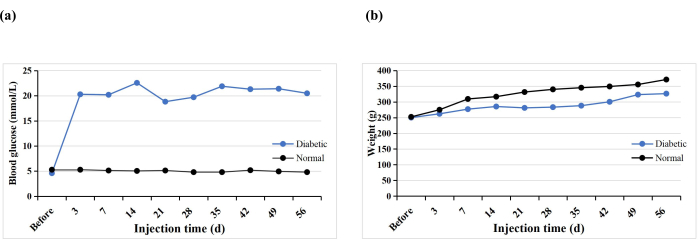
Figure 3 : Glycémie et poids des rats expérimentaux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
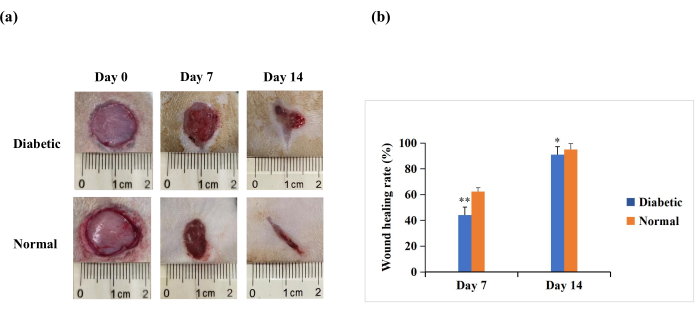
Figure 4 : Plaies cutanées de pleine épaisseur (20 mm de diamètre) sur le dos des rats expérimentaux. (A) L’aspect macroscopique des plaies au jour 0, au jour 7 et au jour 14. Les images de morphologie de la plaie au jour 0, au jour 7 et au jour 14 ont été capturées avec un appareil photo numérique. (B) La surface de la plaie a été mesurée à l’aide du logiciel ImageJ et a été utilisée pour calculer le taux de cicatrisation. Le taux de cicatrisation (%) a été calculé comme suit : (surface initiale de la plaie − zone de la plaie au point temporel indiqué)/surface initiale de la plaie × 100. Les valeurs sont présentées sous forme de moyenne ± ET (n = 14). La signification statistique a été fixée à ** p < 0,01 et * p < 0,05. Veuillez cliquer ici pour voir une version agrandie de cette figure.
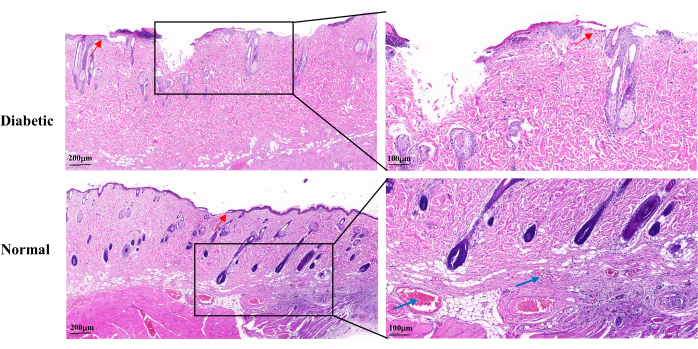
Figure 5 : Images histopathologiques représentatives de H&E au jour 14 après l’établissement de la plaie. Les flèches bleues indiquent les capillaires. Les flèches rouges montrent la prolifération des kératinocytes. Échelle de gauche: une barre = 200 μm; Échelle de droite : une barre = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
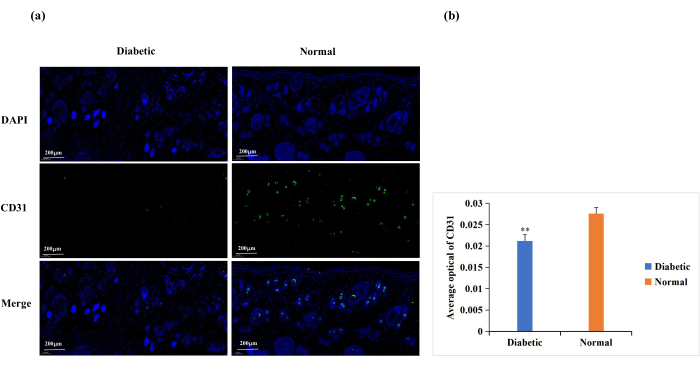
Figure 6 : Analyse de coloration par immunofluorescence pour l’expression de CD31. Les taux de CD31 ont été utilisés pour déterminer l’état de l’angiogenèse. (A) Images représentatives de la coloration par immunofluorescence CD31 dans les groupes diabétique et normal. La valeur de densité optique intégrée (IOD) et la surface de pixels (AREA) pour chaque échantillon de peau ont été calculées avec le logiciel Image-Pro Plus 6.0. La valeur de densité optique moyenne (AOD) (AOD = IOD/AREA) a également été dérivée. La valeur AOD était directement proportionnelle à l’expression positive de CD31. (B) Comparaison quantitative de l’expression positive de CD31 dans les groupes diabétique et normal. Les données sont présentées sous forme de moyenne ± ET. ** p < 0,01. Échelle : une barre = 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce protocole clarifie les opérations contestées dans la modélisation des plaies T1DM. Les préoccupations concernant les protocoles d’injection de STZ, les critères de succès de l’induction du DT1, le temps de stabilisation de la glycémie et l’emplacement et la taille de la plaie ont été abordées dans ce travail. De plus, les caractéristiques pathologiques et les paramètres mesurables pour l’évaluation de la cicatrisation des plaies par DT1 ont été clarifiés.
Les rats ont jeûné pendant 18 heures avant l’injection de STZ pour éviter la liaison compétitive du glucose ou de ses analogues aux cellules β, ce qui pourrait affecter l’efficacité de STZ. La méthode la plus couramment utilisée pour induire le DT1 est une dose unique élevée de STZ, qui augmente la glycémie en endommageant les îlots et en diminuant la sécrétion d’insuline21. Les essais préexpérimentaux ont révélé que la dose optimale de STZ pour un taux de réussite élevé et un faible taux de mortalité était de 55 mg / kg, ce qui est inférieur aux doses optimales rapportées dans les études précédentes22,23,24. Dans ce protocole, le DT1 a été induit en utilisant une seule injection intrapéritonéale de 55 mg/kg de STZ.
Les taux de glucose sanguin étaient tous supérieurs à 16,7 mmol / L 3 jours après l’injection de STZ. Cependant, une glycémie supérieure à 16,7 mmol/L le jour 7 après l’injection de STZ est le critère recommandé pour une modélisation réussie du DT1, car l’étendue des dommages causés aux îlots varie d’un rat à l’autre et une prolongation appropriée du temps de diagnostic peut réduire le taux de faux négatifs. De plus, les fluctuations de la glycémie se sont stabilisées 5 semaines après l’injection de STZ, et les rats ont progressivement pris du poids au cours de cette période, conformément aux résultats précédents25,26. Cela indique que le taux de glucose sanguin dans le modèle DT1 doit être stabilisé pendant au moins 6 semaines, et une augmentation du poids du rat après 6 semaines réduit les taux de mortalité pendant la modélisation de la plaie. Par conséquent, ce protocole a effectué la modélisation des plaies 8 semaines après l’injection STZ.
Le taux de fermeture de la plaie au jour 7 et au jour 14 après la blessure était significativement plus faible chez le diabétique que dans le groupe de plaies normales, indiquant une guérison lente. De plus, la réépithélialisation et l’angiogenèse des plaies étaient significativement plus faibles chez le diabétique que dans le groupe normal. Cela démontre que le modèle de plaie DT1 montre une cicatrisation plus lente et une réépithélialisation retardée que chez les rats normaux, ce qui peut être lié aux changements pathologiques de l’angiogenèse réduite de la plaie. Cependant, au jour 14, le taux de cicatrisation des plaies DT1 était également supérieur à 90%, ce qui est différent de la caractéristique chronique de non-cicatrisation des plaies diabétiques humaines. Cela pourrait être dû au fait que les mécanismes physiologiques des rongeurs pour la cicatrisation des plaies diffèrent de ceux des humains27. Par conséquent, le meilleur diamètre de plaie est d’au moins 20 mm, ce qui est suffisamment grand pour laisser le temps d’évaluer l’efficacité d’une intervention dans une étude sur les plaies diabétiques. L’emplacement de la plaie doit éviter l’omoplate et la colonne vertébrale, car un mouvement continu dans ces deux sites pourrait perturber la cicatrisation de la plaie.
En conclusion, la construction du modèle de plaie DT1 à l’aide de la méthode de ce protocole est efficace. Le protocole reproduit certaines des caractéristiques des plaies diabétiques chroniques, telles qu’une cicatrisation plus lente, une réépithélialisation retardée et une angiogenèse réduite par rapport aux plaies normales chez le rat. Cependant, on ne sait pas si le modèle peut reproduire d’autres phénotypes chroniques de plaies diabétiques. De plus, ce protocole décrit la méthode la plus fondamentale et la plus utilisée, qui ne tient pas compte de la question de la contraction de la peau chez le rat. Les recherches futures peuvent intégrer l’utilisation d’attelles de plaies dans ce protocole ou explorer d’autres modèles de plaies diabétiques chroniques, ce qui constituera un défi important pour les chercheurs à l’avenir.
Déclarations de divulgation
Tous les auteurs déclarent que ce manuscrit n’a pas de conflits d’intérêts.
Remerciements
Cette étude a été financée par la Fondation nationale des sciences naturelles de Chine (82104877).
matériels
| Name | Company | Catalog Number | Comments |
| Antifade mounting medium | Southern Biotechnology Associates, Inc. | 0100-01 | |
| AutoFluo Quencher | Servicebio Technology co., Ltd. | G1221 | |
| Automatic slide stainer | Thermo Fisher Scientific Inc. | Varistain™ Gemini ES | |
| CD31 | Servicebio Technology co., Ltd. | GB11063-2 | |
| Citrate antigen retrieval solution | Servicebio Technology co., Ltd. | G1201 | |
| Cover glass | Citotest Labware Manufacturing Co., Ltd. | 10212432C | |
| DAPI | Servicebio Technology co., Ltd. | G1012 | |
| Decolorization shaker | Scilogex | S1010E | |
| Depilatory cream | Guangzhou Ruixin Biotechnology Co., Ltd. | — | |
| Dimethyl benzene | Chengdu Kelong Chemical Co., Ltd. | 64-17-5 | |
| Drug oscillator | Shenzhen Jiashi Technology Co., Ltd. | VM-370 | |
| Electric razor | Shanghai Flyco Electrical Appliance Co., Ltd. | FC5908 | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd. | JB-P5 | |
| Ethanol absolute | Chengdu Kelong Chemical Co., Ltd. | 1330-20-7 | |
| Fitc-labeled goat anti-rabbit IgG | Servicebio Technology co., Ltd. | GB22303 | |
| Goat serum | Thermo Fisher Scientific Inc. | 16210064 | |
| Hematoxylin and eosin staining solution | Beijing Regan Biotechnology Co., Ltd. | DH0020 | |
| Image J software | National Institutes of Health | — | |
| Microwave oven | Midea Group Co., Ltd. | M1-L213B | |
| Mini centrifuge | Scilogex | D1008 | |
| Neutral balsam | Sinopharm Chemical Reagent Co., Ltd | 10004160 | |
| PBS buffer | Biosharp | G4202 | |
| Portable blood glucose meter | Sinocare Inc. | GA-3 | |
| Rapid tissue processor | Thermo Fisher Scientific Inc. | STP420 ES | |
| Rat fixator | Globalebio (Beijing) Technology co., Ltd | GEGD-Q10G1 | |
| Slicing machine | Thermo Fisher Scientific Inc. | HM325 | |
| Slides glass | Citotest Labware Manufacturing Co., Ltd. | 80312-3181 | |
| sodium citrate buffer | Beijing Solarbio Science & Technology Co., Ltd. | c1013 | |
| Streptozotocin | Sigma | 57654595 |
Références
- Zimmet, P., Alberti, K. G., Shaw, J. Global and societal implications of the diabetes epidemic. Nature. 414 (6865), 782-787 (2001).
- Grennan, D. Diabetic foot ulcers. Journal of the American Medical Association. 321 (1), 114 (2019).
- Eming, S. A., Martin, P., Tomic-Canic, M. Wound repair and regeneration: Mechanisms, signaling, and translation. Science Translational Medicine. 6 (265), 265sr6 (2014).
- Patel, S., Srivastava, S., Singh, M. R., Singh, D. Mechanistic insight into diabetic wounds: Pathogenesis, molecular targets and treatment strategies to pace wound healing. Biomedicine & Pharmacotherapy. 112, 108615 (2019).
- Deeds, M. C., et al. Single dose streptozotocin-induced diabetes: Considerations for study design in islet transplantation models. Laboratory Animals. 45 (3), 131-140 (2011).
- Chao, P. C., et al. Investigation of insulin resistance in the popularly used four rat models of type-2 diabetes. Biomedicine & Pharmacotherapy. 101, 155-161 (2018).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Current Protocols. 1 (4), e78 (2021).
- Wu, J., Yan, L. J. Streptozotocin-induced type 1 diabetes in rodents as a model for studying mitochondrial mechanisms of diabetic β cell glucotoxicity. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy. 8, 181-188 (2015).
- Yang, J., Chen, Z., Pan, D., Li, H., Shen, J. Umbilical cord-derived mesenchymal stem cell-derived exosomes combined pluronic F127 hydrogel promote chronic diabetic wound healing and complete skin regeneration. International Journal of Nanomedicine. 15, 5911-5926 (2020).
- Zhu, Y., Wang, Y., Jia, Y., Xu, J., Chai, Y. Roxadustat promotes angiogenesis through HIF-1α/VEGF/VEGFR2 signaling and accelerates cutaneous wound healing in diabetic rats. Wound Repair and Regeneration. 27 (4), 324-334 (2019).
- Shao, Z., et al. Wound microenvironment self-adaptive hydrogel with efficient angiogenesis for promoting diabetic wound healing. Bioactive Materials. 20, 561-573 (2022).
- Asfour, H. Z., et al. Enhanced healing efficacy of an optimized gabapentin-melittin nanoconjugate gel-loaded formulation in excised wounds of diabetic rats. Drug Delivery. 29 (1), 1892-1902 (2022).
- Wei, L., et al. Mesenchymal stem cells promote wound healing and effects on expression of matrix metalloproteinases-8 and 9 in the wound tissue of diabetic rats. Stem Cells and Development. 32 (1-2), 25-31 (2022).
- Pastar, I., et al. . Preclinical models for wound-healing studies. In Skin Tissue Models., edited by. , 223-253 (2018).
- Yang, R. H., et al. Epidermal stem cells (ESCs) accelerate diabetic wound healing via the Notch signalling pathway. Bioscience Reports. 36 (4), e00364 (2016).
- Suliman Maashi, M., Felemban, S. G., Almasmoum, H. A., Jarahian, M. Nicaraven-loaded electrospun wound dressings promote diabetic wound healing via proangiogenic and immunomodulatory functions: A preclinical investigation. Drug Delivery and Translational Research. 13 (1), 222-236 (2023).
- Hao, M., Ding, C., Sun, S., Peng, X., Liu, W. Chitosan/sodium alginate/velvet antler blood peptides hydrogel promotes diabetic wound healing via regulating angiogenesis, inflammatory response and skin flora. Journal of Inflammation Research. 15, 4921-4938 (2022).
- Kolluru, G. K., Bir, S. C., Kevil, C. G. Endothelial dysfunction and diabetes: Effects on angiogenesis, vascular remodeling, and wound healing. International Journal of Vascular Medicine. 2012, 918267 (2012).
- Okonkwo, U. A., DiPietro, L. A. Diabetes and wound angiogenesis. International Journal of Molecular Sciences. 18 (7), 1419 (2017).
- Yi, C., et al. Targeted inhibition of endothelial calpain delays wound healing by reducing inflammation and angiogenesis. Cell Death & Disease. 11 (7), 533 (2020).
- Goodson 3rd, W. H., Hung, T. K. Studies of wound healing in experimental diabetes mellitus. Journal of Surgical Research. 22 (3), 221-227 (1977).
- Luippold, G., Klein, T., Mark, M., Empagliflozin Grempler, R. a novel potent and selective SGLT-2 inhibitor, improves glycaemic control alone and in combination with insulin in streptozotocin-induced diabetic rats, a model of type 1 diabetes mellitus. Diabetes, Obesity & Metabolism. 14 (7), 601-607 (2012).
- Sayed, N., et al. Effect of dapagliflozin alone and in combination with insulin in a rat model of type 1 diabetes. The Journal of Veterinary Medical Science. 82 (4), 467-474 (2020).
- Han, Y., et al. Human umbilical cord mesenchymal stem cells implantation accelerates cutaneous wound healing in diabetic rats via the Wnt signaling pathway. European Journal of Medical Research. 24 (1), 10 (2019).
- Ansell, D. M., Marsh, C., Walker, L., Hardman, M. J., Holden, K. Evaluating STZ-induced impaired wound healing in rats. Journal of Investigative Dermatology. 138 (4), 994-997 (2018).
- Liu, Y., et al. Human umbilical cord-derived mesenchymal stem cells not only ameliorate blood glucose but also protect vascular endothelium from diabetic damage through a paracrine mechanism mediated by MAPK/ERK signaling. Stem Cell Research & Therapy. 13 (1), 258 (2022).
- Zindle, J. K., Wolinsky, E., Bogie, K. M. A review of animal models from 2015 to 2020 for preclinical chronic wounds relevant to human health. Journal of Tissue Viability. 30 (3), 291-300 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon