Method Article
1型糖尿病のラット創傷モデルを構築するためのプロトコル
要約
雄SDラットにおけるストレプトゾトシン誘発糖尿病創傷モデルは、現在、I型糖尿病における創傷治癒を研究するために最も広く使用されているモデルである。このプロトコルは、このモデルの構築に使用されるメソッドを記述します。また、潜在的な課題を提示して対処し、糖尿病性創傷の進行と血管新生の特徴を調べます。
要約
ラットの背側への単回高用量のストレプトゾトシン注射とそれに続く全層皮膚切除は、1型糖尿病創傷の動物モデルを構築するための一般的な方法です。ただし、不適切な操作は、ラットのモデルの不安定性と高い死亡率につながる可能性があります。残念ながら、1型糖尿病創傷モデリングに関する既存のガイドラインはほとんどなく、詳細が不足しており、特定の参照戦略を提示していません。したがって、このプロトコルは、1型糖尿病創傷モデルを構築するための完全な手順を詳述し、糖尿病創傷の進行および血管新生特性を分析する。1型糖尿病創傷モデリングには、ストレプトゾトシン注射の準備、1型糖尿病の誘発、および創傷モデルの構築が含まれます。創傷後7日目および14日目に創傷面積を測定し、ラットの皮膚組織を抽出して病理組織学的および免疫蛍光解析を行った。その結果、55mg/kgのストレプトゾトシンによる1型糖尿病は死亡率の低下と成功率の高さと関連していることが明らかになった。血糖値は誘導後5週間で比較的安定していた。糖尿病性創傷治癒率は、7日目および14日目の通常の創傷よりも有意に低かった(p < 0.05)が、どちらも14日目に90%以上に達することができた。正常群と比較して、14日目の糖尿病性創傷の表皮層閉鎖は不完全であり、再上皮化を遅らせ、血管新生が有意に低かった(p < 0.01)。このプロトコルに基づいて構築された1型糖尿病創傷モデルは、正常なラット創傷と比較して、閉鎖不良、再上皮化の遅延、血管新生の減少など、慢性創傷治癒の特徴を有する。
概要
1型糖尿病(T1DM)は、高血糖と膵臓β細胞の破壊を特徴とする慢性代謝性疾患です1。T1DM創傷は慢性的な非治癒性創傷であり、ヒトにおける糖尿病の最も一般的で壊滅的な合併症です2,3。動物モデルは、創傷治癒中の病理学的変化および潜在的な治療薬の安全性および有効性を研究するための最も適切なプロトタイプである4。他のタイプと比較して、オスのSprague-Dawley(SD)ラットはストレプトゾトシン(STZ)に対してより敏感であり、関連する死亡率が低いため、糖尿病性創傷研究で人気があります5,6。
T1DM創傷モデルを構築するための多数の方法が記載されている。T1DMモデルに関しては、研究は主に糖尿病誘発の成功率に対するSTZ注射法の効果に焦点を合わせてきました7,8。ただし、モデリングプロセスでは、この同じステップの動作に一貫性がありません。ある研究では、ラットはSTZ注射の前に18時間絶食しました。STZ注射の1週間後に血糖値が16.67 mmol / Lを超えるラットは糖尿病と見なされ、糖尿病性創傷は3週間後に導入されました9。逆に、関連する研究では、ZhuらSTZ注射の前にラットを12時間絶食させた。注射後72時間で血糖値が16.7 mmol / Lを超えるラットは糖尿病と見なされ、糖尿病性創傷は4週間後に導入されました10。全体として、STZ注射プロトコル、糖尿病診断基準、および創傷導入時間には矛盾があります。
創傷モデリングに関しては、ほとんどの研究では、糖尿病誘発が成功した後にT1DM創傷を構築するために背側皮膚の全層が切除される11、12、13。このモデルはラットの皮膚拘縮の影響を受けやすいが、労働集約的ではなく安価であるため、創傷治癒研究で最も一般的に使用されるモデルである14,15。それにもかかわらず、この全層切除技術に関する方法誘導研究は不足しています。さらに、創傷のサイズと位置に関する既存の研究には統一された基準はありません12,16。創傷の大きさおよび位置は、実験デザインの一貫性および結果の科学的妥当性に間接的に影響し得る。したがって、研究者の参考資料として、T1DM誘導および創傷モデリングのための標準プロトコルが緊急に必要とされている。この研究の目的は、T1DM創傷研究の参照として使用できるT1DM創傷モデリングのための特定のプロトコルを視覚化することです。
プロトコル
議定書はヘルシンキ宣言に続いて実施され、すべての動物実験は成都中医薬大学の管理委員会によって承認されました(記録番号2021-13)。
1.ストレプトゾトシン注射の準備
- 8週齢で体重220 g±20 gのSD雄性特異的病原体フリー(SPF)ラット15匹を選択します。単純なランダム化法を使用して、ラットを糖尿病群(n = 10)と正常群(n = 5)に分けます。
- ラットの初期体重を測定し、55 mg / kgの投与を通じてSTZの投与量を決定します。
注:事前実験に基づくと、55 mg / kgが最適なSTZ用量です。 - STZパウダーを正確に計量し、耐光容器に入れます。
- 適量の0.1mol/Lクエン酸ナトリウム緩衝液(pH 4.5)を添加し、STZを1%の濃度に溶解します。
注意: クエン酸ナトリウムバッファーは、使用前に4°Cの冷蔵庫で2時間予冷する必要があります。STZ溶液の調製は無菌性を保証しなければならない。 - 薬物発振器を使用して30秒間振とうします。アイスボックスに入れ、取っておきます。
注:注射は15分以内に使用する必要があります。
2. T1DMモデルの誘導
- STZ注射の前に、ラットを18時間絶食させ、水への自由なアクセスを許可します。
- 1%STZ溶液の腹腔内注射を行う。
- ラットをつかみ、腹部の皮膚と注射部位(2つの太ももの根元と腹部の正中線を結ぶ線の交点)を露出させます。
- 75%アルコールに浸した綿球を使用して注射部位を2回消毒します(時計回りに1回、反時計回りに1回)。ラットの頭を腹部の下に置きます。
- 腹部正中線に平行な針を45°の角度で挿入し、皮膚を突き刺した後、針の角度を30°に下げてから、針を2〜3mm挿入します。針栓をそっと引き、血液や液体がシリンジに吸い込まれないようにします。STZ溶液を注入し、針を引き出し、綿棒で出血を止めます。
注意: 黄色の液体が注射器に引き戻された場合、針が膀胱を貫通した可能性があり、濃い緑色の液体が引き出された場合、針は大腸または盲腸を貫通した可能性があります。いずれの場合も、針はすぐに取り外す必要があります。動物は獣医師によって評価されるべきです。
- STZ誘導後3日目と7日目の午前09:00にカジュアル(非絶食または空腹時)血糖値を測定します。
注:血糖値測定のランダム時間は固定されています。このプロトコルでは、午前9:00に固定されています。ただし、使用されるのはそれだけではありません。針穿刺によって尾静脈から採取された血液は、切断された尾から採取された血液よりも組織液の影響を受けにくいため、血糖値はより正確です。- ラット固定具を用いてラットを固定する(図1)。
- 尾静脈の位置を見つけます。75%アルコールに浸した綿球を使用してラットの尾を2回消毒します。
- 尾静脈を穿刺して出血を誘発し、グルコメーターを使用して血糖値を測定します。綿棒で出血を止めます。
注:STZ注射後7日目に16.7 mmol / Lを超える血糖値は、T1DMと見なされます。
- 毎週ラットの体重を測定し、血糖値と、食事、水分摂取量、尿量などの他のパラメーターを測定します。
- STZ誘導後8週間、通常どおり動物に給餌します。
3. 創傷モデルの構築
- 創傷モデリングの1日前に電気かみそりでラットを剃ります。ラットの背側の5 cm x 5 cmの剃毛領域が一般的に理想的です。
- 剃った部分を温かい生理食塩水コットンボールで拭き、乾かしてから、脱毛クリームを5分間塗ります。ガーゼでその部分をきれいにし、残っている脱毛クリームを温かい生理食塩水で洗います。
- ラットの体重を量り、35 mg / kgの基準に基づいてネンブタールの必要用量を計算します。.通常の生理食塩水を使用してネンブタールを3%の濃度に溶解します。ケタミン/キシラジンまたはイソフルランなどの他の全身麻酔薬をこの手順に使用できます。施設の動物管理および使用委員会と協力して、何が最善かを確認してください。
注:有効性を確実にするために、溶液は新たに調製し、ネンブタール粉末と溶液は光から保護する必要があります。 - 麻酔をかける前にラットを12時間絶食させます。麻酔を腹腔内に注入します。テトラサイクリン眼軟膏または一般的な眼潤滑剤を使用して、麻酔投与後の眼の乾燥を防ぎます。.
注:ラットの筋肉が比較的弛緩し、眼球運動が消え、呼吸が規則的で、痛みを伴う刺激に対する反応が小さい場合、麻酔は中程度と見なされました。 - ヨウ素(時計回りに1回、反時計回りに1回)と75%アルコール(代替ラウンド)に浸した綿球を使用して、背側の皮膚を2回消毒します。
- 乾燥後、直径20 mmの円形生検パンチで皮膚を切ります。
- 滅菌鉗子で皮膚をテント張りし、滅菌外科用ハサミを使用して、パンチカットマークに沿って全層の皮膚を取り除きます。通常の生理食塩水綿球で出血を止めます。
注:創傷の上縁は、肩甲骨下縁から5〜10 mm下、ラットの背骨の右/左に5〜10 mmである必要があります(図2)。2つの傷が構築されると、創傷は脊椎に沿って対称になります。 - ワセリンガーゼを使用して傷を覆い、ゴムテープで所定の位置に保持されたガーゼと通気性のある包帯でそれらを包みます。カルプロフェンを1日1回皮下注射(5mg/kg)し、術後の痛みを和らげます。創傷包帯を1日1回交換する(痛みを和らげるためのカルプロフェンの使用)。
注意: 包帯が完成した後、ラットの動きと呼吸に異常がないか観察し、通気性のある包帯が適切に締まっていることを確認してください。 - 傷の下に定規を置き、14日目までデジタルカメラで傷口を撮影します。施設の動物の世話と使用のガイドラインに従って、14日目にラットを安楽死させます。創傷皮膚組織を創傷端から5mm切断する。組織サンプルを2つの部分に分け、PBSで洗浄して目に見える血痕を取り除き、4%パラホルムアルデヒド溶液で固定します。
4. ImageJソフトウェアによる創傷面積の計算
- ソフトウェアを開いた後、[ ファイル ]ボタンをクリックし、ドロップダウンして[ 開く ]をクリックして傷の写真を開きます。
- ストレートツールを選択し、傷の写真の定規に沿って1cmの直線を引きます。
- [解析] メニューの [縮尺の設定] コマンドをクリックし、[既知の距離] を 1 に設定します。
- フリーハンド選択ツールを選択し、画像上の傷の輪郭をスケッチします。
- [分析]メニューの[測定]コマンドをクリックし、結果がポップアップした後に[面積]の値を読み取ります。
5. ヘマトキシリンおよびエオジン(H&E)染色
- 固定液から皮膚組織を取り除き、ヒュームフード内のメスで薄い部分に切断し、脱水カセットに入れます。
- 脱水カセットを脱水機に入れ、次の手順で組織を脱水します:75%アルコールで4時間;2時間85%アルコール。2時間90%アルコール。1時間95%アルコール。無水エタノールIおよびIIをそれぞれ30分間;アルコールベンゼンを5〜10分間。キシレンIおよびIIをそれぞれ5〜10分間。ワックスI、II、およびIIIをそれぞれ1時間。
- ティッシュをワックスに埋め込みます。凍結テーブルで-20°で冷却し、ワックスブロックをきれいに修正します。
- パラフィン切片作成機を使用してワックスブロックを縦方向に3μmの厚さの切片に切断します。
- 切片をキシレンIおよびIIにそれぞれ20分間、無水エタノールIおよびIIにそれぞれ5分間、水道水に5分間順次浸します。
- 組織をヘマトキシリン染色で3〜5分間浸水させ、0.5%塩酸水溶液を分化させ、0.5%アンモニア水溶液を青色に戻し、水ですすいでください。
- 組織切片を85%および95%アルコールで脱水します。組織にエオジン染色溶液を5分間浸します。
注:通常、エオジン染色には30秒から2分かかり、染色結果と要件に応じて時間を調整できます。 - 次の溶液で切片を順次脱水します:無水エタノールI、無水エタノールII、無水エタノールIII、キシレンI、およびキシレンIIをそれぞれ5分間。最後に、スライドガラスを中性バルサムで覆います。
- H&E染色された組織を顕微鏡で40倍、20倍、10倍で調べ、各スライドの代表的な画像を保持するために写真を撮ります。
6. CD31免疫蛍光染色
- 組織切片をキシレンIおよびIIにそれぞれ15分間、無水エタノールIおよびIIをそれぞれ5分間、85%アルコールで5分間、75%アルコールに5分間浸し、蒸留水ですすいでください。
- 抗原修復
- pH 6.0の適切な10 mMクエン酸緩衝液を電子レンジ容器に加え、強火で沸騰するまで加熱してから、スライドガラスをその中に置きます。
- 中火で8分間沸騰させ、8分間停止してから、中火から弱火で7分間再び沸騰させます。
- スライドを冷まし、PBS(pH 7.4)に入れ、脱色シェーカーを使用してそれぞれ5分間3回洗浄します。
- 5%ヤギ血清を円の中に滴下し、30分間インキュベートします。
- 閉鎖液(5%ヤギ血清)を静かに振り落とし、ウサギ抗CD31抗体(PBSを使用して1:200の比率で希釈)を切片に滴下します。切片を湿った箱に入れ、4°Cで一晩インキュベートします。
- スライドを脱色シェーカーでPBS(pH 7.4)でそれぞれ5分間3回洗浄します。切片を軽く振って乾かしてから、FITCラベルの付いたヤギ抗ウサギIgGの円形滴で覆います。暗所で室温で50分間インキュベートします。
- スライドを脱色シェーカーでPBS(pH 7.4)でそれぞれ5分間3回洗浄します。切片を軽く振とうしながら風乾し、DAPI染色液を加えます。切片を暗所で室温で10分間インキュベートする。
- 切片を乾燥させた後、ペッペンで組織の周りに円を描き(抗体の損失を防ぐため)、自家蛍光消光剤(0.3%スーダンブラックB)を円に5分間加え、その後流水で10分間すすぎます。
- スライドを脱色シェーカーでPBS(pH 7.4)でそれぞれ5分間3回洗浄します。セクションを少し振って、退色防止剤で密封します。
- 切片を蛍光顕微鏡で40倍、20倍、10倍で観察し、撮影します。
注:DAPIUV励起波長は330〜380nmで、発光波長は420nm(青色光)です。FITC励起波長は465〜495nm、発光波長は515〜555nm(緑色光)です。
7.統計分析
- SPSSを使用してデータを収集および分析します。
- データを標準偏差±平均値として報告します。
- 独立したサンプルのt検定を使用して、糖尿病群と正常群の差を分析します。
- 統計的有意性を **p < 0.01 および *p < 0.05 に設定します。
結果
合計10匹のSDラットが、T1DMモデルを誘導するために1回のSTZ腹腔内注射を受けました。1匹のラットが早期に死亡した(10%)が、すべてのラットで糖尿病が誘発された(100%)。STZ注射の3日後、すべてのラットの血糖値は16.7 mmol / Lを超え、血糖値は誘導後5週間で安定しました(図3A)。糖尿病群の体重はSTZ注射後に徐々に増加したが、3週目に減少し、その後4週目から再びゆっくりと増加した(図3B)。対照的に、正常群のラットの体重は着実に増加し、糖尿病誘発後3日目の平均体重は糖尿病群よりも高かった(図3B)。糖尿病ラットはすべて、Haoらの所見と同様に、喉の渇き、多尿、体重減少の典型的な症状を示しました17。
創傷後7日目および14日目に、肉眼的分析により、再上皮化は糖尿病群よりも正常群のラットでより顕著であることが明らかになりました(図4A)。定量的結果は、7日目と14日目に糖尿病群で正常群よりも創傷治癒率が有意に低いことを明らかにしました(p < 0.01)。しかし、14日目には、創傷治癒率は糖尿病群でも90%を超える可能性があります(p < 0.05、 図4B)。これは、T1DM創傷モデルが閉鎖不良を特徴とするが、ヒト糖尿病創傷に見られる慢性的な非治癒の程度ではないことを示唆している。
創傷治癒14日目のH&E染色では、糖尿病群では正常群と比較して、創傷表皮の不完全さ、ケラチノサイトの増殖の遅さ、再上皮化の遅延が認められた。糖尿病性創傷は毛包および皮脂腺の部分的な喪失を示した。また、目に見える毛細血管も少なかった(図5)。
糖尿病は、内皮細胞機能障害、細胞外マトリックスタンパク質のグリコシル化、および血管除神経を引き起こします18。これらの合併症は、糖尿病創傷における創傷血管新生を正常よりも低くする結果をもたらす18。血管新生は創傷治癒に必要であり、創傷血管新生はCD31免疫染色によって頻繁に分析されます(図6A)19,20。CD31発現の平均光学密度(AOD)に基づくと、創傷部位での血管新生は、糖尿病群よりも正常群で有意に高かった(p < 0.01、図6B)。
図1:固定具で固定されたラットの写真。 この図の拡大版を表示するには、ここをクリックしてください。
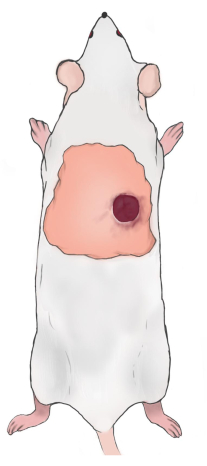
図2:ラットの創傷位置の図。 この図の拡大版を表示するには、ここをクリックしてください。
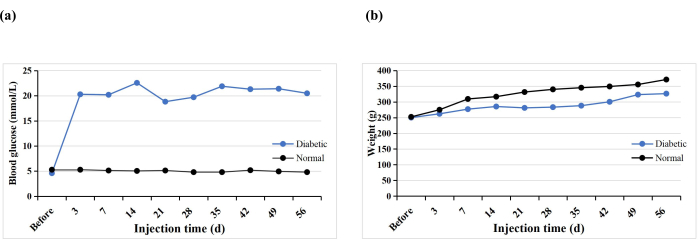
図3:実験ラットの血糖値と体重。 この図の拡大版を表示するには、ここをクリックしてください。
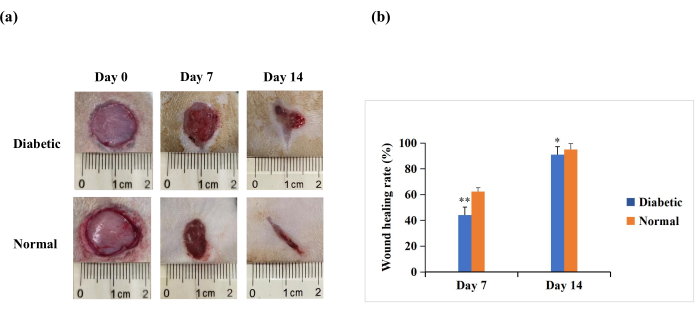
図4:実験ラットの背中の全身皮膚創傷(直径20mm)。 (A)0日目、7日目、および14日目の創傷の肉眼的外観。0日目、7日目、および14日目の創傷形態画像をデジタルカメラで撮影した。(B)創傷面積をImageJソフトウェアを用いて測定し、創傷治癒率の算出に用いた。創傷治癒率(%)は、(初期創傷面積−指示時点における創傷面積)/初期創傷面積×100として算出した。値は、SD ±平均値として表されます (n = 14)。統計的有意性は** p < 0.01および* p < 0.05に設定した。 この図の拡大版を表示するには、ここをクリックしてください。
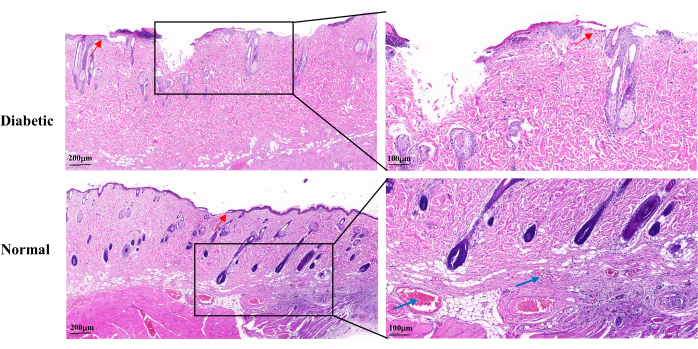
図5:創傷確立後14日目の代表的な病理組織学的H&E画像。 青い矢印は毛細血管を示します。赤い矢印はケラチノサイトの増殖を示す。左スケール:1バー= 200μm;右スケール:1バー= 100μm。 この図の拡大版を表示するには、ここをクリックしてください。
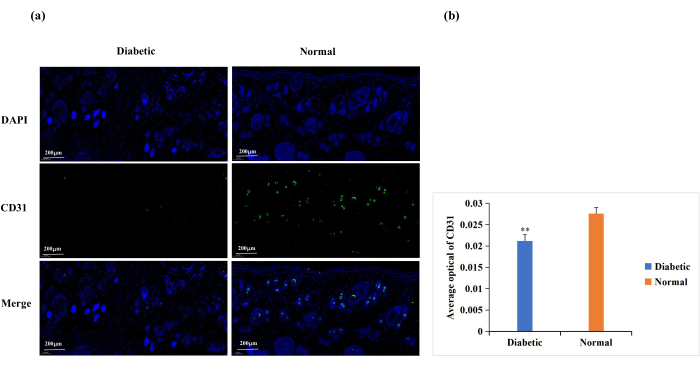
図6:CD31の発現に関する免疫蛍光染色分析。 CD31レベルは、血管新生の状態を決定するために使用されました。(a)糖尿病群および正常群におけるCD31免疫蛍光染色の代表的な画像。各皮膚サンプルの積算光学濃度(IOD)値とピクセル面積(AREA)は、Image-Pro Plus 6.0ソフトウェアで計算されました。平均光学密度(AOD)値(AOD = IOD/面積)も導出されました。AOD値はCD31の陽性発現に正比例した。(B)糖尿病群と正常群におけるCD31陽性発現の定量的比較。データはSD±平均値として表されます。 ** p < 0.01。スケール:1バー= 200μm。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、T1DM創傷モデリングにおける係争中の操作を明確にする。STZ注射プロトコル、T1DM誘導の成功基準、血糖安定化時間、および創傷の位置とサイズに関する懸念は、この作業で対処されています。さらに、T1DM創傷治癒評価のための病理学的特徴と測定可能なパラメータが明らかにされた。
ラットは、STZの有効性に影響を与える可能性のあるグルコースまたはその類似体のβ細胞への競合結合を回避するために、STZ注射の前に18時間絶食しました。T1DMを誘導するために最も一般的に使用される方法は、膵島を損傷し、インスリン分泌を減少させることによって血糖値を上昇させるSTZの単回高用量である21。実験前の試験では、高い成功率と低い死亡率のための最適なSTZ用量は55 mg / kgであり、以前の研究で報告された最適用量よりも低いことが明らかになりました22,23,24。このプロトコルでは、T1DMは55 mg / kgのSTZの腹腔内注射を使用して誘導されました。
血糖値はSTZ注射後3日目に16.7 mmol / Lを超えていた。ただし、STZ注射後7日目の血糖値が16.7 mmol / Lを超えることは、膵島損傷の程度がラットによって異なり、診断時間を適切に延長することで偽陰性率を低下させる可能性があるため、T1DMモデリングを成功させるための推奨基準です。さらに、血糖値の変動はSTZ注射の5週間後に安定し、ラットはこの期間中に徐々に体重が増加し、以前の所見と一致しました25,26。これは、T1DMモデルの血糖値が少なくとも6週間安定する必要があり、6週間後のラット体重の増加が創傷モデリング中の死亡率を低下させることを示しています。したがって、このプロトコルは、STZ注射の8週間後に創傷モデリングを実施しました。
創傷後7日目および14日目の創傷閉鎖率は、正常な創傷群よりも糖尿病患者で有意に低く、治癒が遅いことを示している。さらに、創傷再上皮化および血管新生は、正常群よりも糖尿病患者において有意に低かった。これは、T1DM創傷モデルが正常なラットよりも遅い創傷治癒および遅延再上皮化を示すことを示し、これは創傷血管新生の減少の病理学的変化に関連している可能性がある。しかし、14日目には、T1DM創傷治癒率も90%を超えており、これはヒト糖尿病創傷の慢性非治癒特性とは異なる。これは、げっ歯類の創傷治癒の生理学的メカニズムが人間のそれとは異なるためである可能性があります27。したがって、最良の創傷直径は少なくとも20mmであり、糖尿病創傷研究における介入の有効性を評価する時間を確保するのに十分な大きさである。創傷の位置は、肩甲骨と脊椎を避ける必要があります, これらの2つの部位の連続的な動きは創傷治癒を妨げる可能性があるため.
結論として、このプロトコールの方法を用いたT1DM創傷モデルの構築は有効である。このプロトコルは、正常なラット創傷と比較して、創傷治癒の遅延、再上皮化の遅延、血管新生の減少など、慢性糖尿病創傷の特徴のいくつかを再現します。しかし、このモデルが糖尿病性創傷の他の慢性表現型を再現できるかどうかは不明である。さらに、このプロトコルは、ラットにおける皮膚収縮の問題を考慮しない、最も基本的で広く使用されている方法を記載している。将来の研究では、創傷スプリントの使用をこのプロトコルに組み込むか、慢性糖尿病創傷の追加モデルを調査することができますが、これは将来の研究者にとって重要な課題となるでしょう。
開示事項
すべての著者は、この原稿には利益相反がないことを宣言します。
謝辞
この研究は、中国国家自然科学基金会(82104877)によって財政的に支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Antifade mounting medium | Southern Biotechnology Associates, Inc. | 0100-01 | |
| AutoFluo Quencher | Servicebio Technology co., Ltd. | G1221 | |
| Automatic slide stainer | Thermo Fisher Scientific Inc. | Varistain™ Gemini ES | |
| CD31 | Servicebio Technology co., Ltd. | GB11063-2 | |
| Citrate antigen retrieval solution | Servicebio Technology co., Ltd. | G1201 | |
| Cover glass | Citotest Labware Manufacturing Co., Ltd. | 10212432C | |
| DAPI | Servicebio Technology co., Ltd. | G1012 | |
| Decolorization shaker | Scilogex | S1010E | |
| Depilatory cream | Guangzhou Ruixin Biotechnology Co., Ltd. | — | |
| Dimethyl benzene | Chengdu Kelong Chemical Co., Ltd. | 64-17-5 | |
| Drug oscillator | Shenzhen Jiashi Technology Co., Ltd. | VM-370 | |
| Electric razor | Shanghai Flyco Electrical Appliance Co., Ltd. | FC5908 | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd. | JB-P5 | |
| Ethanol absolute | Chengdu Kelong Chemical Co., Ltd. | 1330-20-7 | |
| Fitc-labeled goat anti-rabbit IgG | Servicebio Technology co., Ltd. | GB22303 | |
| Goat serum | Thermo Fisher Scientific Inc. | 16210064 | |
| Hematoxylin and eosin staining solution | Beijing Regan Biotechnology Co., Ltd. | DH0020 | |
| Image J software | National Institutes of Health | — | |
| Microwave oven | Midea Group Co., Ltd. | M1-L213B | |
| Mini centrifuge | Scilogex | D1008 | |
| Neutral balsam | Sinopharm Chemical Reagent Co., Ltd | 10004160 | |
| PBS buffer | Biosharp | G4202 | |
| Portable blood glucose meter | Sinocare Inc. | GA-3 | |
| Rapid tissue processor | Thermo Fisher Scientific Inc. | STP420 ES | |
| Rat fixator | Globalebio (Beijing) Technology co., Ltd | GEGD-Q10G1 | |
| Slicing machine | Thermo Fisher Scientific Inc. | HM325 | |
| Slides glass | Citotest Labware Manufacturing Co., Ltd. | 80312-3181 | |
| sodium citrate buffer | Beijing Solarbio Science & Technology Co., Ltd. | c1013 | |
| Streptozotocin | Sigma | 57654595 |
参考文献
- Zimmet, P., Alberti, K. G., Shaw, J. Global and societal implications of the diabetes epidemic. Nature. 414 (6865), 782-787 (2001).
- Grennan, D. Diabetic foot ulcers. Journal of the American Medical Association. 321 (1), 114(2019).
- Eming, S. A., Martin, P., Tomic-Canic, M. Wound repair and regeneration: Mechanisms, signaling, and translation. Science Translational Medicine. 6 (265), 265sr6(2014).
- Patel, S., Srivastava, S., Singh, M. R., Singh, D. Mechanistic insight into diabetic wounds: Pathogenesis, molecular targets and treatment strategies to pace wound healing. Biomedicine & Pharmacotherapy. 112, 108615(2019).
- Deeds, M. C., et al. Single dose streptozotocin-induced diabetes: Considerations for study design in islet transplantation models. Laboratory Animals. 45 (3), 131-140 (2011).
- Chao, P. C., et al. Investigation of insulin resistance in the popularly used four rat models of type-2 diabetes. Biomedicine & Pharmacotherapy. 101, 155-161 (2018).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Current Protocols. 1 (4), e78(2021).
- Wu, J., Yan, L. J. Streptozotocin-induced type 1 diabetes in rodents as a model for studying mitochondrial mechanisms of diabetic β cell glucotoxicity. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy. 8, 181-188 (2015).
- Yang, J., Chen, Z., Pan, D., Li, H., Shen, J. Umbilical cord-derived mesenchymal stem cell-derived exosomes combined pluronic F127 hydrogel promote chronic diabetic wound healing and complete skin regeneration. International Journal of Nanomedicine. 15, 5911-5926 (2020).
- Zhu, Y., Wang, Y., Jia, Y., Xu, J., Chai, Y. Roxadustat promotes angiogenesis through HIF-1α/VEGF/VEGFR2 signaling and accelerates cutaneous wound healing in diabetic rats. Wound Repair and Regeneration. 27 (4), 324-334 (2019).
- Shao, Z., et al. Wound microenvironment self-adaptive hydrogel with efficient angiogenesis for promoting diabetic wound healing. Bioactive Materials. 20, 561-573 (2022).
- Asfour, H. Z., et al. Enhanced healing efficacy of an optimized gabapentin-melittin nanoconjugate gel-loaded formulation in excised wounds of diabetic rats. Drug Delivery. 29 (1), 1892-1902 (2022).
- Wei, L., et al. Mesenchymal stem cells promote wound healing and effects on expression of matrix metalloproteinases-8 and 9 in the wound tissue of diabetic rats. Stem Cells and Development. 32 (1-2), 25-31 (2022).
- Pastar, I., et al. Preclinical models for wound-healing studies. In Skin Tissue Models., edited by. , Academic Press. Cambridge, MA. 223-253 (2018).
- Yang, R. H., et al. Epidermal stem cells (ESCs) accelerate diabetic wound healing via the Notch signalling pathway. Bioscience Reports. 36 (4), e00364(2016).
- Suliman Maashi, M., Felemban, S. G., Almasmoum, H. A., Jarahian, M. Nicaraven-loaded electrospun wound dressings promote diabetic wound healing via proangiogenic and immunomodulatory functions: A preclinical investigation. Drug Delivery and Translational Research. 13 (1), 222-236 (2023).
- Hao, M., Ding, C., Sun, S., Peng, X., Liu, W. Chitosan/sodium alginate/velvet antler blood peptides hydrogel promotes diabetic wound healing via regulating angiogenesis, inflammatory response and skin flora. Journal of Inflammation Research. 15, 4921-4938 (2022).
- Kolluru, G. K., Bir, S. C., Kevil, C. G. Endothelial dysfunction and diabetes: Effects on angiogenesis, vascular remodeling, and wound healing. International Journal of Vascular Medicine. 2012, 918267(2012).
- Okonkwo, U. A., DiPietro, L. A. Diabetes and wound angiogenesis. International Journal of Molecular Sciences. 18 (7), 1419(2017).
- Yi, C., et al. Targeted inhibition of endothelial calpain delays wound healing by reducing inflammation and angiogenesis. Cell Death & Disease. 11 (7), 533(2020).
- Goodson 3rd, W. H., Hung, T. K. Studies of wound healing in experimental diabetes mellitus. Journal of Surgical Research. 22 (3), 221-227 (1977).
- Luippold, G., Klein, T., Mark, M., Empagliflozin Grempler, R. a novel potent and selective SGLT-2 inhibitor, improves glycaemic control alone and in combination with insulin in streptozotocin-induced diabetic rats, a model of type 1 diabetes mellitus. Diabetes, Obesity & Metabolism. 14 (7), 601-607 (2012).
- Sayed, N., et al. Effect of dapagliflozin alone and in combination with insulin in a rat model of type 1 diabetes. The Journal of Veterinary Medical Science. 82 (4), 467-474 (2020).
- Han, Y., et al. Human umbilical cord mesenchymal stem cells implantation accelerates cutaneous wound healing in diabetic rats via the Wnt signaling pathway. European Journal of Medical Research. 24 (1), 10(2019).
- Ansell, D. M., Marsh, C., Walker, L., Hardman, M. J., Holden, K. Evaluating STZ-induced impaired wound healing in rats. Journal of Investigative Dermatology. 138 (4), 994-997 (2018).
- Liu, Y., et al. Human umbilical cord-derived mesenchymal stem cells not only ameliorate blood glucose but also protect vascular endothelium from diabetic damage through a paracrine mechanism mediated by MAPK/ERK signaling. Stem Cell Research & Therapy. 13 (1), 258(2022).
- Zindle, J. K., Wolinsky, E., Bogie, K. M. A review of animal models from 2015 to 2020 for preclinical chronic wounds relevant to human health. Journal of Tissue Viability. 30 (3), 291-300 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved