Method Article
用于 X 射线晶体学的脂质双铈环境中的 ABCG5/G8 结晶
摘要
该协议描述了用于结晶甾醇转运蛋白ABCG5 / G8的设置。ABCG5/G8被复构成双细胞进行悬滴结晶。该协议不需要专门的材料或底物,因此可以在任何实验室中轻松使用,以通过X射线晶体学确定蛋白质结构。
摘要
ATP 结合盒 (ABC) 转运蛋白构成脂质包埋膜蛋白。通常通过使用去污剂将这些膜蛋白从脂质双层提取到水环境中。这些去污剂分解脂质双层并溶解蛋白质。脂质双层内膜蛋白的内在栖息地对保持其在溶液中的稳定性和均匀性以进行结构表征提出了挑战。由长链和短链磷脂和洗涤剂组成的双细胞复制了天然脂质结构。脂质双细胞和去污剂的利用可作为获得高质量衍射晶体的合适模型系统,特别是用于确定膜蛋白的高分辨率结构。通过这些合成微环境,膜蛋白保留了其天然构象和功能,促进了三维晶体的形成。在这种方法中,洗涤剂溶解的异二聚体ABCG5 / G8被重新整合到DMPC / CHAPSO双细胞中,并补充了胆固醇。该装置被用于蛋白质结晶的蒸汽扩散实验程序。
引言
ATP 结合盒 (ABC) 转运蛋白构成膜蛋白超家族,负责跨生物膜的不同 ATP 依赖性转运过程 1,2,3,4,5。这些转运蛋白与心血管疾病有关,在促进胆固醇流向胆汁以随后在肝脏中排泄方面发挥重要作用。因此,胆固醇代谢和平衡多年来引起了人们的极大兴趣6.从体内消除胆固醇和其他甾醇的特定机制涉及人类 ABCG 亚家族的成员,特别是异二聚体 ABCG5/G8 7,8,9,10。这些基因中的任何一个的突变都会破坏异二聚体,导致功能丧失并导致 sitosterodemia,这是一种影响甾醇运输的疾病11,12,13。鉴于该疾病的相关性及其在促进胆固醇外流中的作用,甾醇转运蛋白引起了人们的极大关注。然而,其分子机制和底物选择性的复杂细节在很大程度上仍未公开。因此,阐明ABCG5/G8的晶体结构是理解胆固醇转运机制和下游功能的关键一步。
膜蛋白需要锚定在膜内才能折叠并正常发挥作用。因此,从其自然环境中提取膜蛋白通常会导致蛋白质不稳定、错误折叠和功能丧失14,15。这些挑战凸显了膜蛋白结晶面临的主要障碍。然而,将蛋白质重建为合成洗涤剂双层(如双细胞)已成为解决这一困境的方法,使膜蛋白能够维持在类似天然的双层环境中16。双细胞是合成磷脂和洗涤剂的集合体,悬浮并溶于水。值得注意的是,它们采用模仿生物膜的双层结构16,17,18。双细胞可以根据温度和粘度在液相和凝胶相之间过渡。Bicelle 结晶利用小的双层圆盘和低粘度在降低温度下,促进蛋白质和 bicelle 溶液的彻底混合。双细胞的大小取决于制备过程中的洗涤剂与脂质的比率19,20。用于形成二烯酰胺的常用洗涤剂包括 3-[(3-胆酰胺丙基)二甲基氨基]-2-羟基-1-丙磺酸酯 (CHAPSO),以及 3-[(3-胆酰胺丙基)二甲基氨基]-1-丙烷磺酸酯 (CHAPS) 和 1,2-二十三烷酰基-sn-甘油-3-磷酸胆碱 (DHPC)21。这些洗涤剂与脂质结合使用,例如二肉豆蔻酰磷脂酰胆碱 (DMPC) 和 1-棕榈酰基-2-油酰基磷脂酰胆碱 (POPC)。此外,最近的研究已经证明了在生理条件下双细胞内膜蛋白的全部功能。例如,Lee及其同事成功结晶并报道了基于脂质双层22,23的ABCG5 / ABCG8的晶体结构。在结晶过程中,可以使用标准设备(包括高通量结晶机器人24)来容纳蛋白质-双歧杆菌混合物。然而,利用双细胞的可行性取决于蛋白质的热稳定性,因为蛋白质在较高温度下的结晶条件。然而,与其他技术相比,膜蛋白的必要结晶条件通常保持温和,涉及低浓度的沉淀剂、盐和缓冲液。这使得蛋白质-双歧管混合物和蒸汽扩散成为膜蛋白结构研究的有效且易于实施的工具。
该协议概述了蛋白质制备和双晶体结晶的基本步骤,以高分辨率确定ABCG5 / G8的X射线晶体结构(图1)。
研究方案
1. 克隆和蛋白表达
- 按照先前的方案将人ABCG5 / G8基因克隆到毕赤酵母中25,26。简而言之,从 pPICZB 衍生 pSGP18 和 pLIC 表达载体。添加编码鼻病毒 3C 蛋白酶位点的标签,然后添加钙调蛋白结合肽 (CBP) 到 ABCG8 cDNA (pSGP18-G8-3C-CBP) 的 C 末端。
- 在ABCG5 cDNA的C端(pLIC-G5-H12)中加入一个由甘氨酸(His 6 GlyHis6)分离的六组氨酸标签。使用电穿孔将质粒共转化成毕赤酵母菌株KM71H。
注:有关所用质粒、培养基和缓冲液的详细信息,请参阅 材料表 。 - 在28°C的MD琼脂平板上培养转化的酵母细胞。
- 在ABCG5 cDNA的C端(pLIC-G5-H12)中加入一个由甘氨酸(His 6 GlyHis6)分离的六组氨酸标签。使用电穿孔将质粒共转化成毕赤酵母菌株KM71H。
- 1-2 天后,选择 10-12 个菌落,并使用 50 mL 离心管将它们接种到 10 mL 最小甘油酵母氮碱 (MGY) 培养基中进行小规模培养。
- 在离心管盖上打三个小孔,以便更好地曝气。让细胞在28°C下生长,以250rpm不断摇动,直到600nm处的光密度(OD 600)达到10,通常需要1-2过夜。
注意:细胞生长通常需要 12-24 小时。
- 在离心管盖上打三个小孔,以便更好地曝气。让细胞在28°C下生长,以250rpm不断摇动,直到600nm处的光密度(OD 600)达到10,通常需要1-2过夜。
- 第二天,取 1 L 无菌 MGY 培养基,并在 2.4 L 烧瓶中接种原代培养物。将烧瓶在28°C下以250rpm的振荡培养箱孵育24小时。
- 为了将 pH 值保持在 5-6 之间,加入 10% 氢氧化铵 (NH4OH) 直到 pH 值稳定。
- 调节pH值,每1L培养物(0.1%(v/v)甲醇)中加入1mL纯甲醇,诱导蛋白表达。
注:随后每 12 小时用 5 mL 纯甲醇每升培养物(0.5% (v/v) 甲醇)补料细胞,总持续时间为 36-48 小时。 - 通过在4°C下以15,000× g 离心30分钟来收获细胞。
- 收集细胞沉淀并将其重悬于裂解缓冲液(0.33M蔗糖,0.3M Tris-Cl pH 7.5,0.1M氨基己酸,1mM EDTA和1mM EGTA)中,浓度为0.5g / mL。将悬浮液储存在-80°C。 通常,可以从 1 L 培养的细胞中回收 30 ± 5 g 的细胞质量。
注意:将细胞沉淀直接储存在冰箱中或立即在裂解缓冲液中进行重悬,用于膜制备。
2.微粒体膜的制备
- 解冻细胞并加入蛋白酶抑制剂(2μg/ mL亮肽素,2μg/ mL胃蛋白酶抑制素A,2mM PMSF,参见 材料表)。
- 为了进一步裂解细胞,在25,000-30,000 psi下使用冰冷乳化剂或微流化器(参见 材料表)。重复此过程 3-4 次。
- 离心除去细胞碎片:以3,500-4,000×g旋转15分钟,然后以15,000×g再次旋转30分钟。将两个旋转保持在4°C。
- 为了分离微粒体膜囊泡,将上清液转移到超速离心管中,并在4°C下以2,00,000× g 超速离心1.5小时。
- 使用dounce均质器将膜沉淀重悬于50mL缓冲液A(50mM Tris-Cl pH 8.0,100mM NaCl和10%甘油)中。将悬浮液储存在-80°C。
3. 蛋白质制备-异二聚体的纯化
- 解冻冷冻的微粒体膜,并使用增溶缓冲液将浓度调节至4-6mg / mL。缓冲液应含有 50 mM Tris-HCl、pH 8.0、100 mM NaCl、10% 甘油、1% (w/v) β-十二烷基麦芽糖苷 (β-DDM)、0.5% (w/v) 胆酸盐、0.1% (w/v) 胆固醇半琥珀酸酯 (CHS)、5 mM 咪唑、5 mM β-巯基乙醇 (β-ME)、2 μg/mL 亮肽素、2 μg/mL 胃蛋白酶抑制剂 A 和 2 mM PMSF(参见 材料表)。
注:可以混合等体积的膜制剂和增溶缓冲液,或使用不含蛋白酶抑制剂和还原剂的 2x 增溶缓冲液。缓冲液的短暂沸腾有助于有效溶解CHS。纯化时,仅使用4°C冷却的缓冲液。- 在4°C下以中速搅拌混合物1小时。 随后在室温 (RT) 下额外搅拌 20-30 分钟。
- 将混合物在4°C下以1,00,000× g 离心30分钟以除去不溶性膜。收集溶解的上清液并加入20mM咪唑和0.1mM TCEP。
- 进行亲和柱层析26:将溶解的上清液与缓冲液A(步骤2.2.1)中的预平衡Ni-NTA珠(10-15mL)(参见 材料表)结合过夜。
注意:从现在开始,避免在运行缓冲液中使用甘油。- 用含有25mM咪唑的10柱体积的缓冲液B(50 mM HEPES,pH 7.5,100 mM NaCl,0.1%(w/v)β-DDM,0.05%(w/v)胆酸盐,0.01%(w/v)CHS,0.1 mM TCEP)洗涤色谱柱两次。
- 用含有 50 mM 咪唑的 10 柱体积的缓冲液 B 洗涤色谱柱。
- 使用缓冲液 C(含 200 mM 咪唑的缓冲液 B)洗脱蛋白质。
- 向洗脱的蛋白质中加入 1 mM TCEP(参见 材料表)和 10 mM MgCl2 。
- 在SDS-PAGE凝胶上验证洗脱的馏分,以确认正确的蛋白质大小26。
注:典型蛋白质产量(1st Ni-NTA):每 6 L 培养物 10-20 mg 蛋白质。以 DDM 临界胶束浓度 (CMC) 的 10 倍或 5 倍(约 0.01%)使用 DDM。该协议采用 0.1% DDM。 - 用等体积的缓冲液D1(含1mM CaCl 2,1mM MgCl2的缓冲液B)稀释Ni-NTA洗脱的峰馏分,混合,并将蛋白质馏分上样到CBP柱(3-5mL)(参见材料表)上,该CBP柱已用CBP洗涤缓冲液D1预平衡。
- 使用缓冲液 D1 和 D2(缓冲液 B 含 1 mM CaCl 2、1 mM MgCl2、0.1% (w/v) 癸基-麦芽糖新戊二醇 (DMNG),不含 β-DDM)在 CBP 色谱柱上进行顺序洗涤以交换去污剂:首先,用 3 柱体积的 D1 洗涤;其次,用 3 柱体积的 D1:D2 (3:1, v/v) 洗涤;第三,用 3 柱体积的 D1:D2(1:1,v/v)洗涤;第四步,用 3 柱体积的 D1:D2 (1:3, v/v) 洗涤,然后用 6-10 柱体积的 D2 洗涤。
- 使用含有 300 mM NaCl 的 CBP 洗涤缓冲液 D2 从 CBP 柱(总 10 mL)中洗脱蛋白质,分 1 mL 分。将洗脱的馏分浓缩至 1-2 mL。
注意:典型的蛋白质产量 (1st CBP) 为每 6 L 培养物 5-15 mg 蛋白质。麦芽糖新戊二醇(MNG)洗涤剂可增强纯化蛋白质在4°C下的储存。 同时使用DMNG和月桂基MNG(LMNG),DMNG产生更好的X射线衍射晶体。以临界胶束浓度 (CMC) 的 10-20 倍(约 0.003%)使用 DMNG。该协议使用0.1%DMNG。CBP洗脱液的一部分可以通过凝胶过滤色谱法(步骤4.4)进一步纯化,以分析蛋白质的ATP酶活性或通过透射电子显微镜(TEM)评估单分散性。
4. 蛋白质制备-预结晶处理
- 分别使用内切糖苷酶H(Endo H,每10-15mg纯化蛋白~0.2mg)和HRV-3C蛋白酶(每10-15mg纯化蛋白~2mg)切割N-连接聚糖和CBP标签(参见 材料表)。在4°C孵育过夜。
- 在Endo H和3C蛋白酶孵育期间,对混合的蛋白质进行还原烷基化。首先与20mM碘乙酰胺(参见 材料表)在4°C下孵育过夜。 随后在冰上用另外的2mM碘乙酰胺孵育1小时。
注意:此步骤进一步将蛋白质储存在4°C下稳定长达一个月。 - 使用第二根 CBP 柱 (1-2 mL) 分离裂解的 CBP 标签。将缓冲区 D2 用于此过程。
注意:典型的蛋白质产量 (2nd CBP) 为每 6 L 培养物 5-10 mg 蛋白质。 - 使用凝胶过滤色谱法纯化无 CBP 标签蛋白。缓冲液应含有 10 mM HEPES(pH 值 7.5)、100 mM NaCl、0.1% (w/v) DMNG、0.05% (w/v) 胆酸盐和 0.01% (w/v) CHS。
注:典型的蛋白质产量(凝胶过滤)为每 6 L 培养物 2-8 mg 蛋白质。在此步骤中,凝胶过滤过程中没有DDM峰(~65 kD)表明洗涤剂与DMNG的交换成功。 - 通过还原甲基化修饰合并的蛋白质组分:向蛋白质中加入 20 mM 二甲胺硼烷(DMAB,参见 材料表)和 40 mM 甲醛。在振荡振荡器上在4°C孵育2小时。加入 10 mM DMAB。
- 重复步骤4.5,包括加入10mM DMAB,并在4°C下孵育过夜(12-18小时)。
- 加入 100 mM Tris-Cl,pH 7.5 停止反应。
- 将甲基化蛋白加载到用 100 mM Tris-Cl、pH 8.0 和 100 mM NaCl 预平衡的 2 mL Ni-NTA 柱上。
- 使用10柱体积的洗涤缓冲液(10mM HEPES,pH 7.5,100mM NaCl,含0.5mg / mL DOPC:DOPE(3:1,w/w),0.1%(w/v)DMNG,0.05%(w/v)胆酸盐,0.01%(w/v)CHS)洗涤色谱柱。
- 使用洗脱缓冲液(10 mM HEPES,pH 7.5,100 mM NaCl,200 mM 咪唑,0.5 mg / mL DOPC:DOPE(1:1,w/w),0.1%(w / v)DMNG,0.05%(w / v)胆酸盐,0.01%(w / v)CHS)洗脱重新解析的蛋白质。
注:典型的蛋白质产量(2nd Ni-NTA)为每6 L培养物1-5 mg蛋白质。 - 将蛋白质洗脱液通过PD-10脱盐柱,该脱盐柱与步骤4.4中使用的缓冲液预先平衡。
- 将脱盐和重新定盐的蛋白质与胆固醇(在异丙醇或乙醇中制备)孵育过夜至终浓度~20μM。
- 第二天早上,通过在4°C下以1,50,000× g 超速离心10分钟除去沉淀剂。 收集上清液。
- 使用 100 kDa 截止离心浓缩器将蛋白质浓缩至 30-50 mg/mL 的终浓度。
- 使用台式冷冻离心机在4°C下以最高速度除去沉淀物30分钟。
- 将上清液保持在4°C的冰上,并在双细胞中建立结晶条件。
注意:浓缩的蛋白质应在一周内用于晶体生长。不要冷冻蛋白质。
5. 双细胞中的蛋白质结晶
- 用DMPC脂质和CHAPSO去污剂以3:1(w / w)的比例制备10%bicelle储备溶液(参见 材料表)。
注意:在临界胶束浓度 (CMC) 的 5 倍下使用 CHAPSO,约为 0.5%。这保持了蛋白质-双歧杆菌混合物中其CMC周围的洗涤剂浓度(步骤5.2)。- 将去离子H2O溶解洗涤剂(CHAPSO)加入预干燥的脂质(5mol%胆固醇和95mol%DMPC的混合物)中。
注意:在氯仿中制备各种脂质组合物,并在室温下使用氮气流在玻璃试管中干燥。 通过将它们置于真空室中过夜来消除残留溶剂,形成薄的脂质层。 - 使用水浴超声仪重悬脂质和洗涤剂。
- 使用连续电源在冰冷的水中超声处理 bicelle 混合物,直到溶液变得透明。
注意: 使用听力保护装置并确保有足够的冰供应以将混合物保持在液相中。 - 用0.2μm离心过滤器除去未溶解的成分(参见 材料表)。
注意:将等分的bicelle溶液储存在-80°C。
- 将去离子H2O溶解洗涤剂(CHAPSO)加入预干燥的脂质(5mol%胆固醇和95mol%DMPC的混合物)中。
- 通过以 1:4 (v/v) 的比例轻轻混合 10% 双细胞(步骤 5.1.4)和蛋白质(步骤 4.7.4),在冰上形成蛋白质/双细胞混合物,使最终蛋白质浓度在 5-10 mg/mL 之间。
- 将蛋白质和双歧杆菌混合物在冰上孵育30分钟。
- 使用 48 孔板以悬挂液滴蒸气扩散形式设置结晶条件。
- 混合等体积(0.5或1μL)的蛋白质/双歧管混合物和含有1.6M-2.0M硫酸铵,100mM MES(pH 6.5),0%-4%PEG 400和1mM TCEP的结晶储液(参见 材料表)。
注意:在每次实验之前创建储层溶液的基质,调整硫酸铵(1.6-2.0 M)和PEG 400(0%-4%)。 - 在20°C孵育结晶。
- 第二天检查结晶托盘,以确保盖玻片密封正确。
- 每天至少监测一次晶体生长。高质量的晶体通常在 1-2 周内出现,尺寸为 50-150 μm x 20-50 μm x 2-5 μm。
注意:在较低的蛋白质浓度下,晶体可能需要更长的时间才能形成。成熟的晶体应在一个月内收获。 - 将蛋白质晶体浸泡在0.2M丙二酸钠中,并使用50或100μm冷冻环在液氮中快速冷冻。
注意: 如果有 X 射线衍射仪,请用 15-30 分钟的 X 射线束曝光测试一些晶体,以揭示高达 5 Å 的衍射。更高分辨率的衍射需要同步辐射光源。使用 0.2 M 丙二酸钠作为冷冻保护剂,尺寸为 100 μm x 50 μm x 2 μm 的晶体可以通过同步加速器 X 射线提供大约 90 个衍射图像帧。
- 混合等体积(0.5或1μL)的蛋白质/双歧管混合物和含有1.6M-2.0M硫酸铵,100mM MES(pH 6.5),0%-4%PEG 400和1mM TCEP的结晶储液(参见 材料表)。
结果
重组 ABC 半转运蛋白、人 ABCG5 和 ABCG8 在 毕赤 酵母中共表达。然后通过离心分离酵母膜部分。如本方案所述,使用串联柱层析提取异二聚体蛋白。随后,通过将化学预处理的蛋白质与磷脂/胆固醇双细胞孵育而结晶。纯化和结晶过程的示意图如 图1所示。
为了评估纯化蛋白质的单分散性,将含有0.01-0.05mg / mL蛋白质的样品用1%-2%醋酸铀酰染色。然后使用负染色TEM检查这些样品(图2A)。为了在不进行冻融循环的情况下评估蛋白质的稳定性,采用了分析凝胶过滤色谱法。该分析涉及通过使用小的、等体积的蛋白质等分试样来监测纯化蛋白质的时程储存(图2B)。在4°C下孵育一周后,峰值组分的蛋白质可能会有轻微的损失,这可能是由于残留的可溶性蛋白质聚集体。尽管如此,整体蛋白质产量仍然足以进行晶体生长。使用负染色 TEM 和分析凝胶过滤色谱法是评估蛋白质结晶适用性的标准做法,尤其是来自不同工程结构的蛋白质。
为了评估柱层析过程每个步骤以及预结晶化学处理后的蛋白质质量,将对应于两个Ni-NTA柱、两个CBP柱、一个凝胶过滤和还原烷基化馏分的等分试样加载到10%SDS-PAGE凝胶上(图3)。此外,用于烷基化反应的相同反应环境可用于乙基汞(EMTS)的汞标记,尽管这超出了当前研究的范围。
每天使用配备偏光片的台式体视显微镜监测晶体的生长。成熟且适合数据收集的晶体通常达到 50 μm x 100 μm x 2 μm 的尺寸(图 4)。在晶体收获过程中,有意避免较小的晶体或团簇。
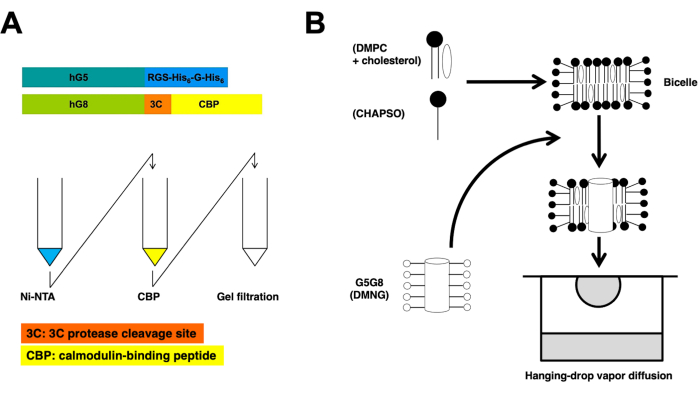
图 1:异二聚体 ABCG5/G8 的纯化 (A) 和双歧晶体结晶 (B) 的示意图。 重组人 ABCG5 (hG5) 和 ABCG8 (hG8) 的构建体分别携带 RGS-H 6-G-H6 和 3C-CBP 标签(A,顶部)。串联亲和柱层析,然后进行凝胶过滤层析,实现异二聚体纯化(A,底部)。请点击这里查看此图的较大版本.
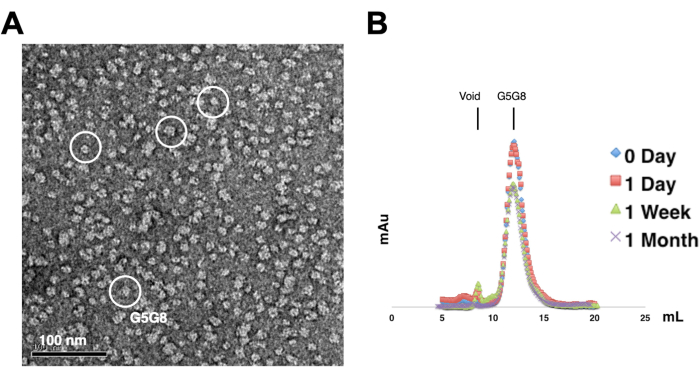
图 2:纯化蛋白质的单分散性 (A) 和稳定性 (B) 的评估 。 (A) 使用 TEM 对阴性染色的 ABCG5/G8 (G5G8) 异二聚体进行电子显微照片。代表性粒子以白色实心圆圈突出显示。比例尺 = 100 nm。(B)在4°C下储存的烷基化蛋白质,通过分析凝胶过滤色谱法分析一个月,一周后蛋白质略有损失。 请点击这里查看此图的较大版本.
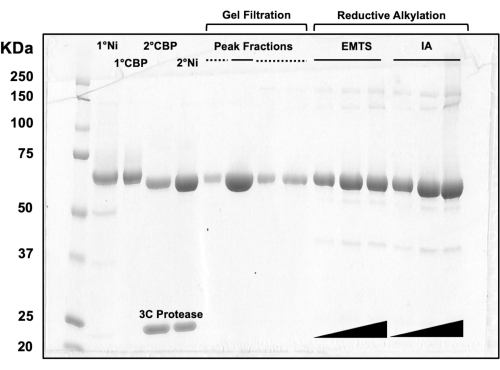
图3:柱层析和还原烷基化蛋白质洗脱液的SDS-PAGE分析。 将不同体积(1-10μL)的蛋白质组分上样到10%Tris/甘氨酸凝胶上,并在200V的恒定电压下运行45分钟。凝胶用考马斯蓝染色,脱色,风干,然后用台式扫描仪扫描。1° & 2° Ni:第一和第二根 Ni-NTA 柱;1° 和 2° CBP:第一和第二 CBP 柱;峰馏分实线:用于结晶的混合馏分;峰值分数虚线:肩部分数;EMTS:硫代水杨酸汞乙酯;IA:碘乙酰胺。 请点击这里查看此图的较大版本.
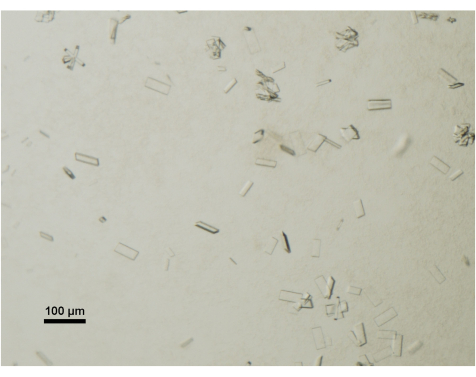
图4:通过光学显微镜评估蛋白质晶体成熟度。 在台式和配备偏光镜的体视显微镜下观察来自结晶液滴的ABCG5 / G8的成熟晶体。比例尺 = 100 μm。 请点击这里查看此图的较大版本.
讨论
与结晶膜蛋白相关的挑战促使脂质双层驱动的结晶方法的发展,例如bicelle27 或脂质立方相(LCP)14 方法。然而,实现膜蛋白的成功结晶仍然取决于蛋白质制备的关键步骤,有时甚至是瓶颈。值得注意的是,ABC转运蛋白在生长适合X射线晶体学的晶体方面存在巨大障碍。该协议为简化人ABCG5 / G8甾醇转运蛋白的制备和通过双晶结晶方法促进晶体生长提供了全面的实践指导。
设计该方案的一个关键考虑因素是在蛋白质纯化的初始阶段必须获得可观的蛋白质产量,在预结晶处理期间允许一定程度的蛋白质损失(图3)。应对这一挑战的常见策略包括广泛的蛋白质工程、利用不同表达宿主以及探索直系同源物或同源物等方法。然而,通过这个看似复杂的程序,已经确定了许多关键步骤,这些步骤支撑了该协议的成功,并提供了对研究其他ABC转运蛋白或膜蛋白时可能出现的潜在局限性的见解。
首先,该方案在每个步骤中都采用彻底离心,以尽量减少蛋白质聚集。此外,持续监测纯化蛋白质的热稳定性也至关重要。电子显微镜用于验证蛋白质的单分散性,而分析凝胶过滤则跟踪蛋白质随时间变化的稳定性(图2)。也可以采用圆二色性 (CD) 或差示扫描量热法 (DSC) 等替代技术。此外,在特定阶段掺入脂质对于最大限度地提高纯化 ABCG5/G8 的活性和结晶作用至关重要。例如,胆酸盐和 CHS 是表现出可测量的 ATP 水解所必需的;磷脂对于维持甲基化蛋白的稳定性是必不可少的;胆固醇是二烯溶液的必要成分,可促进晶体生长,适用于高分辨率X射线衍射(图4)。
从本质上讲,整个过程可以在一周的努力中完成。与LCP相比,从悬挂式结晶托盘中取出晶体非常简单。展望未来,该方案具有可观的蛋白质产量(约10mg),很容易适用于开发涉及ABCG5 / G8突变体或其他转运蛋白的晶体学研究。这对于目前无法通过电子显微镜进行可视化的病例尤其重要。
披露声明
作者没有任何要透露的信息。
致谢
这项工作得到了自然科学与工程研究委员会发现资助(RGPIN 2018-04070)和加拿大卫生研究院研究项目资助(PJT-180640)的支持。该协议基于Farhat等人22 和Lee等人23先前报道的ABCG5 / G8晶体结构中的原始报告。
材料
| Name | Company | Catalog Number | Comments |
| ABCG5 | National Institute of Health collection | NCBI accession number NM_022436 | |
| ABCG8 | National Institute of Health collection | NCBI accession number NM_022437 | |
| ÄKTA FPLC system | Cytiva (formerly GE Healthcare Life Sciences) | ||
| CaCl2 | Wisent | 600-024-CG | Anhydrous |
| CBP | Agilent | 214303 | Calmodulin binding peptide affinity resin |
| Centrifugal concentrators (Vivaspin) | Sartorius | ||
| CHAPSO | Anatrace | C317 | Anagrade |
| Cholesterol | Anatrace | CH200 | |
| CHS | Steraloids | C6823-000 | |
| DMAB | MilliporeSigma | 180238 | 97% |
| DMNG | Anatrace | NG322 | |
| DMPC | Anatrace | D514 | |
| DOPC | Avanti | 850375 | |
| DOPC | Anatrace | D518 | |
| DOPE | Avanti | 850725 | |
| DTT | Fisher | BP172 | |
| Dual Thickness MicroLoops | MiTeGen | ||
| EDTA | BioShop | EDT003 | Disodium salt, dihydrate |
| EGTA | MilliporeSigma | 324626 | |
| Emulsifier (EmulsiFex-C3) | Avestin | ||
| Endo H | New England Biolabs | P0702 | |
| Ethanol | Greenfield | P016EAAN | Ethyl Alcohol Anhydrous |
| Formaldehyde | MilliporeSigma | 252549 | ACS Reagent |
| Glycerol | BioShop | GLY004 | |
| HEPES | BioShop | HEP001 | |
| HRV-3C protease | Homemade | ||
| Imidazole | BioShop | IMD510 | Reagent grade |
| Iodoacetamide | MilliporeSigma | I1149 | BioUltra |
| Isopropanol | Fisher | BP2618212 | |
| Leupeptin | BioShop | LEU001 | |
| MES | MilliporeSigma | 69892 | BioUltra |
| Methanol | Fisher | A412P | |
| MgCl2 | Wisent | 800-070-CG | Hydrated |
| microfluidizer (LM 20) | Microfluidics | ||
| NaCl | BioShop | SOD002 | |
| NH4OH | Fisher | A669-212 | ACS Reagent |
| Ni-NTA superflow | Qiagen | 30430 | Nickel-charged resins |
| PEG 400 | MilliporeSigma | 202398 | |
| Pepstatin | BioShop | PEP605 | |
| PMSF | MilliporeSigma | P7626 | |
| pSGP18 and pLIC | Homemade (derived from pPICZ, Invitrogen) | ||
| SDS | BioShop | SDS003 | |
| Sodium cholate | Fisher | 229101 | |
| Sodium malonate | MilliporeSigma | 63409 | |
| Sucrose | Wisent | 800-081-WG | Ultra pure |
| Superdex 200 30/100 GL | Cytiva (formerly GE Healthcare Life Sciences) | 28990944 | Prepacked gel-filtration column |
| TCEP | |||
| TEM | FEI, Technai | ||
| Tris Base | Fisher | BP152 | |
| β-DDM | Anatrace | D310S | Sol Grade |
| β-mercaptoethanol | MilliporeSigma | ||
| ε-aminocaproic acid | Fisher | AAA1471936 |
参考文献
- Hamada, H., Tsuruo, T. Purification of the 170- to 180-kilodalton membrane glycoprotein associated with multidrug resistance. 170- to 180-kilodalton membrane glycoprotein is an ATPase. Journal of Biological Chemistry. 263 (3), 1454-1458 (1988).
- Higgins, F., Hiles, D., Whalley, K., Jamieson, J. Nucleotide binding by membrane components of bacterial periplasmic binding protein-dependent transport systems. The EMBO Journal. 4 (4), 1033-1039 (1985).
- Higgins, F., et al. A family of related ATP-binding subunits coupled to many distinct biological processes in bacteria. Nature. 323 (6087), 448-450 (1986).
- Horio, M., Gottesman, M., Pastan, I. ATP-dependent transport of vinblastine in vesicles from human multidrug-resistant cells. Proceedings of the National Academy of Sciences of the United States of America. 85 (10), 3580-3584 (1988).
- Mimmack, L., et al. Energy coupling to periplasmic binding protein-dependent transport systems: stoichiometry of ATP hydrolysis during transport in vivo. Proceedings of the National Academy of Sciences of the United States of America. 86 (21), 8257-8261 (1989).
- Grundy, M. Absorption and Metabolism of Dietary Cholesterol. Annual Review of Nutrition. 3 (1), 71-96 (1983).
- Berge, E., et al. Accumulation of dietary cholesterol in sitosterolemia caused by mutations in adjacent ABC transporters. Science. 290 (5497), 1771-1775 (2000).
- Repa, J., et al. Regulation of ATP-binding cassette sterol transporters ABCG5 and ABCG8 by the Liver X receptors α and β. Journal of Biological Chemistry. 277 (21), 18793-18800 (2002).
- Yu, L., et al. Stimulation of cholesterol excretion by the Liver X receptor agonist requires ATP-binding cassette transporters G5 and G8. Journal of Biological Chemistry. 278 (18), 15565-15570 (2003).
- Yu, L., et al. Expression of ABCG5 and ABCG8 is required for regulation of biliary cholesterol secretion. Journal of Biological Chemistry. 280 (10), 8742-8747 (2005).
- Lütjohann, D., Björkhem, I., Beil, F., von Bergmann, K. Sterol absorption and sterol balance in phytosterolemia evaluated by deuterium-labeled sterols: effect of sitostanol treatment. Journal of Lipid Research. 36 (8), 1763-1773 (1995).
- Miettinen, A. Phytosterolaemia, xanthomatosis and premature atherosclerotic arterial disease: a case with high plant sterol absorption, impaired sterol elimination and low cholesterol synthesis. European Journal of Clinical Investigation. 10 (1), 27-35 (1980).
- Salen, G., et al. Sitosterolemia. Journal of Lipid Research. 33 (7), 945-955 (1992).
- Caffrey, M. Membrane protein crystallization. Journal of Structural Biology. 142 (1), 108-132 (2003).
- Michel, H. Crystallization of membrane proteins. Trends in Biochemical Sciences. 8 (2), 56-59 (1983).
- Dürr, N., Gildenberg, M., Ramamoorthy, A. The magic of bicelleslights up membrane protein structure. Chemical Reviews. 112 (11), 6054 (2012).
- Dürr, N., Soong, R., Ramamoorthy, A. When detergent meets bilayer: Birth and coming of age of lipid bicelles. Progress in nuclear magnetic resonance spectroscopy. 69 (1), 1-22 (2013).
- Dufourc, J. Bicelles and nanodiscs for biophysical chemistry. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1863 (1), 183478 (2021).
- Beaugrand, M., et al. Lipid concentration and molar ratio boundaries for the use of isotropic bicelles. Langmuir. 30 (21), 6162-6170 (2014).
- Sanders, R., Schwonek, P. Characterization of magnetically orientable bilayers in mixtures of dihexanoylphosphatidylcholine and dimyristoylphosphatidylcholine by solid-state NMR. Biochemistry. 31 (37), 8898-8905 (1992).
- Seddon, M., Curnow, P., Booth, J. Membrane proteins, lipids and detergents: not just a soap opera. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1666 (1-2), 105-117 (2004).
- Farhat, D., et al. Structural analysis of cholesterol binding and sterol selectivity by ABCG5/G8. Journal of Molecular Biology. 434 (20), 167795 (2022).
- Lee, J. Y., et al. Crystal structure of the human sterol transporter ABCG5/ABCG8. Nature. 533 (7604), 561-564 (2016).
- Ujwal, R., Bowie, U. Crystallizing membrane proteins using lipidic bicelles. Methods. 55 (4), 337-341 (2011).
- Johnson, H., Lee, J. Y., Pickert, A., Urbatsch, L. Bile acids stimulate ATP hydrolysis in the purified cholesterol transporter ABCG5/G8. Biochemistry. 49 (16), 3403-3411 (2010).
- Wang, Z., et al. Purification and ATP hydrolysis of the putative cholesterol transporters ABCG5 and ABCG8. Biochemistry. 45 (32), 9929-9939 (2006).
- Faham, S. Crystallization of bacteriorhodopsin from bicelle formulations at room temperature. Protein Science. 14 (3), 836-840 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。