Method Article
ABCG5/G8-Kristallisation in einer lipidischen Bizellenumgebung für die Röntgenkristallographie
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt einen Aufbau für die Kristallisation des Steroltransporters ABCG5/G8. ABCG5/G8 wird für die Hängetropfenkristallisation in Bizellen rekonstituiert. Das Protokoll erfordert keine speziellen Materialien oder Substrate, so dass es in jedem Labor zur Bestimmung der Proteinstruktur durch Röntgenkristallographie zugänglich und einfach angepasst werden kann.
Zusammenfassung
ATP-bindende Kassettentransporter (ABC-Transporter) stellen in Lipide eingebettete Membranproteine dar. Die Extraktion dieser Membranproteine aus der Lipiddoppelschicht in eine wässrige Umgebung wird typischerweise durch den Einsatz von Detergenzien erreicht. Diese Detergenzien lösen die Lipiddoppelschicht auf und lösen die Proteine auf. Das intrinsische Habitat von Membranproteinen innerhalb der Lipiddoppelschicht stellt eine Herausforderung dar, um ihre Stabilität und Gleichmäßigkeit in Lösung für die strukturelle Charakterisierung aufrechtzuerhalten. Bizellen, die aus einer Mischung aus lang- und kurzkettigen Phospholipiden und Detergenzien bestehen, replizieren die natürliche Lipidstruktur. Die Verwendung von Lipidbizellen und Detergenzien dient als geeignetes Modellsystem zur Gewinnung hochwertiger Beugungskristalle, insbesondere zur Bestimmung der hochauflösenden Struktur von Membranproteinen. Durch diese synthetischen Mikroumgebungen bewahren Membranproteine ihre native Konformation und Funktionalität, was die Bildung dreidimensionaler Kristalle erleichtert. Bei diesem Ansatz wurde das mit Detergenzien lösliche heterodimere ABCG5/G8 in DMPC/CHAPSO-Bizellen reintegriert, ergänzt mit Cholesterin. Dieser Aufbau wurde im experimentellen Verfahren der Dampfdiffusion zur Proteinkristallisation eingesetzt.
Einleitung
ATP-bindende Kassettentransporter (ABC-Transporter) bilden eine Superfamilie von Membranproteinen, die für verschiedene ATP-abhängige Transportprozesse durch biologische Membranen verantwortlich sind 1,2,3,4,5. Diese Transporterproteine sind an Herz-Kreislauf-Erkrankungen beteiligt und spielen eine wichtige Rolle bei der Erleichterung des Cholesterinausflusses in die Galle für die anschließende Ausscheidung in der Leber. Infolgedessen haben der Cholesterinstoffwechsel und das Gleichgewicht des Cholesterinspiegels im Laufe der Jahre beträchtliches Interesse geweckt6. Ein spezifischer Mechanismus, der an der Ausscheidung von Cholesterin und anderen Sterolen aus dem Körper beteiligt ist, betrifft Mitglieder der menschlichen ABCG-Unterfamilie, insbesondere das heterodimere ABCG5/G8 7,8,9,10. Mutationen in einem dieser Gene stören das Heterodimer, was zu Funktionsverlust führt und Sitosterolämie verursacht, eine Störung, die den Steroltransport beeinträchtigt11,12,13. Angesichts der Relevanz der Krankheit und ihrer Rolle bei der Förderung des Cholesterinausflusses haben Steroltransporter große Aufmerksamkeit erregt. Dennoch sind die komplizierten Details ihres molekularen Mechanismus und ihrer Substratselektivität weitgehend ungeklärt. Daher ist die Aufklärung der Kristallstruktur von ABCG5/G8 ein entscheidender Schritt zum Verständnis der Mechanismen und nachgeschalteten Funktionen des Cholesterintransports.
Membranproteine müssen in Membranen verankert werden, um sich zu falten und korrekt zu funktionieren. Folglich führt die Extraktion von Membranproteinen aus ihrer natürlichen Umgebung häufig zu Proteininstabilität, Fehlfaltung und Funktionsverlust14,15. Diese Herausforderungen unterstreichen die wichtigsten Hürden bei der Kristallisation von Membranproteinen. Die Rekonstitution von Proteinen in synthetische Waschmitteldoppelschichten, wie z. B. Bizellen, hat sich jedoch als Lösung für dieses Dilemma erwiesen und ermöglicht die Aufrechterhaltung von Membranproteinen innerhalb eines nativen Doppelschichtmilieus16. Bizellen sind Ansammlungen von synthetischen Phospholipiden und Detergenzien, die in Wasser suspendiert und gelöst sind. Bemerkenswert ist, dass sie eine Doppelschichtstruktur aufweisen, die biologische Membranen nachahmt16,17,18. Bizellen können je nach Temperatur und Viskosität zwischen Flüssig- und Gelphasen wechseln. Die Bizellenkristallisation profitiert von den kleinen zweischichtigen Scheiben und der niedrigen Viskosität bei reduzierten Temperaturen, was ein gründliches Mischen von Proteinen und Bizellenlösungen erleichtert. Die Größe der Bizellen hängt vom Detergenzien-Lipid-Verhältnis bei der Zubereitungab 19,20. Zu den vorherrschenden Detergenzien für die Bizellenbildung gehören 3-[(3-cholamidopropyl)dimethylammonio]-2-hydroxy-1-propansulfonat (CHAPSO) sowie 3-[(3-cholamidopropyl)dimethylammonio]-1-propansulfonat (CHAPS) und 1,2-Ditridecanoyl-sn-glycerin-3-phosphocholin (DHPC)21. Diese Detergenzien werden in Verbindung mit Lipiden wie Dimyristoyl-Phosphatidylcholin (DMPC) und 1-Palmitoyl-2-oleoyl-phosphatidylcholin (POPC) verwendet. Darüber hinaus haben neuere Studien die volle Funktionalität von Membranproteinen in Bizellen unter physiologischen Bedingungen gezeigt. Zum Beispiel gelang es Lee und Kollegen, die Kristallstruktur von ABCG5/ABCG8 auf der Grundlage einer Lipiddoppelschicht22,23 zu kristallisieren und zu beschreiben. Im Kristallisationsprozess können Protein-Bizell-Gemische unter Verwendung von Standardausrüstungen, einschließlich Hochdurchsatz-Kristallisationsrobotern24, untergebracht werden. Die Machbarkeit der Verwendung von Bizellen hängt jedoch von der Thermostabilität der Proteine aufgrund der Kristallisationsbedingungen bei höheren Temperaturen ab. Im Vergleich zu anderen Techniken bleiben die erforderlichen Kristallisationsbedingungen für Membranproteine jedoch im Allgemeinen mild und beinhalten geringe Konzentrationen von Fällungsmitteln, Salz und Puffer. Dies macht sowohl Protein-Bizell-Mischungen als auch Dampfdiffusion zu effektiven und leicht implementierbaren Werkzeugen für Strukturstudien von Membranproteinen.
Dieses Protokoll beschreibt wesentliche Schritte der Proteinpräparation und Bizellenkristallisation zur Bestimmung der Röntgenkristallstruktur von ABCG5/G8 mit hoher Auflösung (Abbildung 1).
Protokoll
1. Klonierung und Proteinexpression
- Klonen Sie das humane ABCG5/G8-Gen in Pichia pastoris-Hefe gemäß den vorherigen Protokollen25,26. Kurz gesagt, leiten Sie pSGP18 und pLIC Expressionsvektoren aus pPICZB ab. Fügen Sie eine Markierung hinzu, die eine 3C-Proteasestelle des Rhinovirus kodiert, gefolgt von einem Calmodulin-bindenden Peptid (CBP) am C-Terminus der ABCG8-cDNA (pSGP18-G8-3C-CBP).
- Fügen Sie eine durch ein Glycin getrennte Sechs-Histidin-Markierung (His 6, GlyHis6) zum C-Terminus der ABCG5-cDNA (pLIC-G5-H12) hinzu. Co-Transformation der Plasmide in Pichia-Stamm KM71H mittels Elektroporation.
HINWEIS: Bitte beachten Sie die Materialtabelle für die Details der verwendeten Plasmide, Medien und Puffer. - Transformierte Hefezellen werden auf MD-Agarplatten bei 28 °C gezüchtet.
- Fügen Sie eine durch ein Glycin getrennte Sechs-Histidin-Markierung (His 6, GlyHis6) zum C-Terminus der ABCG5-cDNA (pLIC-G5-H12) hinzu. Co-Transformation der Plasmide in Pichia-Stamm KM71H mittels Elektroporation.
- Wählen Sie nach 1-2 Tagen 10-12 Kolonien aus und inokulieren Sie sie mit 50-ml-Zentrifugenröhrchen für die Kultur in kleinem Maßstab in 10 ml MGY-Medien (Minimal Glycerin-Hefe-Stickstoffbasis).
- Drei kleine Löcher in den Deckel des Zentrifugenröhrchens bohren, um eine bessere Belüftung zu gewährleisten. Lassen Sie die Zellen bei 28 °C unter ständigem Schütteln bei 250 U/min wachsen, bis die optische Dichte bei 600 nm (OD600) 10 erreicht, was normalerweise 1-2 Nächte dauert.
HINWEIS: Das Zellwachstum dauert in der Regel zwischen 12 und 24 Stunden.
- Drei kleine Löcher in den Deckel des Zentrifugenröhrchens bohren, um eine bessere Belüftung zu gewährleisten. Lassen Sie die Zellen bei 28 °C unter ständigem Schütteln bei 250 U/min wachsen, bis die optische Dichte bei 600 nm (OD600) 10 erreicht, was normalerweise 1-2 Nächte dauert.
- Nehmen Sie am nächsten Tag 1 l steriles MGY-Medium und impfen Sie es mit der Primärkultur in einem 2,4-l-Kolben. Der Kolben wird bei 28 °C in einem Schüttel-Inkubator bei 250 U/min für 24 h inkubiert.
- Um den pH-Wert zwischen 5-6 zu halten, fügen Sie 10% Ammoniumhydroxid (NH4OH) hinzu, bis sich der pH-Wert stabilisiert hat.
- Passen Sie den pH-Wert an und induzieren Sie die Proteinexpression, indem Sie 1 ml reines Methanol pro 1-Liter-Kultur (0,1 % (v/v) Methanol) hinzufügen).
HINWEIS: Die Zellen werden anschließend alle 12 h für eine Gesamtdauer von 36-48 h mit 5 ml reinem Methanol pro Literkultur (0,5 % (v/v) Methanol) gefüttert. - Erntezellen durch Zentrifugieren bei 15.000 x g für 30 min bei 4 °C.
- Die Zellpellets werden gesammelt und in einem Lysepuffer (0,33 M Saccharose, 0,3 M Tris-Cl pH 7,5, 0,1 M Aminohexansäure, 1 mM EDTA und 1 mM EGTA) auf eine Konzentration von 0,5 g/ml resuspendiert. Lagern Sie die Suspension bei -80 °C. Typischerweise kann man 30 ± 5 g Zellmasse aus 1 l kultivierten Zellen gewinnen.
HINWEIS: Lagern Sie Zellpellets direkt im Gefrierschrank oder führen Sie eine sofortige Resuspension in Lysepuffer für Membranpräparationen durch.
2. Vorbereitung der mikrosomalen Membran
- Tauen Sie die Zellen auf und fügen Sie Proteasehemmer hinzu (2 μg/ml Leupeptin, 2 μg/ml Pepstatin A, 2 mM PMSF, siehe Materialtabelle).
- Um die Zellen weiter zu lysieren, verwenden Sie einen eisgekühlten Emulgator oder Mikrofluidisierer (siehe Materialtabelle) bei 25.000-30.000 psi. Wiederholen Sie diesen Vorgang 3-4 Mal.
- Zentrifuge zur Entfernung von Zelltrümmern: Schleudern bei 3.500-4.000 x g für 15 min, gefolgt von einem zweiten Schleudern bei 15.000 x g für 30 min. Beide Schleudergänge bei 4 °C halten.
- Um mikrosomale Membranvesikel zu isolieren, wird der Überstand in Ultrazentrifugenröhrchen überführt und 1,5 h lang bei 4 °C bei 2,00.000 x g ultrazentrifugiert.
- Resuspendieren Sie das Membranpellet in 50 ml Puffer A (50 mM Tris-Cl pH 8,0, 100 mM NaCl und 10 % Glycerin) mit einem Unzenhomogenisator. Lagern Sie die Suspension bei -80 °C.
3. Proteinherstellung - Reinigung von Heterodimeren
- Tauen Sie die gefrorenen mikrosomalen Membranen auf und stellen Sie die Konzentration mit Hilfe eines Solubilisierungspuffers auf 4-6 mg/ml ein. Der Puffer sollte 50 mM Tris-HCl, pH 8,0, 100 mM NaCl, 10 % Glycerin, 1 % (w/v) β-Dodecylmaltosid (β-DDM), 0,5 % (w/v) Cholat, 0,1 % (w/v) Cholesterylhemisuccinat (CHS), 5 mM Imidazol, 5 mM β-Mercaptoethanol (β-ME), 2 μg/ml Leupeptin, 2 μg/ml Pepstatin A und 2 mM PMSF enthalten (siehe Materialtabelle).
HINWEIS: Man kann gleiche Volumina des Membranpräparats und des Solubilisierungspuffers mischen oder 2x Solubilisierungspuffer ohne Proteaseinhibitoren und Reduktionsmittel verwenden. Das kurze Sieden des Puffers trägt dazu bei, CHS effizient aufzulösen. Verwenden Sie zur Reinigung nur den 4 °C gekühlten Puffer.- Die Mischung bei mittlerer Geschwindigkeit 1 h bei 4 °C rühren. Anschließend mit zusätzlichem Rühren bei Raumtemperatur (RT) für 20-30 min umrühren.
- Die Mischung wird bei 1,00,000 x g für 30 min bei 4 °C zentrifugiert, um unlösliche Membranen zu entfernen. Sammeln Sie den gelösten Überstand und fügen Sie 20 mM Imidazol und 0,1 mM TCEP hinzu.
- Affinitätssäulenchromatographie26 durchführen: Binden Sie den solubilisierten Überstand über Nacht an voräquilibrierte Ni-NTA-Kügelchen (10-15 ml) (siehe Materialtabelle) in Puffer A (Schritt 2.2.1).
HINWEIS: Vermeiden Sie ab diesem Zeitpunkt die Verwendung von Glycerin in laufenden Puffern.- Die Säule wird zweimal mit 10 Säulenvolumina Puffer B (50 mM HEPES, pH 7,5, 100 mM NaCl, 0,1 % (w/v) β-DDM, 0,05 % (w/v) Cholat, 0,01 % (w/v) CHS, 0,1 mM TCEP) mit 25 mM Imidazol gewaschen.
- Waschen Sie die Säule mit 10 Säulenvolumina Puffer B mit 50 mM Imidazol.
- Das Protein wird mit Buffer C (Buffer B mit 200 mM Imidazol) eluiert.
- Zu den eluierten Proteinen werden 1 mM TCEP (siehe Materialtabelle) und 10 mM MgCl2gegeben.
- Validieren Sie die eluierten Fraktionen auf einem SDS-PAGE-Gel, um die korrekte Proteingröße26 zu bestätigen.
HINWEIS: Typische Proteinausbeute (1. Ni-NTA): 10-20 mg Protein pro 6-Liter-Kultur. Verwenden Sie DDM mit dem 10- oder 5-fachen der kritischen Mizellenkonzentration (CMC), etwa 0,01 %. Dieses Protokoll verwendet 0,1 % DDM. - Verdünnen Sie die Spitzenfraktionen aus der Ni-NTA-Elution mit einem gleichen Volumen Puffer D1 (Puffer B mit 1 mM CaCl 2, 1 mM MgCl2), mischen Sie und laden Sie die Proteinfraktionen auf eine CBP-Säule (3-5 ml) (siehe Materialtabelle), die mit CBP-Waschpuffer D1 voräquilibriert wurde.
- Führen Sie sequentielle Waschvorgänge an der CBP-Säule durch, um Reinigungsmittel mit Puffer D1 und D2 auszutauschen (Puffer B mit 1 mM CaCl 2, 1 mM MgCl2, 0,1 % (w/v) Decylmaltose-Neopentylglykol (DMNG), ohne β-DDM): Zuerst mit 3 Säulenvolumina D1 waschen; zweitens mit 3 Säulenvolumina D1:D2 (3:1, v/v) waschen; drittens mit 3 Säulenvolumina D1:D2 (1:1, v/v) waschen; Im vierten Schritt wird mit 3 Säulenvolumina D1:D2 (1:3, v/v) gewaschen, gefolgt von 6-10 Säulenvolumina D2.
- Das Protein wird mit CBP-Waschpuffer D2 mit 300 mM NaCl in 1-ml-Fraktionen aus der CBP-Säule (insgesamt 10 ml) eluiert. Konzentrieren Sie die eluierten Fraktionen auf 1-2 ml.
HINWEIS: Die typische Proteinausbeute (1. CBP) beträgt 5-15 mg Protein pro 6-Liter-Kultur. Maltose-Neopentyl-Glykol (MNG)-Detergenzien verbessern die gereinigte Proteinspeicherung bei 4 °C. Es wurden sowohl DMNG als auch Lauryl MNG (LMNG) verwendet, wobei DMNG bessere Röntgenbeugungskristalle lieferte. Verwenden Sie DMNG bei 10-20x seiner kritischen Mizellenkonzentration (CMC), ca. 0,003%. Dieses Protokoll verwendete 0,1 % DMNG. Ein Teil des CBP-Eluats kann durch Gelfiltrationschromatographie (Schritt 4.4.) weiter gereinigt werden, um die ATPase-Aktivität von Proteinen zu analysieren oder die Monodispersität durch Transmissionselektronenmikroskopie (TEM) zu beurteilen.
4. Proteinvorbereitungs-Vorkristallisationsbehandlung
- Spalten Sie die N-verknüpften Glykane und CBP-Tags mit Endoglycosidase H (Endo H, ~0,2 mg pro 10-15 mg gereinigtem Protein) bzw. HRV-3C-Protease (~2 mg pro 10-15 mg gereinigtes Protein) (siehe Materialtabelle). Über Nacht bei 4 °C inkubieren.
- Während der Endo-H- und 3C-Protease-Inkubation wird eine reduktive Alkylierung an den gepoolten Proteinen durchgeführt. Beginnen Sie mit der Inkubation mit 20 mM Jodacetamid (siehe Materialtabelle) über Nacht bei 4 °C. Es folgt eine 1-stündige Inkubation mit zusätzlich 2 mM Jodacetamid auf Eis.
HINWEIS: Dieser Schritt stabilisiert die Proteinspeicherung für bis zu einem Monat bei 4 °C. - Verwenden Sie eine zweite CBP-Säule (1-2 ml), um das gespaltene CBP-Tag zu trennen. Verwenden Sie für diesen Vorgang Puffer D2.
HINWEIS: Die typische Proteinausbeute (2. CBP) beträgt 5-10 mg Protein pro 6-Liter-Kultur. - Reinigen Sie das CBP-Tag-freie Protein mit Hilfe der Gelfiltrationschromatographie. Der Puffer sollte 10 mM HEPES, pH 7,5, 100 mM NaCl, 0,1 % (w/v) DMNG, 0,05 % (w/v) Cholat und 0,01 % (w/v) CHS enthalten.
HINWEIS: Die typische Proteinausbeute (Gelfiltration) beträgt 2-8 mg Protein pro 6-Liter-Kultur. Während dieses Schrittes deutet das Fehlen eines DDM-Peaks (~65 kD) während der Gelfiltration auf einen erfolgreichen Detergenzienaustausch zu DMNG hin. - Modifizieren Sie die gepoolten Proteinfraktionen durch reduktive Methylierung: Geben Sie 20 mM Dimethylaminboran (DMAB, siehe Materialtabelle) und 40 mM Formaldehyd zum Protein. 2 h bei 4 °C auf einem oszillierenden Schüttler inkubieren. Fügen Sie 10 mM DMAB hinzu.
- Wiederholen Sie Schritt 4.5, einschließlich der Zugabe von 10 mM DMAB, und inkubieren Sie über Nacht (12-18 h) bei 4 °C.
- Stoppen Sie die Reaktion durch Zugabe von 100 mM Tris-Cl, pH 7,5.
- Laden Sie das methylierte Protein auf eine 2-ml-Ni-NTA-Säule, die mit 100 mM Tris-Cl, pH 8,0 und 100 mM NaCl voräquilibriert ist.
- Waschen Sie die Säule mit 10 Säulenvolumina Waschpuffer (10 mM HEPES, pH 7,5, 100 mM NaCl, mit 0,5 mg/ml DOPC: Dope (3:1, w/w), 0,1 % (w/v) DMNG, 0,05 % (w/v) Cholat, 0,01 % (w/v) CHS).
- Das relipidierte Protein wird mit Hilfe von Elutionspuffer (10 mM HEPES, pH 7,5, 100 mM NaCl, 200 mM Imidazol, 0,5 mg/ml DOPC: Dope (1:1, w/w), 0,1 % (w/v) DMNG, 0,05 % (w/v) Cholat, 0,01 % (w/v) CHS) eluiert.
HINWEIS: Die typische Proteinausbeute (2. Ni-NTA) beträgt 1-5 mg Protein pro 6-Liter-Kultur. - Die Proteineluate werden durch eine PD-10-Entsalzungssäule geleitet, die mit dem in Schritt 4.4 verwendeten Puffer voräquilibriert ist.
- Das entsalzte und relipidierte Protein wird über Nacht mit Cholesterin (hergestellt in Isopropanol oder Ethanol) auf eine Endkonzentration von ~20 μM inkubiert.
- Am nächsten Morgen wird das Fällmittel durch Ultrazentrifugation bei 1,50.000 x g für 10 min bei 4 °C entfernt. Sammle den Überstand ein.
- Konzentrieren Sie das Protein auf eine Endkonzentration von 30-50 mg/ml unter Verwendung eines 100-kDa-Cutoff-Zentrifugalkonzentrators.
- Entnehmen Sie das Fällmittel mit einer gekühlten Tischzentrifuge bei Höchstgeschwindigkeit für 30 Minuten bei 4 °C.
- Halten Sie den Überstand auf Eis bei 4 °C und stellen Sie Kristallisationsbedingungen in den Bizellen her.
HINWEIS: Die konzentrierten Proteine sollten innerhalb einer Woche für die Kristallzüchtung verwendet werden. Frieren Sie die Proteine nicht ein.
5. Proteinkristallisation in Bizellen
- Bereiten Sie eine 10%ige Bizellen-Stammlösung mit DMPC-Lipiden und CHAPSO-Reinigungsmittel in einem Verhältnis von 3:1 (w/w) vor (siehe Materialtabelle).
HINWEIS: Verwenden Sie CHAPSO bei 5x seiner kritischen Mizellenkonzentration (CMC), ca. 0,5%. Dadurch wird die Detergenzienkonzentration um den CMC im Protein-Bizellen-Gemisch aufrechterhalten (Schritt 5.2).- DeionisiertesH2O-gelöstesReinigungsmittel (CHAPSO) zu vorgetrockneten Lipiden (Mischung aus 5 mol% Cholesterin und 95 mol% DMPC) geben.
HINWEIS: Bereiten Sie verschiedene Lipidzusammensetzungen in Chloroform vor und trocknen Sie sie in einem Glasreagenzglas mit einem Stickstoffgasstrom bei RT. Entfernen Sie Lösungsmittelreste, indem Sie sie über Nacht in eine Vakuumkammer geben, wodurch eine dünne Lipidschicht entsteht. - Resuspendieren Sie Lipide und Reinigungsmittel mit einem Wasserbad-Ultraschallgerät.
- Beschallen Sie die Bizellenmischung in eisgekühltem Wasser mit kontinuierlicher Kraft, bis die Lösung durchsichtig wird.
HINWEIS: Verwenden Sie einen Gehörschutz und sorgen Sie für eine ausreichende Eisversorgung, um das Gemisch in einer flüssigen Phase zu halten. - Ungelöste Bestandteile mit einem 0,2 μm Zentrifugalfilter entfernen (siehe Materialtabelle).
HINWEIS: Lagern Sie die aliquotierte Bizellenlösung bei -80 °C.
- DeionisiertesH2O-gelöstesReinigungsmittel (CHAPSO) zu vorgetrockneten Lipiden (Mischung aus 5 mol% Cholesterin und 95 mol% DMPC) geben.
- Erzeugen Sie eine Protein-Bizelle-Mischung auf Eis, indem Sie vorsichtig 10 % Bizellen (Schritt 5.1.4) und Proteine (Schritt 4.7.4) in einem Verhältnis von 1:4 (v/v) kombinieren, um eine endgültige Proteinkonzentration zwischen 5 und 10 mg/ml zu erreichen.
- Die Mischung aus Protein und Bizelle 30 Minuten auf Eis inkubieren.
- Richten Sie Kristallisationsbedingungen in einem hängenden Tropfendampfdiffusionsformat mit 48-Well-Platten ein.
- Mischen Sie gleiche Volumina (0,5 oder 1 μl) der Protein/Bizell-Mischung und der Kristallisationsreservoirlösung, die 1,6 M-2,0 M Ammoniumsulfat, 100 mM MES (pH 6,5), 0%-4% PEG 400 und 1 mM TCEP enthält (siehe Materialtabelle).
HINWEIS: Erstellen Sie vor jedem Experiment eine Matrix der Lagerstättenlösung und passen Sie Ammoniumsulfat (1,6-2,0 M) und PEG 400 (0%-4%) an. - Zur Kristallisation bei 20 °C inkubieren.
- Überprüfen Sie die Kristallisationsschalen am nächsten Tag, um eine ordnungsgemäße Versiegelung des Deckglases sicherzustellen.
- Überwachen Sie das Kristallwachstum mindestens einmal täglich. Hochwertige Kristalle erscheinen in der Regel innerhalb von 1-2 Wochen mit den Maßen 50-150 μm x 20-50 μm x 2-5 μm.
HINWEIS: Bei niedrigeren Proteinkonzentrationen kann es länger dauern, bis sich Kristalle bilden. Reife Kristalle sollten innerhalb eines Monats geerntet werden. - Proteinkristalle werden in 0,2 M Natriummalonat eingeweicht und mit 50 oder 100 μm Kryoschleifen in flüssigem Stickstoff schockgefroren.
HINWEIS: Wenn ein Röntgendiffraktometer verfügbar ist, testen Sie einige Kristalle mit einem 15-30-minütigen Röntgenstrahl, um eine Beugung von bis zu 5 Å zu zeigen. Für die höher aufgelöste Beugung ist eine Synchrotronlichtquelle erforderlich. Mit 0,2 M Natriummalonat als Kryo-Schutzmittel kann ein Kristall mit den Maßen 100 μm x 50 μm x 2 μm etwa 90 Beugungsbilder mit Synchrotron-Röntgenstrahlung liefern.
- Mischen Sie gleiche Volumina (0,5 oder 1 μl) der Protein/Bizell-Mischung und der Kristallisationsreservoirlösung, die 1,6 M-2,0 M Ammoniumsulfat, 100 mM MES (pH 6,5), 0%-4% PEG 400 und 1 mM TCEP enthält (siehe Materialtabelle).
Ergebnisse
Rekombinante ABC-Halbtransporter, humanes ABCG5 und ABCG8, werden in Pichia pastoris-Hefe koexprimiert. Die Hefemembranfraktion wird dann durch Zentrifugation fraktioniert. Wie in diesem Protokoll beschrieben, werden die heterodimeren Proteine mittels Tandemsäulenchromatographie extrahiert. Anschließend werden chemisch vorbehandelte Proteine kristallisiert, indem sie mit Phospholipid/Cholesterin-Bizellen inkubiert werden. Schematische Übersichten über die Reinigungs- und Kristallisationsprozesse sind in Abbildung 1 dargestellt.
Um die Monodispersität der gereinigten Proteine zu beurteilen, werden Proben, die 0,01-0,05 mg/ml Proteine enthalten, mit 1%-2% Uranylacetat gefärbt. Diese Proben werden dann mit einer Negativfärbungs-TEM untersucht (Abbildung 2A). Um die Proteinstabilität ohne Gefrier-Auftau-Zyklen zu bewerten, wird die analytische Gelfiltrationschromatographie eingesetzt. Diese Analyse beinhaltet die Überwachung der zeitlichen Lagerung von gereinigten Proteinen durch die Verwendung kleiner, gleichvolumiger Aliquots der Proteine (Abbildung 2B). Nach einer Woche Inkubation bei 4 °C kann es zu einem leichten Proteinverlust an den Spitzenfraktionen kommen, möglicherweise aufgrund von verbleibenden löslichen Proteinaggregaten. Nichtsdestotrotz bleibt die Gesamtproteinausbeute für das Kristallwachstum ausreichend. Die Verwendung von Negativfärbungs-TEM und analytischer Gelfiltrationschromatographie ist eine Standardpraxis, um die Eignung von Proteinen für die Kristallisation zu beurteilen, insbesondere aus verschiedenen technischen Konstrukten.
Für die Beurteilung der Proteinqualität in jedem Schritt des Säulenchromatographieprozesses sowie nach der chemischen Behandlung vor der Kristallisation werden Aliquots von Fraktionen, die zwei Ni-NTA-Säulen, zwei CBP-Säulen, einer Gelfiltration und reduktiver Alkylierung entsprechen, auf ein 10%iges SDS-PAGE-Gel geladen (Abbildung 3). Darüber hinaus kann die gleiche Reaktionsumgebung, die für die Alkylierung verwendet wird, für die Quecksilbermarkierung mit Ethylquecksilber (EMTS) verwendet werden, obwohl dies den Rahmen der aktuellen Studie sprengen würde.
Das Wachstum der Kristalle wird täglich mit einem Tischstereomikroskop überwacht, das mit einem Polarisator ausgestattet ist. Ausgereifte und für die Datenerfassung geeignete Kristalle erreichen in der Regel Abmessungen von 50 μm x 100 μm x 2 μm (Abbildung 4). Bei der Kristallernte wird bewusst auf kleinere Kristalle oder Cluster verzichtet.
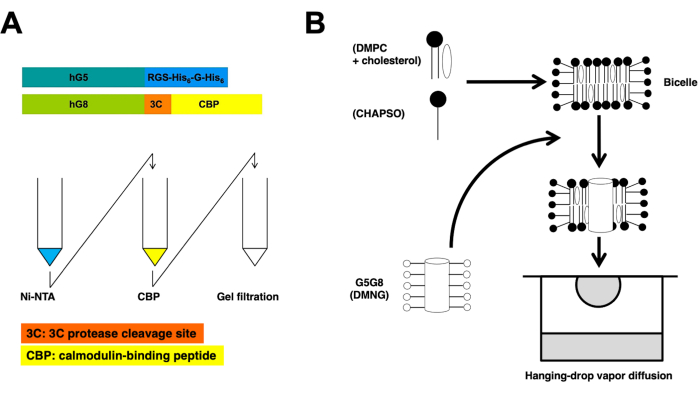
Abbildung 1: Schematische Übersichten für die Aufreinigung (A) und Bizellenkristallisation (B) von heterodimerem ABCG5/G8. Konstrukte aus rekombinantem humanem ABCG5 (hG5) und ABCG8 (hG8) tragen RGS-H 6-G-H6 bzw. 3C-CBP-Tags (A, oben). Tandem-Affinitätssäulenchromatographie, gefolgt von Gelfiltrationschromatographie, um eine heterodimere Aufreinigung zu erreichen (A, unten). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
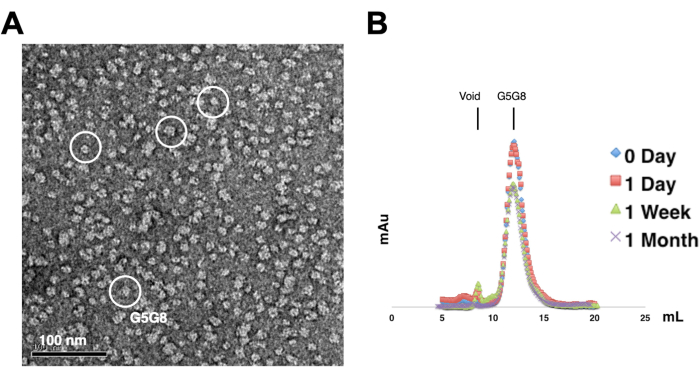
Abbildung 2: Bewertung der Monodispersität (A) und Stabilität (B) von gereinigten Proteinen . (A) Elektronenmikroskopische Aufnahme von negativ gefärbten ABCG5/G8 (G5G8) Heterodimeren mittels TEM. Repräsentative Partikel werden in durchgehenden weißen Kreisen hervorgehoben. Maßstabsleiste = 100 nm. (B) Alkylierte Proteine, die bei 4 °C gelagert und durch analytische Gelfiltrationschromatographie im Laufe eines Monats analysiert wurden, mit einem leichten Proteinverlust nach einer Woche. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
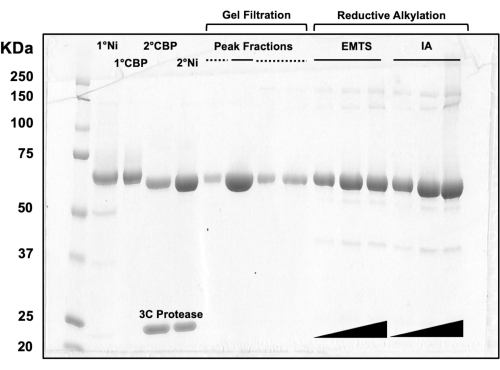
Abbildung 3: SDS-PAGE-Analyse von Proteineluaten der Säulenchromatographie und reduktiven Alkylierung. Verschiedene Volumina (1-10 μl) Proteinfraktionen wurden auf ein 10%iges Tris/Glycin-Gel geladen und liefen 45 min lang bei einer konstanten Spannung von 200 V. Das Gel wurde mit Coomassie-Blau gefärbt, entfärbt, an der Luft getrocknet und mit einem Tischscanner gescannt. 1° & 2° Ni: erste und zweite Ni-NTA-Säule; 1° & 2° CBP: erste und zweite CBP-Säule; Peak Fractions durchgezogene Linie: gepoolte Fraktionen für die Kristallisation; Peak Fractions gestrichelte Linie: Schulteranteile; EMTS: Ethylquecksilberthiosalicynat; IA: Iodacedamid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
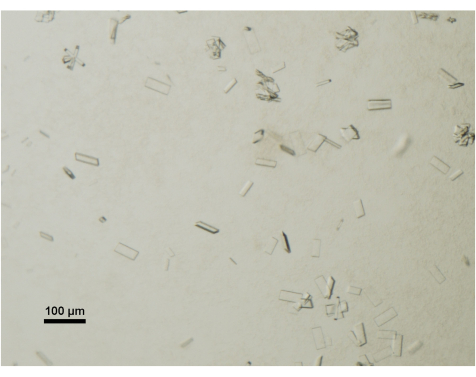
Abbildung 4: Beurteilung der Proteinkristallreifung mittels Lichtmikroskopie. Reife Kristalle von ABCG5/G8 aus einem Kristallisationstropfen wurden unter einem Tisch- und Polarisator-Stereomikroskop visualisiert. Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Herausforderungen, die mit der Kristallisation von Membranproteinen verbunden sind, haben zur Entwicklung von Lipid-Doppelschicht-gesteuerten Kristallisationsmethoden geführt, wie z. B. der Bizelle27 oder der kubischen Lipidphase (LCP)14-Ansätzen . Das Erreichen einer erfolgreichen Kristallisation von Membranproteinen hängt jedoch immer noch von dem kritischen und manchmal engmaschigen Schritt der Proteinherstellung ab. Insbesondere ABC-Transporter stellen eine gewaltige Hürde bei der Züchtung von Kristallen dar, die für die Röntgenkristallographie geeignet sind. Dieses Protokoll bietet eine umfassende praktische Anleitung zur Optimierung der Herstellung des humanen ABCG5/G8-Steroltransporters und zur Förderung des Kristallwachstums durch den Bizellenkristallisationsansatz.
Eine wichtige Überlegung bei der Entwicklung dieses Protokolls war die Notwendigkeit einer erheblichen Proteinausbeute in den Anfangsphasen der Proteinreinigung, die einen gewissen Proteinverlust während der Vorkristallisationsbehandlung ermöglicht (Abbildung 3). Gängige Strategien zur Bewältigung dieser Herausforderung umfassen unter anderem ein umfangreiches Protein-Engineering, die Nutzung verschiedener Expressionswirte und die Erforschung von Orthologen oder Homologen. Nichtsdestotrotz wurden bei diesem scheinbar komplizierten Verfahren eine Reihe von entscheidenden Schritten identifiziert, die den Erfolg des Protokolls untermauern und auch Einblicke in mögliche Einschränkungen geben, die bei der Untersuchung anderer ABC-Transporter oder Membranproteine im Allgemeinen auftreten können.
Erstens verwendet dieses Protokoll bei jedem Schritt eine gründliche Zentrifugation, um die Proteinaggregation zu minimieren. Darüber hinaus ist die kontinuierliche Überwachung der Thermostabilität der gereinigten Proteine von entscheidender Bedeutung. Die Elektronenmikroskopie wird verwendet, um die Monodispersität von Proteinen zu überprüfen, während die analytische Gelfiltration die Proteinstabilität im Laufe der Zeit verfolgt (Abbildung 2). Alternative Techniken wie Zirkulardichroismus (CD) oder dynamische Differenzkalorimetrie (DSC) könnten ebenfalls integriert werden. Darüber hinaus ist der Einbau von Lipiden in bestimmten Stadien unerlässlich, um sowohl die Aktivität als auch die Kristalllogenese des gereinigten ABCG5/G8 zu maximieren. Zum Beispiel sind Cholat und CHS notwendig, um eine messbare ATP-Hydrolyse zu zeigen; Phospholipide sind unentbehrlich für die Aufrechterhaltung der Stabilität methylierter Proteine; und Cholesterin ist ein notwendiger Bestandteil der Bizellenlösung, der das Kristallwachstum fördert, das für die hochauflösende Röntgenbeugung geeignet ist (Abbildung 4).
Im Wesentlichen kann das gesamte Verfahren innerhalb einer Woche durchgeführt werden. Im Gegensatz zu LCP ist die Entnahme von Kristallen aus hängenden Kristallisationsschalen einfach. Mit Blick auf die Zukunft ist dieses Protokoll mit einer beträchtlichen Proteinausbeute (ca. 10 mg) leicht anpassbar für die Entwicklung kristallographischer Untersuchungen mit ABCG5/G8-Mutanten oder anderen Transporterproteinen. Dies gilt insbesondere für Fälle, die sich derzeit der Visualisierung durch Elektronenmikroskopie entziehen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wird durch einen Natural Sciences and Engineering Research Council Discovery Grant (RGPIN 2018-04070) und einen Canadian Institutes of Health Research Project Grant (PJT-180640) an JYL unterstützt. Dieses Protokoll basiert auf den Originalberichten über ABCG5/G8-Kristallstrukturen, die zuvor von Farhat et al.22 und Lee et al.23 berichtet wurden.
Materialien
| Name | Company | Catalog Number | Comments |
| ABCG5 | National Institute of Health collection | NCBI accession number NM_022436 | |
| ABCG8 | National Institute of Health collection | NCBI accession number NM_022437 | |
| ÄKTA FPLC system | Cytiva (formerly GE Healthcare Life Sciences) | ||
| CaCl2 | Wisent | 600-024-CG | Anhydrous |
| CBP | Agilent | 214303 | Calmodulin binding peptide affinity resin |
| Centrifugal concentrators (Vivaspin) | Sartorius | ||
| CHAPSO | Anatrace | C317 | Anagrade |
| Cholesterol | Anatrace | CH200 | |
| CHS | Steraloids | C6823-000 | |
| DMAB | MilliporeSigma | 180238 | 97% |
| DMNG | Anatrace | NG322 | |
| DMPC | Anatrace | D514 | |
| DOPC | Avanti | 850375 | |
| DOPC | Anatrace | D518 | |
| DOPE | Avanti | 850725 | |
| DTT | Fisher | BP172 | |
| Dual Thickness MicroLoops | MiTeGen | ||
| EDTA | BioShop | EDT003 | Disodium salt, dihydrate |
| EGTA | MilliporeSigma | 324626 | |
| Emulsifier (EmulsiFex-C3) | Avestin | ||
| Endo H | New England Biolabs | P0702 | |
| Ethanol | Greenfield | P016EAAN | Ethyl Alcohol Anhydrous |
| Formaldehyde | MilliporeSigma | 252549 | ACS Reagent |
| Glycerol | BioShop | GLY004 | |
| HEPES | BioShop | HEP001 | |
| HRV-3C protease | Homemade | ||
| Imidazole | BioShop | IMD510 | Reagent grade |
| Iodoacetamide | MilliporeSigma | I1149 | BioUltra |
| Isopropanol | Fisher | BP2618212 | |
| Leupeptin | BioShop | LEU001 | |
| MES | MilliporeSigma | 69892 | BioUltra |
| Methanol | Fisher | A412P | |
| MgCl2 | Wisent | 800-070-CG | Hydrated |
| microfluidizer (LM 20) | Microfluidics | ||
| NaCl | BioShop | SOD002 | |
| NH4OH | Fisher | A669-212 | ACS Reagent |
| Ni-NTA superflow | Qiagen | 30430 | Nickel-charged resins |
| PEG 400 | MilliporeSigma | 202398 | |
| Pepstatin | BioShop | PEP605 | |
| PMSF | MilliporeSigma | P7626 | |
| pSGP18 and pLIC | Homemade (derived from pPICZ, Invitrogen) | ||
| SDS | BioShop | SDS003 | |
| Sodium cholate | Fisher | 229101 | |
| Sodium malonate | MilliporeSigma | 63409 | |
| Sucrose | Wisent | 800-081-WG | Ultra pure |
| Superdex 200 30/100 GL | Cytiva (formerly GE Healthcare Life Sciences) | 28990944 | Prepacked gel-filtration column |
| TCEP | |||
| TEM | FEI, Technai | ||
| Tris Base | Fisher | BP152 | |
| β-DDM | Anatrace | D310S | Sol Grade |
| β-mercaptoethanol | MilliporeSigma | ||
| ε-aminocaproic acid | Fisher | AAA1471936 |
Referenzen
- Hamada, H., Tsuruo, T. Purification of the 170- to 180-kilodalton membrane glycoprotein associated with multidrug resistance. 170- to 180-kilodalton membrane glycoprotein is an ATPase. Journal of Biological Chemistry. 263 (3), 1454-1458 (1988).
- Higgins, F., Hiles, D., Whalley, K., Jamieson, J. Nucleotide binding by membrane components of bacterial periplasmic binding protein-dependent transport systems. The EMBO Journal. 4 (4), 1033-1039 (1985).
- Higgins, F., et al. A family of related ATP-binding subunits coupled to many distinct biological processes in bacteria. Nature. 323 (6087), 448-450 (1986).
- Horio, M., Gottesman, M., Pastan, I. ATP-dependent transport of vinblastine in vesicles from human multidrug-resistant cells. Proceedings of the National Academy of Sciences of the United States of America. 85 (10), 3580-3584 (1988).
- Mimmack, L., et al. Energy coupling to periplasmic binding protein-dependent transport systems: stoichiometry of ATP hydrolysis during transport in vivo. Proceedings of the National Academy of Sciences of the United States of America. 86 (21), 8257-8261 (1989).
- Grundy, M. Absorption and Metabolism of Dietary Cholesterol. Annual Review of Nutrition. 3 (1), 71-96 (1983).
- Berge, E., et al. Accumulation of dietary cholesterol in sitosterolemia caused by mutations in adjacent ABC transporters. Science. 290 (5497), 1771-1775 (2000).
- Repa, J., et al. Regulation of ATP-binding cassette sterol transporters ABCG5 and ABCG8 by the Liver X receptors α and β. Journal of Biological Chemistry. 277 (21), 18793-18800 (2002).
- Yu, L., et al. Stimulation of cholesterol excretion by the Liver X receptor agonist requires ATP-binding cassette transporters G5 and G8. Journal of Biological Chemistry. 278 (18), 15565-15570 (2003).
- Yu, L., et al. Expression of ABCG5 and ABCG8 is required for regulation of biliary cholesterol secretion. Journal of Biological Chemistry. 280 (10), 8742-8747 (2005).
- Lütjohann, D., Björkhem, I., Beil, F., von Bergmann, K. Sterol absorption and sterol balance in phytosterolemia evaluated by deuterium-labeled sterols: effect of sitostanol treatment. Journal of Lipid Research. 36 (8), 1763-1773 (1995).
- Miettinen, A. Phytosterolaemia, xanthomatosis and premature atherosclerotic arterial disease: a case with high plant sterol absorption, impaired sterol elimination and low cholesterol synthesis. European Journal of Clinical Investigation. 10 (1), 27-35 (1980).
- Salen, G., et al. Sitosterolemia. Journal of Lipid Research. 33 (7), 945-955 (1992).
- Caffrey, M. Membrane protein crystallization. Journal of Structural Biology. 142 (1), 108-132 (2003).
- Michel, H. Crystallization of membrane proteins. Trends in Biochemical Sciences. 8 (2), 56-59 (1983).
- Dürr, N., Gildenberg, M., Ramamoorthy, A. The magic of bicelleslights up membrane protein structure. Chemical Reviews. 112 (11), 6054 (2012).
- Dürr, N., Soong, R., Ramamoorthy, A. When detergent meets bilayer: Birth and coming of age of lipid bicelles. Progress in nuclear magnetic resonance spectroscopy. 69 (1), 1-22 (2013).
- Dufourc, J. Bicelles and nanodiscs for biophysical chemistry. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1863 (1), 183478 (2021).
- Beaugrand, M., et al. Lipid concentration and molar ratio boundaries for the use of isotropic bicelles. Langmuir. 30 (21), 6162-6170 (2014).
- Sanders, R., Schwonek, P. Characterization of magnetically orientable bilayers in mixtures of dihexanoylphosphatidylcholine and dimyristoylphosphatidylcholine by solid-state NMR. Biochemistry. 31 (37), 8898-8905 (1992).
- Seddon, M., Curnow, P., Booth, J. Membrane proteins, lipids and detergents: not just a soap opera. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1666 (1-2), 105-117 (2004).
- Farhat, D., et al. Structural analysis of cholesterol binding and sterol selectivity by ABCG5/G8. Journal of Molecular Biology. 434 (20), 167795 (2022).
- Lee, J. Y., et al. Crystal structure of the human sterol transporter ABCG5/ABCG8. Nature. 533 (7604), 561-564 (2016).
- Ujwal, R., Bowie, U. Crystallizing membrane proteins using lipidic bicelles. Methods. 55 (4), 337-341 (2011).
- Johnson, H., Lee, J. Y., Pickert, A., Urbatsch, L. Bile acids stimulate ATP hydrolysis in the purified cholesterol transporter ABCG5/G8. Biochemistry. 49 (16), 3403-3411 (2010).
- Wang, Z., et al. Purification and ATP hydrolysis of the putative cholesterol transporters ABCG5 and ABCG8. Biochemistry. 45 (32), 9929-9939 (2006).
- Faham, S. Crystallization of bacteriorhodopsin from bicelle formulations at room temperature. Protein Science. 14 (3), 836-840 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten