Method Article
脂質バイセル環境下でのABCG5/G8結晶化によるX線結晶構造解析
要約
このプロトコルはステロールの運送者ABCG5/G8の結晶化のための組み立てを記述する。ABCG5/G8は、ハンギングドロップ結晶化のためにバイセルに再構成されます。このプロトコルは特殊な材料や基質を必要としないため、X線結晶構造解析によってタンパク質の構造を決定するために、あらゆる実験室でアクセスしやすく、簡単に適応できます。
要約
ATP結合カセット(ABC)トランスポーターは、脂質包埋膜タンパク質を構成します。これらの膜タンパク質を脂質二重層から水性環境に抽出するには、通常、界面活性剤を使用します。これらの界面活性剤は、脂質二重層を崩壊させ、タンパク質を可溶化します。脂質二重層内の膜タンパク質の本質的な生息地は、構造特性評価のために溶液中での安定性と均一性を維持する上で課題を提起します。長鎖および短鎖のリン脂質と界面活性剤のブレンドで構成されるバイセルは、天然の脂質構造を再現します。脂質バイセルと界面活性剤の利用は、特に膜タンパク質の高分解能構造を決定するために、高品質の回折結晶を得るための適切なモデルシステムとして機能します。これらの合成微小環境を通じて、膜タンパク質は本来の立体構造と機能を保持し、3次元結晶の形成を促進します。このアプローチでは、界面活性剤で可溶化したヘテロ二量体ABCG5/G8をDMPC/CHPSOビセルに再統合し、コレステロールを添加しました。このセットアップは、タンパク質結晶化のための蒸気拡散実験手順で採用されました。
概要
ATP結合カセット(ABC)トランスポーターは、生体膜を横切る多様なATP依存性輸送プロセスに関与する膜タンパク質のスーパーファミリーを構成しています1,2,3,4,5。これらのトランスポータータンパク質は心血管疾患に関与しており、その後の肝臓での排泄のために胆汁へのコレステロール流出を促進する上で重要な役割を果たします。その結果、コレステロールの代謝とバランスは、長年にわたってかなりの関心を集めてきました6。体内からのコレステロールおよび他のステロールの除去に関与する特定のメカニズムには、ヒトABCGサブファミリーのメンバー、特にヘテロ二量体ABCG5 / G8 7,8,9,10が関与しています。これらの遺伝子のいずれかの変異はヘテロ二量体を破壊し、機能の喪失につながり、ステロール輸送に影響を与える疾患であるシトステロレミアを引き起こします11,12,13。この疾患の関連性とコレステロール排出を促進する役割を考えると、ステロールトランスポーターは大きな注目を集めています。それにもかかわらず、それらの分子メカニズムと基質選択性の複雑な詳細は、ほとんど明らかにされていないままです。このように、ABCG5/G8の結晶構造の解明は、コレステロール輸送のメカニズムと下流機能を理解するための重要な一歩となります。
膜タンパク質は、正しく折りたたまれて機能するために膜内に固定する必要があります。その結果、自然環境から膜タンパク質を抽出すると、タンパク質が不安定になり、ミスフォールディングが発生し、機能が失われることがよくあります14,15。これらの課題は、膜タンパク質の結晶化で直面する主なハードルを浮き彫りにしています。しかし、この苦境の解決策として、タンパク質をバイセルのような合成界面活性剤二重層に再構成することが浮上し、天然のような二重層環境内で膜タンパク質を維持することを可能にしている16。バイセルは、合成リン脂質と界面活性剤の集合体であり、水に懸濁して可溶化されています。特筆すべきは、生体膜を模倣した二層構造を採用していることである16,17,18。バイセルは、温度と粘度に基づいて液相とゲル相の間を遷移できます。バイセル結晶化は、小さな二重層ディスクと低温での低粘度を利用して、タンパク質とバイセル溶液の完全な混合を促進します。バイセルのサイズは、調製中の界面活性剤と脂質の比率に依存します19,20。ビセル形成用の一般的な界面活性剤には、3-[(3-コラミドプロピル)ジメチルアンモニオ]-2-ヒドロキシ-1-プロパンスルホン酸塩(CHAPSO)、3-[(3-コールアミドプロピル)ジメチルアンモニオ]-1-プロパンスルホン酸塩(CHAPS)、および1,2-ジトリデカノイル-sn-グリセロール-3-ホスホコリン(DHPC)が含まれます21。これらの界面活性剤は、ジ-ミリストイル-ホスファチジルコリン(DMPC)や1-パルミトイル-2-オレオイル-ホスファチジルコリン(POPC)などの脂質と組み合わせて使用されます。さらに、最近の研究では、生理学的条件下でのバイセル内の膜タンパク質の完全な機能が実証されています。例えば、Leeらは脂質二重層に基づくABCG5/ABCG8の結晶構造の結晶化に成功し、報告した22,23。結晶化プロセスにおいて、タンパク質−ビセル混合物は、ハイスループット結晶化ロボット24を含む標準装置を用いて収容することができる。しかし、バイセルの利用可能性は、高温での結晶化条件によるタンパク質の熱安定性にかかっています。それにもかかわらず、他の技術と比較すると、膜タンパク質に必要な結晶化条件は一般に穏やかであり、低濃度の沈殿剤、塩、および緩衝液が含まれます。これにより、タンパク質-バイセル混合物と蒸気拡散の両方が、膜タンパク質の構造研究のための効果的で容易に実装可能なツールになります。
このプロトコルは高リゾリューション(図1)でABCG5/G8のX線の結晶構造を定めるための蛋白質の準備そしてbicelleの結晶化の必要なステップを概説する。
プロトコル
1. クローニングとタンパク質発現
- ヒトABCG5/G8遺伝子を以前のプロトコルに従ってピキア・パストリス酵母にクローニングする25,26。簡単に説明すると、pPICZBからpSGP18およびpLIC発現ベクターを誘導します。ライノウイルスの3Cプロテアーゼ部位とそれに続くカルモジュリン結合ペプチド(CBP)をコードするタグをABCG8 cDNA(pSGP18-G8-3C-CBP)のC末端に追加します。
- グリシン(His 6 GlyHis 6)で区切られた6-ヒスチジンタグをABCG5 cDNA(pLIC-G5-H12)のC末端に添加します。エレクトロポレーションを用いてプラスミドをピキア株KM71Hに共形質転換します。
注:使用したプラスミド、培地、バッファーの詳細については、 材料表 を参照してください。 - 形質転換酵母細胞をMD寒天プレート上で28°Cで増殖させます。
- グリシン(His 6 GlyHis 6)で区切られた6-ヒスチジンタグをABCG5 cDNA(pLIC-G5-H12)のC末端に添加します。エレクトロポレーションを用いてプラスミドをピキア株KM71Hに共形質転換します。
- 1〜2日後、10〜12個のコロニーを選択し、小規模培養用の50 mL遠心チューブを使用して、10 mLの最小グリセロール酵母窒素塩基(MGY)培地に接種します。
- 遠心分離管の蓋に3つの小さな穴を開けて、通気性を高めます。600 nm(OD600)での光学濃度が10に達するまで、250 rpmで一定に振とうしながら、28°Cで細胞を増殖させます。
注:細胞増殖には通常12〜24時間かかります。
- 遠心分離管の蓋に3つの小さな穴を開けて、通気性を高めます。600 nm(OD600)での光学濃度が10に達するまで、250 rpmで一定に振とうしながら、28°Cで細胞を増殖させます。
- 翌日、1 Lの滅菌MGY培地を採取し、2.4 Lフラスコで初代培養液を接種します。フラスコを28°Cのシェーカーインキュベーターで250rpmで24時間インキュベートします。
- pHを5〜6に維持するには、pHが安定するまで10%水酸化アンモニウム(NH4OH)を追加します。
- 培養液 1 L あたり 1 mL の純メタノール(0.1 %(v/v)メタノール)を添加して、pH を調整し、タンパク質発現を誘導します。
注:その後、培養液1リットルあたり5 mLの純粋なメタノール(0.5%(v / v)メタノール)を12時間ごとに合計36〜48時間細胞に供給します。 - 15,000 x g で4°Cで30分間遠心分離して細胞を回収します。
- 細胞ペレットを回収し、溶解緩衝液(0.33 M スクロース、0.3 M Tris-Cl pH 7.5、0.1 M アミノヘキサン酸、1 mM EDTA、および1 mM EGTA)に0.5 g/mLの濃度で再懸濁します。懸濁液は-80°Cで保管してください。 典型的には、1Lの培養細胞から30±5gの細胞塊を回収することができる。
注:細胞ペレットは冷凍庫に直接保存するか、メンブレン調製用の溶解バッファーに直ちに再懸濁してください。
2. ミクロソーム膜の作製
- 細胞を融解し、プロテアーゼ阻害剤(ロイペプチン 2 μg/mL、ペプスタチン A2 μg/mL、PMSF 2 mM、 材料表を参照)を添加します。
- 細胞をさらに溶解するには、25,000〜30,000psiで氷冷乳化剤またはマイクロフルイダイザー( 材料表を参照)を使用します。このプロセスを3〜4回繰り返します。
- 細胞破片を除去するための遠心分離機:3,500-4,000 x gで15分間スピンし、続いて15,000 x gで30分間2回目のスピンを行います。両方のスピンを4°Cに維持します。
- ミクロソーム膜小胞を単離するには、上清を超遠心チューブに移し、2,00,000 x g で4°Cで1.5時間超遠心分離します。
- メンブレンペレットを50 mLのバッファーA(50 mM Tris-Cl pH 8.0、100 mM NaCl、10%グリセロール)にダンスホモジナイザーを使用して再懸濁します。懸濁液は-80°Cで保管してください。
3. 蛋白質調製 - ヘテロ二量体の精製
- 凍結したミクロソーム膜を融解し、可溶化緩衝液を用いて濃度を4-6 mg/mLに調整します。バッファーには、50 mM Tris-HCl、pH 8.0、100 mM NaCl、10% グリセロール、1% (w/v) β-ドデシルマルトシド(β-DDM)、0.5% (w/v)コール酸、0.1 %(w/v)コレステリルヘミコハク酸(CHS)、5 mM イミダゾール、5 mM β-メルカプトエタノール(β-ME)、2 μg/mL ロイペプチン、2 μg/mL ペプスタチン A、2 mM PMSF が含まれている必要があります( 材料表を参照)。
注:同量のメンブレン調製物と可溶化バッファーを混合するか、プロテアーゼ阻害剤および還元剤を含まない2倍の可溶化バッファーを使用できます。緩衝液の沸騰を短くすることで、CHSを効率的に溶解することができます。精製には、4°Cで冷却した緩衝液のみを使用してください。- 混合物を中速で4°Cで1時間撹拌します。 これに続いて、室温(RT)で20〜30分間さらに攪拌します。
- 混合物を1,00,000 x g で4°Cで30分間遠心分離し、不溶性メンブレンを除去します。可溶化上清を回収し、20 mM イミダゾールと 0.1 mM TCEP を添加します。
- アフィニティーカラムクロマトグラフィー26:可溶化した上清をバッファーA(ステップ2.2.1)中で平衡化したNi-NTAビーズ(10〜15mL)( 材料表を参照)に一晩結合します。
注:これ以降は、泳動バッファーにグリセロールを使用することは避けてください。- 25 mM イミダゾールを含む 10 カラム容量のバッファー B (50 mM HEPES、pH 7.5、100 mM NaCl、0.1 % (w/v) β-DDM、0.05 % (w/v) コール酸塩、0.01 % (w/v) CHS、0.1 mM TCEP) でカラムを 2 回洗浄します。
- 50 mM イミダゾールを含むバッファー B の 10 カラム容量でカラムを洗浄します。
- バッファー C(バッファー B、200 mM イミダゾールを含む)を使用してタンパク質を溶出します。
- 溶出したタンパク質に 1 mM TCEP( 材料表を参照)と 10 mM MgCl2 を添加します。
- SDS-PAGEゲルで溶出したフラクションを検証し、正しいタンパク質サイズ26を確認します。
注:典型的なタンパク質収量(1st Ni-NTA):6 L培養あたり10〜20 mgのタンパク質。DDMは臨界ミセル濃度(CMC)の10倍または5倍(約0.01%)で使用してください。このプロトコルは0.1%DDMを採用しています。 - Ni-NTA 溶出からのピークフラクションを等量のバッファー D1(バッファー B と 1 mM CaCl 2、1 mM MgCl2)で希釈し、混合し、CBP 洗浄バッファー D1 で事前に平衡化した CBP カラム(3-5 mL)(材料表を参照)にタンパク質フラクションをロードします。
- バッファー D1 および D2(バッファー B、1 mM CaCl 2、1 mM MgCl2、0.1% (w/v) デシルマルトースネオペンチルグリコール(DMNG)、β-DDM なし)を含むバッファー B)を使用して界面活性剤を交換するために、CBP カラムで連続洗浄を行います。次に、D1:D2(3:1、v/v)の 3 カラム容量で洗浄します。第三に、D1:D2(1:1、v/v)の 3 カラム容量で洗浄します。4 番目のステップでは、3 カラム容量の D1:D2(1:3、v/v)で洗浄し、続いて 6-10 カラム容量の D2 で洗浄します。
- CBP カラムから 300 mM NaCl を 1 mL フラクションで CBP 洗浄バッファー D2 (合計 10 mL) に溶出します。溶出した画分を1〜2 mLに濃縮します。
注:典型的なタンパク質収量(1st CBP)は、6 L培養あたり5〜15 mgのタンパク質です。マルトースネオペンチルグリコール(MNG)界面活性剤は、4°Cでの精製タンパク質の貯蔵を強化します。 DMNGとLauryl MNG(LMNG)の両方が使用され、DMNGの方が優れたX線回折結晶が得られました。DMNGは臨界ミセル濃度(CMC)の10〜20倍、約0.003%で使用してください。このプロトコルでは、0.1%のDMNGを使用しました。CBP溶出液の一部分は、ゲルろ過クロマトグラフィー(ステップ4.4)によってさらに精製され、タンパク質のATPase活性を分析したり、透過型電子顕微鏡(TEM)で単分散性を評価したりできます。
4. 蛋白質の準備前結晶化の処置
- エンドグリコシダーゼH(Endo H、精製タンパク質10-15 mgあたり~0.2 mg)およびHRV-3Cプロテアーゼ(精製タンパク質10-15 mgあたり~2 mg)を用いて、N-結合型糖鎖およびCBPタグをそれぞれ切断します( 材料表を参照)。4°Cで一晩インキュベートします。
- Endo Hおよび3Cプロテアーゼのインキュベーション中に、プールされたタンパク質に対して還元的アルキル化を行います。まず、20 mM ヨードアセトアミド( 材料表を参照)と 4 °C で一晩インキュベートします。 これに続いて、氷上でさらに2 mMヨードアセトアミドと1時間のインキュベーションを行います。
注:このステップにより、タンパク質の保存が4°Cで最大1か月間さらに安定化します。 - 2本目のCBPカラム(1〜2 mL)を使用して、切断したCBPタグを分離します。このプロセスにはバッファー D2 を使用します。
注:典型的なタンパク質収量(2nd CBP)は、6 L培養あたり5〜10 mgのタンパク質です。 - CBPタグフリータンパク質をゲルろ過クロマトグラフィーで精製します。バッファーには、10 mM HEPES、pH 7.5、100 mM NaCl、0.1%(w/v)DMNG、0.05%(w/v)コール酸、および0.01%(w/v)CHSが含まれている必要があります。
注:典型的なタンパク質収量(ゲルろ過)は、6 L培養あたり2〜8 mgのタンパク質です。このステップでは、ゲルろ過中にDDMピーク(~65 kD)が見られないことから、DMNGへの界面活性剤交換が成功したことを示します。 - 還元的メチル化によりプールされたタンパク質画分を修飾します:20 mMのジメチルアミンボラン(DMAB、 材料表を参照)と40 mMのホルムアルデヒドをタンパク質に添加します。振動式シェーカーで4°Cで2時間インキュベートします。10 mM DMAB を添加します。
- 10 mM DMABの添加を含むステップ4.5を繰り返し、4°Cで一晩(12〜18時間)インキュベートします。
- 100 mM Tris-Cl、pH 7.5 を添加して反応を停止します。
- メチル化タンパク質を、100 mM Tris-Cl、pH 8.0、100 mM NaCl で平衡化した 2 mL の Ni-NTA カラムにロードします。
- 10 カラム容量の洗浄バッファー(10 mM HEPES、pH 7.5、100 mM NaCl、0.5 mg/mL DOPC:DOPE (3:1、w/w)、0.1% (w/v) DMNG、0.05% (w/v) コール酸、0.01% (w/v) CHS)を使用してカラムを洗浄します。
- 溶出バッファー(10 mM HEPES、pH 7.5、100 mM NaCl、200 mM イミダゾール、0.5 mg/mL DOPC:DOPE (1:1、w/w)、0.1%(w/v)DMNG、0.05%(w/v)コール酸、0.01%(w/v)CHS)を使用して、再活性化したタンパク質を溶出します。
注:典型的なタンパク質収量(2nd Ni-NTA)は、培養液6 Lあたり1〜5 mgのタンパク質です。 - タンパク質溶出液を、ステップ4.4で使用したバッファーと事前に平衡化したPD-10脱塩カラムに通します。
- 脱塩して再塩化したタンパク質をコレステロール(イソプロパノールまたはエタノールで調製)と一晩インキュベートし、最終濃度が~20 μMになるまでインキュベートします。
- 翌朝、4°Cで10分間、1,50,000 x g で超遠心分離することにより沈殿物を除去します。 上澄み液を採取します。
- 100 kDaカットオフ遠心濃縮器を使用して、タンパク質を最終濃度30〜50 mg/mLまで濃縮します。
- 卓上型冷蔵遠心分離機を使用して、4°Cで30分間、最高速度で沈殿剤を除去します。
- 上清を氷上4°Cに保ち、バイセルの結晶化条件を確立します。
注:濃縮タンパク質は、1週間以内に結晶成長に使用する必要があります。タンパク質を凍結しないでください。
5. バイセルにおけるタンパク質の結晶化
- DMPC 脂質と CHAPSO 界面活性剤を 3:1(w/w)の比率で 10% ビセル原液を調製します( 材料表を参照)。
注:CHAPSO は臨界ミセル濃度(CMC)の 5 倍(約 0.5%)で使用してください。これにより、タンパク質-バイセル混合物中のCMC周辺の界面活性剤濃度が維持されます(ステップ5.2)。- 脱イオン化H2O溶解界面活性剤(CHAPSO)を予備乾燥脂質(5モル%コレステロールと95モル%DMPCの混合物)に加えます。
注:クロロホルムでさまざまな脂質組成物を調製し、室温で窒素ガス流を使用してガラス試験管内で乾燥させます。 残留溶媒を真空チャンバーに一晩置き、薄い脂質層を形成して除去します。 - 水浴超音波処理装置を使用して脂質と界面活性剤を再懸濁します。
- 溶液が透明になるまで、連続的な電力を使用して氷冷水でバイセル混合物を超音波処理します。
注意: 聴覚保護具を使用し、混合物を液相に保つために十分な氷の供給を確保してください。 - 0.2 μmの遠心フィルターで未溶解成分を除去します( 材料表を参照)。
注:分注したバイセル溶液は-80°Cで保管してください。
- 脱イオン化H2O溶解界面活性剤(CHAPSO)を予備乾燥脂質(5モル%コレステロールと95モル%DMPCの混合物)に加えます。
- 10%のバイセル(ステップ5.1.4)とタンパク質(ステップ4.7.4)を1:4(v/v)の比率で穏やかに混合し、最終的なタンパク質濃度を5〜10 mg/mLにすることで、氷上でタンパク質/ビセル混合物を作成します。
- タンパク質とバイセルの混合物を氷上で30分間インキュベートします。
- 48ウェルプレートを用いた吊り下げ滴下蒸気拡散フォーマットで結晶化条件を設定します。
- 等量(0.5または1 μL)のタンパク質/ビセル混合物と、1.6 M-2.0 Mの硫酸アンモニウム、100 mM MES(pH 6.5)、0%-4% PEG 400、および1 mM TCEPを含む結晶化リザーバー溶液を混合します( 材料表を参照)。
注:各実験の前に、硫酸アンモニウム(1.6〜2.0 M)およびPEG 400(0%〜4%)を調整して、リザーバー溶液のマトリックスを作成します。 - 20°Cで結晶化するためにインキュベートします。
- 翌日、結晶化トレイをチェックして、カバーガラスが適切に密閉されていることを確認します。
- 少なくとも1日1回は結晶の成長を監視します。高品質の結晶は通常1〜2週間以内に現れ、50〜150μm x 20〜50μm x 2〜5μmを測定します。
注:結晶は、タンパク質濃度が低いと形成に時間がかかる場合があります。成熟した結晶は1ヶ月以内に収穫する必要があります。 - タンパク質結晶を0.2 Mのマロン酸ナトリウムに浸し、50 μmまたは100 μmのクライオループを使用して液体窒素中で急速凍結します。
注:X線回折計が利用可能な場合は、15〜30分のX線ビーム照射でいくつかの結晶をテストして、最大5 Åの回折を明らかにします。より高分解能の回折には、シンクロトロン光源が必要です。0.2 Mのマロン酸ナトリウムを凍結保護剤として使用すると、100 μm x 50 μm x 2 μmの結晶で、放射光X線で約90の回折像フレームを提供できます。
- 等量(0.5または1 μL)のタンパク質/ビセル混合物と、1.6 M-2.0 Mの硫酸アンモニウム、100 mM MES(pH 6.5)、0%-4% PEG 400、および1 mM TCEPを含む結晶化リザーバー溶液を混合します( 材料表を参照)。
結果
組換えABCハーフトランスポーターであるヒトABCG5およびABCG8は、 ピキア・パストリス 酵母で共発現しています。次に、酵母膜画分を遠心分離によって分画します。このプロトコルで概説されているように、ヘテロ二量体タンパク質はタンデムカラムクロマトグラフィーを使用して抽出されます。その後、化学的に前処理されたタンパク質をリン脂質/コレステロールビセルとインキュベートして結晶化します。精製および結晶化プロセスの概略図を 図 1 に示します。
精製されたタンパク質の単分散性を評価するために、0.01〜0.05 mg / mLのタンパク質を含むサンプルを1%〜2%酢酸ウラニルで染色します。次に、これらのサンプルをネガティブ染色TEMを使用して検査します(図2A)。凍結融解サイクルを経ずにタンパク質の安定性を評価するために、分析用ゲルろ過クロマトグラフィーが採用されています。この分析では、タンパク質の少量の等量アリコートを使用して、精製タンパク質の経時保存をモニタリングします(図2B)。4°Cで1週間インキュベーションした後、おそらく可溶性タンパク質凝集体が残留しているため、ピーク画分でタンパク質がわずかに失われる可能性があります。それにもかかわらず、全体的なタンパク質収量は結晶成長に十分なままです。ネガティブステインTEMおよび分析ゲルろ過クロマトグラフィーの使用は、特に異なる人工コンストラクトからの結晶化に対するタンパク質の適合性を評価するための標準的な方法です。
カラムクロマトグラフィープロセスの各ステップ、および結晶化前の化学処理後のタンパク質品質を評価するために、2 つの Ni-NTA カラム、2 つの CBP カラム、1 つのゲルろ過、および還元的アルキル化に対応するフラクションのアリコートを 10% SDS-PAGE ゲルにロードします(図 3)。さらに、アルキル化に利用されるのと同じ反応環境を、エチル水銀による水銀標識(EMTS)にも適用できますが、これは現在の研究の範囲を超えています。
偏光板を備えた卓上実体顕微鏡を使用して、結晶の成長を毎日監視します。成熟したデータ収集に適した結晶は、一般に50 μm x 100 μm x 2 μmの寸法に達します(図4)。結晶採取プロセスでは、より小さな結晶やクラスターは意図的に避けられます。
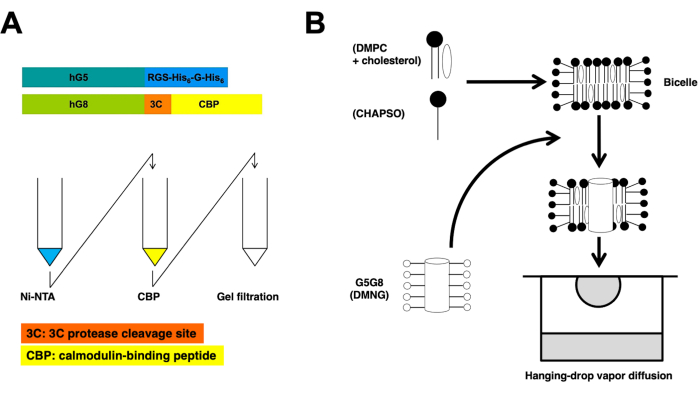
図1:ヘテロ二量体ABCG5/G8の精製(A)およびビセル結晶化(B)の概略図。 組換えヒトABCG5(hG5)およびABCG8(hG8)のコンストラクトは、それぞれRGS-H 6-G-H6および3C-CBPタグを有する(A、上)。タンデムアフィニティーカラムクロマトグラフィー、続いてゲルろ過クロマトグラフィーでヘテロ二量体精製を行います(A、下)。この図の拡大版をご覧になるには、ここをクリックしてください。
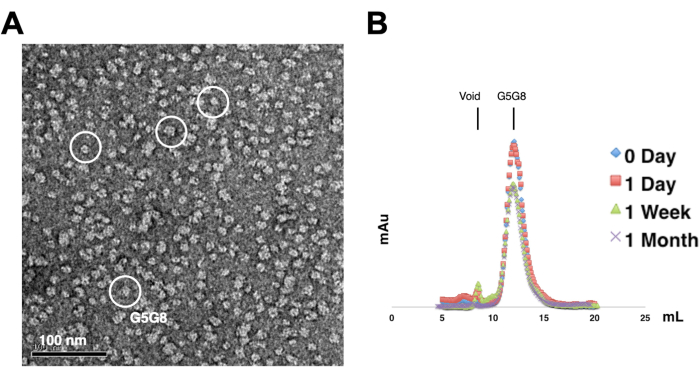
図2:精製タンパク質の単分散性(A)と安定性(B)の評価 。 (A)TEMを用いたネガティブ染色ABCG5/G8(G5G8)ヘテロ二量体の電子顕微鏡写真。代表的な粒子は、白い実線の円で強調表示されます。スケールバー = 100 nm。(B)4°Cで保存したアルキル化タンパク質を、1ヶ月かけて分析ゲルろ過クロマトグラフィーで分析し、1週間後にはタンパク質がわずかに失われます。 この図の拡大版をご覧になるには、ここをクリックしてください。
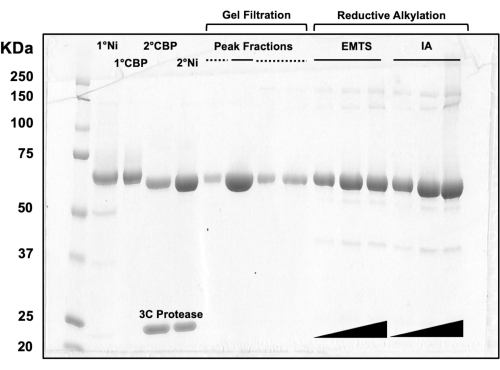
図3:カラムクロマトグラフィーおよび還元的アルキル化によるタンパク質溶出液のSDS-PAGE分析。 さまざまな容量(1〜10μL)のタンパク質画分を10%トリス/グリシンゲルにロードし、200Vの定電圧で45分間泳動しました。ゲルをクマシーブルーで染色し、脱色し、風乾し、卓上スキャナーでスキャンしました。1° & 2° Ni: 第 1 および第 2 Ni-NTA カラム。1° & 2° CBP:第1および第2CBPカラム。ピークフラクションの実線:結晶化のためのプールフラクション。ピークフラクション破線:ショルダーフラクション;EMTS:チオサリシニン酸水銀エチル;IA:ヨードアセダミド。 この図の拡大版をご覧になるには、ここをクリックしてください。
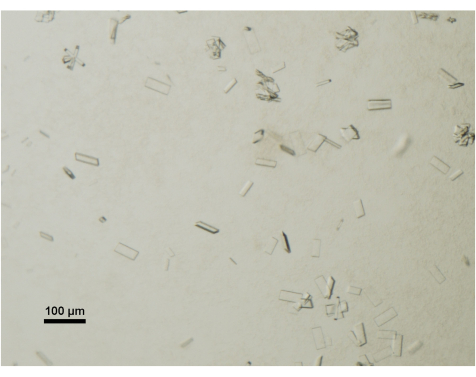
図4:光学顕微鏡によるタンパク質結晶成熟の評価。 結晶化滴からのABCG5/G8の成熟結晶を卓上および偏光子を備えた実体顕微鏡で可視化しました。スケールバー = 100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
膜タンパク質の結晶化に関連する課題は、ビセル27 や脂質立方晶相(LCP)14 アプローチなどの脂質二重層駆動結晶化法の開発を促しました。しかし、膜タンパク質の結晶化を成功させるには、タンパク質調製という重要かつ時にはボトルネックとなるステップが必要です。特に、ABCトランスポーターは、X線結晶構造解析に適した結晶を成長させる上で手ごわいハードルとなっています。このプロトコルは、ヒトABCG5/G8ステロールトランスポーターの調製を合理化し、バイセル結晶化アプローチを通じて結晶成長を促進するための包括的な実践的なガイダンスを提供します。
このプロトコルを考案する上での重要な考慮事項は、タンパク質精製の初期段階でかなりのタンパク質収量が必要であり、結晶化前処理中にある程度のタンパク質損失を可能にすることでした(図3)。この課題に対処するための一般的な戦略には、広範なタンパク質工学、多様な発現宿主の利用、オルソログまたはホモログの探索などのアプローチが含まれます。それにもかかわらず、この一見複雑な手順により、プロトコルの成功を支え、他のABCトランスポーターや膜タンパク質を一般的に研究する際に生じる可能性のある潜在的な制限についての洞察を提供するいくつかの重要なステップが特定されています。
まず、このプロトコルでは、タンパク質の凝集を最小限に抑えるために、各ステップで完全な遠心分離を行います。さらに、精製されたタンパク質の熱安定性を継続的にモニタリングすることも重要です。電子顕微鏡はタンパク質の単分散性を検証するために利用され、分析ゲルろ過はタンパク質の安定性を経時的に追跡します(図2)。円二色性(CD)や示差走査熱量測定(DSC)などの代替技術も組み込むことができます。さらに、精製されたABCG5/G8の活性と結晶形成の両方を最大化するためには、特定の段階での脂質の取り込みが不可欠です。例えば、コール酸とCHSは、測定可能なATP加水分解を示すために必要です。リン脂質はメチル化タンパク質の安定性を維持するために不可欠です。また、コレステロールはバイセル溶液の必須成分であり、高分解能X線回折に適した結晶成長を促進します(図4)。
要するに、1週間の努力ですべての手順を完了できるのです。LCPとは対照的に、吊り下げ式結晶化トレイからの結晶の取り出しは簡単です。将来を見据えて、実質的なタンパク質収量(約10 mg)により、このプロトコルはABCG5/G8変異体または他のトランスポータータンパク質を含む結晶学的研究の開発に容易に適応できます。これは、現在、電子顕微鏡による可視化を回避している症例に特に当てはまります。
開示事項
著者は開示するものを持っていません。
謝辞
この研究は、自然科学・工学研究評議会ディスカバリー助成金(RGPIN 2018-04070)およびカナダ衛生研究所研究プロジェクト助成金(PJT-180640)のJYLへの支援を受けています。このプロトコルはFarhat等22 および李等23によって先に報告されたABCG5/G8結晶構造の元のレポートに基づいている。
資料
| Name | Company | Catalog Number | Comments |
| ABCG5 | National Institute of Health collection | NCBI accession number NM_022436 | |
| ABCG8 | National Institute of Health collection | NCBI accession number NM_022437 | |
| ÄKTA FPLC system | Cytiva (formerly GE Healthcare Life Sciences) | ||
| CaCl2 | Wisent | 600-024-CG | Anhydrous |
| CBP | Agilent | 214303 | Calmodulin binding peptide affinity resin |
| Centrifugal concentrators (Vivaspin) | Sartorius | ||
| CHAPSO | Anatrace | C317 | Anagrade |
| Cholesterol | Anatrace | CH200 | |
| CHS | Steraloids | C6823-000 | |
| DMAB | MilliporeSigma | 180238 | 97% |
| DMNG | Anatrace | NG322 | |
| DMPC | Anatrace | D514 | |
| DOPC | Avanti | 850375 | |
| DOPC | Anatrace | D518 | |
| DOPE | Avanti | 850725 | |
| DTT | Fisher | BP172 | |
| Dual Thickness MicroLoops | MiTeGen | ||
| EDTA | BioShop | EDT003 | Disodium salt, dihydrate |
| EGTA | MilliporeSigma | 324626 | |
| Emulsifier (EmulsiFex-C3) | Avestin | ||
| Endo H | New England Biolabs | P0702 | |
| Ethanol | Greenfield | P016EAAN | Ethyl Alcohol Anhydrous |
| Formaldehyde | MilliporeSigma | 252549 | ACS Reagent |
| Glycerol | BioShop | GLY004 | |
| HEPES | BioShop | HEP001 | |
| HRV-3C protease | Homemade | ||
| Imidazole | BioShop | IMD510 | Reagent grade |
| Iodoacetamide | MilliporeSigma | I1149 | BioUltra |
| Isopropanol | Fisher | BP2618212 | |
| Leupeptin | BioShop | LEU001 | |
| MES | MilliporeSigma | 69892 | BioUltra |
| Methanol | Fisher | A412P | |
| MgCl2 | Wisent | 800-070-CG | Hydrated |
| microfluidizer (LM 20) | Microfluidics | ||
| NaCl | BioShop | SOD002 | |
| NH4OH | Fisher | A669-212 | ACS Reagent |
| Ni-NTA superflow | Qiagen | 30430 | Nickel-charged resins |
| PEG 400 | MilliporeSigma | 202398 | |
| Pepstatin | BioShop | PEP605 | |
| PMSF | MilliporeSigma | P7626 | |
| pSGP18 and pLIC | Homemade (derived from pPICZ, Invitrogen) | ||
| SDS | BioShop | SDS003 | |
| Sodium cholate | Fisher | 229101 | |
| Sodium malonate | MilliporeSigma | 63409 | |
| Sucrose | Wisent | 800-081-WG | Ultra pure |
| Superdex 200 30/100 GL | Cytiva (formerly GE Healthcare Life Sciences) | 28990944 | Prepacked gel-filtration column |
| TCEP | |||
| TEM | FEI, Technai | ||
| Tris Base | Fisher | BP152 | |
| β-DDM | Anatrace | D310S | Sol Grade |
| β-mercaptoethanol | MilliporeSigma | ||
| ε-aminocaproic acid | Fisher | AAA1471936 |
参考文献
- Hamada, H., Tsuruo, T. Purification of the 170- to 180-kilodalton membrane glycoprotein associated with multidrug resistance. 170- to 180-kilodalton membrane glycoprotein is an ATPase. Journal of Biological Chemistry. 263 (3), 1454-1458 (1988).
- Higgins, F., Hiles, D., Whalley, K., Jamieson, J. Nucleotide binding by membrane components of bacterial periplasmic binding protein-dependent transport systems. The EMBO Journal. 4 (4), 1033-1039 (1985).
- Higgins, F., et al. A family of related ATP-binding subunits coupled to many distinct biological processes in bacteria. Nature. 323 (6087), 448-450 (1986).
- Horio, M., Gottesman, M., Pastan, I. ATP-dependent transport of vinblastine in vesicles from human multidrug-resistant cells. Proceedings of the National Academy of Sciences of the United States of America. 85 (10), 3580-3584 (1988).
- Mimmack, L., et al. Energy coupling to periplasmic binding protein-dependent transport systems: stoichiometry of ATP hydrolysis during transport in vivo. Proceedings of the National Academy of Sciences of the United States of America. 86 (21), 8257-8261 (1989).
- Grundy, M. Absorption and Metabolism of Dietary Cholesterol. Annual Review of Nutrition. 3 (1), 71-96 (1983).
- Berge, E., et al. Accumulation of dietary cholesterol in sitosterolemia caused by mutations in adjacent ABC transporters. Science. 290 (5497), 1771-1775 (2000).
- Repa, J., et al. Regulation of ATP-binding cassette sterol transporters ABCG5 and ABCG8 by the Liver X receptors α and β. Journal of Biological Chemistry. 277 (21), 18793-18800 (2002).
- Yu, L., et al. Stimulation of cholesterol excretion by the Liver X receptor agonist requires ATP-binding cassette transporters G5 and G8. Journal of Biological Chemistry. 278 (18), 15565-15570 (2003).
- Yu, L., et al. Expression of ABCG5 and ABCG8 is required for regulation of biliary cholesterol secretion. Journal of Biological Chemistry. 280 (10), 8742-8747 (2005).
- Lütjohann, D., Björkhem, I., Beil, F., von Bergmann, K. Sterol absorption and sterol balance in phytosterolemia evaluated by deuterium-labeled sterols: effect of sitostanol treatment. Journal of Lipid Research. 36 (8), 1763-1773 (1995).
- Miettinen, A. Phytosterolaemia, xanthomatosis and premature atherosclerotic arterial disease: a case with high plant sterol absorption, impaired sterol elimination and low cholesterol synthesis. European Journal of Clinical Investigation. 10 (1), 27-35 (1980).
- Salen, G., et al. Sitosterolemia. Journal of Lipid Research. 33 (7), 945-955 (1992).
- Caffrey, M. Membrane protein crystallization. Journal of Structural Biology. 142 (1), 108-132 (2003).
- Michel, H. Crystallization of membrane proteins. Trends in Biochemical Sciences. 8 (2), 56-59 (1983).
- Dürr, N., Gildenberg, M., Ramamoorthy, A. The magic of bicelleslights up membrane protein structure. Chemical Reviews. 112 (11), 6054 (2012).
- Dürr, N., Soong, R., Ramamoorthy, A. When detergent meets bilayer: Birth and coming of age of lipid bicelles. Progress in nuclear magnetic resonance spectroscopy. 69 (1), 1-22 (2013).
- Dufourc, J. Bicelles and nanodiscs for biophysical chemistry. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1863 (1), 183478 (2021).
- Beaugrand, M., et al. Lipid concentration and molar ratio boundaries for the use of isotropic bicelles. Langmuir. 30 (21), 6162-6170 (2014).
- Sanders, R., Schwonek, P. Characterization of magnetically orientable bilayers in mixtures of dihexanoylphosphatidylcholine and dimyristoylphosphatidylcholine by solid-state NMR. Biochemistry. 31 (37), 8898-8905 (1992).
- Seddon, M., Curnow, P., Booth, J. Membrane proteins, lipids and detergents: not just a soap opera. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1666 (1-2), 105-117 (2004).
- Farhat, D., et al. Structural analysis of cholesterol binding and sterol selectivity by ABCG5/G8. Journal of Molecular Biology. 434 (20), 167795 (2022).
- Lee, J. Y., et al. Crystal structure of the human sterol transporter ABCG5/ABCG8. Nature. 533 (7604), 561-564 (2016).
- Ujwal, R., Bowie, U. Crystallizing membrane proteins using lipidic bicelles. Methods. 55 (4), 337-341 (2011).
- Johnson, H., Lee, J. Y., Pickert, A., Urbatsch, L. Bile acids stimulate ATP hydrolysis in the purified cholesterol transporter ABCG5/G8. Biochemistry. 49 (16), 3403-3411 (2010).
- Wang, Z., et al. Purification and ATP hydrolysis of the putative cholesterol transporters ABCG5 and ABCG8. Biochemistry. 45 (32), 9929-9939 (2006).
- Faham, S. Crystallization of bacteriorhodopsin from bicelle formulations at room temperature. Protein Science. 14 (3), 836-840 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved