Method Article
Ex Vivo (体外 )黑色素瘤患者脑脊髓液中循环肿瘤细胞的培养以研究黑色素瘤相关的软脑膜疾病
摘要
本文描述了一种从黑色素瘤相关软脑膜病 (M-LMD) 患者收集的脑脊髓液循环肿瘤细胞 (CSF-CTC) 的增殖方案,以开发研究 M-LMD 的临床前模型。
摘要
黑色素瘤相关软脑膜病 (M-LMD) 发生在循环肿瘤细胞 (CTC) 进入脑脊髓液 (CSF) 并定植于脑膜(保护大脑和脊髓的膜层)时。一旦确定,M-LMD 患者的预后很差,总生存期从数周到数月不等。这主要是由于我们对这种疾病的了解不足,因此缺乏有效的治疗方案。定义 M-LMD 的基础生物学将显著提高为 M-LMD 治疗调整可用疗法或为这种普遍致命的疾病设计新型抑制剂的能力。然而,一个主要障碍在于从患者来源的 CCF (CSF-CTC) 中获得足够数量的 CTC 以进行临床前实验,例如分子表征、功能分析和 体内 疗效研究。 体外 培养 CSF-CTC 也被证明是具有挑战性的。为了解决这个问题,开发了一种用于 体外 和 体内 培养患者来源的 M-LMD CSF-CTC 的新方案。发现掺入人脑膜细胞 (HMC) 产生的条件培养基对该程序至关重要。细胞因子阵列分析显示,HMC 产生的因子,如胰岛素样生长因子结合蛋白 (IGFBP) 和血管内皮生长因子-A (VEGF-A),在支持 CSF-CTC 离体存活方面很重要。在这里,分离的患者来源的 CSF-CTC 细胞系在确定靶向胰岛素样生长因子 (IGF) 和丝裂原活化蛋白激酶 (MAPK) 信号通路的抑制剂的疗效方面得到了证明。此外,还显示了在 体内 鞘内接种这些细胞以建立 M-LMD 小鼠模型的能力,该模型可用于已批准或新疗法的临床前测试。这些工具可以帮助揭示驱动脑膜中 CSF-CTC 建立的潜在生物学因素,并确定降低与 M-LMD 相关的发病率和死亡率的新疗法。
引言
当循环肿瘤细胞 (CTC) 播散到脑脊髓液 (CSF) 中并在脑膜(大脑和脊髓周围的膜)中建立时,就会发生软脑膜病 (LMD) 1,2。LMD 可发生在多种癌症中,但在黑色素瘤中尤其普遍。在黑色素瘤的晚期,大约 5% 的患者会出现与黑色素瘤相关的 M-LMD 2,3。虽然相对于其他转移部位相对较低,但 M-LMD 的后果是毁灭性的,总生存期从数周到数月不等,并且是导致患者发病率的重要因素 1,3,4。这主要是由于缺乏有效的治疗方案,以及我们对软脑膜如何被黑色素瘤细胞定植的知识存在重大差距2。因此,了解 M-LMD 的生物学将有助于设计新的疗法以改善临床结果。
最近的报告显示了 CTC 如何在独特的 CSF 微环境中定植。例如,补体 C3 通过脉络丛促进肿瘤细胞侵入脑脊液,脉络丛是大脑每个脑室中错综复杂的血管网络5。此外,为了应对 CSF 中稀缺的微量营养素,CTC 可以上调脂质运载蛋白-2(一种铁清除蛋白)及其受体SLC22A17以提高生存率6。使用基于组学的 CSF 分析,我们小组还发现 CSF 富含调节胰岛素样生长因子 (IGF) 信号传导以及先天免疫的蛋白质3。总之,这些数据强调了液体活检中 CSF-CTC 对研究 M-LMD 的价值。
虽然有时可以通过腰椎穿刺、Ommaya 储液器或快速尸检对患者 CSF 进行采样来识别 CSF-CTC,但一个主要限制是获得足够数量的这些稀有和脆弱细胞 1,7。例如,使用 CTC 计数技术,每个患者 CSF 样本只能识别数百到数千个肿瘤细胞7,这使得在体外或体内进行分子和功能分析变得困难。尽管有报道称从外周血(即乳腺癌 CTC)中短暂生长出体外 CTC 的成功8,9,10,但这些细胞通常只在短期内生长,并且没有报道能够在 CSF 中培养黑色素瘤 CTC 的病例。因此,寻找传播黑色素瘤 CSF-CTC 或一般 CTC 的方法将非常有利于研究 M-LMD的生物学 7,11。
首次描述了一种从体外 M-LMD 患者繁殖 CSF-CTC 的新技术。在本报告的此处,制定了一个详细的方案,允许从 M-LMD 患者培养和扩增 CSF-CTC。由于脑膜分泌多种生长因子,如 FGF、IGF、VEGF-A 和 IGFBP,这些因子支持其周围环境的生长 12,13,14,15,16,因此 CSF-CTC 可能需要这些成分在离体条件下生长是合理的。因此,该方案使用通过在体外培养人脑膜细胞 - (HMC-) 产生的条件培养基。对于体内接种,将患者来源的细胞接种到免疫缺陷小鼠中,以产生患者来源的 CSF-CTC (PD-CSF-CTC) 系。患者来源的 M-LMD 细胞的可用性将支持细胞、分子和功能测定,以研究 M-LMD 并为这种致命疾病提出新的治疗策略。
研究方案
南佛罗里达大学机构审查委员会 (IRB) (MCC 50103、50172 和 19332) 批准了去识别化患者 CSF 标本的采集。M-LMD 患者的诊断方式多种多样,包括 CSF 细胞学阳性、脑部和/或脊柱特征性磁共振成像 (MRI) 或临床表现与提示性 MRI 结果的组合。这些 M-LMD 患者的 CSF 作为其标准临床护理的一部分被常规收集。除非有临床指征,否则不进行任何手术。获得患者的知情同意,用于样本采集并将其用于研究和发表。 体内 小鼠-LMD 模型的生成已获得南佛罗里达大学机构动物护理和使用委员会 (IACUC# IS00010398) 的批准。该协议的总体方案总结在 图 1 中。材料 表中列出了研究中使用的试剂和设备的详细信息。
1. HMC 条件培养基的制备
- 用 2 μg/cm2 的聚-L-赖氨酸预涂 T175 培养瓶。
- 将烧瓶置于 37 °C 培养箱中 1 小时。
- 使用无菌血清移液管吸出聚-l-赖氨酸溶液。它不需要冲洗培养瓶,可用于 HMC 培养。
- 在 30 mL 完全脑膜培养基 (MenCM) 中培养大约 1.0 x 106 个 HMC,每个烧瓶含有 5% 胎牛血清、1% 脑膜细胞生长补充剂和 100 I.U./mL 青霉素-链霉素抗生素溶液。在细胞培养箱中,在 37 °C 和 5% CO2 的标准组织培养条件下培养细胞。
- 每 3 天更换一次媒体。
- 当细胞达到大约 75%-80% 汇合时,收集并保存在 50 mL 锥形管中 HMC 培养基。
- 如果需要更多的 HMC 培养基,将 HMC 分液到新的 T175 培养瓶和新鲜的完全 MenCM 中。
- 向 HMC 培养培养基中,添加 1:1 比例的完整 MenCM。
- 添加 20 ng/mL 成纤维细胞生长因子 (FGF) 和 20 ng/mL 表皮生长因子 (EGF),它们将成为 CSF-CTC 的 HMC 条件培养基。
注:建议在 CTC 准备好进行培养时添加新鲜的 FGF 和 EGF。 - 将 HMC 条件培养基以 50 mL 等分试样储存在 4 °C 下。
注:建议将等分试样的 HMC 条件培养基储存在 4 °C 但不要超过 4 周。
2. CSF 的采集和样本处理
- 将其设置为 4 °C 预冷离心机。
- 从患者身上抽取后,立即将 CSF 样品放入冰上的 15 mL 锥形管中以保持冷却。
注意:我们的 IRB 批准的方案允许从同意的患者中提取 7.5 mL CSF。 - 将 CSF 在 4 °C 下以 257 x g 离心 5 分钟。
- 去除、保存和制备 CSF 上清液的等分试样,而不会干扰底部的细胞沉淀。如果需要,CSF 上清液等分试样可以在 -80 °C 下冷冻保存以供进一步分析。
注意:肉眼可能无法看到颗粒;因此,建议在试管底部留下 ~40-50 μL。 - 在同一管中,加入 1 mL 无菌磷酸盐缓冲盐水 (PBS) 以重悬和冲洗细胞,并在 4 °C 下以 257 x g 重复旋转 5 分钟。
注:(可选)如果样品中含有血液污染,则进行红细胞 (RBC) 裂解。但是,请记住,在此过程中可能会丢失一些细胞,包括 CTC。CTC 可以在没有 RBC 裂解程序的情况下繁殖。 - 去除并丢弃 PBS,不干扰细胞沉淀,在底部留下 ~50 μL。
- 进行细胞计数以确定细胞活力。从这里开始,有两种选择可以继续培养 CSF-CTC: 体外 培养(第 3 步)或尝试 体内 患者来源的异种移植扩增(第 4 步)。
注:如果稍后要培养 CSF-CTC,请将细胞冷冻保存在细胞培养冷冻培养基中,直到准备好繁殖。细胞培养冻存培养基可以使用 90% FBS + 10% DMSO 制成。如果有过量的 CSF(即,从患者那里收集了不止一个 CSF 或在尸检时收集了 CSF),可以通过提交样本进行 CTC 计数测定17 或黑色素瘤标志物(即抗 MLANA)的免疫荧光 (IF) 染色来评估 CTC,这可能提供有关 CTC 数量和活力的见解。进行这些实验后无法回收细胞。因此,如果没有患者的后备 CSF 样本,则不建议这样做。
3. CSF-CTCs 的 体外 培养和扩增
- 在 HMC 条件培养基中重悬 CSF-CTC。如果 CSF-CTC 被冷冻保存,请解冻细胞,旋转它们,然后用 PBS 轻轻洗涤它们。
- 将所有细胞分成一式三份的孔,在 96 孔板中,每孔体积为 150 μL。只有活细胞会在一夜之间轻轻粘附在表面。
注意:每个患者样本的 CSF-CTC 数量可能差异很大(表 1)。对于 CTC 计数低的患者,以 96 孔板作为培养起点,由于担心丢失 CTC,不计数即可将整个沉淀板接种。但是,如果有大量 CSF(即从尸检中获得),则可以对细胞进行计数。并非所有肿瘤细胞都可以在 体外生长;有些会在变成静止之前缓慢膨胀几次。目前, 离体 培养黑色素瘤 CSF-CTC 的成功几率约为 60%7。 - 每 3 天加入新鲜的 HMC 条件培养基加满,或将移液器吸头放在孔的一侧轻轻去除培养基,留下一些液体而不干扰孔底,然后用新鲜的 HMC 条件培养基更换。
- 当 离体 CSF-CTC 扩增并达到 90% 汇合时,胰蛋白酶消化并将整个孔转移到 24 孔板中的新孔中。当 24 孔中的孔汇合时,将其转移到 12 孔板,然后转移到 6 孔板,依此类推。
注:胰蛋白酶消化后,考虑在细胞培养冷冻培养基 (10% DMSO + 90% FBS) 中冷冻保存一小部分 CTC 作为备用。 - 继续培养 CTC。一些细胞可能会短期繁殖并最终变成静态的。然而,一个或多个克隆可能会呈指数级转化和扩增(图 2A)。选择这些克隆,它们将成为 体外 患者来源的 CSF-CTC (PD-CSF-CTC) 培养物。
注:如果这些克隆变得过度拥挤或成簇,请将细胞胰蛋白酶消化并重新接种在新鲜的组织培养板/培养瓶中。
4. CSF-CTC 体内接种以生成细胞系来源的异种移植物 (CDX) 或患者来源的异种移植物 (PDX) 模型
注意:PDX模型涉及直接从癌症患者植入癌细胞(无需 离体 培养),而CDX模型使用癌细胞系,或者在这种情况下,使用已经繁殖和永生化的CTC18。
- 使用 6-8 周雌性免疫缺陷型 NOD SCID γ (NSG) 小鼠接种 CSF-CTCs。使用 NSG 是因为它们存在严重的免疫缺陷,并且对人肿瘤细胞植入的接受性很强19。由于免疫缺陷,这些小鼠应饲养在严格控制的卫生环境中,并应与其他小鼠品系隔离饲养。渲染 murine-LMD 的方法已在其他地方详细描述过 20。
注意:离 体 细胞(仅在步骤 2 中处理且未培养的患者 CSF-CTC)用于生成 PDX 模型;需要对动物进行物理观察和脑部 MRI 以确定 LMD 进展。另一方面,使用体外 CDX 模型 , 可以用荧光素酶报告基因标记 PD-CSF-CTC,并且可以通过生物发光成像 (BLI) 评估 LMD 的状态。本报告中使用的细胞标记系统是利用呋喃嗪作为底物的 NanoLuc (NL) 报告基因,它已被证明可以提高与肿瘤生长成比例的敏感性21。未观察到 NL 表达对 CTC 细胞生长 (体外 或 体内) 的干扰。 - 使用以下方法检查 LMD 进展的迹象:身体观察:体重减轻、头部倾斜和驼背。MRI:脑室扩大和脑积水迹象(图2B)。BLI:CNS 区域的阳性生物发光信号(图 2C)。
5. 从具有 LMD 的小鼠中收集 CSF 用于后续克隆扩增
- 用含 4% 异氟醚的 LMD 麻醉 NSG 小鼠(遵循机构批准的方案),直到它没有显示扶正反射的迹象。
- 通过剃掉头部整个腹面的皮毛来准备小鼠,并使用无菌技术准备皮肤。
- 使用立体定向装置的改良 L 形鼻锥定位鼻子,确保鼻孔畅通无阻。用胶带轻轻地将皮肤向前拉过两个耳廓的腹面,将其固定在鼻锥上,然后在固定后将颈部弯曲成大约 90° 角,从而固定皮肤。施用 1.5%-3% 异氟醚以维持麻醉。
- 完全伸展颈部并从耳廓之间开始,以轻微的压力引导手术剪刀尖端向下穿过枕骨。
注意:在这个中线位置,当剪刀尖端进入大水箱上方的凹陷区域时,可以辨别出一个微妙的凹陷。 - 在触诊的凹面上方创建一个 5-7 毫米的小中线切口。
- 使用带有 1-2 毫米尖端的钝头镊子轻轻地对大池施加压力。将尖端置于闭合位置并打开它们,同时对硬脑膜施加向下的压力。
- 重复步骤 6 中概述的钝性解剖过程,直到清晰可辨出硬脑膜,并且在暴露区域内可以看到相关的血管。
- 在保持镊子打开以缩回周围肌肉组织的同时,将一根 27-29 G 针头插入硬脑膜下方的 1 mL 注射器上,以观察斜面。确保针头刚好穿透斜面。逐渐缩回注射器柱塞。
- 在小鼠安乐死之前,尽可能多地收集 CSF(通常在 15-30 μL 之间)。
注意:安乐死是按照机构批准的协议完成的,方法是将对象暴露在浓度不断升高的压缩 CO2 气体中。例如,将采用每分钟腔室容积的 30% 到 70% 的位移率来防止或减少不适或痛苦。然后通过在室内空气中长时间观察超过 10 分钟,确保心血管和呼吸运动停止。 - 将注射器中的 CSF 部署到微量离心管中,并将其放在冰上。
- 将样品在 4 °C 下以 257 x g 旋转 5 分钟,然后轻轻除去液体(如果需要进一步分析,将小鼠 CSF 样品在 -80 °C 下冷冻),而不会干扰细胞沉淀。
- 加入 500 μL 无菌 PBS 并洗涤细胞沉淀;在室温下以 257 x g 重复旋转 5 分钟。
- 在 96 孔板中的 HMC 条件培养基中重悬细胞。
注意:已在 体内 植入并成功生长到 LMD 中的 CSF-CTC 应该能够像正常细胞培养物一样生长。通过每 3 天更换一次媒体来继续扩展。当细胞汇合时,用胰蛋白酶消化细胞并将其转移到更大的细胞培养装置中。这些细胞将成为 体内 PD-CSF-CTC 培养物。在目前的报告中,CDX 模型的成功率为 100%,并且尚未生成 PDX M-LMD。
结果
了解 CSF-CTC 离体成功生长的要求是一项持续的努力。为此,人们认为提供模拟 CSF 微环境的基本因子至关重要22。人脑膜细胞 (HMC) 将多种生长因子分泌到 CSF 中,包括 FGF-2、EGF、IGFBP2 和 IGFBP6,并且已知支持 CTC 细胞的生长 12,13,14,23,24。因此,对 HMC 条件培养基进行人细胞因子阵列分析,以确定 CTC 存活所需的潜在重要成分。事实上,几种生长因子在用 HMC 培养的培养基中上调(图 3A)。例如,粒细胞-巨噬细胞集落刺激因子 (GM-CSF)、VEGF-A 和 IGFBP(IGFBP2、3、4 和 6)。
来自患者的 CSF 细胞成分可能由多种细胞类型组成,例如 CTC、免疫细胞和成纤维细胞。非 CTC 最终将停止加班。通常,成功增殖并保持增殖状态的细胞是癌症 (M-LMD) 细胞。验证培养物中生长的细胞确实是 M-LMD 细胞,这可以通过 IF 检测 MLANA 表达和转录组学分析来完成,这之前已经显示7。
作为显示已建立的体外和体内 PD-CSF-CTC 系的潜在用途和应用的概念验证,使用了单细胞 RNA 测序 (scRNA-seq) 分析,结果揭示了从未培养的患者 CSF-CTC 中富集和保留的几个基因7。其中两种包括受体酪氨酸蛋白激酶 ErbB3 和 IGF-1R,它们对黑色素瘤进展和化疗耐药性有影响 25,26,27。
为了测试它们是否在 CSF-CTC 存活中发挥作用,对用 FDA 批准的药物 tucatinib 和 ceritinib 处理的 PD-CSF-CTC 进行了结晶紫增殖试验,分别靶向 ErbB28 和 IGF-1R 7,29。抗 IGFBP2 抗体作为阳性对照,应阻碍 PD-CSF-CTC 培养物的生长。结果表明,IGFBP2 或 IGF-1R 的缺失可有效减少 PD-CSF-CTCs 的增殖(图 3B)。鉴于 MAPK 信号传导位于 IGF-1R 的下游,还通过用塞里替尼或 MAPK 抑制剂、达拉非尼和曲美替尼或所有三种的组合处理,在三个 M-LMD PD-CSF-CTC 系中进行了钙黄绿素-AM 活细胞染色和 MTT 细胞存活测定。数据表明,塞瑞替尼显着降低了所有三种细胞系的活力,而达拉非尼和曲美替尼则具有混合效应(图 3C)。debrafenib 和 trametinib 治疗的结果令人惊讶。所有 3 个 PD-CSF-CTC 系均来源于携带 BRAFV600E 突变的 M-LMD 患者7。这可能表明 CSF-CTCs 的获得性化疗耐药效应,这是未来需要研究的事情。
接下来,作为如何在 体内利用 PD-CSF-CTCs 的一个例子,通过鞘内接种不同数量的 PD-CSF-CTC 来建立小鼠-M-LMD 模型。确定小鼠的中位生存时间(图 3D)。为了可视化 M-LMD 进展,用生物发光标记物(例如 NL 报告基因系统21)标记 PD-CSF-CTC 线,并通过 BLI 捕获(图 2C)。使用免疫组织化学也证明了 LMD 转移的位置,其中蛋白质黑色素 A (MLANA)30 作为黑色素瘤细胞的标志物(图 3E)。作为在 体内测试 M-LMD 治疗策略的概念验证,小鼠-M-LMD 队列每天口服塞瑞替尼或曲美替尼的单一疗法,或达拉非尼和曲美替尼或塞利替尼和曲美替尼的组合。对照组(未治疗)接受口服生理盐水作为比较。结果显示,在接受色瑞替尼和曲美替尼治疗的队列中,生存率显著延长(图 3F)和疾病检测延迟(图 3G)(未经治疗的 M-LMD 中位生存期:28.5 天 与色瑞替尼和曲美替尼治疗的 M-LMD 中位生存期:38.5 天; P 值 = 0.0052)。这些数据强调了开发的 M-LMD PD-CSF-CTC 细胞系在进行临床前研究以确定新疗法疗效方面的潜在用途。
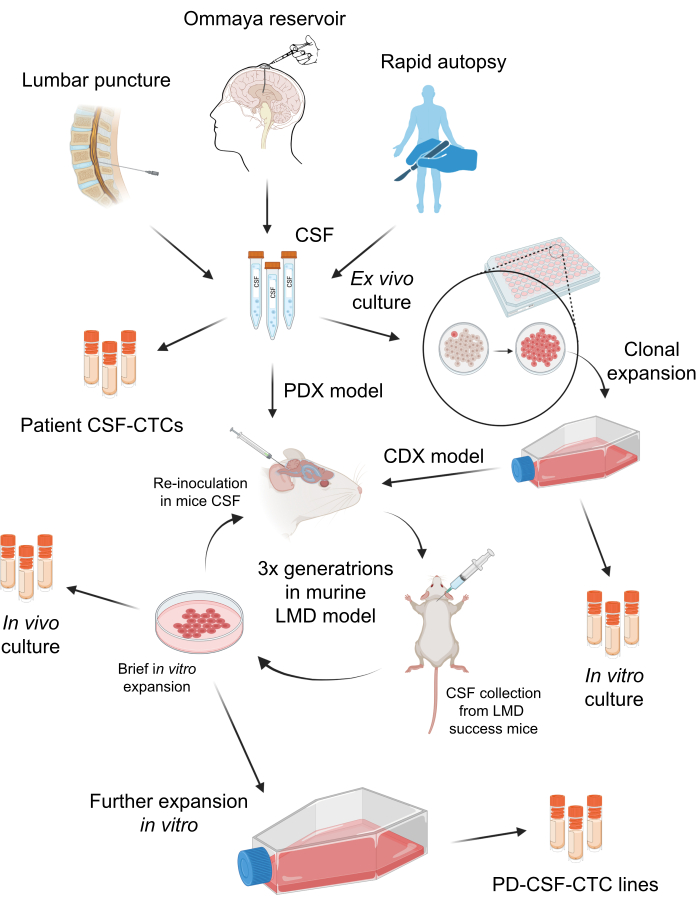
图 1:建立患者来源的 CSF 循环肿瘤细胞 (PD-CSF-CTC) 的过程示意图概述。 可以通过 腰椎 穿刺、Ommaya 储液器或快速尸检对患者的 CSF 进行采样。通过一系列 体外 和 体内 繁殖,每个步骤都会产生中间体 CSF-CTC 培养物(即患者 CSF-CTC、 体外 培养、 体内 培养),直到建立 PD-CSF-CTC 系。 请单击此处查看此图的较大版本。
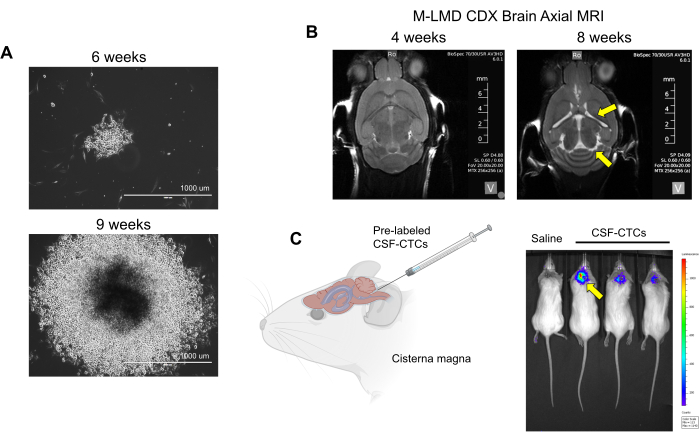
图 2:来自 M-LMD 患者的 CSF-CTC 的 体外 和 体内 培养示例。 (A) 代表性明场图像显示 M-LMD CSF-CTC 集落在 HMC 条件培养基中 6 周和 9 周的 体外 生长。比例尺:1000 μm。(B) 鞘内接种 PD-CSF-CTCs 后 4 周和 8 周的 MRI 图像;成功建立了 M-LMD 的小鼠模型。黄色箭头指向这只 M-LMD 小鼠的脑室扩大和可能的脑积水。(C) 小鼠 M-LMD 发育的代表性 BLI 可视化。该图改编自 Law et al.7。 请单击此处查看此图的较大版本。
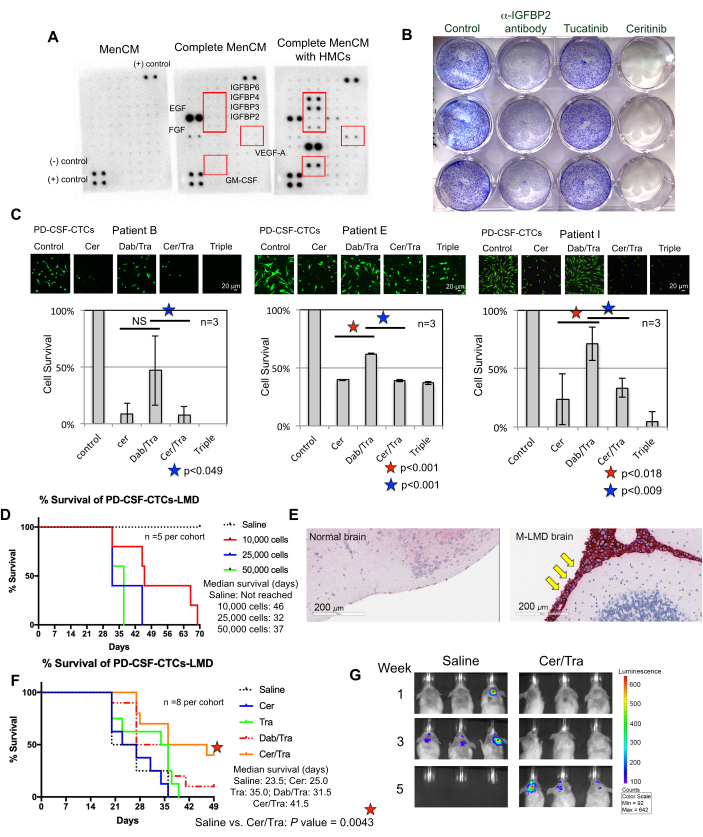
图 3:PD-CSF-CTC 细胞系用于研究 M-LMD 的各种临床前实验。 (A) 人细胞因子阵列显示,在人脑膜细胞 (HMC) 存在下,培养基 (MenCM) 中不同分泌的生长因子(即 IGFBP、VEGF-A 和 GM-CSF)增加。(B) 结晶紫细胞增殖测定的扫描图像,以确定抗 IGFBP2 抗体、图卡替尼和塞瑞替尼对其中一种 PD-CSF-CTC 系的疗效。对照条件给予载体处理。实验一式三份进行。(C) 三种不同的已建立的 PD-CSF-CTC 系(来自患者 09、12 和 16) 的体外细胞存活测定。细胞用塞瑞替尼 (cer)、达拉非尼 (dab) + 曲美替尼 (tra) 的组合、cer + tra 或三种药物处理。在处理后 72 小时收集细胞。钙黄绿素-AM 染色用于观察细胞活力,并使用 MTT 测定来确定细胞存活。采用配对样本 t 检验进行统计分析。比例尺:20 μm。(D) 小鼠 M-LMD 模型的生存曲线。在 10,000、20,000 和 50,000 个细胞中(通过 磁池)用其中一种 PD-CSF-CTC 细胞系鞘内接种 NSG 小鼠。确定 M-LMD 小鼠的中位生存期。(E) 在 M-LMD 小鼠的脑切片中对黑色素瘤标志物 MLANA 的 IHC 检测。在脑膜中发现阳性 MLANA (染红;用黄色箭头指向),而正常 (健康) 大脑没有显示癌症生长 (MLANA 阴性)。比例尺:200 μm。(F) 小鼠 M-LMD 队列的代表性疗效实验,每日口服生理盐水、cer、tra、dab/tra 或 cer/tra。确定小鼠的存活率。采用对数秩 (Mantel-Cox) 检验进行统计分析。(G) 5 周内 M-LMD 进展的代表性 BLI 图像,比较对照(生理盐水)治疗 与对照组。cer/tra 治疗的小鼠 M-LMD 队列。图的面板 (C) 改编自 Law et al.7。 请单击此处查看此图的较大版本。
表 1:M-LMD 患者离体培养获得的临床 CSF-CTC 总结。11 例 M-LMD 患者的汇总表,他们的 CSF-CTC 已被尝试传播。表中的患者之前在 Law 等人 7 中进行了表征。请点击此处下载此表格。
讨论
M-LMD 是一种具有破坏性的、普遍致命的疾病,迫切需要找到更好的治疗策略。研究 M-LMD 的主要障碍之一是无法获得足够的 CSF-CTC 来进行分子和功能研究 1,7。尽管有现有的方法可以从其他癌症类型(如乳腺癌和卵巢癌)的外周血和 CSF 中培养 CTC 11,31,32,但这些 CTC 繁殖方法通常是短期的,并且尚未报告从黑色素瘤中培养 CSF-CTC 的成功。此外,目前增殖 CTC 的方法存在于短期离体环境中,尚未产生源自患者 LMD 细胞的体内 LMD 模型。在这里,提出了一种新的方案来在体外和体内培养这些细胞,从而产生独特的患者来源的细胞系。目前,在研究中的 11 名 M-LMD 患者中,大约有 60% (11 名中的 7 名) 在体外成功繁殖 M-LMD CSF-CTCs,而使用 CDX 方法在体内成功繁殖的机会降低到 ~20% (11 名中的 2 名)7。
很明显,体外条件并不能概括 CSF 微环境。然而,之前已经进行了蛋白质组学方法来研究 CSF 中的蛋白质成分,并提供了一些关于 CTC 离体生长所需关键因素的见解 3。例如,已确定促进 M-LMD 患者 CTC 存活的主要途径之一与 IGF 相关活动增加有关 3,7。此外,研究表明,软脑膜将多种细胞因子/生长因子分泌到 CSF 中,包括 FGF-2、EGF、GM-CSF 和与 IGF 信号转导相关的蛋白质12。事实上,这在用 HMC 培养的培养基中得到了概括,支持这些生长因子在促进 CSF-CTC 生长方面的潜在作用。
生成 PDX(或 CDX)模型的一个主要优势是能够更深入地了解疾病的病理学,这是 体外 条件所缺乏的。理想情况下,首选 PDX 方法,因为 CSF-CTC 将直接来自没有 离体 培养的患者。最初,人们尝试使用这种方法创建 M-LMD,但到目前为止尚未成功。生成 PDX 小鼠的困难可能与起始材料的丰度和完整性有关(即,在临床常规采集时,患者 CSF 中很少有活的 CTC)。这可以解释为什么我们在尸检7 中收集的 CSF 中培养 CTC 取得了卓越的成功。为了增加 体内传播 的可能性,该协议被修改以提供另一种 CDX 方法。CSF-CTC 可以首先 在体外 扩增(第 3 步)以产生具有长期和更大生长潜力的 PD-CSF-CTC 系。然后将这些细胞接种到小鼠中以产生 M-LMD。尽管目前的方法生成的 体内 CDX M-LMD (~ 20%) 模型数量有限,但这可能反映了 CSF-CTC 的转录多样性、CSF 微环境的复杂性以及一般培养这些细胞的难度。鉴于微环境在支持癌细胞活力方面的重要性,我们认为人源化小鼠模型的未来开发可能会提高植入成功率33。
CDX 方法的一个局限性是仅从患者样本中选择某些克隆,并且通过 离体 培养的癌细胞遗传漂变可能不再反映原始来源的转录谱。然而,据报道,尽管 进行了体外 培养,PD-CSF-CTC 系仍保留了与分离的未培养患者 CSF-CTCs 约 97% 的基因表达相似性7。在该研究中,scRNA-seq 分析揭示了未培养的 体外 PD-CSF-CTC 和 体内 PD-CSF-CTC 之间的重叠富集基因特征,例如 SOX9、ErbB3 和 IGF-1R7,表明这些可能是潜在的治疗靶点。此外,这些通常富集的基因参与与转录调控和代谢相关的生物途径7。总的来说,这突出了 PD-CSF-CTC 培养物的转化价值,有助于更好地了解 M-LMD 的生物学特性,确定驱动疾病的靶向分子机制和途径,以及在未来研究中设计合理的疗法。
尽管目前的方法仍然不完善,因为无法预先确定 M-LMD 患者 CSF-CTC 的状态和活力,但已经进行了一些观察,这将增加成功的可能性,因为 CTC 数量少且相当脆弱。这些关键步骤包括与诊所协调,在抽取 CSF 样本后立即将其置于冰上,并迅速将其运送到实验室,以保持细胞完整性。随后,应立即处理 CSF-CTC,将其接种在培养物中或冻存细胞。
总体而言,培养和扩增 CSF-CTC 是一个反复试验的过程,但建立这种生成患者来源的 M-LMD 细胞的方案将为研究人员提供使用患者样本进行实验所需的资源,这在以前是无法完成的。未来的一个主要目标是利用 M-LMD PD-CSF-CTCs 进行分子表征、高通量药物筛选和 体内 药物疗效研究,以设计治疗 M-LMD 的合理疗法。据信,这种方法将导致治疗策略,从而大大降低与晚期转移性黑色素瘤目前致命的方面相关的发病率和死亡率。
披露声明
Peter Forsyth 在 Abvie Inc、Bayer、Bristol Meyers Squib、BTG、Inovio、Novocure、Tocagen 和 Ziopharm 的顾问委员会任职。所有其他作者都没有什么可披露的。
致谢
我们要感谢患者和家属为这项科学研究捐献组织的非凡慷慨。这项工作得到了美国国立卫生研究院赠款 P50 CA168536、R21 CA256289、R21 CA216756(对 KSMS 和 PAF)、K99 CA226679(对 IS)的资助。莫菲特基金会研究加速基金(BC和PAF),莫菲特化学生物学和分子医学项目(PAF和DD),莫菲特基金会(PAF)。Moffitt的分子基因组学、组织和生物信息学与生物统计学共享资源核心部分得到了国家癌症研究所通过癌症中心支持补助金(P30-CA076292)和Moffitt基金会的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe 27 - 29 G needles | Any vendor | n/a | 0.1 mm Sterile Filtered |
| 1.5 mL Eppendorf tubes | Any vendor | ||
| 15 ml and 50 mL polystyrene centrifuge tubes | Any vendor | n/a | |
| 6 - 8 weeks females NOD SCID gamma (NSG) mice | Charles River | Males optional | |
| Buprenorphine Sustained-Release (Bup-SR) | Zoopharm | DEA controlled | |
| Fetal bovine serum (FBS) | ScienCell | #0010 | |
| Gas inhalation anestehsia system | VeteEquip | #901812 | COMPAC5 |
| Hamilton microliter syringes | Hamilton | 10, 25, 50, and 100ml | 30 G for cisterna magna injection |
| Human basic fibroblast growth factor (bFGF) | Milipore Sigma (or any vender) | #F0291 | |
| Human epidermal growth factor (EGF) | Milipore Sigma (or any vender) | #SRP3027 | |
| Human meningeal cells (HMCs) isolated from human leptomeninges | ScienCell | #1400 | |
| IVIS 200 imaging system | Caliper Life Sciences | n/a | |
| Magnifying glass with light | Any vendor | n/a | |
| Meningeal Cell Culture Media (MenCM) | ScienCell | #1401 | |
| Meningeal cell growth supplement (MCGS) | ScienCell | #1452 | |
| MRI imaging | Bruker | BioSpec series | Optional |
| P1000, P200, P20 pipettes/ pipette tips | |||
| penicillin-streptomycin Antibiotic solution | ScienCell (or any vender) | #0503 | |
| Phosphate buffered saline (PBS) | Any vendor | n/a | 0.1 mm Sterile Filtered |
| Rodent Surgical Instruments (Scissors, Forceps) | Roboz Surgical Instrument (or any vendor) | ||
| Screw cap cryo tubes | |||
| Sterile blue paper/ drape covering | Any vendor | n/a | n/a |
| Sterile cotton sticks | Any vendor | n/a | |
| Tissue culture plates/flasks (96-well, 24-well, 12-well, 6-well, T175 etc.) |
参考文献
- Glitza, I. C., et al. Leptomeningeal disease in melanoma patients: An update to treatment, challenges, and future directions. Pigment Cell Melanoma Res. 33 (4), 527-541 (2020).
- Khaled, M. L., Tarhini, A. A., Forsyth, P. A., Smalley, I., Pina, Y. Leptomeningeal disease (LMD) in patients with melanoma metastases. Cancers (Basel). 15 (6), 1884 (2023).
- Smalley, I., et al. Proteomic analysis of CSF from patients with leptomeningeal melanoma metastases identifies signatures associated with disease progression and therapeutic resistance). Clin Cancer Res. 26 (9), 2163-2175 (2020).
- Larkin, J., et al. Five-year survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med. 381, 1535-1546 (2019).
- Boire, A., et al. Complement component 3 adapts the cerebrospinal fluid for leptomeningeal metastasis. Cell. 168 (6), 1101-1113 (2017).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Law, V., et al. A preclinical model of patient-derived cerebrospinal fluid circulating tumor cells for experimental therapeutics in leptomeningeal disease from melanoma. Neuro Oncol. 24 (10), 1673-1686 (2022).
- Carmona-Ule, N., et al. Short-term ex vivo culture of CTCs from advance breast cancer patients: Clinical implications. Cancers (Basel). 13 (11), 2668 (2021).
- Zhang, L., et al. The identification and characterization of breast cancer CTCs competent for brain metastasis. Sci Transl Med. 5 (180), (2013).
- Yu, M., et al. Cancer therapy: Ex vivo culture of circulating breast tumor cells for individualized testing of drug susceptibility. Science. 345 (6193), 216-220 (2014).
- Mohamed, B. M., et al. Ex vivo expansion of circulating tumour cells (CTCs). Sci Rep. 13 (1), 3704 (2023).
- Decimo, I., Fumagalli, G., Berton, V., Krampera, M., Bifari, F. Meninges: From protective membrane to stem cell niche. Am J Stem Cells. 1 (2), 92-105 (2012).
- Mercier, F., Hatton, G. I. Connexin 26 and basic fibroblast growth factor are expressed primarily in the subpial and subependymal layers in adult brain parenchyma: Roles in stem cell proliferation and morphological plasticity. J Comp Neurol. 431 (1), 88-104 (2001).
- Stylianopoulou, F., Herbert, J., Soares, M. B., Efstratiadis, A. Expression of the insulin-like growth factor II gene in the choroid plexus and the leptomeninges of the adult rat central nervous system. Proc Natl Acad Sci U S A. 85 (1), 141-145 (1988).
- Nordqvist, A. C., Mathiesen, T. Expression of IGF-II, IGFBP-2, -5, and -6 in meningiomas with different brain invasiveness. J Neurooncol. 5, 19-26 (2002).
- Zumkeller, W., Westphal, M. The IGF/IGFBP system in CNS malignancy. Mol Pathol. 54 (4), 227-229 (2001).
- Wang, L., et al. Promise and limits of the CellSearch platform for evaluating pharmacodynamics in circulating tumor cells. Semin Oncol. 43 (4), 464-475 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8, 160 (2023).
- Chen, J., et al. The development and improvement of immunodeficient mice and humanized immune system mouse models. Front Immunol. 13, 1007579 (2022).
- Law, V., et al. A Murine Ommaya xenograft model to study direct-targeted therapy of leptomeningeal disease. J Vis Exp. (167), e62033 (2021).
- Stacer, A. C., et al. NanoLuc reporter for dual luciferase imaging in living animals. Mol Imaging. 12 (7), 1-13 (2013).
- Luo, Y. T., et al. The viable circulating tumor cells with cancer stem cells feature, where is the way out. J Exp Clin Cancer Res. 37, 38 (2018).
- Stumm, R., Kolodziej, A., Schulz, S., Kohtz, J. D., Hollt, V. Patterns of SDF-1alpha and SDF-1gamma mRNAs, migration pathways, and phenotypes of CXCR4-expressing neurons in the developing rat telencephalon. J Comp Neurol. 502 (3), 382-399 (2007).
- Aviezer, D., et al. basal lamina proteoglycan, promotes basic fibroblast growth factor-receptor binding, mitogenesis, and angiogenesis. Cell. 79 (6), 1005-1013 (1994).
- Tiwary, S., et al. ERBB3 is required for metastasis formation of melanoma cells. Oncogenesis. 3 (7), e110 (2014).
- Sun, X., et al. miR-7 reverses the resistance to BRAFi in melanoma by targeting EGFR/IGF-1R/CRAF and inhibiting the MAPK and PI3K/AKT signaling pathways. Oncotarget. 7 (33), 53558-53570 (2016).
- Satyamoorthy, K., Li, G., Vaidya, B., Patel, D., Herlyn, M. Insulin-like growth factor-1 induces survival and growth of biologically early melanoma cells through both the mitogen-activated protein kinase and beta-catenin pathways. Cancer Res. 61 (19), 7318-7324 (2001).
- Lin, N. U., et al. Tucatinib vs Placebo, both in combination with Trastuzumab and Capecitabine, for previously treated ERBB2 (HER2)-positive metastatic breast cancer in patients with brain metastases: Updated exploratory analysis of the HER2CLIMB randomized clinical trial. JAMA Oncol. 9 (2), 197-205 (2023).
- Russo, A., et al. Ceritinib-induced regression of an insulin-like growth factor-driven neuroepithelial brain tumor. Int J Mol Sci. 20 (17), 4267 (2019).
- Ohsie, S. J., Sarantopoulos, G. P., Cochran, A. J., Binder, S. W. Immunohistochemical characteristics of melanoma. J Cutan Pathol. 35 (5), 433-444 (2008).
- Kulasinghe, A., et al. Short term ex-vivo expansion of circulating head and neck tumour cells. Oncotarget. 7 (37), 60101-60109 (2016).
- Li, X., et al. Clinical significance of detecting CSF-derived tumor cells in breast cancer patients with leptomeningeal metastasis. Oncotarget. 9 (2), 2705-2714 (2018).
- Lelliott, E. J., et al. A novel immunogenic mouse model of melanoma for the preclinical assessment of combination targeted and immune-based therapy. Sci Rep. 9 (1), 1225 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。