Method Article
生体外 黒色腫関連軟髄膜疾患の研究のための黒色腫患者からの脳脊髄液中の循環腫瘍細胞の培養
要約
この記事では、黒色腫関連軟髄膜疾患 (M-LMD) の患者から収集された脳脊髄液循環腫瘍細胞 (CSF-CTC) の増殖に関するプロトコルについて説明し、M-LMD を研究するための前臨床モデルを開発します。
要約
黒色腫関連軟髄膜疾患(M-LMD)は、循環腫瘍細胞(CTC)が脳脊髄液(CSF)に侵入し、脳と脊髄を保護する膜層である髄膜にコロニーを形成するときに発生します。一旦確定すると、M-LMD患者の予後は悲惨で、全生存期間は数週間から数ヶ月に及びます。これは主に、この疾患に対する理解が不足していること、そしてその結果、効果的な治療オプションが利用できないためです。M-LMDの根底にある生物学を定義することで、M-LMD治療に利用可能な治療法を適応させる能力や、この普遍的に致命的な疾患に対する新規阻害剤を設計する能力が大幅に向上します。しかし、大きな障壁となるのは、分子特性評価、機能解析、 in vivo 有効性研究などの前臨床実験を行うために、患者由来の CSF (CSF-CTC) から十分な量の CTC を得ることです。CSF-CTCを ex vivo で培養することも困難であることが証明されています。これに対処するために、患者由来のM-LMD CSF-CTCを ex vivo および in vivo で培養するための新しいプロトコルが開発されています。ヒト髄膜細胞(HMC)によって産生された馴化培地の取り込みは、この手順にとって重要であることがわかっています。サイトカインアレイ解析により、HMCが産生するインスリン様成長因子結合タンパク質(IGFBP)や血管内皮増殖因子A(VEGF-A)などの因子が、CSF-CTC のex vivo生存をサポートする上で重要であることが明らかになりました。ここでは、単離された患者由来のCSF-CTC株の有用性が、インスリン様成長因子(IGF)およびマイトジェン活性化プロテインキナーゼ(MAPK)シグナル伝達経路を標的とする阻害剤の有効性を決定する上で実証されています。さらに、これらの細胞を in vivo で髄腔内に接種して、承認された治療法または新規の治療法の前臨床試験に使用できるM-LMDのマウスモデルを確立する能力が示されています。これらのツールは、髄膜におけるCSF-CTCの確立を推進する根本的な生物学を解明し、M-LMDに関連する罹患率と死亡率を低下させる新しい治療法を特定するのに役立ちます。
概要
軟髄膜疾患(LMD)は、循環腫瘍細胞(CTC)が脳脊髄液(CSF)に播種し、脳と脊髄を囲む膜である髄膜に確立されるときに発生します1,2。LMDはいくつかのがんに発生する可能性がありますが、特に黒色腫に多く見られます。黒色腫の進行期では、患者の約5%が黒色腫関連M-LMDを発症します2,3。他の転移部位に関しては比較的低いですが、M-LMDの結果は壊滅的であり、全生存期間は数週間から数か月の範囲であり、患者の罹患率に大きく寄与しています1,3,4。これは主に、効果的な治療選択肢が不足していることと、軟髄膜がメラノーマ細胞2によってどのようにコロニーを形成するかに関する知識の大きなギャップによるものです。したがって、M-LMDの生物学を理解することは、臨床転帰を改善するための新しい治療法の設計を容易にします。
最近の報告では、CTCが独自のCSF微小環境にコロニーを形成する方法が示されています。例えば、補体C3は、脳の各心室5にある血管の複雑なネットワークである脈絡叢を介して、腫瘍細胞のCSFへの浸潤を促進します。さらに、CSFの微量栄養素が不足していることに応答して、CTCは鉄捕捉タンパク質であるリポカリン-2とその受容体SLC22A17をアップレギュレートして生存率を高めることができます6。また、オミクスを用いたCSFの解析により、CSFにはインスリン様成長因子(IGF)シグナル伝達を調節するタンパク質や自然免疫が豊富に含まれていることもわかりました3。これらのデータは、M-LMD を研究するためのリキッドバイオプシーからの CSF-CTC の価値を強調しています。
CSF-CTCは、腰椎穿刺、Ommyaリザーバー、または迅速な剖検を介して患者のCSFをサンプリングすることによって同定できる場合がありますが、大きな制限は、これらのまれで壊れやすい細胞1,7の十分な数を得ることです。例えば、CTC計数技術を用いても、患者のCSFサンプル7につき数百から数千の腫瘍細胞しか同定できないため、in vitroまたはin vivoでの分子分析および機能解析を行うことは困難です。末梢血からex vivoでCTC(すなわち、乳がんCTC)を短期間増殖させることに成功したという報告があるが8,9,10、これらの細胞は通常短期間しか増殖せず、CSFでメラノーマCTCを増殖させることができた症例は報告されていない。したがって、黒色腫CSF-CTC、または一般的なCTCを増殖させる方法を見つけることは、M-LMD 7,11の生物学を研究するために非常に有益です。
初めて、M-LMD患者からCSF-CTCをex vivoで増殖させる新しい技術が説明されています。このレポートでは、M-LMD患者からのCSF-CTCの培養と拡大を可能にする詳細なプロトコルが開発されました。髄膜は、その周囲の成長を支えるFGF、IGF、VEGF-A、およびIGFBPなどのさまざまな成長因子を分泌するため12,13,14,15,16、CSF-CTCがこれらの成分をex vivo条件で成長させる必要があることが合理化されました。したがって、このプロトコルでは、in vitroでヒト髄膜細胞-(HMCs-)を培養することによって生成されたコンディショニング培地を使用します。in vivo接種では、免疫不全マウスに患者由来細胞を接種し、患者由来CSF-CTC(PD-CSF-CTC)系統を作製します。患者由来のM-LMD細胞が利用できることは、M-LMDを研究し、この致命的な疾患に対する新しい治療戦略を提案するための細胞、分子、および機能アッセイをサポートします。
プロトコル
匿名化された患者CSF検体の収集は、南フロリダ大学の治験審査委員会(IRB)によって承認されました(MCC 50103、50172、および19332)。M-LMDの患者さんは、CSF細胞診陽性、脳や脊椎の特徴的な磁気共鳴画像法(MRI)、臨床所見と示唆的なMRI所見の組み合わせなど、いくつかの方法で診断されることがあります。これらのM-LMD患者からのCSFは、標準的な臨床ケアの一部として定期的に収集されました。臨床的な適応がない限り、施術は行われません。インフォームドコンセントは、サンプルの収集と研究および出版のためのサンプルの使用のために患者から得られました。 in vivo マウスLMDモデルの作製は、University of South Florida Institutional Animal Care and Use Committee(IACUC# IS00010398)によって承認されました。このプロトコルの全体的なスキームを 図 1 にまとめます。本試験で使用した試薬および機器の詳細は、 資料表に記載されています。
1. HMCコンディショニング培地の調製
- T175フラスコをポリ-l-リジンで2μg/cm2でプレコートします。
- フラスコを37°Cのインキュベーターに1時間置きます。
- 滅菌血清ピペットを使用してポリ-l-リジン溶液を吸引します。フラスコをすすぐ必要はなく、HMC培養の準備ができています。
- 5% ウシ胎児血清、1% 髄膜細胞増殖サプリメント、フラスコあたり 100 I.U./mL ペニシリン - ストレプトマイシン抗生物質溶液を含む 30 mL の完全髄膜培養培地 (MenCM) で約 1.0 x 10 ×10 6 HMC を培養します。細胞培養インキュベーターで、標準的な組織培養条件(37°C、5%CO2)で細胞を培養します。
- メディアは3日ごとに交換します。
- 細胞が約75%〜80%のコンフルエントに達したら、HMC培養培地を50 mLのコニカルチューブに集めて保存します。
- HMC を新しい T175 フラスコと、さらに HMC 培養培地が必要な場合は、新しい完全な MenCM に分割します。
- HMC培養培地に、1:1の比率の完全MenCMを添加します。
- 20 ng/mL の線維芽細胞成長因子 (FGF) と 20 ng/mL の上皮成長因子 (EGF) を添加すると、これが CSF-CTC の HMC コンディショニング培地となります。
注:CTCの培養準備ができたら、新しいFGFとEGFを追加することをお勧めします。 - HMCコンディショニング培地は、50 mLアリコートに入れて4°Cで保存してください。
注:アリコート中のHMCコンディショニング培地は、4°Cで4週間以内に保管することをお勧めします。
2. CSFの収集とサンプル処理
- 遠心分離機を4°Cに設定して予冷します。
- 患者から採取したら、CSFサンプルをすぐに氷上の15 mL円錐形チューブに入れて冷まします。
注: 当社の IRB 承認プロトコルでは、同意した患者から 7.5 mL の CSF を採取できます。 - CSFを257 x g で4°Cで5分間遠心分離します。
- CSF上清を取り出し、保存し、底部の細胞ペレットを乱さずにアリコートを作ります。CSF上清アリコートは、さらなる分析のために必要に応じて-80°Cで凍結保存することができます。
注:ペレットは肉眼では見えない場合があります。したがって、チューブの底に ~40-50 μL を残すことをお勧めします。 - 同じチューブに滅菌リン酸緩衝生理食塩水(PBS)1 mLを加えて細胞を再懸濁およびすすぎ、257 x g で4°Cで5分間遠心を繰り返します。
注:(オプション)サンプルに血液汚染が含まれている場合は、赤血球(RBC)溶解を行います。ただし、CTCを含む一部の細胞がプロセス中に失われる可能性があることに留意してください。 - 細胞ペレットを乱さずにPBSを取り出して廃棄し、底に~50μLを残します。
- 細胞数計数を行い、細胞生存率を決定します。ここから、CSF-CTCの増殖を進めるには、 in vitro 培養(ステップ3)と in vivo 患者由来の異種移植片の拡大を試みる(ステップ4)の2つの選択肢があります。
注:CSF-CTCを後で培養する場合は、細胞培養凍結培地で細胞を凍結保存し、増殖の準備ができるまで保存します。細胞培養凍結培地は、90%FBS+10%DMSOを使用して作製できます。過剰なCSFが利用可能な場合(すなわち、患者から複数のCSF採取を受けた場合、または剖検時にCSFが採取された場合)、CTCは、サンプルをCTC計数アッセイ17に提出するか、または免疫蛍光(IF)染色で黒色腫マーカー(すなわち、抗MLANA)に提出することにより評価することができ、これによりCTCの量および生存率に関する洞察が得られる可能性がある。したがって、患者からのバックアップCSFサンプルがない場合は推奨されません。
3. CSF-CTCの in vitro 培養と拡大
- HMC コンディショニング媒体中の CSF-CTC を再懸濁します。CSF-CTCを凍結保存する場合は、細胞を解凍して回転させ、PBSでやさしく洗浄します。
- ウェルあたり150 μLの容量の96ウェルプレートで、3重ウェルのすべての細胞を分割します。生細胞のみが一晩で表面に軽く付着します。
注:CSF-CTCの数は、1人の患者サンプルごとに大きく異なる可能性があります(表1)。CTC数が少ない患者さんには、96ウェルプレートを起点として培養を行い、CTCの損失を恐れてペレット全体をカウントせずに播種します。ただし、CSFの量が多い場合(つまり、剖検から得られた場合)、細胞をカウントすることが可能です。すべての腫瘍細胞が 生体外で増殖できるわけではありません。いくつかは、静止する前にいくつかのパッセージでゆっくりと拡大します。現在、 ex vivo で黒色腫CSF-CTCを成長させることが成功する可能性は約60%7です。 - 3日ごとに、新しいHMCコンディショニング培地を追加して補充するか、ピペットチップをウェルの側面に置いて培地を静かに取り除き、ウェルの底を乱さずに液体を残してから、新しいHMCコンディショニング培地と交換します。
- ex vivo CSF-CTCが拡大して90%コンフルエントになったら、トリプシン化してウェル全体を24ウェルプレートの新しいウェルに移します。24ウェルのウェルがコンフルエントになったら、12ウェルプレートに移し、次に6ウェルプレートに移します。
注:トリプシン処理後、バックアップとしてプレーティングする前に、細胞培養凍結培地(10% DMSO + 90% FBS)でCTCの小さなサブセットを凍結保存することを検討してください。 - CTCの培養を続けます。一部の細胞は短期間増殖し、最終的には静止する可能性があります。ただし、1 つ以上のクローンが指数関数的に変換および拡張する可能性があります(図 2A)。これらのクローンを選択すると、in vitro患者由来CSF-CTC(PD-CSF-CTC)培養物になります。
注:これらのクローンが過密またはクラスター化した場合は、細胞をトリプシン処理し、新鮮な組織培養プレート/フラスコに再播種します。
4. CSF-CTCの in vivo 接種による細胞株由来異種移植片(CDX)または患者由来異種移植片(PDX)モデルの生成
注:PDXモデルは、がん患者から直接がん細胞を生着させる( ex vivo 培養をしない)のに対し、CDXモデルはがん細胞株、またはこの場合は、増殖して不死化されたCTCを使用します18。
- CSF-CTCsの接種には、6〜8週間の雌の免疫不全NOD SCIDガンマ(NSG)マウスを使用してください。NSGは、重度の免疫不全であり、ヒト腫瘍細胞の生着を非常に受容性が高いため、使用されます19。これらのマウスは免疫不全のため、厳密に管理された衛生的な環境に保ち、他のマウス系統から隔離して飼育する必要があります。マウスLMDをレンダリングする方法は、他の場所で詳細に説明されている20。
注: ex vivo 細胞(ステップ2で培養せずに処理されたのみの患者のCSF-CTC)を使用してPDXモデルを生成します。LMDの進行を判断するには、動物の物理的観察と脳のMRIが必要です。一方、 in vitro を用いたCDXモデルでは、PD-CSF-CTCをルシフェラーゼレポーターで標識し、生物発光イメージング(BLI)によりLMDの状態を評価することができます。この報告で使用した細胞標識システムは、フリマジンを基質として利用するNanoLuc(NL)レポーターであり、腫瘍の成長に比例して感度が向上することが示されています21。NL発現によるCTC細胞増殖(in vitro または in vivo)の干渉は観察されませんでした。 - これらの方法を使用してLMD進行の兆候を確認します:物理的観察:体重減少、頭の傾き、猫背。MRI:脳室の拡大と水頭症の徴候(図2B)。BLI:CNS領域における正の生物発光シグナル(図2C)。
5. LMDを用いたマウスからのCSF採取によるその後のクローン増殖
- NSG マウスに 4% イソフルラン (制度的に承認されたプロトコルに従う) を含む LMD で麻酔をかけ、立ち直反射の兆候がなくなるまで麻酔します。
- 頭の腹面全体の毛皮を剃ってマウスを調製し、滅菌技術を使用して皮膚を準備します。
- 定位装置の改良型L字型ノーズコーンを使用して鼻を配置し、鼻孔が遮られないようにします。皮膚をテープで両方の耳介の腹面を横切って前方にそっと引っ張ってノーズコーンに貼り付け、固定した後、首を約90°の角度で曲げて固定します。.麻酔を維持するために1.5%〜3%のイソフルランを投与します。
- 首を完全に伸ばし、耳介の間から始めて、わずかな圧力で手術用ハサミの先端を後頭骨を横切って下向きに導きます。
注:この正中線位置では、はさみの先端が大槽の上の凹面領域に入ると、微妙なくぼみが識別できます。 - 触診された凹面のすぐ上に5〜7mmの小さな正中線切開を作成します。
- 先端が1〜2mmの鈍い先端の鉗子を使用して、大槽に優しく圧力をかけます。閉じた位置にチップを導入し、硬膜に下向きの圧力をかけながら開きます。
- ステップ6で概説したように、硬膜がはっきりと識別でき、露出領域内に関連する血管が見えるまで、鈍的解剖プロセスを繰り返します。
- 鉗子を開いたままにして周囲の筋肉組織を引っ込めながら、1mLのシリンジに取り付けられた27〜29Gの針を硬膜の下に挿入して、斜角を視覚化します。針がベベルのすぐ向こうに貫通していることを確認します。シリンジプランジャーを徐々に引っ込めます。
- マウスの安楽死の前に、できるだけ多くのCSF(通常は15〜30μL)を収集します。
注:安楽死は、施設で承認されたプロトコルに従って、被験者を圧縮されたCO2 ガスの濃度の上昇にさらすことによって達成されます。例えば、毎分チャンバー容積の30%から70%までの変位率が、不快感や苦痛を予防または軽減するために使用されます。これに続いて、室内の空気中で10分以上長時間観察することにより、心血管運動と呼吸運動の停止を確保します。 - シリンジからCSFをマイクロ遠心チューブに展開し、氷の上に置きます。
- サンプルを257 x g で5分間、4°Cで遠心し、細胞ペレットを乱さずに液体を静かに取り除きます(さらに分析するためにマウスCSFサンプルを-80°Cで凍結します)。
- 滅菌PBS500μLを添加し、細胞ペレットを洗浄します。257 x g で室温で5分間回転を繰り返します。
- HMCコンディショニング培地中の細胞を96ウェルプレートに再懸濁します。
注: in vivo で生着され、LMDに正常に増殖したCSF-CTCは、正常な細胞培養と同様に増殖できるはずです。3日ごとにメディアを交換して拡大を続けます。細胞がコンフルエントになったら、細胞をトリプシン化し、より大きな細胞培養装置に移します。これらの細胞は、 in vivo PD-CSF-CTC 培養物になります。今回のレポートでは、CDXモデルの成功率は100%で、PDX M-LMDはまだ生成されていません。
結果
CSF-CTCのex vivo成長を成功させるための要件を理解することは、継続的な取り組みです。そのためには、CSF微小環境を模倣する必須要素を提供することが重要であると考えられています22。ヒト髄膜細胞(HMC)は、FGF-2、EGF、IGFBP2、およびIGFBP6を含む様々な成長因子をCSFに分泌し、CTC細胞の増殖を支援することが知られている12,13,14,23,24。したがって、ヒトサイトカインアレイ分析をHMCコンディショニング培地で実施し、CTCの生存に必要な潜在的に重要な成分を特定しました。実際、HMCで培養した培地では、いくつかの成長因子がアップレギュレーションされていました(図3A)。例えば、顆粒球マクロファージコロニー刺激因子(GM-CSF)、VEGF-A、およびIGFBP(IGFBP2、3、4、および6)などです。
患者由来のCSF細胞成分は、CTC、免疫細胞、線維芽細胞など、複数の細胞型で構成されている場合があります。非CTCは、最終的に時間外に通過しなくなります。一般に、増殖に成功し、増殖を続ける細胞はがん(M-LMD)細胞です。培養中の増殖細胞の検証は、確かにM-LMD細胞であり、これは以前に示されているMLANA発現のIF検出とトランスクリプトーム分析によって行うことができます7。
確立されたin vitroおよびin vivoのPD-CSF-CTC株の使用と応用の可能性を示す概念実証として、シングルセルRNAシーケンシング(scRNA-seq)解析が行われ、その結果、未培養の患者CSF-CTCs7から濃縮され保持されたいくつかの遺伝子が明らかになりました。そのうちの2つは、受容体チロシン-プロテインキナーゼErbB3およびIGF-1Rを含み、これらは黒色腫の進行および化学療法抵抗性に影響を及ぼします25,26,27。
それらがCSF-CTCの生存に関与したかどうかを検証するために、ErbB28およびIGF-1R 7,29を標的とするFDA承認薬ツカチニブおよびセリチニブで処理されたPD-CSF-CTCに対して結晶紫色増殖アッセイを実施しました。抗IGFBP2抗体は、PD-CSF-CTC培養の成長を妨げるはずのポジティブコントロールとして含まれていました。その結果、IGFBP2またはIGF-1Rの不在がPD-CSF-CTCの増殖を抑制するのに有効であることが示されました(図3B)。MAPKシグナル伝達がIGF-1Rの下流にあることを考えると、3つのM-LMD PD-CSF-CTC株において、セリチニブまたはMAPK阻害剤、ダブラフェニブとトラメチニブ、またはこれら3つすべての組み合わせで治療することにより、calcein-AM生細胞染色およびMTT細胞生存アッセイも実施しました。このデータでは、セリチニブでは3つの細胞株すべての生存率が有意に低下したのに対し、ダブラフェニブとトラメチニブでは効果が混在していたことが示されました(図3C)。デブラフェニブとトラメチニブの治療結果は驚くべきものでした。3つのPD-CSF-CTC系統はすべて、BRAFV600E変異を有するM-LMD患者に由来していました7。これは、CSF-CTCの獲得性化学療法抵抗性効果を示唆している可能性があり、これは将来調査されるべきものです。
次に、PD-CSF-CTCを in vivoでどのように活用できるかの例として、PD-CSF-CTCの数を変えて髄腔内に接種することにより、マウス-M-LMDモデルを確立しました。マウスの生存期間の中央値を決定しました(図3D)。M-LMDの進行を可視化するために、PD-CSF-CTCラインをNLレポーターシステム21などの生物発光マーカーでタグ付けし、BLIで捕捉しました(図2C)。LMD転移の位置は、メラノーマ細胞のマーカーとしてタンパク質melan-A(MLANA)30 を用いた免疫組織化学を用いても実証された(図3E)。 in vivoでM-LMDに対する治療戦略を検証するための概念実証として、マウス-M-LMDコホートにセリチニブまたはトラメチニブの単剤療法、またはダブラフェニブとトラメチニブの併用、またはセリチニブとトラメチニブの併用療法を毎日実施しました。対照(未治療)コホートは、比較として経口生理食塩水を受け取りました。その結果、セリチニブとトラメチニブで治療されたコホートでは、生存期間が有意に延長され(図3F)、疾患検出の遅延(図3G)が示されました(未治療のM-LMD生存期間中央値:28.5日 対セリチニブとトラメチニブで治療されたM-LMD生存期間の中央値:38.5日; P 値 = 0.0052)。これらのデータは、開発されたM-LMD、PD-CSF-CTCラインが、新規治療薬の有効性を判断するための前臨床試験の実施に有用である可能性を強調しています。
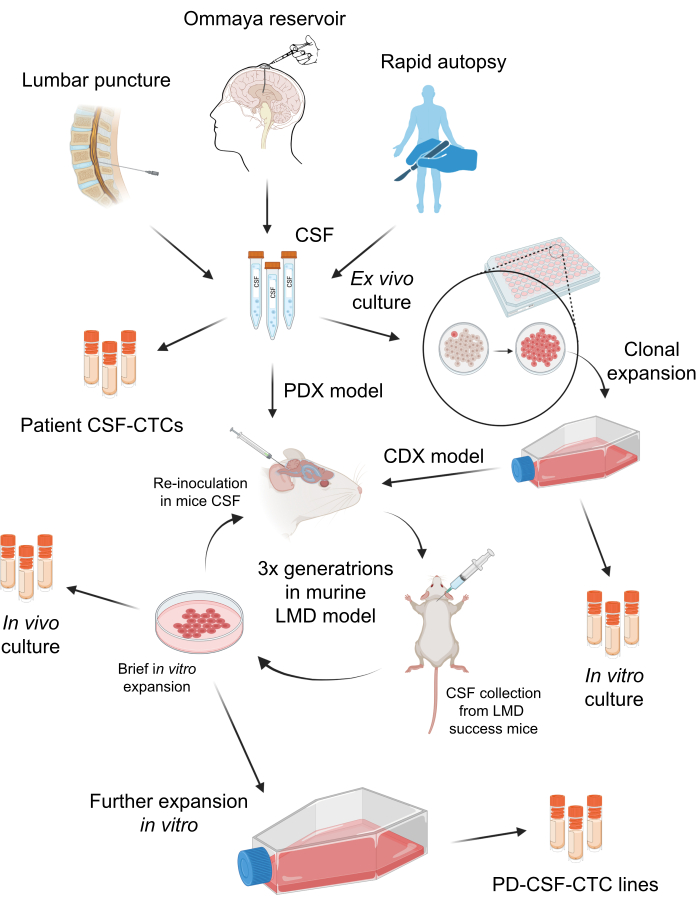
図1:患者由来のCSF循環腫瘍細胞(PD-CSF-CTC)を確立するプロセスの概略図。 患者からのCSFは、腰椎穿刺、オンマヤリザーバー、または迅速剖検 によって サンプリングできます。一連の in vitro および in vivo での増殖を通じて、各ステップで中間のCSF-CTC培養(すなわち、患者CSF-CTC、 in vitro 培養、 in vivo 培養)が生成され、PD-CSF-CTCラインが確立されます。 この図の拡大版を表示するには、ここをクリックしてください。
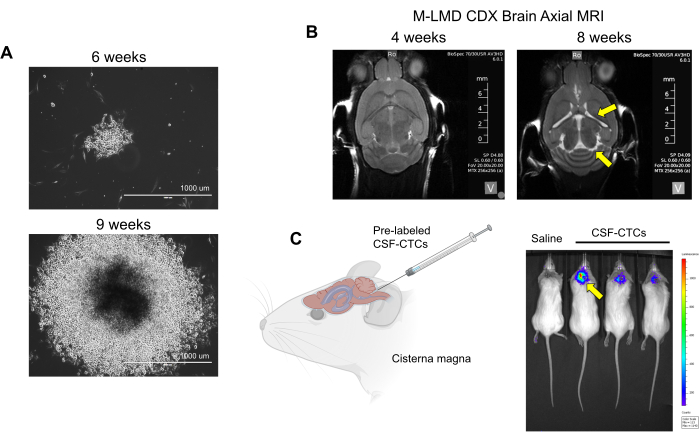
図2:M-LMD患者由来のCSF-CTCの in vitro および in vivo 培養の例。 (A)HMCコンディショニング培地中の6週間および9週間でのM-LMD CSF-CTCコロニーの in vitro 成長を示す代表的な明視野画像。スケールバー:1000μm.(B)髄腔内PD-CSF-CTCsを髄腔内接種してから4週間後および8週間後のMRI画像。M-LMDのマウスモデルの確立に成功しました。黄色の矢印は、このM-LMDマウスの脳室の拡大と水頭症の可能性を示しています。(C)マウスにおけるM-LMD発生の代表的なBLI可視化。この図は、Law et al.7 から採用されています。 この図の拡大版を表示するには、ここをクリックしてください。
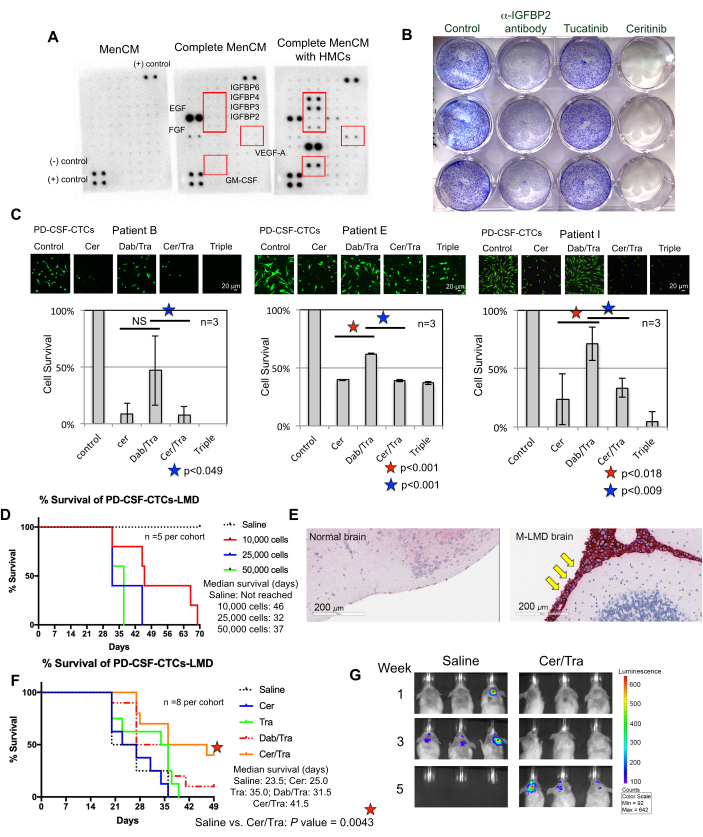
図3:PD-CSF-CTCラインは、M-LMDを研究するためのさまざまな前臨床実験で使用されています。 (A)ヒト髄膜細胞(HMC)の存在下で、培地(MenCM)中のさまざまな分泌成長因子(IGFBP、VEGF-A、GM-CSF)の増加を示すヒトサイトカインアレイ。(B)PD-CSF-CTC ラインの 1 つに対する抗 IGFBP2 抗体、ツカチニブ、およびセリチニブの有効性を判断するためのクリスタル バイオレット細胞増殖アッセイのスキャン画像。制御条件は車両処理が施されました。実験は三重に行われました。(C)3つの異なる確立されたPD-CSF-CTC系統(患者09、12、および16由来)の in vitroでの細胞生存アッセイ。細胞は、セリチニブ(cer)、ダブラフェニブ(dab)+トラメチニブ(tra)、cer+tra、または3つすべてのいずれかで処理しました。細胞は処理後72時間で収集されました。カルセイン-AM染色を使用して細胞生存率を視覚化し、MTTアッセイを使用して細胞の生存率を決定しました。対応のあるサンプル のt検定を統計分析に使用しました。スケールバー:20μm.(D)マウスM-LMDモデルの生存曲線。NSGマウスを髄腔内(大槽を介して )にPD-CSF-CTCラインの1つを10,000、20,000、および50,000細胞で接種しました。M-LMDマウスの生存期間中央値が決定されました。(E)M-LMDマウスの脳切片における黒色腫のマーカーであるMLANAのIHC検出。髄膜には陽性のMLANAが見つかりました(赤く染色され、黄色の矢印で示されています)が、正常な(健康な)脳は癌の増殖を示さなかった(MLANAに陰性)。スケールバー:200μm.(F)毎日経口生理食塩水、cer、tra、dab/traまたはcer/traのいずれかを与えられたマウスM-LMDコホートの代表的な有効性実験。マウスの生存が決定されました。統計分析には、ログランク(Mantel-Cox)検定を使用しました。(G) 5週間後のM-LMD進行の代表的なBLI画像 、対照(生理食塩水)治療との比較。cer/tra で治療されたマウス M-LMD コホート。図のパネル(C)は、Law et al.7から採用されています。 この図の拡大版を表示するには、ここをクリックしてください。
表1:M-LMD患者における ex vivo 培養で得られた臨床CSF-CTCの要約。 11人のM-LMD患者の要約表で、彼らのCSF-CTCが伝播しようと試みられました。表の患者は、以前に Law et al.7 で特徴付けられていました。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
M-LMDは、壊滅的で普遍的に致命的な疾患であり、より良い治療戦略を見つけることが急務です。M-LMDを研究する上での大きな障壁の1つは、分子的および機能的研究を行うのに十分なCSF-CTCを取得できないことです1,7。末梢血および乳がんおよび卵巣がん11,31,32などの他のがん種のCSFからCTCを培養する既存の方法があるが、これらのCTC増殖方法は通常短期的であり、メラノーマからのCSF-CTCの培養における成功は報告されていない。さらに、CTCを増殖させるための現在の方法論は、短期間のex vivo設定に存在し、患者のLMD細胞に由来するin vivo LMDモデルはまだ得られていません。ここでは、これらの細胞をin vitroおよびin vivoで培養するための新しいプロトコルが提示され、ユニークな患者由来の細胞株が生まれます。現在、この研究に参加した 11 人の M-LMD 患者のうち、約 60% (11 人中 7 人) の確率で in vitro で M-LMD CSF-CTC の増殖に成功し、CDX 法7 を使用して IN VIVO で ~20% (11 人中 2 人) に低下しました。
in vitro条件がCSF微小環境を再現しないことは明らかです。しかし、プロテオミクスアプローチは以前にCSF中のタンパク質成分を研究するために行われており、CTCのex vivo成長に必要な主要な要因に関するいくつかの洞察を提供してきました3。例えば、M-LMD患者におけるCTC生存を促進する主要な経路の1つが、IGF関連活動の亢進と関連していることが同定された3,7。さらに、軟髄膜は、FGF-2、EGF、GM-CSF、IGFシグナル伝達に関連するタンパク質など、さまざまなサイトカイン/成長因子をCSFに分泌することが研究で示されています12。実際、このことはHMCで培養されたメディアで再現されており、CSF-CTCの成長を促進する上でこれらの成長要因が潜在的な役割を果たしていることを裏付けています。
PDX(またはCDX)モデルを生成する主な利点は、 in vitro 条件にはない疾患の病理についてより深い洞察を得ることができることです。理想的には、CSF-CTCは ex vivo 培養を行わない患者から直接採取されるため、PDXアプローチが好まれます。当初、このアプローチを用いてM-LMDを作ろうと試みられましたが、これまで成功していません。PDXマウスの作製が困難であることは、出発物質の存在量と完全性に関連している可能性があります(すなわち、クリニックでの定期的な収集時に患者のCSFに生存可能なCTCがほとんどない)。これは、剖検7で収集されたCSFからCTCを成長させることに成功した理由を説明しているかもしれません。 in vivo での増殖の可能性を高めるために、このプロトコルは、代替のCDXアプローチを提供するように修正されました。CSF-CTCは、まず in vitro で増殖させることができ(ステップ3)、長期的かつより大きな成長の可能性を秘めたPD-CSF-CTC株を作製することができます。次に、これらの細胞をマウスに接種してM-LMDを作製します。現在の方法では、限られた数の in vivo CDX M-LMD(~20%)モデルが生成されましたが、これはCSF-CTCの転写の多様性、CSF微小環境の複雑さ、およびこれらの細胞の一般的な培養の難しさを反映している可能性があります。我々は、がん細胞の生存率を支える微小環境の重要性を考えると、ヒト化マウスモデルの将来の開発が生着成功率を高める可能性があると仮定している33。
CDXアプローチの限界は、患者サンプルから特定のクローンのみが選択され、 ex vivo 培養によるがん細胞の遺伝的浮動が元のソースの転写プロファイルを反映しなくなる可能性があることです。しかし、 in vitro 培養にもかかわらず、PD-CSF-CTC系統は、単離された非培養患者CSF-CTCsと遺伝子発現の約97%の類似性を保持していることが報告されています7。この研究では、scRNA-seq解析により、非培養の in vitro PD-CSF-CTCとin vivo PD-CSF-CTC(SOX9、ErbB3、IGF-1R7など)との間には、濃縮された遺伝子シグネチャーが重複していることが明らかになりました。これは、これらが治療標的となる可能性が示唆されています。さらに、これらの一般的に濃縮された遺伝子は、転写調節および代謝に関連する生物学的経路に関与している7。まとめると、これは、M-LMDの生物学をよりよく理解し、疾患を駆動する標的となる分子メカニズムと経路を特定し、将来の研究で合理的な治療法を設計するためのPD-CSF-CTC培養の翻訳価値を強調しています。
M-LMD患者におけるCSF-CTCの状態と生存率を事前に決定する方法がないため、現在の方法論は不完全なままですが、CTCの数が少なく、非常に脆弱であるため、成功の可能性を高めるいくつかの観察結果が得られています。これらの重要なステップには、CSFサンプルが採取されるとすぐに氷上に置かれ、細胞の完全性を維持するために迅速にラボに輸送されるようにクリニックと調整することが含まれます。その後、CSF-CTCは、培養物にプレーティングするか、細胞を凍結保存することにより、直ちに処理する必要があります。
全体として、CSF-CTCの培養と拡大は試行錯誤のプロセスでしたが、患者由来のM-LMD細胞を生成するためのこのプロトコルの確立により、研究者は以前には不可能だった患者サンプルでの実験を行うために必要なリソースを得ることができます。今後の主要な目標は、M-LMD PD-CSF-CTCを利用して、分子特性評価、ハイスループット薬物スクリーニング、 およびin vivo 薬物有効性研究を実施し、M-LMDを治療するための合理的な治療法を設計することです。このアプローチは、進行性転移性黒色腫のこの現在致命的な側面に関連する罹患率と死亡率を大幅に減少させる治療戦略につながると考えられています。
開示事項
ピーター・フォーサイスは、Abvie Inc、Bayer、Bristol Meyers Squib、BTG、Inovio、Novocure、Tocagen、Ziopharmの諮問委員会のメンバーを務めています。他のすべての著者は、開示するものは何もありません。
謝辞
この科学的研究のために組織を提供してくださった患者様とご家族の皆様に、並外れた寛大さに感謝いたします。この研究は、国立衛生研究所からの助成金P50 CA168536、R21 CA256289、R21 CA216756(KSMSおよびPAFへ)、K99 CA226679(ISへ)によって支援されました。Moffitt Foundation Research Acceleration Fund(BC州およびPAFへ)、Moffitt Chemical Biology & Molecular Medicine Program(PAFおよびDD)、Moffitt Foundation(PAF)。MoffittのMolecular Genomics, Tissue, and Bioinformatics & Biostatistics Shared Resource Coresは、Cancer Center Support Grant(P30-CA076292)およびMoffitt Foundationを通じて、National Cancer Instituteによって部分的にサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe 27 - 29 G needles | Any vendor | n/a | 0.1 mm Sterile Filtered |
| 1.5 mL Eppendorf tubes | Any vendor | ||
| 15 ml and 50 mL polystyrene centrifuge tubes | Any vendor | n/a | |
| 6 - 8 weeks females NOD SCID gamma (NSG) mice | Charles River | Males optional | |
| Buprenorphine Sustained-Release (Bup-SR) | Zoopharm | DEA controlled | |
| Fetal bovine serum (FBS) | ScienCell | #0010 | |
| Gas inhalation anestehsia system | VeteEquip | #901812 | COMPAC5 |
| Hamilton microliter syringes | Hamilton | 10, 25, 50, and 100ml | 30 G for cisterna magna injection |
| Human basic fibroblast growth factor (bFGF) | Milipore Sigma (or any vender) | #F0291 | |
| Human epidermal growth factor (EGF) | Milipore Sigma (or any vender) | #SRP3027 | |
| Human meningeal cells (HMCs) isolated from human leptomeninges | ScienCell | #1400 | |
| IVIS 200 imaging system | Caliper Life Sciences | n/a | |
| Magnifying glass with light | Any vendor | n/a | |
| Meningeal Cell Culture Media (MenCM) | ScienCell | #1401 | |
| Meningeal cell growth supplement (MCGS) | ScienCell | #1452 | |
| MRI imaging | Bruker | BioSpec series | Optional |
| P1000, P200, P20 pipettes/ pipette tips | |||
| penicillin-streptomycin Antibiotic solution | ScienCell (or any vender) | #0503 | |
| Phosphate buffered saline (PBS) | Any vendor | n/a | 0.1 mm Sterile Filtered |
| Rodent Surgical Instruments (Scissors, Forceps) | Roboz Surgical Instrument (or any vendor) | ||
| Screw cap cryo tubes | |||
| Sterile blue paper/ drape covering | Any vendor | n/a | n/a |
| Sterile cotton sticks | Any vendor | n/a | |
| Tissue culture plates/flasks (96-well, 24-well, 12-well, 6-well, T175 etc.) |
参考文献
- Glitza, I. C., et al. Leptomeningeal disease in melanoma patients: An update to treatment, challenges, and future directions. Pigment Cell Melanoma Res. 33 (4), 527-541 (2020).
- Khaled, M. L., Tarhini, A. A., Forsyth, P. A., Smalley, I., Pina, Y. Leptomeningeal disease (LMD) in patients with melanoma metastases. Cancers (Basel). 15 (6), 1884 (2023).
- Smalley, I., et al. Proteomic analysis of CSF from patients with leptomeningeal melanoma metastases identifies signatures associated with disease progression and therapeutic resistance). Clin Cancer Res. 26 (9), 2163-2175 (2020).
- Larkin, J., et al. Five-year survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med. 381, 1535-1546 (2019).
- Boire, A., et al. Complement component 3 adapts the cerebrospinal fluid for leptomeningeal metastasis. Cell. 168 (6), 1101-1113 (2017).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Law, V., et al. A preclinical model of patient-derived cerebrospinal fluid circulating tumor cells for experimental therapeutics in leptomeningeal disease from melanoma. Neuro Oncol. 24 (10), 1673-1686 (2022).
- Carmona-Ule, N., et al. Short-term ex vivo culture of CTCs from advance breast cancer patients: Clinical implications. Cancers (Basel). 13 (11), 2668 (2021).
- Zhang, L., et al. The identification and characterization of breast cancer CTCs competent for brain metastasis. Sci Transl Med. 5 (180), (2013).
- Yu, M., et al. Cancer therapy: Ex vivo culture of circulating breast tumor cells for individualized testing of drug susceptibility. Science. 345 (6193), 216-220 (2014).
- Mohamed, B. M., et al. Ex vivo expansion of circulating tumour cells (CTCs). Sci Rep. 13 (1), 3704 (2023).
- Decimo, I., Fumagalli, G., Berton, V., Krampera, M., Bifari, F. Meninges: From protective membrane to stem cell niche. Am J Stem Cells. 1 (2), 92-105 (2012).
- Mercier, F., Hatton, G. I. Connexin 26 and basic fibroblast growth factor are expressed primarily in the subpial and subependymal layers in adult brain parenchyma: Roles in stem cell proliferation and morphological plasticity. J Comp Neurol. 431 (1), 88-104 (2001).
- Stylianopoulou, F., Herbert, J., Soares, M. B., Efstratiadis, A. Expression of the insulin-like growth factor II gene in the choroid plexus and the leptomeninges of the adult rat central nervous system. Proc Natl Acad Sci U S A. 85 (1), 141-145 (1988).
- Nordqvist, A. C., Mathiesen, T. Expression of IGF-II, IGFBP-2, -5, and -6 in meningiomas with different brain invasiveness. J Neurooncol. 5, 19-26 (2002).
- Zumkeller, W., Westphal, M. The IGF/IGFBP system in CNS malignancy. Mol Pathol. 54 (4), 227-229 (2001).
- Wang, L., et al. Promise and limits of the CellSearch platform for evaluating pharmacodynamics in circulating tumor cells. Semin Oncol. 43 (4), 464-475 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8, 160 (2023).
- Chen, J., et al. The development and improvement of immunodeficient mice and humanized immune system mouse models. Front Immunol. 13, 1007579 (2022).
- Law, V., et al. A Murine Ommaya xenograft model to study direct-targeted therapy of leptomeningeal disease. J Vis Exp. (167), e62033 (2021).
- Stacer, A. C., et al. NanoLuc reporter for dual luciferase imaging in living animals. Mol Imaging. 12 (7), 1-13 (2013).
- Luo, Y. T., et al. The viable circulating tumor cells with cancer stem cells feature, where is the way out. J Exp Clin Cancer Res. 37, 38 (2018).
- Stumm, R., Kolodziej, A., Schulz, S., Kohtz, J. D., Hollt, V. Patterns of SDF-1alpha and SDF-1gamma mRNAs, migration pathways, and phenotypes of CXCR4-expressing neurons in the developing rat telencephalon. J Comp Neurol. 502 (3), 382-399 (2007).
- Aviezer, D., et al. basal lamina proteoglycan, promotes basic fibroblast growth factor-receptor binding, mitogenesis, and angiogenesis. Cell. 79 (6), 1005-1013 (1994).
- Tiwary, S., et al. ERBB3 is required for metastasis formation of melanoma cells. Oncogenesis. 3 (7), e110 (2014).
- Sun, X., et al. miR-7 reverses the resistance to BRAFi in melanoma by targeting EGFR/IGF-1R/CRAF and inhibiting the MAPK and PI3K/AKT signaling pathways. Oncotarget. 7 (33), 53558-53570 (2016).
- Satyamoorthy, K., Li, G., Vaidya, B., Patel, D., Herlyn, M. Insulin-like growth factor-1 induces survival and growth of biologically early melanoma cells through both the mitogen-activated protein kinase and beta-catenin pathways. Cancer Res. 61 (19), 7318-7324 (2001).
- Lin, N. U., et al. Tucatinib vs Placebo, both in combination with Trastuzumab and Capecitabine, for previously treated ERBB2 (HER2)-positive metastatic breast cancer in patients with brain metastases: Updated exploratory analysis of the HER2CLIMB randomized clinical trial. JAMA Oncol. 9 (2), 197-205 (2023).
- Russo, A., et al. Ceritinib-induced regression of an insulin-like growth factor-driven neuroepithelial brain tumor. Int J Mol Sci. 20 (17), 4267 (2019).
- Ohsie, S. J., Sarantopoulos, G. P., Cochran, A. J., Binder, S. W. Immunohistochemical characteristics of melanoma. J Cutan Pathol. 35 (5), 433-444 (2008).
- Kulasinghe, A., et al. Short term ex-vivo expansion of circulating head and neck tumour cells. Oncotarget. 7 (37), 60101-60109 (2016).
- Li, X., et al. Clinical significance of detecting CSF-derived tumor cells in breast cancer patients with leptomeningeal metastasis. Oncotarget. 9 (2), 2705-2714 (2018).
- Lelliott, E. J., et al. A novel immunogenic mouse model of melanoma for the preclinical assessment of combination targeted and immune-based therapy. Sci Rep. 9 (1), 1225 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved