Method Article
Canlı Çekim Melanom Hastalarından Beyin Omurilik Sıvısında Dolaşan Tümör Hücrelerinin Melanomla İlişkili Leptomeningeal Hastalığı İncelemek İçin Kültürü
Bu Makalede
Özet
Bu makale, M-LMD'yi incelemek için klinik öncesi modeller geliştirmek üzere melanom ile ilişkili leptomeningeal hastalığı (M-LMD) olan hastalardan toplanan serebral omurilik sıvısı dolaşımındaki tümör hücrelerinin (BOS-CTC'ler) çoğaltılması için bir protokolü açıklamaktadır.
Özet
Melanomla ilişkili leptomeningeal hastalık (M-LMD), dolaşımdaki tümör hücreleri (CTC'ler) beyin omurilik sıvısına (BOS) girdiğinde ve beyni ve omuriliği koruyan zar tabakaları olan meninksleri kolonize ettiğinde ortaya çıkar. Bir kez belirlendikten sonra, M-LMD hastaları için prognoz kasvetlidir ve genel sağkalım haftalar ila aylar arasında değişmektedir. Bunun başlıca nedeni, hastalığı anlamamızdaki yetersizlik ve sonuç olarak etkili tedavi seçeneklerinin mevcudiyetidir. M-LMD'nin altta yatan biyolojisini tanımlamak, M-LMD tedavisi için mevcut tedavileri uyarlama veya bu evrensel olarak ölümcül hastalık için yeni inhibitörler tasarlama yeteneğini önemli ölçüde artıracaktır. Bununla birlikte, moleküler karakterizasyon, fonksiyonel analiz ve in vivo etkinlik çalışmaları gibi klinik öncesi deneyler yapmak için hastadan türetilen BOS'tan (CSF-CTC'ler) yeterli miktarda CTC elde edilmesinde önemli bir engel yatmaktadır. CSF-CTC'lerin ex vivo olarak kültürlenmesinin de zor olduğu kanıtlanmıştır. Bunu ele almak için, ex vivo ve in vivo olarak hastadan türetilen M-LMD BOS-CTC'lerin kültürü için yeni bir protokol geliştirilmiştir. İnsan meningeal hücreleri (HMC'ler) tarafından üretilen şartlandırılmış ortamın dahil edilmesinin prosedür için kritik olduğu bulunmuştur. Sitokin dizi analizi, insülin benzeri büyüme faktörü bağlayıcı proteinler (IGFBP'ler) ve vasküler endotelyal büyüme faktörü-A (VEGF-A) gibi HMC'ler tarafından üretilen faktörlerin BOS-CTC sağkalımını ex vivo desteklemede önemli olduğunu ortaya koymaktadır. Burada, izole hasta kaynaklı BOS-CTC hatlarının kullanışlılığı, insülin benzeri büyüme faktörü (IGF) ve mitojenle aktive olan protein kinaz (MAPK) sinyal yolaklarını hedef alan inhibitörlerin etkinliğinin belirlenmesinde gösterilmiştir. Ek olarak, onaylanmış veya yeni tedavilerin klinik öncesi testleri için kullanılabilecek M-LMD'nin murin modellerini oluşturmak için bu hücrelerin in vivo intratekal olarak aşılanması yeteneği gösterilmiştir. Bu araçlar, meninkslerde CSF-CTC oluşumunu yönlendiren altta yatan biyolojinin çözülmesine ve M-LMD ile ilişkili morbidite ve mortalitenin azaltılmasına yönelik yeni tedavilerin tanımlanmasına yardımcı olabilir.
Giriş
Leptomeningeal hastalık (LMD), dolaşımdaki tümör hücreleri (CTC'ler) beyin omurilik sıvısına (BOS) yayıldığında ve beyin ve omuriliği çevreleyen zar olan meninkslerde yerleştiğinde ortaya çıkar 1,2. LMD birçok kanserde ortaya çıkabilir, ancak özellikle melanomda yaygındır. Melanomun ileri evrelerinde, hastaların yaklaşık% 5'inde melanom ile ilişkili M-LMD 2,3 gelişecektir. Diğer metastaz bölgelerine göre nispeten düşük olsa da, M-LMD'nin sonuçları yıkıcıdır, genel sağkalım haftalar ila aylar arasında değişir ve hasta morbiditesine önemli bir katkıda bulunur 1,3,4. Bunun başlıca nedeni, leptomeninglerin melanom hücreleri tarafından nasıl kolonize edildiğine dair bilgimizdeki büyük boşluklarla birlikte etkili tedavi seçeneklerinin yetersizliğidir2. Bu nedenle, M-LMD'nin biyolojisini anlamak, klinik sonuçları iyileştirmek için yeni tedavilerin tasarlanmasını kolaylaştıracaktır.
Son raporlar, CTC'lerin benzersiz BOS mikro ortamını nasıl kolonize ettiğini göstermiştir. Örneğin, Kompleman C3, beynin her ventrikülünde karmaşık bir kan damarı ağı olan koroid pleksus yoluyla tümör hücrelerinin BOS'a istilasını teşvik eder5. Ayrıca, BOS'taki kıt mikro besinlere yanıt olarak, CTC'ler, demir süpürücü bir protein olan lipokalin-2'yi ve reseptörünü sağkalımı artırmak için SLC22A17 artırabilir6. Grubumuz, BOS'un omik temelli analizlerini kullanarak, BOS'un insülin benzeri büyüme faktörü (IGF) sinyalini düzenleyen proteinlerin yanı sıra doğuştan gelen bağışıklığı da zenginleştirdiğini buldu3. Birlikte, bu veriler M-LMD'yi incelemek için sıvı biyopsilerden elde edilen CSF-CTC'lerin değerini vurgulamaktadır.
BOS-CTC'ler bazen lomber ponksiyon, Ommaya rezervuarı veya hızlı otopsiler yoluyla hasta BOS örneklemesi ile tanımlanabilse de, önemli bir sınırlama bu nadir ve kırılgan hücrelerden yeterli sayıda elde etmektir 1,7. Örneğin, CTC numaralandırma tekniği kullanılarak, hasta BOS numunesi7 başına yalnızca birkaç yüz ila birkaç bin tümör hücresi tanımlanabilir, bu da in vitro veya in vivo moleküler ve fonksiyonel analizlerin yapılmasını zorlaştırır. Periferik kandan (yani meme kanseri CTC'leri) ex vivo olarak kısa süreliğine büyüyen CTC'lerde başarı raporları olmasına rağmen8,9,10, bu hücreler genellikle sadece kısa vadede büyür ve BOS'ta melanom CTC'lerini büyütebildiğine dair herhangi bir vaka bildirilmemiştir. Bu nedenle, melanom CSF-CTC'leri veya genel olarak CTC'leri yaymanın yollarını bulmak, M-LMD 7,11'in biyolojisini incelemek için oldukça faydalı olacaktır.
İlk kez, M-LMD hastalarından CSF-CTC'leri ex vivo olarak çoğaltmak için yeni bir teknik tanımlanmıştır. Bu raporda, M-LMD hastalarından BOS-CTC'lerin kültürlenmesine ve genişletilmesine izin veren ayrıntılı bir protokol geliştirilmiştir. Meninksler, çevresini çevreleyen büyümeyi destekleyen FGF, IGF, VEGF-A ve IGFBP'ler gibi çeşitli büyüme faktörleri salgıladığından 12,13,14,15,16, CSF-CTC'lerin bu bileşenlerin ex vivo koşullarda büyümesini gerektirebileceği rasyonelleştirildi. Bu nedenle, bu protokol, insan meningeal hücrelerinin- (HMC'ler-) in vitro olarak kültürlenmesiyle oluşturulan koşullu ortamı kullanır. İn vivo aşılama için, hastadan türetilen hücreler, hastadan türetilen BOS-CTC'ler (PD-CSF-CTC'ler) hatları oluşturmak için immün yetmezliği olan farelere aşılanır. Hasta kaynaklı M-LMD hücrelerinin mevcudiyeti, M-LMD'yi incelemek ve bu ölümcül hastalık için yeni tedavi stratejileri önermek için hücresel, moleküler ve fonksiyonel testleri destekleyecektir.
Protokol
Kimliği belirsiz hasta BOS örneklerinin toplanması, Güney Florida Üniversitesi Kurumsal İnceleme Kurulu (IRB) (MCC 50103, 50172 ve 19332) tarafından onaylandı. M-LMD'li hastalar, pozitif BOS sitolojisi, beynin ve / veya omurganın karakteristik bir manyetik rezonans görüntülemesi (MRG) veya klinik bulguların düşündürücü MRG bulguları ile bir kombinasyonu dahil olmak üzere çeşitli şekillerde teşhis edilebilir. Bu M-LMD hastalarından alınan BOS, standart klinik bakımlarının bir parçası olarak rutin olarak toplandı. Klinik bir endikasyon olmadıkça herhangi bir işlem yapılmaz. Hastalardan örnek toplanması ve bunların araştırma ve yayın için kullanılması için bilgilendirilmiş onam alındı. İn vivo murin-LMD modellerinin oluşturulması, Güney Florida Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC # IS00010398) tarafından onaylandı. Bu protokolün genel şeması Şekil 1'de özetlenmiştir. Çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. HMC şartlandırılmış ortamın hazırlanması
- Bir T175 şişesini 2 μg/cm2'de poli-l-lizin ile önceden kaplayın.
- Şişeyi 1 saat boyunca 37 ° C'lik bir inkübatöre koyun.
- Steril bir serolojik pipet kullanarak poli-l-lizin çözeltisini aspire edin. Şişenin durulanması gerekli değildir ve HMC kültürü için hazırdır.
- % 5 fetal sığır serumu,% 1 meningeal hücre büyüme takviyesi ve% 100 IU / mL penisilin-streptomisin antibiyotik çözeltisi içeren 30 mL tam Meningeal Kültür Ortamında (MenCM) yaklaşık 1.0 x10 6 HMC'yi kültürleyin. Hücre kültürü inkübatöründeki hücreleri, 37 ° C ve% 5 CO2'de standart doku kültürü koşullarında kültürleyin.
- Medyayı her 3 günde bir değiştirin.
- Hücreler yaklaşık% 75 -% 80 birleşmeye ulaştığında, HMC kültürlenmiş ortamı 50 mL'lik konik bir tüpte toplayın ve saklayın.
- HMC'leri yeni T175 şişelerine bölün ve daha fazla HMC kültürlü ortama ihtiyaç duyulursa taze komple MenCM'yi kullanın.
- HMC kültürlü ortama 1: 1 oranında tam MenCM ekleyin.
- 20 ng/mL fibroblast büyüme faktörü (FGF) ve 20 ng/mL epidermal büyüme faktörü (EGF) ekleyin, bu da CSF-CTC'ler için HMC şartlı ortam haline gelecektir.
NOT: CTC'ler kültürlenmeye hazır olduğunda taze FGF ve EGF eklenmesi önerilir. - HMC şartlandırılmış ortamı 4 °C'de 50 mL'lik alikotlarda saklayın.
NOT: Alikotlarda HMC ile koşullandırılmış ortamın 4 °C'de saklanması, ancak 4 haftadan fazla olmaması önerilir.
2. CSF'nin toplanması ve numune işleme
- Santrifüjü 4 °C'ye ayarlayarak soğutun.
- Hastadan alındıktan sonra, BOS örneğini serin tutmak için hemen buz üzerinde 15 mL'lik konik bir tüpe yerleştirin.
NOT: IRB onaylı protokolümüz, rıza gösterilen hastadan 7.5 mL BOS çekilmesine izin verir. - BOS'u 257 ° C'de 5 dakika boyunca 4 x g'da santrifüjleyin.
- Alttaki hücre peletini rahatsız etmeden BOS süpernatantını çıkarın, kaydedin ve alikotlarını yapın. BOS süpernatan alikotları, daha fazla analiz için gerekirse -80 ° C'de donmuş olarak saklanabilir.
NOT: Pelet çıplak gözle görülemeyebilir; bu nedenle tüpün dibinde ~ 40-50 μL bırakılması önerilir. - Aynı tüpte, hücreleri yeniden süspanse etmek ve durulamak için 1 mL steril fosfat tamponlu salin (PBS) ekleyin ve 4 ° C'de 5 dakika boyunca 257 x g'de dönüşü tekrarlayın.
NOT: (İsteğe bağlı) Numune kan kontaminasyonu içeriyorsa kırmızı kan hücresi (RBC) lizisi gerçekleştirin. Bununla birlikte, CTC'ler de dahil olmak üzere işlem sırasında bazı hücrelerin kaybolabileceğini unutmayın. CTC'ler, RBC lizis prosedürü olmadan çoğaltılabilir. - Hücre peletini bozmadan PBS'yi çıkarın ve atın ve altta ~ 50 μL bırakın.
- Hücre canlılığını belirlemek için hücre sayımı yapın. Buradan, büyüyen CSF-CTC'lere devam etmek için iki seçenek vardır: in vitro kültür (adım 3) veya in vivo hasta kaynaklı ksenogreft genişletme girişimi (adım 4).
NOT: CSF-CTC'ler daha sonra kültürlenecekse, hücreleri, yayılmaya hazır olana kadar hücre kültürü dondurma ortamında dondurarak saklayın. Hücre kültürü dondurma ortamı %90 FBS + %10 DMSO kullanılarak yapılabilir. Fazla BOS mevcutsa (yani, hastalardan birden fazla BOS toplanması veya otopside BOS toplanırsa), CTC'ler, numuneyi CTC sayım testi17 için göndererek veya melanom belirteci için immünofloresan (IF) boyaması (yani, anti-MLANA) CTC'lerin miktarı ve canlılığı hakkında fikir verebilir. Bu deneyler yapıldıktan sonra hücreler kurtarılamaz. Bu nedenle, hastadan yedek BOS örneği yoksa önerilmez.
3. CSF-CTC'lerin in vitro kültür ve genişletilmesi
- CSF-CTC'leri HMC koşullandırılmış ortamda yeniden askıya alın. CSF-CTC'ler kriyoprezervasyonluysa, hücreleri çözün, döndürün ve PBS ile nazikçe yıkayın.
- Tüm hücreleri, oyuk başına 150 μL hacme sahip 96 oyuklu bir plakada üçlü oyuklara bölün. Sadece canlı hücreler gece boyunca yüzeye hafifçe yapışır.
NOT: BOS-CTC'lerin sayısı tek bir hasta numunesi başına büyük ölçüde değişebilir (Tablo 1). Düşük CTC sayısına sahip hastalar için, kültürleme için bir başlangıç noktası olarak 96 oyuklu bir plaka kullanılır ve CTC'leri kaybetme korkusuyla tüm pelet sayılmadan kaplanır. Bununla birlikte, daha büyük miktarda BOS varsa (yani bir otopsiden elde edilmişse), hücreleri saymak mümkündür. Tüm tümör hücreleri ex vivo olarak büyüyemez; Bazıları statik hale gelmeden önce birkaç geçiş için yavaşça genişleyecektir. Şu anda, ex vivo büyüyen melanom CSF-CTC'lerin başarı şansı yaklaşık %60'tır7. - Her 3 günde bir, taze HMC şartlandırılmış ortam ekleyerek doldurun veya pipet ucunu kuyunun yan tarafına yerleştirerek, kuyunun tabanını bozmadan geride bir miktar sıvı bırakarak ortamı nazikçe çıkarın ve ardından taze HMC koşullu ortamla değiştirin.
- Ex vivo CSF-CTC'ler genişlediğinde ve% 90 birleştiğinde, tüm kuyuyu tripsinize edin ve 24 oyuklu bir plakadaki yeni bir kuyuya aktarın. 24 oyuklu bir kuyucuktaki kuyu birleştiğinde, onu 12 oyuklu bir plakaya, ardından 6 oyuklu bir plakaya aktarın ve bu şekilde devam edin.
NOT: Tripsinizasyondan sonra, yedek olarak kaplamadan önce hücre kültürü dondurma ortamında (%10 DMSO + %90 FBS) küçük bir CTC alt kümesini dondurarak saklamayı düşünün. - CTC'leri kültürlemeye devam edin. Bazı hücreler kısa vadede çoğalabilir ve sonunda statik hale gelebilir. Bununla birlikte, bir veya daha fazla klon üstel olarak dönüşebilir ve genişleyebilir (Şekil 2A). İn vitro hastadan türetilen CSF-CTC (PD-CSF-CTC'ler) kültürleri olacak bu klonları seçin.
NOT: Bu klonlar aşırı kalabalıklaşırsa veya kümelenirse, hücreleri taze bir doku kültürü plakasında/şişesinde tripsinize edin ve yeniden plakalayın.
4. Hücre hattından türetilmiş ksenogreft (CDX) veya hastadan türetilmiş ksenogreft (PDX) modeli oluşturmak için CSF-CTC'lerin in vivo inokülasyonu
NOT: Bir PDX modeli, kanser hücrelerinin doğrudan bir kanser hastasından ( ex vivo kültür olmadan) aşılanmasını içerirken, CDX modeli kanser hücre dizilerini veya bu durumda çoğaltılmış ve ölümsüzleştirilmiş CTC'leri kullanır18.
- BOS-CTC aşılaması için 6-8 haftalık dişi immün yetmezlikli NOD SCID gama (NSG) fareleri kullanın. NSG'ler, ciddi şekilde immün yetmezlik yaşadıkları ve insan tümör hücresi engraftmanına çok açık oldukları için kullanılır19. Bağışıklık yetersizlikleri nedeniyle, bu fareler sıkı bir şekilde kontrol edilen hijyenik bir ortamda tutulmalı ve diğer fare türlerinden izole bir şekilde barındırılmalıdır. Murin-LMD'yi oluşturma yöntemi,20'nin başka bir yerinde ayrıntılı olarak açıklanmıştır.
NOT: ex vivo hücreler (kültürlenmeden sadece 2. adımda işlenmiş olan hastaların CSF-CTC'leri) PDX modelini oluşturmak için kullanılır; LMD ilerlemesini belirlemek için hayvanın fiziksel gözlemi ve beynin MRG'si gereklidir. Öte yandan, in vitro kullanılan CDX modeli ile PD-CSF-CTC'ler bir lusiferaz raportörü ile etiketlenebilir ve LMD'nin durumu biyolüminesan görüntüleme (BLI) ile değerlendirilebilir. Bu raporda kullanılan hücre etiketleme sistemi, tümör büyümesi ile orantılı olarak duyarlılığı arttırdığı gösterilen bir substrat olarak furimazin kullanan bir NanoLuc (NL) raportörüdür21. NL ekspresyonu ile CTC hücre büyümesinde (in vitro veya in vivo) bir girişim gözlenmedi. - Şu yöntemleri kullanarak LMD ilerlemesinin belirtilerini kontrol edin: fiziksel gözlem: kilo kaybı, baş eğme ve kambur sırt. MRG: genişlemiş ventriküller ve hidrosefali belirtileri (Şekil 2B). BLI: CNS bölgesindeki pozitif biyolüminesan sinyaller (Şekil 2C).
5. Sonraki klon genişlemesi için LMD'li farelerden BOS toplama
- NSG faresini% 4 izofluran ile LMD ile (kurumsal olarak onaylanmış protokolleri izleyerek) doğrultma refleksi belirtisi göstermeyene kadar uyuşturun.
- Başın tüm ventral yüzeyinin kürkünü tıraş ederek fareyi hazırlayın ve cildi steril teknik kullanarak hazırlayın.
- Burun deliklerinin engellenmediğinden emin olmak için stereotaktik aparatın modifiye edilmiş L şeklinde bir burun konisi kullanarak burnu konumlandırın. Cildi, her iki kulak kepçesinin ventral yüzeyleri boyunca bantla nazikçe öne çekerek, burun konisine sabitleyerek ve ardından sabitledikten sonra boynu yaklaşık 90°'lik bir açıyla bükerek sabitleyin. Anesteziyi sürdürmek için% 1.5 -% 3 izofluran uygulayın.
- Boynu tamamen uzatarak ve kulak kepçesinin hemen arasından başlayarak, cerrahi makas uçlarını hafif bir basınçla oksipital kemik boyunca aşağı doğru yönlendirin.
NOT: Bu orta hat konumunda, makas uçları cisterna magna üzerindeki içbükey alana girerken ince bir çöküntü fark edilebilir. - Palpe edilen içbükeyliğin hemen üzerinde 5-7 mm ölçülerinde küçük bir orta hat insizyonu oluşturun.
- Cisterna magna'ya nazikçe baskı uygulamak için 1-2 mm uçlu künt uçlu forseps kullanın. Uçları kapalı bir konumda yerleştirin ve dura üzerine aşağı doğru baskı uygularken açın.
- Künt diseksiyon işlemini, dural membran açıkça fark edilebilir hale gelene ve ilişkili kan damarları açıkta kalan alanda görünür olana kadar 6. adımda belirtildiği gibi tekrarlayın.
- Çevredeki kas sistemini geri çekmek için forsepsleri açık tutarken, eğimi görselleştirmek için duranın altına 1 mL'lik bir şırıngaya bağlı 27-29 G'lik bir iğne yerleştirin. İğnenin eğimin hemen ötesine nüfuz ettiğinden emin olun. Şırınga pistonunu yavaş yavaş geri çekin.
- Fare ötenazisinden önce mümkün olduğunca fazla BOS toplayın (genellikle 15-30 μL arasında).
NOT: Ötenazi, kurumsal olarak onaylanmış protokolleri izleyerek, konuyu artan basınçlı CO2 gazı konsantrasyonlarına maruz bırakarak gerçekleştirilir. Örneğin, rahatsızlık veya sıkıntıyı önlemek veya azaltmak için dakikada oda hacminin %30 ila %70'i arasında bir yer değiştirme oranı kullanılacaktır. Bunu, oda havasında 10 dakikadan daha uzun süre gözlem yaparak kardiyovasküler ve solunum hareketlerinin durmasını sağlamak takip eder. - BOS'u şırıngadan bir mikrosantrifüj tüpüne yerleştirin ve buzun üzerine yerleştirin.
- Numuneyi 4 °C'de 5 dakika boyunca 257 x g'da döndürün ve hücre peletini bozmadan sıvıyı nazikçe çıkarın (daha fazla analiz için gerekirse fare BOS örneğini -80 °C'de dondurun).
- 500 μL steril PBS ekleyin ve hücre peletini yıkayın; Oda sıcaklığında 5 dakika boyunca 257 x g'de sıkma işlemini tekrarlayın.
- HMC ile koşullandırılmış ortamdaki hücreleri 96 oyuklu bir plakada yeniden süspanse edin.
NOT: İn vivo olarak aşılanmış ve başarılı bir şekilde LMD'ye büyütülmüş CSF-CTC'ler, normal hücre kültürleri gibi büyüyebilmelidir. Her 3 günde bir medya değiştirerek genişletmeye devam edin. Hücreler birleştiğinde hücreleri tripsnize edin ve daha büyük bir hücre kültür aparatına aktarın. Bu hücreler in vivo PD-CSF-CTC kültürleri haline gelecektir. Mevcut raporda, CDX modelinde %100'lük bir başarı oranı vardı ve henüz bir PDX M-LMD oluşturmadılar.
Sonuçlar
CSF-CTC'lerin ex vivo olarak başarılı bir şekilde büyümesi için gereksinimlerin anlaşılması devam eden bir çabadır. Bu amaçla, BOS mikro çevresini taklit eden temel faktörlerin sağlanmasının kilit öneme sahip olduğuna inanılmaktadır22. İnsan meningeal hücreleri (HMC'ler), FGF-2, EGF, IGFBP2 ve IGFBP6 dahil olmak üzere BOS'a çeşitli büyüme faktörleri salgılar ve CTC hücrelerinin büyümesini desteklediği bilinmektedir 12,13,14,23,24. Bu nedenle, CTC sağkalımı için gerekli olan potansiyel olarak önemli bileşenleri belirlemek için HMC ile koşullandırılmış ortam üzerinde bir insan sitokin dizisi analizi yapıldı. Gerçekten de, HMC'lerle kültürlenen ortamda çeşitli büyüme faktörleri yukarı regüle edilmiştir (Şekil 3A). Örneğin, granülosit-makrofaj koloni uyarıcı faktör (GM-CSF), VEGF-A ve IGFBP'ler (IGFBP2, 3, 4 ve 6).
Hastalardan alınan BOS hücresel bileşenleri, CTC'ler, bağışıklık hücreleri ve fibroblastlar gibi çoklu hücre tiplerinden oluşabilir. CTC olmayanlar eninde sonunda fazla mesai yapmayı bırakacaktır. Genel olarak, başarılı bir şekilde çoğalan ve çoğalmada kalan hücreler kanser (M-LMD) hücreleridir. Kültürde büyüyen hücrelerin doğrulanması, daha önce gösterilmiş olan MLANA ekspresyonunun IF tespiti ve transkriptomik analizler ile yapılabilen M-LMD hücreleridir7.
Yerleşik in vitro ve in vivo PD-CSF-CTC hatlarının potansiyel kullanımını ve uygulamasını göstermek için bir kavram kanıtı olarak, tek hücreli RNA dizileme (scRNA-dizilimi) analizi kullanıldı ve sonuçlar, kültürlenmemiş hasta BOS-CTC'lerinden zenginleştirilmiş ve tutulan birkaç geni ortaya çıkardı7. Bunlardan ikisi, melanom ilerlemesi ve kemoterapi direnci üzerinde etkileri olan reseptör tirozin-protein kinaz ErbB3 ve IGF-1R'yi içerir 25,26,27.
CSF-CTC sağkalımında bir rol oynayıp oynamadıklarını test etmek için, sırasıyla ErbB28 ve IGF-1R 7,29'u hedefleyen FDA onaylı ilaçlar tucatinib ve ceritinib ile tedavi edilen PD-CSF-CTC'ler üzerinde bir kristal viyole proliferasyon testi yapıldı. Anti-IGFBP2 antikoru, PD-CSF-CTC kültürlerinin büyümesini engellemesi gereken pozitif bir kontrol olarak dahil edildi. Sonuçlar, IGFBP2 veya IGF-1R'nin yokluğunun PD-CSF-CTC'lerin proliferasyonunu azaltmada etkili olduğunu göstermiştir (Şekil 3B). MAPK sinyalinin IGF-1R'nin aşağı akışında olduğu göz önüne alındığında, kalsein-canlı hücre boyama ve MTT hücre sağkalım testleri, üç M-LMD PD-CSF-CTC hattında, seritinib veya MAPK inhibitörleri, dabrafenib ve trametinib veya üçünün bir kombinasyonu ile muamele edilerek de gerçekleştirildi. Veriler, her üç hücre hattının canlılığının seritinib tarafından önemli ölçüde azaldığını, dabrafenib ve trametinib'in ise karışık etkilere sahip olduğunu göstermiştir (Şekil 3C). Debrafenib ve trametinib tedavilerinden elde edilen sonuç şaşırtıcıydı. Her üç PD-CSF-CTC hattı da BRAFV600E mutasyonu7 barındıran M-LMD hastalarından türetilmiştir. Bu, gelecekte araştırılması gereken bir şey olan CSF-CTC'lerin edinilmiş bir kemo-direnç etkisini düşündürebilir.
Daha sonra, PD-CSF-CTC'lerin in vivo olarak nasıl kullanılabileceğine bir örnek olarak, murin-M-LMD modelleri, değişen sayıda PD-CSF-CTC ile intratekal olarak aşılanarak oluşturulmuştur. Farelerde medyan sağkalım süreleri belirlendi (Şekil 3D). M-LMD ilerlemesini görselleştirmek için, PD-CSF-CTC çizgileri, NL raportör sistemi21 gibi bir biyolüminesan işaretleyici ile etiketlendi ve BLI tarafından yakalandı (Şekil 2C). LMD metastazlarının yeri, melanom hücrelerinin bir belirteci olarak protein melan-A (MLANA)30 ile immünohistokimya kullanılarak da gösterildi (Şekil 3E). M-LMD'ye karşı terapötik stratejileri in vivo test etmek için bir kavram kanıtı olarak, murin-M-LMD kohortlarına günlük oral monoterapisi ceritinib veya trametinib veya dabrafenib ve trametinib veya ceritinib ve trametinib'in bir kombinasyonu verildi. Kontrol (tedavi edilmemiş) kohort, karşılaştırma olarak oral salin aldı. Sonuçlar, ceritinib ve trametinib ile tedavi edilen kohortta önemli ölçüde uzun süreli sağkalım (Şekil 3F) ve gecikmiş hastalık tespiti (Şekil 3G) gösterdi (tedavi edilmemiş M-LMD medyan sağkalımı: 28.5 gün vs. ceritinib ve trametinib ile tedavi edilen M-LMD medyan sağkalımı: 38.5 gün; P değeri = 0.0052). Bu veriler, yeni terapötiklerin etkinliğini belirlemek için klinik öncesi çalışmaların yürütülmesi için geliştirilen M-LMD PD-CSF-CTC hatlarının potansiyel kullanışlılığının altını çizmektedir.
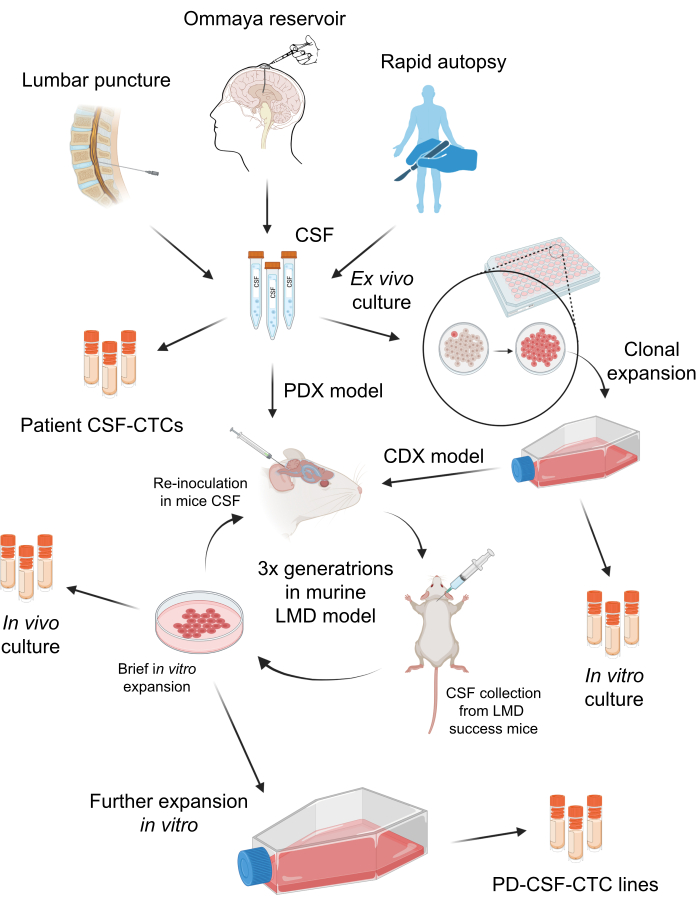
Şekil 1: Hasta kaynaklı BOS dolaşımındaki tümör hücrelerinin (PD-CSF-CTC'ler) oluşturulması sürecine şematik bir bakış. Hastalardan alınan BOS lomber ponksiyon, Ommaya rezervuarı veya hızlı otopsiler yoluyla örneklenebilir. Bir dizi in vitro ve in vivo çoğaltma yoluyla, her adım bir PD-CSF-CTC hattı oluşturana kadar bir ara BOS-CTC kültürü (yani hasta BOS-CTC'leri, in vitro kültür, in vivo kültür) oluşturur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
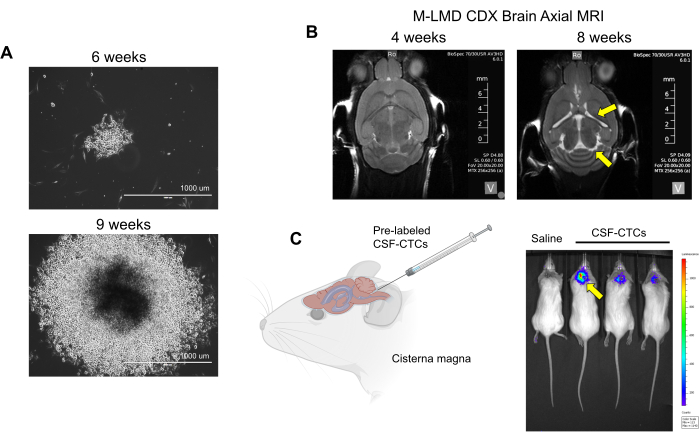
Şekil 2: M-LMD hastalarından elde edilen CSF-CTC'lerin in vitro ve in vivo kültürleme örnekleri. (A) HMC ile koşullandırılmış ortamda 6 hafta ve 9 haftada bir M-LMD CSF-CTC kolonisinin in vitro büyümesini gösteren temsili parlak alan görüntüleri. Ölçek çubuğu: 1000 μm. (B) PD-CSF-CTC'ler ile intratekal olarak aşılandıktan 4 hafta ve 8 hafta sonra MRG görüntüleri; M-LMD'nin bir fare modelinin başarılı bir şekilde kurulması. Sarı oklar, bu M-LMD farede genişlemiş ventriküllere ve olası hidrosefaliye işaret ediyor. (C) Farelerde M-LMD gelişiminin temsili BLI görselleştirmesi. Şekil Law ve ark.7'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
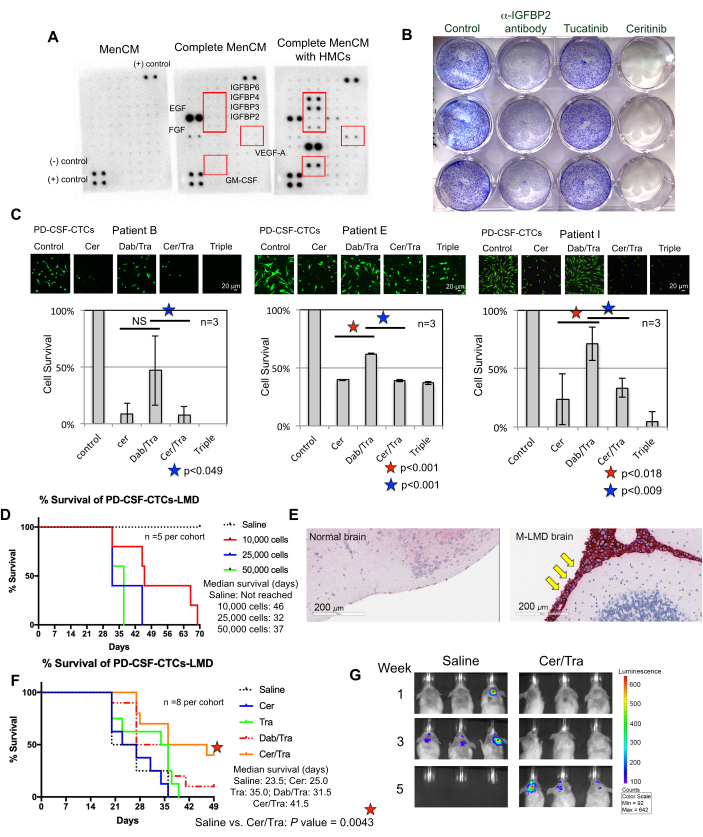
Şekil 3: PD-CSF-CTC çizgileri, M-LMD'yi incelemek için çeşitli klinik öncesi deneylerde kullanılır. (A) İnsan meningeal hücrelerinin (HMC'ler) varlığında kültür ortamında (MenCM) farklı salgılanan büyüme faktörlerinin (yani, IGFBP'ler, VEGF-A ve GM-CSF) artışını gösteren bir insan sitokin dizisi. (B) Anti-IGFBP2 antikoru, tucatinib ve seritinib'in PD-CSF-CTC hatlarından birine karşı etkinliğini belirlemek için bir kristal viyole hücre proliferasyon testinin taranmış bir görüntüsü. Kontrol koşuluna araç tedavisi uygulandı. Deney üç nüsha halinde gerçekleştirilmiştir. (C) İn vitro olarak kurulan üç farklı PD-CSF-CTC hattının (09, 12 ve 16 hastalarından) hücre sağkalım testi. Hücreler ya seritinib (cer), dabrafenib (dab) + trametinib (tra), cer + tra kombinasyonu ya da üçünün tümü ile tedavi edildi. Hücreler tedaviden 72 saat sonra toplandı. Hücre canlılığını görselleştirmek için kalcein-boyaması kullanıldı ve hücre sağkalımını belirlemek için bir MTT testi kullanıldı. İstatistiksel analiz için eşleştirilmiş örneklem t-testi kullanıldı. Ölçek çubukları: 20 μm. (D) Bir murin M-LMD modelinin hayatta kalma eğrisi. NSG fareleri, 10.000, 20.000 ve 50.000 hücrede PD-CSF-CTC hatlarından biri ile intratekal olarak (cisterna magna yoluyla ) aşılandı. M-LMD farelerinin medyan sağkalımı belirlendi. (E) M-LMD farelerinin beyin bölümlerinde melanom için bir belirteç olan MLANA için IHC tespiti. Pozitif MLANA, meninkslerde (kırmızı ile boyanmış; sarı oklarla işaretlenmiş) bulunurken, normal (sağlıklı) beyin kanser büyümesi göstermedi (MLANA için negatif). Ölçek çubukları: 200 μm. (F) Günlük oral salin, cer, tra, dab / tra veya cer / tra verilen murin M-LMD kohortlarının temsili bir etkinlik deneyi. Farelerin sağkalımı belirlendi. İstatistiksel analiz için log-rank (Mantel-Cox) testi kullanıldı. (G) 5 hafta içinde M-LMD ilerlemesinin temsili BLI görüntüleri, kontrol (salin) ile tedavi edilen ve karşılaştırıldığında. cer/tra ile tedavi edilen murin M-LMD kohortları. Şeklin (C) numaralı paneli Law ve ark.7'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: M-LMD hastalarında ex vivo kültür için elde edilen klinik BOS-CTC'lerin özeti. BOS-CTC'leri yayılmaya çalışılan 11 M-LMD hastasının özet tablosu. Tablodaki hastalar daha önce Law ve ark.7'de karakterize edilmişti. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
M-LMD yıkıcı, evrensel olarak ölümcül bir hastalıktır ve daha iyi tedavi stratejileri bulmak için acil bir ihtiyaç vardır. M-LMD çalışmasının önündeki en büyük engellerden biri, moleküler ve fonksiyonel çalışmaları gerçekleştirmek için yeterli CSF-CTC'lerin elde edilememesidir 1,7. Meme ve yumurtalık kanserleri gibi diğer kanser türlerinin periferik kanından ve BOS'undan CTC'leri kültürlemek için mevcut yöntemler olmasına rağmen 11,31,32, bu CTC yayılma yöntemleri genellikle kısa sürelidir ve melanomdan BOS-CTC'lerin kültürlenmesinde rapor edilmiş bir başarı yoktur. Ek olarak, CTC'lerin çoğaltılması için mevcut metodolojiler kısa süreli ex vivo ortamlarda mevcuttur ve henüz hasta LMD hücrelerinden türetilen bir in vivo LMD modeli vermemiştir. Burada, bu hücreleri in vitro ve in vivo olarak kültürlemek için yeni bir protokol sunulmaktadır ve bu da hastadan türetilen benzersiz hücre hatlarına yol açmaktadır. Şu anda, çalışmadaki 11 M-LMD hastasından, M-LMD CSF-CTC'lerin in vitro olarak çoğaltılmasında yaklaşık% 60 (11'in 7'si) başarı şansı vardı ve bu, CDX yöntemi kullanılarak in vivo olarak ~% 20'ye (11'in 2'si)düşürüldü 7.
İn vitro koşulların BOS mikro ortamını özetlemediği açıktır. Bununla birlikte, proteomik yaklaşımlar daha önce BOS'taki protein bileşenlerini incelemek için gerçekleştirilmiş ve CTC büyümesi ex vivo3 için gerekli olan temel faktörler hakkında bazı bilgiler sağlamıştır. Örneğin, M-LMD hastalarında CTC sağkalımını destekleyen ana yollardan birinin, IGF ile ilişkili aktivitelerin artması ile ilişkili olduğu tespit edilmiştir 3,7. Ayrıca, çalışmalar, leptomeninglerin FGF-2, EGF, GM-CSF ve IGF sinyalleme12 ile ilgili proteinler dahil olmak üzere BOS'a çeşitli sitokinler/büyüme faktörleri salgıladığını göstermiştir. Nitekim bu, HMC'lerle kültürlenen medyada özetlendi ve bu büyüme faktörlerinin CSF-CTC büyümesini teşvik etmede potansiyel bir rolünü destekledi.
Bir PDX (veya CDX) modeli oluşturmanın en büyük avantajı, in vitro koşullarda eksik olan hastalık patolojisi hakkında daha derin bilgiler edinme yeteneğidir. İdeal olarak, BOS-CTC'ler ex vivo kültürleme yapılmadan doğrudan hastalardan alınacağı için bir PDX yaklaşımı tercih edilir. Başlangıçta, bu yaklaşımı kullanarak M-LMD oluşturmak için girişimlerde bulunuldu, ancak şu ana kadar başarılı olamadılar. PDX farelerinin üretilmesindeki zorluk, muhtemelen başlangıç materyalinin bolluğu ve bütünlüğü ile ilişkilidir (yani, klinikte rutin toplama sırasında hasta BOS'unda çok az sayıda canlı CTC). Bu, otopsi7'de toplanan CSF'den CTC'leri büyütmede neden üstün başarı elde ettiğimizi açıklayabilir. İn vivo yayılma olasılığını artırmak için, bu protokol alternatif bir CDX yaklaşımı sağlayacak şekilde değiştirildi. CSF-CTC'ler, uzun vadeli ve daha büyük büyüme potansiyeline sahip PD-CSF-CTC hatları oluşturmak için ilk olarak in vitro olarak (adım 3) genişletilebilir. Bu hücreler daha sonra M-LMD oluşturmak için farelere aşılanır. Mevcut yöntem sınırlı sayıda in vivo CDX M-LMD (~% 20) modeli üretmiş olsa da, bu, CSF-CTC'lerin transkripsiyonel çeşitliliğini, BOS mikro ortamının karmaşıklığını ve genel olarak bu hücrelerin kültürlenmesindeki zorluğu yansıtabilir. İnsanlaştırılmış bir fare modelinin gelecekteki gelişiminin, kanser hücresi canlılığını desteklemede mikro çevrenin önemi göz önüne alındığında, aşılama başarı oranını artırabileceğini varsayıyoruz33.
CDX yaklaşımının bir sınırlaması, hasta örneklerinden yalnızca belirli klonların seçilmesi ve kanser hücrelerinin ex vivo kültürleme yoluyla genetik sürüklenmesinin artık orijinal kaynağın transkripsiyonel profilini yansıtmayabilmesidir. Bununla birlikte, in vitro kültürlemeye rağmen, PD-CSF-CTC hatlarının, izole edilmiş, kültürlenmemiş hasta BOS-CTC'lerine gen ekspresyonunun yaklaşık% 97 benzerliğini koruduğu bildirilmiştir7. Bu çalışmada, scRNA-seq analizleri, kültürlenmemiş, in vitro PS-CSF-CTC'ler ile in vivo PD-CSF-CTC'ler arasında SOX9, ErbB3 ve IGF-1R7 gibi örtüşen zenginleştirilmiş gen imzalarını ortaya çıkardı ve bu da bunların potansiyel terapötik hedefler olabileceğini düşündürdü. Ek olarak, bu yaygın olarak zenginleştirilmiş genler, transkripsiyonel düzenleme ve metabolizma ile ilişkili biyolojik yollarda yer alır7. Toplu olarak, bu, M-LMD'nin biyolojisini daha iyi anlamak, hastalığı yönlendiren hedeflenebilir moleküler mekanizmaları ve yolakları belirlemek ve gelecekteki çalışmalarda rasyonel tedaviler tasarlamak için PD-CSF-CTC kültürlerinin translasyonel değerini vurgulamaktadır.
M-LMD hastalarında BOS-CTC'lerin durumunu ve canlılığını önceden belirlemenin bir yolu olmadığı için mevcut metodoloji kusurlu kalsa da, CTC'lerin sayıca düşük ve oldukça kırılgan olması nedeniyle başarı olasılığını artıracak çeşitli gözlemler yapılmıştır. Bu kritik adımlar, BOS örneklerinin çekilir çekilmez buz üzerine yerleştirilmesi ve hücresel bütünlüğü korumak için hızlı bir şekilde laboratuvara taşınması için klinikle koordinasyonu içerir. Daha sonra, CSF-CTC'ler, kültürde kaplanarak veya hücrelerin dondurularak saklanması yoluyla derhal işlenmelidir.
Genel olarak, CSF-CTC'lerin kültürlenmesi ve genişletilmesi bir deneme-yanılma süreciydi, ancak hastadan türetilen M-LMD hücreleri oluşturmak için bu protokolün kurulması, araştırmacılara daha önce yapılamayan hasta örnekleriyle deneyler yapmak için gereken kaynakları sağlayacaktır. İleriye dönük önemli bir hedef, M-LMD'yi tedavi etmek için rasyonel tedaviler tasarlamak için moleküler karakterizasyon, yüksek verimli ilaç taraması ve in vivo ilaç etkinliği çalışmaları yapmak için M-LMD PD-CSF-CTC'leri kullanmaktır. Bu yaklaşımın, ilerlemiş metastatik melanomun şu anda ölümcül olan bu yönü ile ilişkili morbidite ve mortaliteyi büyük ölçüde azaltacak tedavi stratejilerine yol açacağına inanılmaktadır.
Açıklamalar
Peter Forsyth, gönderilen çalışmanın dışında Abvie Inc, Bayer, Bristol Meyers Squib, BTG, Inovio, Novocure, Tocagen ve Ziopharm'ın Danışma Kurullarında görev yapmaktadır. Diğer tüm yazarların ifşa edecek hiçbir şeyi yoktur.
Teşekkürler
Bu bilimsel çalışma için doku bağışında gösterdikleri olağanüstü cömertlik için hastalara ve ailelere teşekkür ederiz. Bu çalışma, Ulusal Sağlık Enstitüleri hibeleri P50 CA168536, R21 CA256289, R21 CA216756 (KSMS ve PAF'a) K99 CA226679 (IS'ye) hibeleri ile desteklenmiştir. Moffitt Vakfı Araştırma Hızlandırma Fonu (BC ve PAF'a), Moffitt Kimyasal Biyoloji ve Moleküler Tıp Programı (PAF ve DD), Moffitt Vakfı (PAF). Moffitt'teki Moleküler Genomik, Doku ve Biyoinformatik ve Biyoistatistik Ortak Kaynak Çekirdekleri, kısmen Ulusal Kanser Enstitüsü tarafından Kanser Merkezi Destek Hibesi (P30-CA076292) ve Moffitt Vakfı aracılığıyla desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL syringe 27 - 29 G needles | Any vendor | n/a | 0.1 mm Sterile Filtered |
| 1.5 mL Eppendorf tubes | Any vendor | ||
| 15 ml and 50 mL polystyrene centrifuge tubes | Any vendor | n/a | |
| 6 - 8 weeks females NOD SCID gamma (NSG) mice | Charles River | Males optional | |
| Buprenorphine Sustained-Release (Bup-SR) | Zoopharm | DEA controlled | |
| Fetal bovine serum (FBS) | ScienCell | #0010 | |
| Gas inhalation anestehsia system | VeteEquip | #901812 | COMPAC5 |
| Hamilton microliter syringes | Hamilton | 10, 25, 50, and 100ml | 30 G for cisterna magna injection |
| Human basic fibroblast growth factor (bFGF) | Milipore Sigma (or any vender) | #F0291 | |
| Human epidermal growth factor (EGF) | Milipore Sigma (or any vender) | #SRP3027 | |
| Human meningeal cells (HMCs) isolated from human leptomeninges | ScienCell | #1400 | |
| IVIS 200 imaging system | Caliper Life Sciences | n/a | |
| Magnifying glass with light | Any vendor | n/a | |
| Meningeal Cell Culture Media (MenCM) | ScienCell | #1401 | |
| Meningeal cell growth supplement (MCGS) | ScienCell | #1452 | |
| MRI imaging | Bruker | BioSpec series | Optional |
| P1000, P200, P20 pipettes/ pipette tips | |||
| penicillin-streptomycin Antibiotic solution | ScienCell (or any vender) | #0503 | |
| Phosphate buffered saline (PBS) | Any vendor | n/a | 0.1 mm Sterile Filtered |
| Rodent Surgical Instruments (Scissors, Forceps) | Roboz Surgical Instrument (or any vendor) | ||
| Screw cap cryo tubes | |||
| Sterile blue paper/ drape covering | Any vendor | n/a | n/a |
| Sterile cotton sticks | Any vendor | n/a | |
| Tissue culture plates/flasks (96-well, 24-well, 12-well, 6-well, T175 etc.) |
Referanslar
- Glitza, I. C., et al. Leptomeningeal disease in melanoma patients: An update to treatment, challenges, and future directions. Pigment Cell Melanoma Res. 33 (4), 527-541 (2020).
- Khaled, M. L., Tarhini, A. A., Forsyth, P. A., Smalley, I., Pina, Y. Leptomeningeal disease (LMD) in patients with melanoma metastases. Cancers (Basel). 15 (6), 1884 (2023).
- Smalley, I., et al. Proteomic analysis of CSF from patients with leptomeningeal melanoma metastases identifies signatures associated with disease progression and therapeutic resistance). Clin Cancer Res. 26 (9), 2163-2175 (2020).
- Larkin, J., et al. Five-year survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med. 381, 1535-1546 (2019).
- Boire, A., et al. Complement component 3 adapts the cerebrospinal fluid for leptomeningeal metastasis. Cell. 168 (6), 1101-1113 (2017).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Law, V., et al. A preclinical model of patient-derived cerebrospinal fluid circulating tumor cells for experimental therapeutics in leptomeningeal disease from melanoma. Neuro Oncol. 24 (10), 1673-1686 (2022).
- Carmona-Ule, N., et al. Short-term ex vivo culture of CTCs from advance breast cancer patients: Clinical implications. Cancers (Basel). 13 (11), 2668 (2021).
- Zhang, L., et al. The identification and characterization of breast cancer CTCs competent for brain metastasis. Sci Transl Med. 5 (180), (2013).
- Yu, M., et al. Cancer therapy: Ex vivo culture of circulating breast tumor cells for individualized testing of drug susceptibility. Science. 345 (6193), 216-220 (2014).
- Mohamed, B. M., et al. Ex vivo expansion of circulating tumour cells (CTCs). Sci Rep. 13 (1), 3704 (2023).
- Decimo, I., Fumagalli, G., Berton, V., Krampera, M., Bifari, F. Meninges: From protective membrane to stem cell niche. Am J Stem Cells. 1 (2), 92-105 (2012).
- Mercier, F., Hatton, G. I. Connexin 26 and basic fibroblast growth factor are expressed primarily in the subpial and subependymal layers in adult brain parenchyma: Roles in stem cell proliferation and morphological plasticity. J Comp Neurol. 431 (1), 88-104 (2001).
- Stylianopoulou, F., Herbert, J., Soares, M. B., Efstratiadis, A. Expression of the insulin-like growth factor II gene in the choroid plexus and the leptomeninges of the adult rat central nervous system. Proc Natl Acad Sci U S A. 85 (1), 141-145 (1988).
- Nordqvist, A. C., Mathiesen, T. Expression of IGF-II, IGFBP-2, -5, and -6 in meningiomas with different brain invasiveness. J Neurooncol. 5, 19-26 (2002).
- Zumkeller, W., Westphal, M. The IGF/IGFBP system in CNS malignancy. Mol Pathol. 54 (4), 227-229 (2001).
- Wang, L., et al. Promise and limits of the CellSearch platform for evaluating pharmacodynamics in circulating tumor cells. Semin Oncol. 43 (4), 464-475 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8, 160 (2023).
- Chen, J., et al. The development and improvement of immunodeficient mice and humanized immune system mouse models. Front Immunol. 13, 1007579 (2022).
- Law, V., et al. A Murine Ommaya xenograft model to study direct-targeted therapy of leptomeningeal disease. J Vis Exp. (167), e62033 (2021).
- Stacer, A. C., et al. NanoLuc reporter for dual luciferase imaging in living animals. Mol Imaging. 12 (7), 1-13 (2013).
- Luo, Y. T., et al. The viable circulating tumor cells with cancer stem cells feature, where is the way out. J Exp Clin Cancer Res. 37, 38 (2018).
- Stumm, R., Kolodziej, A., Schulz, S., Kohtz, J. D., Hollt, V. Patterns of SDF-1alpha and SDF-1gamma mRNAs, migration pathways, and phenotypes of CXCR4-expressing neurons in the developing rat telencephalon. J Comp Neurol. 502 (3), 382-399 (2007).
- Aviezer, D., et al. basal lamina proteoglycan, promotes basic fibroblast growth factor-receptor binding, mitogenesis, and angiogenesis. Cell. 79 (6), 1005-1013 (1994).
- Tiwary, S., et al. ERBB3 is required for metastasis formation of melanoma cells. Oncogenesis. 3 (7), e110 (2014).
- Sun, X., et al. miR-7 reverses the resistance to BRAFi in melanoma by targeting EGFR/IGF-1R/CRAF and inhibiting the MAPK and PI3K/AKT signaling pathways. Oncotarget. 7 (33), 53558-53570 (2016).
- Satyamoorthy, K., Li, G., Vaidya, B., Patel, D., Herlyn, M. Insulin-like growth factor-1 induces survival and growth of biologically early melanoma cells through both the mitogen-activated protein kinase and beta-catenin pathways. Cancer Res. 61 (19), 7318-7324 (2001).
- Lin, N. U., et al. Tucatinib vs Placebo, both in combination with Trastuzumab and Capecitabine, for previously treated ERBB2 (HER2)-positive metastatic breast cancer in patients with brain metastases: Updated exploratory analysis of the HER2CLIMB randomized clinical trial. JAMA Oncol. 9 (2), 197-205 (2023).
- Russo, A., et al. Ceritinib-induced regression of an insulin-like growth factor-driven neuroepithelial brain tumor. Int J Mol Sci. 20 (17), 4267 (2019).
- Ohsie, S. J., Sarantopoulos, G. P., Cochran, A. J., Binder, S. W. Immunohistochemical characteristics of melanoma. J Cutan Pathol. 35 (5), 433-444 (2008).
- Kulasinghe, A., et al. Short term ex-vivo expansion of circulating head and neck tumour cells. Oncotarget. 7 (37), 60101-60109 (2016).
- Li, X., et al. Clinical significance of detecting CSF-derived tumor cells in breast cancer patients with leptomeningeal metastasis. Oncotarget. 9 (2), 2705-2714 (2018).
- Lelliott, E. J., et al. A novel immunogenic mouse model of melanoma for the preclinical assessment of combination targeted and immune-based therapy. Sci Rep. 9 (1), 1225 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır