Method Article
Ex vivo Culture de cellules tumorales circulantes dans le liquide céphalo-rachidien de patients atteints de mélanome pour étudier la maladie leptoméningée associée au mélanome
Dans cet article
Résumé
Cet article décrit un protocole pour la propagation des cellules tumorales circulantes dans le liquide céphalo-rachidien (CTC-LCR) collectées chez des patients atteints de leptoméningée associée au mélanome (M-LMD) afin de développer des modèles précliniques pour étudier M-LMD.
Résumé
La maladie leptoméningée associée au mélanome (M-LMD) se produit lorsque les cellules tumorales circulantes (CTC) pénètrent dans le liquide céphalo-rachidien (LCR) et colonisent les méninges, les couches membranaires qui protègent le cerveau et la moelle épinière. Une fois établi, le pronostic des patients atteints de M-LMD est sombre, avec une survie globale allant de quelques semaines à quelques mois. Cela est principalement dû à un manque de compréhension de la maladie et, par conséquent, à la disponibilité d’options de traitement efficaces. La définition de la biologie sous-jacente de la M-LMD améliorera considérablement la capacité d’adapter les thérapies disponibles pour le traitement de la M-LMD ou de concevoir de nouveaux inhibiteurs pour cette maladie universellement mortelle. Un obstacle majeur, cependant, réside dans l’obtention de quantités suffisantes de CTC à partir du LCR dérivé de patients (CSF-CTC) pour mener des expériences précliniques, telles que la caractérisation moléculaire, l’analyse fonctionnelle et les études d’efficacité in vivo . La culture de CTC-LCR ex vivo s’est également avérée difficile. Pour y remédier, un nouveau protocole est mis au point pour la culture de CCT-CS-CFC M-LMD dérivées de patients, ex vivo et in vivo . L’incorporation de milieux conditionnés produits par les cellules méningées humaines (HMC) s’avère essentielle à la procédure. L’analyse des réseaux de cytokines révèle que les facteurs produits par les HMC, tels que les protéines de liaison au facteur de croissance analogue à l’insuline (IGFBP) et le facteur de croissance de l’endothélium vasculaire-A (VEGF-A), sont importants pour soutenir la survie ex vivo du LCR-CTC. Ici, l’utilité des lignées isolées de CSF-CTC dérivées de patients est démontrée pour déterminer l’efficacité des inhibiteurs qui ciblent les voies de signalisation du facteur de croissance analogue à l’insuline (IGF) et de la protéine kinase activée par les mitogènes (MAPK). De plus, la capacité d’inoculer ces cellules par voie intrathécale in vivo pour établir des modèles murins de M-LMD pouvant être utilisés pour des essais précliniques de thérapies approuvées ou nouvelles est démontrée. Ces outils peuvent aider à démêler la biologie sous-jacente à l’établissement du LCR-CTC dans les méninges et à identifier de nouvelles thérapies pour réduire la morbidité et la mortalité associées au M-LMD.
Introduction
La maladie leptoméningée (LMD) survient lorsque les cellules tumorales circulantes (CTC) se disséminent dans le liquide céphalo-rachidien (LCR) et s’établissent dans les méninges, la membrane entourant le cerveau et la moelle épinière 1,2. La LMD peut survenir dans plusieurs cancers, mais elle est particulièrement répandue dans le mélanome. À un stade avancé du mélanome, environ 5 % des patients développeront un M-LMD 2,3 associé au mélanome. Bien que relativement faibles par rapport aux autres sites de métastases, les conséquences de la M-LMD sont dévastatrices, avec une survie globale allant de quelques semaines à quelques mois, et contribuent de manière significative à la morbidité des patients 1,3,4. Cela est principalement dû à une pénurie d’options de traitement efficaces combinée à des lacunes majeures dans nos connaissances sur la façon dont les leptoméninges sont colonisés par les cellules de mélanome2. Par conséquent, la compréhension de la biologie du M-LMD facilitera la conception de nouvelles thérapies pour améliorer les résultats cliniques.
Des rapports récents ont montré comment les CTC colonisent le microenvironnement unique du LCR. Par exemple, le complément C3 favorise l’invasion des cellules tumorales dans le LCR via le plexus choroïde, un réseau complexe de vaisseaux sanguins dans chaque ventricule du cerveau5. De plus, en réponse à la rareté des micronutriments dans le LCR, les CTC peuvent réguler à la hausse la lipocaline-2, une protéine piégeant le fer, et son récepteur SLC22A17 pour améliorer la survie6. À l’aide d’analyses omiques du LCR, notre groupe a également constaté que le LCR est enrichi en protéines qui régulent la signalisation du facteur de croissance analogue à l’insuline (IGF), ainsi que l’immunité innée3. Ensemble, ces données soulignent la valeur des CTC-LCR provenant de biopsies liquides pour étudier le M-LMD.
Bien que les CTC-LCR puissent parfois être identifiés par prélèvement de LCR de patients via une ponction lombaire, un réservoir d’Ommaya ou des autopsies rapides, une limitation majeure est l’obtention d’un nombre suffisant de ces cellules rares et fragiles 1,7. Par exemple, en utilisant la technique de dénombrement CTC, seules quelques centaines à plusieurs milliers de cellules tumorales sont identifiables par patient ECR7, ce qui rend difficile la réalisation d’analyses moléculaires et fonctionnelles in vitro ou in vivo. Bien qu’il y ait eu des rapports de succès dans la culture brève de CTC ex vivo à partir de sang périphérique (c’est-à-dire des CTC du cancer du sein)8,9,10, ces cellules ne se développent généralement qu’à court terme, et aucun cas n’a été signalé de capacité à cultiver des CTC de mélanome dans le LCR. Par conséquent, trouver des moyens de propager les CTC-LCR du mélanome, ou CTC en général, sera très bénéfique pour étudier la biologie de M-LMD 7,11.
Pour la première fois, une nouvelle technique de propagation ex vivo des CTC-LCR à partir de patients M-LMD est décrite. Ici, dans ce rapport, un protocole détaillé a été développé qui permet la culture et l’expansion des CTC-LCR à partir de patients M-LMD. Étant donné que les méninges sécrètent une variété de facteurs de croissance tels que le FGF, l’IGF, le VEGF-A et les IGFBP qui soutiennent la croissance autour de son environnement 12,13,14,15,16, il a été rationalisé que les CTC-LCR peuvent nécessiter la croissance de ces composants dans des conditions ex vivo. Par conséquent, ce protocole utilise des milieux conditionnés générés par la culture de cellules méningées humaines (HMCs-) in vitro. Pour l’inoculation in vivo, des cellules dérivées de patients sont inoculées à des souris immunodéficientes pour générer des lignées de CHC-CFC CR dérivées de patients (-CSF-CTC). La disponibilité de cellules M-LMD dérivées de patients soutiendra les tests cellulaires, moléculaires et fonctionnels pour étudier les M-LMD et proposer de nouvelles stratégies de traitement pour cette maladie mortelle.
Protocole
La collecte d’échantillons de LCR de patients anonymisés a été approuvée par l’Institutional Review Board (IRB) de l’Université de Floride du Sud (MCC 50103, 50172 et 19332). Les patients atteints de M-LMD peuvent être diagnostiqués de plusieurs façons, notamment par une cytologie positive du LCR, une imagerie par résonance magnétique (IRM) caractéristique du cerveau et/ou de la colonne vertébrale, ou une combinaison de signes cliniques et de résultats d’IRM évocateurs. Le LCR de ces patients M-LMD a été collecté régulièrement dans le cadre de leurs soins cliniques standard. Aucune procédure n’est effectuée à moins qu’il n’y ait une indication clinique. Le consentement éclairé des patients a été obtenu pour la collecte d’échantillons et leur utilisation à des fins de recherche et de publication. La génération de modèles murins-LMD in vivo a été approuvée par le Comité institutionnel de protection et d’utilisation des animaux de l’Université de Floride du Sud (IACUC# IS00010398). Le schéma général de ce protocole est résumé à la figure 1. Les détails des réactifs et de l’équipement utilisés dans l’étude sont énumérés dans la table des matériaux.
1. Préparation des milieux conditionnés par HMC
- Pré-enduire un ballon T175 de poly-l-lysine à 2 μg/cm2.
- Placer le ballon dans un incubateur à 37 °C pendant 1 h.
- Aspirer la solution de poly-l-lysine à l’aide d’une pipette sérologique stérile. Il n’est pas nécessaire de rincer le ballon et est prêt pour la culture HMC.
- Cultiver environ 1,0 x 106 HMC dans 30 mL de milieu de culture complet de méninges (MenCM), qui contient 5 % de sérum fœtal bovin, 1 % de supplément de croissance cellulaire méningée et 100 UI/ml de solution d’antibiotique pénicilline-streptomycine par flacon. Cultivez les cellules dans l’incubateur de culture cellulaire dans des conditions de culture tissulaire standard à 37 °C et 5 % de CO2.
- Changez de support tous les 3 jours.
- Lorsque les cellules atteignent une confluence d’environ 75 % à 80 %, prélever et conserver le milieu de culture HMC dans un tube conique de 50 ml.
- Divisez les HMC en nouveaux flacons T175 et en MenCM complets frais si vous avez besoin de plus de milieux de culture HMC.
- Au milieu de culture HMC, ajoutez un rapport de 1:1 de MenCM complet.
- Ajoutez 20 ng/mL de facteur de croissance des fibroblastes (FGF) et 20 ng/mL de facteur de croissance épidermique (EGF), qui deviendront les milieux conditionnés par HMC pour les CTC-LCR.
REMARQUE : Il est recommandé d’ajouter du FGF et de l’EGF frais lorsque les CTC sont prêts pour la culture. - Stocker les milieux conditionnés HMC dans des aliquotes de 50 mL à 4 °C.
REMARQUE : Il est recommandé de stocker les milieux conditionnés au HMC dans des aliquotes à 4 °C mais pas plus de 4 semaines.
2. Collecte du LCR et traitement des échantillons
- Prérefroidissez la centrifugeuse en la réglant à 4 °C.
- Une fois prélevé sur le patient, placez immédiatement l’échantillon de LCR dans un tube conique de 15 ml sur de la glace pour le garder frais.
REMARQUE : Notre protocole approuvé par l’IRB permet de prélever 7,5 mL de LCR sur le patient consentant. - Centrifuger le LCR à 257 x g pendant 5 min à 4 °C.
- Retirez, conservez et faites des aliquotes du surnageant du LCR sans perturber la cule cellulaire au fond. Les aliquotes surnageantes du LCR peuvent être conservées congelées à -80 °C si nécessaire pour une analyse plus approfondie.
REMARQUE : La pastille peut ne pas être visible à l’œil nu ; par conséquent, il est suggéré de laisser ~40-50 μL au fond du tube. - Dans le même tube, ajouter 1 mL de solution saline tamponnée au phosphate (PBS) stérile pour remettre en suspension et rincer les cellules, puis répéter l’essorage à 257 x g pendant 5 min à 4 °C.
REMARQUE : (Facultatif) Effectuez la lyse des globules rouges (GR) si l’échantillon contient une contamination sanguine. Cependant, gardez à l’esprit que certaines cellules peuvent être perdues au cours du processus, y compris les CTC. Les CTC peuvent être propagées sans la procédure de lyse des globules rouges. - Retirez et jetez le PBS sans déranger la pastille de cellule, et laissez ~50 μL au fond.
- Effectuer la numération cellulaire pour déterminer la viabilité cellulaire. À partir de là, il y a deux options pour procéder à la croissance de CTC-LCR : la culture in vitro (étape 3) ou la tentative d’expansion in vivo de xénogreffes dérivées de patients (étape 4).
REMARQUE : Si les CTC-LCR doivent être cultivés ultérieurement, cryoconservez les cellules dans un milieu de congélation de culture cellulaire jusqu’à ce qu’elles soient prêtes pour la multiplication. Les milieux de congélation de culture cellulaire peuvent être fabriqués en utilisant 90 % de FBS + 10 % de DMSO. S’il y a un excès de LCR (c.-à-d. plus d’un prélèvement de LCR chez les patients ou si le LCR est prélevé à l’autopsie), les CTC peuvent être évalués en soumettant l’échantillon pour le test de dénombrement des CTC17, ou la coloration par immunofluorescence (IF) pour le marqueur de mélanome (c’est-à-dire anti-MLANA), ce qui peut fournir des informations sur la quantité et la viabilité des CTC. Les cellules ne peuvent pas être récupérées après avoir effectué ces expériences. Par conséquent, il n’est pas recommandé s’il n’y a pas d’échantillons de LCR de secours du patient.
3. Culture in vitro et expansion des CTC-LCA
- Remettre en suspension les LCR-CTC dans des milieux conditionnés par HMC. Si les CTC-LCR sont cryoconservés, décongelez les cellules, essorez-les et lavez-les doucement avec du PBS.
- Divisez toutes les cellules dans des puits triples dans une plaque de 96 puits avec un volume de 150 μL par puits. Seules les cellules viables adhèrent légèrement à la surface pendant la nuit.
REMARQUE : Le nombre de CTC-LCR peut varier considérablement d’un échantillon de patient à l’autre (tableau 1). Pour les patients ayant un faible nombre de CTC, une plaque de 96 puits est utilisée comme point de départ pour la culture, et la pastille entière est plaquée sans compter de peur de perdre des CTC. Cependant, s’il y a une plus grande quantité de LCR (c’est-à-dire obtenue à partir d’une autopsie), il est possible de compter les cellules. Toutes les cellules tumorales ne peuvent pas se développer ex vivo ; Certains se dilateront lentement pendant plusieurs passages avant de devenir statiques. À l’heure actuelle, les chances de succès de la culture ex vivo de CTC-LCR de mélanome sont d’environ 60 %7. - Tous les 3 jours, complétez en ajoutant un support frais conditionné au HMC ou retirez délicatement le support en plaçant la pointe de la pipette sur le côté du puits, en laissant un peu de liquide derrière sans perturber le fond du puits, puis remplacez-le par un support frais conditionné au HMC.
- Lorsque les CTC-LCR ex vivo se dilatent et deviennent confluents à 90 %, trypsiniser et transférer l’ensemble du puits vers un nouveau puits dans une plaque de 24 puits. Lorsque le puits d’un puits de 24 puits est confluent, transférez-le sur une plaque de 12 puits, puis sur une plaque de 6 puits et ainsi de suite.
REMARQUE : Après la trypsinisation, envisagez de cryoconserver un petit sous-ensemble de CTC dans des milieux de congélation de culture cellulaire (10 % de DMSO + 90 % de FBS) avant le placage en sauvegarde. - Poursuivre la culture des CTC. Certaines cellules peuvent se propager à court terme et finir par devenir statiques. Cependant, un ou plusieurs clones peuvent se transformer et s’étendre de manière exponentielle (Figure 2A). Sélectionnez ces clones, qui deviendront les cultures in vitro de CSF-CTC dérivées de patients (-CSF-CTC).
REMARQUE : Si ces clones deviennent surpeuplés ou se regroupent, trypsinisez et replaquez les cellules dans une plaque/fiole de culture de tissus frais.
4. Inoculation in vivo de CTC-LCR pour générer un modèle de xénogreffe dérivée d’une lignée cellulaire (CDX) ou d’un modèle de xénogreffe dérivée du patient (PDX)
REMARQUE : Un modèle PDX implique la greffe de cellules cancéreuses directement à partir d’un patient cancéreux (sans culture ex vivo ), tandis que le modèle CDX utilise des lignées cellulaires cancéreuses ou, dans ce cas, des CTC qui ont été propagées et immortalisées18.
- Utiliser des souris femelles immunodéficientes NOD SCID gamma (NSG) de 6 à 8 semaines pour l’inoculation de CTC-LCR. Les NSG sont utilisés parce qu’ils sont gravement immunodéficients et sont très réceptifs à l’ensemencement de cellules tumorales humaines19. En raison de leurs déficiences immunitaires, ces souris doivent être gardées dans un environnement hygiénique strictement contrôlé et doivent être logées isolées des autres souches de souris. La méthode de rendu murin-LMD a été décrite en détail ailleurs20.
REMARQUE : des cellules ex vivo (CTC-LCR des patients qui n’ont été traitées qu’à l’étape 2 sans culture) sont utilisées pour générer le modèle PDX ; l’observation physique de l’animal et l’IRM du cerveau sont nécessaires pour déterminer la progression du LMD. D’autre part, avec le modèle CDX utilisant in vitro, les-CSF-CTC peuvent être marqués avec un rapporteur luciférase, et l’état de la LMD peut être évalué par imagerie bioluminescente (BLI). Le système de marquage cellulaire utilisé dans ce rapport est un rapporteur NanoLuc (NL) qui utilise la furimazine comme substrat, ce qui s’est avéré augmenter la sensibilité proportionnellement à la croissance tumorale21. Aucune interférence de la croissance des cellules CTC (in vitro ou in vivo) par l’expression de NL n’a été observée. - Vérifiez les signes de progression du LMD à l’aide des méthodes suivantes : observation physique : perte de poids, inclinaison de la tête et dos voûté. IRM : ventricules hypertrophiés et signes d’hydrocéphalie (Figure 2B). BLI : signaux bioluminescents positifs dans la région du SNC (Figure 2C).
5. Collecte de LCR sur des souris avec LMD pour l’expansion ultérieure du clone
- Anesthésier la souris NSG avec un LMD avec 4 % d’isoflurane (conformément aux protocoles approuvés par l’établissement) jusqu’à ce qu’elle ne montre aucun signe de réflexe de redressement.
- Préparez la souris en rasant la fourrure de toute la surface ventrale de la tête et préparez la peau à l’aide d’une technique stérile.
- Positionnez le nez à l’aide d’un cône nasal en forme de L modifié de l’appareil stéréotaxique, en veillant à ce que les narines ne soient pas obstruées. Fixez la peau en la tirant doucement vers l’avant sur les surfaces ventrales des deux pavillons avec du ruban adhésif, en la fixant au cône nasal, puis en pliant le cou à un angle d’environ 90° après l’avoir fixée. Administrer de l’isoflurane de 1,5 % à 3 % pour maintenir l’anesthésie.
- En étendant complètement le cou et en commençant juste entre les pavillons, guidez les pointes des ciseaux chirurgicaux vers le bas sur l’os occipital avec une légère pression.
REMARQUE : Dans cette position médiane, une dépression subtile est perceptible lorsque les pointes des ciseaux pénètrent dans la zone concave au-dessus de la citerne magna. - Créez une petite incision médiane de 5 à 7 mm juste au-dessus de la concavité palpée.
- Utilisez une pince à pointe émoussée avec des pointes de 1 à 2 mm pour appliquer doucement une pression sur la citerne magna. Introduisez les pointes en position fermée et ouvrez-les tout en exerçant une pression vers le bas sur la dure-mère.
- Répétez le processus de dissection contondante comme décrit à l’étape 6 jusqu’à ce que la membrane durale soit clairement discernable et que les vaisseaux sanguins associés soient visibles dans la zone exposée.
- Tout en gardant la pince ouverte pour rétracter la musculature environnante, insérez une aiguille de 27-29 G attachée à une seringue de 1 mL sous la dure-mère pour visualiser le biseau. Assurez-vous que l’aiguille pénètre juste au-delà du biseau. Rétractez progressivement le piston de la seringue.
- Prélever la plus grande quantité possible de LCR (généralement entre 15 et 30 μL) avant l’euthanasie de la souris.
REMARQUE : L’euthanasie est accomplie, selon les protocoles approuvés par l’établissement, en exposant le sujet à des concentrations croissantes de CO2 comprimé. Par exemple, un taux de déplacement de 30 % à 70 % du volume de la chambre par minute sera utilisé pour prévenir ou réduire l’inconfort ou la détresse. Ensuite, on s’assure de l’arrêt des mouvements cardiovasculaires et respiratoires par une observation prolongée à l’air ambiant pendant plus de 10 minutes. - Déployez le LCR de la seringue dans un tube de microcentrifugation et placez-le sur de la glace.
- Faites tourner l’échantillon à 257 x g pendant 5 min à 4 °C et retirez délicatement le liquide (congelez l’échantillon de LCR de souris à -80 °C si nécessaire pour une analyse plus approfondie) sans perturber la pastille cellulaire.
- Ajouter 500 μL de PBS stérile et laver la pastille de cellule ; Répétez l’essorage à 257 x g pendant 5 min à température ambiante.
- Remettre en suspension les cellules dans un milieu conditionné HMC dans une plaque à 96 puits.
REMARQUE : Les CTC-LCR qui ont été greffés in vivo et cultivés avec succès dans le LMD devraient pouvoir se développer comme des cultures cellulaires normales. Poursuivez votre expansion en changeant de média tous les 3 jours. Trypsiniser et transférer les cellules vers un appareil de culture cellulaire plus grand lorsque les cellules sont confluentes. Ces cellules deviendront les cultures in vivo -CSF-CTC. Dans le rapport actuel, le taux de réussite du modèle CDX était de 100 % et n’a pas encore généré de M-LMD PDX.
Résultats
Comprendre les exigences d’une croissance réussie des CTC-LCR ex vivo est un effort continu. À cette fin, on estime qu’il est d’une importance capitale de fournir des facteurs essentiels qui imitent le microenvironnement du LCR22. Les cellules méningées humaines (HMC) sécrètent une variété de facteurs de croissance dans le LCR, notamment FGF-2, EGF, IGFBP2 et IGFBP6, et sont connues pour soutenir la croissance des cellules CTC 12,13,14,23,24. Par conséquent, une analyse de réseau de cytokines humaines a été effectuée sur des milieux conditionnés par HMC afin d’identifier les composants potentiellement importants nécessaires à la survie du CTC. En effet, plusieurs facteurs de croissance ont été régulés à la hausse dans les milieux cultivés avec des HMC (Figure 3A). Par exemple, le facteur de stimulation des colonies de granulocytes-macrophages (GM-CSF), VEGF-A et IGFBP (IGFBP2, 3, 4 et 6).
Les composants cellulaires du LCR des patients peuvent être constitués de plusieurs types de cellules, telles que les CTC, les cellules immunitaires et les fibroblastes. Les non-CTC finiront par arrêter de passer les heures supplémentaires. En général, les cellules qui se propagent avec succès et restent en prolifération sont des cellules cancéreuses (M-LMD). La validation des cellules en culture est en effet des cellules M-LMD, ce qui peut être fait par détection IF de l’expression de MLANA et des analyses transcriptomiques, qui ont déjà été démontrées7.
Comme preuve de concept pour montrer l’utilisation et l’application potentielles des lignées-CSF-CTC in vitro et in vivo établies, l’analyse de séquençage de l’ARN sur cellule unique (scRNA-seq) a été utilisée, et les résultats ont révélé plusieurs gènes qui ont été enrichis et conservés à partir des CTC-LCR de patients non cultivés7. Deux d’entre eux incluent le récepteur tyrosine-protéine kinase ErbB3 et IGF-1R, qui ont des implications sur la progression du mélanome et la résistance à la chimiothérapie 25,26,27.
Pour vérifier s’ils jouaient un rôle dans la survie du LCR-CTC, un test de prolifération du violet cristallin a été réalisé sur des-CSF-CTC traités avec des médicaments approuvés par la FDA, le tucatinib et le céritinib, qui ciblent respectivement ErbB28 et IGF-1R 7,29. L’anticorps anti-IGFBP2 a été inclus comme témoin positif qui devrait entraver la croissance des cultures-CSF-CTC. Les résultats ont montré que l’absence d’IGFBP2 ou d’IGF-1R était efficace pour réduire la prolifération des-CSF-CTC (Figure 3B). Étant donné que la signalisation MAPK se trouve en aval de l’IGF-1R, des tests de coloration des cellules vivantes calcéine-AM et de survie des cellules MTT ont également été réalisés dans trois lignées M-LMD,-CSF-CTC en les traitant avec du céritinib ou les inhibiteurs de MAPK, le dabrafenib et le trametinib ou une combinaison des trois. Les données ont démontré que la viabilité des trois lignées cellulaires était significativement réduite par le céritinib, tandis que le dabrafenib et le trametinib avaient des effets mitigés (figure 3C). Le résultat des traitements au débrafenib et au trametinib a été surprenant. Les trois lignées-CSF-CTC ont été dérivées de patients M-LMD porteurs d’une mutation BRAFV600E 7. Cela pourrait suggérer un effet de chimiorésistance acquis des CTC-LCR, ce qui sera étudié à l’avenir.
Ensuite, à titre d’exemple de la façon dont les-CSF-CTC peuvent être utilisés in vivo, des modèles murins-M-LMD ont été établis en inoculant par voie intrathécale avec un nombre variable de-CSF-CTC. Les durées médianes de survie chez la souris ont été déterminées (figure 3D). Pour visualiser la progression de M-LMD, les lignes-CSF-CTC ont été marquées à l’aide d’un marqueur bioluminescent, tel que le système rapporteur NL21, et capturées par BLI (Figure 2C). L’emplacement des métastases LMD a également été démontré à l’aide de l’immunohistochimie avec la protéine melan-A (MLANA)30 comme marqueur des cellules de mélanome (Figure 3E). À titre de preuve de concept pour tester des stratégies thérapeutiques contre M-LMD in vivo, des cohortes murine-M-LMD ont reçu une monothérapie orale quotidienne de céritinib ou de trametinib, ou une combinaison de dabrafenib et de trametinib ou de céritinib et de trametinib. La cohorte témoin (non traitée) a reçu une solution saline orale à titre de comparaison. Les résultats ont montré une survie significativement prolongée (figure 3F) et une détection retardée de la maladie (figure 3G) dans la cohorte traitée par le céritinib et le trametinib (survie médiane du M-LMD non traitée : 28,5 jours par rapport au céritinib et au trametinib traités Survie médiane du M-LMD : 38,5 jours ; Valeur P = 0,0052). Ces données soulignent l’utilité potentielle des lignées M-LMD-CSF-CTC développées pour la réalisation d’études précliniques visant à déterminer l’efficacité de nouveaux traitements.
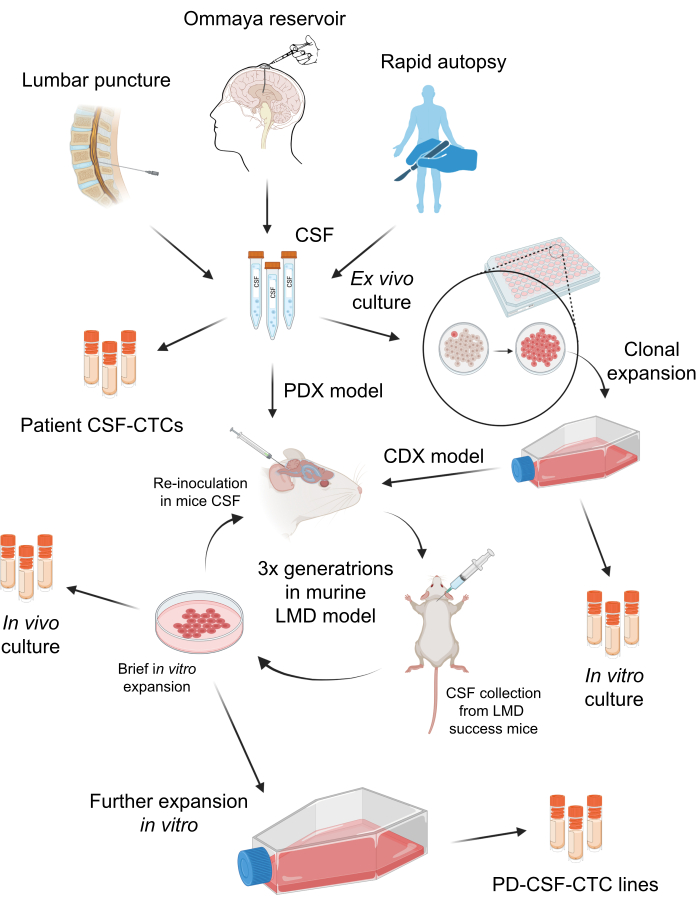
Figure 1 : Vue d’ensemble schématique du processus d’établissement de cellules tumorales circulantes du LCR dérivées de patients (-CSF-CTC). Le LCR des patients peut être prélevé par ponction lombaire, réservoir d’Ommaya ou autopsie rapide. Par une série de multiplications in vitro et in vivo, chaque étape génère une culture intermédiaire de LCR-CTC (c.-à-d. des CTC-LCR de patients, une culture in vitro, une culture in vivo) jusqu’à l’établissement d’une lignée-CSF-CTC. Veuillez cliquer ici pour voir une version agrandie de cette figure.
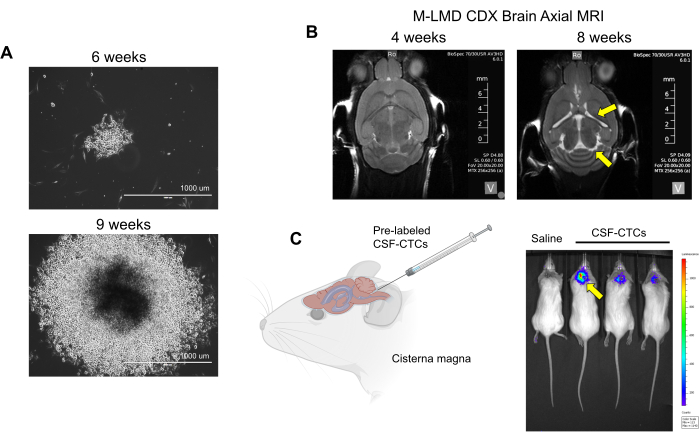
Figure 2 : Exemples de culture in vitro et in vivo de CTC-LCR dérivés de patients M-LMD. (A) Images représentatives en fond clair montrant la croissance in vitro d’une colonie de M-LMD CSF-CTC à 6 semaines et 9 semaines dans des milieux conditionnés par HMC. Barre d’échelle : 1000 μm. (B) Images IRM à 4 semaines et 8 semaines après l’inoculation intrathécale avec des-CSF-CTC ; la mise en place réussie d’un modèle murin de M-LMD. Des flèches jaunes indiquent une hypertrophie des ventricules et une possible hydrocéphalie chez cette souris M-LMD. (C) Visualisation BLI représentative du développement de M-LMD chez la souris. La figure est adaptée de Law et al.7. Veuillez cliquer ici pour voir une version agrandie de cette figure.
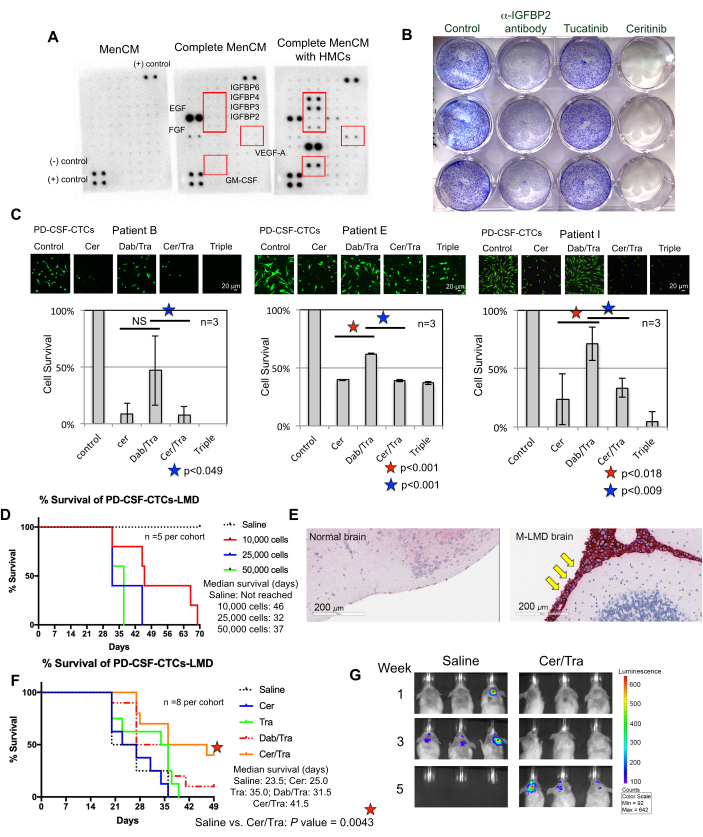
Figure 3 : Les lignées-CSF-CTC sont utilisées dans diverses expériences précliniques pour étudier le M-LMD. (A) Une puce à cytokines humaines montrant une augmentation de différents facteurs de croissance sécrétés (c’est-à-dire IGFBPs, VEGF-A et GM-CSF) dans des milieux de culture (MenCM) en présence de cellules méningées humaines (HMC). (B) Une image scannée d’un test de prolifération de cellules cristallines violettes pour déterminer l’efficacité de l’anticorps anti-IGFBP2, du tucatinib et du céritinib contre l’une des lignées-CSF-CTC. La condition de contrôle a été traitée comme véhicule. L’expérience a été réalisée en trois exemplaires. (C) Test de survie cellulaire de trois lignées différentes de-CSF-CTC établies (chez les patients 09, 12 et 16) in vitro. Les cellules ont été traitées soit avec du céritinib (cer), soit avec une combinaison de dabrafenib (dab) + trametinib (tra), soit avec du cer + tra, soit avec les trois. Les cellules ont été prélevées 72 h après le traitement. La coloration à la calcéine-AM a été utilisée pour visualiser la viabilité cellulaire, et un test MTT a été utilisé pour déterminer la survie cellulaire. Un test t d’échantillon apparié a été utilisé pour l’analyse statistique. Barres d’échelle : 20 μm. (D) Une courbe de survie d’un modèle murin M-LMD. Des souris NSG ont été inoculées par voie intrathécale (via la citerne magna) avec l’une des lignées-CSF-CTC à 10 000, 20 000 et 50 000 cellules. La survie médiane des souris M-LMD a été déterminée. (E) Détection IHC de MLANA, un marqueur du mélanome, dans les sections cérébrales de souris M-LMD. Un MLANA positif a été trouvé dans les méninges (colorées en rouge, pointées par des flèches jaunes), tandis que le cerveau normal (sain) n’a pas montré de croissance cancéreuse (négatif pour MLANA). Barres d’échelle : 200 μm. (F) Une expérience d’efficacité représentative de cohortes murines M-LMD administrées soit une solution saline orale quotidienne, soit cer, tra, dab/tra ou cer/tra. La survie des souris a été déterminée. Le test de log-rank (Mantel-Cox) a été utilisé pour l’analyse statistique. (G) Images BLI représentatives de la progression du M-LMD en 5 semaines, comparant le contrôle (salin) traité vs. cohortes murines M-LMD traitées par cer/tra. La partie (C) de la figure est adaptée de Law et al.7. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Résumé des CTC-LCR cliniques obtenus pour la culture ex vivo chez les patients M-LMD. Un tableau récapitulatif de 11 patients atteints de M-LMD, dont la propagation a été tentée dans leurs CTC-LCR. Les patients du tableau ont déjà été caractérisés dans Law et al.7. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Le M-LMD est une maladie dévastatrice et universellement mortelle, et il est urgent de trouver de meilleures stratégies de traitement. L’un des principaux obstacles à l’étude des M-LMD est l’incapacité d’acquérir suffisamment de CTC-LCR pour effectuer des études moléculaires et fonctionnelles 1,7. Bien qu’il existe des méthodes de culture de CTC à partir de sang périphérique et de LCR d’autres types de cancer, tels que les cancers du sein et de l’ovaire 11,31,32, ces méthodes de propagation de CTC sont généralement à court terme, et il n’y a pas eu de succès signalé dans la culture de CTC-LCR à partir de mélanome. De plus, les méthodologies actuelles de propagation des CTC existent dans des contextes ex vivo à court terme et n’ont pas encore produit de modèle LMD in vivo dérivé de cellules LMD de patients. Ici, un nouveau protocole est présenté pour cultiver ces cellules in vitro et in vivo, conduisant à des lignées cellulaires uniques dérivées de patients. À l’heure actuelle, sur les 11 patients atteints de M-LMD participant à l’étude, il y avait environ 60 % (7 sur 11) de chances de succès dans la propagation des C-CS-LM M-LM in vitro, et bien que ce nombre ait été réduit à ~20 % (2 sur 11) in vivo en utilisant la méthode CDX7.
Il est clair que les conditions in vitro ne récapitulent pas le microenvironnement du LCR. Cependant, des approches protéomiques ont déjà été mises en œuvre pour étudier les composants protéiques dans le LCR et ont fourni des informations sur les facteurs clés nécessaires à la croissance du CTC ex vivo3. Par exemple, il a été identifié que l’une des principales voies favorisant la survie des CTC chez les patients M-LMD était associée à des activités accrues liées à l’IGF 3,7. De plus, des études ont montré que les leptoméninges sécrètent une variété de cytokines/facteurs de croissance dans le LCR, y compris FGF-2, EGF, GM-CSF et des protéines liées à la signalisation IGF12. En effet, cela a été récapitulé dans les médias cultivés avec les HMC, soutenant un rôle potentiel de ces facteurs de croissance dans la promotion de la croissance de la LCA-CTC.
L’un des principaux avantages de la génération d’un modèle PDX (ou CDX) est la possibilité d’obtenir des informations plus approfondies sur la pathologie de la maladie, ce qui fait défaut dans les conditions in vitro . Idéalement, une approche PDX est préférée car les CTC-LCR proviendraient directement de patients sans culture ex vivo . Initialement, des tentatives ont été faites pour créer M-LMD en utilisant cette approche, mais elles n’ont pas abouti jusqu’à présent. La difficulté à générer des souris PDX est peut-être associée à l’abondance et à l’intégrité du matériel de départ (c.-à-d. très peu de CTC viables dans le LCR des patients lors de la collecte de routine en clinique). Cela peut expliquer pourquoi nous avons eu un succès supérieur en cultivant des CTC à partir de LCR collectés à l’autopsie7. Afin d’augmenter la probabilité de propagation in vivo , ce protocole a été modifié afin de fournir une autre approche CDX. Les CTC-CSF peuvent d’abord être élargis in vitro (étape 3) pour générer des lignées-CSF-CTC qui ont un potentiel de croissance à long terme et plus important. Ces cellules sont ensuite inoculées chez la souris pour créer M-LMD. Bien que la méthode actuelle ait généré un nombre limité de modèles CDX M-LMD in vivo (~ 20%), cela pourrait refléter la diversité transcriptionnelle des CTC-LCR, la complexité du microenvironnement du LCR et la difficulté de cultiver ces cellules en général. Nous postulons que le développement futur d’un modèle de souris humanisée pourrait améliorer le taux de réussite de la greffe compte tenu de l’importance du microenvironnement dans le soutien de la viabilité des cellules cancéreuses33.
L’une des limites de l’approche CDX est que seuls certains clones ont été sélectionnés à partir d’échantillons de patients, et que la dérive génétique des cellules cancéreuses par culture ex vivo peut ne plus refléter le profil transcriptionnel de la source d’origine. Cependant, il a été rapporté que, malgré la culture in vitro , les lignées-CSF-CTC conservaient une similitude d’expression génique d’environ 97 % avec des patients isolés et non cultivés de CSF-CTC7. Dans cette étude, les analyses scRNA-seq ont révélé un chevauchement des signatures génétiques enrichies entre des-CSF-CTC in vitro non cultivés et des-CSF-CTC in vivo , tels que SOX9, ErbB3 et IGF-1R7, suggérant qu’il pourrait s’agir de cibles thérapeutiques potentielles. De plus, ces gènes couramment enrichis sont impliqués dans les voies biologiques associées à la régulation transcriptionnelle et au métabolisme7. Collectivement, cela souligne la valeur translationnelle des cultures-CSF-CTC pour mieux comprendre la biologie du M-LMD, identifier les mécanismes moléculaires et les voies cibles à l’origine de la maladie, et concevoir des thérapies rationnelles dans les études futures.
Bien que la méthodologie actuelle reste imparfaite, car il n’existe aucun moyen de prédéterminer l’état et la viabilité des CTC-LCR chez les patients atteints de M-LMD, plusieurs observations ont été faites qui augmenteraient les chances de succès puisque les CTC sont peu nombreux et assez fragiles. Ces étapes essentielles comprennent la coordination avec la clinique pour que les échantillons de LCR soient placés sur de la glace dès qu’ils sont prélevés et qu’ils soient rapidement transportés au laboratoire afin de maintenir l’intégrité cellulaire. Par la suite, les CTC-LCR doivent être traités immédiatement, soit en les mettant en culture, soit en cryoconservant les cellules.
Dans l’ensemble, la culture et l’expansion des CTC-LCR ont été un processus d’essais et d’erreurs, mais la mise en place de ce protocole pour générer des cellules M-LMD dérivées de patients donnera aux chercheurs les ressources nécessaires pour réaliser des expériences avec des échantillons de patients, ce qui n’aurait pas pu être fait auparavant. L’un des principaux objectifs à l’avenir est d’utiliser les-LMD-CSF-CTC pour effectuer des études de caractérisation moléculaire, de criblage de médicaments à haut débit et d’efficacité des médicaments in vivo afin de concevoir des thérapies rationnelles pour traiter le M-LMD. On croit que cette approche mènera à des stratégies de traitement qui réduiront considérablement la morbidité et la mortalité associées à cet aspect actuellement mortel du mélanome métastatique avancé.
Déclarations de divulgation
Peter Forsyth siège aux conseils consultatifs d’Abvie Inc, Bayer, Bristol Meyers Squib, BTG, Inovio, Novocure, Tocagen et Ziopharm, en dehors des travaux soumis. Tous les autres auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier les patients et les familles pour leur extraordinaire générosité en faisant don de tissus pour cette étude scientifique. Ce travail a été soutenu par des subventions des National Institutes of Health : subventions P50 CA168536, R21 CA256289, R21 CA216756 (à KSMS et PAF), K99 CA226679 (à IS). Fonds d’accélération de la recherche de la Fondation Moffitt (à la Colombie-Britannique et à la PAF), au programme de biologie chimique et de médecine moléculaire de Moffitt (PAF et DD), à la Fondation Moffitt (PAF). Les noyaux de ressources partagées en génomique moléculaire, tissus, bioinformatique et biostatistique de Moffitt sont soutenus en partie par le National Cancer Institute par le biais d’une subvention de soutien au centre de cancérologie (P30-CA076292) et la Fondation Moffitt.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL syringe 27 - 29 G needles | Any vendor | n/a | 0.1 mm Sterile Filtered |
| 1.5 mL Eppendorf tubes | Any vendor | ||
| 15 ml and 50 mL polystyrene centrifuge tubes | Any vendor | n/a | |
| 6 - 8 weeks females NOD SCID gamma (NSG) mice | Charles River | Males optional | |
| Buprenorphine Sustained-Release (Bup-SR) | Zoopharm | DEA controlled | |
| Fetal bovine serum (FBS) | ScienCell | #0010 | |
| Gas inhalation anestehsia system | VeteEquip | #901812 | COMPAC5 |
| Hamilton microliter syringes | Hamilton | 10, 25, 50, and 100ml | 30 G for cisterna magna injection |
| Human basic fibroblast growth factor (bFGF) | Milipore Sigma (or any vender) | #F0291 | |
| Human epidermal growth factor (EGF) | Milipore Sigma (or any vender) | #SRP3027 | |
| Human meningeal cells (HMCs) isolated from human leptomeninges | ScienCell | #1400 | |
| IVIS 200 imaging system | Caliper Life Sciences | n/a | |
| Magnifying glass with light | Any vendor | n/a | |
| Meningeal Cell Culture Media (MenCM) | ScienCell | #1401 | |
| Meningeal cell growth supplement (MCGS) | ScienCell | #1452 | |
| MRI imaging | Bruker | BioSpec series | Optional |
| P1000, P200, P20 pipettes/ pipette tips | |||
| penicillin-streptomycin Antibiotic solution | ScienCell (or any vender) | #0503 | |
| Phosphate buffered saline (PBS) | Any vendor | n/a | 0.1 mm Sterile Filtered |
| Rodent Surgical Instruments (Scissors, Forceps) | Roboz Surgical Instrument (or any vendor) | ||
| Screw cap cryo tubes | |||
| Sterile blue paper/ drape covering | Any vendor | n/a | n/a |
| Sterile cotton sticks | Any vendor | n/a | |
| Tissue culture plates/flasks (96-well, 24-well, 12-well, 6-well, T175 etc.) |
Références
- Glitza, I. C., et al. Leptomeningeal disease in melanoma patients: An update to treatment, challenges, and future directions. Pigment Cell Melanoma Res. 33 (4), 527-541 (2020).
- Khaled, M. L., Tarhini, A. A., Forsyth, P. A., Smalley, I., Pina, Y. Leptomeningeal disease (LMD) in patients with melanoma metastases. Cancers (Basel). 15 (6), 1884 (2023).
- Smalley, I., et al. Proteomic analysis of CSF from patients with leptomeningeal melanoma metastases identifies signatures associated with disease progression and therapeutic resistance). Clin Cancer Res. 26 (9), 2163-2175 (2020).
- Larkin, J., et al. Five-year survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med. 381, 1535-1546 (2019).
- Boire, A., et al. Complement component 3 adapts the cerebrospinal fluid for leptomeningeal metastasis. Cell. 168 (6), 1101-1113 (2017).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Law, V., et al. A preclinical model of patient-derived cerebrospinal fluid circulating tumor cells for experimental therapeutics in leptomeningeal disease from melanoma. Neuro Oncol. 24 (10), 1673-1686 (2022).
- Carmona-Ule, N., et al. Short-term ex vivo culture of CTCs from advance breast cancer patients: Clinical implications. Cancers (Basel). 13 (11), 2668 (2021).
- Zhang, L., et al. The identification and characterization of breast cancer CTCs competent for brain metastasis. Sci Transl Med. 5 (180), (2013).
- Yu, M., et al. Cancer therapy: Ex vivo culture of circulating breast tumor cells for individualized testing of drug susceptibility. Science. 345 (6193), 216-220 (2014).
- Mohamed, B. M., et al. Ex vivo expansion of circulating tumour cells (CTCs). Sci Rep. 13 (1), 3704 (2023).
- Decimo, I., Fumagalli, G., Berton, V., Krampera, M., Bifari, F. Meninges: From protective membrane to stem cell niche. Am J Stem Cells. 1 (2), 92-105 (2012).
- Mercier, F., Hatton, G. I. Connexin 26 and basic fibroblast growth factor are expressed primarily in the subpial and subependymal layers in adult brain parenchyma: Roles in stem cell proliferation and morphological plasticity. J Comp Neurol. 431 (1), 88-104 (2001).
- Stylianopoulou, F., Herbert, J., Soares, M. B., Efstratiadis, A. Expression of the insulin-like growth factor II gene in the choroid plexus and the leptomeninges of the adult rat central nervous system. Proc Natl Acad Sci U S A. 85 (1), 141-145 (1988).
- Nordqvist, A. C., Mathiesen, T. Expression of IGF-II, IGFBP-2, -5, and -6 in meningiomas with different brain invasiveness. J Neurooncol. 5, 19-26 (2002).
- Zumkeller, W., Westphal, M. The IGF/IGFBP system in CNS malignancy. Mol Pathol. 54 (4), 227-229 (2001).
- Wang, L., et al. Promise and limits of the CellSearch platform for evaluating pharmacodynamics in circulating tumor cells. Semin Oncol. 43 (4), 464-475 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8, 160 (2023).
- Chen, J., et al. The development and improvement of immunodeficient mice and humanized immune system mouse models. Front Immunol. 13, 1007579 (2022).
- Law, V., et al. A Murine Ommaya xenograft model to study direct-targeted therapy of leptomeningeal disease. J Vis Exp. (167), e62033 (2021).
- Stacer, A. C., et al. NanoLuc reporter for dual luciferase imaging in living animals. Mol Imaging. 12 (7), 1-13 (2013).
- Luo, Y. T., et al. The viable circulating tumor cells with cancer stem cells feature, where is the way out. J Exp Clin Cancer Res. 37, 38 (2018).
- Stumm, R., Kolodziej, A., Schulz, S., Kohtz, J. D., Hollt, V. Patterns of SDF-1alpha and SDF-1gamma mRNAs, migration pathways, and phenotypes of CXCR4-expressing neurons in the developing rat telencephalon. J Comp Neurol. 502 (3), 382-399 (2007).
- Aviezer, D., et al. basal lamina proteoglycan, promotes basic fibroblast growth factor-receptor binding, mitogenesis, and angiogenesis. Cell. 79 (6), 1005-1013 (1994).
- Tiwary, S., et al. ERBB3 is required for metastasis formation of melanoma cells. Oncogenesis. 3 (7), e110 (2014).
- Sun, X., et al. miR-7 reverses the resistance to BRAFi in melanoma by targeting EGFR/IGF-1R/CRAF and inhibiting the MAPK and PI3K/AKT signaling pathways. Oncotarget. 7 (33), 53558-53570 (2016).
- Satyamoorthy, K., Li, G., Vaidya, B., Patel, D., Herlyn, M. Insulin-like growth factor-1 induces survival and growth of biologically early melanoma cells through both the mitogen-activated protein kinase and beta-catenin pathways. Cancer Res. 61 (19), 7318-7324 (2001).
- Lin, N. U., et al. Tucatinib vs Placebo, both in combination with Trastuzumab and Capecitabine, for previously treated ERBB2 (HER2)-positive metastatic breast cancer in patients with brain metastases: Updated exploratory analysis of the HER2CLIMB randomized clinical trial. JAMA Oncol. 9 (2), 197-205 (2023).
- Russo, A., et al. Ceritinib-induced regression of an insulin-like growth factor-driven neuroepithelial brain tumor. Int J Mol Sci. 20 (17), 4267 (2019).
- Ohsie, S. J., Sarantopoulos, G. P., Cochran, A. J., Binder, S. W. Immunohistochemical characteristics of melanoma. J Cutan Pathol. 35 (5), 433-444 (2008).
- Kulasinghe, A., et al. Short term ex-vivo expansion of circulating head and neck tumour cells. Oncotarget. 7 (37), 60101-60109 (2016).
- Li, X., et al. Clinical significance of detecting CSF-derived tumor cells in breast cancer patients with leptomeningeal metastasis. Oncotarget. 9 (2), 2705-2714 (2018).
- Lelliott, E. J., et al. A novel immunogenic mouse model of melanoma for the preclinical assessment of combination targeted and immune-based therapy. Sci Rep. 9 (1), 1225 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon