Method Article
电磁源显像在儿童耐药性癫痫术前评估中的应用
摘要
脑磁图 (MEG) 和高密度脑电图 (HD-EEG) 很少同时记录,尽管它们会产生验证性和互补性信息。在这里,我们说明了同时记录 MEG 和 HD-EEG 的实验设置以及分析这些数据的方法,旨在定位耐药性癫痫儿童的致癫痫和雄辩的大脑区域。
摘要
对于患有耐药性癫痫 (DRE) 的儿童,无癫痫发作依赖于致癫痫区 (EZ) 的描绘和切除(或消融/断开),同时保留雄辩的大脑区域。因此,开发一种可靠且无创的定位方法,为 EZ 的定位提供临床有用的信息,对于实现成功的手术结果至关重要。电和磁源成像 (ESI 和 MSI) 已越来越多地用于这些患者的术前评估,在描绘致癫痫和雄辩的脑区方面显示出有希望的发现。此外,将 ESI 和 MSI 组合成一个解决方案,即电磁源成像 (EMSI),同时在高密度脑电图 (HD-EEG) 和脑磁图 (MEG) 记录上进行,显示出比单独使用任何一种模式更高的源定位精度。尽管有这些令人鼓舞的发现,但这种技术仅在少数三级癫痫中心进行,很少同时记录,并且在儿科队列中未得到充分利用。本研究说明了同时记录 MEG 和 HD-EEG 数据的实验设置,以及分析这些数据的方法框架,旨在定位 DRE 儿童的刺激区、癫痫发作区和雄辩的大脑区域。更具体地说,提出了用于 (i) 记录和定位睡眠期间发作间期和发作期癫痫样活动的实验设置,以及 (ii) 记录视觉、运动、听觉和体感诱发的反应,并绘制相关的雄辩大脑区域(即视觉、运动、听觉和体感)在视觉运动任务期间,以及听觉和体感刺激。进一步介绍了使用等效电流偶极子 (ECD) 和动态统计参数映射 (dSPM) 执行 EMSI 以及单个 ESI 和 MSI 的数据分析管道的详细步骤。
引言
癫痫是最常见和致残性的神经系统疾病之一,其特征是反复发作和无端发作,本质上可以是局灶性的或全身性的。尽管有几种有效的药物治疗(例如抗癫痫药物 [ASM]),但这些患者中约有 20-30% 无法控制癫痫发作并患有耐药性癫痫 (DRE)1。对于这些患者,癫痫手术是消除癫痫发作的最有效治疗方法;通过完全切除(或消融/断开)致癫痫区 (EZ) 可以实现成功的手术,EZ 定义为产生癫痫发作所必需的最小区域2。在保留雄辩皮层的同时,准确描绘和切除 EZ (或消融/断开) 是确保无癫痫发作的关键因素。为了确定手术候选资格,多学科团队使用几种无创诊断工具来定义不同的皮质区域(即刺激区、癫痫发作区 [SOZ]、功能缺陷区和致癫痫病灶),这些区域作为 EZ3 的间接近似值。当这些方法均不能明确识别 EZ 时,需要使用颅内脑电图 (iEEG) 进行术外监测。iEEG 的作用是通过定位 SOZ(即临床癫痫发作产生的大脑区域)来精确定义 EZ 并绘制雄辩的大脑区域。然而,由于其侵入性 4,5,6,它存在严重的局限性,它提供的空间覆盖范围有限,并且需要一个明确的术前定位假设7。因此,可能会错过 SOZ 的实际焦点和范围,从而导致手术失败。此外,其解释需要记录住院几天期间的多次刻板临床癫痫发作,这会增加并发症(例如感染和/或出血)的机会5。因此,开发可靠且无创的定位方法的需求尚未得到满足,这些方法可以提供临床有用的信息并全面改善 DRE 儿童的术前评估。
在过去的几十年里,电和磁源成像 (ESI 和 MSI) 越来越多地用于 DRE 患者的术前评估,以描绘致癫痫性和功能性脑区域。特别是,ESI 和 MSI 允许从无创记录中重建神经源,例如高密度 EEG (HD-EEG) 和脑磁图 (MEG),以帮助指导手术计划或 iEEG 电极放置。ESI 和 MSI 可用于定位发作间期癫痫样放电 (IED),例如尖峰和尖波,或发作期(癫痫发作)活动。它可以进一步用于定位涉及感觉、运动、听觉和认知功能的不同功能大脑区域。电生理事件(如 IED 和癫痫发作)的重建可以分别识别刺激区(即 IED 起源的大脑区域)和 SOZ,它们被认为是 EZ 定位的有效替代物。雄辩的皮层(即确定的皮层功能所必需的大脑区域)的定位3 允许根据计划的切除绘制雄辩区域的位置和范围,因此,提前减少癫痫手术可能预期的潜在功能缺陷 8,9,10,11 .几项研究调查了 ESI 和/或 MSI 在癫痫术前评估中的临床效用,它们在 EZ12、13、14、15、16、17、18、19 的描绘中显示出有希望的发现。例如,Mouthaan 等人 14 使用 11 项前瞻性和回顾性癫痫研究的无创数据进行了广泛的荟萃分析,并报告说这些来源定位技术可以总体上识别具有高敏感性 (82%) 和低特异性 (53%) 的 EZ。其他研究还表明,MSI 和 ESI 可以正确定位磁共振成像 (MRI) 正常的癫痫患者切除区域内的癫痫病灶 19,20,21。这些定位结果对于那些由于临床或影像学检查结果不确定而不适合癫痫手术的患者尤为重要。总之,ESI 和 MSI 对 DRE 患者致癫痫区和功能脑区的术前标测有重大贡献。
尽管有这些令人鼓舞的发现,但目前只有少数三级癫痫中心定期进行此类技术,并且在儿科人群中往往未得到充分利用。此外,HD-EEG 和 MEG 很少同时记录,尽管它们同时提供验证和补充信息。MEG 对检测具有切向方向的浅表源敏感,但对位于脑回或大脑更深区域的径向源视而不见 22,23,24,25,26。此外,与 EEG 16,22,25 相比,MEG 提供更好的空间分辨率(毫米)。与脑电图信号不同,脑磁图信号是无参考的,基本上不受脑组织(即脑膜、脑脊液、颅骨和头皮)的不同电导率的影响25,27,从而提供大脑产生的磁场的不失真测量。另一方面,EEG 可以检测所有方向的来源,但它提供的空间分辨率低于 MEG,并且更容易受到伪影的影响26,28。由于这些对源方向和深度的互补敏感性,大约 30% 的癫痫样活动(例如,IED)只能在 MEG 上记录,而不能在 EEG 上记录,反之亦然 26,29,30,31,32。与允许长时间记录的 EEG 相反,使用 MEG 捕捉临床癫痫发作具有挑战性,因为记录时间有限,通常不足以记录大多数患者的发作事件。此外,由癫痫发作相关的头部运动引起的伪影通常会干扰 MEG 记录的质量29、33、34、35。另一方面,与脑电图相比,脑磁图记录更快、更容易,尤其是在儿童中,因为无需在儿童的头部上安装传感器35。
硬件的进步使得使用覆盖整个头部的大量传感器(超过 550 个传感器)同时记录 MEG 和 HD-EEG 数据成为可能。此外,脑电图技术的现代发展已将 HD-EEG 的准备时间缩短到不到一刻钟36。这对于无法长时间保持静止的具有挑战性行为的儿科人群尤其重要。此外,软件技术的进步允许将 ESI 和 MSI 组合成一个解决方案,即电磁源成像 (EMSI),同时对 HD-EEG 和 MEG 记录进行。几项理论和实证研究报告称,EMSI 的源定位精度高于单独使用任何一种模式13、30、31、37、38、39、40、41。使用不同的源定位方法来重建响应感觉刺激的活动,Sharon 等人。37 发现,与功能性 MRI (fMRI) 相比,EMSI 的定位结果始终优于单独的 ESI 或 MSI,功能性 MRI 是精确定位精度的无创基准。作者认为,这种改进的定位是由于用于求解逆解的传感器数量增加以及两种成像模式的不同灵敏度模式37。同样,Yoshinaga 等人。31 对顽固性定位相关癫痫患者的同步 EEG 和 MEG 数据进行了偶极子分析,结果表明 EMSI 提供了仅使用一种方式无法获得的信息,并导致其中一名患者成功定位癫痫手术分析。在一项前瞻性盲法研究中,Duez 等人。13 表明,与 ESI 和 MSI 相比,EMSI 实现了显着更高的比值比(即无癫痫发作的可能性),定位准确率为 ≥52%,与刺激物和 SOZ 的一致性分别为 ≥53% 和 ≥36%。我们第42 组最近的一项研究表明,与单独的 ESI 或 MSI 相比,EMSI 提供了更好的定位估计和更好的结果预测性能,切除和 SOZ 的定位误差分别为 ~8 毫米和 ~15 毫米。尽管有这些有希望的发现,但缺乏提供有关 DRE 儿童 EMSI 方法框架的研究。
本研究说明了同时进行 MEG 和 HD-EEG 记录的实验设置,以及分析这些数据的方法框架,旨在定位 DRE 儿童的刺激区、SOZ 和雄辩的大脑区域。更具体地说,提出了用于 (i) 记录和定位睡眠期间发作间期和发作期癫痫样活动的实验设置,以及 (ii) 记录视觉、运动、听觉和体感诱发的反应,并绘制相关的雄辩脑区(即视觉、运动、听觉和体感)在视觉运动任务期间,以及听觉和体感刺激。进一步介绍了使用等效电流偶极子 (ECD) 和动态统计参数映射 (dSPM) 执行 EMSI 以及单个 ESI 和 MSI 的数据分析管道的详细步骤。
研究方案
此处应用的实验程序已获得北德克萨斯州地区机构审查委员会 (2019-166;首席研究员:Christos Papadelis)。以下部分将描述在我们的实验室使用同步 MEG 和 HD-EEG 记录对 IED、发作期发作和事件诱发反应(即视觉、运动、听觉和体感)进行无创来源定位的实验方案。国际临床神经生理学联合会43 和美国临床 MEG 学会44 为自发性 MEG 和 EEG 数据的常规临床记录和分析提供了"最低标准"。此处描述的 HD-EEG 记录程序仅适用于基于海绵的 EEG 电极系统。每个主题的整体准备过程约为 2-3 小时,包括 ~1.5 小时的实际记录。
1. MEG 系统的准备工作
- 在受试者到达之前,进行几分钟的空室 MEG 记录,以捕捉背景噪声水平和磁性伪影,并检查所有 MEG 传感器是否正常工作。
- 使用 MEG 传感器调谐程序,确保所有 MEG 传感器的平均白噪声值在 2 到 5 fT/√Hz(梯度计为 fT/cm√Hz)之间。
2. 受试者的准备
- 确保拍摄对象对环境感到满意。对于年幼的孩子,请允许他们探索记录室(包括磁屏蔽室 [MSR])并查看将用于数据采集的测试设备。
- 使用筛选同意书筛选并提供受试者说明。如果需要,使用为每个年龄组开发的特殊单词、玩具和游戏向幼儿解释该程序。询问受试者(或受试者的父母)他/她是否在就诊前的最后 ~2 小时内癫痫发作。
注意:筛选同意书包括测试的描述及其安全性、进行测试的原因以及研究的总体描述。
- 使用筛选同意书筛选并提供受试者说明。如果需要,使用为每个年龄组开发的特殊单词、玩具和游戏向幼儿解释该程序。询问受试者(或受试者的父母)他/她是否在就诊前的最后 ~2 小时内癫痫发作。
- 从受试者身上取下任何金属和/或磁性材料,并为受试者提供医院发放的适当衣服(例如,病号服、磨砂膏)。此外,请对象脱掉他/她的鞋子,以防止磁性灰尘进入 MSR。如果无法去除其他铁磁元件,例如牙科手术或植入式医疗设备,请使用消磁器(即消磁器)去除残余的磁性伪影,这些伪影可能在 MEG 记录期间引起干扰或高噪声水平。在确保所有磁噪声源都已消除后,请受试者坐在木椅上舒适地进行下一步测量。
注意: 消磁器不得直接应用于任何植入的电子设备(例如,起搏器、神经调控装置)。 - 测量受试者的头围以选择合适的脑电网尺寸(通常为 32-34 厘米至 58-61 厘米)。使用卷尺的厘米侧,将卷尺从受试者的鼻孔拉到鼻孔上方 ~1 厘米,然后回到鼻孔,测量头围。
注意:鼻孔是眼睛之间的颅骨测量点,而鼻孔是枕外突起的尖端。- 选择适合受试者头围的正确蚊帐尺寸,并将其浸泡在由 1 夸脱温自来水、1 汤匙电解质(即氯化钾)和 1 汤匙婴儿洗发水组成的液体混合溶液中至少 5 分钟(最多 10 分钟)。在此浸泡过程中,确保将网翻过来,海绵朝外,并完全松开扣子,以将传感器完全浸入装有溶液的塑料桶中。
注意: 为确保网的放大器不会靠近溶液并始终保持干燥,请在所选网的插头上缠上毛巾,如果愿意,将其放在靠近塑料桶所在水槽的椅子或支架上。
- 选择适合受试者头围的正确蚊帐尺寸,并将其浸泡在由 1 夸脱温自来水、1 汤匙电解质(即氯化钾)和 1 汤匙婴儿洗发水组成的液体混合溶液中至少 5 分钟(最多 10 分钟)。在此浸泡过程中,确保将网翻过来,海绵朝外,并完全松开扣子,以将传感器完全浸入装有溶液的塑料桶中。
- 使用微孔纸胶带将五个用作头部位置指示器 (HPI) 线圈的磁线圈直接放在受试者头皮上的已知位置:一个在前额靠近发际线的两侧,一个在每个乳突骨上,一个在头顶。
注意:HPI 线圈通过发射可在扫描过程中定位的已知磁场来定义头部相对于放置在 MEG 系统内部的超导量子干涉器件 (SQUID) 的位置。HPI 线圈的数量取决于 MEG 系统,但通常在 3-5 个 HPI 线圈之间。 - 使用卷尺放置额外的电极,以测量心率(心电图,ECG)、眼球运动或眨眼(眼电图,EOG)和肌肉活动(肌电图,EMG);这些电极的放置还可以监测受试者的健康状况。
- 在锁骨下方胸部的右侧和左侧分别放置两个心电图电极,以记录受试者的心跳,在右眼的上下侧分别放置两个心电图电极,以记录他/她的垂直眼球运动或眨眼。
- 为了测量视觉运动任务期间的肌肉活动,此外,用酒精垫擦拭受试者的手指,以更好地将胶带粘附在皮肤上,并在每只手上总共用两对非一次性杯电极贴上胶带:一对在第一背侧骨间 (FDI) 上,一对在拇短展肌 (APB) 上。
- 在对所有这些电极进行胶带连接之前,将导电膏放入电极杯中,直到它略微溢出,以减少皮肤阻抗并确保粘附性和导电性的最佳混合。
- 对于触觉刺激,将薄弹性膜直接连接到双手三个手指的远端掌侧部分(即拇指 [D1]、中指 [D3] 和小指 [D5])。使用气吹刺激装置,通过硬质塑料管用压缩空气脉冲给膜充气。按照伪随机顺序以 1.5 ± 0.5 秒的刺激间隔释放压缩空气脉冲。将触觉刺激器的压力调整到 50 psi。
- 在锁骨下方胸部的右侧和左侧分别放置两个心电图电极,以记录受试者的心跳,在右眼的上下侧分别放置两个心电图电极,以记录他/她的垂直眼球运动或眨眼。
- 当受试者仍然坐在远离任何金属物体的木椅上时,使用数字化器确定基准解剖地标、五个 HPI 线圈和其他头形点的三维 (3D) 位置。在这个头部数字化过程中,让拍摄对象舒适地坐着,直视前方,几乎保持不动,因为小的动作可能会影响定位精度。
- 将参考接收器穿过塑料护目镜(即一侧附有参考立方体的眼镜)放在被测物的头上,并调整扣环以确保被测物的参考系固定,在整个测量过程中必须保持相对静止。
- 通过主触控笔接收器,定位基准解剖标志(即鼻部和左/右耳前点)和 HPI 线圈的位置,并均匀采样额外的头皮点(至少 100 个,最好接近 ~500)以增强头部表面的高质量重建。
注意:基准解剖标志定义主体坐标系。数字化器使用一个发射器(通常安装在木椅背面的主体后面)和两个接收器(即手写笔和参考接收器)在 3D 空间中生成传感器的坐标。 - 数字化完成后,将触笔接收器放置在距离拍摄对象和发射器 ~15 cm 的位置,并随机数字化一个点以完成数字化过程。
注意:数字化过程的最后一步可能与其他商业产品不同。
- 在应用脑电图网之前,请受试者坐在靠近脑电图放大器的椅子上,并将毛巾放在他/她的胸部和肩膀上,以吸收由于网的应用而最终产生的滴液。从塑料桶中取出脑电网,用海绵朝内转动,然后轻轻地将其缠绕在毛巾上,以吸收过量的混合溶液。
- 让受试者坐在椅子上,并被指示在此步骤中闭上眼睛,将双手放入网中并用手指张开,最后将其放在受试者的头上。
- 在不移动 HPI 线圈位置的情况下,用手指调整受试者头部的拉伸网,以确保参考通道和鼻腔通道分别正确定位在头皮中心和受试者的眼睛之间,最后在网处于正确位置后系紧下巴带。
- 使用 EEG 阻抗计,确保所有头皮电极阻抗在 0-50 kΩ 范围内(建议使用 ˂5 kΩ),以防止任何信号失真。为了降低头皮电极阻抗,检查每个电极是否与头皮具有良好的机械和电气接触,方法是使用木制棉签去除电极和头皮之间的受试者毛发,或使用一次性塑料移液器将更多导电混合溶液转移到电极海绵中(如果需要)。
- 一旦所有阻抗理想情况下都达到 50 kΩ,断开放大器并准备对象进行 EEG 电极数字化。
注意:在 MSR 之外执行 EEG 电极数字化,并确保受试者周围有足够的空间来管理扫描过程。
- 一旦所有阻抗理想情况下都达到 50 kΩ,断开放大器并准备对象进行 EEG 电极数字化。
- 使用手持式光学扫描仪确定 EEG 电极的 3D 位置。在此过程中,除非另有指示,否则请对象舒适地坐着并直视前方。
- 首先,打开光学扫描仪软件,选择与记录期间使用的 EEG 传感器布局相匹配的传感器模板,然后启动扫描过程。
- 在扫描过程中,将扫描仪与脑电网保持一定距离(通常为 ~45 厘米),其扫描孔径垂直于传感器表面,然后沿着拱形条带从顶部(头部中心)到底部(最后一个传感器沿颈部排)缓慢地围绕受试者的头部移动,以记录所有传感器的物理位置。
注意:光学扫描仪将受试者头部的 EEG 电极位置数字化,并将其转换为 3D 坐标文件;它通常以两个发射红外 (IR) 光源的光学传感器为特征。每个扫描的位置通常出现在 3D 传感器云上。3D 传感器云为传感器位置的扫描、探测和对齐提供反馈,而 2D 传感器映射则为这些传感器位置的标记提供反馈。脑电图电极位置的扫描过程总共需要 5-10 分钟,包括基准点的探测。但是,扫描时间有时可能取决于光学扫描仪在检测电极位置方面的性能。
- 扫描完所有脑电图电极(至少 95%)后,使用无线光学探针探测基准点(即鼻孔和左/右耳前点)和四个对齐传感器(即前、左和右对齐节点和 REF 节点)将 3D 传感器云与选定的传感器模板对齐。
注意: 对准传感器根据 EEG 传感器网络配置进行编号。- 要探测基准点,请确保扫描仪的扫描孔径指向探头的反射盘,将光学探头的尖端放在目标基准点中心的受试者皮肤上。同样,将光学探头的尖端放在感兴趣的对准传感器的中心,以探测对准传感器。
- 扫描和探测所有传感器后,查看它们在 3D 传感器云和 2D 传感器地图上相对于实际脑电图的位置和标签,以检查并最终纠正可能的错误;如果在扫描过程中没有发生错误,请导出 3D 坐标.txt文件并将其转换为首选格式。
注意:3D 电极坐标通常以 .txt 格式存储,并且可以通过光学扫描仪软件转换为多种格式(例如,.xml、.sfp、.elp 或 .nsi)。 - 脑电图电极数字化过程(步骤 2.9-2.11)完成后,准备在 MSR 内转移的受试者进行静息/睡眠数据(步骤 2.13)、视觉运动任务(步骤 2.14)、听觉刺激(步骤 2.15)和体感刺激(步骤 2.16)。
- 对于休息/睡眠数据,将 MEG 系统的机架设置到仰卧位置(图 1A)并布置非磁性和兼容的床,使可拆卸头枕与杜瓦瓶底部的头盔形开口对齐。将床身调整到正确位置后,将床身的制动阀设置到关闭锁定位置。在床上放一张床单或毯子,在可拆卸头枕上放一个小泡沫垫枕头,以便在录制过程中固定头部和舒适。
注意:杜瓦瓶是一个充满液氦的低温储存容器,其中传感器阵列通过一个头盔形开口在空间上布置在底部,旨在围绕受试者的头部。头盔适合 59-61 厘米的头围。龙门架是支撑杜瓦瓶的机械系统,允许根据测量位置(即坐姿或仰卧位)修改其仰角和角度。- 将对象转移到 MSR 内,并帮助他/她坐在床沿上并躺下。在拍摄过程中,在拍摄对象身上放几条毯子以保持温暖,确保电极的电缆易于接近,并轻轻系好安全带(如果有的话,请拉起栏杆),向拍摄对象解释此步骤是为了防止他/她在睡觉时从床上滚下来。如果需要,在脖子下放置一条额外的卷起的毛巾,为受试者的颈部和肩膀提供支撑。
- 解锁床的制动阀,轻轻移动受试者的头部,该头部放置在杜瓦瓶头盔形状开口下方的可拆卸头枕上,直到它接触到头盔内部。要提高信噪比 (SNR),请使拍摄对象的头部尽可能靠近头盔。
- 将 HPI 线圈、ECG 和 EOG 电极插入 MEG 系统的相应面板上,将 EEG 网络连接到 MSR 内部的放大器单元,并从 MSR 外部的采集工作站检查头部坐标的测量值,以评估受试者的头部是否正确定位在杜瓦瓶下方。
- 在受试者同意的情况下,降低 MSR 内的光线强度,以帮助刺激放松和睡眠。当被试者感到放松和舒适时,指示被试在录制过程中闭上眼睛休息或睡眠。向受试者保证,在整个录制过程中,他/她将通过安装在 MSR 墙壁上的射频屏蔽彩色摄像机在 MSR 外的监视器上被观察。
- 对于视觉运动任务,将 MEG 系统的机架设置到直立位置(图 1B)并布置 MEG 椅子,使受试者的头部位于机架下方,靠近杜瓦瓶底部的头盔形开口。将椅子调整到正确位置后,将椅子的制动阀设置到关闭锁定位置("0")。
- 在 MSR 中传输主题。帮助他/她坐在非磁性和兼容的椅子上,找到一个舒适放松的姿势。在拍摄对象身上放几条毯子,确保电极的电缆易于接近,以便在录制过程中保持温暖,并放置可拆卸的桌子,以便拍摄对象在执行任务时可以将手放在上面。如果需要,将毛巾放在受试者的膝盖下以帮助保持坐姿,不要滑落。
注意:由于受试者在视觉运动任务期间可能会放松,因此会采取比初始位置更低的姿势,因此在每次任务结束时通过升降踏板(如果有)小心地抬起椅子,或在椅子上放毛巾或毯子,以便受试者的头部再次接触头盔内侧。如果需要,在受试者的脑后放置额外的毛巾或毯子,不仅可以提高舒适度,还可以帮助受试者尽可能保持头部挺直。视觉运动刺激可以在仰卧位交替进行,以避免在录制过程中移动杜瓦瓶。 - 一旦受试者处于正确的位置,将 HPI 线圈、ECG、EOG、FDI 和 APB 电极插入 MEG 机器的右侧面板上,将 EEG 网络连接到 MSR 内的放大器单元,并通过小动作通过升降踏板(如果有)升高椅子或将额外的毛巾或毯子放在椅子上,直到受试者的头部轻轻接触头盔内侧(检查测量来自 MSR 外部采集工作站的头部坐标)。
- 将投影屏幕放置在受试者面前,其中视觉刺激将通过位于 MSR 外部的投影仪镜系统投射(图 1B),并解释在录制过程中要执行的视觉运动任务。特别要注意的是,指示受试者仅在右手和左手的视觉刺激(例如图像)分别出现在屏幕上时,才用食指轻敲桌子。确保被试者理解任务或觉得独自执行任务感到自在;如果需要,与受试者一起练习任务几次,以帮助他/她熟悉它。
注意: 如果在仰卧位进行视觉运动刺激,则会在受试者面部上方一定距离处放置一面镜子,以反射来自投影仪的视觉刺激。 - 在关上 MSR 的门之前,询问对象他/她是否觉得独自在房间里很舒服;如果他/她没有这样做,则在录制期间,团队中的一人或其父母将留在 MSR 内。此外,请向拍摄对象保证,在整个录制过程中,他/她将在 MSR 之外的监视器上被观察。
- 在 MSR 中传输主题。帮助他/她坐在非磁性和兼容的椅子上,找到一个舒适放松的姿势。在拍摄对象身上放几条毯子,确保电极的电缆易于接近,以便在录制过程中保持温暖,并放置可拆卸的桌子,以便拍摄对象在执行任务时可以将手放在上面。如果需要,将毛巾放在受试者的膝盖下以帮助保持坐姿,不要滑落。
- 对于听觉刺激,请使用步骤 2.14 中描述的设置,将投影屏幕放在坐着的受试者前面。帮助拍摄对象佩戴耳机(或耳机),通过该耳机触发声音(例如,调制的啁啾声)。
- 指示被试者在聆听声音触发器的同时注视投影在屏幕上的刺激物(例如,黑色背景上的绿点)。如果需要,请进行一次培训课程,以帮助受试者更好地理解该过程。在关闭 MSR 的门之前,请重复前面描述的安全程序。
- 对于体感刺激,请使用步骤 2.14 中描述的设置。询问拍摄对象他/她想在他/她面前的投影仪屏幕上观看什么视频(或电影)。
- 指示受试者睁大眼睛放松,观看选定的视频,尽可能保持静止,并忽略录制过程中传递到他手指的触觉刺激。向受试者解释他/她会感觉到每只手分别在指尖的皮肤上轻轻敲击。如果受试者感到不舒服,请进行训练以安抚他/她。
注意:眼睛注视视觉目标是一种行之有效的技术,可以最大限度地减少可能影响记录质量并分散受试者在数据采集过程中传递的触觉刺激的生物伪影。
- 指示受试者睁大眼睛放松,观看选定的视频,尽可能保持静止,并忽略录制过程中传递到他手指的触觉刺激。向受试者解释他/她会感觉到每只手分别在指尖的皮肤上轻轻敲击。如果受试者感到不舒服,请进行训练以安抚他/她。
3. 数据采集
注意:同步采集 MEG 和 EEG 数据是在库克儿童医疗中心 (CCMC) 的 MEG 设施中进行的。有关 MEG 在儿科癫痫儿童临床应用的更多详细信息,请参见其他位置 8,27,45。
- 使用全头 MEG 系统(传感器覆盖范围:1,220 cm2)记录 MEG 信号,其特点是 306 个通道,分为 102 个相同的三传感器元件,带有一个磁力计和两个正交平面梯度计。将采样频率设置为至少 1 kHz。
注意:单线圈磁力计测量垂直于 MEG 头盔表面的磁场分量。平面梯度计由"8 字形"线圈配置组成,其特征是成对的磁力计彼此相距较短,并测量它们位置之间的磁场差(即"8"的两个回路之间的差异),也称为空间梯度。与磁力计相比,平面梯度计对大脑深部源的敏感性较低,但通过抑制环境噪声,在检测浅表源方面更可靠。这 306 个通道在 -296 °C (4.2 K) 的液氦中浸泡和冷却,成为超导体。 - 使用非磁性 256 通道脑电图网同时记录脑电图信号,Ag/AgCl 电极传感器均匀分布在头皮、脸颊和颈后。将采样频率设置为至少 1 kHz。
- 关闭 MSR 的门以开始录制。通过语音对讲系统,与对象进行交流,检查他/她是否觉得独自在 MSR 内感到舒适。持续监控视频中的主体,并在紧急情况下立即进入 MSR。
注意:如果他/她感到不舒服或巨大的 MSR 门吓到他/她,在录制过程中,团队中的一人或他/她的父母可以留在 MSR 内,坐在靠近拍摄对象的木椅上;确保在进入房间之前清除所有金属物体。 - 在每次录制之前,通过语音对讲系统指示受试者在开始任务之前保持他/她的位置静止 ~30 秒。对于视觉运动任务,另外通过对讲机传达他/她将在第一次录音时使用哪个食指(右或左)。
- 在被测者保持静止的这段时间内,按下 MEG 数据采集系统上 HPI 测量对话框中的测量按钮,以测量馈入 HPI 线圈的电流产生的磁场,并确定相对于 MEG 传感器阵列的头部测量位置;因此,请确认受试者位置正确(头部 |z 坐标|˂ 75 毫米)并记下每次会话的 3D 测量值。
- 如果受试者的头部和头盔之间仍有空间,请重新进入 MSR 内部并通过升降踏板(如果有)调整椅子的高度,在椅子上放毛巾或毯子,或通过对讲机指导受试者如何将头部移动到更靠近头盔的位置(如果受试者坐着), 最后再次检查头部测量位置。在休息/睡眠记录的情况下,重新进入 MSR 并使床更靠近头盔,从而减少头部与头盔的空间间隙。
- 一旦受试者相对于 MEG 头盔处于良好位置并准备开始,按照精确的顺序开始第一次录制(持续时间 ~10 分钟)(参见步骤 3.5.1)以实现准确的 MEG 和 EEG 同步(参见步骤 3.12)。
注意:为确保高质量的录制,第一次录制会话对于捕获数据中由于主体移动或外部环境引起的伪影至关重要。如果需要,重新进入 MSR 以调整最终通道连接或受试者在 MEG 椅子上的位置。建议在录制过程中记下任何异常的伪影或事件,以便在需要时在录制后查看。- 按下 EEG 数据采集软件上的记录按钮开始 EEG 记录。按下 MEG 数据采集软件上的记录按钮开始 MEG 记录。最后,按下刺激计算机软件中的开始按钮以显示视觉刺激或传递听觉刺激。
注意:运行视觉(或听觉)刺激软件的刺激计算机连接到 MSR 外部的投影仪镜系统,该系统可以根据执行的记录类型打开或关闭。在静息/睡眠记录期间,由于受试者正在休息或睡眠,系统处于关闭状态,但在刺激计算机上运行视觉刺激软件有助于安排每次记录的时间。在视觉运动任务期间,以及在听觉和体感刺激期间,系统通过允许受试者观察刺激或投影在他/她面前的屏幕上的视频来打开软件运行。在这项研究中,总共选择了 (i) 107 个刺激(即 85 张图像叠加在棋盘背景和 22 个棋盘背景上),每个刺激之间的间隔为 ~4 秒用于视觉运动任务;(ii) 200 个调制的啁啾声,听觉刺激的刺激间隔为 3 s;(iii) 每个手指(即 D1、D3 和 D5)的 200 次触觉刺激,遵循半随机序列,体感刺激的刺激间隔为 ~1.5 秒。
- 按下 EEG 数据采集软件上的记录按钮开始 EEG 记录。按下 MEG 数据采集软件上的记录按钮开始 MEG 记录。最后,按下刺激计算机软件中的开始按钮以显示视觉刺激或传递听觉刺激。
- 要停止记录,请按下 MEG 数据采集软件上的停止按钮,然后按下 EEG 数据采集软件上的停止按钮。在每次录制会话结束时,通过对讲机与拍摄对象交流以安抚他/她,如果 MSR 内部不需要频道连接或位置调整,请继续进行下一个会话。
- 对于视觉运动任务,为每次会话选择不同的视觉刺激,以保持受试者在录制过程中的积极性和娱乐性。
- 对于视觉运动或静息/睡眠数据,记录总共 ~1 小时的同步 MEG 和 EEG 记录,其特征是 5-6 次会话。但是,每个科目的会话数可能会有所不同。此外,分别记录听觉和体感刺激数据总共 ~20 分钟(1-2 次,每次 ~10 分钟)和 ~14 分钟(1-2 次,每次 ~7 分钟)的同步 MEG 和 EEG 记录。
注意:在这项研究中,MEG 和 EEG 数据在记录结束时分别以 .fif 和 .mff 格式自动存储在 CCMC 的 IT 存储系统中。 - 记录结束后,输入 MSR 以帮助受试者从椅子或床上站起来,并要求他/她坐在 MSR 外的椅子上,以移除脑电网和电极。
- 指示受试者闭上眼睛,直到另有通知,并帮助他/她通过完全松开下巴带并用两只手轻轻拉出网(从受试者的前额到后脑勺)来移除脑电图网,直到它完全剥落。在此步骤中,请确保在取下网时不要拉扯拍摄对象的头发。此外,帮助受试者轻轻去除之前贴在他/她皮肤上的剩余电极(即在视觉运动任务的情况下,ECG、EOG 和 EMG)。
- 移除脑电图网和电极后,告诉受试者(和他/她的父母)所有程序终于完成了。
- 拍摄对象离开房间后,请仔细清洁光学扫描仪(如用户手册中所述)并将其存放在保护套中。
- 使用医院批准的过氧化氢湿巾或消毒喷雾和纸巾清洁和消毒记录期间使用的任何设备(例如椅子、床、书桌)的表面,将用过的毯子和毛巾放入医院提供的容器内,并扔掉任何用过的胶带。
- 将测量工具存放在储物柜内,并在流来的自来水下使用木制棉签清洁装满导电膏的电极杯内部。
- 要冲洗脑电图网,请将水槽中的塑料桶装满干净、温暖的自来水,然后重复以下步骤,总共四次。
- 将脑电图网浸入水中,轻轻搅拌脑电图网 10-20 秒(或将其浸入桶内外 ~25 次)。
- 排干桶中的水,然后用干净温的自来水重新装满桶。
- 要对脑电图网进行消毒,请将由 2 夸脱温水面和 1 汤匙消毒剂组成的消毒液装满水槽中的塑料桶,然后将脑电图网浸泡在其中 10 分钟。从消毒液中冲洗桶,然后按照冲洗和排水过程进行 3 次,以去除脑电图网中的任何残留溶液。
- 对于冲洗或消毒过程,请从桶中取出浸入的脑电图网,用干净的干毛巾去除多余的水擦干,然后将其挂在靠近水槽的地方存放。
- 为了抑制 MEG 数据中的内部和外部磁干扰和测量/移动伪影,请将信号空间分离 (tSSS) 方法的时间扩展应用于原始数据 MEG .fif 文件。
注意:时空麦克斯韦滤波 (tSSS) 非常适合抑制位于 MEG 传感器阵列内部或非常靠近 MEG 传感器阵列的干扰源,即内部干扰。 - 当同时进行 MEG 和 EEG 记录时,在空间上将两个采集设备的坐标系与受试者头部的解剖标志对齐(图 2A),并校正由于可能的采样率不同而发生的信号之间的线性时钟漂移(图 2B)。
注意:在记录过程中,MEG 和 EEG 信号也会受到随时间缓慢变化的影响,因为按下 Start 和 End 按钮可能会延迟,以及当触发器发送到 MEG 和 EEG 数据采集软件时发生的内部时钟漂移。为了确保这些信号之间的精确同步,用 Python 开发了一个内部代码,该代码使用数据采集期间两个系统上发送的触发事件作为公共触发信号。该代码包括 MNE-Python 软件库中可用的三个函数:两个读取 MEG 和 EEG 信号的函数和一个从信号中提取触发事件信息的函数,例如通道名称和时间戳(即事件发生的日期和时间)。每个信号中触发事件出现之间的时间差(即 delta)定义了线性时钟漂移随时间的变化(图 2B)。后续步骤中提供了开发代码的详细说明(请参阅 3.12.1-3.12.4)。- 使用每个信号上发生的第一个触发事件之间的差值作为偏移值(即,要从两个信号之一中修剪的部分)来对齐录音。
注意: mne.io.read_raw_fif 和 mne.io.read_raw_egi 函数将 MEG 和 EEG 记录转换为 2D 数组格式,而 mne.find_events 函数从原始信号中提取事件信息。 - 一旦这些第一个触发因素对齐,计算皮尔逊相关系数以评估信号之间的相关程度;建议使用 < 1 x 10-6 的 p 值,以确保完美对齐。
注意:来自 scipy 库的 pearsonr 函数估计 MEG 和 EEG 信号之间的 Pearson 相关系数以及该相关性的 p 值。 - 为了验证这种相关性准确性,通过执行一阶多项式拟合来估计两个信号之间的漂移率,并使用多项式函数系数表示的差异程度对多项式拟合的 x 轴上的信号进行重新采样(图 2B)。
注意:numpy 库中的 polyfit 函数将 MEG 和 EEG 信号拟合到多项式函数中;此函数返回一个系数,该系数表示两个信号之间的差异程度。mne.resample 函数根据多项式函数的系数对 MEG 和 EEG 信号进行重采样。 - 重采样完成后,比较每个信号上发生的最后一个触发事件的时间戳,并删除 MEG 和 EEG 信号中不常见的时间窗口。最后,合并同步的 MEG 和 EEG 信号,以创建由 MEG 和 EEG 传感器表征的单个记录,可用于进一步分析。
注: mne.add_channels 功能将两个信号合并为一个录音。
- 使用每个信号上发生的第一个触发事件之间的差值作为偏移值(即,要从两个信号之一中修剪的部分)来对齐录音。
- 在每个 ~1.5 小时记录结束时,使用总共 5-6 次(每次 ~10 分钟)、1-2 次(每次 ~10 分钟)和 1-2 次(每次 ~7 分钟)同步 MEG 和 EEG 记录,分别用于视觉运动(和休息/睡眠)、听觉和体感刺激数据,用于数据分析。
注意:理想情况下,受试者需要对三个视觉运动记录进行右指敲击,对其余三个视觉运动记录进行左指敲击。
4. 数据分析
- 刺激区标测
- 使用 FreeSurfer 的皮质重建过程从受试者的 MRI 生成 3D 皮质表面, FreeSurfer 是一种开源神经成像工具,用于处理、分析和可视化人脑 MR 图像46。
- 在 Brainstorm 上导入重建的解剖结构, Brainstorm 是 MATLAB 的一个开源应用程序,专门用于 MEG 和 EEG 数据可视化和处理47,以可视化皮层重建结果。从 Brainstorm 中,在导入的 MRI 上设置定义主体坐标系的基准点(即鼻音、左/右耳前、前/后连合和半球间)。
- 在 Brainstorm 上导入同步 MEG 和 HD-EEG 信号,并使用 MRI 配准过程在 MRI 上配准 MEG 和 EEG 传感器,以调整它们与数字化基准点的对齐方式。如有必要,将 EEG 传感器投射到皮质表面。
- 打开同步 MEG 和 HD-EEG 记录,并目视检查原始数据以去除不良通道。此外,应用 Brainstorm 中提供的信号空间投影 (SSP) 伪影校正技术,以拒绝录音中的生物伪影(例如,心跳、眨眼)。
- 将陷波(50 或 60 Hz,根据电力线干扰)和带通 (1-70 Hz) 滤波器应用于同步 MEG 和 HD-EEG 数据。
- 选择包含发作间期活动的数据部分,这些活动的特点是频繁的 IED,例如尖峰和尖锐的波,并且具有最少的运动伪影(如果可能)。
注:IED 是瞬态波形,其特征是 <70 ms 的时间演变、>50 μV 的振幅和尖锐的形状,可以与 1-70 Hz 频带48 中的背景活动明显区分开来。 图 3A 表示同步 MEG 和 HD-EEG 信号部分的示例,在两个记录中都可以看到频繁的 IED。 - 使用每页 10 秒的标准显示设置,标记 MEG 和 EEG 记录(图 3A)以及单独每种模态上出现的每个 IED 的负峰值。在标记每个 IED 之前,请分别检查 MEG 和 EEG 的地形场和电位图。
注意:还必须检查每个 IED 上升阶段(而不是其峰值)期间其他时间点的电压分布,以考虑可能传播的癫痫活动49。有关如何使用 Brainstorm 标记发作间期尖峰事件的更多详细信息,请参阅其他地方 (https://neuroimage.usc.edu/brainstorm/Tutorials/Epilepsy)。 - 使用 Brainstorm 中提供的 OpenMEEG BEM(对称边界元法)软件计算一个逼真的头部模型,定义为三层(即头皮、内颅骨和外颅骨)几何模型(图 3B)。使用 MRI 体积作为源空间(具有 5 mm 空间分辨率的源点网格)。
注意:OpenMEEG BEM 软件使用对称边界元方法计算以头皮(即空气-头皮界面)、外颅骨(即头皮-颅骨界面)和内颅骨(颅骨-大脑界面)为特征的真实正演模型。作为替代解决方案,有限元法 (FEM) 可用于解决前向问题,因为它允许对头部体积导体进行逼真的特定主题表示。头部组织电导率值通常从文献中假设,并且可能因受试者的年龄而异50 岁。要使用 FEM 求解正演模型,请使用 Brainstorm 47,50,51 中提供的 DUNEuro FEM 软件计算实际头部模型,定义为三到五层(即白质、灰质、脑脊液、颅骨和皮肤)几何模型。有关使用 FEM 估计前向模型的更多详细信息,请参见其他位置 (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro)。 - 使用无约束的 ECD 方法分别在 MEG、EEG 以及组合的 MEG 和 EEG 传感器阵列上定位所选发作间期尖峰的基础生成器。要定位这些偶极子源,请计算空室 MEG 记录的噪声协方差或将其设置为单位矩阵。
注意:如果 IED 的 SNR 较低,请考虑在具有相似电压分布的平均 IED 上执行源定位,作为替代方法12。 - 在先前标记的每个 IED 的峰值处执行 Brainstorm 中提供的偶极子扫描方法,以选择整个脑体积中最重要的源偶极子。仅选择拟合优度为 >60% 的源偶极子,并估计它们为每个偶极子定义的簇性,即位于距其中心 15 mm 处的偶极子数(图 3C)。
注意:有关 ECD 集群性的更多详细信息可以在其他位置找到52.
- SOZ 映射
- 使用 FreeSurfer46 的皮质重建过程从受试者的 MRI 生成 3D 皮质表面。
- 在 Brainstorm47 上导入重建的解剖结构,以可视化皮质重建结果。在导入的 MRI 上设置定义主题坐标系的基准点。
- 在 Brainstorm 上导入同步 MEG 和 HD-EEG 信号(包含发作事件),并使用 MRI 配准过程在 MRI 上注册 MEG 和 EEG 传感器,以调整它们与数字化基准点的对齐方式。如有必要,将 EEG 传感器投射到皮质表面。
注意:如果受试者在录制期间癫痫发作,请查看录制期间的笔记,以评估记录发作事件的会话。 - 打开同步 MEG 和 HD-EEG 记录,并目视检查原始数据以去除不良通道。应用 Brainstorm47 中提供的 SSP 伪影校正技术,从录音中拒绝生物伪影(例如,心跳、眨眼)。
- 将陷波(50 或 60 Hz,根据电力线干扰)和带通 (1-70 Hz) 滤波器应用于同步 MEG 和 HD-EEG 数据。
- 根据记录笔记,确定癫痫发作的开始及其终止(如果注意到)并在信号上标记这些事件,以确定包含发作期癫痫样分泌物的数据的正确部分。 图 4 中分别显示了 MEG 和 HD-EEG 的癫痫发作示例。
注意:当受试者在 MEG 采集期间癫痫发作时,医务人员需要立即协助受试者并提供紧急护理。因此,那些具有发作事件的数据部分的持续时间可能很短。 - 使用每页 10 秒的标准显示设置,在 MEG 和 EEG 上标记发作事件期间发生的每次癫痫样放电(例如,重复尖峰、尖波或尖峰波复合体)的负峰值,以及单独在每种模式上。在每次峰值标记之前,分别检查 MEG 和 EEG 的地形场和电位图(图 4A)。
注意:癫痫发作分为全身性或局灶性,具体取决于其发作开始的位置。虽然依赖于癫痫综合征,但癫痫发作是一种至少 10 秒的现象,其特征是重复放电,频率、振幅和形态可能不同。 - 使用 Brainstorm 中提供的 OpenMEEG BEM 软件计算 MEG 和 EEG 传感器的三层(即头皮、内颅骨和外颅骨)真实头部模型。使用 MRI 体积作为源空间(具有 5 mm 空间分辨率的源点网格)。
注意:要使用 FEM 求解正演模型,请使用 Brainstorm 47,50,51 中提供的 DUNEuro FEM 软件计算实际头部模型,定义为三到五层(即白质、灰质、脑脊液、颅骨和皮肤)几何模型。有关使用 FEM 估计前向模型的更多详细信息,请参见其他位置 (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro)。 - 使用无约束的 ECD 方法分别在 MEG、EEG 以及 MEG 和 EEG 组合传感器阵列上定位所选发作期放电的底层发生器。要定位这些偶极子源,请计算空室 MEG 记录的噪声协方差或将其设置为单位矩阵。
- 在先前标记的每个发作波形的峰值处执行 Brainstorm 中提供的偶极子扫描方法,以选择整个脑体积中最重要的源偶极子。仅选择拟合优度为 >60% 的源偶极子,并估计它们的簇性(偶极子与每个偶极子中心的距离设置为 15 mm)52。
- 雄辩的皮层映射
- 使用在视觉运动任务以及听觉和体感刺激期间记录的信号执行前面描述的步骤 4.2.1-4.2.3。
- 同时打开 MEG 和 HD-EEG 记录,并目视检查原始数据以去除不良通道。另外,对于每个会话,应用 Brainstorm47 中提供的 SSP 伪影校正技术,以拒绝录音中的生物伪影(例如,心跳、眨眼)。此外,丢弃或标记为 "Bad interval" 所有那些被工件污染的、无法用于进一步分析的数据段。
- 将陷波(50 或 60 Hz,根据电力线干扰)和带通 (1-100 Hz) 滤波器应用于同步 MEG 和 HD-EEG 数据。
- 为了映射运动皮层,打开从 FDI 和 APB 电极记录的 EMG 信号,并通过选择与 FDI 对电极上的基线不同的肌肉激活的第一个峰值,手动标记受试者分别为右手和左手执行的敲击事件。使用 Brainstorm47 为每个会话单独执行此步骤。
注意:仅在 Brainstorm 上使用"过滤器"选项卡进行可视化,并选择频率范围(例如,高通:30 Hz;低通:300 Hz;陷波:60 Hz),这有助于在敲击时正确标记 EMG 活动的峰值。事件的名称在各个会话中需要相同;例如,当主题执行右指(或左指)敲击时的事件可以命名为"Tap_right"(或"Tap_left")。此步骤允许我们对所有会话中发生的相同类型的事件执行唯一分析。 - 从每个会话中,通过选择以下参数导入无伪影片段上发生的事件:视觉刺激:[-200; +500] 毫秒时间窗口,包括刺激开始前 [-200; 0] 毫秒的基线;敲击事件:[-1500; +1000] 毫秒时间窗口,包括视觉刺激开始前 [-1500; -1000] 毫秒的基线;调制啁啾声:[-500; +1000] 毫秒时间窗口,包括刺激开始前 [-500; 0] 毫秒的基线;和触觉刺激:[-100; +500] 毫秒时间窗口,包括刺激开始前 [-100; 0] 毫秒的基线。
- 从所有会话中导入特定任务的事件后,应用平均参考蒙太奇以提高脑电图数据的 SNR,并估计刺激的平均值以获得事件诱发的视野和电位。在运动任务(即敲击)和触觉刺激的情况下,最后一步分别对右手和左手执行。
注意:图 5、图 6、图 7 和图 8 的面板 A 和 B 分别显示了 MEG 和 EEG 的视觉、运动、听觉和体感诱发反应的示例以及它们的相对地形场和电位图。特定任务的刺激总数严格取决于已完成的会话数;在电机任务的情况下,这个数字还取决于正确执行的攻丝任务。 - 对于视觉、运动、听觉或体感诱发电场和电位,使用 Brainstorm 中提供的 OpenMEEG BEM 软件计算 MEG 和 EEG 传感器的三层(即头皮、内颅骨和外颅骨)真实头部模型。使用 3D 皮质表面作为源空间。
注意:要使用 FEM 求解正演模型,请使用 Brainstorm 47,50,51 中提供的 DUNEuro FEM 软件计算实际头部模型,定义为三到五层(即白质、灰质、脑脊液、颅骨和皮肤)几何模型。有关使用 FEM 估计前向模型的更多详细信息,请参见其他位置 (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro)。 - 对于每个事件诱发的野和电位,使用在 Brainstorm 工具箱中实现的 dSPM 计算平均事件的皮层来源,分别用于 MEG、EEG 以及 MEG 和 EEG 组合传感器阵列。使用特定于每个任务的刺激前基线周期设置噪声协方差矩阵(请参阅步骤 4.3.5)。
- 根据任务,提取在所涉及的雄辩大脑区域 [初级视觉皮层 (V1)、初级运动皮层 (M1)、初级听觉皮层 (A1) 或初级体感皮层 (S1)] 观察到的最大皮层源,这些皮层源可以使用图谱或通过重建该位置的虚拟传感器(即感兴趣区域,ROI)来定义(图 5C, 图 6C、 图 7C 和 图 8C)。
- 以线性刻度(频率范围:1:1:100 Hz)对所涉及的雄辩大脑区域(V1、M1、A1 或 S1)的事件诱发场和潜在来源进行 Morlet 小波时频分解。
注意:为了估计与刺激开始时间锁定和相位锁定的诱发振荡,MEG/EEG 信号最初在事件上平均,然后进行时频分析53,54。 - 使用 Brainstorm 中提供的事件相关扰动方法对皮层源图进行标准化,以根据基线(参见步骤 4.3.5)分别针对每个事件(图 5D、 图 6D、 图 7D 和 图 8D)对皮层源图进行标准化。
注意:使用事件相关扰动对源映射进行标准化是时频幂图的标准化度量,它以百分比估计基线上与平均值的偏差。有关此标准化过程的更多详细信息,请参见 elsewhere (https://neuroimage.usc.edu/brainstorm/Tutorials/TimeFrequency#Normalized_time-frequency_maps)。
- 验证
- 通过植入硬膜下网格和/或深度电极获取术外 iEEG 记录。颅内电极的数量、类型和位置由多学科癫痫团队根据从术前评估的无创诊断测试中获得的信息汇总得出的临床假设来决定。
注意:作为术前评估的一部分,使用 1,024 Hz 采样率通过数字脑电图系统记录几天的术外 iEEG。 - 确定癫痫专家根据每个受试者可用的临床信息定义的 SOZ。
注意:SOZ 定义为显示第一次明确的发作期电图放电的大脑区域,这与可能在临床定义的发作期发作之前或同时发生的背景活动不同。参与这种发作期电图放电的所有通道都被视为 SOZ 触点,即使捕获到源自不同大脑区域的癫痫发作。 - 在 iEEG 上记录的发作事件期间,标记每个颅内电极上发生的每次癫痫样放电爆发的峰值,并使用 ECD 方法对这些发作事件进行源定位,如之前的步骤 4.1.7-4.1.10 中所述。
- 将 iEEG 定位结果与临床定义的 SOZ 进行比较,作为源定位结果的金标准。
- 通过植入硬膜下网格和/或深度电极获取术外 iEEG 记录。颅内电极的数量、类型和位置由多学科癫痫团队根据从术前评估的无创诊断测试中获得的信息汇总得出的临床假设来决定。
结果
DRE 儿科患者是从库克儿童保健系统 (CCHCS) Jane 和 John Justin 心理健康研究所的癫痫诊所招募的。这里展示了来自三名代表性患者的数据:(i) 一名 10 岁女性,(ii) 一名 13 岁男性,以及 (iii) 一名 10 岁女性。
案例 1: 一名 10 岁女性因 3 岁开始癫痫发作入院。即使在服用 8 种 ASM 后,患者仍每天癫痫发作。初始癫痫发作的特征是眼睛偏斜 (不清楚的一侧) 和行为停滞。后来,患者经历了 ~30 秒的每日癫痫发作,其特征是发作期噘嘴 ("chapeau de gendarme" 征) 、头部向左偏和双侧强直臂僵硬 (右侧为主)。长期视频脑电图显示两组不对称强直性癫痫发作,头部向左偏,然后她的左臂向上抬起。在睡眠时还观察到 3 次强直发作,频繁出现全身性快速多棘波和慢波,间歇性睁眼、向上凝视和左臂或右臂抬高。这些多尖峰和慢睡眠波主要从左颞叶中部突出。脑部 MRI 显示以下多灶性异型增生:(i) 左顶叶(中央回后)局灶性皮质发育不良 (FCD) 伴跨套征(II 型 FCD),(ii) 右顶枕交界处 FCD,以及 (iii) 左颞极 FCD。正电子发射断层扫描 (PET) 显示左顶叶、左颞叶和右顶枕交界处代谢减退,对应于 MRI 检查中信号异常的病灶 (即 FCD)。患者被诊断为顽固性癫痫,刻板的 chapeau 符号学后强直性手臂僵硬,提示可能的额内侧或岛叶/颞部发作。建议通过针对额叶、扣带回、岛叶和发育不良区域进行广泛的双侧立体脑电图 (sEEG) 探查。在 iEEG 监测期间,患者有典型的癫痫发作,伴有 "chapeau de gendarme" ,然后是右上肢或左上肢的强直性抬高/屈曲,其特征是弥漫性脑电图发作,在双侧前岛叶上最大。多灶性 IED 主要观察到于左右前颞叶和背外侧额叶皮层,包括双侧岛叶。对 iEEG 记录进行的 ESI 证实了 SOZ 的位置,临床上定义为双侧左右背外侧额叶皮层和前岛叶。
作为术前评估的一部分,对同步 MEG 和 HD-EEG 数据进行了源定位。MEG 和 HD-EEG 记录表明两个额颞区都频繁出现 IED。 图 3A 显示了 MEG 和 HD-EEG 数据上的 IED 的代表性示例;两种模式的地形野和潜在映射表明右侧额颞区可能存在潜在来源。ESI 显示覆盖左右额颞叶和顶叶区域的分散偶极子簇。MSI 显示位于右额颞叶附近的右额颞叶有一个局灶性偶极子簇。EMSI 指示双侧额颞区存在局灶性偶极子簇,与在 iEEG 金标准上进行的 ESI 一致,这证实了临床观察结果(图 3C)。通过 EMSI 估计的这些偶极子显示与 iEEG 定义的 SOZ 的平均距离为 9.81 毫米(中位数:11.18;标准:2.37)。
案例 2: 一名患有顽固性癫痫的 13 岁男性因 9 岁开始癫痫发作入院。癫痫发作开始时有先兆,然后是头部/眼睛向左偏斜,有时保持意识,头部阵挛向左,持续 ~30 秒,每周发生数次。开出的 ASM 均未达到癫痫发作控制。从长期视频脑电图中,我们观察到右半球右后颞叶尖峰和频繁的尖峰波放电,涉及中颞叶、额颞叶、颞顶叶和中央顶叶皮层。患者有 6 次电临床癫痫发作,其特征是行为改变、左臂伸展时头部/眼睛向左偏斜,有时左臂有阵挛活动,以及 3 次癫痫发作伴继发性双侧惊厥活动。最大发病发生在右侧颞叶中叶,右额颞叶发生进化。脑部 MRI 显示右半球皮层的广泛畸形 (外侧膜为主) 和右大脑半球轻度体积丢失,伴有右侧脑室空洞扩张。患者被诊断为顽固性癫痫,起病于右半球,有利于弥漫性皮质畸形区域的颞部和外侧发病。进行立体脑电图以描绘受累程度,将电极放置在右侧颞叶、外侧、岛叶和顶枕叶皮层中。在 iEEG 监测期间捕获了几次电临床局灶性癫痫发作,其中右额颞叶的大面积发作最大。对 iEEG 数据进行的 ESI 将这些癫痫发作定位在更重要的区域,包括右颞叶中回(靠近右颞中回)和外侧区域。
作为术前评估的一部分,同时进行了 MEG 和 HD-EEG,在此期间患者经历了两次癫痫发作:一次是在数字化过程中坐在木椅上时,一次是在实际记录期间捕获的,发作在 MEG 和 HD-EEG 上都可见(图 4A)。发作时的地形野和电位图表明,癫痫发作的潜在来源可能位于右侧颞叶中部,如图 4A 所示。发作事件的来源定位对 ESI 和 MSI 有不同的发现:ESI 显示偶极子定位于右侧额颞叶和中央顶叶,而 MSI 显示偶极子主要在右侧颞叶(图 4B),在额颞叶皮层中还有额外的分散偶极子。通过结合这些解决方案,EMSI 揭示了发作期在颞叶内的定位,与 iEEG 金标准的 ESI 一致(图 4B)。特别是,EMSI 呈现了定位结果,与 iEEG 监测定义的 SOZ 的平均距离为 12.21 毫米(中位数:13.62;标准:2.37)。
病例 3:一名患有局部相关性特发性癫痫的 15 岁女性从 13 岁开始癫痫发作入院,但回想起来可能在 8-9 岁时,当她因重复、刻板的颈部运动而被诊断出患有抽搐时。患者有短暂的头部向左倾斜,有时会发展为局灶性认知障碍发作伴运动过度行为(即全身强直阵挛发作)以及夜间惊厥发作。施用了几种 ASMs 而没有达到完全的癫痫发作控制。在长期视频脑电图监测期间,患者出现局灶性临床电发作伴继发性全身性发作,起病于左后颞叶,多次短暂的局灶性运动性癫痫发作,头部向左倾斜,以及起病于左中央顶叶皮层的轻微电图发作。头颅 MRI 显示无急性颅内异常和 Chiari I 畸形。头部正电子发射断层扫描-计算机断层扫描 (PET-CT) 检查结果为阴性。建议进行其他检查,例如发作期单光子发射 CT (SPECT)、同步 MEG 和 HD-EEG、颈椎 X 线检查、头颈部磁共振血管造影 (MRA),以及最终对左半球进行 sEEG 探查。
作为评估的一部分,患者参与了同步 MEG 和 HD-EEG 记录,以绘制雄辩的大脑区域,例如初级视觉、运动、听觉和体感皮层。最初,患者执行视觉运动任务,然后进行听觉和体感刺激。MEG 和 HD-EEG 刺激开始后 ~70 ms 皮质对视觉刺激的反应 (图 5A). 图 5B 分别报告 MEG 和 HD-EEG 视觉刺激所涉及的皮层位置的地形野和潜在图。对于 HD-EEG,观察到覆盖枕脑区域的通道极性发生变化,而在 MEG 的相同区域发现了更复杂的视野分布(图 5B).使用 dSPM 的源定位揭示了此时 Desikan-Killiany 寰图谱以下大脑区域内的局灶性皮层活动:(i) MSI 的楔部;(ii) ESI 的枕外侧皮层;(iii) EMSI 的楔骨和枕外侧皮层 (图 5C).视觉皮层反应的时频分析显示,MSI(大约范围:30-50 Hz)、ESI(大约范围:40-50 Hz)和 EMSI(大约范围:30-50 Hz)在伽马频带中存在事件相关同步 (ERS)(图 5D).对于运动诱发反应,在运动开始时观察到对侧 M1 的 mu 节律活动抑制 (图 6A).在 图 6B,我们分别报告了 MEG 和 HD-EEG 运动任务期间激活的大脑区域的地形野和电位图。脑磁图场图显示对侧中枢脑区磁流入和流出的明显变化,这可能表明对侧 M1 中存在潜在的局灶发生器(图 6B).HD-EEG 电位图显示相同区域的局灶性极性变化,电位垂直于磁场 (图 6B).在 MSI 、 ESI 和 EMSI 的 Desikan-Killiany 图谱的对侧中央前回执行敲击任务时,观察到最大源激活的峰值,如下所示 图 6C.在预期即将到来的敲击运动期间发生的运动相关皮层反应显示 MSI(大约范围:20-30 Hz)和 EMSI(大约范围:20-40 Hz)的 beta 和 gamma 波段以及 ESI 的 γ 波段(大约范围:30-50 Hz),在文献中称为 mu rhythm suppression (图 6D).55,56 响应听觉刺激的听觉诱发电场和电位分别在 MEG 和 HD-EEG 刺激开始传递后 ~80 ms 和 ~120 ms 达到最大正峰值 (图 7A).在 图 7B,我们分别报告了 MEG 和 HD-EEG 听觉刺激所涉及的皮层位置的地形野和潜在图。在 MEG 和 HD-EEG 中,在覆盖左颞脑区域的传感器上观察到明显的极性变化,具有明确定义的负极和正极;这些垂直的磁场和电势图可能会揭示 V1 中的潜在焦点发生器 (图 7B).在平均听觉诱发电场和电位上进行源定位,在 MSI、ESI 和 EMSI 的 Desikan-Killiany 寰图谱的颞横回和颞上回后部观察到最大皮层激活 (图 7C).听觉诱发反应的时频分析显示,MSI(大约范围:40-60 Hz)和 EMSI(大约范围:35-50 Hz)的 ERS 处于伽马波段,ESI 的 beta 和 gamma 频段(大约范围:25-60 Hz)为 ESI(图 7D).最后,我们分别在 MEG 和 HD-EEG 刺激开始后 ~60 和 ~50 ms 观察到响应触觉刺激的第一次皮层活动 (图 8A).在 图 8B,我们分别报道了 MEG 和 HD-EEG 体感刺激期间激活的脑区的地形野和电位图。MEG 场图显示明显的极性变化,覆盖对侧顶叶区域的传感器的磁通量发生了明显的变化,而 HD-EEG 电位图显示相同区域的极性变化不太明显,正极比负极强。这些垂直的磁场和电位图可能表明 S1 中存在局灶性皮层发生器。在平均体感诱发反应上使用 dSPM,在该时间点在 Desikan-Killiany 寰张的对侧中央后回内观察到 MSI、ESI 和 EMSI 的最大皮层源活动 (图 8C).为了响应触觉刺激,MSI(大约范围:15-40 Hz)和 EMSI(大约范围:20-40 Hz)的 beta 和 gamma 频段的 ERS 以及 ESI(大约范围:30-40 Hz)的 gamma 频段 (图 8D) 也被观察到。
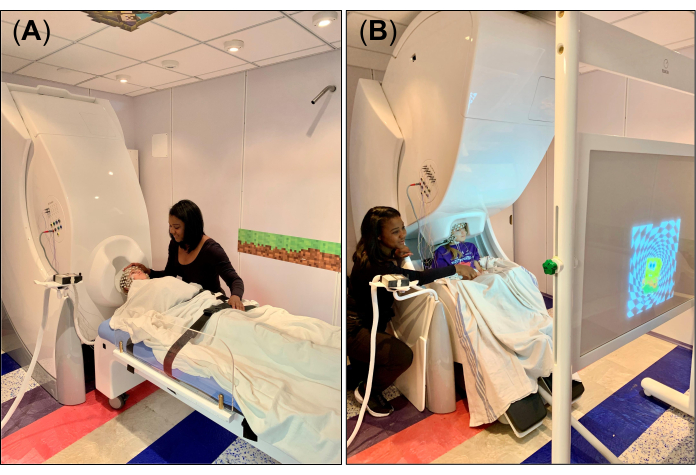
图 1:在 CCHCS 同时进行 MEG 和 HD-EEG 的实验装置。 (A) HD-EEG(256 通道)和 MEG(306 个传感器)系统,其中 MEG 的机架设置为仰卧位置(90°,水平位置),用于使用非磁性 MEG 兼容床进行静息/睡眠状态记录。技术人员正在为拍摄对象(一名 9 岁的女孩)做准备进行录制,同时确保安全和舒适。(B) HD-EEG 和 MEG 系统设置为使用非磁性 MEG 兼容椅子以坐姿进行记录。技术人员正在为拍摄对象做准备,同时确保拍摄对象在屏幕前的正确位置,在视觉运动任务期间,视觉刺激将被投射到该位置。 请单击此处查看此图的较大版本。
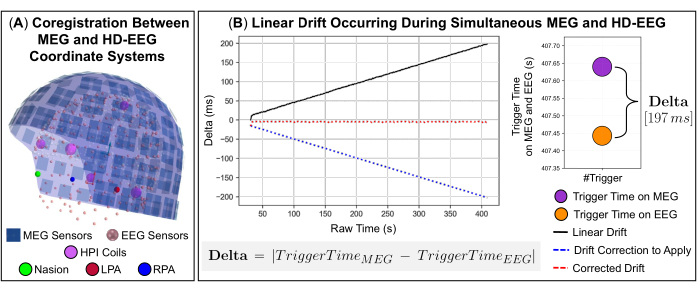
图 2:使用不同采集系统将来自同步 MEG 和 HD-EEG 记录的数据相结合的技术方面。 (A) 将 MEG 和 HD-EEG 传感器的空间对齐(共同配准)到代表性受试者(一名 9 岁女孩)的同一坐标系(由受试者的头部坐标定义)中。受试者的头部坐标由以下基准点表示:鼻音(绿色)和左/右耳前点(分别为红色和蓝色)。显示 306 个 MEG 传感器(蓝色)——102 个磁力计和 204 个平面梯度计——以及磁头位置指示器 (HPI) 线圈(洋红色);对齐到同一坐标系中,还会显示 256 个 HD-EEG 通道(粉红色)。(B) 左图:代表性受试者(一名 9 岁女孩)在 MEG 和 HD-EEG 系统之间发生的数据样本的线性漂移(即 delta,显示为黑线)。Delta 定义为将同一触发发送到 MEG 和 EEG 系统并随时间不断增加的时间之差的绝对值:从低(delta = 0 ms)到高(delta = 197 ms)值。使用要应用于信号的多项式函数估计的线性漂移的校正以蓝色虚线显示。代表 MEG 和 EEG 系统之间同步时间的校正漂移(随时间变化的增量 ~0 毫秒)以红色虚线显示。 右面板:显示了发送到 MEG 和 EEG 系统的最后一个触发估计的时间偏移(delta = 197 ms)的图形表示。 请单击此处查看此图的较大版本。
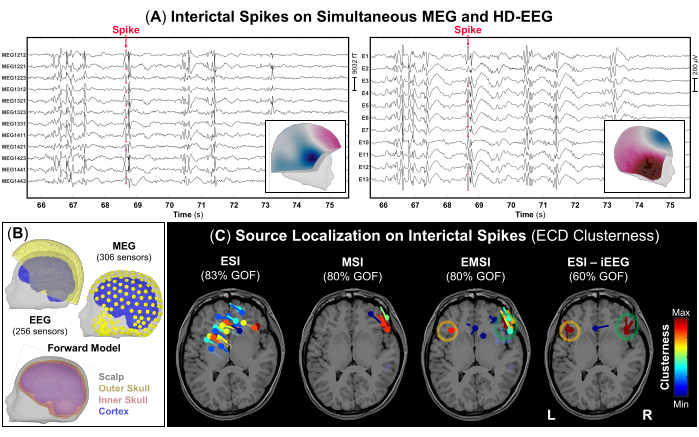
图 3:MEG 和 HD-EEG 数据上的发作间期癫痫样放电 (IED)。 (A) 一名 10 岁女性(病例 1)同时记录 MEG 和 HD-EEG 的时间部分(10 秒),IED 频繁。为了可视化,选择了 306 个 MEG 传感器和 256 个 EEG 电极的子组。IED 峰值的地形场和电位图分别显示为 MEG 和 HD-EEG 的内面板。(B) MEG 和 HD-EEG 传感器(黄色)在受试者的 3D 头部和皮质(蓝色)表面上的位置。逼真的边界元法 (BEM) 头部模型由三层 [即头皮(灰色)、外颅骨(黄色)和内颅骨(粉红色)] 组成,由受试者的术前 MRI 重建。(C) 使用等效电流偶极子 (ECD) 在 IED 上执行的源定位集群性结果显示在受试者的术前 MRI 上,用于 ESI、MSI、EMSI 和 iEEG(金标准)上的 ESI(金标准)52。拟合优度为 >60% 的偶极子簇的热图从较低(蓝色)到较高(红色)值显示。通过对 iEEG 数据执行的 ESI 定义的癫痫发作区被视为金标准 (橙色和绿色圆圈)。 请单击此处查看此图的较大版本。
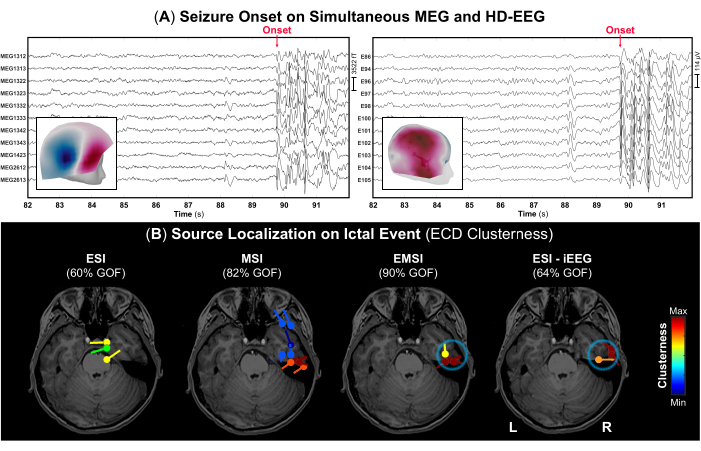
图 4:MEG 和 HD-EEG 数据上的癫痫发作。 (A) 一名 13 岁男性(病例 2)癫痫发作(红色箭头)同时记录 MEG 和 HD-EEG 的时间部分(10 秒)。为了可视化,选择了 306 个 MEG 传感器和 256 个 EEG 电极的子组。发作时的地形野和电位图分别显示为 MEG 和 HD-EEG 的内面板。(B) 在发作事件开始时使用等效电流偶极子 (ECD) 方法进行的源定位聚集性结果显示在受试者的术前 MRI 上,用于 ESI、MSI、EMSI 和 iEEG(金标准)上的 ESI(金标准)52。拟合优度为 >60% 的偶极子簇的热图从较低(蓝色)到较高(红色)值显示。通过对 iEEG 数据进行的 ESI 定义的癫痫发作区被视为金标准 (蓝色圆圈)。 请单击此处查看此图的较大版本。
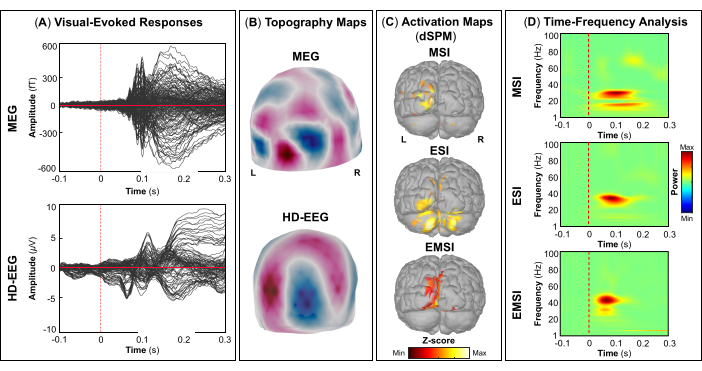
图 5:来自 MEG 和 HD-EEG 数据的视觉诱发电场和电位。 (A) 显示 15 岁女性对 MEG(上图)和 HD-EEG(下图)的平均视觉诱发电位反应,时间间隔在 -100 毫秒到 300 毫秒之间。(B) 显示 MEG 和 HD-EEG 的初级视觉皮层的地形场和电位图, 分别。(C) 使用动态统计参数映射 (dSPM) 方法分别估计 MSI、ESI 和 EMSI 的 Desikan-Killiany 寰图集(即楔骨和枕外侧皮层)大脑区域(即楔骨和枕外侧皮层)具有最大皮层激活振幅的源激活图。将显示源激活的热图(dSPM 标准化 z 分数)。(D) 在 -100 ms 至 300 ms 时间窗口内显示使用 Morlet 小波时频分解在初级视觉皮层的视觉诱发反应上获得的时频图。显示时频功率的热图,以百分比表示,该热图基于基线 [-200; 0] ms 上归一化数据与平均值的偏差。 请单击此处查看此图的较大版本。
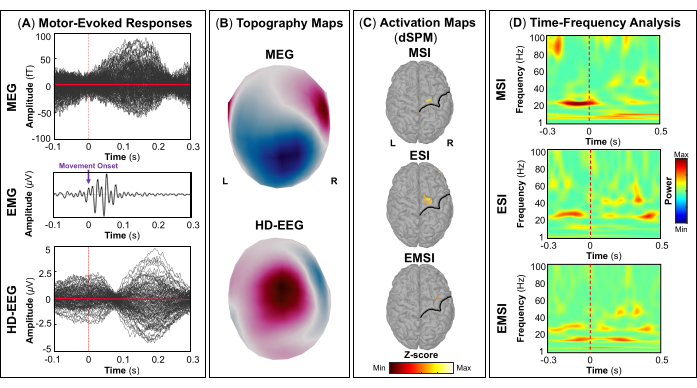
图 6:来自 MEG 和 HD-EEG 数据的运动诱发电场和电位。 (A) 在 -100 到 300 毫秒的时间间隔内,显示了一名 15 岁女性对 MEG(上图)和 HD-EEG(下图)的平均运动诱发电息反应。显示肌电图 (EMG) 信号(中间面板)和运动开始(紫色箭头),时间间隔为 -100 ms 和 300 ms;信号在 30-300 Hz 频段(陷波滤波器:60 Hz)中过滤。(B) 分别显示了 MEG 和 HD-EEG 的初级运动皮层的地形场和电位图。(C) 使用动态统计参数映射 (dSPM) 方法分别对 MSI、ESI 和 EMSI 估计的 Desikan-Killiany 寰张对侧中央前回处皮层激活最大振幅的源激活图。显示源激活的热图(dSPM 归一化 z 分数)以及中央沟(黑线)。(D) 在 -300 ms 至 500 ms 时间窗口内,使用初级运动皮层的运动诱发响应的 Morlet 小波时频分解获得的时频图。显示时频功率的热图,以百分比表示,该热图基于基线 [-1500; -1000] ms 上标准化数据与平均值的偏差。 请单击此处查看此图的较大版本。
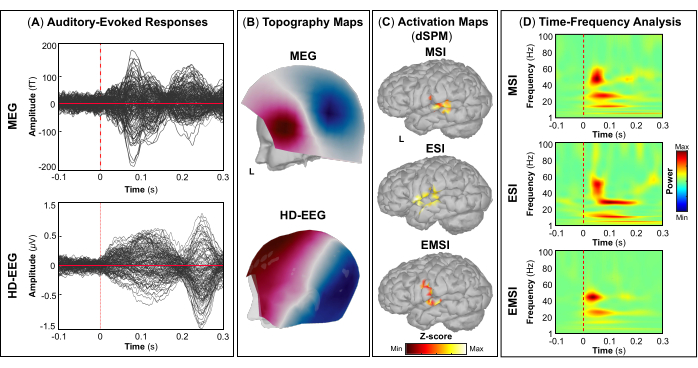
图 7:来自 MEG 和 HD-EEG 数据的听觉诱发电场和电位。 (A) 显示 15 岁女性对 MEG(上图)和 HD-EEG(下图)的平均听觉诱发反应,时间间隔在 -100 ms 和 300 ms 之间。(B) 分别显示 MEG 和 HD-EEG 的初级听觉皮层的地形场和电位图。(C) 分别使用动态统计参数映射 (dSPM) 方法估计的 MSI、ESI 和 EMSI 的 Desikan-Killiany 图谱的横颞回和颞上回后部皮层激活幅度最大的源激活图。将显示源激活的热图(dSPM 标准化 z 分数)。(D) 在 -100 至 300 ms 时间窗口内,在初级听觉皮层的听觉诱发反应上使用 Morlet 小波时频分解获得的时频图。显示时频功率的热图,根据基线 [-500; 0] ms 内标准化数据与平均值的偏差,以百分比表示。 请单击此处查看此图的较大版本。
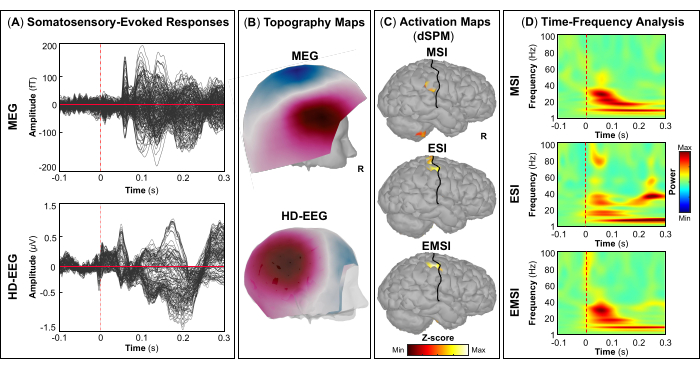
图 8:来自 MEG 和 HD-EEG 数据的体感诱发电场和电位。 (A) 在 -100 到 300 毫秒的时间间隔内,显示了一名 15 岁女性对 MEG(上图)和 HD-EEG(下图)刺激的平均体感诱发反应。(B) 显示了 MEG 和 HD-EEG 的初级体感皮层的地形场和电位图, 分别。(C) 使用动态统计参数映射 (dSPM) 方法分别估计 MSI、ESI 和 EMSI 的 Desikan-Killiany 寰图对侧中央后回处皮层激活振幅最大的源激活图。显示源激活的热图(dSPM 归一化 z 分数)以及中央沟(黑线)。(D) 在 -100 ms 至 300 ms 时间窗口内,在初级体感皮层的体感诱发反应上使用 Morlet 小波时频分解获得的时频图。显示时频功率的热图,以百分比表示,该热图基于基线 [-100; 0] ms 上归一化数据与平均值的偏差。 请单击此处查看此图的较大版本。
讨论
在这项研究中,我们说明了在休息/睡眠、执行任务或接受刺激时同时记录 DRE 儿童 MEG 和 HD-EEG 的实验设置,并提出了一个使用 EMSI 定位刺激区、SOZ 和雄辩脑区的方法框架,以及单个 MSI 和 ESI。我们进一步提供了技术建议,用于合并来自具有独特功能的不同市售产品的 MEG 和 HD-EEG 数据。我们提供了来自三个病例的数据,以增强 EMSI 在致癫痫和雄辩脑区定位中的临床效用。这里的研究结果表明,EMSI 结果优于单独通过任何一种模式获得的结果,这很可能是由于组合解决方案中 MEG 和 EEG 信号互补特性的附加价值,并且可能是由于用于记录数据的传感器数量增加(>550 个传感器)。特别是,EMSI 无创定位刺激物和 SOZ,与 iEEG 金标准上的 ESI 结果一致,这证实了临床观察结果。
所提出的方法包括以下关键步骤:(i) 高质量同时采集 MEG 和 HD-EEG(即高 SNR)记录,并对传感器(>550 个传感器)进行高空间采样,覆盖整个大脑的发作间期和发作期活动,以及视觉、运动、听觉和体感诱发野和电位,来自 DRE 儿童(步骤 3.1-3.2);(ii) 用不同采集系统记录的 MEG 和 HD-EEG 信号的时间同步和空间共配准(步骤 3.12);(iii) 仔细预处理和选择包含发作间期活动(步骤 4.1.1-4.1.7)、发作期活动(步骤 4.2.1-4.2.7)和事件相关反应(步骤 4.3.1-4.3.6)的数据部分;(iv) 使用可靠的来源定位方法(例如,具有聚类和 dSPM 的 ECD)准确定位刺激区、SOZ 和感兴趣的雄辩大脑区域(分别为步骤 4.1.8-4.1.9、4.2.8-4.2.9 和 4.3.7-4.3.9)。
同时执行 MEG 和 HD-EEG 记录时,最关键的步骤是在空间上(坐标空间之间的对齐)和时间上(校正线性时钟漂移)同步两个采集系统记录的数据。这种同步对于确保正确识别 MEG 和 HD-EEG 信号中同时发生的发作间期、发作期和视觉/运动/听觉/触觉事件至关重要。这些事件的时间点选择错误可能会影响源定位结果,并识别不一定参与这些事件生成的大脑区域。
MEG 系统通常提供兼容的 32、64 和 128 通道 EEG 系统,该系统集成到产品中,用于同时进行 MEG 和 EEG 测量。在这些情况下,无需通过发送常见的 trigger 信号来临时同步数据。同样,现在大多数脑电图系统都与所有脑电图系统兼容。尽管硬件取得了这些进步,但只有少数癫痫中心同时进行 MEG 和 HD-EEG 记录作为术前评估的一部分。在这里,我们利用了这种可集成性,并将 306 通道 MEG 和 256 通道 EEG 系统相结合,通过覆盖受试者头部的 >550 个传感器同时记录大脑活动。到目前为止,用于 MEG、HD-EEG 和 iEEG 数据高级分析的软件(例如 Brainstorm、CURRY、EEGLab、FieldTrip、MNE 或 NUTMEG)很少可用。因此,未来的研究有必要使用新的神经影像分析软件来验证所提出的方法。最后,将 MSI 和 ESI 组合成一个独特的解决方案 (EMSI) 增加了数据分析的计算复杂性。
所描述的方法存在一些应在未来研究中解决的局限性。我们手动选择了两名代表性患者的 MEG 和 HD-EEG 数据上发生的 ED,同时忽略了仅发生在两个信号之一(MEG 或 EEG)中的发作间期尖峰。手动选择尖峰可能是一种耗时且主观的方法,可以使用过去几十年开发的自动化方法来检测 IED 进行简化57,58,59.但是,始终建议进行目视检查,以便对每个 IED 进行仔细分析和精细检测。此外,我们使用 SOZ 作为 EZ 的近似值。然而,SOZ 并不总是能预测手术结果60,61,62,63.因此,未来的研究可以使用手术结果作为更精确描述 EZ 的基本事实13,14,15,16,17,19,20.尽管使用同步 MEG 和 EEG 可以成功捕获癫痫发作,并使用适当的源定位技术进行定位44,64,在临床实践中记录此类发作事件相对罕见,尤其是门诊接受 ASMs 的患者。这主要是由于 MEG 记录的持续时间有限以及癫痫发作期间发生的过度身体运动(例如,患者的头部从杜瓦瓶中滑出),这可能会导致生物伪影,从而严重影响源定位结果。在最近的一篇综述中,Stefan 等人. 报告了 7%-24% 的患者在 MEG 记录期间癫痫发作的发生率,在不同研究中平均记录时间为 30 分钟至 5.7 小时65.在 CCMC,89 名患者中有 18 名 (20.2%) 在过去 ~2 年内同时进行 MEG 和 HD-EEG 记录时捕获了发作事件。然而,18 例患者中只有 8 例 (44.4%) 成功分析。在发作间期 MEG 记录显示正常或不确定结果的情况下,发作期 MEG 或 HD-EEG 可用于高精度定位 EZ。然而,这些录音的技术和后勤要求应该得到解决。此外,通过 EMSI 进行雄辩的皮层定位的代表性数据未与这些功能脑区域定位的任何金标准进行比较,例如无创 fMRI 或术中皮层电刺激。因此,进一步的研究可能会将 EMSI 和 fMRI 整合到多模式无创成像工具中,以提高 DRE 儿童这些雄辩的大脑区域的定位准确性。这项工作也可以扩展到定位其他功能性大脑区域,例如语言雄辩区域。在 DRE 患者的术前评估中,语言功能的定位至关重要,以确定他们的手术候选资格,规划手术切除的范围,并防止永久性术后功能缺陷66.几项无创研究表明,使用 MEG 进行语言映射可以提供一致的结果,类似于侵入性 Wada 测试,后者通常被视为识别优势语言半球的金标准67,68,69,70.最近的一项研究提出了一种多模式方法,其中不同技术的组合(即皮层刺激标测、高伽马皮层电图、fMRI 和经颅磁刺激)可以为术前语言标测提供相互、验证和互补的信息71.尽管有这些优势,但对于因年龄而存在认知、智力和语言障碍的儿科患者来说,绘制语言区域仍然具有挑战性。因此,在不久的将来应该开发更多针对特定年龄的任务和适合儿童的设置。在这项工作中,我们使用未经临床认证的软件分析了 MEG 和 HD-EEG 数据。尽管这些工具已被证明是有价值和有效的,但它们存在责任问题,在报告临床使用的术前评估结果时应考虑这些问题。在这里,我们描述了仅使用基于海绵的 EEG 电极系统的 HD-EEG 记录程序。使用凝胶基 EEG 电极的替代系统广泛用于临床和研究环境。尽管它们提供更高的 SNR EEG 记录,但它们需要更长的准备时间(~40-60 分钟),因此不太适合儿科使用。或者,一些实验室在 MEG 记录期间使用基于低密度凝胶的 EEG 系统,这在准备时间方面是有利的(与 HD-EEG 系统相比),但由于覆盖整个头皮的电极数量减少,它们提供的空间分辨率明显较低12,16,72,73.
目前,癫痫患者致癫痫脑区的定位仍主要通过 iEEG 监测来实现。此外,精确定位雄辩的大脑区域的方法定义不明确,目前 MEG 实验室使用的实验设置不适合儿科患者,而 HD-EEG 用于此目的的使用非常有限。这些区域的准确定位可能有助于术前评估,并增强切除或 iEEG 电极放置的手术计划。到目前为止,几项研究调查了 ESI 或 MSI 在 DRE 和局灶性癫痫患者术前评估中对识别 EZ12、13、14、15、16、17、18、19 和体感皮层雄辩区域的贡献41分别。很少有研究表明,与单独使用 MSI 或 ESI 相比,使用 EMSI 的源定位结果和结果预测性能更好 13,31,42。尽管有这些发现,但 MEG 和 EEG 的记录很少同时进行,并且 MSI 和 ESI 仅在全球少数癫痫中心实施。据我们所知,这是第一项为同时收集和分析 MEG 和 HD-EEG 数据以及在儿科癫痫中进行 EMSI 以无创识别刺激区、SOZ 和雄辩的大脑区域(即初级视觉、运动、听觉和体感皮层)提供建议的研究。
在这里,我们对两名 DRE 患者(病例 1 和 2)同时无创数据中检测到的发作间期尖峰和发作事件进行了 EMSI,并实现了距 SOZ 的源定位误差分别为 ~9 mm 和 ~12 mm,与之前的研究一致42。令人印象深刻的是,这种方法实现了与颅内发现相当的定位准确性(即 iEEG 数据上的 ESI),其中聚集的偶极子位于大脑区域,被临床观察确定为致癫痫(图 3C 和 图 4B)。使用来自第三名代表性 DRE 患者(案例 3)的无创数据,我们还对视觉、运动、听觉和体感诱发活动进行了 EMSI,并在相应的雄辩大脑区域(即视觉、运动、听觉和体感皮层)发现了突出的来源激活模式(图 5C、图 6C、图 7C 和图 8C)。
我们的结果来自从 MEG 和 EEG 模态捕获的互补信息的融合,这可能会提高定位准确性。众所周知,脑电图可以反映所有颅内电流,而 MEG 对切向源最敏感,对大脑深部源不敏感29,74。正如本研究所表明的,因此,结合 MEG 和 EEG 可以克服每种模式的局限性,提供卓越的定位结果,并识别 ESI 或 MSI 单独使用时可能遗漏的致癫痫和雄辩的大脑区域。此外,我们提出了一种替代的无创方法,用于在术前评估期间未接受 fMRI 的患者使用 EMSI 绘制雄辩的脑区。
使用无创技术(例如同时进行 MEG 和 EEG)定位致癫痫和雄辩的大脑区域,是 DRE 患儿术前评估中的重要步骤,用于完全去除或断开 EZ,同时保留雄辩的皮质区域。所提出的方法详细描述了同步 MEG 和 EEG 数据的采集和分析,这不仅支持其在术前癫痫评估中的应用,而且在认知神经科学中,用于探索正常发育儿童和健康成人健康大脑的生理功能,以及与癫痫或其他神经系统疾病相关的大脑形态和功能变化。未来调查致癫痫脑网络的研究还可能评估使用 EMSI 在同步 MEG 和 HD-EEG 数据上无创估计的网络枢纽(即高度连接的大脑区域)是否比单独使用 MSI 和/或 ESI 估计的网络中心更准确地定位 DRE 儿童的 EZ 75,76,77.此外,通过 EMSI 估计的尖峰和涟漪(即高频振荡,>80 Hz)的时空传播的无创映射有助于更好地了解传播癫痫样活动的病理生理机制,并无创评估这些传播的起始产生者,这是 EZ78,79 的精确生物标志物.所提出的协议可能有助于通过检查 MEG 和 EEG 传感器阵列对不同方向源的敏感性来进一步研究 MEG 和 EEG 系统的互补性。这种分析可以在同时进行 MEG 和 HD-EEG 时提供对大脑电生理特性的见解。
披露声明
作者报告没有披露。
致谢
这项工作得到了美国国家神经疾病和中风研究所 (R01NS104116;R01NS134944;首席研究员:Christos Papadelis)。
材料
| Name | Company | Catalog Number | Comments |
| AIRSTIM unit | SD Instruments | N/A | The SDI AIRSTIM system is an alternative unconditioned stimulus to shock |
| Baby Shampoo | Johnson's | N/A | Baby Shampoo is as gentle to the eyes as pure water and is specially designed to gently cleanse baby’s delicate hair and scalp. |
| Control III disinfectant cleaning solution | Maril Products, Inc. | http://www.controlthree.com/ | Disinfectant and germicide solution formulated for hospitals |
| Elekta Neuromag | TRIUX | NM24132A | Comprehensive bioelectromagnetic measurement system characterized by 306-channel neuromagnetometer for functional brain studies |
| FASTRAK | Polhemus technology | NS-7806 | Using A/C electromagnetic technology, FASTRAK delivers accurate position and orientation data, with virtually no latency. With a single magnetic source, FASTRAK delivers data for up to four sensors. The source emits an electromagnetic field, sensors within the field of range are tracked in full 6DOF (6 Degrees-Of-Freedom). Setup is simple and intuitive, with no user calibration required. |
| Genuine Grass Reusable Cup EEG Electrodes | Natus Medical, Inc. | N/A | Each Genuine Grass EEG Electrode undergoes rigorous mechanical and electrical testing to assure long life for unsurpassed recording clarity and dependability. |
| Geodesic Sensor Net | Electrical Geodesics, Inc. | S-MAN-200-GSNR-001 | 32 to 256 electrodes to place on the human head to aquire dense-array electroencephalography data |
| GeoScan Sensor Digitization System | Electrical Geodesics, Inc. | 8100550-03 | Handheld Scanner and Software for 3D electrode position registration |
| Natus Xltek NeuroWorks | Natus Medical, Inc. | https://natus.com/ | The Natus NeuroWorks platform simplifies the process of collecting, monitoring and managing data for routine EEG testing, ambulatory EEG, long-term monitoring, ICU monitoring, and research studies. |
| Natus NeuroWorks EEG Software | Natus Medical, Inc. | https://natus.com/neuro/neuroworks-eeg-software/ | NeuroWorks EEG software simplifies the process of collecting, monitoring, trending and managing EEG testing data, allowing care providers to save time and focus on delivering the best care. |
| ROSA ONE Brain | Zimmer Biomet | https://www.zimmerbiomet.com/en/products-and-solutions/zb-edge/robotics/rosa-brain.html | ROSA ONE Brain is a robotic solution to assist surgeons in planning and performing complex neurosurgical procedures through a small drill hole in the skull. |
| Ten20 Conductive Paste | Weaver and company | N/A | Ten20 contains the right balance of adhesiveness and conductivity, enabling the electrodes to remain in place while allowing the transmittance of electrical signals. |
参考文献
- Oldham, M. S., Horn, P. S., Tsevat, J., Standridge, S. Costs and clinical outcomes of epilepsy surgery in children with drug-resistant epilepsy. Pediatr Neurol. 53 (3), 216-220 (2015).
- Willie, J. T., et al. Real-time magnetic resonance-guided stereotactic laser amygdalohippocampotomy for mesial temporal lobe epilepsy. Neurosurgery. 74 (6), 569-584 (2014).
- Rosenow, F., Lüders, H. Presurgical evaluation of epilepsy. Brain. 124, Pt 9 1683-1700 (2001).
- Önal, Ç, et al. Complications of invasive subdural grid monitoring in children with epilepsy). J Neurosurg. 98 (5), 1017-1026 (2003).
- Hader, W. J., et al. Complications of epilepsy surgery-a systematic review of focal surgical resections and invasive EEG monitoring. Epilepsia. 54 (5), 840-847 (2013).
- Meng, Y., et al. Risk factors for surgical site infection after intracranial electroencephalography monitoring for epilepsy in the pediatric population. J Neurosurg Pediatr. 22 (1), 31-36 (2018).
- Jobst, B. C., et al. Intracranial EEG in the 21st Century. Epilepsy Curr. 20 (4), 180-188 (2020).
- Schwartz, E. S., et al. Magnetoencephalography for pediatric epilepsy: how we do it. AJNR Am J Neuroradiol. 29 (5), 832-837 (2008).
- Michel, C. M., et al. Electric source imaging of human brain functions. Brain Res Rev. 36 (2-3), 108-118 (2001).
- Michel, C. M., He, B. EEG source localization. Handb Clin Neurol. 160, 85-101 (2019).
- Michel, C. M., Brunet, D. EEG source imaging: A practical review of the analysis steps. Front Neurol. 10, 325(2019).
- Plummer, C., et al. Interictal and ictal source localization for epilepsy surgery using high-density EEG with MEG: a prospective long-term study. Brain. 142 (4), 932-951 (2019).
- Duez, L., et al. Electromagnetic source imaging in presurgical workup of patients with epilepsy: A prospective study. Neurology. 92 (6), e576-e586 (2019).
- Mouthaan, B. E., et al. Diagnostic accuracy of interictal source imaging in presurgical epilepsy evaluation: A systematic review from the E-PILEPSY consortium. Clin Neurophysiol. 130 (5), 845-855 (2019).
- Pellegrino, G., et al. Clinical yield of magnetoencephalography distributed source imaging in epilepsy: A comparison with equivalent current dipole method. Hum Brain Mapp. 39 (1), 218-231 (2018).
- Tamilia, E., et al. Assessing the localization accuracy and clinical utility of electric and magnetic source imaging in children with epilepsy. Clin Neurophysiol. 130 (4), 491-504 (2019).
- Coito, A., et al. Interictal epileptogenic zone localization in patients with focal epilepsy using electric source imaging and directed functional connectivity from low-density EEG. Epilepsia Open. 4 (2), 281-292 (2019).
- Singh, J., Ebersole, J. S., Brinkmann, B. H. From theory to practical fundamentals of electroencephalographic source imaging in localizing the epileptogenic zone. Epilepsia. 63 (10), 2476-2490 (2022).
- Brodbeck, V., et al. Electrical source imaging for presurgical focus localization in epilepsy patients with normal MRI. Epilepsia. 51 (4), 583-591 (2010).
- Santalucia, R., et al. Clinical added value of interictal automated electrical source imaging in the presurgical evaluation of MRI-negative epilepsy: A real-life experience in 29 consecutive patients. Epilepsy Behav. 143, 109229(2023).
- Schneider, F., et al. Magnetic source imaging in non-lesional neocortical epilepsy: additional value and comparison with ICEEG. Epilepsy Behav. 24 (2), 234-240 (2012).
- Hämäläinen, M., Hari, R., Ilmoniemi, R. J., Knuutila, J., Lounasmaa, O. V. Magnetoencephalography-theory, instrumentation, and applications to noninvasive studies of the working human brain. Rev Mod Phys. 65, 413-497 (1993).
- Baillet, S., Mosher, J. C., Leahy, R. M. Electromagnetic brain mapping. IEEE Signal Process Mag. 18 (6), 14-30 (2001).
- Fuchs, M., Kastner, J., Tech, R., Wagner, M., Gasca, F. MEG and EEG dipole clusters from extended cortical sources. Biomed Eng Lett. 7 (3), 185-191 (2017).
- Singh, S. P. Magnetoencephalography: Basic principles. Ann Indian Acad Neurol. 17, Suppl 1 S107-S112 (2014).
- Ahlfors, S. P., Han, J., Belliveau, J. W., Hämäläinen, M. S. Sensitivity of MEG and EEG to source orientation. Brain Topogr. 23, 227-232 (2010).
- Kim, H., Chung, C. K., Hwang, H. Magnetoencephalography in pediatric epilepsy. Korean J Pediatr. 56 (10), 431-438 (2013).
- Gorjan, D., Gramann, K., De Pauw, K., Marusic, U. Removal of movement-induced EEG artifacts: Current state of the art and guidelines. J Neural Eng. , (2022).
- Barkley, G. L., Baumgartner, C. MEG and EEG in epilepsy. J Clin Neurophysiol. 20 (3), 163-178 (2003).
- Ebersole, J. S., Ebersole, S. M. Combining MEG and EEG source modeling in epilepsy evaluations. J Clin Neurophysiol. 27 (6), 360-371 (2010).
- Yoshinaga, H., et al. Benefit of simultaneous recording of EEG and MEG in dipole localization. Epilepsia. 43 (8), 924-928 (2002).
- Baumgartner, C. Controversies in clinical neurophysiology. MEG is superior to EEG in the localization of interictal epileptiform activity: Con. Clin Neurophysiol. 115 (5), 1010-1020 (2004).
- Barkley, G. L. Controversies in neurophysiology. MEG is superior to EEG in localization of interictal epileptiform activity: Pro. Clin Neurophysiol. 115 (5), 1001-1009 (2004).
- Braeutigam, S. Magnetoencephalography: Fundamentals and established and emerging clinical applications in radiology. ISRN Radiol. 2013, 529463(2013).
- Papadelis, C., et al. Current and emerging potential for magnetoencephalography in pediatric epilepsy. J Pediatr Epilepsy. 2 (1), 73-85 (2013).
- Fiedler, P., Fonseca, C., Supriyanto, E., Zanow, F., Haueisen, J. A high-density 256-channel cap for dry electroencephalography. Hum Brain Mapp. 43 (4), 1295(2022).
- Sharon, D., Hämäläinen, M. S., Tootell, R. B. H., Halgren, E., Belliveau, J. W. The advantage of combining MEG and EEG: comparison to fMRI in focally-stimulated visual cortex. Neuroimage. 36 (4), 1225(2007).
- Pataraia, E., Lindinger, G., Deecke, L., Mayer, D., Baumgartner, C. Combined MEG/EEG analysis of the interictal spike complex in mesial temporal lobe epilepsy. Neuroimage. 24 (3), 607-614 (2005).
- Ahmed Mahmutoglu, M., Rupp, A., Baumgärtner, U. Simultaneous EEG/MEG yields complementary information of nociceptive evoked responses. Clin Neurophysiol. 143, 21-35 (2022).
- Aydin, Ü, et al. Combined EEG/MEG can outperform single modality EEG or MEG source reconstruction in presurgical epilepsy diagnosis. PLoS One. 10 (3), e0118753(2015).
- Bast, T., et al. Combined EEG and MEG analysis of early somatosensory evoked activity in children and adolescents with focal epilepsies. Clin Neurophysiol. 118 (8), 1721-1735 (2007).
- Chikara, R. K., et al. Electromagnetic source imaging predicts surgical outcome in children with focal cortical dysplasia. Clin Neurophysiol. 153, 88-101 (2023).
- Hari, R., et al. IFCN-endorsed practical guidelines for clinical magnetoencephalography (MEG). Clin Neurophysiol. 129 (8), 1720-1747 (2018).
- Bagić, A. I., Knowlton, R. C., Rose, D. F., Ebersole, J. S. American Clinical Magnetoencephalography Society Clinical Practice Guideline 1: Recording and analysis of spontaneous cerebral activity. J Clin Neurophysiol. 28 (4), 348-354 (2011).
- Papadelis, C., Chen, Y. H. Pediatric magnetoencephalography in clinical practice and research. Neuroimaging Clin N Am. 30 (2), 239-248 (2020).
- De Macedo Rodrigues, K., et al. A FreeSurfer-compliant consistent manual segmentation of infant brains spanning the 0-2 year age range. Front Hum Neurosci. 9, 21(2015).
- Tadel, F., Baillet, S., Mosher, J. C., Pantazis, D., Leahy, R. M. Brainstorm: A user-friendly application for MEG/EEG analysis. Comput Intell Neurosci. 2011, 879716(2011).
- Kane, N., et al. A revised glossary of terms most commonly used by clinical electroencephalographers and updated proposal for the report format of the EEG findings. Revision 2017. Clin Neurophysiol Pract. 2, 170-185 (2017).
- Lantz, G., et al. Propagation of interictal epileptiform activity can lead to erroneous source localizations: a 128-channel EEG mapping study. J Clin Neurophysiol. 20 (5), 311-319 (2003).
- Vorwerk, J., et al. A guideline for head volume conductor modeling in EEG and MEG. Neuroimage. 100, 590-607 (2014).
- Schrader, S., et al. DUNEuro-A software toolbox for forward modeling in bioelectromagnetism. PLoS One. 16 (6), e0252431(2021).
- Ntolkeras, G., et al. Presurgical accuracy of dipole clustering in MRI-negative pediatric patients with epilepsy: Validation against intracranial EEG and resection. Clin Neurophysiol. 141, 126-138 (2022).
- David, O., Kilner, J. M., Friston, K. J. Mechanisms of evoked and induced responses in MEG/EEG. Neuroimage. 31, 1580-1591 (2006).
- Pantev, C. Evoked and induced gamma-band activity of the human cortex. Brain Topogr. 7 (4), 321-330 (1995).
- Fox, N. A., et al. Assessing human mirror activity with EEG mu rhythm: A meta-analysis. Psychol Bull. 142 (3), 291-313 (2016).
- Genzer, S., Ong, D. C., Zaki, J., Perry, A. Mu rhythm suppression over sensorimotor regions is associated with greater empathic accuracy. Soc Cogn Affect Neurosci. 17 (9), 788-801 (2022).
- Janmohamed, M., et al. Moving the field forward: detection of epileptiform abnormalities on scalp electroencephalography using deep learning-clinical application perspectives. Brain Commun. 4 (5), 218(2022).
- Bagheri, E., Jin, J., Dauwels, J., Cash, S., Westover, M. B. A fast machine learning approach to facilitate the detection of interictal epileptiform discharges in the scalp electroencephalogram. J Neurosci Methods. 326, 108362(2019).
- Thomas, J., et al. Automated detection of interictal epileptiform discharges from scalp electroencephalograms by convolutional neural networks. Int J Neural Syst. 30 (11), 2050030(2020).
- Zijlmans, M., Zweiphenning, W., van Klink, N. Changing concepts in presurgical assessment for epilepsy surgery. Nat Rev Neurol. 15 (10), 594-606 (2019).
- Akiyama, T., et al. Focal resection of fast ripples on extraoperative intracranial EEG improves seizure outcome in pediatric epilepsy. Epilepsia. 52 (10), 1802-1811 (2011).
- Duncan, J. S., Winston, G. P., Koepp, M. J., Ourselin, S. Brain imaging in the assessment for epilepsy surgery. Lancet Neurol. 15 (4), 420(2016).
- Jacobs, J., et al. High-frequency electroencephalographic oscillations correlate with outcome of epilepsy surgery. Ann Neurol. 67 (2), 209-220 (2010).
- Ricci, L., et al. Virtual implantation using conventional scalp EEG delineates seizure onset and predicts surgical outcome in children with epilepsy. Clin Neurophysiol. 139, 49-57 (2022).
- Stefan, H., Rampp, S. Interictal and Ictal MEG in presurgical evaluation for epilepsy surgery. Acta Epileptologica. 2, 11(2020).
- Jahangiri, F. R., Chima, G. S., Pearson, M., Jackson, J., Siddiqui, A. A. Mapping of the language cortex. Cureus. 13 (5), e14960(2021).
- Merrifield, W. S., Simos, P. G., Papanicolaou, A. C., Philpott, L. M., Sutherling, W. W. Hemispheric language dominance in magnetoencephalography: sensitivity, specificity, and data reduction techniques. Epilepsy Behav. 10 (1), 120-128 (2007).
- Wheless, J. W., et al. Magnetoencephalography (MEG) and magnetic source imaging (MSI). Neurologist. 10 (3), 138-153 (2004).
- Breier, J. I., Simos, P. G., Zouridakis, G., Papanicolaou, A. C. Lateralization of activity associated with language function using magnetoencephalography: a reliability study. J Clin Neurophysiol. 17 (5), 503-510 (2000).
- Pataraia, E., Baumgartner, C., Lindinger, G., Deecke, L. Magnetoencephalography in presurgical epilepsy evaluation. Neurosurg Rev. 25 (3), 141-159 (2002).
- Babajani-Feremi, A., et al. Language mapping using high gamma electrocorticography, fMRI, and TMS versus electrocortical stimulation. Clin Neurophysiol. 127 (3), 1822-1836 (2016).
- Brodbeck, V., et al. Electroencephalographic source imaging: a prospective study of 152 operated epileptic patients. Brain. 134, Pt 10 2887-2897 (2011).
- Sohrabpour, A., et al. Effect of EEG electrode number on epileptic source localization in pediatric patients. Clin Neurophysiol. 126 (3), 472-480 (2015).
- Laohathai, C., et al. Practical fundamentals of clinical MEG interpretation in epilepsy. Front Neurol. 12, 722986(2021).
- Corona, L., et al. Mapping functional connectivity of epileptogenic networks through virtual implantation. Proceedings of the Annu Int Conf IEEE Eng Med Biol Soc. 2021, 408-411 (2021).
- Corona, L., et al. Non-invasive mapping of epileptogenic networks predicts surgical outcome. Brain. 146 (5), 1916-1931 (2023).
- Rijal, S., et al. Functional connectivity discriminates epileptogenic states and predicts surgical outcome in children with drug resistant epilepsy. Sci Rep. 13 (1), 9622(2023).
- Tamilia, E., et al. Noninvasive mapping of ripple onset predicts outcome in epilepsy surgery. Ann Neurol. 89 (5), 911-925 (2021).
- Matarrese, M. A. G., et al. Spike propagation mapping reveals effective connectivity and predicts surgical outcome in epilepsy. Brain. 146 (9), 3898-3912 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。