Method Article
Bildgebung mit elektromagnetischen Quellen bei der präoperativen Beurteilung von Kindern mit arzneimittelresistenter Epilepsie
In diesem Artikel
Zusammenfassung
Die Magnetenzephalographie (MEG) und die High-Density-Elektroenzephalographie (HD-EEG) werden selten gleichzeitig aufgezeichnet, obwohl sie bestätigende und komplementäre Informationen liefern. In diesem Artikel veranschaulichen wir den experimentellen Aufbau zur gleichzeitigen Aufzeichnung von MEG und HD-EEG und die Methodik zur Analyse dieser Daten mit dem Ziel, epileptogene und eloquente Hirnareale bei Kindern mit medikamentenresistenter Epilepsie zu lokalisieren.
Zusammenfassung
Bei Kindern mit medikamentenresistenter Epilepsie (DRE) beruht die Anfallsfreiheit auf der Abgrenzung und Resektion (oder Ablation/Trennung) der epileptogenen Zone (EZ) unter Beibehaltung der eloquenten Hirnareale. Die Entwicklung einer zuverlässigen und nicht-invasiven Lokalisationsmethode, die klinisch nützliche Informationen für die Lokalisation der EZ liefert, ist daher entscheidend für das Erreichen erfolgreicher chirurgischer Ergebnisse. Elektrische und magnetische Bildgebung (ESI und MSI) werden zunehmend bei der präoperativen Beurteilung dieser Patienten eingesetzt, was vielversprechende Ergebnisse bei der Abgrenzung sowohl epileptogener als auch eloquenter Hirnareale zeigt. Darüber hinaus hat die Kombination von ESI und MSI in einer einzigen Lösung, nämlich der elektromagnetischen Bildgebung (EMSI), die bei gleichzeitigen Aufzeichnungen der Elektroenzephalographie (HD-EEG) und der Magnetenzephalographie (MEG) durchgeführt wurde, eine höhere Genauigkeit bei der Lokalisierung der Quelle gezeigt als jede der beiden Modalitäten allein. Trotz dieser ermutigenden Ergebnisse werden solche Techniken nur in wenigen tertiären Epilepsiezentren durchgeführt, selten gleichzeitig aufgezeichnet und in pädiatrischen Kohorten zu wenig genutzt. Diese Studie veranschaulicht den Versuchsaufbau für die gleichzeitige Aufzeichnung von MEG- und HD-EEG-Daten sowie den methodischen Rahmen für die Analyse dieser Daten mit dem Ziel, die irritative Zone, die Anfallszone und eloquente Hirnareale bei Kindern mit DRE zu lokalisieren. Genauer gesagt werden die Versuchsanordnungen vorgestellt für (i) die Aufzeichnung und Lokalisierung interiktaler und iktaler epileptiformer Aktivität während des Schlafs und (ii) die Aufzeichnung visueller, motorischer, auditiver und somatosensorisch evozierter Reaktionen und die Kartierung relevanter eloquenter Hirnareale (d.h. visueller, motorischer, auditiver und somatosensorischer Bereiche) während visuomotorischer Aufgaben sowie auditiver und somatosensorischer Stimulationen. Des Weiteren werden detaillierte Schritte der Datenanalyse-Pipeline für die Durchführung von EMSI sowie individuellen ESI und MSI unter Verwendung von Equivalent Current Dipol (ECD) und Dynamic Statistical Parametric Mapping (dSPM) vorgestellt.
Einleitung
Epilepsie ist eine der häufigsten und behinderndsten neurologischen Erkrankungen, die durch wiederkehrende und unprovozierte Anfälle gekennzeichnet ist, die entweder fokaler oder generalisierter Natur sein können. Trotz der Verfügbarkeit mehrerer wirksamer pharmakologischer Therapien (z. B. Antiepileptika [ASMs]) sind etwa 20-30 % dieser Patienten nicht in der Lage, ihre Anfälle zu kontrollieren und leiden an medikamentenresistenter Epilepsie (DRE)1. Für diese Patienten ist die Epilepsiechirurgie die wirksamste Behandlung zur Beseitigung von Anfällen. Eine erfolgreiche Operation kann durch die vollständige Resektion (oder Ablation/Trennung) der epileptogenen Zone (EZ) erreicht werden, die als der minimale Bereich definiert ist, der für die Entstehung von Anfällen unerlässlich ist2. Eine genaue Abgrenzung und Resektion (oder Ablation/Disconnection) des EZ unter Beibehaltung des eloquenten Kortex sind entscheidende Faktoren für die Gewährleistung der Anfallsfreiheit. Um die Operationskandidatur zu etablieren, werden von einem multidisziplinären Team mehrere nicht-invasive Diagnoseinstrumente verwendet, um verschiedene kortikale Bereiche (d. h. Reizzone, Anfallszone [SOZ], funktionelle Defizitzone und epileptogene Läsion) zu definieren, die als indirekte Approximatoren der EZ3 dienen. Ein extraoperatives Monitoring mit intrakraniellem EEG (iEEG) ist erforderlich, wenn keine dieser Methoden die EZ eindeutig identifiziert. Die Rolle des iEEG besteht darin, die EZ genau zu definieren, indem die SOZ (d. h. der Gehirnbereich, in dem klinische Anfälle ausgelöst werden) lokalisiert und eloquente Gehirnbereiche kartiert werden. Aufgrund ihrer Invasivität 4,5,6 weist sie jedoch erhebliche Einschränkungen auf, bietet eine begrenzte räumliche Abdeckung und erfordert eine klare präoperative Lokalisationshypothese7. Dies kann dazu führen, dass der eigentliche Fokus und das Ausmaß der SOZ übersehen werden, was zu einer erfolglosen Operation führt. Außerdem erfordert seine Interpretation die Aufzeichnung mehrerer stereotyper klinischer Anfälle während mehrerer Tage des Krankenhausaufenthalts, was die Wahrscheinlichkeit von Komplikationen (z. B. Infektionen und/oder Blutungen) erhöht5. Daher besteht ein ungedeckter Bedarf, zuverlässige und nicht-invasive Lokalisierungsmethoden zu entwickeln, die klinisch nützliche Informationen liefern und die präoperative Beurteilung von Kindern mit DRE insgesamt verbessern können.
In den letzten Jahrzehnten wurden elektrische und magnetische Bildgebungsquellen (ESI und MSI) zunehmend in der präoperativen Beurteilung von Patienten mit DRE zur Abgrenzung epileptogener sowie funktioneller Hirnareale eingesetzt. ESI und MSI ermöglichen insbesondere die Rekonstruktion neuronaler Quellen aus nicht-invasiven Aufzeichnungen, wie z. B. High-Density-EEG (HD-EEG) und Magnetoenzephalographie (MEG), um die Operationsplanung oder die Platzierung von iEEG-Elektroden zu unterstützen. ESI und MSI können zur Lokalisation von interiktalen epileptiformen Entladungen (IEDs), wie Spikes und scharfen Wellen, oder zur Lokalisation von iktaler (Anfalls-)Aktivität eingesetzt werden. Es kann weiterhin zur Lokalisierung verschiedener funktioneller Gehirnbereiche verwendet werden, die an sensorischen, motorischen, auditiven und kognitiven Funktionen beteiligt sind. Die Rekonstruktion elektrophysiologischer Ereignisse wie IEDs und Krampfanfälle ermöglicht die Identifizierung der irritativen Zone (d.h. des Gehirnbereichs, aus dem IEDs stammen) bzw. der SOZ, die als gültiges Surrogat für die EZ-Lokalisation angesehen werden. Die Lokalisation des eloquenten Kortex (d.h. der Hirnareale, die für definierte kortikale Funktionen unerlässlich sind)3 ermöglicht es stattdessen, die Lage und das Ausmaß der eloquenten Areale in Bezug auf die geplante Resektion zu kartieren und somit mögliche funktionelle Defizite, die bei der Epilepsiechirurgie zu erwarten sind, im Voraus zu reduzieren 8,9,10,11 . Mehrere Studien untersuchten den klinischen Nutzen von ESI und/oder MSI bei der präoperativen Beurteilung von Epilepsie und zeigten vielversprechende Ergebnisse bei der Abgrenzung der EZ 12,13,14,15,16,17,18,19. Zum Beispiel führten Mouthaan et al.14 eine umfangreiche Metaanalyse mit nicht-invasiven Daten von 11 prospektiven und retrospektiven Epilepsiestudien durch und berichteten, dass diese Lokalisierungstechniken die EZ insgesamt mit hoher Sensitivität (82%) und geringer Spezifität (53%) identifizieren können. Andere Studien zeigten auch, dass MSI und ESI den epileptischen Fokus innerhalb des resezierten Bereichs bei Epilepsiepatienten mit einer normalen Magnetresonanztomographie (MRT) korrekt lokalisieren können19,20,21. Diese Lokalisationsergebnisse sind besonders wichtig für diejenigen Patienten, die aufgrund nicht eindeutiger klinischer oder bildgebender Befunde nicht für eine Epilepsieoperation in Frage kommen. Zusammenfassend lässt sich sagen, dass ESI und MSI wesentlich zur präoperativen Kartierung epileptogener sowie funktioneller Hirnareale bei Patienten mit DRE beitragen können.
Trotz dieser ermutigenden Ergebnisse werden solche Techniken derzeit nur in wenigen tertiären Epilepsiezentren regelmäßig durchgeführt und in der pädiatrischen Bevölkerung oft zu wenig genutzt. Darüber hinaus werden HD-EEG und MEG selten gleichzeitig aufgezeichnet, obwohl sie sowohl bestätigende als auch komplementäre Informationen liefern. MEG ist empfindlich für die Detektion oberflächlicher Quellen mit tangentialer Ausrichtung, ist aber blind für radial ausgerichtete Quellen, die sich an der Gyri oder tieferen Bereichen des Gehirns befinden 22,23,24,25,26. Darüber hinaus bietet MEG eine bessere räumliche Auflösung (Millimeter) im Vergleich zu EEG 16,22,25. Im Gegensatz zu EEG-Signalen sind MEG-Signale referenzfrei und werden im Wesentlichen nicht von unterschiedlichen Leitfähigkeiten des Hirngewebes (d. h. Hirnhäute, Liquor, Schädel und Kopfhaut) beeinflusst25,27 und liefern unverzerrte Messungen der vom Gehirn erzeugten Magnetfelder. Auf der anderen Seite kann das EEG Quellen aller Orientierungen erkennen, bietet jedoch eine geringere räumliche Auflösung als MEG und ist anfälliger für Artefakte26,28. Aufgrund dieser komplementären Sensitivitäten in Bezug auf Quellenorientierung und -tiefe können etwa 30% der epileptiformen Aktivität (z. B. IEDs) nur im MEG, nicht aber im EEG aufgezeichnet werden und umgekehrt 26,29,30,31,32. Im Gegensatz zum EEG, das längere Aufzeichnungen ermöglicht, ist die Erfassung klinischer Anfälle mit MEG aufgrund der begrenzten Aufzeichnungszeit, die bei den meisten Patienten in der Regel nicht ausreicht, um iktale Ereignisse aufzuzeichnen, eine Herausforderung. Darüber hinaus können Artefakte, die durch anfallsbedingte Kopfbewegungen verursacht werden, häufig die Qualität von MEG-Aufzeichnungen beeinträchtigen 29,33,34,35. Auf der anderen Seite sind MEG-Aufzeichnungen im Vergleich zum EEG schneller und einfacher, insbesondere bei Kindern, da keine Sensoren über dem Kopf des Kindes angebracht werden müssen35.
Fortschritte in der Hardware haben es möglich gemacht, gleichzeitig MEG- und HD-EEG-Daten mit einer großen Anzahl von Sensoren (über 550 Sensoren) aufzuzeichnen, die den gesamten Kopf abdecken. Darüber hinaus haben moderne Entwicklungen in der EEG-Technologie die Vorbereitungszeit für das HD-EEG auf weniger als eine Viertelstunde minimiert36. Dies ist besonders wichtig für pädiatrische Populationen mit herausfordernden Verhaltensweisen, die nicht in der Lage sind, über längere Zeiträume still zu bleiben. Darüber hinaus haben Fortschritte in der Softwaretechnologie die Kombination von ESI und MSI in einer einzigen Lösung ermöglicht, nämlich der elektromagnetischen Bildgebung (EMSI), die bei gleichzeitigen HD-EEG- und MEG-Aufzeichnungen durchgeführt wird. Mehrere theoretische und empirische Studien berichteten über eine höhere Genauigkeit der Quellenlokalisierung mit EMSI als mit beiden Modalitäten allein 13,30,31,37,38,39,40,41. Unter Verwendung verschiedener Ansätze zur Lokalisierung von Quellen, um die Aktivität als Reaktion auf sensorische Reize zu rekonstruieren, haben Sharon et al.37 fanden heraus, dass EMSI durchweg bessere Lokalisationsergebnisse aufwies als ESI oder MSI allein im Vergleich zur funktionellen MRT (fMRT), die als nicht-invasiver Maßstab für die präzise Lokalisierungsgenauigkeit dient. Die Autoren schlugen vor, dass diese verbesserte Lokalisation auf die erhöhte Anzahl von Sensoren zur Lösung der inversen Lösung und die unterschiedlichen Empfindlichkeitsmuster der beiden Bildgebungsmodalitäten zurückzuführen ist37. In ähnlicher Weise haben Yoshinaga et al.31 führten Dipolanalysen an gleichzeitigen EEG- und MEG-Daten von Patienten mit hartnäckiger lokalisationsbedingter Epilepsie durch und zeigten, dass EMSI Informationen lieferte, die mit nur einer Modalität allein nicht möglich gewesen wären, und bei einem der analysierten Patienten zu einer erfolgreichen Lokalisation für eine Epilepsiechirurgie führte. In einer prospektiven verblindeten Studie haben Duez et al.13 zeigte, dass EMSI im Vergleich zu ESI und MSI eine signifikant höhere Odds Ratio (d.h. die Wahrscheinlichkeit, anfallsfrei zu werden) erreichte, eine Lokalisationsgenauigkeit ≥52% und eine Konkordanz ≥53% bzw. ≥36% mit dem Irritativ bzw. der SOZ. Eine neuere Studie aus unserer Gruppe42 hat gezeigt, dass EMSI überlegene Lokalisationsschätzungen und eine bessere Vorhersageleistung der Ergebnisse lieferte als ESI oder MSI allein, mit Lokalisationsfehlern aus Resektion und SOZ von ~8 mm bzw. ~15 mm. Trotz dieser vielversprechenden Ergebnisse fehlt es an Studien, die den methodischen Rahmen für EMSI bei Kindern mit DRE liefern.
Diese Studie veranschaulicht den experimentellen Aufbau für die gleichzeitige Durchführung von MEG- und HD-EEG-Aufzeichnungen sowie den methodischen Rahmen für die Analyse dieser Daten mit dem Ziel, die irritative Zone, SOZ und eloquente Hirnareale bei Kindern mit DRE zu lokalisieren. Genauer gesagt werden die Versuchsanordnungen vorgestellt für (i) die Aufzeichnung und Lokalisierung interiktaler und iktaler epileptiformer Aktivität während des Schlafs und (ii) die Aufzeichnung visueller, motorischer, auditiver und somatosensorisch evozierter Reaktionen und die Kartierung relevanter eloquenter Hirnareale (d.h. visueller, motorischer, auditiver und somatosensorischer Areale) während einer visuomotorischen Aufgabe sowie auditiver und somatosensorischer Stimulationen. Des Weiteren werden detaillierte Schritte der Datenanalyse-Pipeline für die Durchführung von EMSI sowie individuellen ESI und MSI unter Verwendung von Equivalent Current Dipol (ECD) und Dynamic Statistical Parametric Mapping (dSPM) vorgestellt.
Protokoll
Die hier angewandten experimentellen Verfahren wurden vom North Texas Regional Institutional Review Board (2019-166; Projektleiter: Christos Papadelis). Im folgenden Abschnitt wird das experimentelle Protokoll für die nichtinvasive Lokalisierung von IEDs, iktale Onsets und ereignisevozierte Reaktionen (d.h. visuelle, motorische, auditive und somatosensorische) unter Verwendung gleichzeitiger MEG- und HD-EEG-Aufzeichnungen beschrieben, die in unserem Labor durchgeführt werden. Die International Federation of Clinical Neurophysiology43 und die American Clinical MEG Society44 haben "Mindeststandards" für die routinemäßige klinische Aufzeichnung und Analyse von spontanen MEG- und EEG-Daten festgelegt. Die hier beschriebenen Verfahren für HD-EEG-Aufzeichnungen gelten nur für schwammbasierte EEG-Elektrodensysteme. Der gesamte Vorbereitungsprozess für jedes Fach beträgt ca. 2-3 Stunden, wobei die eigentlichen Aufnahmen ~1,5 Stunden betragen.
1. Vorbereitung des MEG-Systems
- Führen Sie vor der Ankunft des Probanden eine einige Minuten dauernde MEG-Aufzeichnung in einem leeren Raum durch, um den Hintergrundgeräuschpegel und die magnetischen Artefakte zu erfassen und zu überprüfen, ob alle MEG-Sensoren ordnungsgemäß funktionieren.
- Stellen Sie mit dem Abstimmungsprogramm für MEG-Sensoren sicher, dass der durchschnittliche Wert des weißen Rauschens aller MEG-Sensoren zwischen 2 und 5 fT/√Hz (fT/cm√Hz für Gradiometer) liegt.
2. Vorbereitung des Probanden
- Stellen Sie sicher, dass sich das Motiv in der Umgebung wohlfühlt. Lassen Sie kleine Kinder den Aufnahmeraum (einschließlich des magnetisch abgeschirmten Raums [MSR]) erkunden und die Testgeräte sehen, die für die Datenerfassung verwendet werden.
- Screening und Bereitstellung von Anweisungen für die Prüfungsteilnehmer mithilfe der Einverständniserklärung für das Screening. Erklären Sie kleinen Kindern bei Bedarf das Verfahren mit speziellen Wörtern, Spielzeug und Spielen, die für jede Altersgruppe entwickelt wurden. Fragen Sie den Probanden (oder die Eltern des Probanden), ob er/sie innerhalb der letzten ~2 Stunden vor dem Besuch einen Anfall hatte.
HINWEIS: Die Einverständniserklärung für das Screening enthält eine Beschreibung des Tests sowie seine Sicherheit, warum der Test durchgeführt wird, und eine allgemeine Beschreibung der Studie.
- Screening und Bereitstellung von Anweisungen für die Prüfungsteilnehmer mithilfe der Einverständniserklärung für das Screening. Erklären Sie kleinen Kindern bei Bedarf das Verfahren mit speziellen Wörtern, Spielzeug und Spielen, die für jede Altersgruppe entwickelt wurden. Fragen Sie den Probanden (oder die Eltern des Probanden), ob er/sie innerhalb der letzten ~2 Stunden vor dem Besuch einen Anfall hatte.
- Entfernen Sie alle metallischen und/oder magnetischen Materialien von der Person und stellen Sie der Person geeignete Krankenhauskleidung zur Verfügung (z. B. Krankenhauskittel, Kittel). Bitten Sie die Person außerdem, ihre Schuhe auszuziehen, um zu verhindern, dass magnetischer Staub in den MSR eindringt. Wenn andere ferromagnetische Elemente, wie z. B. zahnärztliche Arbeiten oder implantierte medizinische Geräte, nicht entfernt werden können, verwenden Sie einen Degausser (d. h. einen Entmagnetisierer), um verbleibende magnetische Artefakte zu entfernen, die bei MEG-Aufnahmen entweder Interferenzen oder einen hohen Rauschpegel verursachen können. Nachdem Sie sich vergewissert haben, dass alle Quellen des magnetischen Rauschens entfernt wurden, bitten Sie den Probanden, sich auf einen Holzstuhl zu setzen und es sich bequem zu machen, wo die nächsten Messverfahren angewendet werden.
HINWEIS: Der Degausser darf nicht direkt auf implantierte elektronische Geräte (z. B. Herzschrittmacher, Neuromodulationsgeräte) aufgetragen werden. - Messen Sie den Kopfumfang des Probanden, um die passende EEG-Netzgröße auszuwählen (in der Regel 32-34 cm bis 58-61 cm). Messen Sie mit der Zentimeterseite des Maßbandes den Kopfumfang, indem Sie das Band von der Nase des Probanden bis zu ~1 cm über dem Inion und dann zurück zum Nasenband halten.
HINWEIS: Das Nasion ist der kraniometrische Punkt zwischen den Augen, während das Inion die Spitze des äußeren Hinterhauptsvorsprungs ist.- Wählen Sie die richtige Netzgröße, die zum Kopfumfang der Person passt, und weichen Sie sie mindestens 5 Minuten lang (maximal 10 Minuten) in einer flüssigen gemischten Lösung ein, die aus 1 kg warmem Leitungswasser, 1 Esslöffel Elektrolyten (z. B. Kaliumchlorid) und 1 Esslöffel Babyshampoo besteht. Stellen Sie während dieses Einweichvorgangs sicher, dass das Netz mit den Schwämmen nach außen auf links gedreht und die Verschlüsse vollständig gelöst sind, um die Sensoren vollständig in den Plastikeimer mit der Lösung einzutauchen.
HINWEIS: Um sicherzustellen, dass der Verstärker des Netzes nicht in die Nähe der Lösung kommt und immer trocken bleibt, wickeln Sie ein Handtuch um den Stecker des ausgewählten Netzes und legen Sie es gegebenenfalls auf einen Stuhl oder eine Stütze in der Nähe des Waschbeckens, wo sich der Plastikeimer befindet.
- Wählen Sie die richtige Netzgröße, die zum Kopfumfang der Person passt, und weichen Sie sie mindestens 5 Minuten lang (maximal 10 Minuten) in einer flüssigen gemischten Lösung ein, die aus 1 kg warmem Leitungswasser, 1 Esslöffel Elektrolyten (z. B. Kaliumchlorid) und 1 Esslöffel Babyshampoo besteht. Stellen Sie während dieses Einweichvorgangs sicher, dass das Netz mit den Schwämmen nach außen auf links gedreht und die Verschlüsse vollständig gelöst sind, um die Sensoren vollständig in den Plastikeimer mit der Lösung einzutauchen.
- Platzieren Sie fünf Magnetspulen, die als HPI-Spulen (Head Position Indicator) dienen, an bekannten Stellen direkt auf der Kopfhaut des Probanden mit Mikroporen-Papierband: eine auf jeder Seite der Stirn in der Nähe des Haaransatzes, eine auf jedem Mastoidknochen und eine auf der Oberseite des Kopfes.
HINWEIS: Die HPI Spulen definieren die Position des Kopfes relativ zu den supraleitenden Quanteninterferenzgeräten (SQUIDs), die im MEG System platziert sind, indem sie bekannte Magnetfelder aussenden, die während des Scans lokalisiert werden können. Die Anzahl der HPI Coils hängt vom MEG System ab, liegt aber in der Regel zwischen 3-5 HPI Coils. - Platzieren Sie zusätzliche Elektroden mit Klebeband, um die Herzfrequenz (Elektrokardiographie, EKG), Augenbewegungen oder Blinzeln (Elektrookulographie, EOG) und die Muskelaktivität (Elektromyographie, EMG) zu messen. Die Platzierung dieser Elektroden ermöglicht auch die Überwachung des Gesundheitszustands des Probanden.
- Platzieren Sie zwei EKG-Elektroden auf der rechten bzw. linken Seite der Brust unterhalb des Schlüsselbeins, um den Herzschlag des Probanden aufzuzeichnen, und zwei EOG-Elektroden auf der oberen bzw. unteren Seite des rechten Auges, um seine vertikalen Augenbewegungen oder sein Blinzeln aufzuzeichnen.
- Um die Muskelaktivität während der visuomotorischen Aufgabe zu messen, wischen Sie zusätzlich die Finger des Probanden mit Alkoholpads ab, um eine bessere Haftung des Tapes auf der Haut zu gewährleisten, und kleben Sie insgesamt zwei Paar nicht Einweg-Becherelektroden auf jede Hand: eines auf den ersten dorsalen interossären (FDI) und eines auf den Abductor pollicis brevis (APB).
- Bevor Sie all diese Elektroden mit Klebeband verkleben, geben Sie die leitfähige Paste in den Elektrodenbecher, bis er leicht überfüllt ist, um die Hautimpedanz zu verringern und eine optimale Mischung aus Haftfähigkeit und Leitfähigkeit zu gewährleisten.
- Befestigen Sie für die taktile Stimulation dünne elastische Membranen direkt an den distalen, volaren Teilen von drei Fingern (d. h. Daumen [D1], Mittelfinger [D3] und kleiner Finger [D5]) beider Hände. Blasen Sie die Membranen mit Druckluftimpulsen durch starre Kunststoffschläuche mit einem Luftstoßstimulationsgerät auf. Die Druckluftimpulse werden mit einem Inter-Stimulus-Intervall von 1,5 ± 0,5 s nach einer pseudozufälligen Reihenfolge freigesetzt. Stellen Sie den Druck des taktilen Stimulators auf 50 psi ein.
- Platzieren Sie zwei EKG-Elektroden auf der rechten bzw. linken Seite der Brust unterhalb des Schlüsselbeins, um den Herzschlag des Probanden aufzuzeichnen, und zwei EOG-Elektroden auf der oberen bzw. unteren Seite des rechten Auges, um seine vertikalen Augenbewegungen oder sein Blinzeln aufzuzeichnen.
- Während das Subjekt immer noch auf dem Holzstuhl sitzt, weit entfernt von metallischen Gegenständen, bestimmen Sie mit einem Digitalisierer die dreidimensionalen (3D) Positionen der passermarkentreuen anatomischen Orientierungspunkte, der fünf HPI-Spulen und anderer Kopfformpunkte. Bitten Sie das Subjekt während dieses Prozesses der Kopfdigitalisierung, bequem zu sitzen, geradeaus zu schauen und praktisch bewegungslos zu bleiben, da kleine Bewegungen die Lokalisierungsgenauigkeit beeinträchtigen können.
- Platzieren Sie den Referenzempfänger durch die Kunststoffbrille (d. h. eine Brille, an der der Referenzwürfel auf einer Seite befestigt ist) auf dem Kopf des Probanden und stellen Sie die Verschlüsse so ein, dass ein fester Referenzrahmen zum Motiv gewährleistet ist, der während der gesamten Messung relativ ruhig bleiben muss.
- Lokalisieren Sie durch den primären Nadelempfänger die ohrenverführerischen anatomischen Orientierungspunkte (d. h. Nasen- und linke/rechte präaurikuläre Punkte) und die Position der HPI-Spulen und nehmen Sie gleichmäßig zusätzliche Kopfhautpunkte (mindestens 100, vorzugsweise nahe ~500) ab, um eine qualitativ hochwertige Rekonstruktion der Kopfoberfläche zu verbessern.
HINWEIS: Die anatomischen Orientierungspunkte definieren das Motivkoordinatensystem. Der Digitalisierer generiert die Koordinaten eines Sensors im 3D-Raum mit einem Sender (typischerweise hinter dem Motiv an der Rückenlehne des Holzstuhls montiert) und zwei Empfängern (d. h. dem Stift und den Referenzempfängern). - Nachdem die Digitalisierung abgeschlossen ist, platzieren Sie den Stiftempfänger ~15 cm vom Motiv und Sender entfernt und digitalisieren Sie einen zufälligen Punkt, um den Digitalisierungsprozess abzuschließen.
HINWEIS: Dieser letzte Schritt des Digitalisierungsprozesses kann sich von anderen kommerziellen Produkten unterscheiden.
- Bitten Sie den Probanden vor dem Anlegen des EEG-Netzes, sich auf einen Stuhl in der Nähe des EEG-Verstärkers zu setzen und Handtücher auf Brust und Schultern zu legen, um eventuelle Tropfen aufgrund der Anwendung des Netzes zu absorbieren. Nehmen Sie das EEG-Netz aus dem Plastikeimer, drehen Sie es mit den Schwämmen nach innen und wickeln Sie es vorsichtig um ein Handtuch, um die gemischte Lösung im Überschuss aufzunehmen.
- Wenn die Versuchsperson auf dem Stuhl sitzt und angewiesen wird, während dieses Schritts die Augen geschlossen zu halten, stecken Sie beide Hände in das Netz, spreizen Sie es mit den Fingern und legen Sie es schließlich auf den Kopf der Versuchsperson.
- Ohne die Positionen der HPI Coils zu bewegen, stellen Sie das gedehnte Netz am Kopf des Probanden mit den Fingern ein, um sicherzustellen, dass der Referenz- und der Nasenkanal korrekt in der Mitte der Kopfhaut bzw. zwischen den Augen des Probanden positioniert sind, und befestigen Sie schließlich den Kinnriemen, sobald sich das Netz in der richtigen Position befindet.
- Stellen Sie mit einem EEG-Impedanzmessgerät sicher, dass alle Impedanzen der Kopfhautelektroden im Bereich von 0-50 kΩ liegen (Werte ˂5 kΩ werden empfohlen), um Signalverzerrungen zu vermeiden. Um die Impedanzen zwischen Kopfhaut und Elektrode zu reduzieren, überprüfen Sie, ob jede Elektrode einen guten mechanischen und elektrischen Kontakt mit der Kopfhaut hat, indem Sie entweder ein Holzwattestäbchen verwenden, um die Haare des Probanden zwischen der Elektrode und der Kopfhaut zu entfernen, oder eine Einweg-Plastikpipette, um bei Bedarf eine leitfähigere gemischte Lösung in die Schwämme der Elektroden zu übertragen.
- Sobald alle Impedanzen idealerweise bis zu 50 kΩ betragen, trennen Sie den Verstärker und bereiten Sie das Subjekt für die Digitalisierung der EEG-Elektrode vor.
HINWEIS: Führen Sie die Digitalisierung der EEG-Elektrode außerhalb des MSR durch und stellen Sie sicher, dass genügend Platz um das Subjekt herum vorhanden ist, um den Scanvorgang zu steuern.
- Sobald alle Impedanzen idealerweise bis zu 50 kΩ betragen, trennen Sie den Verstärker und bereiten Sie das Subjekt für die Digitalisierung der EEG-Elektrode vor.
- Bestimmen Sie die 3D-Positionen der EEG-Elektroden mit einem optischen Handscanner. Bitten Sie den Probanden während dieses Prozesses, bequem zu sitzen und geradeaus zu schauen, sofern nicht anders angewiesen.
- Öffnen Sie zunächst die Software für den optischen Scanner, wählen Sie die Sensorvorlage aus, die dem während der Aufzeichnungen verwendeten EEG-Sensorlayout entspricht, und starten Sie dann den Scanvorgang.
- Halten Sie den Scanner während des Scannens in einem bestimmten Abstand zum EEG-Netz (normalerweise ~45 cm), wobei die Scanöffnungen senkrecht zur Oberfläche der Sensoren stehen, und bewegen Sie ihn langsam um den Kopf des Probanden, indem Sie gewölbten Schneisen von oben (Mitte des Kopfes) nach unten folgen (letzte Sensorreihe entlang des Halses), um die physischen Positionen aller Sensoren aufzuzeichnen.
HINWEIS: Der optische Scanner digitalisiert die Positionen der EEG-Elektroden am Kopf des Probanden und wandelt sie in eine 3D-Koordinatendatei um. Es zeichnet sich in der Regel durch zwei optische Sensoren aus, die Infrarot (IR)-Lichtquellen aussenden. Jeder gescannte Ort wird in der Regel in einer 3D-Sensorwolke angezeigt. Die 3D-Sensor-Cloud liefert Feedback für das Scannen, Abtasten und Ausrichten der Sensorpositionen, während die 2D-Sensorkarte Feedback für die Beschriftung dieser Sensorpositionen liefert. Der Scanvorgang der EEG-Elektrodenpositionen dauert insgesamt 5-10 min, einschließlich der Sondierung der Passerpunkte. Die Scanzeit kann jedoch manchmal von der Leistung des optischen Scanners bei der Erkennung der Elektrodenpositionen abhängen.
- Nachdem alle EEG-Elektroden gescannt wurden (mindestens 95 %), untersuchen Sie die Referenzpunkte (d. h. Nasen- und linke/rechte präaurikuläre Punkte) und vier Ausrichtungssensoren (d. h. vordere, linke und rechte Ausrichtungsknoten und REF-Knoten) mit der drahtlosen optischen Sonde, um die 3D-Sensorwolke an der ausgewählten Sensorvorlage auszurichten.
HINWEIS: Die Nummerierung der Ausrichtungssensoren basiert auf der Konfiguration des EEG-Sensornetzes.- Um die Referenzpunkte zu prüfen, platzieren Sie die Spitze der optischen Sonde auf der Haut des Motivs in der Mitte des Referenzpunkts, indem Sie sicherstellen, dass die Scanöffnungen des Scanners auf die reflektierenden Scheiben der Sonde zeigen. Platzieren Sie auf ähnliche Weise die Spitze des optischen Tastkopfs in der Mitte des gewünschten Ausrichtungssensors, um die Ausrichtungssensoren zu sondieren.
- Sobald alle Sensoren gescannt und sondiert wurden, überprüfen Sie ihre Positionen und Beschriftungen in der 3D-Sensorwolke und der 2D-Sensorkarte in Bezug auf das tatsächliche EEG-Netz, um mögliche Fehler zu überprüfen und schließlich zu korrigieren. Wenn während des Scanvorgangs keine Fehler aufgetreten sind, exportieren Sie die Datei .txt 3D-Koordinate und konvertieren Sie sie in das gewünschte Format.
HINWEIS: Die 3D-Elektrodenkoordinaten werden in der Regel in .txt Format gespeichert und können über eine optische Scannersoftware in verschiedene Formate (z. B. .xml, .sfp, .elp oder .nsi) konvertiert werden. - Nachdem der Digitalisierungsprozess der EEG-Elektrode (Schritte 2.9-2.11) abgeschlossen ist, bereiten Sie den Probanden, der in den MSR verlegt werden soll, auf die Durchführung von Ruhe-/Schlafdaten (Schritt 2.13), visuomotorische Aufgaben (Schritt 2.14), auditive Stimulation (Schritt 2.15) und somatosensorische Stimulation (Schritt 2.16) vor.
- Stellen Sie für die Ruhe-/Schlafdaten die Gantry des MEG-Systems in die Rückenlage (Abbildung 1A) und ordnen Sie das nichtmagnetische und kompatible Bett so an, dass die abnehmbare Kopfstütze mit der helmförmigen Öffnung an der Unterseite des Dewars ausgerichtet ist. Nachdem Sie das Bett in die richtige Position gebracht haben, stellen Sie das Bremsventil des Bettes in die ausgeschaltete Position. Legen Sie ein Laken oder eine Decke über das Bett und ein kleines Schaumstoffkissen auf die abnehmbare Kopfstütze, um den Kopf zu fixieren und während der Aufnahme bequem zu sein.
HINWEIS: Der Dewar ist ein mit flüssigem Helium gefüllter kryogener Lagerbehälter, in dem die Sensorarrays am Boden über eine helmförmige Öffnung räumlich angeordnet sind, die den Kopf des Probanden umgibt. Der Helm passt bis zu einem Kopfumfang von 59-61 cm. Die Gantry ist das mechanische System, das den Dewar unterstützt und es ermöglicht, seine Höhe und seinen Winkel basierend auf der Messposition (d. h. sitzend oder in Rückenlage) zu ändern.- Übertragen Sie die Person in den MSR und helfen Sie ihr, sich auf die Bettkante zu setzen und sich darauf zu legen. Legen Sie mehrere Decken auf den Körper des Probanden, um ihn während der Aufnahme warm zu halten, indem Sie sicherstellen, dass die Kabel der Elektroden leicht zugänglich sind, und ziehen Sie die Sicherheitsgurte leicht an (oder ziehen Sie das Geländer hoch, falls vorhanden), und erklären Sie dem Probanden, dass dieser Schritt verhindern soll, dass er sich während des Schlafens aus dem Bett rollt. Legen Sie bei Bedarf ein zusätzliches gerolltes Handtuch unter den Nacken, um den Nacken und die Schultern des Motivs zu stützen.
- Entriegeln Sie das Bremsventil des Bettes, um den Kopf des Probanden sanft zu bewegen, der auf der abnehmbaren Kopfstütze unter der helmförmigen Öffnung des Dewars platziert ist, bis er die Innenseite des Helms berührt. Um das Signal-Rausch-Verhältnis (SNR) zu erhöhen, bringen Sie den Kopf des Motivs so nah wie möglich an den Helm.
- Stecken Sie die HPI Spulen, EKG- und EOG-Elektroden in die entsprechenden Panels des MEG Systems, verbinden Sie das EEG Netz mit der Verstärkereinheit im MSR und überprüfen Sie die Messungen der Kopfkoordinaten von der Erfassungsstation außerhalb des MSR, um zu beurteilen, ob der Kopf des Probanden richtig unter dem Dewar positioniert ist.
- Reduzieren Sie mit dem Einverständnis des Probanden die Intensität des Lichts im MSR, um die Entspannung und den Schlaf zu stimulieren. Wenn sich der Proband entspannt und wohl fühlt, weisen Sie ihn an, sich während der Aufnahme mit geschlossenen Augen auszuruhen oder zu schlafen. Versichern Sie dem Probanden, dass er während der gesamten Aufzeichnung über die hochfrequenzgeschirmte Farbkamera, die an der Wand des MSR angebracht ist, auf dem Monitor außerhalb des MSR beobachtet wird.
- Für die visuomotorische Aufgabe stellen Sie die Gantry des MEG-Systems in die aufrechte Position (Abbildung 1B) und ordnen Sie den MEG-Stuhl so an, dass sich der Kopf des Probanden unter der Gantry befindet, in der Nähe der helmförmigen Öffnung am unteren Ende des Dewars. Nachdem Sie den Stuhl in die richtige Position gebracht haben, stellen Sie das Bremsventil des Stuhls in die entriegelte Position ("0").
- Übertragen Sie das Motiv in den MSR. Helfen Sie ihm, sich auf den nichtmagnetischen und kompatiblen Stuhl zu setzen und eine bequeme und entspannte Position zu finden. Legen Sie mehrere Decken auf den Körper des Probanden, um ihn während der Aufnahme warm zu halten, indem Sie sicherstellen, dass die Kabel der Elektroden leicht zugänglich sind, und platzieren Sie den abnehmbaren Tisch so, dass der Proband während der Aufgabe seine Hände darauf legen kann. Legen Sie bei Bedarf ein Handtuch unter die Knie des Probanden, um die Sitzposition beizubehalten, und rutschen Sie nicht nach unten.
HINWEIS: Da sich der Proband während der visuomotorischen Aufgabe entspannen und daher eine niedrigere Position als die ursprüngliche einnehmen kann, heben Sie den Stuhl am Ende jeder Aufgabensitzung vorsichtig über das Hebepedal (falls vorhanden) an oder legen Sie Handtücher oder Decken auf den Stuhl, so dass der Kopf des Probanden wieder die Innenseite des Helms berührt. Legen Sie bei Bedarf zusätzliche Handtücher oder Decken hinter den Kopf des Motivs, nicht nur für besseren Komfort, sondern auch, um dem Motiv zu helfen, den Kopf so gerade wie möglich zu halten. Die visuomotorische Stimulation kann alternativ in Rückenlage durchgeführt werden, um zu vermeiden, dass sich der Dewar mitten in einer Aufnahmesitzung bewegt. - Sobald sich der Proband in der richtigen Position befindet, stecken Sie die HPI Spulen, EKG-, EOG-, FDI- und APB-Elektroden an die rechte Blende des MEG-Geräts, verbinden Sie das EEG-Netz mit der Verstärkereinheit im MSR und heben Sie den Stuhl mit kleinen Bewegungen durch das Erhöhungspedal (falls vorhanden) an oder legen Sie zusätzliche Handtücher oder Decken auf den Stuhl, bis der Kopf des Probanden leicht die Innenseite des Helms berührt (überprüfen Sie die Maße des Koordinaten des Kopfes vom Erfassungsarbeitsplatz außerhalb des MSR).
- Platzieren Sie die Projektionsfläche, auf die die visuellen Reize über ein außerhalb des MSR positioniertes Projektorspiegelsystem projiziert werden, vor dem Probanden (Abbildung 1B) und erklären Sie die visuomotorische Aufgabe, die während der Aufnahme ausgeführt werden soll. Weisen Sie die Versuchsperson insbesondere an, nur dann mit dem Zeigefinger auf den Tisch zu tippen, wenn der visuelle Reiz (z. B. ein Bild) für die rechte bzw. linke Hand auf dem Bildschirm erscheint. Stellen Sie sicher, dass der Proband die Aufgabe versteht oder sich wohl fühlt, sie alleine auszuführen; Üben Sie die Aufgabe bei Bedarf mehrmals gemeinsam mit dem Probanden, um ihm zu helfen, sich damit vertraut zu machen.
HINWEIS: Wenn eine visuomotorische Stimulationssitzung in Rückenlage durchgeführt wird, wird ein Spiegel in einem gewissen Abstand über dem Gesicht des Probanden platziert, um die visuellen Reize des Projektors zu reflektieren. - Bevor Sie die Tür des MSR schließen, fragen Sie den Probanden, ob er sich wohl fühlt, allein im Raum zu sein. Falls nicht, bleibt entweder eine Person aus dem Team oder ihre Eltern während der Aufnahmesitzungen im MSR. Versichern Sie dem Probanden außerdem, dass er während der gesamten Aufzeichnung auf dem Monitor außerhalb des MSR beobachtet wird.
- Übertragen Sie das Motiv in den MSR. Helfen Sie ihm, sich auf den nichtmagnetischen und kompatiblen Stuhl zu setzen und eine bequeme und entspannte Position zu finden. Legen Sie mehrere Decken auf den Körper des Probanden, um ihn während der Aufnahme warm zu halten, indem Sie sicherstellen, dass die Kabel der Elektroden leicht zugänglich sind, und platzieren Sie den abnehmbaren Tisch so, dass der Proband während der Aufgabe seine Hände darauf legen kann. Legen Sie bei Bedarf ein Handtuch unter die Knie des Probanden, um die Sitzposition beizubehalten, und rutschen Sie nicht nach unten.
- Für die auditive Stimulation verwenden Sie den in Schritt 2.14 beschriebenen Aufbau mit der Projektionsfläche vor dem sitzenden Probanden. Helfen Sie dem Probanden, die Kopfhörer (oder Ohrhörer) zu tragen, über die die Schallauslöser (z. B. modulierte Zwitschergeräusche) abgegeben werden.
- Weisen Sie das Subjekt an, die auf den Bildschirm projizierten Reize (z. B. grüner Punkt auf schwarzem Hintergrund) zu fixieren, während es den Tonauslösern lauscht. Führen Sie bei Bedarf eine Schulung durch, um dem Probanden zu helfen, das Verfahren besser zu verstehen. Wiederholen Sie vor dem Schließen der Tür des MSR die Sicherheitsmaßnahmen wie zuvor beschrieben.
- Für die somatosensorische Stimulation verwenden Sie den in Schritt 2.14 beschriebenen Aufbau. Fragen Sie die Person, welches Video (oder welchen Film) sie auf der Projektionsleinwand vor sich sehen möchte.
- Weisen Sie den Probanden an, sich mit offenen Augen zu entspannen, das ausgewählte Video anzusehen, so still wie möglich zu bleiben und die taktilen Reize zu ignorieren, die während der Aufnahme an seine Finger abgegeben werden. Erklären Sie dem Probanden, dass er/sie sanfte Klopfen auf der Haut an den Fingerspitzen bzw. für jede Hand spüren wird. Wenn sich der Proband unwohl fühlt, führen Sie eine Schulung durch, um ihn zu beruhigen.
HINWEIS: Die Fixierung des Auges auf ein visuelles Ziel ist eine etablierte Technik zur Minimierung biologischer Artefakte, die die Qualität der Aufnahme beeinträchtigen und das Motiv von den taktilen Reizen ablenken können, die während der Datenerfassung abgegeben werden.
- Weisen Sie den Probanden an, sich mit offenen Augen zu entspannen, das ausgewählte Video anzusehen, so still wie möglich zu bleiben und die taktilen Reize zu ignorieren, die während der Aufnahme an seine Finger abgegeben werden. Erklären Sie dem Probanden, dass er/sie sanfte Klopfen auf der Haut an den Fingerspitzen bzw. für jede Hand spüren wird. Wenn sich der Proband unwohl fühlt, führen Sie eine Schulung durch, um ihn zu beruhigen.
3. Datenerfassung
HINWEIS: Die gleichzeitige Erfassung von MEG- und EEG-Daten erfolgt in der MEG-Einrichtung des Cook Children's Medical Center (CCMC). Weitere Einzelheiten zur klinischen Anwendung von MEG bei Kindern mit Epilepsie finden Sie an anderer Stelle 8,27,45.
- Erfassen Sie MEG-Signale mit dem Ganzkopf-MEG-System (Sensorabdeckung: 1.220 cm2), das sich durch 306 Kanäle auszeichnet, die in 102 identischen Dreifachsensorelementen mit einem Magnetometer und zwei orthogonalen planaren Gradiometern gruppiert sind. Stellen Sie eine Abtastfrequenz von mindestens 1 kHz ein.
HINWEIS: Einspulen-Magnetometer messen die Komponente des Magnetfelds senkrecht zur MEG-Helmoberfläche. Planare Gradiometer bestehen aus einer "Achter"-Spulenkonfiguration, die durch Paare von Magnetometern gekennzeichnet ist, die in geringem Abstand zueinander angeordnet sind und die Differenz im Magnetfeld zwischen ihren Positionen messen (d. h. die Differenz zwischen den beiden Achterschleifen), auch als räumlicher Gradient bezeichnet. Im Vergleich zu Magnetometern sind planare Gradiometer weniger empfindlich gegenüber tiefen Hirnquellen, aber robuster bei der Erkennung oberflächlicher Quellen, indem sie Umgebungsgeräusche unterdrücken. Diese 306 Kanäle werden in flüssiges Helium bei -296 °C (4,2 K) getaucht und abgekühlt, um zu Supraleitern zu werden. - Gleichzeitige Aufzeichnung von EEG-Signalen mit dem nichtmagnetischen 256-Kanal-EEG-Netz mit Ag/AgCl-Elektrodensensoren, die gleichmäßig über die Kopfhaut, die Wangen und den Nacken verteilt sind. Stellen Sie eine Abtastfrequenz von mindestens 1 kHz ein.
- Schließen Sie die Klappe des MSR, um die Aufnahme zu starten. Kommunizieren Sie über die Sprachsprechanlage mit der Person und prüfen Sie, ob sie sich wohl fühlt, wenn sie allein im MSR ist. Überwachen Sie das Motiv ständig auf Video und betreten Sie im Notfall sofort das MSR.
HINWEIS: Falls er/sie sich nicht wohl fühlt oder die massive MSR-Tür ihn einschüchtert, kann entweder eine Person aus dem Team oder seine Eltern während der Aufnahmesessions auf einem Holzstuhl in der Nähe des Probanden im MSR sitzen; Stellen Sie sicher, dass alle metallischen Gegenstände entfernt werden, bevor Sie den Raum betreten. - Weisen Sie den Probanden vor jeder Aufnahme über die Sprachsprechanlage an, seine Position ~30 Sekunden lang ruhig zu halten, bevor er mit der Aufgabe beginnt. Für die visuomotorische Aufgabe kommunizieren Sie zusätzlich über die Gegensprechanlage, welchen Zeigefinger (entweder rechts oder links) er/sie für die erste Aufnahmesitzung verwenden wird.
- Während dieses Zeitraums, in dem der Proband still steht, drücken Sie die Messtaste im HPI-Messdialog auf dem MEG-Datenerfassungssystem, um das Magnetfeld zu messen, das durch den in die HPI-Spulen eingespeisten Strom erzeugt wird, und um die Messpositionen des Kopfes in Bezug auf das MEG-Sensorarray zu bestimmen. Vergewissern Sie sich daher, dass das Motiv gut positioniert ist (Kopf |z-Koordinate | ˂ 75 mm) und notieren Sie die 3D-Maße für jede Sitzung.
- Wenn zwischen dem Kopf der Person und dem Helm noch Platz ist, betreten Sie entweder wieder den MSR und stellen Sie die Höhe des Stuhls über das Erhöhungspedal ein (falls vorhanden), legen Sie Handtücher oder Decken auf den Stuhl oder weisen Sie die Person über die Gegensprechanlage an, wie sie den Kopf in eine engere Position zum Helm bringen soll (wenn die Person sitzt), und überprüfen Sie abschließend noch einmal die Positionen der Kopfmessungen. Bei Ruhe-/Schlafaufzeichnungen wieder in den MSR eintreten und das Bett näher an den Helm bringen, um den räumlichen Abstand zwischen Kopf und Helm zu verringern.
- Sobald der Proband in Bezug auf den MEG-Helm gut positioniert und bereit zum Start ist, beginnen Sie die erste Aufnahmesitzung (Dauer ~10 Minuten), indem Sie einer genauen Reihenfolge folgen (siehe Schritt 3.5.1), um eine genaue MEG- und EEG-Synchronisation zu gewährleisten (siehe Schritt 3.12).
HINWEIS: Um qualitativ hochwertige Aufnahmen zu gewährleisten, ist die erste Aufzeichnungssitzung entscheidend, um Artefakte zu erfassen, die in den Daten aufgrund von Bewegungen des Motivs oder durch die externe Umgebung vorhanden sind. Treten Sie bei Bedarf erneut in den MSR ein, um eventuelle Kanalverbindungen oder die Position des Motivs auf dem MEG-Stuhl anzupassen. Es wird empfohlen, sich während der Aufnahmen Notizen über ungewöhnliche Artefakte oder Ereignisse zu machen, die im Nachhinein bei Bedarf überprüft werden können.- Drücken Sie die Aufzeichnungstaste an der EEG-Datenerfassungssoftware, um die EEG-Aufzeichnung zu starten. Drücken Sie die Aufnahmetaste an der MEG-Datenerfassungssoftware, um die MEG-Aufnahme zu starten. Drücken Sie abschließend die Starttaste in der Software des Stimulationscomputers, um entweder visuelle Reize anzuzeigen oder auditive Reize abzugeben.
HINWEIS: Der Stimulationscomputer, auf dem die visuelle (oder auditive) Stimulussoftware ausgeführt wird, ist mit dem Projektorspiegelsystem außerhalb des MSR verbunden, das je nach Art der durchgeführten Aufnahme ein- oder ausgeschaltet werden kann. Während der Ruhe-/Schlafaufzeichnungen wird das System ausgeschaltet, da der Proband entweder ruht oder schläft, aber das Ausführen der visuellen Reizsoftware auf dem Stimulationscomputer hilft bei der Zeitplanung jeder Aufnahmesitzung. Während der visuomotorischen Aufgabe sowie während der auditiven und somatosensorischen Stimulation wird das System eingeschaltet, indem es dem Probanden ermöglicht, die Reize oder ein Video zu beobachten, das auf den vor ihm platzierten Bildschirm projiziert wird, während die Software läuft. Für diese Studie wurden insgesamt (i) 107 Stimuli (d.h. 85 Bilder, die auf einem Schachbretthintergrund und 22 Schachbretthintergründen überlagert wurden) mit einem Intervall von ~4 s zwischen den einzelnen Reizen für die visuomotorische Aufgabe ausgewählt; (ii) 200 modulierte Chirp-Töne mit einem Inter-Stimulus-Intervall von 3 s für die auditive Stimulation; und (iii) 200 taktile Reize für jeden Finger (d.h. D1, D3 und D5), die einer halbzufälligen Sequenz mit einem Inter-Stimulus-Intervall von ~1,5 s für die somatosensorische Stimulation folgen.
- Drücken Sie die Aufzeichnungstaste an der EEG-Datenerfassungssoftware, um die EEG-Aufzeichnung zu starten. Drücken Sie die Aufnahmetaste an der MEG-Datenerfassungssoftware, um die MEG-Aufnahme zu starten. Drücken Sie abschließend die Starttaste in der Software des Stimulationscomputers, um entweder visuelle Reize anzuzeigen oder auditive Reize abzugeben.
- Um die Aufzeichnungen zu stoppen, drücken Sie die Stopp-Taste an der MEG-Datenerfassungssoftware und dann die Stopp-Taste an der EEG-Datenerfassungssoftware. Kommunizieren Sie am Ende jeder Aufnahmesitzung über die Gegensprechanlage mit dem Probanden, um ihn zu beruhigen, und wenn keine Kanalverbindungen oder Positionsanpassungen im MSR erforderlich sind, fahren Sie mit der nächsten Sitzung fort.
- Wählen Sie für die visuomotorische Aufgabe für jede Sitzung unterschiedliche visuelle Reize aus, um den Probanden während der Aufnahme zu motivieren und zu unterhalten.
- Zeichnen Sie entweder für visuomotorische oder Ruhe-/Schlafdaten insgesamt ~1 h gleichzeitige MEG- und EEG-Aufzeichnung auf, gekennzeichnet durch 5-6 Sitzungen. Die Anzahl der Sitzungen kann jedoch je nach Fach variieren. Zeichnen Sie außerdem insgesamt ~20 Minuten (1-2 Sitzungen à ~10 Minuten) und ~14 Minuten (1-2 Sitzungen à ~7 Minuten) gleichzeitige MEG- und EEG-Aufzeichnung für die auditiven bzw. somatosensorischen Stimulationsdaten auf.
HINWEIS: In dieser Studie werden die MEG- und EEG-Daten am Ende der Aufzeichnungen automatisch im .fif- bzw. .mff-Format im IT-Speichersystem von CCMC gespeichert. - Wenn die Aufzeichnung beendet ist, geben Sie den MSR ein, um dem Probanden zu helfen, vom Stuhl oder Bett aufzustehen, und bitten Sie ihn, sich auf einen Stuhl außerhalb des MSR zu setzen, um sowohl das EEG-Netz als auch die Elektroden zu entfernen.
- Weisen Sie den Probanden an, die Augen zu schließen, bis ihm etwas anderes gesagt wird, und helfen Sie ihm, das EEG-Netz zu entfernen, indem Sie die Kinnriemen vollständig lösen und das Netz vorsichtig mit zwei Händen herausziehen (von der Stirn zum Hinterkopf des Probanden), bis es vollständig abgezogen ist. Achten Sie bei diesem Schritt darauf, dass Sie nicht an den Haaren der Person ziehen, während Sie das Netz entfernen. Helfen Sie dem Probanden außerdem, die verbleibenden Elektroden (d. h. EKG, EOG und EMG im Falle einer visuomotorischen Aufgabe), die zuvor auf seiner Haut geklebt wurden, vorsichtig zu entfernen.
- Nachdem das EEG-Netz und die Elektroden entfernt wurden, informieren Sie den Probanden (und seine Eltern), dass alle Eingriffe endlich abgeschlossen sind.
- Nachdem das Motiv den Raum verlassen hat, reinigen Sie den optischen Scanner vorsichtig (wie in der Bedienungsanleitung beschrieben) und bewahren Sie ihn in seiner Schutzhülle auf.
- Reinigen und desinfizieren Sie die Oberflächen aller Geräte, die während der Aufnahmen verwendet werden (z. B. Stühle, Betten, Schreibtische), entweder mit vom Krankenhaus zugelassenen Wasserstoffperoxidtüchern oder Desinfektionsspray und Papiertüchern, legen Sie die gebrauchten Decken und Handtücher in den vom Krankenhaus bereitgestellten Behälter und werfen Sie alle gebrauchten Klebebandstücke weg.
- Bewahren Sie die Messgeräte im Vorratsschrank auf und reinigen Sie die Innenseite der mit leitfähiger Paste gefüllten Elektrodenbecher mit Wattestäbchen aus Holz unter fließendem Leitungswasser.
- Um das EEG-Netz zu spülen, füllen Sie den Plastikeimer in der Spüle mit sauberem, warmem Leitungswasser und wiederholen Sie die folgenden Schritte insgesamt viermal.
- Tauchen Sie das EEG-Netz in das Wasser und bewegen Sie das EEG-Netz vorsichtig für 10-20 s (oder tauchen Sie es ~25 Mal in und außerhalb des Eimers).
- Lassen Sie das Wasser aus dem Eimer ab und füllen Sie den Eimer mit sauberem und warmem Leitungswasser.
- Um das EEG-Netz zu desinfizieren, füllen Sie den Plastikeimer in der Spüle mit der Desinfektionslösung, die aus 2 qt lauwarmem Leitungswasser und 1 EL Desinfektionsmittel besteht, und weichen Sie das EEG-Netz 10 Minuten lang darin ein. Spülen Sie den Eimer von der Desinfektionslösung aus und führen Sie den Spül- und Entleervorgang dreimal durch, um alle Lösungsreste aus dem EEG-Netz zu entfernen.
- Nehmen Sie für den Spül- oder Desinfektionsvorgang das eingetauchte EEG-Netz aus dem Eimer, trocknen Sie es, indem Sie das überschüssige Wasser mit Hilfe eines sauberen, trockenen Handtuchs entfernen, und bewahren Sie es auf, indem Sie es nahe an der Spüle aufhängen.
- Um interne und externe magnetische Interferenzen und Mess-/Bewegungsartefakte aus den MEG-Daten zu unterdrücken, wenden Sie die zeitliche Erweiterung der Signalraumtrennungsmethode (tSSS) auf die MEG-.fif-Rohdatendatei an.
HINWEIS: Die raumzeitliche Maxwell-Filterung (tSSS) ist ideal für die Unterdrückung von Störquellen, die sich innerhalb oder sehr nahe des MEG-Sensorarrays befinden, insbesondere interne Interferenzen. - Bei gleichzeitigen MEG- und EEG-Aufzeichnungen ist die Koordinatensysteme der beiden Erfassungsgeräte räumlich auf die anatomischen Landmarken auf dem Kopf des Probanden auszurichten (Abbildung 2A) und die lineare Taktdrift zwischen den Signalen zu korrigieren, die aufgrund der möglicherweise unterschiedlichen Abtastraten auftritt (Abbildung 2B).
HINWEIS: Während der Aufzeichnungen können sowohl MEG- als auch EEG-Signale im Laufe der Zeit durch langsame Verschiebungen beeinflusst werden, die auf mögliche Verzögerungen beim Drücken der Start- und Endtasten und auf eine interne Taktdrift zurückzuführen sind, die auftritt, wenn die Trigger an die MEG- und EEG-Datenerfassungssoftware gesendet werden. Um eine präzise Synchronisation zwischen diesen Signalen zu gewährleisten, wurde ein hauseigener Code in Python entwickelt, der die während der Datenerfassung auf beiden Systemen gesendeten Triggerereignisse als gemeinsames Triggersignal verwendet. Der Code enthält drei Funktionen, die in der MNE-Python-Softwarebibliothek verfügbar sind: zwei Funktionen, die die MEG- und EEG-Signale lesen, und eine Funktion, die Informationen über die Triggerereignisse aus den Signalen extrahiert, wie z. B. Kanalnamen und Zeitstempel (d. h. Datum und Uhrzeit des Auftretens des Ereignisses). Zeitunterschiede zwischen dem Auftreten von Trigger-Ereignissen in den einzelnen Signalen (d. h. Delta) definieren die lineare Taktdrift über die Zeit (Abbildung 2B). Eine detaillierte Beschreibung des entwickelten Codes finden Sie in den nächsten Schritten (siehe 3.12.1-3.12.4).- Verwenden Sie die Differenz zwischen dem ersten Trigger-Ereignis, das auf jedem Signal auftritt, als Offset-Wert (d. h. der Teil, der von einem der beiden Signale gekürzt werden soll), um die Aufnahmen auszurichten.
HINWEIS: Die Funktionen mne.io.read_raw_fif und mne.io.read_raw_egi konvertieren die MEG- und EEG-Aufzeichnungen in ein 2D-Array-Format, während die Funktion mne.find_events Ereignisinformationen aus den Rohsignalen extrahiert. - Sobald diese ersten Auslöser ausgerichtet sind, berechnen Sie den Pearson-Korrelationskoeffizienten, um den Grad der Korrelation zwischen den Signalen zu bewerten. p-Werte < 1 x 10-6 werden empfohlen, um eine perfekte Ausrichtung zu gewährleisten.
HINWEIS: Die pearsonr-Funktion aus der scipy-Bibliothek schätzt den Pearson-Korrelationskoeffizienten zwischen MEG- und EEG-Signalen und den p-Wert dieser Korrelation. - Um diese Korrelationsgenauigkeit zu validieren, schätzen Sie die Driftrate zwischen den beiden Signalen, indem Sie eine polynomiale Anpassung ersten Grades durchführen und das resultierende Ausmaß der Disparität, das durch den Koeffizienten der Polynomfunktion dargestellt wird, verwenden, um die Signale auf der x-Achse der polynomialen Anpassung neu abzutasten (Abbildung 2B).
HINWEIS: Die polyfit-Funktion aus der numpy-Bibliothek passt die MEG- und EEG-Signale in eine Polynomfunktion ein; Diese Funktion gibt einen Koeffizienten zurück, der das Ausmaß der Diskrepanz zwischen den beiden Signalen darstellt. Die Funktion mne.resample berechnet die MEG- und EEG-Signale entsprechend dem Koeffizienten der Polynomfunktion neu. - Vergleichen Sie nach Abschluss des Resampling die Zeitstempel des letzten Triggerereignisses, das bei jedem Signal aufgetreten ist, und entfernen Sie die Zeitfenster, die sowohl in MEG- als auch in EEG-Signalen nicht üblich sind. Führen Sie schließlich die synchronisierten MEG- und EEG-Signale zusammen, um eine einzige Aufzeichnung zu erstellen, die sowohl von MEG- als auch von EEG-Sensoren gekennzeichnet ist und für die weitere Analyse verwendet werden kann.
HINWEIS: Die Funktion mne.add_channels führt die beiden Signale zu einer einzigen Aufnahme zusammen.
- Verwenden Sie die Differenz zwischen dem ersten Trigger-Ereignis, das auf jedem Signal auftritt, als Offset-Wert (d. h. der Teil, der von einem der beiden Signale gekürzt werden soll), um die Aufnahmen auszurichten.
- Verwenden Sie am Ende jeder ~1,5-stündigen Aufzeichnung insgesamt 5-6 (jeweils ~10 Minuten), 1-2 (jeweils ~10 Minuten) und 1-2 (jeweils ~7 Minuten) Sitzungen synchronisierter MEG- und EEG-Aufzeichnungen für die visuomotorische (und Ruhe-/Schlaf-), auditive und somatosensorische Stimulationsdaten für die Datenanalyse.
HINWEIS: Im Idealfall muss der Proband für drei visuomotorische Aufnahmen mit dem rechten Finger und für die restlichen drei visuomotorischen Aufnahmen mit dem linken Finger tippen.
4. Datenanalyse
- Kartierung der Reizzone
- Generieren Sie die kortikalen 3D-Oberflächen aus der MRT des Probanden mit dem kortikalen Rekonstruktionsprozess von FreeSurfer, einem Open-Source-Neuroimaging-Tool zur Verarbeitung, Analyse und Visualisierung von MRT-Bildern des menschlichen Gehirns46.
- Importieren Sie die rekonstruierte Anatomie in Brainstorm, einer Open-Source-Anwendung von MATLAB, die sich der Visualisierung und Verarbeitung von MEG- und EEG-Datenwidmet 47, um die kortikalen Rekonstruktionsergebnisse zu visualisieren. Legen Sie in Brainstorm die Referenzpunkte (d. h. Nasión, linke/rechte präaurikuläre, anteriore/posteriore Kommissur und interhemisphärische Kommissur) auf dem importierten MRT fest, die das Subjektkoordinatensystem definieren.
- Importieren Sie das gleichzeitige MEG- und HD-EEG-Signal in Brainstorm und registrieren Sie die MEG- und EEG-Sensoren auf dem MRT mithilfe des MRT-Registrierungsprozesses, um ihre Ausrichtung an die digitalisierten Passerpunkte anzupassen. Projizieren Sie die EEG-Sensoren bei Bedarf auf die kortikale Oberfläche.
- Öffnen Sie die gleichzeitige MEG- und HD-EEG-Aufzeichnung und überprüfen Sie die Rohdaten visuell, um fehlerhafte Kanäle zu entfernen. Wenden Sie außerdem die in Brainstorm verfügbare Artefaktkorrekturtechnik (SSP) an, um biologische Artefakte (z. B. Herzschläge, Augenblinzeln) aus den Aufzeichnungen zu unterdrücken.
- Wenden Sie Kerb- (50 oder 60 Hz, je nach Netzstörung) und Bandpassfilter (1-70 Hz) auf die gleichzeitigen MEG- und HD-EEG-Daten an.
- Wählen Sie Teile von Daten aus, die interiktale Aktivität enthalten, die durch häufige IEDs wie Spikes und scharfe Wellen gekennzeichnet sind und (wenn möglich) minimale Bewegungsartefakte aufweisen.
HINWEIS: IEDs sind transiente Wellenformen, die durch eine zeitliche Entwicklung von <70 ms, eine Amplitude von >50 μV und eine scharfe Form gekennzeichnet sind, die deutlich von der Hintergrundaktivität im Frequenzband 1-70 Hz48 unterschieden werden kann. Abbildung 3A zeigt ein Beispiel für Teile der gleichzeitigen MEG- und HD-EEG-Signale mit häufigen IEDs, die auf beiden Aufzeichnungen sichtbar sind. - Markieren Sie mit der Standardanzeigeeinstellung von 10 s pro Seite den negativen Peak jedes IED, der sowohl bei MEG- als auch bei EEG-Aufzeichnungen (Abbildung 3A) sowie bei jeder Modalität allein auftritt. Überprüfen Sie vor dem Markieren jeder IED das Topographiefeld und die Potenzialkarten für das MEG bzw. EEG.
ANMERKUNG: Die Spannungsverteilungen zusätzlicher Zeitpunkte während der Aufstiegsphase jedes IED und nicht dessen Spitze müssen ebenfalls überprüft werden, um eine mögliche Ausbreitung epileptischer Aktivität zu berücksichtigen49. Weitere Informationen zum Markieren von interiktalen Spikes-Ereignissen mit Brainstorm finden Sie an anderer Stelle (https://neuroimage.usc.edu/brainstorm/Tutorials/Epilepsy). - Berechnen Sie ein realistisches Kopfmodell, das als dreischichtiges geometrisches Modell (d. h. Kopfhaut, innerer Schädel und äußerer Schädel) definiert ist (Abbildung 3B), mit der OpenMEEG BEM-Software (symmetrische Randelementmethode), die in Brainstorm verfügbar ist. Verwenden Sie das MRT-Volumen als Quellraum (Quelle-Punkt-Gitter mit 5 mm räumlicher Auflösung).
HINWEIS: Die OpenMEEG BEM-Software verwendet die symmetrische Randelementmethode, um ein realistisches Vorwärtsmodell zu berechnen, das durch die Kopfhaut (d. h. Luft-Kopfhaut-Grenzfläche), den äußeren Schädel (d. h. die Kopfhaut-Schädel-Grenzfläche) und den inneren Schädel (Schädel-Hirn-Grenzfläche) gekennzeichnet ist. Als alternative Lösung kann die Finite-Elemente-Methode (FEM) zur Lösung des Vorwärtsproblems eingesetzt werden, da sie eine realitätsnahe fachspezifische Darstellung des Kopfvolumenleiters ermöglicht. Die Leitfähigkeitswerte des Kopfgewebes werden oft aus der Literatur angenommen und können je nach Alter des Probandenvariieren: 50 Jahre. Um das Vorwärtsmodell mit der FEM zu lösen, berechnen Sie das realistische Kopfmodell, das als geometrisches Modell aus drei bis fünf Schichten (d. h. weiße Substanz, graue Substanz, Liquor, Schädel und Haut) definiert ist, unter Verwendung der DUNEuro FEM-Software, die in Brainstorm 47,50,51 verfügbar ist. Weitere Einzelheiten zur Schätzung des Forward-Modells mit FEM finden Sie an anderer Stelle (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Lokalisieren Sie die zugrunde liegenden Generatoren der ausgewählten interiktalen Spikes mit der uneingeschränkten ECD-Methode auf dem MEG-, EEG- und kombinierten MEG- und EEG-Sensorarray separat. Um diese Dipolquellen zu lokalisieren, berechnen Sie die Rauschkovarianz aus den MEG-Aufnahmen im leeren Raum oder stellen Sie sie als Identitätsmatrix ein.
HINWEIS: Erwägen Sie die Quellenlokalisierung an gemittelten IEDs mit ähnlichen Spannungsverteilungen als alternativer Ansatz, falls das SNR von IEDs niedrig12 ist. - Führen Sie die in Brainstorm verfügbare Dipol-Scanning-Methode am Höhepunkt jedes zuvor markierten IED durch, um die signifikantesten Quelldipole über das gesamte Gehirnvolumen auszuwählen. Wählen Sie nur Quelldipole mit einer Anpassungsgüte von >60 % aus und schätzen Sie deren Clusterbildung, die für jeden Dipol definiert ist als die Anzahl der Dipole, die sich 15 mm von seinem Mittelpunkt entfernt befinden (Abbildung 3C).
HINWEIS: Weitere Einzelheiten zur ECD-Cluster-Bildung finden Sie an anderer Stelle52.
- Kartierung der SOZ
- Generieren Sie die kortikalen 3D-Oberflächen aus dem MRT des Probanden mit dem kortikalen Rekonstruktionsprozess von FreeSurfer46.
- Importieren Sie die rekonstruierte Anatomie in Brainstorm47 , um die Ergebnisse der kortikalen Rekonstruktion zu visualisieren. Legen Sie die Passermarkenpunkte auf dem importierten MRT fest, die das Motivkoordinatensystem definieren.
- Importieren Sie das gleichzeitige MEG- und HD-EEG-Signal (mit dem iktalen Ereignis) in Brainstorm und registrieren Sie die MEG- und EEG-Sensoren auf dem MRT mithilfe des MRT-Registrierungsprozesses, um ihre Ausrichtung an die digitalisierten Referenzpunkte anzupassen. Projizieren Sie die EEG-Sensoren bei Bedarf auf die kortikale Oberfläche.
HINWEIS: Wenn der Proband während der Aufzeichnung einen Anfall hatte, überprüfen Sie die Notizen, die während der Aufzeichnung gemacht wurden, um zu beurteilen, in welcher Sitzung das iktale Ereignis aufgezeichnet wurde. - Öffnen Sie die gleichzeitige MEG- und HD-EEG-Aufzeichnung und überprüfen Sie die Rohdaten visuell, um fehlerhafte Kanäle zu entfernen. Wenden Sie die in Brainstorm47 verfügbare SSP-Artefaktkorrekturtechnik an, um biologische Artefakte (z. B. Herzschläge, Augenblinzeln) aus der Aufzeichnung zu verwerfen.
- Wenden Sie Kerbfilter (entweder 50 oder 60 Hz, je nach Netzstörung) und Bandpassfilter (1-70 Hz) auf die gleichzeitigen MEG- und HD-EEG-Daten an.
- Identifizieren Sie gemäß den Aufzeichnungsnotizen den Beginn des Anfalls und seine Beendigung (falls vermerkt) und markieren Sie diese Ereignisse auf dem Signal, um den korrekten Teil der Daten zu identifizieren, die iktale epileptiforme Entladungen enthalten. Beispiele für einen Anfallsbeginn sind in Abbildung 4 für MEG bzw. HD-EEG dargestellt.
HINWEIS: Wenn ein Patient während der MEG-Erfassung einen Anfall erleidet, ist medizinisches Personal erforderlich, um dem Patienten sofort zu helfen und eine Notfallversorgung zu gewährleisten. Daher kann die Dauer derjenigen Datenteile mit iktalen Ereignissen kurz sein. - Markieren Sie unter Verwendung der Standardanzeigeeinstellung von 10 s pro Seite den negativen Peak jedes Ausbruchs epileptiformer Entladungen (z. B. wiederholte Spikes, scharfe Wellen oder Spike-Wave-Komplexe), die während des iktalen Ereignisses auf MEG und EEG sowie auf jeder Modalität allein auftreten. Überprüfen Sie vor jeder Peakmarkierung das Topographiefeld und die Potenzialkarten für das MEG bzw. EEG (Abbildung 4A).
HINWEIS: Anfälle werden als generalisiert oder fokal eingestuft, je nachdem, wo sie beginnen. Obwohl ein Anfall vom Epilepsiesyndrom abhängig ist, ist er ein Phänomen von mindestens 10 s, das durch sich wiederholende elektrische Entladungen gekennzeichnet ist, die in Frequenz, Amplitude und Morphologie variieren können. - Berechnen Sie das realistische Kopfmodell aus drei Schichten (d. h. Kopfhaut, innerer Schädel und äußerer Schädel) für die MEG- und EEG-Sensoren mit der OpenMEEG BEM-Software, die in Brainstorm verfügbar ist. Verwenden Sie das MRT-Volumen als Quellraum (Quelle-Punkt-Gitter mit 5 mm räumlicher Auflösung).
HINWEIS: Um das Vorwärtsmodell mit der FEM zu lösen, berechnen Sie das realistische Kopfmodell, das als geometrisches Modell mit drei bis fünf Schichten (d. h. weiße Substanz, graue Substanz, Liquor, Schädel und Haut) definiert ist, unter Verwendung der DUNEuro FEM-Software, die in Brainstorm 47,50,51 verfügbar ist. Weitere Einzelheiten zur Schätzung des Forward-Modells mit FEM finden Sie an anderer Stelle (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Lokalisieren Sie die zugrunde liegenden Generatoren der ausgewählten iktalen Entladungen mit der uneingeschränkten ECD-Methode auf dem MEG-, EEG- und kombinierten MEG- und EEG-Sensorarray separat. Um diese Dipolquellen zu lokalisieren, berechnen Sie die Rauschkovarianz aus den MEG-Aufnahmen im leeren Raum oder stellen Sie sie als Identitätsmatrix ein.
- Führen Sie die in Brainstorm verfügbare Dipol-Scanning-Methode am Höhepunkt jeder zuvor markierten iktalen Wellenform durch, um die signifikantesten Quelldipole über das gesamte Gehirnvolumen auszuwählen. Wählen Sie nur Quelldipole mit einer Anpassungsgüte von >60 %) aus, und schätzen Sie deren Clustergröße (Abstand der Dipole von der Mitte jedes Dipols auf 15 mm festgelegt)52.
- Kartierung des eloquenten Kortex
- Führen Sie die zuvor beschriebenen Schritte 4.2.1-4.2.3 mit den Signalen durch, die während der visuomotorischen Aufgabe sowie während der auditiven und somatosensorischen Stimulation aufgezeichnet wurden.
- Öffnen Sie die gleichzeitigen MEG- und HD-EEG-Aufzeichnungen und überprüfen Sie die Rohdaten visuell, um fehlerhafte Kanäle zu entfernen. Wenden Sie separat für jede Sitzung die in Brainstorm47 verfügbare SSP-Artefaktkorrekturtechnik an, um biologische Artefakte (z. B. Herzschläge, Augenblinzeln) aus den Aufzeichnungen zu verwerfen. Verwerfen Sie außerdem alle Datensegmente, die durch Artefakte kontaminiert sind und nicht für die weitere Analyse verwendet werden können, oder markieren Sie sie als "Ungültiges Intervall".
- Wenden Sie Kerbfilter (entweder 50 oder 60 Hz, je nach Netzstörung) und Bandpassfilter (1-100 Hz) auf die gleichzeitigen MEG- und HD-EEG-Daten an.
- Um den motorischen Kortex zu kartieren, öffnen Sie die von den FDI- und APB-Elektroden aufgezeichneten EMG-Signale und markieren Sie manuell das vom Probanden durchgeführte Klopfereignis, getrennt für die rechte und linke Hand, indem Sie den ersten Peak der Muskelaktivierung auswählen, der sich von der Grundlinie auf dem FDI-Elektrodenpaar unterscheidet. Führen Sie diesen Schritt separat für jede Sitzung mit Brainstorm47 aus.
HINWEIS: Verwenden Sie die Registerkarte Filter nur für die Visualisierung in Brainstorm und wählen Sie Frequenzbereiche aus (z. B. Hochpass: 30 Hz; Tiefpass: 300 Hz; Kerbe: 60 Hz), die dazu beitragen können, die Spitzen der EMG-Aktivität beim Tippen korrekt zu markieren. Der Name der Ereignisse muss in allen Sitzungen identisch sein. Ereignisse, bei denen die Person mit dem rechten Finger (oder dem linken Finger) getippt hat, können z. B. als "Tap_right" (oder "Tap_left") bezeichnet werden. Dieser Schritt ermöglicht es uns, eine eindeutige Analyse für denselben Ereignistyp durchzuführen, der in allen Sitzungen aufgetreten ist. - Importieren Sie aus jeder Sitzung die Ereignisse, die in artefaktfreien Segmenten auftreten, indem Sie die folgenden Parameter auswählen: visuelle Stimuli: [-200; +500] ms Zeitfenster, einschließlich der Basislinie von [-200; 0] ms vor dem Einsetzen des Stimulus; Klopfereignisse: [-1500; +1000] ms Zeitfenster, einschließlich der Grundlinie von [-1500; -1000] ms vor dem Einsetzen des visuellen Stimulus; modulierte Chirp-Geräusche: [-500; +1000] ms Zeitfenster, einschließlich der Grundlinie von [-500; 0] ms vor dem Einsetzen des Stimulus; und taktile Stimuli: [-100; +500] ms Zeitfenster, einschließlich der Baseline von [-100; 0] ms vor dem Einsetzen des Stimulus.
- Sobald die Ereignisse einer bestimmten Aufgabe aus allen Sitzungen importiert wurden, wenden Sie die durchschnittliche Referenzmontage an, um das SNR auf den EEG-Daten zu erhöhen, und schätzen Sie den Durchschnitt über die Stimuli, um die ereignisevozierten Felder und Potentiale zu erhalten. Bei motorischen Aufgaben (d.h. Klopfen) und taktiler Stimulation wird dieser letzte Schritt für die rechte bzw. linke Hand durchgeführt.
HINWEIS: Die Felder A und B in Abbildung 5, Abbildung 6, Abbildung 7 und Abbildung 8 zeigen Beispiele für visuelle, motorische, auditive bzw. somatosensorisch evozierte Reaktionen für MEG und EEG sowie deren relative Topographiefeld- und Potentialkarten. Die Gesamtzahl der Stimuli für eine bestimmte Aufgabe hängt streng von der Anzahl der abgeschlossenen Sitzungen ab. Bei der motorischen Aufgabe hängt diese Zahl auch von der korrekt ausgeführten Gewindebohraufgabe ab. - Berechnen Sie für die visuellen, motorischen, auditiven oder somatosensorisch evozierten Felder und Potentiale das realistische Kopfmodell aus drei Schichten (d. h. Kopfhaut, innerer Schädel und äußerer Schädel) für die MEG- und EEG-Sensoren mit der OpenMEEG BEM-Software, die in Brainstorm verfügbar ist. Verwenden Sie die kortikale 3D-Oberfläche als Quellraum.
HINWEIS: Um das Vorwärtsmodell mit der FEM zu lösen, berechnen Sie das realistische Kopfmodell, das als geometrisches Modell mit drei bis fünf Schichten (d. h. weiße Substanz, graue Substanz, Liquor, Schädel und Haut) definiert ist, unter Verwendung der DUNEuro FEM-Software, die in Brainstorm 47,50,51 verfügbar ist. Weitere Einzelheiten zur Schätzung des Forward-Modells mit FEM finden Sie an anderer Stelle (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Berechnen Sie für jedes ereignisevozierte Feld und jedes Potenzial die kortikalen Quellen auf den gemittelten Ereignissen mit dSPM, das in der Brainstorm-Toolbox für das MEG-, EEG- und kombinierte MEG- und EEG-Sensorarray separat implementiert ist. Stellen Sie die Rauschkovarianzmatrix unter Verwendung der für jede Aufgabe spezifischen Basisperiode vor dem Stimulus ein (siehe Schritt 4.3.5).
- Extrahieren Sie je nach Aufgabenstellung die maximalen kortikalen Quellen, die an dem beteiligten eloquenten Hirnareal [primärer visueller Kortex (V1), primärer motorischer Kortex (M1), primärer auditorischer Kortex (A1) oder primärer somatosensorischer Kortex (S1)] beobachtet werden können, die entweder mit Hilfe eines Atlas oder durch die Rekonstruktion eines virtuellen Sensors (d. h. Region of Interest, ROI) an diesem Ort definiert werden können (Abbildung 5C, Abbildung 6C, Abbildung 7C und Abbildung 8C).
- Führen Sie die Morlet-Wavelet-Zeit-Frequenz-Zerlegung auf dem ereignisevozierten Feld und den potentiellen Quellen im beteiligten eloquenten Hirnareal (V1, M1, A1 oder S1) mit einer linearen Skala (Frequenzbereich: 1:1:100 Hz) durch.
HINWEIS: Zur Abschätzung evozierter Schwingungen, die zeit- und phasengebunden an den Stimulusbeginn sind, wird das MEG/EEG-Signal zunächst über Ereignisse gemittelt und dann einer Zeit-Frequenz-Analyseunterzogen 53,54. - Führen Sie eine Standardisierung der kortikalen Quellkarten mit der in Brainstorm verfügbaren ereignisbezogenen Störungsmethode durch, um sie in Bezug auf die Basislinie (siehe Schritt 4.3.5) separat für jedes Ereignis zu normalisieren (Abbildung 5D, Abbildung 6D, Abbildung 7D und Abbildung 8D).
HINWEIS: Die Standardisierung von Quellkarten unter Verwendung ereignisbezogener Störungen ist ein Normalisierungsmaß für Zeit-Frequenz-Leistungskarten, das die Abweichung vom Mittelwert über der Basislinie in Prozent schätzt. Weitere Einzelheiten zu diesem Standardisierungsprozess finden Sie an anderer Stelle (https://neuroimage.usc.edu/brainstorm/Tutorials/TimeFrequency#Normalized_time-frequency_maps).
- Validierung
- Erwerben Sie eine extraoperative iEEG-Aufzeichnung durch die Implantation von subduralen Gittern und/oder Tiefenelektroden. Die Anzahl, Art und Platzierung der intrakraniellen Elektroden wird vom multidisziplinären Epilepsieteam auf der Grundlage der klinischen Hypothese entschieden, die aus der Summe der Informationen aus den nicht-invasiven diagnostischen Tests der präoperativen Bewertung generiert wird.
HINWEIS: Im Rahmen der präoperativen Abklärung wird das extraoperative iEEG über mehrere Tage über ein digitales EEG-System mit einer Abtastrate von 1.024 Hz aufgezeichnet. - Identifizieren Sie die SOZ, wie sie von einem erfahrenen Epileptologen auf der Grundlage der für jeden Probanden verfügbaren klinischen Informationen definiert wurde.
HINWEIS: Die SOZ ist definiert als das Hirnareal, das die erste eindeutige iktale elektrographische Entladung zeigt, die sich von der Hintergrundaktivität unterscheidet, die entweder vor oder gleichzeitig mit dem klinisch definierten iktalen Beginn auftreten kann. Alle Kanäle, die an dieser iktalen elektrographischen Entladung beteiligt sind, werden als SOZ-Kontakte betrachtet, auch wenn sie Anfälle erfassen, die aus verschiedenen Hirnarealen stammen. - Markieren Sie während des im iEEG aufgezeichneten iktalen Ereignisses den Höhepunkt jedes Ausbruchs epileptiformer Entladungen, die an jeder intrakraniellen Elektrode auftreten, und führen Sie eine Quellenlokalisierung dieser iktalen Ereignisse mit der ECD-Methode durch, wie zuvor in den Schritten 4.1.7 bis 4.1.10 beschrieben.
- Vergleichen Sie die iEEG-Lokalisierungsergebnisse mit der klinisch definierten SOZ als Goldstandard für die Ergebnisse der Lokalisierung an der Quelle.
- Erwerben Sie eine extraoperative iEEG-Aufzeichnung durch die Implantation von subduralen Gittern und/oder Tiefenelektroden. Die Anzahl, Art und Platzierung der intrakraniellen Elektroden wird vom multidisziplinären Epilepsieteam auf der Grundlage der klinischen Hypothese entschieden, die aus der Summe der Informationen aus den nicht-invasiven diagnostischen Tests der präoperativen Bewertung generiert wird.
Ergebnisse
Pädiatrische Patienten mit DRE wurden aus der Epilepsieklinik des Jane and John Justin Institute for Mind Health, Cook Children's Health Care System (CCHCS), rekrutiert. Hier werden Daten von drei repräsentativen Patienten vorgestellt: (i) eine 10-jährige Frau, (ii) ein 13-jähriger Mann und (iii) eine 10-jährige Frau.
Fall 1: Eine 10-jährige Hündin wurde mit Krampfanfällen ab dem Alter von drei Jahren eingeliefert. Der Patient litt auch nach der Verabreichung von 8 ASMs unter täglichen Anfällen. Die ersten Anfälle waren gekennzeichnet durch Augenabweichung (unklare Seite) und Verhaltensstillstand. Später erlebte der Patient tägliche Anfälle von ~30 s, die durch iktales Schmollen ("chapeau de gendarme"-Zeichen), Kopfabweichung nach links und bilaterale tonische Armversteifung (rechte Prädominanz) gekennzeichnet waren. Das Langzeit-Video-EEG zeigte zwei Häufungen von asymmetrischen tonischen Anfällen mit einer Kopfabweichung nach links, gefolgt von ihrem linken Arm, der nach oben kam. Drei tonische Anfälle wurden auch im Schlaf beobachtet, mit häufigen Läufen generalisierter schneller Polyspikes und langsamer Wellen mit intermittierender Augenöffnung, Blick nach oben und Anhebung des linken oder rechten Arms. Diese Polyspikes und Slow-Sleep-Wellen waren hauptsächlich vom linken mittleren Temporallappen aus prominent. Die MRT des Gehirns zeigte die folgenden multifokalen Dysplasien: (i) fokale kortikale Dysplasie (FCD des postzentralen Gyrus) des linken Parietallappens (Postcentralys) mit Transmantle-Zeichen (FCD Typ II), (ii) FCD des rechten parietookzipitalen Übergangs und (iii) FCD des linken Schläfenpols. Die Positronen-Emissions-Tomographie (PET) zeigte in der MRT-Untersuchung einen Hypometabolismus im linken Parietallappen, im linken Temporallappen und im rechten parietooccipitalen Übergang, der den Herden der Signalanomalie (d. h. FCD) entspricht. Bei dem Patienten wurde eine hartnäckige Epilepsie diagnostiziert, mit stereotyper Semiologie des Chapeau, gefolgt von einer tonischen Armversteifung, was auf einen möglichen mesialen frontalen oder insularen/temporalen Beginn hindeutet. Es wurde eine umfangreiche bilaterale Stereo-EEG (sEEG)-Exploration empfohlen, die auf den Frontallappen, das Cingulum, die Insula und die Regionen der Dysplasie abzielte. Während der iEEG-Überwachung hatte der Patient typische Anfälle mit "Chapeau de gendarme", gefolgt von einer tonischen Hebung/Flexion der rechten oder linken oberen Extremität, die durch einen diffusen EEG-Beginn gekennzeichnet war, maximal über der bilateralen vorderen Insula. Multifokale IEDs wurden hauptsächlich am rechten und linken vorderen Temporallappen und am dorsolateralen frontalen Kortex beobachtet, einschließlich der bilateralen Insula. Die ESI, die mit iEEG-Aufzeichnung durchgeführt wurde, bestätigte die Lokalisation der SOZ, die klinisch bilateral am linken und rechten dorsolateralen frontalen Kortex und der vorderen Insula definiert wurde.
Im Rahmen der präoperativen Evaluation wurde eine Quellenlokalisierung auf den simultanen MEG- und HD-EEG-Daten durchgeführt. MEG- und HD-EEG-Aufzeichnungen zeigten häufige IEDs in beiden frontotemporalen Regionen. Abbildung 3A zeigt ein repräsentatives Beispiel für eine IED sowohl auf MEG- als auch auf HD-EEG-Daten; Das topographische Feld und die mögliche Kartierung beider Modalitäten deuteten auf eine mögliche zugrundeliegende Quelle in der rechten frontotemporalen Region hin. ESI zeigte eine verstreute Ansammlung von Dipolen, die Bereiche des rechten und linken frontotemporalen und parietalen Lappens bedeckten. MSI zeigte einen fokalen Cluster von Dipolen im rechten frontotemporalen Lappen, der sich in der Nähe der rechten Insula befindet. EMSI zeigte fokale Cluster von Dipolen in den bilateralen frontotemporalen Regionen an, in Übereinstimmung mit der ESI, die am iEEG-Goldstandard durchgeführt wurde und die klinischen Beobachtungen bestätigte (Abbildung 3C). Diese Dipole, die durch EMSI geschätzt wurden, zeigten einen mittleren Abstand von der iEEG-definierten SOZ von 9,81 mm (Median: 11,18; std: 2,37).
Fall 2: Ein 13-jähriger Mann mit hartnäckiger Epilepsie wurde mit Anfällen ab dem Alter von neun Jahren eingeliefert. Die Anfälle begannen mit einer Aura, gefolgt von einer linksgerichteten Kopf-/Augenabweichung mit zeitweise erhaltenem Bewusstsein und fokalem Klonus des Kopfes nach links, dauerten ~30 s und traten mehrmals pro Woche auf. Keines der verschriebenen ASMs erreichte eine Anfallskontrolle. Im Langzeit-Video-EEG beobachteten wir rechts-posteriore temporale Spikes und häufige Spike-Wellen-Entladungen in der rechten Hemisphäre, an denen der mittlere temporale, frontotemporale, temporoparietale und zentroparietale Kortex beteiligt war. Der Patient hatte sechs elektroklinische Anfälle, die durch eine Verhaltensänderung, eine Kopf-/Augenabweichung nach links mit gestrecktem linken Arm und manchmal klonische Aktivität des linken Arms gekennzeichnet waren, und drei Anfälle mit sekundärer bilateraler konvulsiver Aktivität. Der maximale Beginn erfolgte am rechten mittleren Temporallappen mit einer Evolution im rechten frontotemporalen Lappen. Die MRT des Gehirns zeigte eine ausgedehnte Fehlbildung der Hirnrinde in der rechten Hirnhälfte (perisylvisch vorherrschend) und einen leichten Volumenverlust in der rechten Hirnhälfte mit ex vacuo-Dilatation des rechten lateralen Ventrikels. Bei der Patientin wurde eine hartnäckige Epilepsie diagnostiziert, die in der rechten Hemisphäre begann und den temporalen und perisylvischen Beginn im Bereich der diffusen kortikalen Fehlbildung begünstigte. Um das Ausmaß der Beteiligung abzugrenzen, wurde ein Stereo-EEG durchgeführt, wobei die Elektroden in der rechten temporalen, perisylvischen, insularen und parietooccipitalen Kortex platziert wurden. Während des iEEG-Monitorings wurden mehrere elektroklinisch fokale Anfälle mit maximalen Anfällen in einem weiten Bereich des rechten Frontotemporallappens erfasst. Die ESI, die an iEEG-Daten durchgeführt wurde, lokalisierte diese Anfälle in einem stärker fokussierten Bereich, der sowohl den rechten temporalen (in der Nähe des rechten mittleren temporalen Gyrus) als auch den perisylvianischen Bereich umfasst.
Im Rahmen der präoperativen Untersuchung wurde ein simultanes MEG und HD-EEG durchgeführt, bei dem der Patient zwei Anfälle erlitt: einen während des Digitalisierungsprozesses auf dem Holzstuhl sitzend und einen während der eigentlichen Aufzeichnung, wobei der Beginn sowohl im MEG als auch im HD-EEG sichtbar war (Abbildung 4A). Das topographische Feld und mögliche Karten zu Beginn des iktalen Beginns deuteten darauf hin, dass der zugrunde liegende Generator des Anfallsbeginns am rechten mittleren Temporallappen liegen könnte, wie in Abbildung 4A dargestellt. Die Lokalisation des iktalen Ereignisses ergab unterschiedliche Befunde für ESI und MSI: ESI zeigte Dipole, die in Richtung des rechten frontotemporalen und zentroparietalen Lappens lokalisiert waren, während MSI Dipole mit hoher Clusterbildung hauptsächlich am rechten Temporallappen zeigte (Abbildung 4B), mit zusätzlichen verstreuten Dipolen im frontotemporalen Kortex. Durch die Kombination dieser Lösungen konnte EMSI eine Lokalisation des iktalen Beginns innerhalb des Temporallappens nachweisen, die mit dem ESI auf dem iEEG-Goldstandard übereinstimmt (Abbildung 4B). Insbesondere präsentierte EMSI Lokalisationsergebnisse mit einem mittleren Abstand von der durch das iEEG-Monitoring definierten SOZ von 12,21 mm (Median: 13,62; std: 2,37).
Fall 3: Eine 15-jährige Frau mit lokalisationsbedingter idiopathischer Epilepsie wurde mit Anfällen ab dem Alter von 13 Jahren aufgenommen, möglicherweise aber im Nachhinein mit 8-9 Jahren, als bei ihr Tics aufgrund von sich wiederholenden, stereotypen Nackenbewegungen diagnostiziert wurden. Der Patient hatte kurze Kopfneigungen nach links, die manchmal zu fokalen dyskognitiven Anfällen mit hypermotorischen Verhaltensweisen (d. h. generalisierten tonisch-klonischen Anfällen) sowie zu nächtlichen Krampfanfällen führten. Mehrere ASMs wurden verabreicht, ohne eine vollständige Anfallskontrolle zu erreichen. Während der Langzeit-Video-EEG-Überwachung hatte der Patient fokale elektroklinische Anfälle mit sekundärer Generalisierung mit Beginn am linken hinteren Temporallappen, zahlreiche kurze fokale motorische Anfälle mit Kopfneigung nach links und einen subtilen elektrographischen Anfall mit Beginn am linken zentroparietalen Kortex. Die MRT des Gehirns ergab keine akute intrakranielle Anomalie und eine Chiari-I-Fehlbildung. Die Positronen-Emissions-Tomographie-Computertomographie (PET-CT) Untersuchung des Kopfes fiel negativ aus. Zusätzliche Untersuchungen, wie z. B. iktale Einzelphotonen-Emissions-CT (SPECT), simultanes MEG und HD-EEG, Röntgenaufnahmen der Halswirbelsäule, Magnetresonanzangiographie (MRA) des Kopfes und Halses und schließlich sEEG-Exploration der linken Hemisphäre, wurden empfohlen.
Im Rahmen der Evaluation nahm der Patient an gleichzeitigen MEG- und HD-EEG-Aufzeichnungen teil, um eloquente Hirnareale wie den primären visuellen, motorischen, auditiven und somatosensorischen Kortex zu kartieren. Zunächst führte der Patient eine visuomotorische Aufgabe aus, gefolgt von auditiven und somatosensorischen Stimulationen. Die erste kortikale Reaktion auf die visuelle Stimulation erfolgte ~70 ms nach Stimulusbeginn sowohl für MEG als auch für HD-EEG (Abbildung 5A). Abbildung 5B berichtet über das Topographiefeld und mögliche Karten der kortikalen Lokalisationen, die an der visuellen Stimulation für MEG bzw. HD-EEG beteiligt sind. Für das HD-EEG wurde eine Änderung der Polarität in den Kanälen beobachtet, die die okzipitalen Hirnareale abdecken, während für das MEG eine komplexere Feldverteilung in den gleichen Bereichen gefunden wurde (Abbildung 5B). Die Lokalisierung der Quelle mittels dSPM zeigte zu diesem Zeitpunkt eine fokale kortikale Aktivität in den folgenden Hirnregionen des Desikan-Killiany-Atlas: (i) cuneus für MSI; (ii) lateraler okzipitaler Kortex für ESI; und (iii) Cuneus und lateraler okzipitaler Kortex für EMSI (Abbildung 5C). Die Zeit-Frequenz-Analyse der Reaktionen der visuellen Kortikalis ergab eine ereigniskorrelierte Synchronisation (ERS) im Gamma-Frequenzband für MSI (ungefährer Bereich: 30-50 Hz), ESI (ungefährer Bereich: 40-50 Hz) und EMSI (ungefährer Bereich: 30-50 Hz) (Abbildung 5D). Bei den motorisch evozierten Reaktionen wurde eine Unterdrückung der mu-Rhythmus-Aktivität über dem kontralateralen M1 während des Bewegungsbeginns beobachtet (Abbildung 6A). In Abbildung 6Bberichteten wir über das Topographiefeld und die Potentialkarten der Hirnareale, die während der motorischen Aufgabe für MEG bzw. HD-EEG aktiviert wurden. MEG-Feldkarten zeigten deutliche Veränderungen des magnetischen Ein- und Ausflusses in den kontralateralen zentralen Hirnarealen, was auf einen zugrundeliegenden fokalen Generator im kontralateralen M1 hinweisen könnte (Abbildung 6B). HD-EEG-Potentialkarten zeigten eine fokale Polaritätsänderung in den gleichen Bereichen, wobei elektrische Potentiale senkrecht zu den Magnetfeldern (Abbildung 6B). Die Spitzen der maximalen Quellenaktivierung wurden bei der Durchführung der Klopfaufgabe am kontralateralen präzentralen Gyrus des Desikan-Killiany-Atlas für MSI, ESI bzw. EMSI beobachtet, wie in Abbildung 6C. Motorische kortikale Reaktionen, die während der Erwartung der bevorstehenden Klopfbewegung auftraten, zeigten ERS in Beta- und Gamma-Bändern für MSI (ungefährer Bereich: 20-30 Hz) und EMSI (ungefährer Bereich: 20-40 Hz) und Gamma-Band für ESI (ungefährer Bereich: 30-50 Hz), in der Literatur als bezeichnet mu rhythm suppression (Abbildung 6D).55,56 Hörevozierte Felder und Potentiale als Reaktion auf auditive Stimulation hatten einen maximalen positiven Peak bei ~80 ms bzw. ~120 ms nach dem Einsetzen des Stimulus für MEG bzw. HD-EEG (Abbildung 7A). In Abbildung 7Bberichteten wir über das Topographiefeld und mögliche Karten der kortikalen Lokalisationen, die an der auditiven Stimulation für MEG bzw. HD-EEG beteiligt sind. Sowohl im MEG als auch im HD-EEG wurde eine deutliche Polaritätsänderung mit klar definierten negativen und positiven Polen an den Sensoren beobachtet, die die linken temporalen Hirnareale abdecken; Diese senkrechten Magnetfeld- und elektrischen Potentialkarten könnten einen zugrunde liegenden fokalen Generator in V1 (Abbildung 7B). Bei der Lokalisierung der Quelle an den gemittelten auditiv evozierten Feldern und Potentialen wurde eine maximale kortikale Aktivierung am transversalen Gyrus temporalis und am hinteren Teil des Gyrus temporalis superior des Desikan-Killiany-Atlas für MSI, ESI bzw. EMSI beobachtet (Abbildung 7C). Die Zeit-Frequenz-Analyse auditiv evozierter Reaktionen ergab ERS im Gamma-Band für MSI (ungefährer Bereich: 40-60 Hz) und EMSI (ungefährer Bereich: 35-50 Hz) und im Beta- und Gamma-Frequenzband (ungefährer Bereich: 25-60 Hz) für ESI (Abbildung 7D). Schließlich beobachteten wir die erste kortikale Aktivität als Reaktion auf die taktile Stimulation bei ~60 bzw. ~50 ms nach dem Stimulusbeginn für MEG bzw. HD-EEG (Abbildung 8A). In Abbildung 8Bberichteten wir über das Topographiefeld und potentielle Karten der Hirnareale, die während der somatosensorischen Stimulation für MEG bzw. HD-EEG aktiviert wurden. MEG-Feldkarten zeigten eine deutliche Polaritätsänderung mit deutlichen Veränderungen des magnetischen Flusses an Sensoren, die die kontralateralen parietalen Bereiche abdecken, während HD-EEG-Potentialkarten eine weniger offensichtliche Polaritätsänderung in denselben Bereichen mit einem stärkeren positiven Pol als dem negativen Pol zeigten. Diese senkrechten Magnetfeld- und elektrischen Potentialkarten könnten auf einen fokalen kortikalen Generator in S1 hinweisen. Unter Verwendung von dSPM auf die gemittelten somatosensorisch evozierten Reaktionen wurde die maximale kortikale Quellenaktivität zu diesem Zeitpunkt im kontralateralen postzentralen Gyrus des Desikan-Killiany-Atlas für MSI, ESI bzw. EMSI beobachtet (Abbildung 8C). Als Reaktion auf die taktilen Reize wird ERS im Beta- und Gamma-Frequenzband für MSI (ungefährer Bereich: 15-40 Hz) und EMSI (ungefährer Bereich: 20-40 Hz) und im Gamma-Frequenzband für ESI (ungefährer Bereich: 30-40 Hz) (Abbildung 8D) wurden ebenfalls beobachtet.
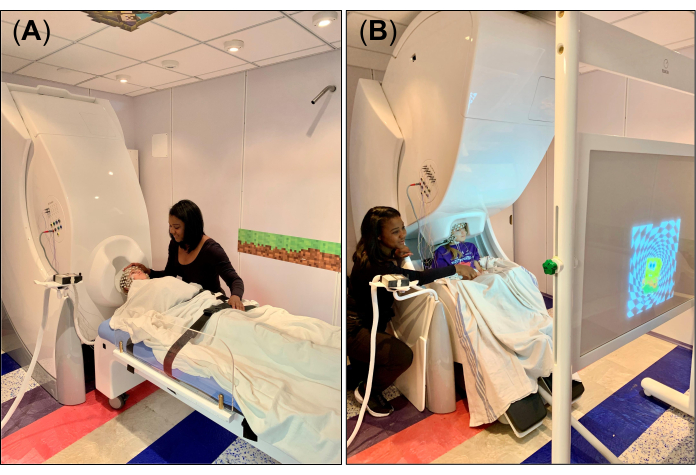
Abbildung 1: Versuchsaufbau für simultanes MEG und HD-EEG an CCHCS. (A) HD-EEG (256 Kanäle) und MEG (306 Sensoren) Systeme, bei denen die Gantry des MEG in Rückenlage (90°, horizontale Position) für eine Ruhe-/Schlafzustandsaufzeichnung mit dem nichtmagnetischen MEG-kompatiblen Bett eingestellt ist. Der Techniker bereitet die Person (ein 9-jähriges Mädchen) für die Aufnahme vor und sorgt gleichzeitig für Sicherheit und Komfort. (B) HD-EEG- und MEG-Systeme, die für eine Aufzeichnung in sitzender Position unter Verwendung des nichtmagnetischen MEG-kompatiblen Stuhls eingestellt sind. Der Techniker bereitet das Subjekt für die Aufnahme vor und stellt gleichzeitig sicher, dass das Subjekt die richtige Position vor dem Bildschirm einnimmt, auf den während der visuomotorischen Aufgabe visuelle Reize projiziert werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
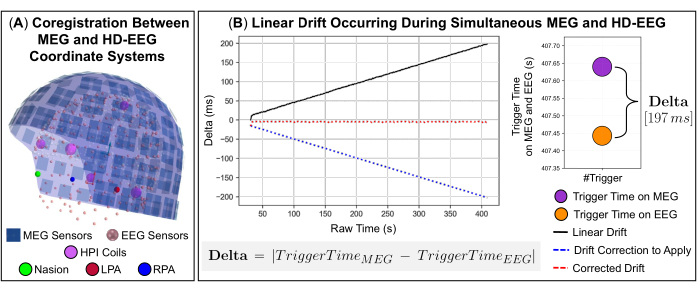
Abbildung 2: Technische Aspekte der Kombination von Daten aus gleichzeitigen MEG- und HD-EEG-Aufzeichnungen unter Verwendung verschiedener Erfassungssysteme. (A) Räumliche Ausrichtung (Koregistrierung) von MEG- und HD-EEG-Sensoren in das gleiche Koordinatensystem (definiert durch die Kopfkoordinaten des Probanden) für ein repräsentatives Subjekt (ein 9-jähriges Mädchen). Die Kopfkoordinaten des Motivs werden durch die folgenden Referenzpunkte dargestellt: nasion (grün) und linke/rechte präaurikuläre Punkte (rot bzw. blau). Angezeigt werden die 306 MEG-Sensoren (blau) - 102 Magnetometer und 204 planare Gradiometer - und die Head-Position-Indicator-Spulen (HPI) (magentafarben); im gleichen Koordinatensystem ausgerichtet sind, werden auch die 256 HD-EEG-Kanäle angezeigt (rosafarben). (B) Linkes Bild: Lineare Drift (d.h. Delta, dargestellt als schwarze Linie) von Datenproben, die zwischen MEG- und HD-EEG-Systemen für ein repräsentatives Subjekt (ein 9-jähriges Mädchen) auftreten. Delta ist definiert als der absolute Wert der Differenz zwischen den Zeiten, in denen derselbe Auslöser sowohl an MEG- als auch an EEG-Systeme gesendet wird, und steigt im Laufe der Zeit kontinuierlich an: von niedrigen (Delta = 0 ms) zu hohen (Delta = 197 ms) Werten. Die Korrektur der linearen Drift, die mit einer Polynomfunktion geschätzt wird, die auf die Signale angewendet werden soll, wird mit einer blauen gestrichelten Linie angezeigt. Die korrigierte Drift (Delta ~0 ms über die Zeit), die eine synchronisierte Zeit zwischen MEG- und EEG-Systemen darstellt, wird mit einer roten gestrichelten Linie angezeigt. Rechtes Bild: Es wird eine grafische Darstellung der Zeitverschiebung (Delta = 197 ms) angezeigt, die für den letzten Trigger geschätzt wurde, der sowohl an das MEG- als auch an das EEG-System gesendet wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
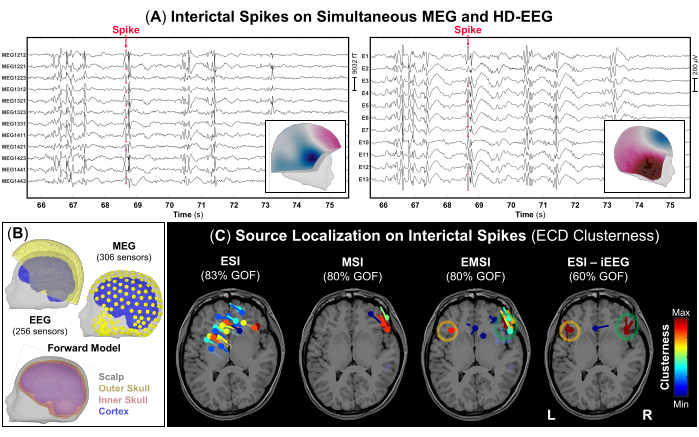
Abbildung 3: Interiktale epileptiforme Entladungen (IEDs) auf MEG- und HD-EEG-Daten. (A) Zeitanteil der gleichzeitigen MEG- und HD-EEG-Aufzeichnung (10 s) bei einer 10-jährigen Frau (Fall 1) mit häufigen IEDs. Für Visualisierungszwecke wurde eine Untergruppe der 306 MEG-Sensoren und 256 EEG-Elektroden ausgewählt. Das Topographiefeld und die Potentialkarten am Höhepunkt einer IED werden als innere Felder für MEG bzw. HD-EEG dargestellt. (B) Position von MEG- und HD-EEG-Sensoren (gelb gefärbt), die auf dem 3D-Kopf und der kortikalen (blau) Oberfläche des Probanden koregistriert sind. Realistisches Kopfmodell der Grenzelementmethode (BEM), bestehend aus drei Schichten [d. h. Kopfhaut (grau gefärbt), äußerer Schädel (gelb gefärbt) und innerer Schädel (rosa gefärbt)], rekonstruiert aus der präoperativen MRT des Probanden. (C) Die Clusterness-Ergebnisse der Lokalisierung der Quelle, die an IEDs mit äquivalentem Stromdipol (ECD) durchgeführt wurden, werden in der präoperativen MRT des Probanden für ESI, MSI, EMSI und ESI im iEEG (Goldstandard) gezeigt52. Heatmaps der Dipolclusterbildung mit einer Anpassungsgüte von >60 % werden von niedrigeren (blau) zu höheren (rot) Werten angezeigt. Die durch ESI definierte Anfallszone, die anhand von iEEG-Daten durchgeführt wurde, galt als Goldstandard (orangefarbene und grüne Kreise). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
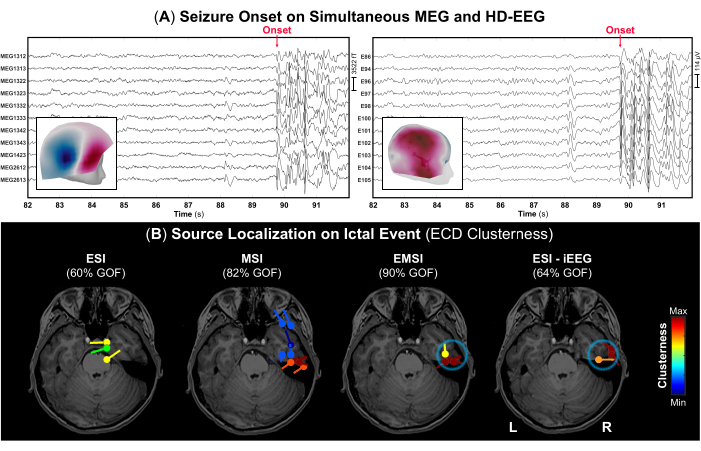
Abbildung 4: Anfallsbeginn anhand von MEG- und HD-EEG-Daten. (A) Zeitteil der gleichzeitigen MEG- und HD-EEG-Aufzeichnung (10 s) eines 13-jährigen Mannes (Fall 2) mit dem Beginn des Anfalls (roter Pfeil). Für Visualisierungszwecke wurde eine Untergruppe der 306 MEG-Sensoren und 256 EEG-Elektroden ausgewählt. Topographiefeld- und Potentialkarten zu Beginn des iktalen Beginns werden als innere Panels für MEG bzw. HD-EEG dargestellt. (B) Die Clusterness-Ergebnisse der Lokalisierung der Quelle, die zu Beginn des iktalen Ereignisses mit der ECD-Methode (Equivalent Current Dipol) durchgeführt wurden, werden in der präoperativen MRT des Probanden für ESI, MSI, EMSI und ESI im iEEG (Goldstandard) gezeigt52. Heatmaps der Dipolclusterbildung mit einer Anpassungsgüte von >60 % werden von niedrigeren (blau) zu höheren (rot) Werten angezeigt. Die durch ESI anhand von iEEG-Daten definierte Zone für den Anfallsbeginn wurde als Goldstandard angesehen (blauer Kreis). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
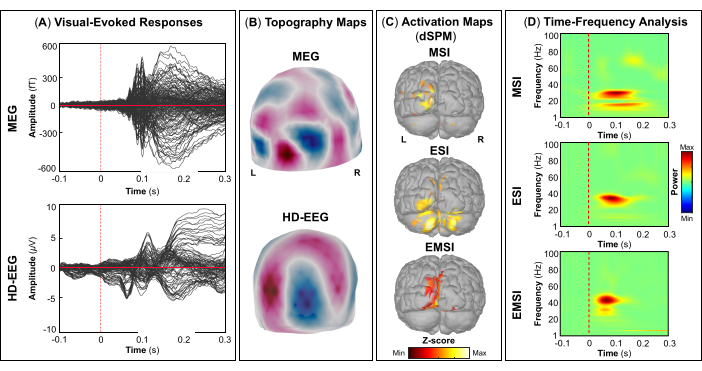
Abbildung 5: Visuell evozierte Felder und Potentiale aus MEG- und HD-EEG-Daten. (A) Gemittelte visuell evozierte Reaktionen einer 15-jährigen Frau auf MEG (oberes Feld) und HD-EEG (unteres Bild) werden für das Zeitintervall zwischen -100 ms und 300 ms dargestellt. (B) Topographiefeld- und Potentialkarten des primären visuellen Kortex werden für MEG und HD-EEG dargestellt, beziehungsweise. (C) Quellaktivierungskarten mit maximalen Amplituden der kortikalen Aktivierung an Hirnregionen des Desikan-Killiany-Atlas (nämlich Cuneus und lateraler okzipitaler Kortex), geschätzt unter Verwendung der dynamischen statistisch-parametrischen Kartierungsmethode (dSPM) für MSI, ESI bzw. EMSI. Es werden Heatmaps der Quellenaktivierung (dSPM-normalisierter Z-Score) angezeigt. (D) Zeit-Frequenz-Karten, die mit Hilfe der Morlet-Wavelet-Zeit-Frequenz-Zerlegung der visuell evozierten Reaktionen am primären visuellen Kortex erhalten wurden, werden für das Zeitfenster von -100 ms bis 300 ms angezeigt. Es werden Heatmaps der Zeit-Frequenz-Leistung angezeigt, ausgedrückt in Prozentsätzen, die auf der Abweichung der normierten Daten vom Mittelwert über die Basislinie [-200; 0] ms basieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
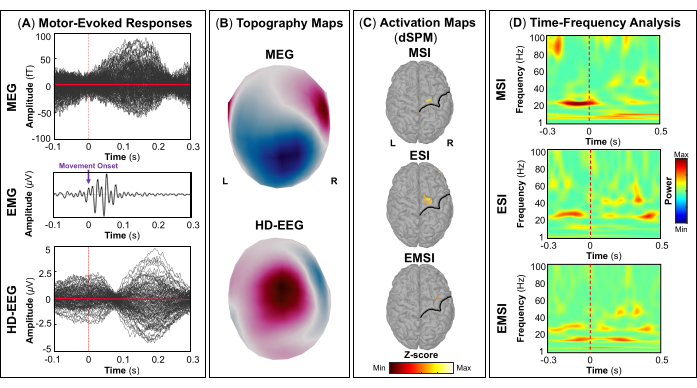
Abbildung 6: Motorisch evozierte Felder und Potentiale aus MEG- und HD-EEG-Daten. (A) Die gemittelten motorisch evozierten Reaktionen einer 15-jährigen Frau auf MEG (oberes Feld) und HD-EEG (unteres Feld) sind für die linke Indexklopfaufgabe im Zeitintervall zwischen -100 und 300 ms dargestellt. Das Elektromyographie (EMG)-Signal (mittleres Feld) mit dem Bewegungsbeginn (violetter Pfeil) wird für das Zeitintervall zwischen -100 ms und 300 ms angezeigt; Das Signal wird im Frequenzband 30-300 Hz gefiltert (Notch-Filter: 60 Hz). (B) Topographiefeld- und Potentialkarten des primären motorischen Kortex werden für MEG bzw. HD-EEG dargestellt. (C) Quellaktivierungskarten mit maximalen Amplituden der kortikalen Aktivierung am kontralateralen präzentralen Gyrus des Desikan-Killiany-Atlas, geschätzt mit der dynamischen statistisch-parametrischen Kartierungsmethode (dSPM) für MSI, ESI bzw. EMSI. Heatmaps der Quellenaktivierung (dSPM-normalisierter Z-Score) werden zusammen mit dem zentralen Sulcus (schwarze Linie) angezeigt. (D) Zeit-Frequenz-Karten, die unter Verwendung der Morlet-Wavelet-Zeit-Frequenz-Zerlegung der motorisch evozierten Reaktionen am primären motorischen Kortex für das Zeitfenster von -300 ms bis 500 ms erhalten wurden. Es werden Heatmaps der Zeit-Frequenz-Leistung angezeigt, ausgedrückt in Prozentsätzen, die auf der Abweichung der normierten Daten vom Mittelwert über die Basislinie [-1500; -1000] ms basieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
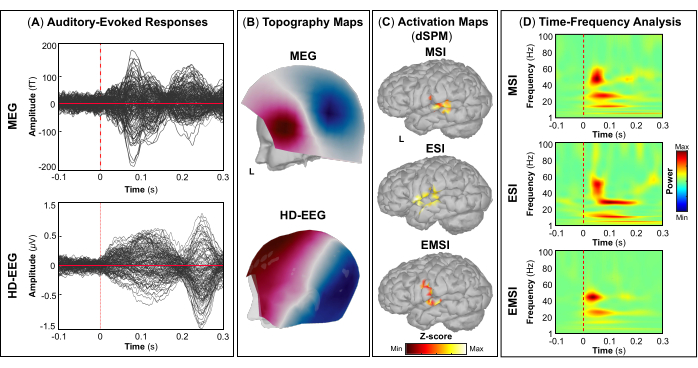
Abbildung 7: Auditorisch evozierte Felder und Potentiale aus MEG- und HD-EEG-Daten. (A) Die gemittelten auditiv evozierten Reaktionen einer 15-jährigen Frau auf MEG (oberes Feld) und HD-EEG (unteres Bild) werden für das Zeitintervall zwischen -100 ms und 300 ms angezeigt. (B) Das Topographiefeld und die Potentialkarten des primären auditorischen Kortex werden für das MEG bzw. HD-EEG angezeigt. (C) Quellaktivierungskarten mit maximalen Amplituden der kortikalen Aktivierung am transversalen Gyrus temporalis und am hinteren Teil des Gyrus temporalis superior des Desikan-Killiany-Atlas, geschätzt mit der Methode der dynamischen statistisch-parametrischen Kartierung (dSPM) für MSI, ESI bzw. EMSI. Es werden Heatmaps der Quellenaktivierung (dSPM-normalisierter Z-Score) angezeigt. (D) Zeit-Frequenz-Karten, die unter Verwendung der Morlet-Wavelet-Zeit-Frequenz-Zerlegung der auditiv evozierten Reaktionen am primären auditorischen Kortex für das Zeitfenster von -100 bis 300 ms erhalten wurden. Es werden Heatmaps der Zeit-Frequenz-Leistung angezeigt, ausgedrückt in Prozentsätzen, die auf der Abweichung der normierten Daten vom Mittelwert über die Basislinie [-500; 0] ms basieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
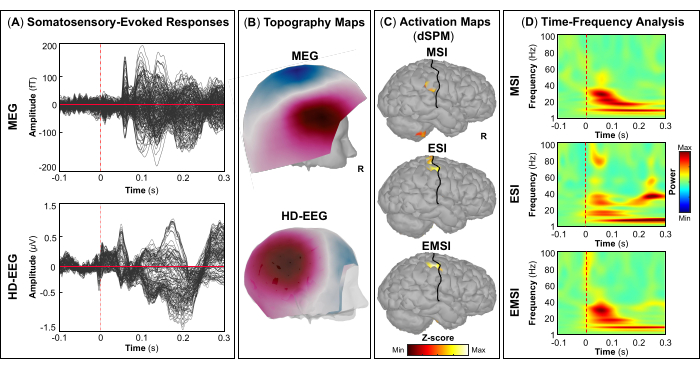
Abbildung 8: Somatosensorisch evozierte Felder und Potentiale aus MEG- und HD-EEG-Daten. (A) Gemittelte somatosensorisch evozierte Reaktionen einer 15-jährigen Frau auf MEG (oberes Feld) und HD-EEG (unteres Feld) werden für die Stimulation der linken Zehen im Zeitintervall zwischen -100 und 300 ms angezeigt. (B) Topographiefeld- und Potentialkarten des primären somatosensorischen Kortex werden für das MEG und HD-EEG angezeigt, beziehungsweise. (C) Quellaktivierungskarten mit maximalen Amplituden der kortikalen Aktivierung am kontralateralen postzentralen Gyrus des Desikan-Killiany-Atlas, geschätzt mit der dynamischen statistisch-parametrischen Kartierungsmethode (dSPM) für MSI, ESI bzw. EMSI. Heatmaps der Quellenaktivierung (dSPM-normalisierter Z-Score) werden zusammen mit dem zentralen Sulcus (schwarze Linie) angezeigt. (D) Zeit-Frequenz-Karten, die unter Verwendung der Morlet-Wavelet-Zeit-Frequenz-Zerlegung der somatosensorisch evozierten Reaktionen am primären somatosensorischen Kortex für das Zeitfenster von -100 ms bis 300 ms erhalten wurden. Es werden Heatmaps der Zeit-Frequenz-Leistung angezeigt, ausgedrückt in Prozentsätzen, die auf der Abweichung der normierten Daten vom Mittelwert über die Basislinie [-100; 0] ms basieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In dieser Studie veranschaulichen wir den experimentellen Aufbau zur gleichzeitigen Aufzeichnung von MEG und HD-EEG bei Kindern mit DRE, während sie sich ausruhen/schlafen, eine Aufgabe ausführen oder Reize empfangen, und schlagen einen methodischen Rahmen für die Lokalisierung der irritativen Zone, der SOZ und der eloquenten Hirnareale mittels EMSI sowie individueller MSI und ESI vor. Darüber hinaus geben wir technische Empfehlungen für die Zusammenführung von MEG- und HD-EEG-Daten aus verschiedenen kommerziell erhältlichen Produkten, die einzigartige Funktionen aufweisen. Wir präsentieren Daten aus drei Fällen, um den klinischen Nutzen von EMSI bei der Lokalisation epileptogener und eloquenter Hirnareale zu verbessern. Die Ergebnisse deuten darauf hin, dass die EMSI-Ergebnisse diejenigen übertreffen, die mit beiden Modalitäten allein erzielt wurden, höchstwahrscheinlich aufgrund des additiven Werts der komplementären Eigenschaften von MEG- und EEG-Signalen in der kombinierten Lösung und möglicherweise aufgrund der erhöhten Anzahl von Sensoren, die zur Aufzeichnung der Daten verwendet werden (>550 Sensoren). Insbesondere lokalisierte EMSI nichtinvasiv die irritativen und SOZs mit übereinstimmenden Befunden als ESI auf iEEG-Goldstandard, was die klinischen Beobachtungen bestätigte.
Die vorgeschlagene Methodik umfasst die folgenden kritischen Schritte: (i) qualitativ hochwertige Erfassung von gleichzeitigen MEG- und HD-EEG-Aufzeichnungen (d. h. hohes SNR) mit hoher räumlicher Abtastung von Sensoren (>550 Sensoren), die das gesamte Gehirn der interiktalen und iktalen Aktivitäten sowie visuelle, motorische, auditive und somatosensorisch evozierte Felder und Potentiale von Kindern mit DRE abdecken (Schritte 3.1-3.2); (ii) zeitliche Synchronisation und räumliche Co-Registrierung von MEG- und HD-EEG-Signalen, die mit unterschiedlichen Erfassungssystemen aufgezeichnet wurden (Schritt 3.12); iii) sorgfältige Vorverarbeitung und Auswahl von Datenteilen, die interiktale Aktivität (Schritte 4.1.1-4.1.7), iktale Onset-Aktivität (Schritte 4.2.1-4.2.7) bzw. ereignisbezogene Reaktionen (Schritte 4.3.1-4.3.6) enthalten; und (iv) genaue Quellenlokalisierung der irritativen Zone, der SOZ und der eloquenten Hirnareale von Interesse unter Verwendung zuverlässiger Quellenlokalisierungsmethoden (z. B. ECDs mit Clustering und dSPM) (Schritte 4.1.8-4.1.9, 4.2.8-4.2.9 bzw. 4.3.7-4.3.9).
Der wichtigste Schritt bei gleichzeitigen MEG- und HD-EEG-Aufzeichnungen besteht darin, die von den beiden Erfassungssystemen aufgezeichneten Daten räumlich (Ausrichtung zwischen den Koordinatenräumen) und zeitlich (Korrektur der linearen Taktdrift) zu synchronisieren. Eine solche Synchronisation ist entscheidend, um die korrekte Identifizierung von interiktalen, iktalen und visuellen/motorischen/auditiven/taktilen Ereignissen zu gewährleisten, die gleichzeitig in den MEG- und HD-EEG-Signalen auftreten. Fehler bei der Auswahl des Zeitpunkts dieser Ereignisse können die Ergebnisse der Lokalisierung der Quelle beeinflussen und Bereiche des Gehirns identifizieren, die nicht unbedingt an der Erzeugung dieser Ereignisse beteiligt sind.
MEG-Systeme bieten häufig kompatible 32-, 64- und 128-Kanal-EEG-Systeme an, die in das Produkt integriert sind, um gleichzeitige MEG- und EEG-Messungen durchzuführen. In diesen Fällen ist es nicht erforderlich, die Daten zeitlich zu synchronisieren, indem gemeinsame Triggersignale gesendet werden. Ebenso sind die meisten EEG-Systeme heutzutage mit allen MEG-Systemen kompatibel. Trotz dieser Fortschritte in der Hardware führen nur wenige Epilepsiezentren gleichzeitige MEG- und HD-EEG-Aufzeichnungen als Teil der präoperativen Abklärung durch. Hier haben wir uns diese Integrierbarkeit zunutze gemacht und die 306-Kanal-MEG- und 256-Kanal-EEG-Systeme kombiniert, um die Gehirnaktivität gleichzeitig mit >550 Sensoren aufzuzeichnen, die den Kopf des Probanden abdecken. Bisher sind nur wenige Software für die erweiterte Analyse von MEG-, HD-EEG- und iEEG-Daten (z. B. Brainstorm, CURRY, EEGLab, FieldTrip, MNE oder NUTMEG) verfügbar. Zukünftige Studien sind daher notwendig, um die vorgeschlagene Methodik mit einer neuen Neuroimaging-Analysesoftware zu validieren. Schließlich erhöhte die Kombination von MSI und ESI zu einer einzigartigen Lösung (EMSI) die Rechenkomplexität der Datenanalyse.
Die beschriebene Methode weist einige Einschränkungen auf, die in zukünftigen Studien berücksichtigt werden sollten. Wir wählten manuell IEDs aus, die sowohl in MEG- als auch in HD-EEG-Daten von zwei repräsentativen Patienten auftraten, während interiktale Spikes, die nur in einem der beiden Signale (entweder MEG oder EEG) auftraten, ignoriert wurden. Die manuelle Auswahl von Spikes kann ein zeitaufwändiger und subjektiver Ansatz sein, der durch automatisierte Ansätze zur Erkennung von IEDs, die in den letzten Jahrzehnten entwickelt wurden, vereinfacht werden kann57,58,59. Eine visuelle Inspektion wird jedoch immer empfohlen, um eine sorgfältige Analyse und eine verfeinerte Erkennung jeder IED zu gewährleisten. Darüber hinaus haben wir die SOZ als Approximator der EZ verwendet. Dennoch sagt die SOZ nicht immer die chirurgischen Ergebnisse voraus60,61,62,63. Zukünftige Studien können daher das chirurgische Ergebnis als Ground Truth für eine genauere Abgrenzung der EZ nutzen13,14,15,16,17,19,20. Obwohl Anfälle erfolgreich mit gleichzeitigem MEG und EEG erfasst und mit geeigneten Techniken zur Lokalisierung der Quelle lokalisiert werden können44,64ist es relativ selten, solche iktalen Ereignisse in der klinischen Praxis zu erfassen, insbesondere bei ambulanten Patienten mit ASMs. Dies ist vor allem auf die begrenzte Dauer der MEG-Aufzeichnungen und die übermäßigen Körperbewegungen zurückzuführen, die während der Anfälle auftreten (z. B. wenn der Kopf des Patienten aus dem Dewar herausrutscht), was zu biologischen Artefakten führen kann, die die Befunde zur Lokalisierung der Quelle stark beeinträchtigen können. In einer kürzlich erschienenen Übersichtsarbeit haben Stefan et al.. berichteten über das Auftreten von Krampfanfällen während MEG-Aufzeichnungen bei 7 % bis 24 % der Patienten, mit einer durchschnittlichen Aufzeichnungszeit von 30 Minuten bis zu 5,7 Stunden in verschiedenen Studien65. Bei CCMC wurden bei 18 von 89 (20,2%) Patienten iktale Ereignisse während gleichzeitiger MEG- und HD-EEG-Aufzeichnungen aufgezeichnet, die in den letzten ~2 Jahren durchgeführt wurden. Allerdings wurden nur 8 der 18 Patienten (44,4%) erfolgreich analysiert. In Fällen, in denen interiktale MEG-Aufzeichnungen normale oder nicht schlüssige Befunde zeigen, kann das iktale MEG oder HD-EEG verwendet werden, um die EZ mit hoher Präzision zu lokalisieren. Es sollten jedoch technische und logistische Anforderungen an diese Aufzeichnungen erfüllt werden. Darüber hinaus wurden die repräsentativen Daten für die eloquente Kortexlokalisation mittels EMSI nicht mit irgendwelchen Goldstandards für die Lokalisation dieser funktionellen Hirnareale, wie z.B. nicht-invasiver fMRT oder intraoperativer elektrokortikaler Stimulation, verglichen. Weitere Untersuchungen können daher EMSI und fMRT in ein multimodales nicht-invasives Bildgebungswerkzeug integrieren, um die Lokalisationsgenauigkeit dieser eloquenten Hirnareale bei Kindern mit DRE zu verbessern. Diese Arbeit kann auch auf die Lokalisierung anderer funktioneller Hirnareale ausgeweitet werden, wie z.B. der sprachsprachlichen Regionen. Die Lokalisierung der Sprachfunktionen ist bei der präoperativen Beurteilung von Patienten mit DRE von entscheidender Bedeutung, um ihre chirurgische Kandidatur zu bestimmen, das Ausmaß der chirurgischen Resektion zu planen und dauerhafte postoperative Funktionsdefizite zu verhindern66. Mehrere nicht-invasive Studien haben gezeigt, dass die Kartierung von Sprachen mit MEG übereinstimmende Ergebnisse liefern kann, ähnlich wie der invasive Wada-Test, der oft als Goldstandard zur Identifizierung der dominanten Sprachhemisphäre angesehen wird67,68,69,70. In einer kürzlich durchgeführten Studie wurde ein multimodaler Ansatz vorgeschlagen, bei dem die Kombination verschiedener Techniken (d. h. kortikale Stimulationskartierung, High-Gamma-Elektrokortikographie, fMRT und transkranielle Magnetstimulation) gegenseitige, bestätigende und komplementäre Informationen für die präoperative Sprachkartierung liefern kann71. Trotz dieser Vorteile ist die Kartierung von Sprachgebieten bei pädiatrischen Patienten, die aufgrund ihres Alters kognitive, intellektuelle und sprachliche Barrieren haben, immer noch eine Herausforderung. So sollen in naher Zukunft altersspezifischere Aufgaben und kindgerechte Setups entwickelt werden. In dieser Arbeit analysierten wir MEG- und HD-EEG-Daten mit einer Software, die nicht für klinische Zwecke zertifiziert ist. Obwohl sich diese Instrumente als wertvoll und effektiv erwiesen haben, werfen sie Haftungsfragen auf, die bei der Meldung von präoperativen Untersuchungsergebnissen für den klinischen Einsatz berücksichtigt werden sollten. Hier beschreiben wir die Verfahren für HD-EEG-Aufzeichnungen mit ausschließlich schwammbasierten EEG-Elektrodensystemen. Alternative Systeme mit gelbasierten EEG-Elektroden sind sowohl in der Klinik als auch in der Forschung weit verbreitet. Obwohl sie EEG-Aufzeichnungen mit höherem SNR liefern, benötigen sie eine längere Vorbereitungszeit (~40-60 min) und sind daher weniger für den pädiatrischen Einsatz geeignet. Alternativ verwenden einige Labore bei den MEG-Aufzeichnungen gelbasierte EEG-Systeme mit geringer Dichte, die in Bezug auf die Vorbereitungszeit (im Vergleich zu HD-EEG-Systemen) vorteilhaft sind, aber aufgrund der reduzierten Anzahl von Elektroden, die die gesamte Kopfhaut bedecken, eine deutlich geringere räumliche Auflösung bieten12,16,72,73.
Gegenwärtig wird die Lokalisation der epileptogenen Hirnareale bei Patienten mit Epilepsie noch hauptsächlich mit iEEG-Monitoring erreicht. Darüber hinaus ist die Methodik zur präzisen Lokalisierung eloquenter Hirnareale schlecht definiert, und die derzeit in MEG-Laboratorien verwendeten Versuchsaufbauten sind für pädiatrische Patienten ungeeignet, während der Einsatz von HD-EEG zu diesem Zweck sehr begrenzt ist. Eine genaue Lokalisierung dieser Bereiche kann die präoperative Beurteilung erleichtern und die chirurgische Planung für die Resektion oder die iEEG-Elektrodenplatzierung erweitern. Bisher wurde in mehreren Studien der Beitrag von ESI oder MSI bei der präoperativen Beurteilung von Patienten mit DRE und fokalen Epilepsien zur Identifizierung der EZ 12,13,14,15,16,17,18,19 und eloquenten Areale des somatosensorischen Kortex untersucht 41beziehungsweise. Nur wenige Studien haben gezeigt, dass EMSI bessere Ergebnisse bei der Lokalisierung von Quellen und eine bessere Leistung bei der Vorhersage von Ergebnissen mit EMSI im Vergleich zu MSI oder ESI allein erzielt hat 13,31,42. Trotz dieser Befunde wird die Aufzeichnung von MEG und EEG selten gleichzeitig durchgeführt, und MSI und ESI werden nur in wenigen Epilepsiezentren weltweit eingesetzt. Unseres Wissens nach ist dies die erste Studie, die Vorschläge für die gleichzeitige Erfassung und Analyse von MEG- und HD-EEG-Daten sowie für die Durchführung von EMSI bei pädiatrischer Epilepsie zur nicht-invasiven Identifizierung der irritativen Zone, der SOZ und der eloquenten Gehirnbereiche, nämlich des primären visuellen, motorischen, auditiven und somatosensorischen Kortex, enthält.
Hier führten wir EMSI an interiktalen Spikes und iktalen Ereignissen durch, die in gleichzeitigen nicht-invasiven Daten von zwei Patienten mit DRE (Fälle 1 und 2) nachgewiesen wurden, und erreichten einen Lokalisationsfehler von ~9 mm bzw. ~12 mm aus der SOZ, in Übereinstimmung mit früheren Studien42. Beeindruckend ist, dass eine solche Methode eine Lokalisierungsgenauigkeit erreichte, die mit den intrakraniellen Befunden (d.h. ESI auf iEEG-Daten) vergleichbar war, mit geclusterten Dipolen, die im Hirnbereich lokalisiert waren und durch die klinischen Beobachtungen als epileptogen lokalisiert wurden (Abbildung 3C und Abbildung 4B). Unter Verwendung nicht-invasiver Daten eines dritten repräsentativen Patienten mit DRE (Fall 3) führten wir auch EMSI bei visuellen, motorischen, auditiven und somatosensorisch evozierten Aktivitäten durch und fanden prominente Aktivierungsmuster in den entsprechenden eloquenten Hirnarealen (d.h. visueller, motorischer, auditiver und somatosensorischer Kortex) (Abbildung 5C, Abbildung 6C, Abbildung 7C und Abbildung 8C).
Unsere Ergebnisse wurden aus der Fusion komplementärer Informationen abgeleitet, die aus MEG- und EEG-Modalitäten erfasst wurden und die Lokalisierungsgenauigkeit verbessern können. Es ist bekannt, dass das EEG alle intrakraniellen Ströme reflektiert, während das MEG hauptsächlich empfindlich auf tangentiale Quellen reagiert und blind auf Quellen im tiefen Gehirn reagiert29,74. Wie in dieser Studie gezeigt, kann die Kombination von MEG und EEG daher die Einschränkungen jeder Modalität überwinden, überlegene Lokalisationsergebnisse liefern und epileptogene und eloquente Hirnareale identifizieren, die entweder ESI oder MSI bei alleiniger Anwendung möglicherweise übersehen hätten. Darüber hinaus stellen wir einen alternativen nicht-invasiven Ansatz zur Kartierung eloquenter Hirnareale mittels EMSI bei Patienten vor, die sich während ihrer präoperativen Untersuchung keiner fMRT unterzogen haben.
Die Lokalisation epileptogener und eloquenter Hirnareale mit nicht-invasiven Techniken, wie z.B. simultanem MEG und EEG, ist ein wesentlicher Schritt bei der präoperativen Beurteilung von Kindern mit DRE zur vollständigen Entfernung oder Trennung der EZ unter Beibehaltung eloquenter kortikaler Areale. Die vorgeschlagene Methodik bietet eine detaillierte Beschreibung der Erfassung und Analyse gleichzeitiger MEG- und EEG-Daten, die ihre Anwendung nicht nur in der präoperativen Epilepsiebewertung, sondern auch in den kognitiven Neurowissenschaften zur Erforschung physiologischer Funktionen des gesunden Gehirns sowohl bei sich typischerweise entwickelnden Kindern als auch bei gesunden Erwachsenen sowie bei morphologischen und funktionellen Hirnveränderungen im Zusammenhang mit Epilepsie oder anderen neurologischen Störungen unterstützt. Zukünftige Studien, die epileptogene Gehirnnetzwerke untersuchen, könnten auch beurteilen, ob Netzwerk-Hubs (d. h. hochgradig verbundene Hirnregionen), die nicht-invasiv mit EMSI auf gleichzeitigen MEG- und HD-EEG-Daten geschätzt werden, die EZ bei Kindern mit DRE genauer lokalisieren können als solche, die mit MSI und/oder ESI allein geschätzt wurden 75,76,77. Darüber hinaus kann die nicht-invasive Kartierung von raumzeitlichen Ausbreitungen von Spikes und Ripples (d.h. hochfrequente Oszillationen, >80 Hz), die durch EMSI geschätzt wird, dazu beitragen, die pathophysiologischen Mechanismen der Ausbreitung epileptiformer Aktivität besser zu verstehen und den Onset-Generator dieser Propagationen, der ein präziser Biomarker für die EZ78,79 ist, nicht-invasiv zu beurteilen. Das vorgestellte Protokoll kann dazu beitragen, die Komplementarität von MEG- und EEG-Systemen weiter zu untersuchen, indem die Empfindlichkeit von MEG- und EEG-Sensorarrays gegenüber Quellen unterschiedlicher Orientierung untersucht wird. Eine solche Analyse kann Einblicke in die elektrophysiologischen Eigenschaften des Gehirns bei gleichzeitiger Durchführung von MEG und HD-EEG geben.
Offenlegungen
Die Autoren berichten über keine Offenlegungen.
Danksagungen
Diese Arbeit wurde unterstützt vom National Institute of Neurological Disorders and Stroke (R01NS104116; R01NS134944; Projektleiter: Christos Papadelis).
Materialien
| Name | Company | Catalog Number | Comments |
| AIRSTIM unit | SD Instruments | N/A | The SDI AIRSTIM system is an alternative unconditioned stimulus to shock |
| Baby Shampoo | Johnson's | N/A | Baby Shampoo is as gentle to the eyes as pure water and is specially designed to gently cleanse baby’s delicate hair and scalp. |
| Control III disinfectant cleaning solution | Maril Products, Inc. | http://www.controlthree.com/ | Disinfectant and germicide solution formulated for hospitals |
| Elekta Neuromag | TRIUX | NM24132A | Comprehensive bioelectromagnetic measurement system characterized by 306-channel neuromagnetometer for functional brain studies |
| FASTRAK | Polhemus technology | NS-7806 | Using A/C electromagnetic technology, FASTRAK delivers accurate position and orientation data, with virtually no latency. With a single magnetic source, FASTRAK delivers data for up to four sensors. The source emits an electromagnetic field, sensors within the field of range are tracked in full 6DOF (6 Degrees-Of-Freedom). Setup is simple and intuitive, with no user calibration required. |
| Genuine Grass Reusable Cup EEG Electrodes | Natus Medical, Inc. | N/A | Each Genuine Grass EEG Electrode undergoes rigorous mechanical and electrical testing to assure long life for unsurpassed recording clarity and dependability. |
| Geodesic Sensor Net | Electrical Geodesics, Inc. | S-MAN-200-GSNR-001 | 32 to 256 electrodes to place on the human head to aquire dense-array electroencephalography data |
| GeoScan Sensor Digitization System | Electrical Geodesics, Inc. | 8100550-03 | Handheld Scanner and Software for 3D electrode position registration |
| Natus Xltek NeuroWorks | Natus Medical, Inc. | https://natus.com/ | The Natus NeuroWorks platform simplifies the process of collecting, monitoring and managing data for routine EEG testing, ambulatory EEG, long-term monitoring, ICU monitoring, and research studies. |
| Natus NeuroWorks EEG Software | Natus Medical, Inc. | https://natus.com/neuro/neuroworks-eeg-software/ | NeuroWorks EEG software simplifies the process of collecting, monitoring, trending and managing EEG testing data, allowing care providers to save time and focus on delivering the best care. |
| ROSA ONE Brain | Zimmer Biomet | https://www.zimmerbiomet.com/en/products-and-solutions/zb-edge/robotics/rosa-brain.html | ROSA ONE Brain is a robotic solution to assist surgeons in planning and performing complex neurosurgical procedures through a small drill hole in the skull. |
| Ten20 Conductive Paste | Weaver and company | N/A | Ten20 contains the right balance of adhesiveness and conductivity, enabling the electrodes to remain in place while allowing the transmittance of electrical signals. |
Referenzen
- Oldham, M. S., Horn, P. S., Tsevat, J., Standridge, S. Costs and clinical outcomes of epilepsy surgery in children with drug-resistant epilepsy. Pediatr Neurol. 53 (3), 216-220 (2015).
- Willie, J. T., et al. Real-time magnetic resonance-guided stereotactic laser amygdalohippocampotomy for mesial temporal lobe epilepsy. Neurosurgery. 74 (6), 569-584 (2014).
- Rosenow, F., Lüders, H. Presurgical evaluation of epilepsy. Brain. 124, Pt 9 1683-1700 (2001).
- Önal, Ç, et al. Complications of invasive subdural grid monitoring in children with epilepsy). J Neurosurg. 98 (5), 1017-1026 (2003).
- Hader, W. J., et al. Complications of epilepsy surgery-a systematic review of focal surgical resections and invasive EEG monitoring. Epilepsia. 54 (5), 840-847 (2013).
- Meng, Y., et al. Risk factors for surgical site infection after intracranial electroencephalography monitoring for epilepsy in the pediatric population. J Neurosurg Pediatr. 22 (1), 31-36 (2018).
- Jobst, B. C., et al. Intracranial EEG in the 21st Century. Epilepsy Curr. 20 (4), 180-188 (2020).
- Schwartz, E. S., et al. Magnetoencephalography for pediatric epilepsy: how we do it. AJNR Am J Neuroradiol. 29 (5), 832-837 (2008).
- Michel, C. M., et al. Electric source imaging of human brain functions. Brain Res Rev. 36 (2-3), 108-118 (2001).
- Michel, C. M., He, B. EEG source localization. Handb Clin Neurol. 160, 85-101 (2019).
- Michel, C. M., Brunet, D. EEG source imaging: A practical review of the analysis steps. Front Neurol. 10, 325(2019).
- Plummer, C., et al. Interictal and ictal source localization for epilepsy surgery using high-density EEG with MEG: a prospective long-term study. Brain. 142 (4), 932-951 (2019).
- Duez, L., et al. Electromagnetic source imaging in presurgical workup of patients with epilepsy: A prospective study. Neurology. 92 (6), e576-e586 (2019).
- Mouthaan, B. E., et al. Diagnostic accuracy of interictal source imaging in presurgical epilepsy evaluation: A systematic review from the E-PILEPSY consortium. Clin Neurophysiol. 130 (5), 845-855 (2019).
- Pellegrino, G., et al. Clinical yield of magnetoencephalography distributed source imaging in epilepsy: A comparison with equivalent current dipole method. Hum Brain Mapp. 39 (1), 218-231 (2018).
- Tamilia, E., et al. Assessing the localization accuracy and clinical utility of electric and magnetic source imaging in children with epilepsy. Clin Neurophysiol. 130 (4), 491-504 (2019).
- Coito, A., et al. Interictal epileptogenic zone localization in patients with focal epilepsy using electric source imaging and directed functional connectivity from low-density EEG. Epilepsia Open. 4 (2), 281-292 (2019).
- Singh, J., Ebersole, J. S., Brinkmann, B. H. From theory to practical fundamentals of electroencephalographic source imaging in localizing the epileptogenic zone. Epilepsia. 63 (10), 2476-2490 (2022).
- Brodbeck, V., et al. Electrical source imaging for presurgical focus localization in epilepsy patients with normal MRI. Epilepsia. 51 (4), 583-591 (2010).
- Santalucia, R., et al. Clinical added value of interictal automated electrical source imaging in the presurgical evaluation of MRI-negative epilepsy: A real-life experience in 29 consecutive patients. Epilepsy Behav. 143, 109229(2023).
- Schneider, F., et al. Magnetic source imaging in non-lesional neocortical epilepsy: additional value and comparison with ICEEG. Epilepsy Behav. 24 (2), 234-240 (2012).
- Hämäläinen, M., Hari, R., Ilmoniemi, R. J., Knuutila, J., Lounasmaa, O. V. Magnetoencephalography-theory, instrumentation, and applications to noninvasive studies of the working human brain. Rev Mod Phys. 65, 413-497 (1993).
- Baillet, S., Mosher, J. C., Leahy, R. M. Electromagnetic brain mapping. IEEE Signal Process Mag. 18 (6), 14-30 (2001).
- Fuchs, M., Kastner, J., Tech, R., Wagner, M., Gasca, F. MEG and EEG dipole clusters from extended cortical sources. Biomed Eng Lett. 7 (3), 185-191 (2017).
- Singh, S. P. Magnetoencephalography: Basic principles. Ann Indian Acad Neurol. 17, Suppl 1 S107-S112 (2014).
- Ahlfors, S. P., Han, J., Belliveau, J. W., Hämäläinen, M. S. Sensitivity of MEG and EEG to source orientation. Brain Topogr. 23, 227-232 (2010).
- Kim, H., Chung, C. K., Hwang, H. Magnetoencephalography in pediatric epilepsy. Korean J Pediatr. 56 (10), 431-438 (2013).
- Gorjan, D., Gramann, K., De Pauw, K., Marusic, U. Removal of movement-induced EEG artifacts: Current state of the art and guidelines. J Neural Eng. , (2022).
- Barkley, G. L., Baumgartner, C. MEG and EEG in epilepsy. J Clin Neurophysiol. 20 (3), 163-178 (2003).
- Ebersole, J. S., Ebersole, S. M. Combining MEG and EEG source modeling in epilepsy evaluations. J Clin Neurophysiol. 27 (6), 360-371 (2010).
- Yoshinaga, H., et al. Benefit of simultaneous recording of EEG and MEG in dipole localization. Epilepsia. 43 (8), 924-928 (2002).
- Baumgartner, C. Controversies in clinical neurophysiology. MEG is superior to EEG in the localization of interictal epileptiform activity: Con. Clin Neurophysiol. 115 (5), 1010-1020 (2004).
- Barkley, G. L. Controversies in neurophysiology. MEG is superior to EEG in localization of interictal epileptiform activity: Pro. Clin Neurophysiol. 115 (5), 1001-1009 (2004).
- Braeutigam, S. Magnetoencephalography: Fundamentals and established and emerging clinical applications in radiology. ISRN Radiol. 2013, 529463(2013).
- Papadelis, C., et al. Current and emerging potential for magnetoencephalography in pediatric epilepsy. J Pediatr Epilepsy. 2 (1), 73-85 (2013).
- Fiedler, P., Fonseca, C., Supriyanto, E., Zanow, F., Haueisen, J. A high-density 256-channel cap for dry electroencephalography. Hum Brain Mapp. 43 (4), 1295(2022).
- Sharon, D., Hämäläinen, M. S., Tootell, R. B. H., Halgren, E., Belliveau, J. W. The advantage of combining MEG and EEG: comparison to fMRI in focally-stimulated visual cortex. Neuroimage. 36 (4), 1225(2007).
- Pataraia, E., Lindinger, G., Deecke, L., Mayer, D., Baumgartner, C. Combined MEG/EEG analysis of the interictal spike complex in mesial temporal lobe epilepsy. Neuroimage. 24 (3), 607-614 (2005).
- Ahmed Mahmutoglu, M., Rupp, A., Baumgärtner, U. Simultaneous EEG/MEG yields complementary information of nociceptive evoked responses. Clin Neurophysiol. 143, 21-35 (2022).
- Aydin, Ü, et al. Combined EEG/MEG can outperform single modality EEG or MEG source reconstruction in presurgical epilepsy diagnosis. PLoS One. 10 (3), e0118753(2015).
- Bast, T., et al. Combined EEG and MEG analysis of early somatosensory evoked activity in children and adolescents with focal epilepsies. Clin Neurophysiol. 118 (8), 1721-1735 (2007).
- Chikara, R. K., et al. Electromagnetic source imaging predicts surgical outcome in children with focal cortical dysplasia. Clin Neurophysiol. 153, 88-101 (2023).
- Hari, R., et al. IFCN-endorsed practical guidelines for clinical magnetoencephalography (MEG). Clin Neurophysiol. 129 (8), 1720-1747 (2018).
- Bagić, A. I., Knowlton, R. C., Rose, D. F., Ebersole, J. S. American Clinical Magnetoencephalography Society Clinical Practice Guideline 1: Recording and analysis of spontaneous cerebral activity. J Clin Neurophysiol. 28 (4), 348-354 (2011).
- Papadelis, C., Chen, Y. H. Pediatric magnetoencephalography in clinical practice and research. Neuroimaging Clin N Am. 30 (2), 239-248 (2020).
- De Macedo Rodrigues, K., et al. A FreeSurfer-compliant consistent manual segmentation of infant brains spanning the 0-2 year age range. Front Hum Neurosci. 9, 21(2015).
- Tadel, F., Baillet, S., Mosher, J. C., Pantazis, D., Leahy, R. M. Brainstorm: A user-friendly application for MEG/EEG analysis. Comput Intell Neurosci. 2011, 879716(2011).
- Kane, N., et al. A revised glossary of terms most commonly used by clinical electroencephalographers and updated proposal for the report format of the EEG findings. Revision 2017. Clin Neurophysiol Pract. 2, 170-185 (2017).
- Lantz, G., et al. Propagation of interictal epileptiform activity can lead to erroneous source localizations: a 128-channel EEG mapping study. J Clin Neurophysiol. 20 (5), 311-319 (2003).
- Vorwerk, J., et al. A guideline for head volume conductor modeling in EEG and MEG. Neuroimage. 100, 590-607 (2014).
- Schrader, S., et al. DUNEuro-A software toolbox for forward modeling in bioelectromagnetism. PLoS One. 16 (6), e0252431(2021).
- Ntolkeras, G., et al. Presurgical accuracy of dipole clustering in MRI-negative pediatric patients with epilepsy: Validation against intracranial EEG and resection. Clin Neurophysiol. 141, 126-138 (2022).
- David, O., Kilner, J. M., Friston, K. J. Mechanisms of evoked and induced responses in MEG/EEG. Neuroimage. 31, 1580-1591 (2006).
- Pantev, C. Evoked and induced gamma-band activity of the human cortex. Brain Topogr. 7 (4), 321-330 (1995).
- Fox, N. A., et al. Assessing human mirror activity with EEG mu rhythm: A meta-analysis. Psychol Bull. 142 (3), 291-313 (2016).
- Genzer, S., Ong, D. C., Zaki, J., Perry, A. Mu rhythm suppression over sensorimotor regions is associated with greater empathic accuracy. Soc Cogn Affect Neurosci. 17 (9), 788-801 (2022).
- Janmohamed, M., et al. Moving the field forward: detection of epileptiform abnormalities on scalp electroencephalography using deep learning-clinical application perspectives. Brain Commun. 4 (5), 218(2022).
- Bagheri, E., Jin, J., Dauwels, J., Cash, S., Westover, M. B. A fast machine learning approach to facilitate the detection of interictal epileptiform discharges in the scalp electroencephalogram. J Neurosci Methods. 326, 108362(2019).
- Thomas, J., et al. Automated detection of interictal epileptiform discharges from scalp electroencephalograms by convolutional neural networks. Int J Neural Syst. 30 (11), 2050030(2020).
- Zijlmans, M., Zweiphenning, W., van Klink, N. Changing concepts in presurgical assessment for epilepsy surgery. Nat Rev Neurol. 15 (10), 594-606 (2019).
- Akiyama, T., et al. Focal resection of fast ripples on extraoperative intracranial EEG improves seizure outcome in pediatric epilepsy. Epilepsia. 52 (10), 1802-1811 (2011).
- Duncan, J. S., Winston, G. P., Koepp, M. J., Ourselin, S. Brain imaging in the assessment for epilepsy surgery. Lancet Neurol. 15 (4), 420(2016).
- Jacobs, J., et al. High-frequency electroencephalographic oscillations correlate with outcome of epilepsy surgery. Ann Neurol. 67 (2), 209-220 (2010).
- Ricci, L., et al. Virtual implantation using conventional scalp EEG delineates seizure onset and predicts surgical outcome in children with epilepsy. Clin Neurophysiol. 139, 49-57 (2022).
- Stefan, H., Rampp, S. Interictal and Ictal MEG in presurgical evaluation for epilepsy surgery. Acta Epileptologica. 2, 11(2020).
- Jahangiri, F. R., Chima, G. S., Pearson, M., Jackson, J., Siddiqui, A. A. Mapping of the language cortex. Cureus. 13 (5), e14960(2021).
- Merrifield, W. S., Simos, P. G., Papanicolaou, A. C., Philpott, L. M., Sutherling, W. W. Hemispheric language dominance in magnetoencephalography: sensitivity, specificity, and data reduction techniques. Epilepsy Behav. 10 (1), 120-128 (2007).
- Wheless, J. W., et al. Magnetoencephalography (MEG) and magnetic source imaging (MSI). Neurologist. 10 (3), 138-153 (2004).
- Breier, J. I., Simos, P. G., Zouridakis, G., Papanicolaou, A. C. Lateralization of activity associated with language function using magnetoencephalography: a reliability study. J Clin Neurophysiol. 17 (5), 503-510 (2000).
- Pataraia, E., Baumgartner, C., Lindinger, G., Deecke, L. Magnetoencephalography in presurgical epilepsy evaluation. Neurosurg Rev. 25 (3), 141-159 (2002).
- Babajani-Feremi, A., et al. Language mapping using high gamma electrocorticography, fMRI, and TMS versus electrocortical stimulation. Clin Neurophysiol. 127 (3), 1822-1836 (2016).
- Brodbeck, V., et al. Electroencephalographic source imaging: a prospective study of 152 operated epileptic patients. Brain. 134, Pt 10 2887-2897 (2011).
- Sohrabpour, A., et al. Effect of EEG electrode number on epileptic source localization in pediatric patients. Clin Neurophysiol. 126 (3), 472-480 (2015).
- Laohathai, C., et al. Practical fundamentals of clinical MEG interpretation in epilepsy. Front Neurol. 12, 722986(2021).
- Corona, L., et al. Mapping functional connectivity of epileptogenic networks through virtual implantation. Proceedings of the Annu Int Conf IEEE Eng Med Biol Soc. 2021, 408-411 (2021).
- Corona, L., et al. Non-invasive mapping of epileptogenic networks predicts surgical outcome. Brain. 146 (5), 1916-1931 (2023).
- Rijal, S., et al. Functional connectivity discriminates epileptogenic states and predicts surgical outcome in children with drug resistant epilepsy. Sci Rep. 13 (1), 9622(2023).
- Tamilia, E., et al. Noninvasive mapping of ripple onset predicts outcome in epilepsy surgery. Ann Neurol. 89 (5), 911-925 (2021).
- Matarrese, M. A. G., et al. Spike propagation mapping reveals effective connectivity and predicts surgical outcome in epilepsy. Brain. 146 (9), 3898-3912 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten