Method Article
Imagerie de source électromagnétique dans l’évaluation préchirurgicale d’enfants atteints d’épilepsie résistante aux médicaments
Dans cet article
Résumé
La magnétoencéphalographie (MEG) et l’électroencéphalographie à haute densité (HD-EEG) sont rarement enregistrées simultanément, bien qu’elles fournissent des informations de confirmation et complémentaires. Ici, nous illustrons le dispositif expérimental d’enregistrement simultané de la MEG et de l’HD-EEG et la méthodologie d’analyse de ces données visant à localiser les zones cérébrales épileptogènes et éloquentes chez les enfants atteints d’épilepsie résistante aux médicaments.
Résumé
Pour les enfants atteints d’épilepsie résistante aux médicaments (ERD), l’absence de crise repose sur la délimitation et la résection (ou l’ablation/déconnexion) de la zone épileptogène (ZE) tout en préservant les zones cérébrales éloquentes. Le développement d’une méthode de localisation fiable et non invasive qui fournit des informations cliniquement utiles pour la localisation de la zone EZ est donc crucial pour obtenir des résultats chirurgicaux réussis. L’imagerie de sources électriques et magnétiques (ESI et MSI) a été de plus en plus utilisée dans l’évaluation préchirurgicale de ces patients, montrant des résultats prometteurs dans la délimitation des zones cérébrales épileptogènes et éloquentes. De plus, la combinaison de l’ESI et de la MSI en une seule solution, à savoir l’imagerie de source électromagnétique (EMSI), réalisée sur des enregistrements simultanés d’électroencéphalographie à haute densité (HD-EEG) et de magnétoencéphalographie (MEG), a montré une plus grande précision de localisation de la source que l’une ou l’autre modalité seule. Malgré ces résultats encourageants, ces techniques ne sont pratiquées que dans quelques centres d’épilepsie tertiaires, sont rarement enregistrées simultanément et sont sous-utilisées dans les cohortes pédiatriques. Cette étude illustre le dispositif expérimental d’enregistrement simultané des données MEG et HD-EEG ainsi que le cadre méthodologique d’analyse de ces données visant à localiser la zone irritative, la zone d’apparition des crises et les zones cérébrales éloquentes chez les enfants atteints de TR. Plus précisément, les configurations expérimentales sont présentées pour (i) enregistrer et localiser l’activité épileptiforme interictale et ictale pendant le sommeil et (ii) enregistrer les réponses visuelles, motrices, auditives et somatosensorielles évoquées et cartographier les zones cérébrales éloquentes pertinentes (c’est-à-dire visuelles, motrices, auditives et somatosensorielles) pendant la tâche visuomotrice, ainsi que les stimulations auditives et somatosensorielles. Les étapes détaillées du pipeline d’analyse des données sont présentées en détail pour la réalisation d’EMSI ainsi que d’ESI et de MSI individuels à l’aide d’un dipôle de courant équivalent (ECD) et d’une cartographie paramétrique statistique dynamique (dSPM).
Introduction
L’épilepsie est l’un des troubles neurologiques les plus courants et les plus invalidants, caractérisé par des crises récurrentes et non provoquées qui peuvent être de nature focale ou généralisée. Malgré la disponibilité de plusieurs traitements pharmacologiques efficaces (p. ex., les médicaments anticonvulsivants [ASM]), environ 20 à 30 % de ces patients sont incapables de contrôler leurs crises et souffrent d’épilepsie résistante aux médicaments (ERD)1. Pour ces patients, la chirurgie de l’épilepsie est le traitement le plus efficace pour éliminer les crises ; une chirurgie réussie peut être obtenue par la résection complète (ou ablation/déconnexion) de la zone épileptogène (ZE), définie comme la zone minimale indispensable à la génération de crises2. La délimitation et la résection précises (ou l’ablation/déconnexion) de la ZE tout en préservant le cortex éloquent sont des facteurs cruciaux pour assurer l’absence de crise. Pour établir la candidature chirurgicale, plusieurs outils de diagnostic non invasifs sont utilisés par une équipe multidisciplinaire pour définir différentes zones corticales (c’est-à-dire la zone irritative, la zone d’apparition des crises [SOZ], la zone déficitaire fonctionnelle et la lésion épileptogène), qui servent d’approximateurs indirects de l’EZ3. Une surveillance extraopératoire par EEG intracrânien (EEG) est nécessaire lorsqu’aucune de ces méthodes n’identifie sans équivoque la ZEE. Le rôle de l’iEEG est de définir précisément la ZE en localisant la SOZ (c’est-à-dire la zone cérébrale où se génèrent les crises cliniques) et de cartographier les zones cérébrales éloquentes. Pourtant, il présente de sérieuses limitations en raison de son caractère invasif 4,5,6, il offre une couverture spatiale limitée et il a besoin d’une hypothèse de localisation préchirurgicale claire7. En conséquence, l’objectif et l’étendue réels de la SOZ peuvent être manqués, ce qui conduit à l’échec de la chirurgie. De plus, son interprétation nécessite l’enregistrement de plusieurs crises cliniques stéréotypées pendant plusieurs jours d’hospitalisation, ce qui augmente les risques de complications (par exemple, infection et/ou saignement)5. Par conséquent, il existe un besoin non satisfait de développer des méthodes de localisation fiables et non invasives qui peuvent fournir des informations cliniquement utiles et améliorer globalement l’évaluation préchirurgicale des enfants atteints d’ERD.
Au cours des dernières décennies, l’imagerie de sources électriques et magnétiques (ESI et MSI) a été de plus en plus utilisée dans l’évaluation préchirurgicale des patients atteints d’ERD pour délimiter les zones cérébrales épileptogènes et fonctionnelles. En particulier, l’ESI et le MSI permettent la reconstruction de sources neuronales à partir d’enregistrements non invasifs, tels que l’EEG à haute densité (HD-EEG) et la magnétoencéphalographie (MEG), pour aider à guider la planification chirurgicale ou le placement des électrodes iEEG. L’ESI et la MSI peuvent être appliquées pour localiser soit les décharges épileptiformes interictales (IED), telles que les pointes et les ondes aiguës, soit l’activité ictale (convulsions). Il peut également être utilisé pour la localisation de différentes zones cérébrales fonctionnelles impliquées dans les fonctions sensorielles, motrices, auditives et cognitives. La reconstitution d’événements électrophysiologiques, tels que les DEI et les convulsions, permet d’identifier la zone irritative (c’est-à-dire la zone cérébrale d’où proviennent les DEI) et la SOZ, respectivement, qui sont considérées comme un substitut valide pour la localisation de la ZEI. La localisation du cortex éloquent (c’est-à-dire les zones cérébrales indispensables à des fonctions corticales définies)3 permet au contraire de cartographier l’emplacement et l’étendue des zones éloquentes par rapport à la résection programmée et, par conséquent, de réduire à l’avance les déficits fonctionnels potentiels que l’on peut attendre d’une chirurgie de l’épilepsie 8,9,10,11 . Plusieurs études ont examiné l’utilité clinique de l’ESI et/ou de la MSI dans l’évaluation préchirurgicale de l’épilepsie, et elles ont montré des résultats prometteurs dans la délimitation de l’EZ 12,13,14,15,16,17,18,19. Par exemple, Mouthaan et coll.14 ont effectué une méta-analyse approfondie à l’aide de données non invasives provenant de 11 études prospectives et rétrospectives sur l’épilepsie et ont rapporté que ces techniques de localisation de la source peuvent identifier globalement la ZE avec une sensibilité élevée (82 %) et une faible spécificité (53 %). D’autres études ont également montré que la MSI et l’ESI peuvent localiser correctement le foyer épileptique dans la zone réséquée chez les patients épileptiques ayant une imagerie par résonance magnétique (IRM) normale19,20,21. Ces résultats de localisation sont particulièrement importants pour les patients qui ne sont pas éligibles à la chirurgie de l’épilepsie en raison de résultats cliniques ou d’imagerie non concluants. En résumé, l’ESI et la MSI peuvent contribuer de manière significative à la cartographie préchirurgicale des zones cérébrales épileptogènes et fonctionnelles chez les patients atteints de TR.
Malgré ces résultats encourageants, ces techniques ne sont actuellement pratiquées que dans quelques centres d’épilepsie tertiaires sur une base régulière et sont souvent sous-utilisées dans les populations pédiatriques. De plus, l’EEG HD et la MEG sont rarement enregistrés simultanément, bien qu’ils fournissent à la fois des informations de confirmation et complémentaires. La MEG est sensible à la détection des sources superficielles avec une orientation tangentielle, mais elle est aveugle aux sources orientées radialement situées au niveau du gyri ou des zones plus profondes du cerveau. De plus, la MEG offre une meilleure résolution spatiale (millimètres) par rapport à l’EEG 16,22,25. Contrairement aux signaux EEG, les signaux MEG sont sans référence et ne sont essentiellement pas affectés par les différentes conductivités des tissus cérébraux (c’est-à-dire les méninges, le liquide céphalo-rachidien, le crâne et le cuir chevelu)25,27, fournissant des mesures non déformées des champs magnétiques produits par le cerveau. D’autre part, l’EEG peut détecter des sources de toutes les orientations, mais il offre une résolution spatiale inférieure à celle de la MEG et est plus sensible aux artefacts26,28. En raison de ces sensibilités complémentaires à l’orientation de la source et à la profondeur, environ 30 % de l’activité épileptiforme (par exemple, les DEI) ne peut être enregistrée que sur MEG mais pas sur EEG, et vice versa 26,29,30,31,32. Contrairement à l’EEG, qui permet des enregistrements prolongés, la capture des crises cliniques avec la MEG est difficile en raison du temps d’enregistrement restreint qui est généralement insuffisant pour enregistrer les événements ictaux chez la plupart des patients. De plus, les artefacts causés par les mouvements de la tête liés aux convulsions peuvent souvent interférer avec la qualité des enregistrements MEG 29,33,34,35. D’autre part, les enregistrements MEG sont plus rapides et plus faciles que l’EEG, en particulier chez les enfants puisqu’il n’est pas nécessaire de fixer des capteurs sur la tête de l’enfant35.
Les progrès du matériel ont permis d’enregistrer simultanément des données MEG et HD-EEG avec un grand nombre de capteurs (plus de 550 capteurs) couvrant l’ensemble de la tête. De plus, les développements modernes des technologies EEG ont réduit le temps de préparation de l’EEG HD à moins d’un quart d’heure36. Ceci est particulièrement important pour les populations pédiatriques ayant des comportements difficiles qui sont incapables de rester immobiles pendant des périodes prolongées. De plus, les progrès des technologies logicielles ont permis de combiner ESI et MSI en une seule solution, à savoir l’imagerie de source électromagnétique (EMSI), réalisée sur des enregistrements simultanés HD-EEG et MEG. Plusieurs études théoriques et empiriques ont rapporté une plus grande précision de localisation de la source avec EMSI que l’une ou l’autre modalité seule 13,30,31,37,38,39,40,41. En utilisant différentes approches de localisation de sources pour reconstruire l’activité en réponse à des stimuli sensoriels, Sharon et al.37 ont constaté que l’EMSI avait systématiquement de meilleurs résultats de localisation que l’ESI ou le MSI seuls par rapport à l’IRM fonctionnelle (IRMf), qui sert de référence non invasive de précision de localisation précise. Les auteurs ont suggéré que cette meilleure localisation est due à l’augmentation du nombre de capteurs pour résoudre la solution inverse et aux différents modèles de sensibilité des deux modalités d’imagerie37. De même, Yoshinaga et al.31 ont effectué une analyse dipolaire sur des données EEG et MEG simultanées de patients atteints d’épilepsie liée à la localisation réfractaire et ont montré que l’EMSI fournissait des informations qui ne seraient pas disponibles en utilisant une seule modalité et a conduit à une localisation réussie pour la chirurgie de l’épilepsie chez l’un des patients analysés. Dans une étude prospective en aveugle, Duez et al.13 ont montré que l’EMSI atteignait un rapport de cotes significativement plus élevé (c’est-à-dire la probabilité de ne plus avoir de crises) par rapport à l’ESI et au MSI, une précision de localisation ≥52 % et une concordance ≥53 % et ≥36 % avec l’irritatif et le SOZ, respectivement. Une étude plus récente de notre groupe42 a montré que l’EMSI fournissait des estimations de localisation supérieures et de meilleures performances de prédiction des résultats que l’ESI ou le MSI seuls, avec des erreurs de localisation de la résection et de la SOZ de ~8 mm et ~15 mm, respectivement. Malgré ces résultats prometteurs, il y a un manque d’études qui fournissent le cadre méthodologique concernant l’EMSI chez les enfants atteints d’ERD.
Cette étude illustre le dispositif expérimental permettant d’effectuer simultanément des enregistrements MEG et HD-EEG ainsi que le cadre méthodologique d’analyse de ces données visant à localiser la zone irritative, la SOZ et les zones cérébrales éloquentes chez les enfants atteints de TR. Plus précisément, les configurations expérimentales sont présentées pour (i) enregistrer et localiser l’activité épileptiforme interictale et ictale pendant le sommeil et (ii) enregistrer les réponses évoquées visuelles, motrices, auditives et somatosensorielles et cartographier les zones cérébrales éloquentes pertinentes (c’est-à-dire visuelles, motrices, auditives et somatosensorielles) pendant une tâche visuomotrice, ainsi que les stimulations auditives et somatosensorielles. Les étapes détaillées du pipeline d’analyse des données sont présentées en détail pour la réalisation d’EMSI ainsi que d’ESI et de MSI individuels à l’aide d’un dipôle de courant équivalent (ECD) et d’une cartographie paramétrique statistique dynamique (dSPM).
Protocole
Les procédures expérimentales appliquées ici ont été approuvées par le North Texas Regional Institutional Review Board (2019-166 ; Chercheur principal : Christos Papadelis). La section suivante décrit le protocole expérimental pour la localisation non invasive des DEI, les activations ictales et les réponses évoquées par des événements (c’est-à-dire visuelles, motrices, auditives et somatosensorielles) à l’aide d’enregistrements simultanés MEG et HD-EEG suivis dans notre laboratoire. La Fédération internationale de neurophysiologie clinique43 et l’American Clinical MEG Society44 ont fourni des « normes minimales » pour l’enregistrement clinique de routine et l’analyse des données MEG et EEG spontanées. Les procédures d’enregistrement HD-EEG décrites ici ne s’appliquent qu’aux systèmes d’électrodes EEG à base d’éponges. Le processus global de préparation pour chaque sujet est d’environ 2-3 h, comprenant les enregistrements réels de ~1,5 h.
1. Préparation du système MEG
- Avant l’arrivée du sujet, effectuez un enregistrement MEG de quelques minutes dans une pièce vide pour capturer les niveaux de bruit de fond et les artefacts magnétiques et vérifiez que tous les capteurs MEG fonctionnent correctement.
- À l’aide du programme de réglage des capteurs MEG, assurez-vous que la valeur moyenne du bruit blanc de tous les capteurs MEG est comprise entre 2 et 5 fT/√Hz (fT/cm√Hz pour les gradiomètres).
2. Préparation du sujet
- Assurez-vous que le sujet est à l’aise avec l’environnement. Dans le cas de jeunes enfants, permettez-leur d’explorer la salle d’enregistrement (y compris la salle à blindage magnétique [MSR]) et de voir l’équipement d’essai qui sera utilisé pour l’acquisition de données.
- Filtrez et fournissez des instructions au sujet à l’aide du formulaire de consentement au dépistage. Si nécessaire, expliquez la procédure aux jeunes enfants à l’aide de mots, de jouets et de jeux spéciaux conçus pour chaque groupe d’âge. Demandez au sujet (ou aux parents du sujet) s’il a eu une crise dans les ~2 heures précédant la visite.
REMARQUE : Le formulaire de consentement au dépistage comprend une description de l’essai, ainsi que son innocuité, la raison pour laquelle l’essai est effectué et une description générale de l’étude.
- Filtrez et fournissez des instructions au sujet à l’aide du formulaire de consentement au dépistage. Si nécessaire, expliquez la procédure aux jeunes enfants à l’aide de mots, de jouets et de jeux spéciaux conçus pour chaque groupe d’âge. Demandez au sujet (ou aux parents du sujet) s’il a eu une crise dans les ~2 heures précédant la visite.
- Retirez tout matériau métallique et/ou magnétique du sujet et fournissez-lui des vêtements appropriés fournis par l’hôpital (p. ex., blouses d’hôpital, blouses). De plus, demandez au sujet d’enlever ses chaussures pour éviter que la poussière magnétique ne pénètre dans le MSR. Si d’autres éléments ferromagnétiques, tels que des travaux dentaires ou des dispositifs médicaux implantés, ne peuvent pas être retirés, utilisez un démagnétiseur (c’est-à-dire un démagnétiseur) pour éliminer les artefacts magnétiques résiduels qui peuvent provoquer des interférences ou des niveaux de bruit élevés pendant les enregistrements MEG. Après s’être assuré que toutes les sources de bruit magnétique ont été éliminées, demandez au sujet de s’asseoir et de s’installer confortablement sur une chaise en bois où les prochaines procédures de mesure seront appliquées.
REMARQUE : Le démagnétiseur ne doit pas être appliqué directement sur des dispositifs électroniques implantés (par exemple, stimulateurs cardiaques, dispositifs de neuromodulation). - Mesurez le tour de tête du sujet pour sélectionner la taille de filet EEG appropriée (généralement 32-34 cm jusqu’à 58-61 cm). À l’aide du côté centimétrique du ruban à mesurer, mesurez la circonférence de la tête en tenant le ruban de la nasion du sujet à ~1 cm au-dessus de l’ionion, puis de nouveau à la nasion.
REMARQUE : La nasion est le point craniométrique entre les yeux, tandis que l’inion est l’extrémité de la protubérance occipitale externe.- Sélectionnez la taille de filet qui correspond à la circonférence de la tête du sujet et faites-le tremper pendant au moins 5 minutes (10 minutes maximum) dans une solution liquide mixte composée de 1 pinte d’eau chaude du robinet, 1 cuillère à soupe d’électrolytes (c’est-à-dire du chlorure de potassium) et 1 cuillère à soupe de shampooing pour bébé. Au cours de ce processus de trempage, assurez-vous que le filet est retourné avec les éponges vers l’extérieur et les fermoirs complètement desserrés pour immerger complètement les capteurs à l’intérieur du seau en plastique contenant la solution.
REMARQUE : Pour vous assurer que l’amplificateur du réseau ne s’approche pas de la solution et reste toujours sec, enroulez une serviette autour de la prise du filet sélectionné et, si vous préférez, placez-le sur une chaise ou un support près de l’évier où se trouve le seau en plastique.
- Sélectionnez la taille de filet qui correspond à la circonférence de la tête du sujet et faites-le tremper pendant au moins 5 minutes (10 minutes maximum) dans une solution liquide mixte composée de 1 pinte d’eau chaude du robinet, 1 cuillère à soupe d’électrolytes (c’est-à-dire du chlorure de potassium) et 1 cuillère à soupe de shampooing pour bébé. Au cours de ce processus de trempage, assurez-vous que le filet est retourné avec les éponges vers l’extérieur et les fermoirs complètement desserrés pour immerger complètement les capteurs à l’intérieur du seau en plastique contenant la solution.
- Placez cinq bobines magnétiques servant d’indicateurs de position de la tête (HPI) à des endroits connus directement sur le cuir chevelu du sujet à l’aide de ruban adhésif en papier microporeux : une de chaque côté du front près de la racine des cheveux, une sur chaque os mastoïdien et une sur le dessus de la tête.
REMARQUE : Les bobines HPI définissent la position de la tête par rapport aux dispositifs d’interférence quantique supraconducteurs (SQUID) placés à l’intérieur du système MEG en émettant des champs magnétiques connus qui peuvent être localisés pendant le balayage. Le nombre de bobines HPI dépend du système MEG, mais il varie généralement de 3 à 5 bobines HPI. - Placez des électrodes supplémentaires à l’aide de ruban adhésif pour mesurer la fréquence cardiaque (électrocardiographie, ECG), les mouvements oculaires ou les clignements (électrooculographie, EOG) et l’activité musculaire (électromyographie, EMG) ; La mise en place de ces électrodes permet également de surveiller l’état de santé du sujet.
- Placez deux électrodes ECG sur les côtés droit et gauche de la poitrine, sous les clavicules, respectivement, pour enregistrer le rythme cardiaque du sujet, et deux électrodes EOG sur les côtés supérieur et inférieur de l’œil droit, respectivement, pour enregistrer ses mouvements oculaires verticaux ou ses clignements.
- Pour mesurer l’activité musculaire pendant la tâche visuomotrice, essuyez également les doigts du sujet avec des tampons imbibés d’alcool pour une meilleure adhérence du ruban sur la peau et collez un total de deux paires d’électrodes à cupule non jetables sur chaque main : une sur le premier interosseux dorsal (FDI) et un sur le court abducteur du muscle (APB).
- Avant de coller toutes ces électrodes, placez la pâte conductrice à l’intérieur de la coupelle d’électrode jusqu’à ce qu’elle soit légèrement trop remplie pour réduire l’impédance de la peau et assurer un mélange optimal d’adhérence et de conductivité.
- Pour la stimulation tactile, fixez de fines membranes élastiques directement sur les parties distales et palmaires de trois doigts (c’est-à-dire le pouce [D1], le majeur [D3] et l’auriculaire [D5]) des deux mains. Gonflez les membranes avec des impulsions d’air comprimé à travers des tubes en plastique rigide à l’aide d’un appareil de stimulation par bouffée d’air. Libérez les impulsions d’air comprimé avec un intervalle inter-stimulus de 1,5 ± 0,5 s suivant un ordre pseudo-aléatoire. Ajustez la pression du stimulateur tactile à 50 psi.
- Placez deux électrodes ECG sur les côtés droit et gauche de la poitrine, sous les clavicules, respectivement, pour enregistrer le rythme cardiaque du sujet, et deux électrodes EOG sur les côtés supérieur et inférieur de l’œil droit, respectivement, pour enregistrer ses mouvements oculaires verticaux ou ses clignements.
- Pendant que le sujet est toujours assis sur la chaise en bois, à l’écart de tout objet métallique, déterminez les positions tridimensionnelles (3D) des repères anatomiques, des cinq bobines HPI et d’autres points de forme de la tête à l’aide d’un numériseur. Au cours de ce processus de numérisation de la tête, demandez au sujet de s’asseoir confortablement, de regarder droit devant lui et de rester pratiquement immobile, car de petits mouvements peuvent affecter la précision de la localisation.
- Placez le récepteur de référence à travers les lunettes en plastique (c’est-à-dire des lunettes avec le cube de référence attaché d’un côté) sur la tête du sujet et ajustez les fermoirs pour assurer un cadre de référence fixe au sujet qui doit rester relativement immobile pendant toute la mesure.
- À travers le récepteur du stylet primaire, localisez les repères anatomiques (c’est-à-dire la nasion et les points préauriculaires gauche/droit) et la position des bobines HPI, et échantillonnez uniformément des points supplémentaires du cuir chevelu (au moins 100, de préférence près de ~500) pour améliorer une reconstruction de haute qualité de la surface de la tête.
REMARQUE : Les repères anatomiques du repère définissent le système de coordonnées du sujet. Le numériseur génère les coordonnées d’un capteur dans l’espace 3D à l’aide d’un émetteur (généralement monté derrière le sujet sur le dos de la chaise en bois) et de deux récepteurs (c’est-à-dire le stylet et les récepteurs de référence). - Une fois la numérisation terminée, placez le récepteur du stylet à ~15 cm du sujet et de l’émetteur et numérisez un point aléatoire pour terminer le processus de numérisation.
REMARQUE : Cette dernière étape du processus de numérisation peut différer de celle d’autres produits commerciaux.
- Avant d’appliquer le filet EEG, demandez au sujet de s’asseoir sur une chaise à proximité de l’amplificateur EEG et placez des serviettes sur sa poitrine et ses épaules pour absorber les éventuelles gouttes dues à l’application du filet. Retirez le filet EEG du seau en plastique, retournez-le avec les éponges vers l’intérieur et enroulez-le doucement autour d’une serviette pour absorber l’excès de solution mélangée.
- Avec le sujet assis sur la chaise et invité à garder les yeux fermés pendant cette étape, mettez les deux mains à l’intérieur du filet et écartez-le avec les doigts, et enfin placez-le sur la tête du sujet.
- Sans déplacer les positions des bobines HPI, ajustez le filet étiré sur la tête du sujet à l’aide des doigts pour vous assurer que les canaux de référence et nasion sont correctement positionnés au centre du cuir chevelu et entre les yeux du sujet, respectivement, et enfin fixez la mentonnière une fois que le filet est dans la bonne position.
- À l’aide d’un impédancemètre EEG, assurez-vous que toutes les impédances de l’électrode du cuir chevelu sont dans la plage de 0 à 50 kΩ (des valeurs ˂5 kΩ sont recommandées) pour éviter toute distorsion du signal. Pour réduire les impédances du cuir chevelu-électrode, vérifiez que chaque électrode a un bon contact mécanique et électrique avec le cuir chevelu en utilisant soit un coton-tige en bois pour enlever les poils du sujet entre l’électrode et le cuir chevelu, soit une pipette en plastique jetable pour transférer une solution mixte plus conductrice dans les éponges des électrodes si nécessaire.
- Une fois que toutes les impédances sont idéalement jusqu’à 50 kΩ, débranchez l’amplificateur et préparez le sujet pour la numérisation de l’électrode EEG.
REMARQUE : Effectuez la numérisation de l’électrode EEG à l’extérieur du MSR et assurez-vous d’avoir suffisamment d’espace autour du sujet pour gérer le processus de balayage.
- Une fois que toutes les impédances sont idéalement jusqu’à 50 kΩ, débranchez l’amplificateur et préparez le sujet pour la numérisation de l’électrode EEG.
- Déterminez les positions 3D des électrodes EEG à l’aide d’un scanner optique portable. Pendant ce processus, demandez au sujet de s’asseoir confortablement et de regarder droit devant lui, sauf indication contraire.
- Tout d’abord, ouvrez le logiciel du scanner optique, sélectionnez le modèle de capteur qui correspond à la disposition du capteur EEG utilisé pendant les enregistrements, puis lancez le processus de balayage.
- Pendant le balayage, tenez le scanner à une certaine distance du réseau EEG (généralement ~45 cm), avec ses ouvertures de balayage perpendiculaires à la surface des capteurs, et déplacez-le lentement autour de la tête du sujet en suivant des bandes arquées du haut (centre de la tête) vers le bas (dernière rangée de capteurs le long du cou) pour enregistrer les emplacements physiques de tous les capteurs.
REMARQUE : Le scanner optique numérise les emplacements des électrodes EEG sur la tête du sujet et les transforme en un fichier de coordonnées 3D ; il est généralement caractérisé par deux capteurs optiques qui émettent des sources de lumière infrarouge (IR). Chaque emplacement numérisé apparaît généralement sur un nuage de capteurs 3D. Le nuage de capteurs 3D fournit un retour d’information pour le balayage, le palpage et l’alignement des positions des capteurs, tandis que la carte de capteur 2D fournit un retour d’information pour l’étiquetage de ces positions de capteurs. Le processus de balayage des positions des électrodes EEG nécessite un total de 5 à 10 minutes, y compris le sondage des points de repère. Cependant, le temps de balayage peut parfois dépendre de la performance du scanner optique dans la détection des positions des électrodes.
- Une fois que toutes les électrodes EEG ont été balayées (au moins 95 %), sondez les points repères (c’est-à-dire la nasion et les points préauriculaires gauche/droit) et quatre capteurs d’alignement (c’est-à-dire les nœuds d’alignement avant, gauche et droit, et le nœud REF) à l’aide de la sonde optique sans fil pour aligner le nuage de capteurs 3D sur le modèle de capteur sélectionné.
REMARQUE : Les capteurs d’alignement sont numérotés en fonction de la configuration du réseau du capteur EEG.- Pour sonder les points de repère, placez la pointe de la sonde optique sur la peau du sujet au centre du point de repère d’intérêt en vous assurant que les ouvertures de balayage du scanner pointent vers les disques réfléchissants de la sonde. De même, placez la pointe de la sonde optique au centre du capteur d’alignement qui vous intéresse pour sonder les capteurs d’alignement.
- Une fois que tous les capteurs ont été scannés et sondés, examinez leurs positions et leurs étiquettes sur le nuage de capteurs 3D et la carte des capteurs 2D par rapport au réseau EEG réel pour vérifier et éventuellement corriger d’éventuelles erreurs ; si aucune erreur ne s’est produite pendant le processus de numérisation, exportez le fichier .txt de coordonnées 3D et convertissez-le dans le format de votre choix.
REMARQUE : Les coordonnées de l’électrode 3D sont généralement stockées dans .txt format et peuvent être converties via un logiciel de scanner optique dans plusieurs formats (par exemple, .xml, .sfp, .elp ou .nsi). - Une fois le processus de numérisation des électrodes EEG terminé (étapes 2.9-2.11), préparez le sujet à transférer à l’intérieur du MSR pour effectuer des données de repos/sommeil (étape 2.13), une tâche visuomotrice (étape 2.14), une stimulation auditive (étape 2.15) et une stimulation somatosensorielle (étape 2.16).
- Pour les données de repos/sommeil, réglez le portique du système MEG en position couchée (Figure 1A) et disposez le lit non magnétique et compatible de manière à ce que l’appui-tête amovible soit aligné avec l’ouverture en forme de casque au bas du dewar. Après avoir réglé le lit dans la bonne position, réglez la soupape de frein du lit en position d’arrêt. Placez un drap ou une couverture sur le lit et un petit coussin en mousse sur l’appui-tête amovible pour la fixation de la tête et le confort pendant l’enregistrement.
REMARQUE : Le dewar est un récipient de stockage cryogénique rempli d’hélium liquide dans lequel les réseaux de capteurs sont disposés spatialement au fond via une ouverture en forme de casque conçue pour entourer la tête du sujet. Le casque s’adapte jusqu’à 59-61 cm de tour de tête. Le portique est le système mécanique qui supporte le dewar et qui permet de modifier son élévation et son angle en fonction de la position de mesure (c’est-à-dire assis ou couché).- Transférez le sujet à l’intérieur du MSR et aidez-le à s’asseoir sur le bord du lit et à s’allonger dessus. Placez plusieurs couvertures sur le corps du sujet pour le garder au chaud pendant l’enregistrement en veillant à ce que les câbles des électrodes soient facilement accessibles, et attachez légèrement les ceintures de sécurité (ou tirez les balustrades s’il y en a), en expliquant au sujet que cette étape consiste à l’empêcher de rouler hors du lit pendant son sommeil. Si nécessaire, placez une serviette roulée supplémentaire sous le cou pour soutenir le cou et les épaules du sujet.
- Déverrouillez la soupape de frein du lit pour déplacer doucement la tête du sujet, qui est placée sur l’appui-tête amovible sous l’ouverture en forme de casque du dewar jusqu’à ce qu’elle touche l’intérieur du casque. Pour augmenter le rapport signal/bruit (SNR), rapprochez la tête du sujet le plus près possible du casque.
- Branchez les bobines HPI, les électrodes ECG et EOG sur les panneaux correspondants du système MEG, connectez le réseau EEG à l’unité d’amplification à l’intérieur du MSR et vérifiez les mesures des coordonnées de la tête depuis le poste de travail d’acquisition à l’extérieur du MSR pour évaluer si la tête du sujet est correctement positionnée sous le Dewar.
- Avec le consentement du sujet, réduisez l’intensité de la lumière à l’intérieur du MSR pour aider à stimuler la relaxation et le sommeil. Lorsque le sujet se sent détendu et à l’aise, demandez-lui de se reposer les yeux fermés ou de dormir pendant l’enregistrement. Rassurez le sujet en lui disant qu’il sera observé sur le moniteur à l’extérieur du MSR via la caméra couleur blindée contre les radiofréquences montée sur le mur du MSR pour l’ensemble de l’enregistrement.
- Pour la tâche visuomotrice, réglez le portique du système MEG en position verticale (Figure 1B) et disposez le fauteuil MEG de manière à ce que la tête du sujet soit sous le portique, près de l’ouverture en forme de casque au bas du dewar. Après avoir réglé le fauteuil dans la bonne position, réglez la soupape de frein du fauteuil sur la position déverrouillée (« 0 »).
- Transférez le sujet à l’intérieur du MSR. Aidez-le à s’asseoir sur la chaise non magnétique et compatible et à trouver une position confortable et détendue. Placez plusieurs couvertures sur le corps du sujet pour le garder au chaud pendant l’enregistrement en veillant à ce que les câbles des électrodes soient facilement accessibles, et placez la table amovible de manière à ce que le sujet puisse poser ses mains dessus pendant la tâche. Si nécessaire, placez une serviette sous les genoux du sujet pour l’aider à maintenir la position assise et ne glissez pas vers le bas.
REMARQUE : Étant donné que le sujet peut se détendre pendant la tâche visuomotrice et, par conséquent, adopter une position plus basse que la position initiale, soulevez soigneusement la chaise à la fin de chaque séance de tâche via la pédale d’élévation (si présente) ou placez des serviettes ou des couvertures sur la chaise de manière à ce que la tête du sujet touche à nouveau l’intérieur du casque. Si nécessaire, placez des serviettes ou des couvertures supplémentaires derrière la tête du sujet, non seulement pour un meilleur confort, mais aussi pour aider le sujet à garder la tête aussi droite que possible. La stimulation visuomotrice peut être réalisée alternativement en position couchée pour éviter de déplacer le dewar au milieu d’une séance d’enregistrement. - Une fois que le sujet est dans la bonne position, branchez les bobines HPI, l’ECG, l’EOG, le FDI et les électrodes APB sur le panneau droit de la machine MEG, connectez le réseau EEG à l’unité d’amplification à l’intérieur du MSR et soulevez le fauteuil à l’aide de la pédale d’élévation (le cas échéant) avec de petits mouvements ou placez des serviettes ou des couvertures supplémentaires sur le fauteuil jusqu’à ce que la tête du sujet touche légèrement l’intérieur du casque (vérifiez les mesures du coordonnées de la tête à partir du poste de travail d’acquisition à l’extérieur du RSM).
- Placez l’écran de projection, dans lequel les stimuli visuels seront projetés via un système de miroir de projection positionné à l’extérieur du MSR, devant le sujet (Figure 1B), et expliquez la tâche visuomotrice à effectuer pendant l’enregistrement. En particulier, demandez au sujet de taper son index sur la table uniquement lorsque le stimulus visuel (par exemple, une image) apparaît à l’écran, respectivement, pour la main droite et la main gauche. Assurez-vous que le sujet comprend la tâche ou se sent à l’aise de l’accomplir seul ; Si nécessaire, pratiquez la tâche avec le sujet plusieurs fois pour l’aider à se familiariser avec celle-ci.
REMARQUE : Si une séance de stimulation visuomotrice est effectuée en position couchée, un miroir est placé à une distance au-dessus du visage du sujet pour refléter les stimuli visuels du projecteur. - Avant de fermer la porte du MSR, demandez au sujet s’il se sent à l’aise d’être seul à l’intérieur de la pièce ; dans le cas où il ne le ferait pas, une personne de l’équipe ou ses parents resteront à l’intérieur du MSR pendant les sessions d’enregistrement. De plus, rassurez le sujet en lui disant qu’il sera observé sur le moniteur à l’extérieur du MSR pendant toute la durée de l’enregistrement.
- Transférez le sujet à l’intérieur du MSR. Aidez-le à s’asseoir sur la chaise non magnétique et compatible et à trouver une position confortable et détendue. Placez plusieurs couvertures sur le corps du sujet pour le garder au chaud pendant l’enregistrement en veillant à ce que les câbles des électrodes soient facilement accessibles, et placez la table amovible de manière à ce que le sujet puisse poser ses mains dessus pendant la tâche. Si nécessaire, placez une serviette sous les genoux du sujet pour l’aider à maintenir la position assise et ne glissez pas vers le bas.
- Pour la stimulation auditive, utilisez la configuration décrite à l’étape 2.14 avec l’écran de projection devant le sujet assis. Aidez le sujet à porter le casque (ou les écouteurs) par lequel les déclencheurs sonores (par exemple, les sons de bip modulés) sont émis.
- Demandez au sujet de fixer les stimuli (par exemple, un point vert sur fond noir) projetés sur l’écran pendant qu’il écoute les déclencheurs sonores. Si nécessaire, effectuez une séance de formation pour aider le sujet à mieux comprendre la procédure. Avant de fermer la porte du MSR, répétez les procédures de sécurité décrites précédemment.
- Pour la stimulation somatosensorielle, utilisez la configuration décrite à l’étape 2.14. Demandez au sujet quelle vidéo (ou film) il souhaite regarder sur l’écran de projection devant lui.
- Demandez au sujet de se détendre les yeux ouverts, de regarder la vidéo sélectionnée, de rester aussi immobile que possible et d’ignorer les stimuli tactiles délivrés à ses doigts pendant l’enregistrement. Expliquez au sujet qu’il sentira de légers tapotements sur la peau au bout des doigts, respectivement, pour chaque main. Si le sujet se sent mal à l’aise, effectuez une séance de formation pour le rassurer.
REMARQUE : La fixation oculaire sur une cible visuelle est une technique bien établie pour minimiser les artefacts biologiques qui peuvent affecter la qualité de l’enregistrement et distraire le sujet des stimuli tactiles délivrés lors de l’acquisition des données.
- Demandez au sujet de se détendre les yeux ouverts, de regarder la vidéo sélectionnée, de rester aussi immobile que possible et d’ignorer les stimuli tactiles délivrés à ses doigts pendant l’enregistrement. Expliquez au sujet qu’il sentira de légers tapotements sur la peau au bout des doigts, respectivement, pour chaque main. Si le sujet se sent mal à l’aise, effectuez une séance de formation pour le rassurer.
3. Acquisition de données
REMARQUE : L’acquisition simultanée des données MEG et EEG est effectuée dans l’installation MEG du Cook Children’s Medical Center (CCMC). Plus de détails sur l’utilisation clinique de la MEG chez les enfants pédiatriques atteints d’épilepsie peuvent être trouvés ailleurs 8,27,45.
- Enregistrez des signaux MEG à l’aide du système MEG tête entière (couverture du capteur : 1 220 cm2) caractérisé par 306 canaux regroupés en 102 éléments de capteurs triples identiques avec un magnétomètre et deux gradiomètres planaires orthogonaux. Réglez une fréquence d’échantillonnage d’au moins 1 kHz.
REMARQUE : Les magnétomètres à bobine unique mesurent la composante du champ magnétique perpendiculaire à la surface du casque MEG. Les gradiomètres planaires consistent en une configuration de bobine en forme de huit caractérisée par des paires de magnétomètres placés à une petite distance les uns des autres et mesurent la différence de champ magnétique entre leurs emplacements (c’est-à-dire la différence entre les deux boucles de « huit »), également appelée gradient spatial. Par rapport aux magnétomètres, les gradiomètres planaires sont moins sensibles aux sources cérébrales profondes, mais plus robustes pour détecter les sources superficielles en supprimant le bruit ambiant. Ces 306 canaux sont immergés et refroidis dans de l’hélium liquide à -296 °C (4,2 K) pour devenir supraconducteurs. - Enregistrez simultanément les signaux EEG à l’aide du réseau EEG non magnétique à 256 canaux avec capteurs d’électrodes Ag/AgCl uniformément espacés sur le cuir chevelu, les joues et la nuque. Réglez une fréquence d’échantillonnage d’au moins 1 kHz.
- Fermez la porte du MSR pour commencer l’enregistrement. Grâce au système d’interphone vocal, communiquez avec le sujet, en vérifiant s’il se sent à l’aise d’être seul à l’intérieur du MSR. Surveillez constamment le sujet sur vidéo et, en cas d’urgence, entrez immédiatement dans le MSR.
REMARQUE : Dans le cas où il/elle ne se sent pas à l’aise ou que la porte massive du MSR l’intimide, soit une personne de l’équipe, soit ses parents, peut rester à l’intérieur du MSR pendant les sessions d’enregistrement assis sur une chaise en bois près du sujet ; Assurez-vous que tous les objets métalliques sont retirés avant d’entrer dans la pièce. - Avant chaque enregistrement, demandez au sujet via le système d’interphone vocal de garder sa position immobile pendant ~30 s avant de commencer la tâche. Pour la tâche visuomotrice, communiquez en outre via l’interphone quel index (droit ou gauche) il utilisera pour la première session d’enregistrement.
- Pendant cette période pendant laquelle le sujet reste immobile, appuyez sur le bouton de mesure de la boîte de dialogue de mesure HPI du système d’acquisition de données MEG pour mesurer le champ magnétique généré par le courant introduit dans les bobines HPI et déterminer les positions de mesure de la tête par rapport au réseau de capteurs MEG ; par conséquent, vérifiez que le sujet est bien positionné (tête |coordonnée z | ˂ 75 mm) et notez les mesures 3D pour chaque séance.
- S’il y a encore de l’espace entre la tête du sujet et le casque, rentrez à l’intérieur du MSR et ajustez la hauteur de la chaise à l’aide de la pédale d’élévation (le cas échéant), placez des serviettes ou des couvertures sur la chaise, ou donnez des instructions au sujet via l’interphone sur la façon de déplacer la tête dans une position plus proche du casque (si le sujet est assis), et enfin vérifiez à nouveau les positions de mesure de la tête. En cas d’enregistrements de repos/sommeil, rentrez dans le MSR et rapprochez le lit du casque, réduisant ainsi l’espace entre la tête et le casque.
- Une fois que le sujet est bien positionné par rapport au casque MEG et prêt à démarrer, commencez la première session d’enregistrement (durée ~10 min) en suivant un ordre précis (voir étape 3.5.1) pour une synchronisation précise de la MEG et de l’EEG (voir étape 3.12).
REMARQUE : Pour garantir des enregistrements de haute qualité, la première session d’enregistrement est essentielle pour capturer les artefacts présents dans les données en raison des mouvements du sujet ou causés par l’environnement externe. Si nécessaire, entrez à nouveau dans le MSR pour ajuster les éventuelles connexions de canaux ou la position du sujet sur le fauteuil MEG. Il est recommandé de prendre des notes sur tout artefact ou événement inhabituel pendant les enregistrements, qui peut être examiné par la suite si nécessaire.- Appuyez sur le bouton d’enregistrement du logiciel d’acquisition de données EEG pour commencer l’enregistrement EEG. Appuyez sur le bouton d’enregistrement du logiciel d’acquisition de données MEG pour commencer l’enregistrement MEG. Enfin, appuyez sur le bouton de démarrage du logiciel de l’ordinateur de stimulation pour afficher des stimuli visuels ou délivrer des stimuli auditifs.
REMARQUE : L’ordinateur de stimulation exécutant le logiciel de stimulus visuel (ou auditif) est connecté au système de miroir du projecteur à l’extérieur du MSR, qui peut être activé ou désactivé en fonction du type d’enregistrement effectué. Pendant les enregistrements de repos/sommeil, le système est éteint car le sujet se repose ou dort, mais l’exécution du logiciel de stimulus visuel sur l’ordinateur de stimulation aide à chronométrer chaque session d’enregistrement. Pendant la tâche visuomotrice, ainsi que lors des stimulations auditives et somatosensorielles, le système est activé en permettant au sujet d’observer les stimuli ou une vidéo projetée sur l’écran placé devant lui pendant que le logiciel fonctionne. Pour cette étude, on a sélectionné un total de (i) 107 stimuli (c’est-à-dire 85 images superposées sur un fond en damier et 22 fonds en damier) avec un intervalle de ~4 s entre chaque stimulus pour la tâche visuo-motrice ; (ii) 200 sons de gazouillis modulés avec un intervalle inter-stimulus de 3 s pour la stimulation auditive ; et (iii) 200 stimuli tactiles pour chaque doigt (c’est-à-dire D1, D3 et D5) suivant une séquence semi-aléatoire avec un intervalle inter-stimulus de ~1,5 s pour la stimulation somatosensorielle.
- Appuyez sur le bouton d’enregistrement du logiciel d’acquisition de données EEG pour commencer l’enregistrement EEG. Appuyez sur le bouton d’enregistrement du logiciel d’acquisition de données MEG pour commencer l’enregistrement MEG. Enfin, appuyez sur le bouton de démarrage du logiciel de l’ordinateur de stimulation pour afficher des stimuli visuels ou délivrer des stimuli auditifs.
- Pour arrêter les enregistrements, appuyez sur le bouton d’arrêt du logiciel d’acquisition de données MEG, puis sur le bouton d’arrêt du logiciel d’acquisition de données EEG. À la fin de chaque session d’enregistrement, communiquez avec le sujet via l’interphone pour le rassurer et si aucune connexion de canal ou réglage de position à l’intérieur du MSR n’est nécessaire, passez à la session suivante.
- Pour la tâche visuomotrice, sélectionnez différents stimuli visuels pour chaque séance afin de garder le sujet motivé et diverti pendant l’enregistrement.
- Pour les données visuo-motrices ou au repos/sommeil, enregistrez un total de ~1 h d’enregistrement simultané MEG et EEG, caractérisé par 5-6 séances. Cependant, le nombre de séances peut varier pour chaque sujet. De plus, enregistrez un total de ~20 min (1-2 séances de ~10 min chacune) et ~14 min (1-2 séances de ~7 min chacune) d’enregistrement simultané MEG et EEG pour les données de stimulation auditive et somatosensorielle, respectivement.
REMARQUE : Dans cette étude, les données MEG et EEG sont automatiquement stockées à la fin des enregistrements aux formats .fif et .mff, respectivement, dans le système de stockage informatique du CCMC. - À la fin de l’enregistrement, entrez dans le MSR pour aider le sujet à se lever de la chaise ou du lit et demandez-lui de s’asseoir sur une chaise à l’extérieur du MSR pour retirer à la fois le filet EEG et les électrodes.
- Demandez au sujet de fermer les yeux jusqu’à ce qu’on lui dise le contraire et aidez-le à retirer le filet EEG en desserrant complètement les mentonnières et en tirant doucement le filet à l’aide de ses deux mains (du front vers l’arrière de la tête du sujet) jusqu’à ce qu’il soit complètement décollé. Lors de cette étape, veillez à ne pas tirer les cheveux du sujet tout en retirant le filet. De plus, aidez le sujet à retirer doucement les électrodes restantes (c’est-à-dire l’ECG, l’EOG et l’EMG en cas de tâche visuomotrice) précédemment collées sur sa peau.
- Une fois le réseau EEG et les électrodes retirés, informez le sujet (et ses parents) que toutes les procédures sont enfin terminées.
- Une fois que le sujet a quitté la pièce, nettoyez soigneusement le scanner optique (comme décrit dans le manuel d’utilisation) et rangez-le dans son étui de protection.
- Nettoyez et désinfectez les surfaces de tout équipement utilisé pendant les enregistrements (p. ex., chaises, lits, bureaux) avec des lingettes au peroxyde d’hydrogène approuvées par l’hôpital ou un vaporisateur désinfectant et des serviettes en papier, mettez les couvertures et les serviettes usagées dans le contenant fourni par l’hôpital et jetez tout morceau de ruban usagé.
- Rangez les outils de mesure à l’intérieur de l’armoire de rangement et nettoyez l’intérieur des godets d’électrodes remplis de pâte conductrice à l’aide de cotons-tiges en bois sous l’eau courante du robinet.
- Pour rincer le filet EEG, remplissez le seau en plastique de l’évier avec de l’eau du robinet propre et chaude et répétez les étapes suivantes pour un total de quatre fois.
- Immergez le filet EEG dans l’eau et agitez doucement le filet EEG pendant 10 à 20 s (ou plongez-le à l’intérieur et à l’extérieur du seau ~25 fois).
- Vidangez l’eau du seau et remplissez le seau avec de l’eau du robinet propre et chaude.
- Pour désinfecter le filet EEG, remplissez le seau en plastique de l’évier avec la solution désinfectante composée de 2 pintes d’eau tiède du robinet et 1 cuillère à soupe de désinfectant et faites tremper le filet EEG à l’intérieur pendant 10 min. Rincez le seau de la solution désinfectante et suivez trois fois le processus de rinçage et de vidange pour éliminer toute solution résiduelle du filet EEG.
- Pour le processus de rinçage ou de désinfection, retirez le filet EEG immergé du seau, séchez-le en enlevant l’excès d’eau à l’aide d’une serviette propre et sèche, et rangez-le en le suspendant près de l’évier.
- Pour supprimer les interférences magnétiques internes et externes et les artefacts de mesure/mouvement des données MEG, appliquez la méthode tSSS (extension temporelle de la méthode de séparation de l’espace du signal) au fichier MEG .fif de données brutes.
REMARQUE : Le filtrage spatio-temporel Maxwell (tSSS) est idéal pour supprimer les sources d’interférence situées à l’intérieur ou très près du réseau de capteurs MEG, à savoir les interférences internes. - Lors de l’exécution simultanée d’enregistrements MEG et EEG, alignez spatialement les systèmes de coordonnées des deux appareils d’acquisition par rapport aux repères anatomiques sur la tête du sujet (Figure 2A) et corrigez la dérive linéaire de l’horloge entre les signaux qui se produit en raison des différentes fréquences d’échantillonnage possibles (Figure 2B).
REMARQUE : Pendant les enregistrements, les signaux MEG et EEG peuvent également être affectés par des décalages lents au fil du temps en raison de retards possibles dans l’appui sur les boutons Start et End et à une dérive de l’horloge interne qui se produit lorsque les déclencheurs sont envoyés au logiciel d’acquisition de données MEG et EEG. Pour assurer une synchronisation précise entre ces signaux, un code interne a été développé en Python qui utilise les événements déclencheurs envoyés sur les deux systèmes lors de l’acquisition des données comme signal de déclenchement commun. Le code comprend trois fonctions disponibles dans la bibliothèque logicielle MNE-Python : deux fonctions qui lisent les signaux MEG et EEG et une fonction qui extrait des informations sur les événements déclencheurs à partir des signaux, tels que les noms de canaux et les horodatages (c’est-à-dire la date et l’heure de l’occurrence de l’événement). Les différences de temps entre l’occurrence d’événements déclencheurs dans chaque signal (c’est-à-dire delta) définissent la dérive linéaire de l’horloge au fil du temps (Figure 2B). Une description détaillée du code développé est fournie dans les étapes suivantes (voir 3.12.1-3.12.4).- Utilisez la différence entre le premier événement déclencheur survenant sur chaque signal comme valeur de décalage (c’est-à-dire la partie à couper de l’un des deux signaux) pour aligner les enregistrements.
REMARQUE : Les fonctions mne.io.read_raw_fif et mne.io.read_raw_egi convertissent les enregistrements MEG et EEG dans un format de tableau 2D, tandis que la fonction mne.find_events extrait les informations d’événement des signaux bruts. - Une fois ces premiers déclencheurs alignés, calculez le coefficient de corrélation de Pearson pour évaluer le degré de corrélation entre les signaux ; Des valeurs p < 1 x 10-6 sont recommandées pour assurer un alignement parfait.
REMARQUE : La fonction pearsonr de la bibliothèque scipy estime le coefficient de corrélation de Pearson entre les signaux MEG et EEG et la valeur p de cette corrélation. - Pour valider cette précision de corrélation, estimez le taux de dérive entre les deux signaux en effectuant un ajustement polynomial de premier degré et utilisez l’étendue de disparité résultante représentée par le coefficient de la fonction polynomiale pour rééchantillonner les signaux sur l’axe des x de l’ajustement polynomial (Figure 2B).
REMARQUE : La fonction polyfit de la bibliothèque numpy ajuste les signaux MEG et EEG au sein d’une fonction polynomiale ; Cette fonction renvoie un coefficient qui représente l’étendue de la disparité entre les deux signaux. La fonction mne.resample rééchantillonne les signaux MEG et EEG en fonction du coefficient de la fonction polynomiale. - Une fois le rééchantillonnage terminé, comparez les horodatages du dernier événement déclencheur survenu sur chaque signal et supprimez les fenêtres temporelles qui ne sont pas courantes dans les signaux MEG et EEG. Enfin, fusionnez les signaux MEG et EEG synchronisés pour créer un seul enregistrement caractérisé par des capteurs MEG et EEG qui peuvent être utilisés pour une analyse plus approfondie.
REMARQUE : La fonction mne.add_channels fusionne les deux signaux pour créer un seul enregistrement.
- Utilisez la différence entre le premier événement déclencheur survenant sur chaque signal comme valeur de décalage (c’est-à-dire la partie à couper de l’un des deux signaux) pour aligner les enregistrements.
- À la fin de chaque enregistrement de ~1,5 heure, utilisez un total de 5 à 6 (~10 min chacune), 1 à 2 (~10 min chacune) et 1 à 2 (~7 min chacune) d’enregistrements MEG et EEG synchronisés, respectivement pour les données de stimulation visuomotrice (et repos/sommeil), auditive et somatosensorielle, pour l’analyse des données.
REMARQUE : Idéalement, le sujet doit effectuer un tapotement du doigt droit pour trois enregistrements visuomoteurs et un tapotement du doigt gauche pour les trois enregistrements visuomoteurs restants.
4. Analyse des données
- Cartographie de la zone irritative
- Générez les surfaces corticales 3D à partir de l’IRM du sujet à l’aide du processus de reconstruction corticale de FreeSurfer, qui est un outil de neuroimagerie open source pour le traitement, l’analyse et la visualisation d’images IRM du cerveau humain46.
- Importez l’anatomie reconstruite sur Brainstorm, une application open-source de MATLAB dédiée à la visualisation et au traitement de données MEG et EEG47, pour visualiser les résultats de la reconstruction corticale. À partir de Brainstorm, définissez les points de repère (c’est-à-dire nasion, préauriculaire gauche/droite, commissure antérieure/postérieure et interhémisphérique) sur l’IRM importée qui définissent le système de coordonnées du sujet.
- Importez le signal MEG et HD-EEG simultané sur Brainstorm et enregistrez les capteurs MEG et EEG sur l’IRM à l’aide du processus d’enregistrement IRM pour ajuster leur alignement sur les points de repère numérisés. Si nécessaire, projetez les capteurs EEG sur la surface corticale.
- Ouvrez l’enregistrement simultané MEG et HD-EEG et inspectez visuellement les données brutes pour supprimer les canaux défectueux. De plus, appliquez la technique de correction d’artefacts de projection dans l’espace du signal (SSP) disponible dans Brainstorm pour rejeter les artefacts biologiques (par exemple, les battements cardiaques, les clignements d’yeux) des enregistrements.
- Appliquez des filtres coupe-bande (50 ou 60 Hz, selon les interférences de ligne électrique) et passe-bande (1-70 Hz) aux données MEG et HD-EEG simultanées.
- Sélectionnez des parties de données contenant une activité interictale caractérisée par des EEI fréquents, tels que des pointes et des ondes aiguës, et ayant des artefacts de mouvement minimaux (si possible).
REMARQUE : Les DEI sont des formes d’onde transitoires caractérisées par une évolution temporelle de <70 ms, une amplitude de >50 μV et une forme nette qui peut être clairement distinguée de l’activité de fond dans la bande de fréquence 1-70 Hz48. La figure 3A représente un exemple de parties des signaux MEG et HD-EEG simultanés avec des DEI fréquents visibles sur les deux enregistrements. - À l’aide du réglage d’affichage standard de 10 s par page, marquez le pic négatif de chaque IED qui se produit sur les enregistrements MEG et EEG (Figure 3A), ainsi que sur chaque modalité seule. Avant de marquer chaque EEI, vérifiez le champ topographique et les cartes potentielles pour le MEG et l’EEG, respectivement.
REMARQUE : Les distributions de tension de points temporels supplémentaires pendant la phase ascendante de chaque IED, plutôt que son pic, doivent également être vérifiées pour tenir compte de la propagation possible de l’activité épileptique49. Vous trouverez plus de détails sur la façon de marquer les événements de pointes interictales à l’aide de Brainstorm ailleurs (https://neuroimage.usc.edu/brainstorm/Tutorials/Epilepsy). - Calculez un modèle de tête réaliste, défini comme un modèle géométrique à trois couches (c’est-à-dire le cuir chevelu, l’intérieur du crâne et l’extérieur du crâne) (Figure 3B), à l’aide du logiciel OpenMEEG BEM (méthode des éléments de frontière symétriques) disponible dans Brainstorm. Utilisez le volume IRM comme espace source (grille source-point avec une résolution spatiale de 5 mm).
REMARQUE : Le logiciel OpenMEEG BEM utilise la méthode des éléments de frontière symétriques pour calculer un modèle direct réaliste caractérisé par le cuir chevelu (c’est-à-dire l’interface air-cuir chevelu), l’extérieur du crâne (c’est-à-dire l’interface scalp-crâne) et l’intérieur du crâne (interface crâne-cerveau). Comme solution alternative, la méthode des éléments finis (FEM) peut être utilisée pour résoudre le problème direct car elle permet une représentation réaliste du conducteur de volume de tête spécifique au sujet. Les valeurs de conductivité du tissu cifférial sont souvent supposées à partir de la littérature et peuvent varier en fonction de l’âge du sujet50 ans. Pour résoudre le modèle direct à l’aide de la FEM, calculez le modèle de tête réaliste, défini comme un modèle géométrique de trois à cinq couches (c’est-à-dire la substance blanche, la matière grise, le liquide céphalo-rachidien, le crâne et la peau), à l’aide du logiciel DUNEuro FEM disponible dans Brainstorm 47,50,51. Vous trouverez plus de détails sur l’estimation du modèle direct à l’aide de la MEF ailleurs (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Localisez les générateurs sous-jacents des pointes interictales sélectionnées à l’aide de la méthode ECD sans contrainte sur le réseau de capteurs MEG, EEG et MEG et EEG combinés, séparément. Pour localiser ces sources dipôles, calculez la covariance de bruit à partir des enregistrements MEG en salle vide ou définissez-la comme une matrice d’identité.
REMARQUE : Envisagez d’effectuer la localisation de la source sur des DEI moyennés avec des distributions de tension similaires comme approche alternative dans le cas où le SNR des DEI est faible12. - Effectuez la méthode de balayage des dipôles disponible dans Brainstorm au sommet de chaque IED précédemment marqué pour sélectionner les dipôles sources les plus significatifs sur l’ensemble du volume cérébral. Sélectionnez uniquement les dipôles sources dont la qualité de l’ajustement est de >60 % et estimez leur agrégation définie pour chaque dipôle comme le nombre de dipôles situés à 15 mm de son centre (Figure 3C).
REMARQUE : On trouvera ailleurs plus de détails sur le regroupement de l’ECD52.
- Cartographie de la SOZ
- Générez les surfaces corticales 3D à partir de l’IRM du sujet en utilisant le processus de reconstruction corticale de FreeSurfer46.
- Importez l’anatomie reconstruite sur Brainstorm47 pour visualiser les résultats de la reconstruction corticale. Définissez les points de repère sur l’IRM importée qui définissent le système de coordonnées du sujet.
- Importez le signal MEG et HD-EEG simultané (contenant l’événement ictal) sur Brainstorm et enregistrez les capteurs MEG et EEG sur l’IRM à l’aide du processus d’enregistrement MRI pour ajuster leur alignement sur les points de repère numérisés. Si nécessaire, projetez les capteurs EEG sur la surface corticale.
REMARQUE : Si le sujet a eu une crise pendant les enregistrements, examinez les notes prises pendant l’enregistrement pour évaluer dans quelle session l’événement ictal a été enregistré. - Ouvrez l’enregistrement simultané MEG et HD-EEG et inspectez visuellement les données brutes pour supprimer les canaux défectueux. Appliquez la technique de correction d’artefact SSP disponible dans Brainstorm47 pour rejeter les artefacts biologiques (par exemple, les battements cardiaques, les clignements d’yeux) de l’enregistrement.
- Appliquez des filtres coupe-bande (50 ou 60 Hz, selon les interférences de la ligne électrique) et passe-bande (1-70 Hz) aux données MEG et HD-EEG simultanées.
- Selon les notes d’enregistrement, identifiez le début de la crise et sa fin (le cas échéant) et marquez ces événements sur le signal pour identifier la bonne partie des données contenant des écoulements épileptiformes ictals. Des exemples d’apparition d’une crise sont illustrés à la figure 4 pour la MEG et l’EEG-HD, respectivement.
REMARQUE : Lorsqu’un sujet a une crise pendant l’acquisition de MEG, le personnel médical est tenu d’aider immédiatement le sujet et de fournir des soins d’urgence. Ainsi, la durée de ces parties de données avec des événements ictal peut être courte. - À l’aide du réglage d’affichage standard de 10 s par page, marquez le pic négatif de chaque rafale de décharges épileptiformes (par exemple, pics répétitifs, ondes aiguës ou complexes d’ondes de pointe) se produisant pendant l’événement ictal sur MEG et EEG, ainsi que sur chaque modalité seule. Avant chaque marquage de pic, vérifiez le champ topographique et les cartes de potentiel pour le MEG et l’EEG, respectivement (Figure 4A).
REMARQUE : Les crises sont classées comme généralisées ou focales selon l’endroit où elles commencent. Bien que dépendante du syndrome d’épilepsie, une crise est un phénomène d’au moins 10 s caractérisé par des décharges électriques répétitives qui peuvent varier en fréquence, en amplitude et en morphologie. - Calculez le modèle de tête réaliste à trois couches (c’est-à-dire le cuir chevelu, l’intérieur du crâne et l’extérieur du crâne) pour les capteurs MEG et EEG à l’aide du logiciel OpenMEEG BEM disponible dans Brainstorm. Utilisez le volume IRM comme espace source (grille source-point avec une résolution spatiale de 5 mm).
REMARQUE : Pour résoudre le modèle direct à l’aide de la FEM, calculez le modèle de tête réaliste, défini comme un modèle géométrique de trois à cinq couches (c’est-à-dire la substance blanche, la matière grise, le liquide céphalo-rachidien, le crâne et la peau), à l’aide du logiciel DUNEuro FEM disponible dans Brainstorm 47,50,51. Vous trouverez plus de détails sur l’estimation du modèle direct à l’aide de la MEF ailleurs (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Localisez les générateurs sous-jacents des décharges ictales sélectionnées à l’aide de la méthode ECD sans contrainte sur le réseau de capteurs MEG, EEG et MEG et EEG combinés séparément. Pour localiser ces sources dipôles, calculez la covariance de bruit à partir des enregistrements MEG en salle vide ou définissez-la comme une matrice d’identité.
- Effectuez la méthode de balayage dipolaire disponible dans Brainstorm au sommet de chaque forme d’onde ictale précédemment marquée pour sélectionner les dipôles sources les plus significatifs sur l’ensemble du volume cérébral. Sélectionnez uniquement les dipôles sources dont l’ajustement est de >60 % et estimez leur amas (distance entre les dipôles et le centre de chaque dipôle, réglée à 15 mm)52.
- Cartographie du cortex éloquent
- Effectuez les étapes 4.2.1-4.2.3 décrites précédemment en utilisant les signaux enregistrés pendant la tâche visuomotrice, ainsi que pendant les stimulations auditives et somatosensorielles.
- Ouvrez les enregistrements simultanés MEG et HD-EEG et inspectez visuellement les données brutes pour supprimer les canaux défectueux. Séparément, pour chaque session, appliquez la technique de correction d’artefact SSP disponible dans Brainstorm47 pour rejeter les artefacts biologiques (par exemple, les battements cardiaques, les clignements d’yeux) des enregistrements. De plus, supprimez ou marquez comme « Intervalle incorrect » tous les segments de données contaminés par des artefacts qui ne peuvent pas être utilisés pour une analyse plus approfondie.
- Appliquez des filtres coupe-bande (50 ou 60 Hz, selon les interférences de la ligne électrique) et passe-bande (1-100 Hz) aux données MEG et HD-EEG simultanées.
- Pour cartographier le cortex moteur, ouvrez les signaux EMG enregistrés à partir des électrodes FDI et APB et marquez manuellement l’événement de tapotement effectué par le sujet, séparément pour la main droite et la main gauche, en sélectionnant le premier pic d’activation musculaire différent de la ligne de base sur la pair-électrode FDI. Effectuez cette étape séparément pour chaque session à l’aide de Brainstorm47.
REMARQUE : Utilisez l’onglet Filtre pour la visualisation uniquement sur Brainstorm et sélectionnez des plages de fréquences (par exemple, passe-haut : 30 Hz ; passe-bas : 300 Hz ; encoche : 60 Hz) qui peuvent aider à marquer correctement les pics de l’activité EMG pendant le tapotement. Le nom des événements doit être le même d’une session à l’autre. Par exemple, les événements où le sujet a tapé avec le doigt droit (ou le doigt gauche) peuvent être nommés « Tap_right » (ou « Tap_left »). Cette étape nous permet d’effectuer une analyse unique sur le même type d’événement qui s’est produit sur toutes les sessions. - À partir de chaque session, importez les événements se produisant sur des segments sans artefact en sélectionnant les paramètres suivants : stimuli visuels : [-200 ; +500] ms fenêtre de temps, y compris la ligne de base de [-200 ; 0] ms avant le début du stimulus ; Événements de tapotement : fenêtre de temps de [-1500 ; +1000] ms, y compris la ligne de base de [-1500 ; -1000] ms avant le début du stimulus visuel ; Chirp modulé : fenêtre de temps de [-500 ; +1000] ms, y compris la ligne de base de [-500 ; 0] ms avant le début du stimulus ; et stimuli tactiles : fenêtre de temps de [-100 ; +500] ms, y compris la ligne de base de [-100 ; 0] ms avant le début du stimulus.
- Une fois que les événements d’une tâche spécifique ont été importés à partir de toutes les sessions, appliquez le montage de référence moyen pour augmenter le SNR sur les données EEG et estimez la moyenne sur les stimuli pour obtenir les champs et les potentiels évoqués par l’événement. Dans le cas des tâches motrices (c’est-à-dire le tapotement) et de la stimulation tactile, cette dernière étape est effectuée pour la main droite et la main gauche, respectivement.
REMARQUE : Les panneaux A et B de la figure 5, de la figure 6, de la figure 7 et de la figure 8 montrent des exemples de réponses visuelles, motrices, auditives et somatosensorielles, respectivement, pour la MEG et l’EEG et leur champ topographique relatif et leurs cartes de potentiel. Le nombre total de stimuli pour une tâche spécifique dépend strictement du nombre de sessions terminées ; Dans le cas d’une tâche motrice, ce nombre dépend également de la tâche de tapotement correctement effectuée. - Pour les champs et les potentiels évoqués visuellement, motrice, auditive ou somatosensorielle, calculez le modèle de tête réaliste à trois couches (c’est-à-dire le cuir chevelu, l’intérieur du crâne et l’extérieur du crâne) pour les capteurs MEG et EEG à l’aide du logiciel OpenMEEG BEM disponible dans Brainstorm. Utilisez la surface corticale 3D comme espace source.
REMARQUE : Pour résoudre le modèle direct à l’aide de la FEM, calculez le modèle de tête réaliste, défini comme un modèle géométrique de trois à cinq couches (c’est-à-dire la substance blanche, la matière grise, le liquide céphalo-rachidien, le crâne et la peau), à l’aide du logiciel DUNEuro FEM disponible dans Brainstorm 47,50,51. Vous trouverez plus de détails sur l’estimation du modèle direct à l’aide de la MEF ailleurs (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Pour chaque champ et potentiel évoqué par un événement, calculez les sources corticales sur les événements moyennés à l’aide de la dSPM implémentée dans la boîte à outils Brainstorm pour le réseau de capteurs MEG, EEG et MEG et EEG combinés séparément. Définissez la matrice de covariance du bruit à l’aide de la période de référence pré-stimulus spécifique à chaque tâche (voir étape 4.3.5).
- Selon la tâche, extraire les sources corticales maximales observées dans la zone cérébrale éloquente impliquée [cortex visuel primaire (V1), cortex moteur primaire (M1), cortex auditif primaire (A1) ou cortex somatosensoriel primaire (S1)] qui peuvent être définies soit à l’aide d’un atlas, soit par la reconstruction d’un capteur virtuel (c’est-à-dire la région d’intérêt, ROI) à cet endroit (Figure 5C, Figure 6C, Figure 7C et Figure 8C).
- Effectuez la décomposition temps-fréquence en ondelettes de Morlet sur le champ évoqué par l’événement et les sources potentielles dans la zone cérébrale éloquente impliquée (V1, M1, A1 ou S1) avec une échelle linéaire (gamme de fréquences : 1:1:100 Hz).
REMARQUE : Pour estimer les oscillations évoquées qui sont verrouillées dans le temps et la phase au début du stimulus, le signal MEG/EEG est initialement moyenné sur les événements, puis devient soumis à une analyse temps-fréquence53,54. - Effectuez la normalisation des cartes de sources corticales à l’aide de la méthode de perturbation liée aux événements disponible dans Brainstorm pour les normaliser par rapport à la ligne de base (voir l’étape 4.3.5), séparément pour chaque événement (Figure 5D, Figure 6D, Figure 7D et Figure 8D).
REMARQUE : La normalisation des cartes de sources à l’aide de perturbations liées à des événements est une mesure de normalisation des cartes de puissance temps-fréquence qui estime l’écart par rapport à la moyenne par rapport à la ligne de base en pourcentage. Plus de détails sur ce processus de normalisation peuvent être trouvés ailleurs (https://neuroimage.usc.edu/brainstorm/Tutorials/TimeFrequency#Normalized_time-frequency_maps).
- Validation
- Acquérir un enregistrement iEEG extra-opératoire grâce à l’implantation de grilles sous-durales et/ou d’électrodes de profondeur. Le nombre, le type et l’emplacement des électrodes intracrâniennes sont décidés par l’équipe multidisciplinaire de l’épilepsie sur la base de l’hypothèse clinique générée à partir de la somme des informations obtenues à partir des tests de diagnostic non invasifs de l’évaluation préchirurgicale.
REMARQUE : Dans le cadre de l’évaluation préchirurgicale, l’iEEG extraopératoire est enregistré sur plusieurs jours via un système EEG numérique à l’aide d’une fréquence d’échantillonnage de 1 024 Hz. - Identifier la SOZ telle que définie par un épileptologue expert sur la base des informations cliniques disponibles pour chaque sujet.
REMARQUE : La SOZ est définie comme la zone cérébrale montrant la première décharge électrographique ictale sans équivoque, qui est différente de l’activité de fond qui peut se produire avant ou en même temps que l’apparition de l’ictal cliniquement définie. Tous les canaux impliqués dans cette décharge électrographique ictale sont considérés comme des contacts SOZ, même s’ils capturent des crises provenant de différentes zones du cerveau. - Au cours de l’événement ictal enregistré sur iEEG, marquez le pic de chaque rafale de décharges épileptiformes se produisant à chaque électrode intracrânienne et effectuez la localisation de la source sur ces événements ictaux en utilisant la méthode ECD comme décrit précédemment aux étapes 4.1.7-4.1.10.
- Comparez les résultats de localisation de l’iEEG par rapport à la SOZ cliniquement définie comme référence pour les résultats de localisation source.
- Acquérir un enregistrement iEEG extra-opératoire grâce à l’implantation de grilles sous-durales et/ou d’électrodes de profondeur. Le nombre, le type et l’emplacement des électrodes intracrâniennes sont décidés par l’équipe multidisciplinaire de l’épilepsie sur la base de l’hypothèse clinique générée à partir de la somme des informations obtenues à partir des tests de diagnostic non invasifs de l’évaluation préchirurgicale.
Résultats
Les patients pédiatriques atteints d’ERD ont été recrutés à la clinique d’épilepsie de l’Institut Jane et John Justin pour la santé mentale du Cook Children’s Health Care System (CCHCS). Ici, les données de trois patients représentatifs sont présentées : (i) une fille de 10 ans, (ii) un garçon de 13 ans et (iii) une fille de 10 ans.
Cas 1 : Une fillette de 10 ans a été admise pour des convulsions à partir de l’âge de trois ans. Le patient souffrait de convulsions quotidiennes même après l’administration de 8 ASM. Les crises initiales ont été caractérisées par une déviation oculaire (côté peu clair) et un arrêt comportemental. Plus tard, le patient a ressenti des crises quotidiennes de ~30 s caractérisées par une moue ictale (signe du chapeau de gendarme), une déviation de la tête vers la gauche et un raidissement tonique bilatéral du bras (prédominance à droite). L’EEG vidéo à long terme a révélé deux grappes de crises toniques asymétriques avec une déviation de la tête vers la gauche, suivie de son bras gauche vers le haut. Trois crises toniques ont également été observées pendant le sommeil, avec des séries fréquentes de polypointes rapides généralisées et des ondes lentes avec une ouverture intermittente des yeux, un regard vers le haut et une élévation du bras gauche ou droit. Ces polypointes et ces ondes de sommeil lent étaient principalement proéminentes à partir du lobe temporal moyen gauche. L’IRM cérébrale a révélé les dysplasies multifocales suivantes : (i) dysplasie corticale focale du lobe pariétal gauche (gyrus postcentral), dysplasie corticale focale (FCD) avec signe de transmantle (FCD de type II), (ii) jonction pariéto-occipitale droite FCD et (iii) FCD du pôle temporal gauche. La tomographie par émission de positons (TEP) a mis en évidence un hypométabolisme dans le lobe pariétal gauche, le lobe temporal gauche et la jonction parieto-occipitale droite correspondant aux foyers de l’anomalie du signal (c’est-à-dire FCD) à l’examen IRM. Le patient a été diagnostiqué avec une épilepsie réfractaire, avec une sémiologie stéréotypée du chapeau suivie d’une raideur tonique du bras, suggérant une possible apparition mésiale frontale ou insulaire/temporale. Une exploration stéréo-EEG bilatérale (sEEG) extensive a été recommandée en ciblant le lobe frontal, le cingulaire, l’insula et les régions de dysplasie. Au cours de la surveillance iEEG, le patient a eu des crises typiques avec « chapeau de gendarme » suivi d’une élévation/flexion tonique du membre supérieur droit ou gauche, caractérisée par un début d’EEG diffus, maximal sur l’insula antérieure bilatérale. Les DEI multifocaux ont été principalement observés au niveau des lobes temporaux antérieurs droit et gauche et du cortex frontal dorsolatéral, y compris l’insula bilatérale. L’ESI réalisée sur l’enregistrement iEEG a confirmé l’emplacement de la SOZ, qui a été cliniquement définie bilatéralement au niveau du cortex frontal dorsolatéral gauche et droit et de l’insula antérieure.
Dans le cadre de l’évaluation préchirurgicale, une localisation à la source sur les données simultanées de MEG et d’EEG HD a été effectuée. Les enregistrements MEG et HD-EEG ont indiqué des DEI fréquents dans les deux régions frontotemporales. La figure 3A montre un exemple représentatif d’EEI sur des données MEG et HD-EEG ; Le champ topographique et la cartographie potentielle des deux modalités ont indiqué une source sous-jacente possible dans la région frontotemporale droite. L’ESI a indiqué un groupe dispersé de dipôles couvrant des zones des lobes frontotemporaux et pariétaux droit et gauche. MSI a montré un groupe focal de dipôles dans le lobe frontotemporal droit, situé près de l’insula droite. EMSI a indiqué des grappes focales de dipôles dans les régions frontotemporales bilatérales, conformément à l’ESI réalisée sur l’étalon-or iEEG, qui a confirmé les observations cliniques (Figure 3C). Ces dipôles estimés par EMSI ont montré une distance moyenne par rapport à la SOZ définie par iEEG de 9,81 mm (médiane : 11,18 ; standard : 2,37).
Cas 2 : Un garçon de 13 ans atteint d’épilepsie réfractaire a été admis pour des convulsions à partir de l’âge de neuf ans. Les crises ont commencé par une aura, suivie d’une déviation de la tête ou des yeux vers la gauche, avec parfois une conscience préservée et un clonus focal de la tête vers la gauche, qui dure ~30 s et se produit plusieurs fois par semaine. Aucun des ASM prescrits n’a permis de contrôler les crises. À partir de l’EEG vidéo à long terme, nous avons observé des pics temporaux postérieurs droits et des décharges fréquentes d’ondes de pointe dans l’hémisphère droit impliquant le cortex temporal moyen, fronto-temporal, temporopariétal et centropariétal. Le patient a eu six crises électrocliniques caractérisées par un changement de comportement, une déviation de la tête / des yeux vers la gauche avec extension du bras gauche, et parfois une activité clonique du bras gauche, et trois crises avec une activité convulsive bilatérale secondaire. Le début maximal était au niveau du lobe temporal moyen droit avec une évolution dans le lobe frontotemporal droit. L’IRM cérébrale a révélé une malformation étendue du cortex dans l’hémisphère cérébral droit (périsylvien prédominant) et une légère perte de volume dans l’hémisphère cérébral droit avec dilatation ex vacuo du ventricule latéral droit. Le patient a été diagnostiqué avec une épilepsie réfractaire avec un début dans l’hémisphère droit, favorisant l’apparition temporale et périsylvienne dans la région de la malformation corticale diffuse. Un stéréo-EEG a été réalisé pour délimiter l’étendue de l’atteinte, avec des électrodes placées dans les cortex temporal, périsylvien, insulaire et parietoo-cipital droit. Plusieurs crises focales électrocliniques ont été capturées au cours de la surveillance iEEG avec des apparitions maximales dans une large zone du lobe frontotemporal droit. L’ESI réalisée sur les données iEEG a localisé ces crises dans une zone plus focale comprenant à la fois les zones temporale droite (près du gyrus temporal moyen droit) et périsylvienne.
Dans le cadre de l’évaluation préchirurgicale, une MEG et un HD-EEG simultanés ont été réalisés, au cours desquels le patient a ressenti deux crises : l’une alors qu’il était assis sur la chaise en bois pendant le processus de numérisation et l’autre capturée pendant l’enregistrement réel, le début étant visible à la fois sur la MEG et l’HD-EEG (Figure 4A). Le champ topographique et les cartes de potentiel au début de l’ictal ont indiqué que le générateur sous-jacent du début de la crise pourrait se trouver au lobe temporal moyen droit, comme le montre la figure 4A. La localisation de la source sur l’événement ictal a montré des résultats différents pour ESI et MSI : ESI a montré des dipôles localisés vers les lobes frontotemporaux et centropariétals droits, tandis que MSI a montré des dipôles à forte concentration principalement au lobe temporal droit (Figure 4B), avec des dipôles dispersés supplémentaires dans le cortex frontotemporal. En combinant ces solutions, EMSI a révélé la localisation de l’apparition de l’ictal dans le lobe temporal concordant avec l’ESI sur l’étalon-or iEEG (Figure 4B). En particulier, EMSI a présenté des résultats de localisation avec une distance moyenne par rapport à la SOZ définie par la surveillance iEEG de 12,21 mm (médiane : 13,62 ; standard : 2,37).
Cas 3 : Une jeune femme de 15 ans atteinte d’épilepsie idiopathique liée à la localisation a été admise pour des convulsions à partir de l’âge de 13 ans, mais peut-être à 8-9 ans rétrospectivement, lorsqu’elle a été diagnostiquée avec des tics dus à des mouvements répétitifs et stéréotypés du cou. Le patient présentait de brèves inclinaisons de la tête vers la gauche qui évoluaient parfois vers une crise dyscognitive focale avec des comportements hypermoteurs (c’est-à-dire des crises tonico-cloniques généralisées), ainsi que des crises convulsives nocturnes. Plusieurs ASM ont été administrés sans que les crises ne soient totalement contrôlées. Au cours de la surveillance vidéo-EEG à long terme, le patient a présenté des crises électrocliniques focales avec généralisation secondaire avec apparition au lobe temporal postérieur gauche, de nombreuses crises motrices focales brèves avec inclinaison de la tête vers la gauche et une crise électrographique subtile avec apparition au niveau du cortex centropariétal gauche. L’IRM cérébrale n’a révélé aucune anomalie intracrânienne aiguë et une malformation de Chiari I. L’examen de la tête par tomographie par émission de positons (TEP-TDM) s’est révélé négatif. Des tests supplémentaires, tels que la TDM par émission de photons uniques ictales (SPECT), la MEG et l’EEG HD simultanés, la radiographie de la colonne cervicale, l’angiographie par résonance magnétique (ARM) de la tête et du cou, et éventuellement l’exploration sEEG de l’hémisphère gauche, ont été recommandés.
Dans le cadre de l’évaluation, le patient a participé à des enregistrements simultanés MEG et HD-EEG pour cartographier les zones cérébrales éloquentes, telles que les cortex visuel, moteur, auditif et somatosensoriel primaires. Dans un premier temps, le patient effectuait une tâche visuomotrice, suivie de stimulations auditives et somatosensorielles. La première réponse corticale à la stimulation visuelle s’est produite à ~70 ms après le début du stimulus pour la MEG et l’EEG-HD (Graphique 5A). Graphique 5B rapporte le champ topographique et les cartes potentielles des localisations corticales impliquées dans la stimulation visuelle pour la MEG et l’EEG-HD, respectivement. Pour l’EEG-HD, un changement de polarité dans les canaux couvrant les zones cérébrales occipitales a été observé, tandis qu’une distribution de champ plus complexe a été observée dans les mêmes zones pour la MEG (Graphique 5B). La localisation de la source à l’aide de la dSPM a révélé une activité corticale focale à ce moment-là dans les régions cérébrales suivantes de l’atlas de Desikan-Killiany : (i) cuneus pour MSI ; (ii) cortex occipital latéral pour l’ESI ; et (iii) le cunéus et le cortex occipital latéral pour l’EMSI (Graphique 5C). L’analyse temps-fréquence des réponses corticales visuelles a révélé une synchronisation liée à l’événement (ERS) dans la bande de fréquence gamma pour MSI (plage approximative : 30-50 Hz), ESI (plage approximative : 40-50 Hz) et EMSI (plage approximative : 30-50 Hz) (Graphique 5D). Pour les réponses évoquées motrices, une suppression de l’activité du rythme mu a été observée sur le controlatéral M1 au cours du début du mouvement (Graphique 6A). Dans Graphique 6B, nous avons rapporté le champ topographique et les cartes potentielles des zones cérébrales activées pendant la tâche motrice pour la MEG et l’HD-EEG, respectivement. Les cartes de champ MEG ont indiqué des altérations claires de l’influx et de l’écoulement magnétiques dans les zones centrales controlatérales du cerveau, ce qui peut indiquer un générateur focal sous-jacent dans le controlatéral M1 (Graphique 6B). Les cartes de potentiel HD-EEG ont montré un changement de polarité focale dans les mêmes zones, avec des potentiels électriques perpendiculaires aux champs magnétiques (Graphique 6B). Les pics d’activation maximale de la source ont été observés lors de l’exécution de la tâche de tapotement au niveau du gyrus précentral controlatéral de l’atlas de Desikan-Killiany pour MSI, ESI et EMSI, respectivement, comme le montrent les Graphique 6C. Les réponses corticales liées à la motricité survenant lors de l’anticipation du mouvement de tapotement à venir ont montré que le SERS se trouvait dans les bandes bêta et gamma pour le MSI (plage approximative : 20-30 Hz) et l’EMSI (plage approximative : 20-40 Hz) et la bande gamma pour l’ESI (plage approximative : 30-50 Hz), désignées dans la littérature comme mu rhythm suppression (Graphique 6D).55,56 Les champs et les potentiels évoqués auditifs en réponse à la stimulation auditive ont eu un pic positif maximal à ~80 ms et ~120 ms après le début de l’administration du stimulus pour la MEG et l’HD-EEG, respectivement (Graphique 7A). Dans Graphique 7B, nous avons rapporté le champ topographique et les cartes potentielles des localisations corticales impliquées dans la stimulation auditive pour la MEG et l’EEG-HD, respectivement. Dans la MEG et l’EEG HD, un changement de polarité évident avec des pôles négatifs et positifs clairement définis au niveau des capteurs couvrant les zones temporales gauches du cerveau a été observé ; ces cartes de champ magnétique perpendiculaire et de potentiel électrique peuvent révéler un générateur de focale sous-jacent dans V1 (Graphique 7B). En effectuant une localisation de la source sur les champs et les potentiels auditifs moyennés, une activation corticale maximale a été observée au niveau du gyrus temporal transverse et de la partie postérieure du gyrus temporal supérieur de l’atlas de Desikan-Killiany pour MSI, ESI et EMSI, respectivement (Graphique 7C). L’analyse temps-fréquence des réponses évoquées auditives a révélé un ERS dans la bande gamma pour MSI (plage approximative : 40-60 Hz) et EMSI (plage approximative : 35-50 Hz), et dans les bandes de fréquences bêta et gamma (plage approximative : 25-60 Hz) pour ESI (Graphique 7D). Enfin, nous avons observé la première activité corticale en réponse à la stimulation tactile à ~60 et ~50 ms après le début du stimulus pour la MEG et l’HD-EEG, respectivement (Graphique 8A). Dans Graphique 8B, nous avons rapporté le champ topographique et les cartes potentielles des zones cérébrales activées lors de la stimulation somatosensorielle pour la MEG et l’EEG-HD, respectivement. Les cartes de champ MEG ont révélé un changement de polarité clair avec des altérations distinctes du flux magnétique aux capteurs couvrant les zones pariétales controlatérales, tandis que les cartes de potentiel HD-EEG ont montré un changement de polarité moins évident dans les mêmes zones avec un pôle positif plus fort que le pôle négatif. Ces cartes de champ magnétique perpendiculaire et de potentiel électrique peuvent indiquer un générateur cortical focal dans S1. En utilisant la dSPM sur les réponses évoquées somatosensorielles moyennes, l’activité maximale de la source corticale à ce point temporel a été observée dans le gyrus postcentral controlatéral de l’atlas de Desikan-Killiany pour MSI, ESI et EMSI, respectivement (Graphique 8C). En réponse aux stimuli tactiles, l’ERS dans les bandes de fréquences bêta et gamma pour MSI (plage approximative : 15-40 Hz) et EMSI (plage approximative : 20-40 Hz), et la bande de fréquence gamma pour ESI (plage approximative : 30-40 Hz) (Graphique 8D) ont également été observés.
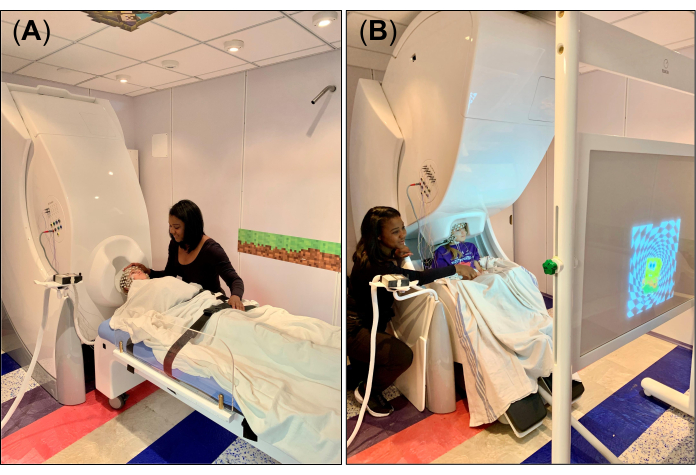
Figure 1 : Configuration expérimentale pour la MEG et l’EEG HD simultanés au CCHCS. (A) Systèmes HD-EEG (256 canaux) et MEG (306 capteurs) avec le portique de la MEG réglé en position couchée (90°, position horizontale) pour un enregistrement de l’état de repos/sommeil à l’aide du lit non magnétique compatible MEG. Le technicien prépare le sujet (une fillette de 9 ans) à l’enregistrement tout en assurant sécurité et confort. (B) Systèmes HD-EEG et MEG réglés pour un enregistrement en position assise à l’aide du fauteuil non magnétique compatible MEG. Le technicien prépare le sujet pour l’enregistrement tout en s’assurant de la bonne position du sujet devant l’écran où les stimuli visuels seront projetés pendant la tâche visuomotrice. Veuillez cliquer ici pour voir une version agrandie de cette figure.
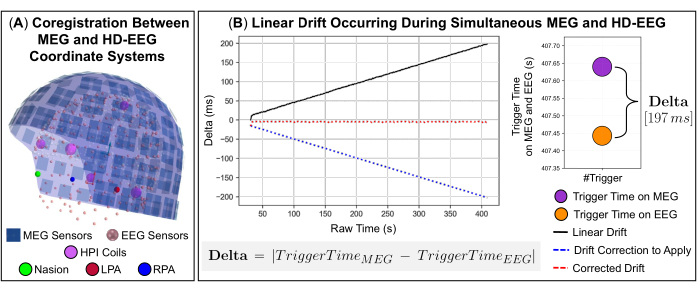
Figure 2 : Aspects techniques de la combinaison de données provenant d’enregistrements simultanés MEG et HD-EEG à l’aide de différents systèmes d’acquisition. (A) Alignement spatial (coregistration) des capteurs MEG et HD-EEG dans le même système de coordonnées (défini par les coordonnées de la tête du sujet) pour un sujet représentatif (une fillette de 9 ans). Les coordonnées de la tête du sujet sont représentées par les points repères suivants : nasion (de couleur verte) et points préauriculaires gauche/droit (de couleur rouge et bleue, respectivement). Les 306 capteurs MEG (de couleur bleue) - 102 magnétomètres et 204 gradiomètres planaires - et les bobines de l’indicateur de position de la tête (HPI) (de couleur magenta) sont affichés ; alignés dans le même système de coordonnées, les 256 canaux HD-EEG sont également affichés (de couleur rose). (B) Panneau de gauche : Dérive linéaire (c’est-à-dire delta, affiché par une ligne noire) d’échantillons de données se produisant entre les systèmes MEG et HD-EEG pour un sujet représentatif (une fillette de 9 ans). Delta est défini comme la valeur absolue de la différence entre les moments où le même déclencheur est envoyé aux systèmes MEG et EEG et augmente continuellement au fil du temps : de valeurs faibles (delta = 0 ms) à élevées (delta = 197 ms). La correction de la dérive linéaire estimée à l’aide d’une fonction polynomiale à appliquer aux signaux est affichée par une ligne pointillée bleue. La dérive corrigée (delta ~0 ms dans le temps) représentant un temps synchronisé entre les systèmes MEG et EEG est affichée par une ligne pointillée rouge. Panneau de droite : la représentation graphique du décalage temporel (delta = 197 ms) estimé pour le dernier déclencheur envoyé aux systèmes MEG et EEG est affichée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
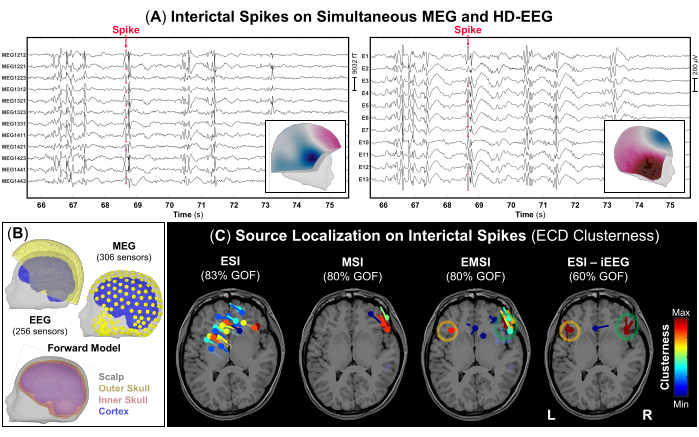
Figure 3 : Décharges épileptiformes interictales (DEI) sur les données MEG et EEG-HD. (A) Partie temporelle de l’enregistrement simultané de la MEG et de l’EEG-HD (10 s) d’une fillette de 10 ans (Cas 1) présentant des DEI fréquents. Un sous-groupe de 306 capteurs MEG et de 256 électrodes EEG a été sélectionné à des fins de visualisation. Le champ topographique et les cartes de potentiel au sommet d’un IED sont affichés sous forme de panneaux internes pour la MEG et l’EEG HD, respectivement. (B) Localisation des capteurs MEG et HD-EEG (de couleur jaune) coenregistrés sur la tête 3D du sujet et les surfaces corticales (de couleur bleue). Modèle de tête réaliste de la méthode des éléments limites (BEM) composé de trois couches [c’est-à-dire le cuir chevelu (de couleur grise), le crâne externe (de couleur jaune) et le crâne intérieur (de couleur rose)] reconstruites à partir de l’IRM préopératoire du sujet. (C) Les résultats de clusterness de localisation de source effectués sur des IED utilisant un dipôle de courant équivalent (ECD) sont présentés sur l’IRM préopératoire du sujet pour ESI, MSI, EMSI et ESI sur iEEG (gold standard)52. Les cartes thermiques de l’agrégation des dipôles avec une qualité de l’ajustement de >60 % sont affichées des valeurs les plus basses (en bleu) et les plus élevées (en rouge). La zone d’apparition des crises définie par l’ESI réalisée sur les données iEEG a été considérée comme l’étalon-or (cercles orange et vert). Veuillez cliquer ici pour voir une version agrandie de cette figure.
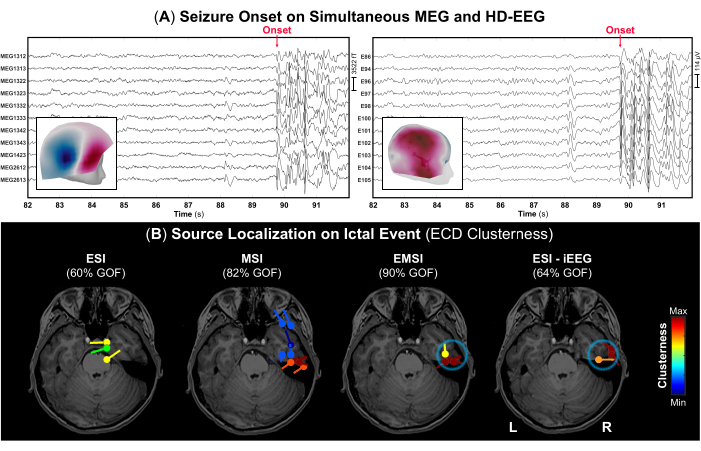
Figure 4 : Début des crises sur les données MEG et HD-EEG. (A) Partie temporelle de l’enregistrement simultané de la MEG et de l’EEG-HD (10 s) d’un garçon de 13 ans (cas 2) avec le début de la crise (flèche rouge). Un sous-groupe de 306 capteurs MEG et de 256 électrodes EEG a été sélectionné à des fins de visualisation. Le champ topographique et les cartes de potentiel au début de l’ictal sont affichés sous forme de panneaux internes pour la MEG et l’EEG HD, respectivement. (B) Les résultats de l’agrégation de localisation de la source effectués au début de l’événement ictal à l’aide de la méthode du dipôle de courant équivalent (ECD) sont présentés sur l’IRM préopératoire du sujet pour ESI, MSI, EMSI et ESI sur iEEG (étalon-or)52. Les cartes thermiques de l’agrégation des dipôles avec une qualité de l’ajustement de >60 % sont affichées des valeurs les plus basses (en bleu) et les plus élevées (en rouge). La zone d’apparition des crises définie par l’ESI réalisée sur les données iEEG a été considérée comme l’étalon-or (cercle bleu). Veuillez cliquer ici pour voir une version agrandie de cette figure.
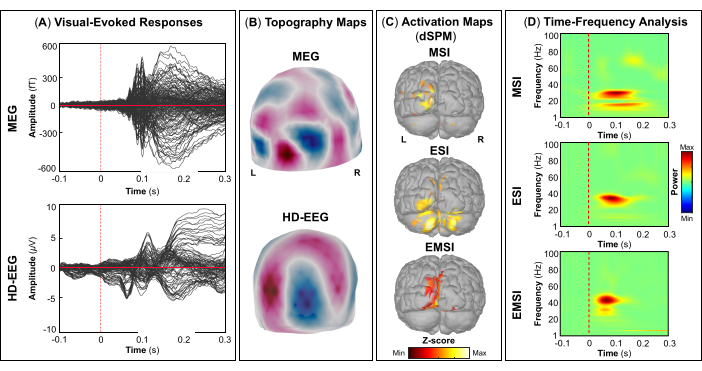
Figure 5 : Champs et potentiels évoqués visuellement à partir de données MEG et HD-EEG. (A) Les réponses visuelles évoquées moyennes d’une femelle de 15 ans pour la MEG (panneau supérieur) et l’EEG-HD (panneau inférieur) sont affichées pour l’intervalle de temps compris entre -100 ms et 300 ms. (B) Le champ topographique et les cartes de potentiel du cortex visuel primaire sont affichés pour la MEG et l’EEG-HD, respectivement. (C) Cartes d’activation de la source avec des amplitudes maximales d’activation corticale dans les régions cérébrales de l’atlas de Desikan-Killiany (à savoir, le cuneus et le cortex occipital latéral) estimées à l’aide de la méthode de cartographie paramétrique statistique dynamique (dSPM) pour MSI, ESI et EMSI, respectivement. Les cartes thermiques de l’activation de la source (score z normalisé dSPM) sont affichées. (D) Les cartes temps-fréquence obtenues à l’aide de la décomposition temps-fréquence en ondelettes de Morlet sur les réponses évoquées visuellement au niveau du cortex visuel primaire sont affichées pour la fenêtre temporelle de -100 ms à 300 ms. Des cartes thermiques de la puissance temps-fréquence, exprimées en pourcentages sur la base de l’écart des données normalisées par rapport à la moyenne par rapport à la ligne de base [-200 ; 0] ms, sont affichées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
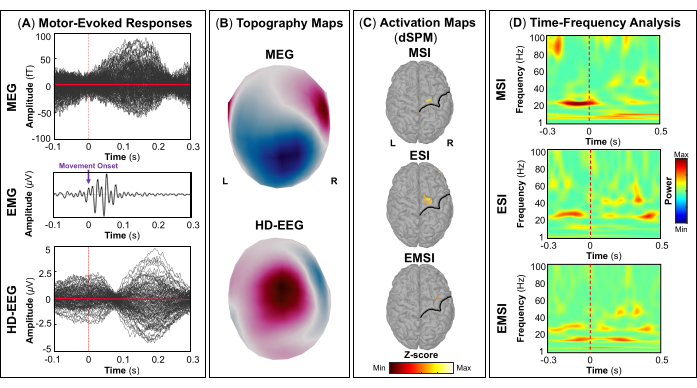
Figure 6 : Champs et potentiels évoqués par moteur à partir de données MEG et HD-EEG. (A) Les réponses évoquées par moteur moyennes d’une femelle de 15 ans pour la MEG (panneau du haut) et l’EEG HD (panneau du bas) sont affichées pour la tâche de tapotement de l’index gauche dans l’intervalle de temps compris entre -100 et 300 ms. Le signal d’électromyographie (EMG) (panneau du milieu) avec le début du mouvement (flèche violette) est affiché pour l’intervalle de temps entre -100 ms et 300 ms ; le signal est filtré dans la bande de fréquences 30-300 Hz (filtre coupe-bande : 60 Hz). (B) Le champ topographique et les cartes potentielles du cortex moteur primaire sont affichés pour la MEG et l’EEG-HD, respectivement. (C) Cartes d’activation de la source avec des amplitudes maximales d’activation corticale au niveau du gyrus précentral controlatéral de l’atlas de Desikan-Killiany estimées à l’aide de la méthode de cartographie paramétrique statistique dynamique (dSPM) pour MSI, ESI et EMSI, respectivement. Des cartes thermiques de l’activation de la source (score z normalisé dSPM) sont affichées, ainsi que le sillon central (ligne noire). (D) Cartes temps-fréquence obtenues à l’aide de la décomposition temps-fréquence en ondelettes de Morlet sur les réponses évoquées par moteur au niveau du cortex moteur primaire pour la fenêtre temporelle de -300 ms à 500 ms. Des cartes thermiques de la puissance temps-fréquence, exprimée en pourcentages sur la base de l’écart des données normalisées par rapport à la moyenne sur la ligne de base [-1500 ; -1000] ms, sont affichées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
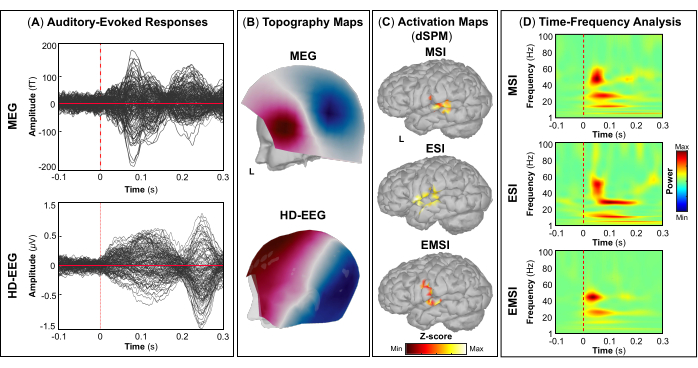
Figure 7 : Champs et potentiels évoqués auditifs à partir de données MEG et HD-EEG. (A) Les réponses évoquées auditives moyennes d’une jeune fille de 15 ans pour la MEG (panneau supérieur) et l’EEG-HD (panneau inférieur) sont affichées pour l’intervalle de temps compris entre -100 ms et 300 ms. (B) Le champ topographique et les cartes de potentiel du cortex auditif primaire sont affichés pour la MEG et l’EEG-HD, respectivement. (C) Cartes d’activation de la source avec des amplitudes maximales d’activation corticale au niveau du gyrus temporal transversal et de la partie postérieure du gyrus temporal supérieur de l’atlas de Desikan-Killiany estimées à l’aide de la méthode de cartographie paramétrique statistique dynamique (dSPM) pour MSI, ESI et EMSI, respectivement. Les cartes thermiques de l’activation de la source (score z normalisé dSPM) sont affichées. (D) Cartes temps-fréquence obtenues à l’aide de la décomposition temps-fréquence en ondelettes de Morlet sur les réponses évoquées auditives au niveau du cortex auditif primaire pour la fenêtre temporelle de -100 à 300 ms. Des cartes thermiques de la puissance temps-fréquence, exprimées en pourcentages sur la base de l’écart des données normalisées par rapport à la moyenne sur la ligne de base [-500 ; 0] ms, sont affichées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
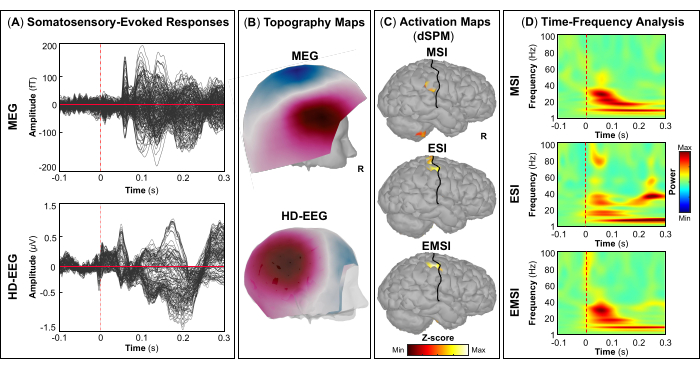
Figure 8 : Champs et potentiels évoqués par les somatocapteurs à partir de données MEG et HD-EEG. (A) Les réponses évoquées somatosensorielles moyennes d’une femelle de 15 ans pour la MEG (panneau du haut) et l’EEG-HD (panneau du bas) sont affichées pour la stimulation des chiffres de gauche dans l’intervalle de temps compris entre -100 et 300 ms. (B) Le champ topographique et les cartes de potentiel du cortex somatosensoriel primaire sont affichés pour la MEG et l’EEG-HD, respectivement. (C) Cartes d’activation de la source avec des amplitudes maximales d’activation corticale au niveau du gyrus postcentral controlatéral de l’atlas de Desikan-Killiany estimées à l’aide de la méthode de cartographie paramétrique statistique dynamique (dSPM) pour MSI, ESI et EMSI, respectivement. Des cartes thermiques de l’activation de la source (score z normalisé dSPM) sont affichées, ainsi que le sillon central (ligne noire). (D) Cartes temps-fréquence obtenues à l’aide de la décomposition temps-fréquence en ondelettes de Morlet sur les réponses évoquées somatosensorielles au niveau du cortex somatosensoriel primaire pour la fenêtre temporelle de -100 ms à 300 ms. Des cartes thermiques de la puissance temps-fréquence, exprimée en pourcentages sur la base de l’écart des données normalisées par rapport à la moyenne sur la ligne de base [-100 ; 0] ms, sont affichées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Dans cette étude, nous illustrons le dispositif expérimental permettant d’enregistrer simultanément la MEG et l’EEG HD chez les enfants atteints de TRD pendant qu’ils se reposent/dorment, effectuent une tâche ou reçoivent des stimuli, et proposons un cadre méthodologique pour localiser la zone irritative, la SOZ et les zones cérébrales éloquentes à l’aide de l’EMSI, ainsi que de la MSI et de l’ESI individuelles. Nous fournissons en outre des recommandations techniques pour fusionner les données MEG et HD-EEG de différents produits disponibles dans le commerce qui présentent des caractéristiques uniques. Nous présentons les données de trois cas pour améliorer l’utilité clinique de l’EMSI dans la localisation des zones cérébrales épileptogènes et éloquentes. Les résultats indiquent que les résultats d’EMSI surpassent ceux obtenus par l’une ou l’autre modalité seule, très probablement en raison de la valeur additive des propriétés complémentaires des signaux MEG et EEG dans la solution combinée et peut-être en raison de l’augmentation du nombre de capteurs utilisés pour l’enregistrement des données (> 550 capteurs). En particulier, EMSI a localisé de manière non invasive les zones irritatives et SOZ avec des résultats concordants comme ESI sur l’étalon-or iEEG, ce qui a confirmé les observations cliniques.
La méthodologie proposée comprend les étapes critiques suivantes : (i) acquisition de haute qualité d’enregistrements simultanés MEG et HD-EEG (c’est-à-dire à rapport signal/bruit élevé) avec un échantillonnage spatial élevé de capteurs (>550 capteurs) couvrant l’ensemble du cerveau des activités interictales et ictales, ainsi que des champs et des potentiels visuels, moteurs, auditifs et somatosensoriels évoqués, chez des enfants atteints d’ERD (étapes 3.1-3.2) ; (ii) synchronisation temporelle et co-enregistrement spatial des signaux MEG et HD-EEG enregistrés avec différents systèmes d’acquisition (étape 3.12) ; (iii) un prétraitement et une sélection minutieux des parties de données contenant respectivement l’activité interictale (étapes 4.1.1 à 4.1.7), l’activité d’apparition de l’ictal (étapes 4.2.1 à 4.2.7) et les réponses liées aux événements (étapes 4.3.1 à 4.3.6) ; et (iv) localisation précise de la source de la zone irritative, de la SOZ et des zones cérébrales éloquentes d’intérêt à l’aide de méthodes fiables de localisation de la source (p. ex., ECD avec regroupement et dSPM) (étapes 4.1.8-4.1.9, 4.2.8-4.2.9 et 4.3.7-4.3.9, respectivement).
L’étape la plus critique lors de la réalisation simultanée d’enregistrements MEG et HD-EEG est de synchroniser spatialement (alignement entre les espaces de coordonnées) et temporellement (correction de la dérive de l’horloge linéaire) les données enregistrées par les deux systèmes d’acquisition. Une telle synchronisation est cruciale pour garantir l’identification correcte des événements interictal, ictal et visuels/moteurs/auditifs/tactiles qui se produisent simultanément dans les signaux MEG et HD-EEG. Des erreurs dans la sélection des points temporels de ces événements peuvent affecter les résultats de localisation de la source et identifier les zones du cerveau qui ne sont pas nécessairement impliquées dans la génération de ces événements.
Les systèmes MEG offrent souvent des systèmes EEG compatibles à 32, 64 et 128 canaux intégrés au produit pour effectuer des mesures MEG et EEG simultanées. Dans ces cas, il n’est pas nécessaire de synchroniser temporellement les données en envoyant des signaux de déclenchement communs. De même, la plupart des systèmes EEG sont aujourd’hui compatibles avec tous les systèmes MEG. Malgré ces progrès matériels, seuls quelques centres d’épilepsie effectuent des enregistrements simultanés MEG et HD-EEG dans le cadre de l’évaluation préchirurgicale. Ici, nous avons tiré parti d’une telle intégrabilité et combiné les systèmes MEG à 306 canaux et EEG à 256 canaux pour enregistrer simultanément l’activité cérébrale avec > 550 capteurs couvrant la tête du sujet. Jusqu’à présent, peu de logiciels d’analyse avancée des données MEG, HD-EEG et iEEG (par exemple, Brainstorm, CURRY, EEGLab, FieldTrip, MNE ou NUTMEG) sont disponibles. De futures études sont donc nécessaires pour valider la méthodologie proposée avec un nouveau logiciel d’analyse de neuroimagerie. Enfin, la combinaison de MSI et d’ESI en une solution unique (EMSI) a augmenté la complexité de calcul de l’analyse des données.
La méthode décrite présente quelques limites qui devraient être abordées dans les études futures. Nous avons sélectionné manuellement les DEI apparaissant à la fois sur les données MEG et HD-EEG de deux patients représentatifs, tout en ignorant les pics interictaux qui se sont produits dans un seul des deux signaux (MEG ou EEG). La sélection manuelle des pointes peut être une approche longue et subjective qui peut être simplifiée à l’aide d’approches automatisées de détection des EEI développées au cours des dernières décennies57,58,59. Cependant, l’inspection visuelle est toujours recommandée pour une analyse minutieuse et une détection affinée de chaque EEI. De plus, nous avons utilisé la SOZ comme approximateur de la EZ. Pourtant, la SOZ ne prédit pas toujours les résultats chirurgicaux60,61,62,63. Les études futures peuvent donc utiliser le résultat chirurgical comme vérité de terrain pour une délimitation plus précise de la zone euro13,14,15,16,17,19,20. Bien que les crises puissent être capturées avec succès à l’aide simultanées de MEG et d’EEG et localisées à l’aide de techniques de localisation à la source appropriées44,64, il est relativement rare d’enregistrer de tels événements ictaux dans la pratique clinique, en particulier chez les patients ambulatoires sous ASM. Cela est principalement dû à la durée limitée des enregistrements MEG et aux mouvements corporels excessifs qui se produisent pendant les crises (par exemple, la tête du patient a glissé hors du Dewar), ce qui peut provoquer des artefacts biologiques pouvant gravement affecter les résultats de localisation de la source. Dans une revue récente, Stefan et al. a signalé l’apparition de convulsions pendant les enregistrements MEG chez 7 à 24 % des patients, avec une durée d’enregistrement moyenne de 30 minutes à 5,7 h dans différentes études65. Au CCMC, 18 patients sur 89 (20,2 %) ont eu des événements ictaux capturés lors d’enregistrements simultanés MEG et HD-EEG effectués au cours des ~2 dernières années. Cependant, seuls 8 des 18 patients (44,4 %) ont été analysés avec succès. Dans les cas où les enregistrements de la MEG interictale montrent des résultats normaux ou non concluants, la MEG ictale ou l’EEG-HD peuvent être utilisés pour localiser la ZE avec une grande précision. Cependant, les exigences techniques et logistiques relatives à ces enregistrements doivent être prises en compte. De plus, les données représentatives de la localisation du cortex éloquent via EMSI n’ont pas été comparées à des étalons-or pour la localisation de ces zones cérébrales fonctionnelles, telles que l’IRMf non invasive ou la stimulation électrocorticale peropératoire. Des recherches plus approfondies pourraient donc intégrer l’EMSI et l’IRMf dans un outil d’imagerie multimodal non invasif afin d’améliorer la précision de localisation de ces zones cérébrales éloquentes chez les enfants atteints de TR. Ce travail peut également être étendu à la localisation d’autres zones cérébrales fonctionnelles, telles que les régions éloquentes du langage. La localisation des fonctions langagières est d’une importance cruciale lors de l’évaluation préopératoire des patients atteints d’ERD afin de déterminer leur candidature chirurgicale, de planifier l’étendue de la résection chirurgicale et de prévenir les déficits fonctionnels postopératoires permanents66. Plusieurs études non invasives ont montré que la cartographie linguistique à l’aide de la MEG peut fournir des résultats concordants, similaires au test invasif de l’AMA, qui est souvent considéré comme l’étalon-or pour identifier l’hémisphère linguistique dominant67,68,69,70. Une étude récente a proposé une approche multimodale dans laquelle la combinaison de différentes techniques (c’est-à-dire la cartographie de la stimulation corticale, l’électrocorticographie à haute gamma, l’IRMf et la stimulation magnétique transcrânienne) peut fournir des informations mutuelles, confirmatives et complémentaires pour la cartographie du langage préopératoire71. Malgré ces avantages, la cartographie des aires linguistiques reste difficile chez les patients pédiatriques qui ont des barrières cognitives, intellectuelles et linguistiques en raison de leur âge. Ainsi, des tâches plus spécifiques à l’âge et des configurations adaptées aux enfants devraient être développées dans un avenir proche. Dans ce travail, nous avons analysé les données MEG et HD-EEG à l’aide d’un logiciel qui n’est pas certifié à des fins cliniques. Bien que ces outils se soient avérés précieux et efficaces, ils comportent des problèmes de responsabilité qui doivent être pris en compte lors de la communication des résultats de l’évaluation préchirurgicale à des fins cliniques. Nous décrivons ici les procédures d’enregistrement HD-EEG en utilisant uniquement des systèmes d’électrodes EEG à base d’éponges. Les systèmes alternatifs utilisant des électrodes EEG à base de gel sont largement utilisés dans les milieux cliniques et de recherche. Bien qu’ils fournissent des enregistrements EEG SNR plus élevés, ils nécessitent un temps de préparation plus long (~40-60 min) et sont donc moins adaptés à une utilisation pédiatrique. Alternativement, plusieurs laboratoires utilisent des systèmes EEG à base de gel à faible densité lors des enregistrements MEG, qui sont avantageux en termes de temps de préparation (par rapport aux systèmes HD-EEG), mais ils offrent une résolution spatiale nettement inférieure en raison du nombre réduit d’électrodes couvrant l’ensemble du cuir chevelu12,16,72,73.
À l’heure actuelle, la localisation des zones cérébrales épileptogènes chez les patients épileptiques est encore principalement réalisée avec la surveillance iEEG. De plus, la méthodologie de localisation précise des zones cérébrales éloquentes est mal définie, et les configurations expérimentales actuellement utilisées dans les laboratoires MEG sont inappropriées pour les patients pédiatriques, alors que l’utilisation de l’EEG HD à cette fin est très limitée. La localisation précise de ces zones peut faciliter l’évaluation préchirurgicale et augmenter la planification chirurgicale pour la résection ou la mise en place d’électrodes iEEG. Jusqu’à présent, plusieurs études ont examiné la contribution de l’ESI ou de la MSI dans l’évaluation préchirurgicale des patients atteints d’ERD et d’épilepsies focales pour l’identification de l’EZ 12,13,14,15,16,17,18,19 et des zones éloquentes du cortex somatosensoriel 41respectivement. Peu d’études ont montré de meilleurs résultats de localisation de source et de performance de prédiction des résultats à l’aide d’EMSI par rapport à MSI ou ESI seuls 13,31,42. Malgré ces résultats, l’enregistrement de la MEG et de l’EEG est rarement effectué simultanément, et la MSI et l’ESI ne sont mises en œuvre que dans quelques centres d’épilepsie dans le monde. À notre connaissance, il s’agit de la première étude qui fournit des suggestions pour la collecte et l’analyse simultanées de données MEG et HD-EEG, ainsi que pour la réalisation d’EMSI dans l’épilepsie pédiatrique pour l’identification non invasive de la zone irritative, de la SOZ et des zones cérébrales éloquentes, à savoir les cortex visuel, moteur, auditif et somatosensoriel primaires.
Ici, nous avons effectué EMSI sur des pics interictaux et des événements ictaux détectés sur des données non invasives simultanées de deux patients atteints de DRE (cas 1 et 2) et avons obtenu une erreur de localisation de la source de ~9 mm et ~12 mm de la SOZ, respectivement, conformément aux études précédentes42. De manière impressionnante, une telle méthode a permis d’obtenir une précision de localisation comparable aux résultats intracrâniens (c’est-à-dire ESI sur les données iEEG), avec des dipôles groupés localisés dans la région du cerveau identifiés comme épileptogènes par les observations cliniques (Figure 3C et Figure 4B). À l’aide de données non invasives provenant d’un troisième patient représentatif atteint d’ERD (cas 3), nous avons également effectué une EMSI sur les activités visuelles, motrices, auditives et somatosensorielles évoquées et avons trouvé des modèles d’activation de source proéminents dans les zones cérébrales éloquentes correspondantes (c’est-à-dire les cortex visuel, moteur, auditif et somatosensoriel) (Figure 5C, Figure 6C, Figure 7C et Figure 8C).
Nos résultats ont été dérivés de la fusion d’informations complémentaires capturées à partir de modalités MEG et EEG qui peuvent améliorer la précision de la localisation. L’EEG est bien connu pour refléter tous les courants intracrâniens, tandis que la MEG est principalement sensible aux sources tangentielles et aveugle aux sources cérébrales profondes29,74. Comme le montre cette étude, la combinaison de la MEG et de l’EEG peut donc surmonter les limites de chaque modalité, fournir des résultats de localisation supérieurs et identifier des zones cérébrales épileptogènes et éloquentes que l’ESI ou la MSI auraient pu manquer si elles étaient utilisées seules. De plus, nous présentons une approche alternative non invasive pour cartographier des zones cérébrales éloquentes à l’aide de l’EMSI chez les patients qui n’ont pas subi d’IRMf lors de leur évaluation préchirurgicale.
La localisation des zones cérébrales épileptogènes et éloquentes à l’aide de techniques non invasives, telles que la MEG et l’EEG simultanés, est une étape essentielle lors de l’évaluation préopératoire des enfants atteints de TR pour l’ablation complète ou la déconnexion de la ZE tout en préservant les aires corticales éloquentes. La méthodologie proposée offre une description détaillée de l’acquisition et de l’analyse simultanées de données MEG et EEG qui soutient son application non seulement dans l’évaluation préchirurgicale de l’épilepsie, mais aussi dans les neurosciences cognitives pour explorer les fonctions physiologiques du cerveau sain chez les enfants en développement typique ainsi que chez les adultes en bonne santé, ainsi que les changements morphologiques et fonctionnels du cerveau associés à l’épilepsie ou à d’autres troubles neurologiques. Des études futures portant sur les réseaux cérébraux épileptogènes pourraient également évaluer si les centres de réseau (c’est-à-dire des régions cérébrales hautement connectées) estimés de manière non invasive à l’aide de l’EMSI sur des données simultanées MEG et HD-EEG peuvent localiser plus précisément l’EZ chez les enfants atteints d’ERD que ceux estimés à l’aide de l’EMI et/ou de l’ESI seuls 75,76,77. De plus, la cartographie non invasive des propagations spatio-temporelles des pointes et des ondulations (c’est-à-dire les oscillations à haute fréquence, >80 Hz), estimée par EMSI, peut aider à mieux comprendre les mécanismes physiopathologiques de la propagation de l’activité épileptiforme et à évaluer de manière non invasive le générateur de début de ces propagations qui est un biomarqueur précis de l’EZ78,79. Le protocole présenté peut aider à étudier plus avant la complémentarité des systèmes MEG et EEG en examinant la sensibilité des réseaux de capteurs MEG et EEG à des sources d’orientations différentes. Une telle analyse peut fournir des informations sur les propriétés électrophysiologiques du cerveau lors de la réalisation simultanée de MEG et d’EEG HD.
Déclarations de divulgation
Les auteurs ne rapportent aucune divulgation.
Remerciements
Ces travaux ont été soutenus par l’Institut national des troubles neurologiques et des accidents vasculaires cérébraux (R01NS104116 ; R01NS134944 ; Chercheur principal : Christos Papadelis).
matériels
| Name | Company | Catalog Number | Comments |
| AIRSTIM unit | SD Instruments | N/A | The SDI AIRSTIM system is an alternative unconditioned stimulus to shock |
| Baby Shampoo | Johnson's | N/A | Baby Shampoo is as gentle to the eyes as pure water and is specially designed to gently cleanse baby’s delicate hair and scalp. |
| Control III disinfectant cleaning solution | Maril Products, Inc. | http://www.controlthree.com/ | Disinfectant and germicide solution formulated for hospitals |
| Elekta Neuromag | TRIUX | NM24132A | Comprehensive bioelectromagnetic measurement system characterized by 306-channel neuromagnetometer for functional brain studies |
| FASTRAK | Polhemus technology | NS-7806 | Using A/C electromagnetic technology, FASTRAK delivers accurate position and orientation data, with virtually no latency. With a single magnetic source, FASTRAK delivers data for up to four sensors. The source emits an electromagnetic field, sensors within the field of range are tracked in full 6DOF (6 Degrees-Of-Freedom). Setup is simple and intuitive, with no user calibration required. |
| Genuine Grass Reusable Cup EEG Electrodes | Natus Medical, Inc. | N/A | Each Genuine Grass EEG Electrode undergoes rigorous mechanical and electrical testing to assure long life for unsurpassed recording clarity and dependability. |
| Geodesic Sensor Net | Electrical Geodesics, Inc. | S-MAN-200-GSNR-001 | 32 to 256 electrodes to place on the human head to aquire dense-array electroencephalography data |
| GeoScan Sensor Digitization System | Electrical Geodesics, Inc. | 8100550-03 | Handheld Scanner and Software for 3D electrode position registration |
| Natus Xltek NeuroWorks | Natus Medical, Inc. | https://natus.com/ | The Natus NeuroWorks platform simplifies the process of collecting, monitoring and managing data for routine EEG testing, ambulatory EEG, long-term monitoring, ICU monitoring, and research studies. |
| Natus NeuroWorks EEG Software | Natus Medical, Inc. | https://natus.com/neuro/neuroworks-eeg-software/ | NeuroWorks EEG software simplifies the process of collecting, monitoring, trending and managing EEG testing data, allowing care providers to save time and focus on delivering the best care. |
| ROSA ONE Brain | Zimmer Biomet | https://www.zimmerbiomet.com/en/products-and-solutions/zb-edge/robotics/rosa-brain.html | ROSA ONE Brain is a robotic solution to assist surgeons in planning and performing complex neurosurgical procedures through a small drill hole in the skull. |
| Ten20 Conductive Paste | Weaver and company | N/A | Ten20 contains the right balance of adhesiveness and conductivity, enabling the electrodes to remain in place while allowing the transmittance of electrical signals. |
Références
- Oldham, M. S., Horn, P. S., Tsevat, J., Standridge, S. Costs and clinical outcomes of epilepsy surgery in children with drug-resistant epilepsy. Pediatr Neurol. 53 (3), 216-220 (2015).
- Willie, J. T., et al. Real-time magnetic resonance-guided stereotactic laser amygdalohippocampotomy for mesial temporal lobe epilepsy. Neurosurgery. 74 (6), 569-584 (2014).
- Rosenow, F., Lüders, H. Presurgical evaluation of epilepsy. Brain. 124, Pt 9 1683-1700 (2001).
- Önal, Ç, et al. Complications of invasive subdural grid monitoring in children with epilepsy). J Neurosurg. 98 (5), 1017-1026 (2003).
- Hader, W. J., et al. Complications of epilepsy surgery-a systematic review of focal surgical resections and invasive EEG monitoring. Epilepsia. 54 (5), 840-847 (2013).
- Meng, Y., et al. Risk factors for surgical site infection after intracranial electroencephalography monitoring for epilepsy in the pediatric population. J Neurosurg Pediatr. 22 (1), 31-36 (2018).
- Jobst, B. C., et al. Intracranial EEG in the 21st Century. Epilepsy Curr. 20 (4), 180-188 (2020).
- Schwartz, E. S., et al. Magnetoencephalography for pediatric epilepsy: how we do it. AJNR Am J Neuroradiol. 29 (5), 832-837 (2008).
- Michel, C. M., et al. Electric source imaging of human brain functions. Brain Res Rev. 36 (2-3), 108-118 (2001).
- Michel, C. M., He, B. EEG source localization. Handb Clin Neurol. 160, 85-101 (2019).
- Michel, C. M., Brunet, D. EEG source imaging: A practical review of the analysis steps. Front Neurol. 10, 325(2019).
- Plummer, C., et al. Interictal and ictal source localization for epilepsy surgery using high-density EEG with MEG: a prospective long-term study. Brain. 142 (4), 932-951 (2019).
- Duez, L., et al. Electromagnetic source imaging in presurgical workup of patients with epilepsy: A prospective study. Neurology. 92 (6), e576-e586 (2019).
- Mouthaan, B. E., et al. Diagnostic accuracy of interictal source imaging in presurgical epilepsy evaluation: A systematic review from the E-PILEPSY consortium. Clin Neurophysiol. 130 (5), 845-855 (2019).
- Pellegrino, G., et al. Clinical yield of magnetoencephalography distributed source imaging in epilepsy: A comparison with equivalent current dipole method. Hum Brain Mapp. 39 (1), 218-231 (2018).
- Tamilia, E., et al. Assessing the localization accuracy and clinical utility of electric and magnetic source imaging in children with epilepsy. Clin Neurophysiol. 130 (4), 491-504 (2019).
- Coito, A., et al. Interictal epileptogenic zone localization in patients with focal epilepsy using electric source imaging and directed functional connectivity from low-density EEG. Epilepsia Open. 4 (2), 281-292 (2019).
- Singh, J., Ebersole, J. S., Brinkmann, B. H. From theory to practical fundamentals of electroencephalographic source imaging in localizing the epileptogenic zone. Epilepsia. 63 (10), 2476-2490 (2022).
- Brodbeck, V., et al. Electrical source imaging for presurgical focus localization in epilepsy patients with normal MRI. Epilepsia. 51 (4), 583-591 (2010).
- Santalucia, R., et al. Clinical added value of interictal automated electrical source imaging in the presurgical evaluation of MRI-negative epilepsy: A real-life experience in 29 consecutive patients. Epilepsy Behav. 143, 109229(2023).
- Schneider, F., et al. Magnetic source imaging in non-lesional neocortical epilepsy: additional value and comparison with ICEEG. Epilepsy Behav. 24 (2), 234-240 (2012).
- Hämäläinen, M., Hari, R., Ilmoniemi, R. J., Knuutila, J., Lounasmaa, O. V. Magnetoencephalography-theory, instrumentation, and applications to noninvasive studies of the working human brain. Rev Mod Phys. 65, 413-497 (1993).
- Baillet, S., Mosher, J. C., Leahy, R. M. Electromagnetic brain mapping. IEEE Signal Process Mag. 18 (6), 14-30 (2001).
- Fuchs, M., Kastner, J., Tech, R., Wagner, M., Gasca, F. MEG and EEG dipole clusters from extended cortical sources. Biomed Eng Lett. 7 (3), 185-191 (2017).
- Singh, S. P. Magnetoencephalography: Basic principles. Ann Indian Acad Neurol. 17, Suppl 1 S107-S112 (2014).
- Ahlfors, S. P., Han, J., Belliveau, J. W., Hämäläinen, M. S. Sensitivity of MEG and EEG to source orientation. Brain Topogr. 23, 227-232 (2010).
- Kim, H., Chung, C. K., Hwang, H. Magnetoencephalography in pediatric epilepsy. Korean J Pediatr. 56 (10), 431-438 (2013).
- Gorjan, D., Gramann, K., De Pauw, K., Marusic, U. Removal of movement-induced EEG artifacts: Current state of the art and guidelines. J Neural Eng. , (2022).
- Barkley, G. L., Baumgartner, C. MEG and EEG in epilepsy. J Clin Neurophysiol. 20 (3), 163-178 (2003).
- Ebersole, J. S., Ebersole, S. M. Combining MEG and EEG source modeling in epilepsy evaluations. J Clin Neurophysiol. 27 (6), 360-371 (2010).
- Yoshinaga, H., et al. Benefit of simultaneous recording of EEG and MEG in dipole localization. Epilepsia. 43 (8), 924-928 (2002).
- Baumgartner, C. Controversies in clinical neurophysiology. MEG is superior to EEG in the localization of interictal epileptiform activity: Con. Clin Neurophysiol. 115 (5), 1010-1020 (2004).
- Barkley, G. L. Controversies in neurophysiology. MEG is superior to EEG in localization of interictal epileptiform activity: Pro. Clin Neurophysiol. 115 (5), 1001-1009 (2004).
- Braeutigam, S. Magnetoencephalography: Fundamentals and established and emerging clinical applications in radiology. ISRN Radiol. 2013, 529463(2013).
- Papadelis, C., et al. Current and emerging potential for magnetoencephalography in pediatric epilepsy. J Pediatr Epilepsy. 2 (1), 73-85 (2013).
- Fiedler, P., Fonseca, C., Supriyanto, E., Zanow, F., Haueisen, J. A high-density 256-channel cap for dry electroencephalography. Hum Brain Mapp. 43 (4), 1295(2022).
- Sharon, D., Hämäläinen, M. S., Tootell, R. B. H., Halgren, E., Belliveau, J. W. The advantage of combining MEG and EEG: comparison to fMRI in focally-stimulated visual cortex. Neuroimage. 36 (4), 1225(2007).
- Pataraia, E., Lindinger, G., Deecke, L., Mayer, D., Baumgartner, C. Combined MEG/EEG analysis of the interictal spike complex in mesial temporal lobe epilepsy. Neuroimage. 24 (3), 607-614 (2005).
- Ahmed Mahmutoglu, M., Rupp, A., Baumgärtner, U. Simultaneous EEG/MEG yields complementary information of nociceptive evoked responses. Clin Neurophysiol. 143, 21-35 (2022).
- Aydin, Ü, et al. Combined EEG/MEG can outperform single modality EEG or MEG source reconstruction in presurgical epilepsy diagnosis. PLoS One. 10 (3), e0118753(2015).
- Bast, T., et al. Combined EEG and MEG analysis of early somatosensory evoked activity in children and adolescents with focal epilepsies. Clin Neurophysiol. 118 (8), 1721-1735 (2007).
- Chikara, R. K., et al. Electromagnetic source imaging predicts surgical outcome in children with focal cortical dysplasia. Clin Neurophysiol. 153, 88-101 (2023).
- Hari, R., et al. IFCN-endorsed practical guidelines for clinical magnetoencephalography (MEG). Clin Neurophysiol. 129 (8), 1720-1747 (2018).
- Bagić, A. I., Knowlton, R. C., Rose, D. F., Ebersole, J. S. American Clinical Magnetoencephalography Society Clinical Practice Guideline 1: Recording and analysis of spontaneous cerebral activity. J Clin Neurophysiol. 28 (4), 348-354 (2011).
- Papadelis, C., Chen, Y. H. Pediatric magnetoencephalography in clinical practice and research. Neuroimaging Clin N Am. 30 (2), 239-248 (2020).
- De Macedo Rodrigues, K., et al. A FreeSurfer-compliant consistent manual segmentation of infant brains spanning the 0-2 year age range. Front Hum Neurosci. 9, 21(2015).
- Tadel, F., Baillet, S., Mosher, J. C., Pantazis, D., Leahy, R. M. Brainstorm: A user-friendly application for MEG/EEG analysis. Comput Intell Neurosci. 2011, 879716(2011).
- Kane, N., et al. A revised glossary of terms most commonly used by clinical electroencephalographers and updated proposal for the report format of the EEG findings. Revision 2017. Clin Neurophysiol Pract. 2, 170-185 (2017).
- Lantz, G., et al. Propagation of interictal epileptiform activity can lead to erroneous source localizations: a 128-channel EEG mapping study. J Clin Neurophysiol. 20 (5), 311-319 (2003).
- Vorwerk, J., et al. A guideline for head volume conductor modeling in EEG and MEG. Neuroimage. 100, 590-607 (2014).
- Schrader, S., et al. DUNEuro-A software toolbox for forward modeling in bioelectromagnetism. PLoS One. 16 (6), e0252431(2021).
- Ntolkeras, G., et al. Presurgical accuracy of dipole clustering in MRI-negative pediatric patients with epilepsy: Validation against intracranial EEG and resection. Clin Neurophysiol. 141, 126-138 (2022).
- David, O., Kilner, J. M., Friston, K. J. Mechanisms of evoked and induced responses in MEG/EEG. Neuroimage. 31, 1580-1591 (2006).
- Pantev, C. Evoked and induced gamma-band activity of the human cortex. Brain Topogr. 7 (4), 321-330 (1995).
- Fox, N. A., et al. Assessing human mirror activity with EEG mu rhythm: A meta-analysis. Psychol Bull. 142 (3), 291-313 (2016).
- Genzer, S., Ong, D. C., Zaki, J., Perry, A. Mu rhythm suppression over sensorimotor regions is associated with greater empathic accuracy. Soc Cogn Affect Neurosci. 17 (9), 788-801 (2022).
- Janmohamed, M., et al. Moving the field forward: detection of epileptiform abnormalities on scalp electroencephalography using deep learning-clinical application perspectives. Brain Commun. 4 (5), 218(2022).
- Bagheri, E., Jin, J., Dauwels, J., Cash, S., Westover, M. B. A fast machine learning approach to facilitate the detection of interictal epileptiform discharges in the scalp electroencephalogram. J Neurosci Methods. 326, 108362(2019).
- Thomas, J., et al. Automated detection of interictal epileptiform discharges from scalp electroencephalograms by convolutional neural networks. Int J Neural Syst. 30 (11), 2050030(2020).
- Zijlmans, M., Zweiphenning, W., van Klink, N. Changing concepts in presurgical assessment for epilepsy surgery. Nat Rev Neurol. 15 (10), 594-606 (2019).
- Akiyama, T., et al. Focal resection of fast ripples on extraoperative intracranial EEG improves seizure outcome in pediatric epilepsy. Epilepsia. 52 (10), 1802-1811 (2011).
- Duncan, J. S., Winston, G. P., Koepp, M. J., Ourselin, S. Brain imaging in the assessment for epilepsy surgery. Lancet Neurol. 15 (4), 420(2016).
- Jacobs, J., et al. High-frequency electroencephalographic oscillations correlate with outcome of epilepsy surgery. Ann Neurol. 67 (2), 209-220 (2010).
- Ricci, L., et al. Virtual implantation using conventional scalp EEG delineates seizure onset and predicts surgical outcome in children with epilepsy. Clin Neurophysiol. 139, 49-57 (2022).
- Stefan, H., Rampp, S. Interictal and Ictal MEG in presurgical evaluation for epilepsy surgery. Acta Epileptologica. 2, 11(2020).
- Jahangiri, F. R., Chima, G. S., Pearson, M., Jackson, J., Siddiqui, A. A. Mapping of the language cortex. Cureus. 13 (5), e14960(2021).
- Merrifield, W. S., Simos, P. G., Papanicolaou, A. C., Philpott, L. M., Sutherling, W. W. Hemispheric language dominance in magnetoencephalography: sensitivity, specificity, and data reduction techniques. Epilepsy Behav. 10 (1), 120-128 (2007).
- Wheless, J. W., et al. Magnetoencephalography (MEG) and magnetic source imaging (MSI). Neurologist. 10 (3), 138-153 (2004).
- Breier, J. I., Simos, P. G., Zouridakis, G., Papanicolaou, A. C. Lateralization of activity associated with language function using magnetoencephalography: a reliability study. J Clin Neurophysiol. 17 (5), 503-510 (2000).
- Pataraia, E., Baumgartner, C., Lindinger, G., Deecke, L. Magnetoencephalography in presurgical epilepsy evaluation. Neurosurg Rev. 25 (3), 141-159 (2002).
- Babajani-Feremi, A., et al. Language mapping using high gamma electrocorticography, fMRI, and TMS versus electrocortical stimulation. Clin Neurophysiol. 127 (3), 1822-1836 (2016).
- Brodbeck, V., et al. Electroencephalographic source imaging: a prospective study of 152 operated epileptic patients. Brain. 134, Pt 10 2887-2897 (2011).
- Sohrabpour, A., et al. Effect of EEG electrode number on epileptic source localization in pediatric patients. Clin Neurophysiol. 126 (3), 472-480 (2015).
- Laohathai, C., et al. Practical fundamentals of clinical MEG interpretation in epilepsy. Front Neurol. 12, 722986(2021).
- Corona, L., et al. Mapping functional connectivity of epileptogenic networks through virtual implantation. Proceedings of the Annu Int Conf IEEE Eng Med Biol Soc. 2021, 408-411 (2021).
- Corona, L., et al. Non-invasive mapping of epileptogenic networks predicts surgical outcome. Brain. 146 (5), 1916-1931 (2023).
- Rijal, S., et al. Functional connectivity discriminates epileptogenic states and predicts surgical outcome in children with drug resistant epilepsy. Sci Rep. 13 (1), 9622(2023).
- Tamilia, E., et al. Noninvasive mapping of ripple onset predicts outcome in epilepsy surgery. Ann Neurol. 89 (5), 911-925 (2021).
- Matarrese, M. A. G., et al. Spike propagation mapping reveals effective connectivity and predicts surgical outcome in epilepsy. Brain. 146 (9), 3898-3912 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon