Method Article
Imaging della sorgente elettromagnetica nella valutazione prechirurgica di bambini con epilessia resistente ai farmaci
In questo articolo
Riepilogo
La magnetoencefalografia (MEG) e l'elettroencefalografia ad alta densità (HD-EEG) sono raramente registrate contemporaneamente, sebbene forniscano informazioni di conferma e complementari. Qui, illustriamo il setup sperimentale per la registrazione simultanea di MEG e HD-EEG e la metodologia per l'analisi di questi dati con l'obiettivo di localizzare le aree cerebrali epilettogene ed eloquenti nei bambini con epilessia resistente ai farmaci.
Abstract
Per i bambini con epilessia resistente ai farmaci (DRE), la libertà dalle crisi si basa sulla delineazione e la resezione (o ablazione/disconnessione) della zona epilettogena (EZ) preservando le aree cerebrali eloquenti. Lo sviluppo di un metodo di localizzazione affidabile e non invasivo che fornisca informazioni clinicamente utili per la localizzazione dell'EZ è, quindi, fondamentale per ottenere risultati chirurgici di successo. L'imaging elettrico e magnetico (ESI e MSI) è stato sempre più utilizzato nella valutazione prechirurgica di questi pazienti, mostrando risultati promettenti nella delineazione delle aree cerebrali epilettogene ed eloquenti. Inoltre, la combinazione di ESI e MSI in un'unica soluzione, vale a dire l'imaging elettromagnetico della sorgente (EMSI), eseguita su registrazioni simultanee di elettroencefalografia ad alta densità (HD-EEG) e magnetoencefalografia (MEG) ha dimostrato una maggiore accuratezza della localizzazione della sorgente rispetto a entrambe le modalità da sole. Nonostante questi risultati incoraggianti, tali tecniche vengono eseguite solo in pochi centri per l'epilessia terziaria, raramente vengono registrate contemporaneamente e sono sottoutilizzate nelle coorti pediatriche. Questo studio illustra la configurazione sperimentale per la registrazione simultanea di dati MEG e HD-EEG, nonché il quadro metodologico per l'analisi di questi dati con l'obiettivo di localizzare la zona irritativa, la zona di insorgenza delle crisi e le aree cerebrali eloquenti nei bambini con DRE. Più specificamente, vengono presentati i setup sperimentali per (i) registrare e localizzare l'attività epilettiforme interictale e ictale durante il sonno e (ii) registrare le risposte evocate visivamente, motoriamente, uditiva e somatosensoriale e mappare le aree eloquenti rilevanti del cervello (ad esempio, visive, motorie, uditive e somatosensoriali) durante il compito visuomotorio, nonché le stimolazioni uditive e somatosensoriali. Vengono inoltre presentati i passaggi dettagliati della pipeline di analisi dei dati per l'esecuzione di EMSI, ESI e MSI individuali utilizzando il dipolo di corrente equivalente (ECD) e la mappatura parametrica statistica dinamica (dSPM).
Introduzione
L'epilessia è uno dei disturbi neurologici più comuni e invalidanti caratterizzati da convulsioni ricorrenti e non provocate che possono essere di natura focale o generalizzata. Nonostante la disponibilità di diverse terapie farmacologiche efficaci (ad esempio, farmaci anticonvulsivanti [ASM]), circa il 20-30% di questi pazienti non è in grado di controllare le proprie crisi e soffre di epilessia resistente ai farmaci (DRE)1. Per questi pazienti, la chirurgia dell'epilessia è il trattamento più efficace per eliminare le convulsioni; un intervento chirurgico di successo può essere ottenuto attraverso la resezione completa (o ablazione/disconnessione) della zona epilettogena (EZ), definita come l'area minima indispensabile per la generazione delle crisiepilettiche 2. L'accurata delineazione e resezione (o ablazione/disconnessione) dell'EZ, preservando la corteccia eloquente, sono fattori cruciali per garantire la libertà dalle crisi. Per stabilire la candidatura chirurgica, un team multidisciplinare utilizza diversi strumenti diagnostici non invasivi per definire diverse aree corticali (ad esempio, zona irritativa, zona di insorgenza delle crisi [SOZ], zona di deficit funzionale e lesione epilettogena), che fungono da approssimatori indiretti dell'EZ3. Il monitoraggio extra-operatorio con EEG intracranico (iEEG) è necessario quando nessuno di questi metodi identifica in modo inequivocabile l'EZ. Il ruolo dell'iEEG è quello di definire con precisione l'EZ localizzando la SOZ (cioè l'area cerebrale in cui si generano le convulsioni cliniche) e mappare le aree cerebrali eloquenti. Tuttavia, presenta gravi limitazioni dovute alla sua invasività 4,5,6, offre una copertura spaziale limitata e necessita di una chiara ipotesi di localizzazione prechirurgica7. Di conseguenza, l'effettivo focus e l'entità della SOZ possono essere persi, portando a un intervento chirurgico non riuscito. Inoltre, la sua interpretazione richiede la registrazione di più crisi cliniche stereotipate durante diversi giorni di ricovero, il che aumenta le possibilità di complicanze (ad esempio, infezione e/o sanguinamento)5. Pertanto, esiste un'esigenza insoddisfatta di sviluppare metodi di localizzazione affidabili e non invasivi in grado di fornire informazioni clinicamente utili e migliorare complessivamente la valutazione prechirurgica dei bambini con DRE.
Negli ultimi decenni, l'imaging elettrico e magnetico (ESI e MSI) è stato sempre più utilizzato nella valutazione prechirurgica di pazienti con DRE per la delineazione delle aree cerebrali epilettogene e funzionali. In particolare, ESI e MSI consentono la ricostruzione di sorgenti neurali da registrazioni non invasive, come l'EEG ad alta densità (HD-EEG) e la magnetoencefalografia (MEG), per aiutare a guidare la pianificazione chirurgica o il posizionamento degli elettrodi iEEG. ESI e MSI possono essere applicati per localizzare sia le scariche epilettiformi interictali (IED), come picchi e onde taglienti, sia l'attività ictale (convulsioni). Può inoltre essere utilizzato per la localizzazione di diverse aree funzionali del cervello coinvolte nelle funzioni sensoriali, motorie, uditive e cognitive. La ricostruzione di eventi elettrofisiologici, come IED e convulsioni, permette l'identificazione rispettivamente della zona irritativa (cioè l'area cerebrale dove hanno origine gli IED) e della SOZ, che sono considerati un valido surrogato per la localizzazione dell'EZ. La localizzazione della corteccia eloquente (cioè delle aree cerebrali indispensabili per determinate funzioni corticali)3 permette invece di mappare la localizzazione e l'estensione delle aree eloquenti rispetto alla resezione programmata e, quindi, di ridurre in anticipo i potenziali deficit funzionali che ci si può aspettare dalla chirurgia dell'epilessia 8,9,10,11 . Diversi studi hanno indagato l'utilità clinica di ESI e/o MSI nella valutazione prechirurgica dell'epilessia e hanno mostrato risultati promettenti nella delineazione dell'EZ 12,13,14,15,16,17,18,19. Ad esempio, Mouthaan et al.14 hanno eseguito un'ampia meta-analisi utilizzando i dati non invasivi di 11 studi prospettici e retrospettivi sull'epilessia e hanno riportato che queste tecniche di localizzazione della fonte possono identificare complessivamente l'EZ con alta sensibilità (82%) e bassa specificità (53%). Altri studi hanno anche dimostrato che MSI ed ESI possono localizzare correttamente il fuoco epilettico all'interno dell'area resecata in pazienti epilettici con risonanza magnetica normale (MRI)19,20,21. Questi risultati di localizzazione sono particolarmente importanti per quei pazienti che non sono idonei alla chirurgia dell'epilessia a causa di risultati clinici o di imaging inconcludenti. In sintesi, ESI e MSI possono contribuire in modo significativo alla mappatura prechirurgica delle aree cerebrali epilettogene e funzionali nei pazienti con DRE.
Nonostante questi risultati incoraggianti, tali tecniche sono attualmente eseguite regolarmente solo in pochi centri di epilessia terziaria e sono spesso sottoutilizzate nelle popolazioni pediatriche. Inoltre, l'HD-EEG e il MEG sono raramente registrati contemporaneamente, sebbene forniscano informazioni sia di conferma che complementari. Il MEG è sensibile per rilevare sorgenti superficiali con orientamento tangenziale, ma è cieco alle sorgenti orientate radialmente situate nel giro o nelle aree più profonde del cervello 22,23,24,25,26. Inoltre, il MEG offre una migliore risoluzione spaziale (millimetri) rispetto all'EEG 16,22,25. A differenza dei segnali EEG, i segnali MEG sono privi di riferimenti e non sono essenzialmente influenzati dalle diverse conduttività dei tessuti cerebrali (ad esempio, meningi, liquido cerebrospinale, cranio e cuoio capelluto)25,27 fornendo misurazioni non distorte dei campi magnetici prodotti dal cervello. D'altra parte, l'EEG può rilevare sorgenti di tutti gli orientamenti, ma offre una risoluzione spaziale inferiore rispetto al MEG ed è più suscettibile agli artefatti26,28. A causa di queste sensibilità complementari all'orientamento e alla profondità della sorgente, circa il 30% dell'attività epilettiforme (ad esempio, IED) può essere registrata solo su MEG ma non su EEG, e viceversa 26,29,30,31,32. A differenza dell'EEG, che consente registrazioni prolungate, l'acquisizione delle crisi cliniche con MEG è difficile a causa del tempo di registrazione limitato che di solito è insufficiente per registrare gli eventi ictali nella maggior parte dei pazienti. Inoltre, gli artefatti causati dai movimenti della testa correlati alle convulsioni possono spesso interferire con la qualità delle registrazioni MEG 29,33,34,35. D'altra parte, le registrazioni MEG sono più veloci e più facili rispetto all'EEG, soprattutto nei bambini poiché non è necessario collegare sensori sopra la testa dei bambini35.
I progressi nell'hardware hanno reso possibile la registrazione simultanea di dati MEG e HD-EEG con un elevato numero di sensori (oltre 550 sensori) che coprono l'intera testa. Inoltre, i moderni sviluppi nelle tecnologie EEG hanno ridotto al minimo il tempo di preparazione per l'HD-EEG a meno di un quarto d'ora36. Ciò è particolarmente importante per le popolazioni pediatriche con comportamenti difficili che non sono in grado di stare ferme per periodi prolungati. Inoltre, i progressi nelle tecnologie software hanno permesso la combinazione di ESI e MSI in un'unica soluzione, ovvero l'imaging elettromagnetico della sorgente (EMSI), eseguito su registrazioni simultanee HD-EEG e MEG. Diversi studi teorici ed empirici hanno riportato una maggiore accuratezza della localizzazione della sorgente con EMSI rispetto a entrambe le modalità da sole 13,30,31,37,38,39,40,41. Utilizzando diversi approcci di localizzazione della fonte per ricostruire l'attività in risposta a stimoli sensoriali, Sharon et al.37 hanno scoperto che l'EMSI aveva risultati di localizzazione costantemente migliori rispetto all'ESI o all'MSI da soli rispetto alla risonanza magnetica funzionale (fMRI), che funge da punto di riferimento non invasivo per l'accuratezza precisa della localizzazione. Gli autori hanno suggerito che questa migliore localizzazione è dovuta all'aumento del numero di sensori per risolvere la soluzione inversa e ai diversi modelli di sensibilità delle due modalità di imaging37. Allo stesso modo, Yoshinaga et al.31 hanno eseguito l'analisi del dipolo su dati EEG e MEG simultanei di pazienti con epilessia correlata alla localizzazione intrattabile e hanno dimostrato che l'EMSI ha fornito informazioni che non sarebbero state ottenibili utilizzando una sola modalità e ha portato a una localizzazione di successo per la chirurgia dell'epilessia in uno dei pazienti analizzati. In uno studio prospettico in cieco, Duez et al.13 hanno dimostrato che l'EMSI ha raggiunto un odds ratio significativamente più alto (cioè la probabilità di diventare libero da convulsioni) rispetto a ESI e MSI, un'accuratezza di localizzazione ≥52% e una concordanza ≥53% e ≥36% con l'irritante e il SOZ, rispettivamente. Uno studio più recente del nostro gruppo42 ha dimostrato che l'EMSI ha fornito stime di localizzazione superiori e migliori prestazioni di previsione dei risultati rispetto all'ESI o all'MSI da soli, con errori di localizzazione da resezione e SOZ rispettivamente di ~8 mm e ~15 mm. Nonostante questi risultati promettenti, mancano studi che forniscano il quadro metodologico relativo all'EMSI nei bambini con DRE.
Questo studio illustra la configurazione sperimentale per l'esecuzione simultanea di registrazioni MEG e HD-EEG, nonché il quadro metodologico per l'analisi di questi dati con l'obiettivo di localizzare la zona irritativa, la SOZ e le aree cerebrali eloquenti nei bambini con DRE. Più specificamente, vengono presentati i setup sperimentali per (i) registrare e localizzare l'attività epilettiforme interictale e ictale durante il sonno e (ii) registrare le risposte evocate visivamente, motoria, uditiva e somatosensoriale e mappare le aree cerebrali eloquenti rilevanti (cioè visive, motorie, uditive e somatosensoriali) durante un compito visuomotorio, nonché le stimolazioni uditive e somatosensoriali. Vengono inoltre presentati i passaggi dettagliati della pipeline di analisi dei dati per l'esecuzione di EMSI, ESI e MSI individuali utilizzando il dipolo di corrente equivalente (ECD) e la mappatura parametrica statistica dinamica (dSPM).
Protocollo
Le procedure sperimentali qui applicate sono state approvate dal North Texas Regional Institutional Review Board (2019-166; Investigatore principale: Christos Papadelis). La sezione seguente descriverà il protocollo sperimentale per la localizzazione non invasiva della sorgente di IED, insorgenza ictale e risposte evocate da eventi (cioè visive, motorie, uditive e somatosensoriali) utilizzando registrazioni simultanee MEG e HD-EEG seguite nel nostro laboratorio. L'International Federation of Clinical Neurophysiology43 e l'American Clinical MEG Society44 hanno fornito "standard minimi" per la registrazione clinica di routine e l'analisi dei dati MEG ed EEG spontanei. Le procedure per le registrazioni HD-EEG qui descritte si applicano solo ai sistemi di elettrodi EEG a spugna. Il processo di preparazione complessivo per ogni argomento è di circa 2-3 ore, comprendendo le registrazioni effettive di ~1,5 ore.
1. Preparazione del sistema MEG
- Prima dell'arrivo del soggetto, eseguire una registrazione MEG in una stanza vuota di alcuni minuti per catturare i livelli di rumore di fondo e gli artefatti magnetici e verificare che tutti i sensori MEG funzionino correttamente.
- Utilizzando il programma di regolazione dei sensori MEG, assicurarsi che il valore medio del rumore bianco di tutti i sensori MEG sia compreso tra 2 e 5 fT/√Hz (fT/cm√Hz per i gradiometri).
2. Preparazione del soggetto
- Assicurarsi che il soggetto si senta a proprio agio con l'ambiente. Nel caso di bambini piccoli, consentire loro di esplorare la sala di registrazione (compresa la stanza schermata magneticamente [MSR]) e vedere l'apparecchiatura di test che verrà utilizzata per l'acquisizione dei dati.
- Esamina e fornisci le istruzioni al soggetto utilizzando il modulo di consenso allo screening. Se necessario, spiega la procedura ai bambini piccoli usando parole speciali, giocattoli e giochi sviluppati per ogni fascia d'età. Chiedi al soggetto (o ai genitori del soggetto) se ha avuto un attacco epilettico nelle ultime ~2 ore prima della visita.
NOTA: Il modulo di consenso allo screening include una descrizione del test, nonché la sua sicurezza, il motivo per cui viene eseguito il test e una descrizione generale dello studio.
- Esamina e fornisci le istruzioni al soggetto utilizzando il modulo di consenso allo screening. Se necessario, spiega la procedura ai bambini piccoli usando parole speciali, giocattoli e giochi sviluppati per ogni fascia d'età. Chiedi al soggetto (o ai genitori del soggetto) se ha avuto un attacco epilettico nelle ultime ~2 ore prima della visita.
- Rimuovere qualsiasi materiale metallico e/o magnetico dal soggetto e fornire al soggetto indumenti appropriati forniti dall'ospedale (ad esempio, camici ospedalieri, camici). Inoltre, chiedere al soggetto di togliersi le scarpe per evitare che la polvere magnetica penetri nella MSR. Se non è possibile rimuovere altri elementi ferromagnetici, come lavori odontoiatrici o dispositivi medici impiantati, utilizzare uno smagnetizzatore (ad es. smagnetizzatore) per rimuovere gli artefatti magnetici residui che possono causare interferenze o livelli di rumore elevati durante le registrazioni MEG. Dopo esservi assicurati che tutte le fonti di rumore magnetico siano state rimosse, chiedete al soggetto di sedersi e mettersi comodo su una sedia di legno dove verranno applicate le successive procedure di misurazione.
NOTA: Lo smagnetizzatore non deve essere applicato direttamente su dispositivi elettronici impiantati (ad es. pacemaker, dispositivi di neuromodulazione). - Misurare la circonferenza della testa del soggetto per selezionare la dimensione appropriata della rete EEG (di solito 32-34 cm fino a 58-61 cm). Utilizzando il lato centimetrico del metro, misurare la circonferenza della testa tenendo il nastro dalla parte del soggetto a ~1 cm sopra l'inione e poi di nuovo alla nasione.
NOTA: Il nasion è il punto craniometrico tra gli occhi, mentre l'inion è la punta della protuberanza occipitale esterna.- Seleziona la dimensione netta corretta che si adatta alla circonferenza della testa del soggetto e immergila per almeno 5 minuti (massimo 10 minuti) in una soluzione liquida miscelata composta da 1 qt di acqua calda del rubinetto, 1 cucchiaio di elettroliti (cioè cloruro di potassio) e 1 cucchiaio di shampoo per bambini. Durante questo processo di ammollo, assicurarsi che la rete sia capovolta con le spugne rivolte verso l'esterno e i fermagli completamente allentati per immergere completamente i sensori all'interno del secchio di plastica contenente la soluzione.
NOTA: Per fare in modo che l'amplificatore della rete non si avvicini alla soluzione e rimanga sempre asciutto, avvolgere un asciugamano attorno alla spina della rete selezionata e, se possibile, posizionarlo su una sedia o un supporto vicino al lavandino dove si trova il secchio di plastica.
- Seleziona la dimensione netta corretta che si adatta alla circonferenza della testa del soggetto e immergila per almeno 5 minuti (massimo 10 minuti) in una soluzione liquida miscelata composta da 1 qt di acqua calda del rubinetto, 1 cucchiaio di elettroliti (cioè cloruro di potassio) e 1 cucchiaio di shampoo per bambini. Durante questo processo di ammollo, assicurarsi che la rete sia capovolta con le spugne rivolte verso l'esterno e i fermagli completamente allentati per immergere completamente i sensori all'interno del secchio di plastica contenente la soluzione.
- Posizionare cinque bobine magnetiche servite come bobine di indicatore della posizione della testa (HPI) in posizioni note direttamente sul cuoio capelluto del soggetto utilizzando nastro di carta microporoso: uno su ciascun lato della fronte vicino all'attaccatura dei capelli, uno su ciascun osso mastoideo e uno sulla parte superiore della testa.
NOTA: Le bobine HPI definiscono la posizione della testa rispetto ai dispositivi di interferenza quantistica superconduttori (SQUID) posti all'interno del sistema MEG emettendo campi magnetici noti che possono essere localizzati durante la scansione. Il numero di bobine HPI dipende dal sistema MEG, ma di solito varia da 3 a 5 bobine HPI. - Posizionare elettrodi aggiuntivi utilizzando del nastro adesivo per misurare la frequenza cardiaca (elettrocardiografia, ECG), i movimenti oculari o le palpebre (elettrocardiografia, EOG) e l'attività muscolare (elettromiografia, EMG); Il posizionamento di questi elettrodi permette anche il monitoraggio dello stato di salute del soggetto.
- Posizionare due elettrodi ECG sul lato destro e sinistro del torace sotto le clavicole, rispettivamente, per registrare il battito cardiaco del soggetto e due elettrodi EOG sul lato superiore e inferiore dell'occhio destro, rispettivamente, per registrare i movimenti oculari verticali o le palpebre.
- Per misurare l'attività muscolare durante il compito visuomotorio, inoltre, pulire le dita del soggetto con tamponi imbevuti di alcol per una migliore adesione del nastro sulla pelle e fissare con nastro un totale di due paia di elettrodi a coppa non monouso su ciascuna mano: uno sul primo interosseo dorsale (FDI) e uno sull'abduttore breve del pollice (APB).
- Prima di fissare tutti questi elettrodi, posizionare la pasta conduttiva all'interno della coppa dell'elettrodo fino a riempirla leggermente per ridurre l'impedenza cutanea e garantire una miscela ottimale di adesività e conduttività.
- Per la stimolazione tattile, attaccare sottili membrane elastiche direttamente alle parti distali e volatili di tre dita (cioè pollice [D1], medio [D3] e mignolo [D5]) di entrambe le mani. Gonfiare le membrane con impulsi di aria compressa attraverso tubi di plastica rigida utilizzando un dispositivo di stimolazione a soffio d'aria. Rilasciare gli impulsi di aria compressa con un intervallo interstimolo di 1,5 ± 0,5 s seguendo un ordine pseudocasuale. Regolare la pressione dello stimolatore tattile a 50 psi.
- Posizionare due elettrodi ECG sul lato destro e sinistro del torace sotto le clavicole, rispettivamente, per registrare il battito cardiaco del soggetto e due elettrodi EOG sul lato superiore e inferiore dell'occhio destro, rispettivamente, per registrare i movimenti oculari verticali o le palpebre.
- Mentre il soggetto è ancora seduto sulla sedia di legno, distante da qualsiasi oggetto metallico, determina le posizioni tridimensionali (3D) dei punti di riferimento anatomici fiduciali, delle cinque bobine HPI e di altri punti di forma della testa utilizzando un digitalizzatore. Durante questo processo di digitalizzazione della testa, chiedi al soggetto di sedersi comodamente, guardare dritto davanti a sé e rimanere praticamente immobile poiché piccoli movimenti possono influire sull'accuratezza della localizzazione.
- Posizionare il ricevitore di riferimento attraverso gli occhiali di plastica (cioè gli occhiali con il cubo di riferimento attaccato su un lato) sulla testa del soggetto e regolare i fermagli per garantire un quadro di riferimento fisso al soggetto che deve rimanere relativamente fermo durante l'intera misurazione.
- Attraverso il ricevitore dello stilo primario, individuare i punti di riferimento anatomici fiduciali (ad esempio, nasion e punti preauricolari sinistro/destro) e la posizione delle bobine HPI e campionare uniformemente ulteriori punti del cuoio capelluto (almeno 100, preferibilmente vicino a ~500) per migliorare una ricostruzione di alta qualità della superficie della testa.
NOTA: I punti di riferimento anatomici fiduciali definiscono il sistema di coordinate del soggetto. Il digitalizzatore genera le coordinate di un sensore nello spazio 3D utilizzando un trasmettitore (tipicamente montato dietro il soggetto sullo schienale della sedia di legno) e due ricevitori (cioè lo stilo e i ricevitori di riferimento). - Al termine della digitalizzazione, posizionare il ricevitore dello stilo a ~15 cm di distanza dal soggetto e dal trasmettitore e digitalizzare un punto casuale per completare il processo di digitalizzazione.
NOTA: Questa fase finale del processo di digitalizzazione può differire da altri prodotti commerciali.
- Prima di applicare la rete EEG, chiedere al soggetto di sedersi su una sedia vicino all'amplificatore EEG e posizionare degli asciugamani sul petto e sulle spalle per assorbire eventuali gocciolamenti dovuti all'applicazione della rete. Togliete la retina EEG dal secchio di plastica, giratela con le spugne rivolte verso l'interno e avvolgetela delicatamente attorno a un asciugamano per assorbire la soluzione miscelata in eccesso.
- Con il soggetto seduto sulla sedia e istruito a tenere gli occhi chiusi durante questo passaggio, metti entrambe le mani all'interno della rete e allargala con le dita, quindi posizionala sulla testa del soggetto.
- Senza spostare le posizioni delle bobine HPI, regolare la rete tesa sulla testa del soggetto utilizzando le dita per assicurarsi che i canali di riferimento e nasion siano posizionati correttamente rispettivamente al centro del cuoio capelluto e tra gli occhi del soggetto, e infine allacciare il sottogola una volta che la rete è nella posizione corretta.
- Utilizzando un impedenziometro EEG, assicurarsi che tutte le impedenze degli elettrodi del cuoio capelluto siano comprese nell'intervallo 0-50 kΩ (si consigliano valori ˂5 kΩ) per evitare distorsioni del segnale. Per ridurre le impedenze dell'elettrodo del cuoio capelluto, verificare che ogni elettrodo abbia un buon contatto meccanico ed elettrico con il cuoio capelluto utilizzando un batuffolo di cotone di legno per rimuovere i peli del soggetto tra l'elettrodo e il cuoio capelluto o una pipetta di plastica usa e getta per trasferire una soluzione mista più conduttiva nelle spugne degli elettrodi, se necessario.
- Una volta che tutte le impedenze sono idealmente fino a 50 kΩ, scollegare l'amplificatore e preparare il soggetto per la digitalizzazione dell'elettrodo EEG.
NOTA: Eseguire la digitalizzazione dell'elettrodo EEG all'esterno dell'MSR e garantire spazio sufficiente intorno al soggetto per gestire il processo di scansione.
- Una volta che tutte le impedenze sono idealmente fino a 50 kΩ, scollegare l'amplificatore e preparare il soggetto per la digitalizzazione dell'elettrodo EEG.
- Determinare le posizioni 3D degli elettrodi EEG utilizzando uno scanner ottico portatile. Durante questo processo, chiedi al soggetto di sedersi comodamente e di guardare dritto davanti a sé, a meno che non venga indicato diversamente.
- Innanzitutto, apri il software dello scanner ottico, seleziona il modello di sensore che corrisponde al layout del sensore EEG utilizzato durante le registrazioni, quindi avvia il processo di scansione.
- Durante la scansione, tenere lo scanner a una certa distanza dalla rete EEG (di solito ~45 cm), con le sue aperture di scansione perpendicolari alla superficie dei sensori, e spostarlo lentamente intorno alla testa del soggetto seguendo strisce arcuate dall'alto (centro della testa) verso il basso (ultima fila di sensori lungo il collo) per registrare le posizioni fisiche di tutti i sensori.
NOTA: Lo scanner ottico digitalizza le posizioni degli elettrodi EEG sulla testa del soggetto e li trasforma in un file di coordinate 3D; di solito è caratterizzato da due sensori ottici che emettono sorgenti luminose a infrarossi (IR). Ogni posizione scansionata di solito appare su una nuvola di sensori 3D. La nuvola di sensori 3D fornisce un feedback per la scansione, il rilevamento e l'allineamento delle posizioni dei sensori, mentre la mappa dei sensori 2D fornisce un feedback per l'etichettatura di queste posizioni dei sensori. Il processo di scansione delle posizioni degli elettrodi EEG richiede un totale di 5-10 minuti, compreso il sondaggio dei punti fiduciali. Tuttavia, il tempo di scansione può talvolta dipendere dalle prestazioni dello scanner ottico nel rilevare le posizioni degli elettrodi.
- Una volta scansionati tutti gli elettrodi EEG (almeno il 95%), sonda i punti fiduciali (cioè i punti nasion e i punti preauricolari sinistro/destro) e quattro sensori di allineamento (cioè i nodi di allineamento anteriore, sinistro e destro e il nodo REF) utilizzando la sonda ottica wireless per allineare la nuvola di sensori 3D al modello di sensore selezionato.
NOTA: I sensori di allineamento sono numerati in base alla configurazione della rete del sensore EEG.- Per sondare i punti fiduciali, posizionare la punta della sonda ottica sulla pelle del soggetto al centro del punto di interesse fiduciale, assicurandosi che le aperture di scansione dello scanner puntino verso i dischi riflettenti della sonda. Allo stesso modo, posizionare la punta della sonda ottica al centro del sensore di allineamento di interesse per sondare i sensori di allineamento.
- Una volta che tutti i sensori sono stati scansionati e sondati, rivedere le loro posizioni ed etichette sulla nuvola di sensori 3D e sulla mappa dei sensori 2D rispetto alla rete EEG effettiva per controllare ed eventualmente correggere eventuali errori; se non si sono verificati errori durante il processo di scansione, esportare il file di .txt delle coordinate 3D e convertirlo nel formato preferito.
NOTA: Le coordinate degli elettrodi 3D sono solitamente memorizzate in formato .txt e possono essere convertite tramite software di scansione ottica in diversi formati (ad es. .xml, .sfp, .elp o .nsi). - Dopo aver completato il processo di digitalizzazione degli elettrodi EEG (passaggi 2.9-2.11), preparare il soggetto da trasferire all'interno dell'MSR per l'esecuzione dei dati di riposo/sonno (passaggio 2.13), attività visuomotoria (passaggio 2.14), stimolazione uditiva (passaggio 2.15) e stimolazione somatosensoriale (passaggio 2.16).
- Per i dati di riposo/sonno, impostare il gantry del sistema MEG in posizione supina (Figura 1A) e disporre il letto non magnetico e compatibile in modo che il poggiatesta rimovibile sia allineato con l'apertura a forma di casco nella parte inferiore del dewar. Dopo aver regolato il letto nella posizione corretta, impostare la valvola del freno del letto in posizione di blocco spento. Posiziona un lenzuolo o una coperta sopra il letto e un piccolo cuscino in schiuma sul poggiatesta rimovibile per il fissaggio della testa e il comfort durante la registrazione.
NOTA: Il dewar è un contenitore criogenico riempito con elio liquido in cui le schiere di sensori sono disposte spazialmente sul fondo tramite un'apertura a forma di casco progettata per circondare la testa del soggetto. Il casco si adatta a una circonferenza della testa fino a 59-61 cm. Il gantry è il sistema meccanico che supporta il dewar che permette di modificarne l'elevazione e l'angolo in base alla posizione di misurazione (cioè seduto o supino).- Trasferisci il soggetto all'interno dell'MSR e aiutalo a sedersi sul bordo del letto e sdraiarsi su di esso. Posizionare diverse coperte sul corpo del soggetto per tenerlo al caldo durante la registrazione assicurandosi che i cavi degli elettrodi siano facilmente accessibili, e allacciare leggermente le cinture di sicurezza (o tirare su le ringhiere se presenti), spiegando al soggetto che questo passaggio serve a impedirgli di rotolare fuori dal letto durante il sonno. Se necessario, posizionare un asciugamano arrotolato aggiuntivo sotto il collo per fornire supporto al collo e alle spalle del soggetto.
- Sbloccare la valvola del freno del lettino per muovere delicatamente la testa del soggetto, che viene posizionata sul poggiatesta rimovibile sotto l'apertura a forma di casco del dewar fino a toccare l'interno del casco. Per aumentare il rapporto segnale/rumore (SNR), avvicinare il più possibile la testa del soggetto al casco.
- Collegare le bobine HPI, gli elettrodi ECG ed EOG ai pannelli corrispondenti del sistema MEG, collegare la rete EEG all'unità amplificatore all'interno dell'MSR e controllare le misurazioni delle coordinate della testa dalla stazione di acquisizione all'esterno dell'MSR per valutare se la testa del soggetto è posizionata correttamente sotto il dewar.
- Con il consenso del soggetto, ridurre l'intensità della luce all'interno dell'MSR per aiutare a stimolare il rilassamento e il sonno. Quando il soggetto si sente rilassato e a proprio agio, chiedigli di riposare con gli occhi chiusi o di dormire durante la registrazione. Rassicurare il soggetto che sarà osservato sul monitor al di fuori dell'MSR tramite la telecamera a colori schermata a radiofrequenza montata sulla parete dell'MSR per l'intera registrazione.
- Per il compito visuomotorio, impostare il gantry del sistema MEG in posizione verticale (Figura 1B) e sistemare la sedia MEG in modo che la testa del soggetto sia sotto il gantry, vicino all'apertura a forma di casco nella parte inferiore del dewar. Dopo aver regolato la sedia nella posizione corretta, impostare la valvola del freno della sedia in posizione di blocco ("0").
- Trasferire il soggetto all'interno dell'MSR. Aiutalo a sedersi sulla sedia non magnetica e compatibile e a trovare una posizione comoda e rilassata. Posiziona diverse coperte sul corpo del soggetto per tenerlo al caldo durante la registrazione, assicurandoti che i cavi degli elettrodi siano facilmente accessibili, e posiziona il tavolo rimovibile in modo che il soggetto possa metterci le mani sopra durante l'attività. Se necessario, posizionare un asciugamano sotto le ginocchia del soggetto per aiutare a mantenere la posizione seduta e non scivolare verso il basso.
NOTA: Poiché il soggetto potrebbe rilassarsi durante il compito visuomotorio e, quindi, assumere una posizione più bassa rispetto a quella iniziale, sollevare con cautela la sedia al termine di ogni sessione di lavoro tramite il pedale di elevazione (se presente) o posizionare asciugamani o coperte sulla sedia in modo che la testa del soggetto tocchi nuovamente l'interno del casco. Se necessario, posizionare asciugamani o coperte aggiuntivi dietro la testa del soggetto non solo per un migliore comfort, ma anche per aiutare il soggetto a mantenere la testa il più dritta possibile. La stimolazione visuomotoria può essere eseguita alternativamente in posizione supina per evitare di muovere il dewar nel bel mezzo di una sessione di registrazione. - Una volta che il soggetto si trova nella posizione corretta, collegare le bobine HPI, ECG, EOG, FDI e APB sul pannello destro della macchina MEG, collegare la rete EEG all'unità amplificatore all'interno dell'MSR e sollevare la sedia tramite il pedale di elevazione (se presente) con piccoli movimenti o posizionare asciugamani o coperte aggiuntivi sulla sedia fino a quando la testa del soggetto non tocca leggermente l'interno del casco (controllare le misure del coordinate del responsabile dalla stazione di acquisizione al di fuori dell'MSR).
- Posizionare lo schermo di proiezione, in cui verranno proiettati gli stimoli visivi tramite un sistema di specchi di proiezione posizionato all'esterno dell'MSR, di fronte al soggetto (Figura 1B), e spiegare il compito visuomotorio da svolgere durante la registrazione. In particolare, istruire il soggetto a battere il dito indice sul tavolo solo quando lo stimolo visivo (ad esempio, un'immagine) appare sullo schermo, rispettivamente, per la mano destra e sinistra. Assicurati che il soggetto capisca il compito o si senta a proprio agio nell'eseguirlo da solo; Se necessario, esercitati più volte con il soggetto per aiutarlo a familiarizzare con esso.
NOTA: Se una sessione di stimolazione visuomotoria viene eseguita in posizione supina, uno specchio viene posizionato a una distanza sopra il viso del soggetto per riflettere gli stimoli visivi provenienti dal proiettore. - Prima di chiudere la porta del MSR, chiedi al soggetto se si sente a suo agio a stare da solo all'interno della stanza; in caso contrario, una persona del team o i suoi genitori rimarranno all'interno dell'MSR durante le sessioni di registrazione. Inoltre, rassicurare il soggetto che sarà osservato sul monitor al di fuori dell'MSR per l'intera registrazione.
- Trasferire il soggetto all'interno dell'MSR. Aiutalo a sedersi sulla sedia non magnetica e compatibile e a trovare una posizione comoda e rilassata. Posiziona diverse coperte sul corpo del soggetto per tenerlo al caldo durante la registrazione, assicurandoti che i cavi degli elettrodi siano facilmente accessibili, e posiziona il tavolo rimovibile in modo che il soggetto possa metterci le mani sopra durante l'attività. Se necessario, posizionare un asciugamano sotto le ginocchia del soggetto per aiutare a mantenere la posizione seduta e non scivolare verso il basso.
- Per la stimolazione uditiva, utilizzare la configurazione descritta al punto 2.14 con lo schermo di proiezione di fronte al soggetto seduto. Aiuta il soggetto a indossare le cuffie (o gli auricolari) attraverso le quali vengono erogati i trigger sonori (ad esempio, suoni cinguettio modulati).
- Istruire il soggetto a fissare gli stimoli (ad esempio, un punto verde su uno sfondo nero) proiettati sullo schermo mentre ascolta i trigger sonori. Se necessario, eseguire una sessione di formazione per aiutare il soggetto a comprendere meglio la procedura. Prima di chiudere lo sportello dell'MSR, ripetere le procedure di sicurezza come descritto in precedenza.
- Per la stimolazione somatosensoriale, utilizzare la configurazione descritta al punto 2.14. Chiedi al soggetto quale video (o film) vuole guardare sullo schermo del proiettore di fronte a lui/lei.
- Chiedi al soggetto di rilassarsi con gli occhi aperti, guardare il video selezionato, rimanere il più fermo possibile e ignorare gli stimoli tattili inviati alle sue dita durante la registrazione. Spiega al soggetto che sentirà dei leggeri colpi sulla pelle sulla punta delle dita, rispettivamente, per ogni mano. Se il soggetto si sente a disagio, eseguire una sessione di allenamento per rassicurarlo.
NOTA: La fissazione degli occhi su un bersaglio visivo è una tecnica consolidata per ridurre al minimo gli artefatti biologici che possono influenzare la qualità della registrazione e distrarre il soggetto dagli stimoli tattili erogati durante l'acquisizione dei dati.
- Chiedi al soggetto di rilassarsi con gli occhi aperti, guardare il video selezionato, rimanere il più fermo possibile e ignorare gli stimoli tattili inviati alle sue dita durante la registrazione. Spiega al soggetto che sentirà dei leggeri colpi sulla pelle sulla punta delle dita, rispettivamente, per ogni mano. Se il soggetto si sente a disagio, eseguire una sessione di allenamento per rassicurarlo.
3. Acquisizione dati
NOTA: L'acquisizione simultanea di dati MEG ed EEG viene eseguita nella struttura MEG del Cook Children's Medical Center (CCMC). Maggiori dettagli sull'uso clinico del MEG su bambini pediatrici con epilessia possono essere trovati altrove 8,27,45.
- Registra i segnali MEG utilizzando il sistema MEG a testa intera (copertura del sensore: 1.220 cm2) caratterizzato da 306 canali raggruppati in 102 elementi identici a triplo sensore con un magnetometro e due gradiometri planari ortogonali. Impostare una frequenza di campionamento di almeno 1 kHz.
NOTA: I magnetometri a bobina singola misurano la componente del campo magnetico perpendicolare alla superficie del casco MEG. I gradiometri planari sono costituiti da una configurazione a bobina "a forma di otto" caratterizzata da coppie di magnetometri posti a una piccola distanza tra loro e misurano la differenza del campo magnetico tra le loro posizioni (cioè la differenza tra i due anelli di "otto"), chiamata anche gradiente spaziale. Rispetto ai magnetometri, i gradiometri planari sono meno sensibili alle sorgenti cerebrali profonde ma più robusti nel rilevare le sorgenti superficiali sopprimendo il rumore ambientale. Questi 306 canali vengono immersi e raffreddati in elio liquido a -296 °C (4,2 K) per diventare superconduttori. - Registra i segnali EEG contemporaneamente utilizzando la rete EEG non magnetica a 256 canali con sensori di elettrodi Ag/AgCl distribuiti uniformemente su cuoio capelluto, guance e parte posteriore del collo. Impostare una frequenza di campionamento di almeno 1 kHz.
- Chiudere lo sportello dell'MSR per iniziare la registrazione. Attraverso il sistema di interfono vocale, comunica con il soggetto, verificando se si sente a suo agio a stare da solo all'interno dell'MSR. Monitora costantemente il soggetto su video e, in caso di emergenza, entra immediatamente nell'MSR.
NOTA: Nel caso in cui non si senta a proprio agio o l'enorme porta MSR lo intimidisca, una persona del team o i suoi genitori possono rimanere all'interno dell'MSR durante le sessioni di registrazione seduti su una sedia di legno vicino al soggetto; Assicurarsi che tutti gli oggetti metallici siano stati rimossi prima di entrare nella stanza. - Prima di ogni registrazione, istruire il soggetto tramite il sistema di interfono vocale a mantenere ferma la sua posizione per ~30 s prima di iniziare l'attività. Per il compito visuomotorio, comunicare inoltre tramite l'interfono quale dito indice (destro o sinistro) utilizzerà per la prima sessione di registrazione.
- Durante questo periodo in cui il soggetto rimane fermo, premere il pulsante di misurazione dalla finestra di dialogo di misurazione HPI sul sistema di acquisizione dati MEG per misurare il campo magnetico generato dalla corrente immessa nelle bobine HPI e determinare le posizioni di misurazione della testa rispetto all'array di sensori MEG; pertanto, verificare che il soggetto sia ben posizionato (testa |coordinata z| ˂ 75 mm) e annotare le misurazioni 3D per ogni sessione.
- Se c'è ancora spazio tra la testa del soggetto e il casco, rientrare all'interno dell'MSR e regolare l'altezza della sedia tramite il pedale di elevazione (se presente), posizionare asciugamani o coperte sulla sedia o istruire il soggetto tramite l'interfono su come spostare la testa in una posizione più vicina al casco (se il soggetto è seduto), e infine controllare nuovamente le posizioni di misurazione della testa. In caso di registrazioni di riposo/sonno, rientrare nell'MSR e avvicinare il letto al casco, riducendo il divario spaziale testa-casco.
- Una volta che il soggetto è ben posizionato rispetto al casco MEG e pronto per iniziare, iniziare la prima sessione di registrazione (durata ~10 min) seguendo un ordine preciso (vedere il passaggio 3.5.1) per una sincronizzazione MEG ed EEG accurata (vedere il passaggio 3.12).
NOTA: Per garantire registrazioni di alta qualità, la prima sessione di registrazione è fondamentale per catturare gli artefatti presenti nei dati dovuti ai movimenti del soggetto o causati dall'ambiente esterno. Se necessario, rientrare all'interno dell'MSR per regolare eventuali collegamenti dei canali o la posizione del soggetto sulla sedia MEG. Si consiglia di prendere nota di eventuali artefatti o eventi insoliti durante le registrazioni che possono essere rivisti in seguito, se necessario.- Premere il pulsante di registrazione sul software di acquisizione dati EEG per avviare la registrazione EEG. Premere il pulsante di registrazione sul software di acquisizione dati MEG per avviare la registrazione MEG. Infine, premere il pulsante di avvio dal software del computer di stimolazione per visualizzare gli stimoli visivi o fornire stimoli uditivi.
NOTA: Il computer di stimolazione che esegue il software di stimolo visivo (o uditivo) è collegato al sistema di specchi del proiettore all'esterno dell'MSR, che può essere acceso o spento a seconda del tipo di registrazione eseguita. Durante le registrazioni di riposo/sonno, il sistema è spento poiché il soggetto sta riposando o dormendo, ma l'esecuzione del software di stimolo visivo sul computer di stimolazione aiuta a cronometrare ogni sessione di registrazione. Durante il compito visuomotorio, così come durante le stimolazioni uditive e somatosensoriali, il sistema viene acceso permettendo al soggetto di osservare gli stimoli o un video proiettato sullo schermo posto di fronte a lui/lei mentre il software è in esecuzione. Per questo studio, è stato selezionato un totale di (i) 107 stimoli (cioè 85 immagini sovrapposte su uno sfondo a scacchiera e 22 sfondi a scacchiera) con un intervallo di ~4 s tra ogni stimolo per il compito visuomotorio; (ii) 200 cinguettii modulati con un intervallo interstimolo di 3 s per la stimolazione uditiva; e (iii) 200 stimoli tattili per ogni dito (cioè D1, D3 e D5) seguendo una sequenza semi-casuale con un intervallo inter-stimolo di ~1,5 s per la stimolazione somatosensoriale.
- Premere il pulsante di registrazione sul software di acquisizione dati EEG per avviare la registrazione EEG. Premere il pulsante di registrazione sul software di acquisizione dati MEG per avviare la registrazione MEG. Infine, premere il pulsante di avvio dal software del computer di stimolazione per visualizzare gli stimoli visivi o fornire stimoli uditivi.
- Per interrompere le registrazioni, premere il pulsante di arresto sul software di acquisizione dati MEG e quindi il pulsante di arresto sul software di acquisizione dati EEG. Al termine di ogni sessione di registrazione, comunicare con il soggetto tramite l'interfono per rassicurarlo e se non sono necessari collegamenti di canale o regolazioni di posizione all'interno dell'MSR, procedere con la sessione successiva.
- Per il compito visuomotorio, seleziona diversi stimoli visivi per ogni sessione per mantenere il soggetto motivato e intrattenuto durante la registrazione.
- Per i dati visuomotori o di riposo/sonno, registrare un totale di ~1 ora di registrazione simultanea di MEG ed EEG, caratterizzata da 5-6 sessioni. Tuttavia, il numero di sessioni può variare per ogni materia. Inoltre, registrare un totale di ~20 minuti (1-2 sessioni di ~10 minuti ciascuna) e ~14 minuti (1-2 sessioni di ~7 minuti ciascuna) di registrazione simultanea MEG ed EEG rispettivamente per i dati di stimolazione uditiva e somatosensoriale.
NOTA: In questo studio, i dati MEG ed EEG vengono automaticamente memorizzati alla fine delle registrazioni rispettivamente nei formati .fif e .mff nel sistema di archiviazione IT di CCMC. - Al termine della registrazione, inserire l'MSR per aiutare il soggetto ad alzarsi dalla sedia o dal letto e chiedergli di sedersi su una sedia all'esterno dell'MSR per rimuovere sia la rete EEG che gli elettrodi.
- Istruire il soggetto a chiudere gli occhi fino a quando non viene detto diversamente e aiutarlo a rimuovere la rete EEG allentando completamente i sottogola ed estraendo delicatamente la rete con due mani (dalla fronte verso la parte posteriore della testa del soggetto) fino a quando non è completamente staccata. Durante questo passaggio, assicurarsi di non tirare i capelli del soggetto durante la rimozione della rete. Inoltre, aiutare il soggetto a rimuovere delicatamente gli elettrodi rimanenti (ad es. ECG, EOG ed EMG in caso di attività visuomotoria) precedentemente fissati con nastro adesivo sulla pelle.
- Dopo aver rimosso la rete EEG e gli elettrodi, informare il soggetto (e i suoi genitori) che tutte le procedure sono state finalmente completate.
- Dopo che il soggetto ha lasciato la stanza, pulire accuratamente lo scanner ottico (come descritto nel manuale dell'utente) e riporlo all'interno della sua custodia protettiva.
- Pulire e disinfettare le superfici di qualsiasi apparecchiatura utilizzata durante le registrazioni (ad esempio, sedie, letti, scrivanie) con salviette al perossido di idrogeno approvate dall'ospedale o spray disinfettanti e asciugamani di carta, mettere le coperte e gli asciugamani usati all'interno del contenitore fornito dall'ospedale e gettare via qualsiasi pezzo di nastro adesivo usato.
- Conservare gli strumenti di misura all'interno dell'armadio di stoccaggio e pulire l'interno delle coppe degli elettrodi riempite di pasta conduttiva utilizzando tamponi di cotone di legno sotto l'acqua corrente del rubinetto.
- Per sciacquare la rete EEG, riempire il secchio di plastica nel lavandino con acqua di rubinetto calda e pulita e ripetere i passaggi seguenti per un totale di quattro volte.
- Immergere la rete EEG nell'acqua e agitare delicatamente la rete EEG per 10-20 s (o immergerla all'interno e all'esterno del secchio ~25 volte).
- Scolare l'acqua dal secchio e riempire il secchio con acqua di rubinetto pulita e calda.
- Per disinfettare la rete EEG, riempire il secchio di plastica nel lavandino con la soluzione disinfettante composta da 2 qt di acqua tiepida del rubinetto e 1 cucchiaio di disinfettante e immergere la rete EEG al suo interno per 10 minuti. Sciacquare il secchio dalla soluzione disinfettante e seguire il processo di risciacquo e scarico tre volte per rimuovere eventuali residui di soluzione dalla rete EEG.
- Per il processo di risciacquo o disinfezione, rimuovere la rete EEG immersa dal secchio, asciugarla rimuovendo l'acqua in eccesso con l'aiuto di un asciugamano pulito e asciutto e riporla appendendola vicino al lavandino.
- Per sopprimere le interferenze magnetiche interne ed esterne e gli artefatti di misurazione/movimento dai dati MEG, applicare l'estensione temporale del metodo tSSS (Signal Space Separation) al file .fif MEG dei dati grezzi.
NOTA: Il filtraggio spaziotemporale Maxwell (tSSS) è ideale per sopprimere le fonti di interferenza situate all'interno o molto vicino all'array di sensori MEG, ovvero le interferenze interne. - Quando si eseguono registrazioni MEG ed EEG simultanee, allineare spazialmente i sistemi di coordinate dei due dispositivi di acquisizione rispetto ai punti di riferimento anatomici sulla testa del soggetto (Figura 2A) e correggere la deriva lineare dell'orologio tra i segnali che si verifica a causa delle possibili diverse frequenze di campionamento (Figura 2B).
NOTA: Durante le registrazioni, sia i segnali MEG che EEG possono essere influenzati anche da spostamenti lenti nel tempo dovuti a possibili ritardi nella pressione dei pulsanti Start e End e a una deriva interna del clock che si verifica quando i trigger vengono inviati al software di acquisizione dati MEG ed EEG. Per garantire una sincronizzazione precisa tra questi segnali, è stato sviluppato un codice interno in Python che utilizza gli eventi di trigger inviati su entrambi i sistemi durante l'acquisizione dei dati come segnale di trigger comune. Il codice include tre funzioni disponibili nella libreria software MNE-Python: due funzioni che leggono i segnali MEG ed EEG e una funzione che estrae le informazioni degli eventi di trigger dai segnali, come i nomi dei canali e i timestamp (ad esempio, la data e l'ora del verificarsi dell'evento). Le differenze di tempo tra il verificarsi di eventi di trigger in ciascun segnale (ad esempio, delta) definiscono la deriva lineare del clock nel tempo (Figura 2B). Una descrizione dettagliata del codice sviluppato viene fornita nei passaggi successivi (vedi 3.12.1-3.12.4).- Utilizzare la differenza tra il primo evento di trigger che si verifica su ciascun segnale come valore di offset (ad esempio, la parte da tagliare da uno dei due segnali) per allineare le registrazioni.
NOTA: Le funzioni mne.io.read_raw_fif e mne.io.read_raw_egi convertono le registrazioni MEG ed EEG in un formato array 2D, mentre la funzione mne.find_events estrae le informazioni sugli eventi dai segnali grezzi. - Una volta allineati questi primi trigger, calcolare il coefficiente di correlazione di Pearson per valutare il grado di correlazione tra i segnali; Si consigliano valori p < 1 x 10-6 per garantire un perfetto allineamento.
NOTA: La funzione pearsonr della libreria scipy stima il coefficiente di correlazione di Pearson tra i segnali MEG ed EEG e il valore p di questa correlazione. - Per convalidare questa accuratezza di correlazione, stimare il tasso di deriva tra i due segnali eseguendo un adattamento polinomiale di primo grado e utilizzare l'entità risultante della disparità rappresentata dal coefficiente della funzione polinomiale per ricampionare i segnali sull'asse x dell'adattamento polinomiale (Figura 2B).
NOTA: La funzione polyfit della libreria numpy adatta i segnali MEG ed EEG all'interno di una funzione polinomiale; Questa funzione restituisce un coefficiente che rappresenta l'entità della disparità tra i due segnali. La funzione mne.resample ricampiona i segnali MEG ed EEG in base al coefficiente della funzione polinomiale. - Al termine del ricampionamento, confrontare i timestamp dell'ultimo evento di attivazione che si verifica su ciascun segnale e rimuovere quelle finestre temporali che non sono comuni sia nei segnali MEG che in quelli EEG. Infine, unire i segnali MEG ed EEG sincronizzati per creare un'unica registrazione caratterizzata da sensori MEG ed EEG che possono essere utilizzati per ulteriori analisi.
NOTA: La funzione mne.add_channels unisce i due segnali per creare un'unica registrazione.
- Utilizzare la differenza tra il primo evento di trigger che si verifica su ciascun segnale come valore di offset (ad esempio, la parte da tagliare da uno dei due segnali) per allineare le registrazioni.
- Alla fine di ogni registrazione di ~1,5 ore, utilizzare un totale di 5-6 (~10 minuti ciascuna), 1-2 (~10 minuti ciascuna) e 1-2 (~7 minuti ciascuna) sessioni di registrazioni MEG ed EEG sincronizzate, rispettivamente per i dati di stimolazione visuomotoria (e riposo/sonno), uditiva e somatosensoriale, per l'analisi dei dati.
NOTA: Idealmente, il soggetto deve eseguire il tocco del dito destro per tre registrazioni visuomotorie e il tocco del dito sinistro per le restanti tre registrazioni visuomotorie.
4. Analisi dei dati
- Mappatura della zona irritativa
- Generare le superfici corticali 3D dalla risonanza magnetica del soggetto utilizzando il processo di ricostruzione corticale di FreeSurfer, che è uno strumento di neuroimaging open source per l'elaborazione, l'analisi e la visualizzazione di immagini RM del cervello umano46.
- Importa l'anatomia ricostruita su Brainstorm, che è un'applicazione open-source di MATLAB dedicata alla visualizzazione e all'elaborazione dei dati MEG ed EEG47, per visualizzare i risultati della ricostruzione corticale. Da Brainstorm, impostare i punti fiduciali (ad esempio, nasion, preauricolare sinistro/destro, commessura anteriore/posteriore e interemisferica) sulla risonanza magnetica importata che definiscono il sistema di coordinate del soggetto.
- Importa il segnale MEG e HD-EEG simultaneo su Brainstorm e registra i sensori MEG ed EEG sulla risonanza magnetica utilizzando il processo di registrazione della risonanza magnetica per regolare il loro allineamento ai punti fiduciali digitalizzati. Se necessario, proiettare i sensori EEG sulla superficie corticale.
- Aprire la registrazione simultanea MEG e HD-EEG e ispezionare visivamente i dati grezzi per rimuovere i canali difettosi. Inoltre, applica la tecnica di correzione degli artefatti SSP (Signal-Space Projection) disponibile in Brainstorm per rifiutare gli artefatti biologici (ad esempio, battiti cardiaci, battiti delle palpebre) dalle registrazioni.
- Applicare filtri notch (50 o 60 Hz, a seconda dell'interferenza della linea di alimentazione) e passa-banda (1-70 Hz) ai dati MEG e HD-EEG simultanei.
- Selezionare porzioni di dati contenenti attività interictale caratterizzate da IED frequenti, come picchi e onde taglienti, e con artefatti di movimento minimi (se possibile).
NOTA: Gli IED sono forme d'onda transitorie caratterizzate da un'evoluzione temporale di <70 ms, un'ampiezza di >50 μV e una forma nitida che può essere chiaramente distinta dall'attività di fondo nella banda di frequenza 1-70 Hz48. La Figura 3A rappresenta un esempio di porzioni dei segnali simultanei MEG e HD-EEG con frequenti IED visibili su entrambe le registrazioni. - Utilizzando l'impostazione di visualizzazione standard di 10 s per pagina, contrassegnare il picco negativo di ciascun IED che si verifica sia sulle registrazioni MEG che EEG (Figura 3A), nonché su ciascuna modalità da sola. Prima di contrassegnare ogni IED, controlla il campo topografico e le potenziali mappe rispettivamente per il MEG e l'EEG.
NOTA: Anche le distribuzioni di tensione di punti temporali aggiuntivi durante la fase di salita di ogni IED, piuttosto che il suo picco, devono essere controllate per tenere conto della possibile propagazione dell'attività epilettica49. Maggiori dettagli su come contrassegnare gli eventi di picchi interictali utilizzando Brainstorm possono essere trovati altrove (https://neuroimage.usc.edu/brainstorm/Tutorials/Epilepsy). - Calcola un modello realistico della testa, definito come un modello geometrico a tre strati (cioè cuoio capelluto, cranio interno e cranio esterno) (Figura 3B), utilizzando il software OpenMEEG BEM (metodo dell'elemento di contorno simmetrico) disponibile in Brainstorm. Utilizzare il volume MRI come spazio sorgente (griglia del punto sorgente con risoluzione spaziale di 5 mm).
NOTA: Il software OpenMEEG BEM utilizza il metodo degli elementi di confine simmetrici per calcolare un modello in avanti realistico caratterizzato dal cuoio capelluto (cioè interfaccia aria-cuoio capelluto), dal cranio esterno (cioè interfaccia scalpo-cranio) e dal cranio interno (interfaccia cranio-cervello). Come soluzione alternativa, il metodo degli elementi finiti (FEM) può essere utilizzato per risolvere il problema in avanti poiché consente una rappresentazione realistica specifica del soggetto del conduttore del volume della testa. I valori di conducibilità del tessuto cranico sono spesso assunti dalla letteratura e possono variare a seconda dell'età del soggetto50 anni. Per risolvere il modello in avanti utilizzando il FEM, calcolare il modello realistico della testa, definito come un modello geometrico da tre a cinque strati (cioè materia bianca, materia grigia, liquido cerebrospinale, cranio e pelle), utilizzando il software DUNEuro FEM disponibile in Brainstorm 47,50,51. Maggiori dettagli sulla stima del modello diretto utilizzando FEM possono essere trovati altrove (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Localizzare i generatori sottostanti dei picchi interictali selezionati utilizzando il metodo ECD non vincolato sull'array di sensori MEG, EEG e MEG ed EEG combinati separatamente. Per localizzare queste sorgenti di dipolo, calcolare la covarianza del rumore dalle registrazioni MEG in una stanza vuota o impostarla come matrice identità.
NOTA: Considerare l'esecuzione della localizzazione della sorgente su IED medi con distribuzioni di tensione simili come approccio alternativo nel caso in cui l'SNR degli IED sia bassoa 12. - Eseguire il metodo di scansione del dipolo disponibile in Brainstorm al picco di ogni IED precedentemente contrassegnato per selezionare i dipoli sorgente più significativi nell'intero volume del cervello. Selezionare solo dipoli sorgente con una bontà di adattamento >60% e stimare la loro clusterness definita per ciascun dipolo come il numero di dipoli situati a 15 mm dal suo centro (Figura 3C).
NOTA: Maggiori dettagli sulla clusterness ECD possono essere trovati altrove52.
- Mappatura della SOZ
- Genera le superfici corticali 3D dalla risonanza magnetica del soggetto utilizzando il processo di ricostruzione corticale di FreeSurfer46.
- Importa l'anatomia ricostruita su Brainstorm47 per visualizzare i risultati della ricostruzione corticale. Impostare i punti di riferimento sulla risonanza magnetica importata che definiscono il sistema di coordinate del soggetto.
- Importa il segnale simultaneo MEG e HD-EEG (contenente l'evento ictale) su Brainstorm e registra i sensori MEG ed EEG sulla risonanza magnetica utilizzando il processo di registrazione della risonanza magnetica per regolare il loro allineamento ai punti fiduciali digitalizzati. Se necessario, proiettare i sensori EEG sulla superficie corticale.
NOTA: Se il soggetto ha avuto un attacco durante le registrazioni, rivedere gli appunti presi durante la registrazione per valutare in quale sessione è stato registrato l'evento ictale. - Aprire la registrazione simultanea MEG e HD-EEG e ispezionare visivamente i dati grezzi per rimuovere i canali difettosi. Applica la tecnica di correzione degli artefatti SSP disponibile in Brainstorm47 per rifiutare gli artefatti biologici (ad esempio, battiti cardiaci, battiti di ciglia) dalla registrazione.
- Applicare filtri notch (50 o 60 Hz, a seconda dell'interferenza della linea di alimentazione) e passa-banda (1-70 Hz) ai dati MEG e HD-EEG simultanei.
- Secondo le note di registrazione, identificare l'inizio della crisi e la sua cessazione (se annotata) e contrassegnare questi eventi sul segnale per identificare la parte corretta dei dati contenenti scariche epilettiformi ictali. Esempi di insorgenza di convulsioni sono mostrati nella Figura 4 rispettivamente per MEG e HD-EEG.
NOTA: Quando un soggetto ha un attacco epilettico durante l'acquisizione del MEG, il personale medico è tenuto ad assistere immediatamente il soggetto e a fornire cure di emergenza. Pertanto, la durata di quelle porzioni di dati con eventi ictali può essere breve. - Utilizzando l'impostazione di visualizzazione standard di 10 s per pagina, contrassegnare il picco negativo di ogni raffica di scariche epilettiformi (ad esempio, picchi ripetitivi, onde acute o complessi spike-wave) che si verificano durante l'evento ictale su MEG ed EEG, nonché su ciascuna modalità da sola. Prima di ogni marcatura del picco, controllare il campo topografico e le mappe potenziali rispettivamente per il MEG e l'EEG (Figura 4A).
NOTA: Le convulsioni sono classificate come generalizzate o focali a seconda di dove inizia la loro insorgenza. Sebbene dipenda dalla sindrome epilettica, una crisi epilettica è un fenomeno di almeno 10 s caratterizzato da scariche elettriche ripetitive che possono variare in frequenza, ampiezza e morfologia. - Calcola il modello realistico della testa a tre strati (ad esempio, cuoio capelluto, cranio interno ed esterno) per i sensori MEG ed EEG utilizzando il software OpenMEEG BEM disponibile in Brainstorm. Utilizzare il volume MRI come spazio sorgente (griglia del punto sorgente con risoluzione spaziale di 5 mm).
NOTA: Per risolvere il modello in avanti utilizzando il FEM, calcolare il modello realistico della testa, definito come un modello geometrico da tre a cinque strati (cioè materia bianca, materia grigia, liquido cerebrospinale, cranio e pelle), utilizzando il software DUNEuro FEM disponibile in Brainstorm 47,50,51. Maggiori dettagli sulla stima del modello diretto utilizzando FEM possono essere trovati altrove (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Localizzare i generatori sottostanti delle scariche ictali selezionate utilizzando il metodo ECD non vincolato sull'array di sensori MEG, EEG e MEG ed EEG combinati separatamente. Per localizzare queste sorgenti di dipolo, calcolare la covarianza del rumore dalle registrazioni MEG in una stanza vuota o impostarla come matrice identità.
- Eseguire il metodo di scansione del dipolo disponibile in Brainstorm al picco di ciascuna forma d'onda ictale precedentemente contrassegnata per selezionare i dipoli sorgente più significativi nell'intero volume cerebrale. Seleziona solo dipoli sorgente con una bontà di adattamento >60% e stima la loro clusterness (distanza dei dipoli dal centro di ciascun dipolo impostata a 15 mm)52.
- Mappatura della corteccia eloquente
- Eseguire i passaggi 4.2.1-4.2.3 precedentemente descritti utilizzando i segnali registrati durante il compito visuomotorio, nonché durante le stimolazioni uditive e somatosensoriali.
- Apri le registrazioni simultanee MEG e HD-EEG e ispeziona visivamente i dati grezzi per rimuovere i canali difettosi. Separatamente, per ogni sessione, applicare la tecnica di correzione degli artefatti SSP disponibile in Brainstorm47 per rifiutare gli artefatti biologici (ad esempio, battiti cardiaci, battiti di ciglia) dalle registrazioni. Inoltre, scartare o contrassegnare come "Intervallo errato" tutti quei segmenti di dati contaminati da artefatti che non possono essere utilizzati per ulteriori analisi.
- Applicare filtri notch (50 o 60 Hz, a seconda dell'interferenza della linea di alimentazione) e passa-banda (1-100 Hz) ai dati MEG e HD-EEG simultanei.
- Per mappare la corteccia motoria, aprire i segnali EMG registrati dagli elettrodi FDI e APB e contrassegnare manualmente l'evento di tapping eseguito dal soggetto, separatamente per la mano destra e sinistra, selezionando il primo picco di attivazione muscolare diverso dalla linea di base sulla coppia-elettrodo FDI. Esegui questo passaggio separatamente per ogni sessione utilizzando Brainstorm47.
NOTA: Utilizzare la scheda Filtro per la visualizzazione solo su Brainstorm e selezionare gli intervalli di frequenza (ad esempio, passa-alto: 30 Hz; passa-basso: 300 Hz; tacca: 60 Hz) che possono aiutare a contrassegnare correttamente i picchi dell'attività EMG durante il tocco. Il nome degli eventi deve essere lo stesso in tutte le sessioni; Ad esempio, gli eventi in cui il soggetto ha eseguito il tocco del dito destro (o sinistro) possono essere denominati "Tap_right" (o "Tap_left"). Questo passaggio ci consente di eseguire un'analisi univoca sullo stesso tipo di evento che si è verificato in tutte le sessioni. - Da ogni sessione, importare gli eventi che si verificano su segmenti privi di artefatti selezionando i seguenti parametri: Stimoli visivi: [-200; +500] ms Finestra temporale, inclusa la linea di base di [-200; 0] ms prima dell'insorgenza dello stimolo; Eventi di tocco: [-1500; +1000] finestra temporale di ms, inclusa la linea di base di [-1500; -1000] ms prima dell'insorgenza dello stimolo visivo; Suoni CHIRP modulati: [-500; +1000] ms finestra temporale, inclusa la linea di base di [-500; 0] ms prima dell'inizio dello stimolo; e stimoli tattili: [-100; +500] ms finestra temporale, inclusa la linea di base di [-100; 0] ms prima dell'insorgenza dello stimolo.
- Una volta che gli eventi di un compito specifico sono stati importati da tutte le sessioni, applicare il montaggio di riferimento medio per aumentare l'SNR sui dati EEG e stimare la media tra gli stimoli per ottenere i campi e i potenziali evocati dall'evento. Nel caso di compiti motori (ad esempio, picchiettare) e stimolazione tattile, quest'ultimo passaggio viene eseguito rispettivamente per la mano destra e sinistra.
NOTA: I pannelli A e B della Figura 5, Figura 6, Figura 7 e Figura 8 mostrano esempi di risposte evocate visivamente, motoriamente, uditiva e somatosensoriale, rispettivamente, per MEG ed EEG e il loro campo topografico relativo e le mappe di potenziale. Il numero totale di stimoli per un compito specifico dipende strettamente dal numero di sessioni completate; Nel caso di un'attività motoria, questo numero dipende anche dall'attività di maschiatura eseguita correttamente. - Per i campi e i potenziali evocati visivi, motori, uditivi o somatosensoriali, calcola il modello realistico della testa a tre strati (cioè cuoio capelluto, cranio interno e cranio esterno) per i sensori MEG ed EEG utilizzando il software OpenMEEG BEM disponibile in Brainstorm. Utilizzare la superficie corticale 3D come spazio sorgente.
NOTA: Per risolvere il modello in avanti utilizzando il FEM, calcolare il modello realistico della testa, definito come un modello geometrico da tre a cinque strati (cioè materia bianca, materia grigia, liquido cerebrospinale, cranio e pelle), utilizzando il software DUNEuro FEM disponibile in Brainstorm 47,50,51. Maggiori dettagli sulla stima del modello diretto utilizzando FEM possono essere trovati altrove (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Per ogni campo e potenziale evocato da eventi, calcolare le sorgenti corticali sugli eventi medi utilizzando il dSPM implementato nel toolbox Brainstorm per l'array di sensori MEG, EEG e MEG ed EEG combinati separatamente. Impostare la matrice di covarianza del rumore utilizzando il periodo di riferimento pre-stimolo specifico per ogni attività (vedere il passaggio 4.3.5).
- A seconda del compito, estrarre le fonti corticali massime osservate nell'area cerebrale eloquente coinvolta [corteccia visiva primaria (V1), corteccia motoria primaria (M1), corteccia uditiva primaria (A1) o corteccia somatosensoriale primaria (S1)] che possono essere definite utilizzando un atlante o attraverso la ricostruzione di un sensore virtuale (ad esempio, regione di interesse, ROI) in quella posizione (Figura 5C, Figura 6C, Figura 7C e Figura 8C).
- Eseguire la decomposizione tempo-frequenza della wavelet di Morlet sul campo evocato dall'evento e sulle potenziali sorgenti nell'area cerebrale eloquente coinvolta (V1, M1, A1 o S1) con una scala lineare (intervallo di frequenza: 1:1:100 Hz).
NOTA: Per stimare le oscillazioni evocate che sono bloccate nel tempo e in fase all'inizio dello stimolo, il segnale MEG/EEG viene inizialmente mediato sugli eventi e poi diventa soggetto all'analisi tempo-frequenza53,54. - Eseguire la standardizzazione delle mappe delle sorgenti corticali utilizzando il metodo di perturbazione correlata agli eventi disponibile in Brainstorm per normalizzarle rispetto alla linea di base (vedere il passaggio 4.3.5), separatamente per ogni evento (Figura 5D, Figura 6D, Figura 7D e Figura 8D).
NOTA: La standardizzazione delle mappe di origine utilizzando le perturbazioni correlate agli eventi è una misura di normalizzazione per le mappe di potenza tempo-frequenza che stima la deviazione dalla media rispetto alla linea di base in percentuale. Maggiori dettagli su questo processo di standardizzazione sono disponibili altrove (https://neuroimage.usc.edu/brainstorm/Tutorials/TimeFrequency#Normalized_time-frequency_maps).
- Convalida
- Acquisizione della registrazione iEEG extra-operatoria attraverso l'impianto di griglie subdurali e/o elettrodi di profondità. Il numero, il tipo e il posizionamento degli elettrodi intracranici sono decisi dall'équipe multidisciplinare per l'epilessia in base all'ipotesi clinica generata dalla somma delle informazioni ottenute dai test diagnostici non invasivi della valutazione prechirurgica.
NOTA: Come parte della valutazione prechirurgica, l'iEEG extraoperatorio viene registrato per diversi giorni tramite un sistema EEG digitale utilizzando una frequenza di campionamento di 1.024 Hz. - Identificare la SOZ come definita da un epilettologo esperto in base alle informazioni cliniche disponibili per ciascun soggetto.
NOTA: La SOZ è definita come l'area cerebrale che mostra la prima scarica elettrografica ictale inequivocabile, che è diversa dall'attività di fondo che può verificarsi prima o in concomitanza con l'insorgenza ictale clinicamente definita. Tutti i canali coinvolti in questa scarica elettrografica ictale sono considerati contatti SOZ, anche se catturano convulsioni che originano da diverse aree cerebrali. - Durante l'evento ictale registrato su iEEG, segnare il picco di ogni raffica di scariche epilettiformi che si verifica in ciascun elettrodo intracranico ed eseguire la localizzazione della sorgente su questi eventi ictali utilizzando il metodo ECD come precedentemente descritto nei passaggi 4.1.7-4.1.10.
- Confrontare i risultati della localizzazione iEEG rispetto al SOZ clinicamente definito come gold standard per i risultati della localizzazione della fonte.
- Acquisizione della registrazione iEEG extra-operatoria attraverso l'impianto di griglie subdurali e/o elettrodi di profondità. Il numero, il tipo e il posizionamento degli elettrodi intracranici sono decisi dall'équipe multidisciplinare per l'epilessia in base all'ipotesi clinica generata dalla somma delle informazioni ottenute dai test diagnostici non invasivi della valutazione prechirurgica.
Risultati
I pazienti pediatrici con DRE sono stati reclutati dalla Epilepsy Clinic presso il Jane and John Justin Institute for Mind Health, Cook Children's Health Care System (CCHCS). Qui vengono presentati i dati di tre pazienti rappresentativi: (i) una femmina di 10 anni, (ii) un maschio di 13 anni e (iii) una femmina di 10 anni.
Caso 1: Una bambina di 10 anni è stata ricoverata con convulsioni a partire dall'età di tre anni. Il paziente soffriva di convulsioni quotidiane anche dopo la somministrazione di 8 ASM. Le crisi iniziali erano caratterizzate da deviazione oculare (lato non chiaro) e arresto comportamentale. Successivamente, il paziente ha manifestato convulsioni quotidiane di ~30 s caratterizzate da broncio ictale (segno "chapeau de gendarme"), deviazione della testa a sinistra e irrigidimento bilaterale del braccio tonico (predominanza destra). L'EEG video a lungo termine ha rivelato due gruppi di convulsioni toniche asimmetriche con deviazione della testa a sinistra, seguite dal braccio sinistro in salita. Durante il sonno sono state osservate anche tre crisi toniche, con frequenti cicli di polispike veloci generalizzati e onde lente con apertura intermittente degli occhi, sguardo verso l'alto ed elevazione del braccio sinistro o destro. Questi polispike e le onde di sonno lento erano per lo più prominenti dal lobo temporale medio sinistro. La risonanza magnetica cerebrale ha rivelato le seguenti displasie multifocali: (i) lobo parietale sinistro (giro postcentrale), displasia corticale focale (FCD) con segno transmantello (FCD di tipo II), (ii) FCD della giunzione parietooccipitale destra e (iii) FCD del polo temporale sinistro. La tomografia a emissione di positroni (PET) ha dimostrato ipometabolismo nel lobo parietale sinistro, nel lobo temporale sinistro e nella giunzione parietooccipitale destra corrispondenti ai focolai dell'anomalia del segnale (cioè FCD) all'esame MRI. Al paziente è stata diagnosticata un'epilessia intrattabile, con semiologia stereotipata dello chapeau seguita da irrigidimento tonico del braccio, suggerendo una possibile insorgenza frontale mesiale o insulare/temporale. L'esplorazione estensiva dello stereo-EEG bilaterale (sEEG) è stata raccomandata mirando al lobo frontale, al cingolo, all'insula e alle regioni di displasia. Durante il monitoraggio iEEG, il paziente presentava tipiche crisi epilettiche con "chapeau de gendarme" seguite da elevazione/flessione tonica dell'arto superiore destro o sinistro caratterizzate da insorgenza EEG diffusa, massima sull'insula anteriore bilaterale. Gli IED multifocali sono stati osservati principalmente a livello del lobo temporale anteriore destro e sinistro e della corteccia frontale dorsolaterale, compresa l'insula bilaterale. L'ESI eseguita sulla registrazione iEEG ha confermato la posizione della SOZ, che è stata clinicamente definita bilateralmente nella corteccia frontale dorsolaterale sinistra e destra e nell'insula anteriore.
Nell'ambito della valutazione prechirurgica, è stata eseguita la localizzazione della sorgente sui dati simultanei MEG e HD-EEG. Le registrazioni MEG e HD-EEG hanno indicato frequenti IED in entrambe le regioni frontotemporali. La Figura 3A mostra un esempio rappresentativo di IED sia su dati MEG che HD-EEG; Il campo topografico e la mappatura del potenziale da entrambe le modalità hanno indicato una possibile fonte sottostante nella regione frontotemporale destra. ESI indicava un ammasso sparso di dipoli che coprivano aree dei lobi frontotemporali e parietali destro e sinistro. L'MSI ha mostrato un ammasso focale di dipoli nel lobo frontotemporale destro, situato vicino all'insula destra. L'EMSI ha indicato cluster focali di dipoli nelle regioni frontotemporali bilaterali, in linea con l'ESI eseguito sul gold standard iEEG, che ha confermato le osservazioni cliniche (Figura 3C). Questi dipoli stimati attraverso EMSI hanno mostrato una distanza media dal SOZ definito da iEEG di 9,81 mm (mediana: 11,18; std: 2,37).
Caso 2: Un maschio di 13 anni con epilessia intrattabile è stato ricoverato con convulsioni a partire dall'età di nove anni. Le convulsioni sono iniziate con un'aura seguita da deviazione testa/occhio verso sinistra con consapevolezza conservata a volte e clono focale della testa a sinistra, durano per ~30 s e si verificano più volte alla settimana. Nessuno degli ASM prescritti ha raggiunto il controllo delle crisi. Dal video-EEG a lungo termine, abbiamo osservato picchi temporali posteriori destri e frequenti scariche di onde di picco nell'emisfero destro che coinvolgono la corteccia temporale media, frontotemporale, temporoparietale e centroparietale. Il paziente ha avuto sei crisi elettrocliniche caratterizzate da un cambiamento comportamentale, deviazione testa/occhio a sinistra con estensione del braccio sinistro e talvolta attività clonica del braccio sinistro, e tre crisi con attività convulsiva bilaterale secondaria. L'esordio massimo è stato nel lobo temporale medio destro con un'evoluzione nel lobo frontotemporale destro. La RM cerebrale ha rivelato un'estesa malformazione della corteccia nell'emisfero cerebrale destro (perisilviano predominante) e una lieve perdita di volume nell'emisfero cerebrale destro con dilatazione ex vuoto del ventricolo laterale destro. Al paziente è stata diagnosticata un'epilessia intrattabile con esordio nell'emisfero destro, che favorisce l'esordio temporale e perisilviano nella regione di malformazione corticale diffusa. Lo stereo-EEG è stato eseguito per delineare l'entità del coinvolgimento, con elettrodi posizionati nelle corte temporale destra, perisilviaria, insulare e parietooccipitale. Durante il monitoraggio iEEG sono state acquisite diverse crisi elettrocliniche ad esordio focale con esordio massimo in un'ampia area del lobo frontotemporale destro. L'ESI eseguito sui dati iEEG ha localizzato queste crisi in un'area più focale che comprende sia l'area temporale destra (vicino al giro temporale medio destro) che l'area perisilviana.
Nell'ambito della valutazione prechirurgica, sono stati eseguiti simultaneamente MEG e HD-EEG durante i quali il paziente ha avuto due convulsioni: una mentre era seduta sulla sedia di legno durante il processo di digitalizzazione e una catturata durante la registrazione vera e propria con l'inizio visibile sia su MEG che su HD-EEG (Figura 4A). Il campo topografico e le mappe di potenziale all'insorgenza ictale hanno indicato che il generatore sottostante dell'insorgenza della crisi può essere nel lobo temporale medio destro, come mostrato nella Figura 4A. La localizzazione della sorgente sull'evento ictale ha presentato risultati diversi per ESI e MSI: ESI ha mostrato dipoli localizzati verso i lobi frontotemporali e centroparietali destri, mentre MSI ha mostrato dipoli con elevata clusterness principalmente al lobo temporale destro (Figura 4B), con ulteriori dipoli sparsi nella corteccia frontotemporale. Combinando queste soluzioni, l'EMSI ha rivelato la localizzazione dell'insorgenza ictale all'interno del lobo temporale concordante con l'ESI sul gold standard iEEG (Figura 4B). In particolare, EMSI ha presentato i risultati della localizzazione con una distanza media dal SOZ definita dal monitoraggio iEEG di 12,21 mm (mediana: 13,62; std: 2,37).
Caso 3: una ragazza di 15 anni con epilessia idiopatica correlata alla localizzazione è stata ricoverata con convulsioni a partire dall'età di 13 anni, ma forse a 8-9 anni in retrospettiva, quando le sono stati diagnosticati tic dovuti a movimenti ripetitivi e stereotipati del collo. Il paziente presentava brevi inclinazioni della testa verso sinistra che a volte progredivano in crisi discognitive focali con comportamenti ipermotori (cioè crisi tonico-cloniche generalizzate), nonché crisi convulsive notturne. Diversi ASM sono stati somministrati senza ottenere un controllo completo delle crisi. Durante il monitoraggio video-EEG a lungo termine, il paziente ha avuto crisi elettrocliniche focali con generalizzazione secondaria con esordio al lobo temporale posteriore sinistro, numerose brevi crisi motorie focali con inclinazione della testa a sinistra e una sottile crisi elettrografica con esordio alla corteccia centroparietale sinistra. La risonanza magnetica cerebrale non ha rivelato alcuna anomalia intracranica acuta e una malformazione di Chiari I. L'esame della tomografia computerizzata a emissione di positroni (PET-CT) della testa è risultato negativo. Sono stati raccomandati ulteriori test, come la TC ictale a emissione di fotone singolo (SPECT), la simultanea MEG e HD-EEG, la radiografia del rachide cervicale, l'angiografia a risonanza magnetica (MRA) della testa e del collo e, infine, l'esplorazione sEEG dell'emisfero sinistro.
Come parte della valutazione, il paziente ha partecipato a registrazioni simultanee MEG e HD-EEG per mappare aree cerebrali eloquenti, come le cortecce visive primarie, motorie, uditive e somatosensoriali. Inizialmente, il paziente ha svolto un compito visuomotorio, seguito da stimolazioni uditive e somatosensoriali. La prima risposta corticale alla stimolazione visiva si è verificata a ~70 ms dopo l'insorgenza dello stimolo sia per il MEG che per l'HD-EEG (Figura 5A). Figura 5B riporta il campo topografico e le mappe potenziali delle posizioni corticali coinvolte nella stimolazione visiva per MEG e HD-EEG, rispettivamente. Per l'HD-EEG, è stato osservato un cambiamento di polarità nei canali che coprono le aree occipitali del cervello, mentre una distribuzione di campo più complessa è stata riscontrata nelle stesse aree per il MEG (Figura 5B). La localizzazione della sorgente utilizzando dSPM ha rivelato un'attività corticale focale in questo punto temporale all'interno delle seguenti regioni cerebrali dell'atlante Desikan-Killiany: (i) cuneo per MSI; (ii) corteccia occipitale laterale per ESI; e (iii) cuneo e corteccia occipitale laterale per EMSI (Figura 5C). L'analisi tempo-frequenza sulle risposte corticali visive ha rivelato una sincronizzazione evento-correlata (ERS) nella banda di frequenza gamma per MSI (intervallo approssimativo: 30-50 Hz), ESI (intervallo approssimativo: 40-50 Hz) ed EMSI (intervallo approssimativo: 30-50 Hz) (Figura 5D). Per le risposte evocate motorie, è stata osservata una soppressione dell'attività del ritmo mu sul M1 controlaterale durante l'insorgenza del movimento (Figura 6A). In Figura 6B, abbiamo riportato il campo topografico e le mappe potenziali delle aree cerebrali attivate durante il compito motorio rispettivamente per MEG e HD-EEG. Le mappe di campo MEG hanno indicato chiare alterazioni dell'afflusso e del deflusso magnetico nelle aree cerebrali centrali controlaterali, che possono indicare un generatore focale sottostante nella M1 controlaterale (Figura 6B). Le mappe di potenziale HD-EEG hanno mostrato un cambiamento di polarità focale nelle stesse aree, con potenziali elettrici perpendicolari ai campi magnetici (Figura 6B). I picchi di massima attivazione della sorgente sono stati osservati durante l'esecuzione del compito di tapping al giro precentrale controlaterale dell'atlante Desikan-Killiany per MSI, ESI ed EMSI, rispettivamente, come mostrato in Figura 6C. Le risposte corticali motorie che si verificano durante l'anticipazione dell'imminente movimento di battito hanno mostrato ERS nelle bande beta e gamma per MSI (intervallo approssimativo: 20-30 Hz) ed EMSI (intervallo approssimativo: 20-40 Hz) e nella banda gamma per ESI (intervallo approssimativo: 30-50 Hz), indicato in letteratura come mu rhythm suppression (Figura 6D).55,56 I campi evocati uditivi e i potenziali in risposta alla stimolazione uditiva hanno avuto un picco positivo massimo a ~80 ms e ~120 ms dopo l'erogazione dello stimolo per MEG e HD-EEG, rispettivamente (Figura 7A). In Figura 7B, abbiamo riportato il campo topografico e le mappe potenziali delle posizioni corticali coinvolte nella stimolazione uditiva per MEG e HD-EEG, rispettivamente. Sia nel MEG che nell'HD-EEG, è stato osservato un evidente cambiamento di polarità con poli negativi e positivi chiaramente definiti ai sensori che coprono le aree temporali del cervello sinistro; queste mappe del campo magnetico perpendicolare e del potenziale elettrico possono rivelare un generatore focale sottostante in V1 (Figura 7B). Eseguendo la localizzazione della sorgente sui campi e sui potenziali mediamente evocati dall'udito, è stata osservata la massima attivazione corticale al giro temporale trasverso e alla porzione posteriore del giro temporale superiore dell'atlante Desikan-Killiany per MSI, ESI ed EMSI, rispettivamente (Figura 7C). L'analisi tempo-frequenza delle risposte evocate dall'udito ha rivelato ERS nella banda gamma per MSI (intervallo approssimativo: 40-60 Hz) ed EMSI (intervallo approssimativo: 35-50 Hz) e nelle bande di frequenza beta e gamma (intervallo approssimativo: 25-60 Hz) per ESI (Figura 7D). Infine, abbiamo osservato la prima attività corticale in risposta alla stimolazione tattile a ~60 e ~50 ms dopo l'inizio dello stimolo rispettivamente per MEG e HD-EEG (Figura 8A). In Figura 8B, abbiamo riportato il campo topografico e le mappe potenziali delle aree cerebrali attivate durante la stimolazione somatosensoriale rispettivamente per MEG e HD-EEG. Le mappe di campo MEG hanno rivelato un chiaro cambiamento di polarità con distinte alterazioni del flusso magnetico ai sensori che coprono le aree parietali controlaterali, mentre le mappe di potenziale HD-EEG hanno mostrato un cambiamento di polarità meno evidente nelle stesse aree con un polo positivo più forte di quello negativo. Queste mappe del campo magnetico perpendicolare e del potenziale elettrico possono indicare un generatore corticale focale in S1. Utilizzando dSPM sulle risposte medie evocate somatosensorialmente, è stata osservata la massima attività della sorgente corticale in questo punto temporale all'interno del giro postcentrale controlaterale dell'atlante di Desikan-Killiany rispettivamente per MSI, ESI ed EMSI (Figura 8C). In risposta agli stimoli tattili, l'ERS nelle bande di frequenza beta e gamma per MSI (intervallo approssimativo: 15-40 Hz) ed EMSI (intervallo approssimativo: 20-40 Hz) e nella banda di frequenza gamma per ESI (intervallo approssimativo: 30-40 Hz) (Figura 8D).
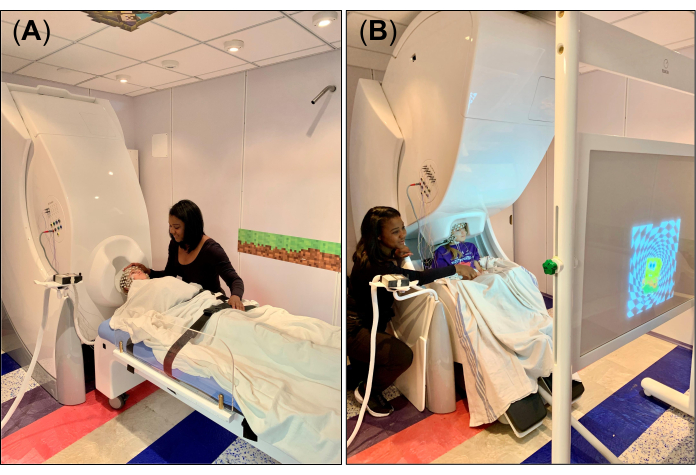
Figura 1: Configurazione sperimentale per MEG e HD-EEG simultanei presso CCHCS. (A) Sistemi HD-EEG (256 canali) e MEG (306 sensori) con il gantry del MEG impostato in posizione supina (90°, posizione orizzontale) per una registrazione dello stato di riposo/sonno utilizzando il letto compatibile con MEG non magnetico. Il tecnico sta preparando il soggetto (una bambina di 9 anni) per la registrazione garantendo sicurezza e comfort. (B) Sistemi HD-EEG e MEG predisposti per una registrazione in posizione seduta utilizzando la sedia non magnetica compatibile con MEG. Il tecnico prepara il soggetto per la registrazione garantendo la corretta posizione del soggetto davanti allo schermo dove verranno proiettati gli stimoli visivi durante il compito visuomotorio. Clicca qui per visualizzare una versione più grande di questa figura.
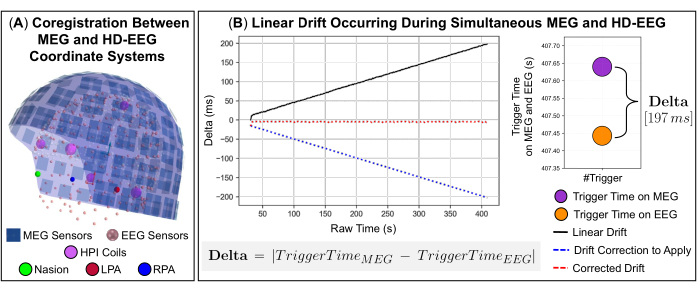
Figura 2: Aspetti tecnici della combinazione di dati provenienti da registrazioni simultanee di MEG e HD-EEG utilizzando diversi sistemi di acquisizione. (A) Allineamento spaziale (coregistrazione) dei sensori MEG e HD-EEG nello stesso sistema di coordinate (definito dalle coordinate della testa del soggetto) per un soggetto rappresentativo (una bambina di 9 anni). Le coordinate della testa del soggetto sono rappresentate dai seguenti punti fiduciali: nasion (di colore verde) e punti preauricolari sinistro/destro (rispettivamente di colore rosso e blu). Vengono visualizzati i 306 sensori MEG (di colore blu) - 102 magnetometri e 204 gradiometri planari - e le bobine dell'indicatore di posizione della testa (HPI) (di colore magenta); allineati nello stesso sistema di coordinate, vengono visualizzati anche i 256 canali HD-EEG (di colore rosa). (B) Pannello di sinistra: deriva lineare (cioè delta, visualizzata come una linea nera) dei campioni di dati che si verificano tra i sistemi MEG e HD-EEG per un soggetto rappresentativo (una bambina di 9 anni). Il delta è definito come il valore assoluto della differenza tra i tempi in cui lo stesso trigger viene inviato sia al sistema MEG che a quello EEG e aumenta continuamente nel tempo: da valori bassi (delta = 0 ms) ad alti (delta = 197 ms). La correzione della deriva lineare stimata utilizzando una funzione polinomiale da applicare ai segnali viene visualizzata con una linea tratteggiata blu. La deriva corretta (delta ~0 ms nel tempo) che rappresenta un tempo sincronizzato tra i sistemi MEG ed EEG viene visualizzata con una linea tratteggiata rossa. Pannello di destra: viene visualizzata la rappresentazione grafica dello spostamento temporale (delta = 197 ms) stimato per l'ultimo trigger inviato sia al sistema MEG che a quello EEG. Clicca qui per visualizzare una versione più grande di questa figura.
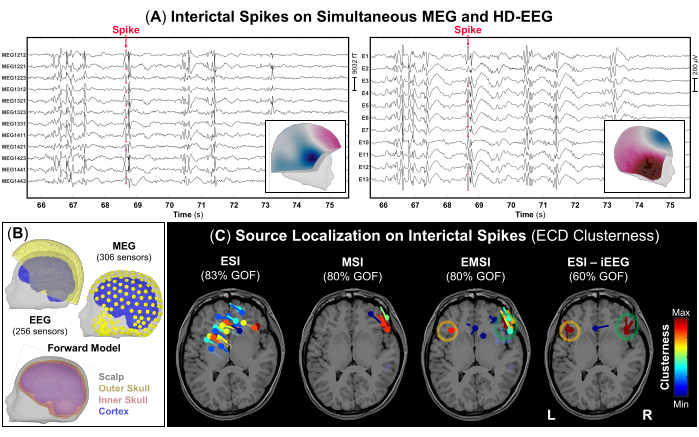
Figura 3: Scariche epilettiformi interictali (IED) su dati MEG e HD-EEG. (A) Porzione temporale della registrazione simultanea di MEG e HD-EEG (10 s) da una femmina di 10 anni (Caso 1) con IED frequenti. Per scopi di visualizzazione è stato selezionato un sottogruppo di 306 sensori MEG e 256 elettrodi EEG. Il campo topografico e le mappe potenziali al culmine di un IED vengono visualizzati come pannelli interni rispettivamente per MEG e HD-EEG. (B) Posizione dei sensori MEG e HD-EEG (di colore giallo) coregistrati sulla testa 3D del soggetto e sulle superfici corticali (di colore blu). Modello realistico della testa con il metodo degli elementi di confine (BEM) costituito da tre strati [ad esempio, cuoio capelluto (di colore grigio), cranio esterno (di colore giallo) e cranio interno (di colore rosa)] ricostruiti dalla risonanza magnetica preoperatoria del soggetto. (C) I risultati della clusterness della localizzazione della sorgente eseguiti su IED utilizzando il dipolo di corrente equivalente (ECD) sono mostrati sulla risonanza magnetica pre-operatoria del soggetto per ESI, MSI, EMSI ed ESI su iEEG (gold standard)52. Le mappe di calore del cluster di dipolo con una bontà di adattamento >60% vengono visualizzate da valori più bassi (blu) a valori più alti (rosso). La zona di insorgenza delle crisi definite attraverso l'ESI eseguito sui dati iEEG è stata considerata il gold standard (cerchi arancioni e verdi). Clicca qui per visualizzare una versione più grande di questa figura.
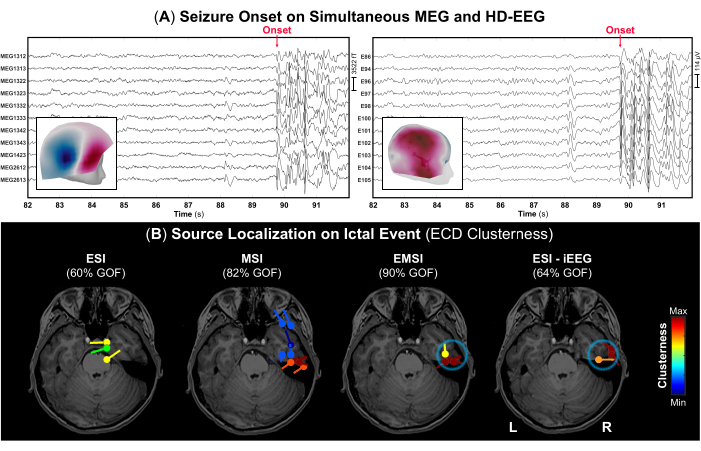
Figura 4: Insorgenza delle crisi su dati MEG e HD-EEG. (A) Porzione temporale della registrazione simultanea di MEG e HD-EEG (10 s) da un maschio di 13 anni (Caso 2) con l'insorgenza delle crisi (freccia rossa). Per scopi di visualizzazione è stato selezionato un sottogruppo di 306 sensori MEG e 256 elettrodi EEG. Il campo topografico e le mappe del potenziale all'inizio dell'esordio ictale vengono visualizzati come pannelli interni rispettivamente per MEG e HD-EEG. (B) I risultati di clusterness della localizzazione della sorgente eseguiti all'inizio dell'evento ictale utilizzando il metodo del dipolo di corrente equivalente (ECD) sono mostrati sulla risonanza magnetica pre-operatoria del soggetto per ESI, MSI, EMSI ed ESI su iEEG (gold standard)52. Le mappe di calore del cluster di dipolo con una bontà di adattamento >60% vengono visualizzate da valori più bassi (blu) a valori più alti (rosso). La zona di insorgenza delle crisi definite attraverso l'ESI eseguito sui dati iEEG è stata considerata gold standard (cerchio blu). Clicca qui per visualizzare una versione più grande di questa figura.
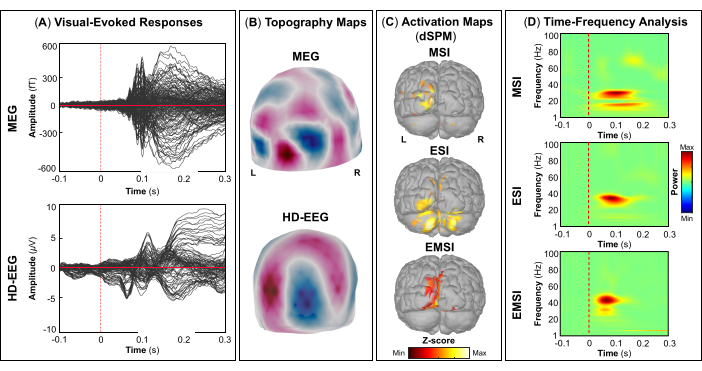
Figura 5: Campi evocati visivi e potenziali dai dati MEG e HD-EEG. (A) Le risposte visive evocate mediamente di una femmina di 15 anni per MEG (pannello superiore) e HD-EEG (pannello inferiore) sono visualizzate per l'intervallo di tempo compreso tra -100 ms e 300 ms. (B) Il campo topografico e le mappe potenziali della corteccia visiva primaria sono visualizzati per MEG e HD-EEG, rispettivamente. (C) Mappe di attivazione della sorgente con ampiezze massime di attivazione corticale nelle regioni cerebrali dell'atlante Desikan-Killiany (vale a dire, cuneo e corteccia occipitale laterale) stimate utilizzando il metodo di mappatura parametrica statistica dinamica (dSPM) rispettivamente per MSI, ESI ed EMSI. Vengono visualizzate le mappe di calore dell'attivazione della sorgente (z-score normalizzato dSPM). (D) Le mappe tempo-frequenza ottenute utilizzando la scomposizione tempo-frequenza wavelet della wavelet di Morlet sulle risposte evocate visive nella corteccia visiva primaria sono visualizzate per la finestra temporale da -100 ms a 300 ms. Vengono visualizzate le mappe termiche della potenza tempo-frequenza, espresse in percentuali basate sulla deviazione dei dati normalizzati dalla media sul basale [-200; 0] ms. Clicca qui per visualizzare una versione più grande di questa figura.
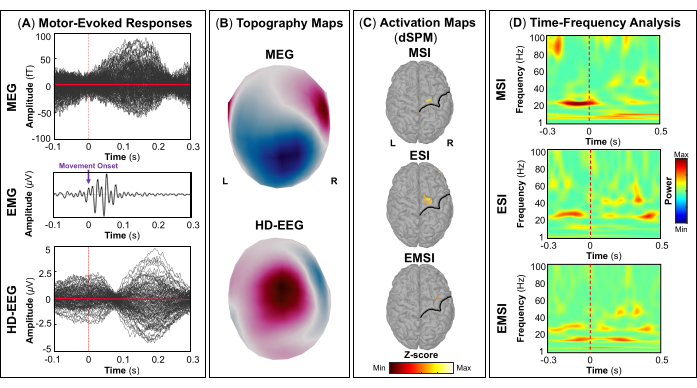
Figura 6: Campi evocati motori e potenziali da dati MEG e HD-EEG. (A) Le risposte medie evocate dal motore di una femmina di 15 anni per MEG (pannello superiore) e HD-EEG (pannello inferiore) vengono visualizzate per l'attività di tapping dell'indice sinistro nell'intervallo di tempo compreso tra -100 e 300 ms. Il segnale dell'elettromiografia (EMG) (pannello centrale) con l'inizio del movimento (freccia viola) viene visualizzato per l'intervallo di tempo compreso tra -100 ms e 300 ms; il segnale viene filtrato nella banda di frequenza 30-300 Hz (filtro Notch: 60 Hz). (B) Il campo topografico e le mappe del potenziale della corteccia motoria primaria sono visualizzati rispettivamente per MEG e HD-EEG. (C) Mappe di attivazione della sorgente con ampiezze massime di attivazione corticale al giro precentrale controlaterale dell'atlante di Desikan-Killiany stimate utilizzando il metodo di mappatura parametrica statistica dinamica (dSPM) rispettivamente per MSI, ESI ed EMSI. Vengono visualizzate le mappe di calore dell'attivazione della sorgente (z-score normalizzato dSPM), insieme al solco centrale (linea nera). (D) Mappe tempo-frequenza ottenute utilizzando la decomposizione tempo-frequenza wavelet Morlet sulle risposte evocate motoriamente nella corteccia motoria primaria per la finestra temporale da -300 ms a 500 ms. Vengono visualizzate le mappe termiche della potenza tempo-frequenza, espresse in percentuali basate sulla deviazione dei dati normalizzati dalla media sulla linea di base [-1500; -1000] ms. Clicca qui per visualizzare una versione più grande di questa figura.
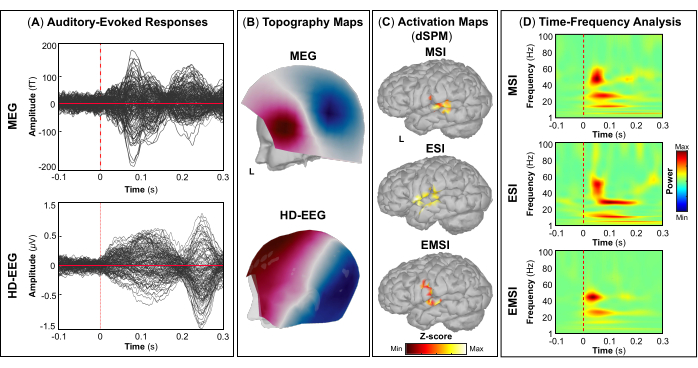
Figura 7: Campi evocati uditivi e potenziali da dati MEG e HD-EEG. (A) Le risposte uditive evocate mediamente di una femmina di 15 anni per MEG (pannello superiore) e HD-EEG (pannello inferiore) vengono visualizzate per l'intervallo di tempo compreso tra -100 ms e 300 ms. (B) Il campo topografico e le mappe potenziali della corteccia uditiva primaria vengono visualizzati rispettivamente per il MEG e l'HD-EEG. (C) Mappe di attivazione della sorgente con ampiezze massime di attivazione corticale al giro temporale trasverso e alla porzione posteriore del giro temporale superiore dell'atlante di Desikan-Killiany stimate utilizzando il metodo di mappatura parametrica statistica dinamica (dSPM) rispettivamente per MSI, ESI ed EMSI. Vengono visualizzate le mappe di calore dell'attivazione della sorgente (z-score normalizzato dSPM). (D) Mappe tempo-frequenza ottenute utilizzando la decomposizione tempo-frequenza wavelet di Morlet sulle risposte evocate uditivamente nella corteccia uditiva primaria per la finestra temporale da -100 a 300 ms. Vengono visualizzate le mappe termiche della potenza tempo-frequenza, espresse in percentuali basate sulla deviazione dei dati normalizzati dalla media rispetto al basale [-500; 0] ms. Clicca qui per visualizzare una versione più grande di questa figura.
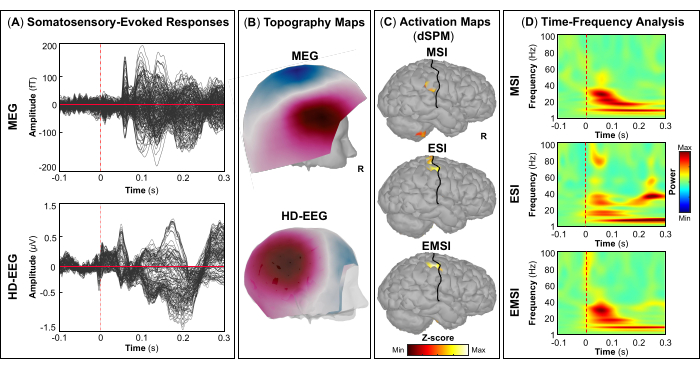
Figura 8: Campi evocati somatosensoriali e potenziali dai dati MEG e HD-EEG. (A) Le risposte somatosensoriali evocate medie di una femmina di 15 anni per MEG (pannello superiore) e HD-EEG (pannello inferiore) sono visualizzate per la stimolazione delle cifre sinistre nell'intervallo di tempo compreso tra -100 e 300 ms. (B) Il campo topografico e le mappe di potenziale della corteccia somatosensoriale primaria sono visualizzati per il MEG e l'HD-EEG, rispettivamente. (C) Mappe di attivazione della sorgente con ampiezze massime di attivazione corticale al giro postcentrale controlaterale dell'atlante di Desikan-Killiany stimate utilizzando il metodo di mappatura parametrica statistica dinamica (dSPM) rispettivamente per MSI, ESI ed EMSI. Vengono visualizzate le mappe di calore dell'attivazione della sorgente (z-score normalizzato dSPM), insieme al solco centrale (linea nera). (D) Mappe tempo-frequenza ottenute utilizzando la decomposizione tempo-frequenza wavelet di Morlet sulle risposte evocate somatosensorialmente alla corteccia somatosensoriale primaria per la finestra temporale da -100 ms a 300 ms. Vengono visualizzate le mappe termiche della potenza tempo-frequenza, espresse in percentuali basate sulla deviazione dei dati normalizzati dalla media sulla linea di base [-100; 0] ms. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
In questo studio, illustriamo la configurazione sperimentale per registrare simultaneamente MEG e HD-EEG in bambini con DRE mentre riposano/dormono, eseguono un compito o ricevono stimoli e proponiamo un quadro metodologico per localizzare la zona irritativa, la SOZ e le aree cerebrali eloquenti utilizzando EMSI, nonché MSI ed ESI individuali. Forniamo inoltre raccomandazioni tecniche per l'unione di dati MEG e HD-EEG provenienti da diversi prodotti disponibili in commercio che presentano caratteristiche uniche. Presentiamo i dati di tre casi per migliorare l'utilità clinica dell'EMSI nella localizzazione delle aree cerebrali epilettogene ed eloquenti. I risultati qui indicano che i risultati EMSI superano quelli ottenuti con entrambe le modalità da sole, molto probabilmente a causa del valore additivo delle proprietà complementari dei segnali MEG ed EEG nella soluzione combinata e probabilmente a causa dell'aumento del numero di sensori utilizzati per registrare i dati (>550 sensori). In particolare, l'EMSI ha localizzato in modo non invasivo l'irritativo e le SOZ con risultati concordanti come ESI sul gold standard iEEG, che ha confermato le osservazioni cliniche.
La metodologia proposta include le seguenti fasi critiche: (i) acquisizione di alta qualità di registrazioni simultanee MEG e HD-EEG (cioè SNR elevato) con un elevato campionamento spaziale di sensori (>550 sensori) che coprono l'intero cervello delle attività interictali e ictali, nonché campi e potenziali evocati visivi, motori, uditivi e somatosensoriali, da bambini con DRE (fasi 3.1-3.2); (ii) sincronizzazione temporale e co-registrazione spaziale di segnali MEG e HD-EEG registrati con diversi sistemi di acquisizione (step 3.12); (iii) un'attenta pre-elaborazione e selezione di porzioni di dati contenenti attività interictale (fasi 4.1.1-4.1.7), attività di insorgenza ictale (fasi 4.2.1-4.2.7) e risposte correlate agli eventi (fasi 4.3.1-4.3.6), rispettivamente; e (iv) localizzazione accurata della sorgente della zona irritativa, SOZ e aree cerebrali eloquenti di interesse utilizzando metodi di localizzazione della sorgente affidabili (ad esempio, ECD con clustering e dSPM) (passaggi 4.1.8-4.1.9, 4.2.8-4.2.9 e 4.3.7-4.3.9, rispettivamente).
Il passaggio più critico quando si eseguono registrazioni simultanee MEG e HD-EEG è quello di sincronizzare spazialmente (allineamento tra gli spazi di coordinate) e temporalmente (correzione della deriva lineare dell'orologio) i dati registrati dai due sistemi di acquisizione. Tale sincronizzazione è fondamentale per garantire la corretta identificazione degli eventi interictali, ictali e visivi/motori/uditivi/tattili che si verificano contemporaneamente nei segnali MEG e HD-EEG. Errori nella selezione del punto temporale di questi eventi possono influenzare i risultati della localizzazione della sorgente e identificare aree del cervello che non sono necessariamente coinvolte nella generazione di questi eventi.
I sistemi MEG offrono spesso sistemi EEG compatibili a 32, 64 e 128 canali incorporati nel prodotto per l'esecuzione simultanea di misurazioni MEG ed EEG. In questi casi, non è necessario sincronizzare temporalmente i dati inviando segnali di trigger comuni. Allo stesso modo, la maggior parte dei sistemi EEG sono oggi compatibili con tutti i sistemi MEG. Nonostante questi progressi nell'hardware, solo pochi centri per l'epilessia eseguono registrazioni simultanee MEG e HD-EEG come parte della valutazione prechirurgica. Qui, abbiamo sfruttato tale integrabilità e abbiamo combinato i sistemi MEG a 306 canali e EEG a 256 canali per registrare simultaneamente l'attività cerebrale con >550 sensori che coprono la testa del soggetto. Finora, sono disponibili pochi software per l'analisi avanzata di dati MEG, HD-EEG e iEEG (ad esempio, Brainstorm, CURRY, EEGLab, FieldTrip, MNE o NUTMEG). Sono quindi necessari studi futuri per convalidare la metodologia proposta con un nuovo software di analisi di neuroimaging. Infine, la combinazione di MSI ed ESI in un'unica soluzione (EMSI) ha aumentato la complessità computazionale dell'analisi dei dati.
Il metodo descritto presenta alcune limitazioni che dovrebbero essere affrontate in studi futuri. Abbiamo selezionato manualmente gli IED che si verificano sia sui dati MEG che HD-EEG di due pazienti rappresentativi, ignorando i picchi interictali che si sono verificati in uno solo dei due segnali (MEG o EEG). La selezione manuale dei picchi può essere un approccio soggettivo e dispendioso in termini di tempo che può essere semplificato utilizzando approcci automatizzati per il rilevamento degli IED sviluppati negli ultimi decenni57,58,59. Tuttavia, l'ispezione visiva è sempre consigliata per un'analisi attenta e un rilevamento raffinato di ogni IED. Inoltre, abbiamo usato il SOZ come approssimatore dell'EZ. Tuttavia, la SOZ non sempre prevede gli esiti chirurgici60,61,62,63. Gli studi futuri possono, quindi, utilizzare l'esito chirurgico come verità di base per una delineazione più precisa dell'EZ13,14,15,16,17,19,20. Sebbene le convulsioni possano essere rilevate con successo utilizzando MEG ed EEG simultanei e localizzate utilizzando tecniche di localizzazione della fonte appropriate44,64, è relativamente raro registrare tali eventi ictali nella pratica clinica, specialmente da pazienti ambulatoriali in ASM. Ciò è dovuto principalmente alla durata limitata delle registrazioni MEG e agli eccessivi movimenti del corpo che si verificano durante le convulsioni (ad esempio, la testa del paziente è scivolata fuori dal dewar), che possono causare artefatti biologici che possono influenzare gravemente i risultati della localizzazione della fonte. In una recente revisione, Stefan et al. ha riportato l'insorgenza di convulsioni durante le registrazioni MEG nel 7%-24% dei pazienti, con un tempo medio di registrazione da 30 minuti fino a 5,7 ore in diversi studi65. Al CCMC, 18 pazienti su 89 (20,2%) hanno avuto eventi ictali catturati durante registrazioni simultanee MEG e HD-EEG eseguite negli ultimi ~2 anni. Tuttavia, solo 8 dei 18 pazienti (44,4%) sono stati analizzati con successo. Nei casi in cui le registrazioni MEG interictali mostrino risultati normali o inconcludenti, è possibile utilizzare MEG ictale o HD-EEG per localizzare l'EZ con elevata precisione. Tuttavia, i requisiti tecnici e logistici per queste registrazioni dovrebbero essere affrontati. Inoltre, i dati rappresentativi per la localizzazione eloquente della corteccia tramite EMSI non sono stati confrontati con alcun gold standard per la localizzazione di queste aree funzionali del cervello, come la risonanza magnetica funzionale non invasiva o la stimolazione elettrocorticale intraoperatoria. Ulteriori indagini potrebbero, quindi, integrare EMSI e fMRI verso uno strumento di imaging multimodale non invasivo per migliorare l'accuratezza della localizzazione di queste aree cerebrali eloquenti nei bambini con DRE. Questo lavoro può anche essere esteso per localizzare altre aree funzionali del cervello, come le regioni eloquenti del linguaggio. La localizzazione delle funzioni linguistiche è di fondamentale importanza durante la valutazione prechirurgica dei pazienti con DRE per determinare la loro candidatura chirurgica, pianificare l'estensione della resezione chirurgica e prevenire deficit funzionali postoperatori permanenti66. Diversi studi non invasivi hanno dimostrato che la mappatura linguistica utilizzando il MEG può fornire risultati concordanti, simili al test Wada invasivo, che è spesso considerato il gold standard per identificare l'emisfero linguistico dominante67,68,69,70. Uno studio recente ha proposto un approccio multimodale in cui la combinazione di diverse tecniche (ad esempio, mappatura della stimolazione corticale, elettrocorticografia ad alta gamma, risonanza magnetica funzionale e stimolazione magnetica transcranica) può fornire informazioni reciproche, confermative e complementari per la mappatura del linguaggio prechirurgico71. Nonostante questi vantaggi, la mappatura delle aree linguistiche è ancora impegnativa nei pazienti pediatrici che presentano barriere cognitive, intellettuali e linguistiche a causa della loro età. Pertanto, nel prossimo futuro dovrebbero essere sviluppati compiti più specifici per l'età e configurazioni a misura di bambino. In questo lavoro, abbiamo analizzato i dati MEG e HD-EEG utilizzando un software non certificato per scopi clinici. Sebbene questi strumenti si siano dimostrati preziosi ed efficaci, comportano problemi di responsabilità che dovrebbero essere considerati quando si riportano i risultati della valutazione prechirurgica per uso clinico. Qui, descriviamo le procedure per le registrazioni HD-EEG utilizzando solo sistemi di elettrodi EEG a base di spugna. I sistemi alternativi che utilizzano elettrodi EEG a base di gel sono ampiamente utilizzati sia in ambito clinico che di ricerca. Sebbene forniscano registrazioni EEG SNR più elevate, richiedono un tempo di preparazione più lungo (~40-60 min) e quindi sono meno adatti per l'uso pediatrico. In alternativa, diversi laboratori utilizzano sistemi EEG a base di gel a bassa densità durante le registrazioni MEG, che sono vantaggiosi in termini di tempo di preparazione (rispetto ai sistemi HD-EEG), ma offrono una risoluzione spaziale significativamente inferiore a causa del ridotto numero di elettrodi che coprono l'intero cuoio capelluto12,16,72,73.
Attualmente, la localizzazione delle aree cerebrali epilettogene nei pazienti con epilessia è ancora ottenuta principalmente con il monitoraggio iEEG. Inoltre, la metodologia per la localizzazione precisa delle aree cerebrali eloquenti è scarsamente definita, e le configurazioni sperimentali attualmente utilizzate nei laboratori MEG sono inappropriate per i pazienti pediatrici, mentre l'uso dell'HD-EEG per questo scopo è molto limitato. Un'accurata localizzazione di queste aree può facilitare la valutazione prechirurgica e aumentare la pianificazione chirurgica per la resezione o il posizionamento degli elettrodi iEEG. Finora, diversi studi hanno indagato il contributo di ESI o MSI nella valutazione prechirurgica di pazienti con DRE ed epilessie focali per l'identificazione delle EZ 12,13,14,15,16,17,18,19 e delle aree eloquenti della corteccia somatosensoriale41rispettivamente. Pochi studi hanno dimostrato migliori risultati di localizzazione della sorgente e prestazioni di previsione dei risultati utilizzando EMSI rispetto a MSI o ESI da soli 13,31,42. Nonostante questi risultati, la registrazione di MEG ed EEG viene raramente eseguita contemporaneamente e MSI ed ESI sono implementati solo in pochi centri per l'epilessia in tutto il mondo. Per quanto ne sappiamo, questo è il primo studio che fornisce suggerimenti per la raccolta e l'analisi simultanea di dati MEG e HD-EEG, nonché per l'esecuzione di EMSI nell'epilessia pediatrica per l'identificazione non invasiva della zona irritativa, SOZ e aree cerebrali eloquenti, vale a dire cortecce visive primarie, motorie, uditive e somatosensoriali.
Qui, abbiamo eseguito l'EMSI su picchi interictali ed eventi ictali rilevati su dati simultanei non invasivi di due pazienti con DRE (Casi 1 e 2) e abbiamo ottenuto un errore di localizzazione della sorgente di ~9 mm e ~12 mm dal SOZ, rispettivamente, in linea con gli studi precedenti42. Sorprendentemente, un tale metodo ha raggiunto un'accuratezza di localizzazione paragonabile ai risultati intracranici (cioè ESI su dati iEEG), con dipoli raggruppati localizzati nell'area cerebrale individuati come epilettogeni dalle osservazioni cliniche (Figura 3C e Figura 4B). Utilizzando i dati non invasivi di un terzo paziente rappresentativo con DRE (Caso 3), abbiamo anche eseguito l'EMSI su attività evocate visivamente, motoriamente, uditiva e somatosensoriale e abbiamo trovato modelli di attivazione della fonte prominenti nelle corrispondenti aree eloquenti del cervello (ad esempio, cortecce visive, motorie, uditive e somatosensoriali) (Figura 5C, Figura 6C, Figura 7C e Figura 8C).
I nostri risultati sono stati derivati dalla fusione di informazioni complementari acquisite dalle modalità MEG ed EEG che possono migliorare l'accuratezza della localizzazione. L'EEG è ben noto per riflettere tutte le correnti intracraniche, mentre il MEG è per lo più sensibile alle fonti tangenziali e cieco alle fonti cerebrali profonde29,74. Come dimostrato in questo studio, la combinazione di MEG ed EEG può, quindi, superare i limiti di ciascuna modalità, fornire risultati di localizzazione superiori e identificare aree cerebrali epilettogene ed eloquenti che ESI o MSI potrebbero aver perso se usati da soli. Inoltre, presentiamo un approccio alternativo non invasivo per la mappatura delle aree cerebrali eloquenti utilizzando EMSI in quei pazienti che non sono stati sottoposti a fMRI durante la loro valutazione prechirurgica.
La localizzazione delle aree cerebrali epilettogene ed eloquenti utilizzando tecniche non invasive, come MEG ed EEG simultanei, è un passo essenziale durante la valutazione prechirurgica dei bambini con DRE per la completa rimozione o disconnessione dell'EZ, preservando le aree corticali eloquenti. La metodologia proposta offre una descrizione dettagliata dell'acquisizione e dell'analisi di dati simultanei MEG ed EEG che supporta la sua applicazione non solo nella valutazione prechirurgica dell'epilessia, ma anche nelle neuroscienze cognitive per esplorare le funzioni fisiologiche del cervello sano sia nei bambini con sviluppo tipico che negli adulti sani, nonché i cambiamenti morfologici e funzionali del cervello associati all'epilessia o ad altri disturbi neurologici. Studi futuri che indagano le reti cerebrali epilettogene potrebbero anche valutare se gli hub di rete (cioè le regioni cerebrali altamente connesse) stimati in modo non invasivo utilizzando EMSI su dati MEG e HD-EEG simultanei possono localizzare in modo più accurato l'EZ nei bambini con DRE rispetto a quelli stimati utilizzando MSI e/o ESI da soli 75,76,77. Inoltre, la mappatura non invasiva delle propagazioni spazio-temporali di picchi e increspature (i.e., oscillazioni ad alta frequenza, >80 Hz), stimate attraverso EMSI, può aiutare a comprendere meglio i meccanismi fisiopatologici di propagazione dell'attività epilettiforme e valutare in modo non invasivo il generatore di insorgenza di queste propagazioni che è un preciso biomarcatore dell'EZ78,79. Il protocollo presentato può aiutare a studiare ulteriormente la complementarità dei sistemi MEG ed EEG esaminando la sensibilità degli array di sensori MEG ed EEG a sorgenti di diversi orientamenti. Tale analisi può fornire informazioni sulle proprietà elettrofisiologiche del cervello durante l'esecuzione simultanea di MEG e HD-EEG.
Divulgazioni
Gli autori non riportano alcuna divulgazione.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institute of Neurological Disorders and Stroke (R01NS104116; R01NS134944; Investigatore principale: Christos Papadelis).
Materiali
| Name | Company | Catalog Number | Comments |
| AIRSTIM unit | SD Instruments | N/A | The SDI AIRSTIM system is an alternative unconditioned stimulus to shock |
| Baby Shampoo | Johnson's | N/A | Baby Shampoo is as gentle to the eyes as pure water and is specially designed to gently cleanse baby’s delicate hair and scalp. |
| Control III disinfectant cleaning solution | Maril Products, Inc. | http://www.controlthree.com/ | Disinfectant and germicide solution formulated for hospitals |
| Elekta Neuromag | TRIUX | NM24132A | Comprehensive bioelectromagnetic measurement system characterized by 306-channel neuromagnetometer for functional brain studies |
| FASTRAK | Polhemus technology | NS-7806 | Using A/C electromagnetic technology, FASTRAK delivers accurate position and orientation data, with virtually no latency. With a single magnetic source, FASTRAK delivers data for up to four sensors. The source emits an electromagnetic field, sensors within the field of range are tracked in full 6DOF (6 Degrees-Of-Freedom). Setup is simple and intuitive, with no user calibration required. |
| Genuine Grass Reusable Cup EEG Electrodes | Natus Medical, Inc. | N/A | Each Genuine Grass EEG Electrode undergoes rigorous mechanical and electrical testing to assure long life for unsurpassed recording clarity and dependability. |
| Geodesic Sensor Net | Electrical Geodesics, Inc. | S-MAN-200-GSNR-001 | 32 to 256 electrodes to place on the human head to aquire dense-array electroencephalography data |
| GeoScan Sensor Digitization System | Electrical Geodesics, Inc. | 8100550-03 | Handheld Scanner and Software for 3D electrode position registration |
| Natus Xltek NeuroWorks | Natus Medical, Inc. | https://natus.com/ | The Natus NeuroWorks platform simplifies the process of collecting, monitoring and managing data for routine EEG testing, ambulatory EEG, long-term monitoring, ICU monitoring, and research studies. |
| Natus NeuroWorks EEG Software | Natus Medical, Inc. | https://natus.com/neuro/neuroworks-eeg-software/ | NeuroWorks EEG software simplifies the process of collecting, monitoring, trending and managing EEG testing data, allowing care providers to save time and focus on delivering the best care. |
| ROSA ONE Brain | Zimmer Biomet | https://www.zimmerbiomet.com/en/products-and-solutions/zb-edge/robotics/rosa-brain.html | ROSA ONE Brain is a robotic solution to assist surgeons in planning and performing complex neurosurgical procedures through a small drill hole in the skull. |
| Ten20 Conductive Paste | Weaver and company | N/A | Ten20 contains the right balance of adhesiveness and conductivity, enabling the electrodes to remain in place while allowing the transmittance of electrical signals. |
Riferimenti
- Oldham, M. S., Horn, P. S., Tsevat, J., Standridge, S. Costs and clinical outcomes of epilepsy surgery in children with drug-resistant epilepsy. Pediatr Neurol. 53 (3), 216-220 (2015).
- Willie, J. T., et al. Real-time magnetic resonance-guided stereotactic laser amygdalohippocampotomy for mesial temporal lobe epilepsy. Neurosurgery. 74 (6), 569-584 (2014).
- Rosenow, F., Lüders, H. Presurgical evaluation of epilepsy. Brain. 124, Pt 9 1683-1700 (2001).
- Önal, Ç, et al. Complications of invasive subdural grid monitoring in children with epilepsy). J Neurosurg. 98 (5), 1017-1026 (2003).
- Hader, W. J., et al. Complications of epilepsy surgery-a systematic review of focal surgical resections and invasive EEG monitoring. Epilepsia. 54 (5), 840-847 (2013).
- Meng, Y., et al. Risk factors for surgical site infection after intracranial electroencephalography monitoring for epilepsy in the pediatric population. J Neurosurg Pediatr. 22 (1), 31-36 (2018).
- Jobst, B. C., et al. Intracranial EEG in the 21st Century. Epilepsy Curr. 20 (4), 180-188 (2020).
- Schwartz, E. S., et al. Magnetoencephalography for pediatric epilepsy: how we do it. AJNR Am J Neuroradiol. 29 (5), 832-837 (2008).
- Michel, C. M., et al. Electric source imaging of human brain functions. Brain Res Rev. 36 (2-3), 108-118 (2001).
- Michel, C. M., He, B. EEG source localization. Handb Clin Neurol. 160, 85-101 (2019).
- Michel, C. M., Brunet, D. EEG source imaging: A practical review of the analysis steps. Front Neurol. 10, 325(2019).
- Plummer, C., et al. Interictal and ictal source localization for epilepsy surgery using high-density EEG with MEG: a prospective long-term study. Brain. 142 (4), 932-951 (2019).
- Duez, L., et al. Electromagnetic source imaging in presurgical workup of patients with epilepsy: A prospective study. Neurology. 92 (6), e576-e586 (2019).
- Mouthaan, B. E., et al. Diagnostic accuracy of interictal source imaging in presurgical epilepsy evaluation: A systematic review from the E-PILEPSY consortium. Clin Neurophysiol. 130 (5), 845-855 (2019).
- Pellegrino, G., et al. Clinical yield of magnetoencephalography distributed source imaging in epilepsy: A comparison with equivalent current dipole method. Hum Brain Mapp. 39 (1), 218-231 (2018).
- Tamilia, E., et al. Assessing the localization accuracy and clinical utility of electric and magnetic source imaging in children with epilepsy. Clin Neurophysiol. 130 (4), 491-504 (2019).
- Coito, A., et al. Interictal epileptogenic zone localization in patients with focal epilepsy using electric source imaging and directed functional connectivity from low-density EEG. Epilepsia Open. 4 (2), 281-292 (2019).
- Singh, J., Ebersole, J. S., Brinkmann, B. H. From theory to practical fundamentals of electroencephalographic source imaging in localizing the epileptogenic zone. Epilepsia. 63 (10), 2476-2490 (2022).
- Brodbeck, V., et al. Electrical source imaging for presurgical focus localization in epilepsy patients with normal MRI. Epilepsia. 51 (4), 583-591 (2010).
- Santalucia, R., et al. Clinical added value of interictal automated electrical source imaging in the presurgical evaluation of MRI-negative epilepsy: A real-life experience in 29 consecutive patients. Epilepsy Behav. 143, 109229(2023).
- Schneider, F., et al. Magnetic source imaging in non-lesional neocortical epilepsy: additional value and comparison with ICEEG. Epilepsy Behav. 24 (2), 234-240 (2012).
- Hämäläinen, M., Hari, R., Ilmoniemi, R. J., Knuutila, J., Lounasmaa, O. V. Magnetoencephalography-theory, instrumentation, and applications to noninvasive studies of the working human brain. Rev Mod Phys. 65, 413-497 (1993).
- Baillet, S., Mosher, J. C., Leahy, R. M. Electromagnetic brain mapping. IEEE Signal Process Mag. 18 (6), 14-30 (2001).
- Fuchs, M., Kastner, J., Tech, R., Wagner, M., Gasca, F. MEG and EEG dipole clusters from extended cortical sources. Biomed Eng Lett. 7 (3), 185-191 (2017).
- Singh, S. P. Magnetoencephalography: Basic principles. Ann Indian Acad Neurol. 17, Suppl 1 S107-S112 (2014).
- Ahlfors, S. P., Han, J., Belliveau, J. W., Hämäläinen, M. S. Sensitivity of MEG and EEG to source orientation. Brain Topogr. 23, 227-232 (2010).
- Kim, H., Chung, C. K., Hwang, H. Magnetoencephalography in pediatric epilepsy. Korean J Pediatr. 56 (10), 431-438 (2013).
- Gorjan, D., Gramann, K., De Pauw, K., Marusic, U. Removal of movement-induced EEG artifacts: Current state of the art and guidelines. J Neural Eng. , (2022).
- Barkley, G. L., Baumgartner, C. MEG and EEG in epilepsy. J Clin Neurophysiol. 20 (3), 163-178 (2003).
- Ebersole, J. S., Ebersole, S. M. Combining MEG and EEG source modeling in epilepsy evaluations. J Clin Neurophysiol. 27 (6), 360-371 (2010).
- Yoshinaga, H., et al. Benefit of simultaneous recording of EEG and MEG in dipole localization. Epilepsia. 43 (8), 924-928 (2002).
- Baumgartner, C. Controversies in clinical neurophysiology. MEG is superior to EEG in the localization of interictal epileptiform activity: Con. Clin Neurophysiol. 115 (5), 1010-1020 (2004).
- Barkley, G. L. Controversies in neurophysiology. MEG is superior to EEG in localization of interictal epileptiform activity: Pro. Clin Neurophysiol. 115 (5), 1001-1009 (2004).
- Braeutigam, S. Magnetoencephalography: Fundamentals and established and emerging clinical applications in radiology. ISRN Radiol. 2013, 529463(2013).
- Papadelis, C., et al. Current and emerging potential for magnetoencephalography in pediatric epilepsy. J Pediatr Epilepsy. 2 (1), 73-85 (2013).
- Fiedler, P., Fonseca, C., Supriyanto, E., Zanow, F., Haueisen, J. A high-density 256-channel cap for dry electroencephalography. Hum Brain Mapp. 43 (4), 1295(2022).
- Sharon, D., Hämäläinen, M. S., Tootell, R. B. H., Halgren, E., Belliveau, J. W. The advantage of combining MEG and EEG: comparison to fMRI in focally-stimulated visual cortex. Neuroimage. 36 (4), 1225(2007).
- Pataraia, E., Lindinger, G., Deecke, L., Mayer, D., Baumgartner, C. Combined MEG/EEG analysis of the interictal spike complex in mesial temporal lobe epilepsy. Neuroimage. 24 (3), 607-614 (2005).
- Ahmed Mahmutoglu, M., Rupp, A., Baumgärtner, U. Simultaneous EEG/MEG yields complementary information of nociceptive evoked responses. Clin Neurophysiol. 143, 21-35 (2022).
- Aydin, Ü, et al. Combined EEG/MEG can outperform single modality EEG or MEG source reconstruction in presurgical epilepsy diagnosis. PLoS One. 10 (3), e0118753(2015).
- Bast, T., et al. Combined EEG and MEG analysis of early somatosensory evoked activity in children and adolescents with focal epilepsies. Clin Neurophysiol. 118 (8), 1721-1735 (2007).
- Chikara, R. K., et al. Electromagnetic source imaging predicts surgical outcome in children with focal cortical dysplasia. Clin Neurophysiol. 153, 88-101 (2023).
- Hari, R., et al. IFCN-endorsed practical guidelines for clinical magnetoencephalography (MEG). Clin Neurophysiol. 129 (8), 1720-1747 (2018).
- Bagić, A. I., Knowlton, R. C., Rose, D. F., Ebersole, J. S. American Clinical Magnetoencephalography Society Clinical Practice Guideline 1: Recording and analysis of spontaneous cerebral activity. J Clin Neurophysiol. 28 (4), 348-354 (2011).
- Papadelis, C., Chen, Y. H. Pediatric magnetoencephalography in clinical practice and research. Neuroimaging Clin N Am. 30 (2), 239-248 (2020).
- De Macedo Rodrigues, K., et al. A FreeSurfer-compliant consistent manual segmentation of infant brains spanning the 0-2 year age range. Front Hum Neurosci. 9, 21(2015).
- Tadel, F., Baillet, S., Mosher, J. C., Pantazis, D., Leahy, R. M. Brainstorm: A user-friendly application for MEG/EEG analysis. Comput Intell Neurosci. 2011, 879716(2011).
- Kane, N., et al. A revised glossary of terms most commonly used by clinical electroencephalographers and updated proposal for the report format of the EEG findings. Revision 2017. Clin Neurophysiol Pract. 2, 170-185 (2017).
- Lantz, G., et al. Propagation of interictal epileptiform activity can lead to erroneous source localizations: a 128-channel EEG mapping study. J Clin Neurophysiol. 20 (5), 311-319 (2003).
- Vorwerk, J., et al. A guideline for head volume conductor modeling in EEG and MEG. Neuroimage. 100, 590-607 (2014).
- Schrader, S., et al. DUNEuro-A software toolbox for forward modeling in bioelectromagnetism. PLoS One. 16 (6), e0252431(2021).
- Ntolkeras, G., et al. Presurgical accuracy of dipole clustering in MRI-negative pediatric patients with epilepsy: Validation against intracranial EEG and resection. Clin Neurophysiol. 141, 126-138 (2022).
- David, O., Kilner, J. M., Friston, K. J. Mechanisms of evoked and induced responses in MEG/EEG. Neuroimage. 31, 1580-1591 (2006).
- Pantev, C. Evoked and induced gamma-band activity of the human cortex. Brain Topogr. 7 (4), 321-330 (1995).
- Fox, N. A., et al. Assessing human mirror activity with EEG mu rhythm: A meta-analysis. Psychol Bull. 142 (3), 291-313 (2016).
- Genzer, S., Ong, D. C., Zaki, J., Perry, A. Mu rhythm suppression over sensorimotor regions is associated with greater empathic accuracy. Soc Cogn Affect Neurosci. 17 (9), 788-801 (2022).
- Janmohamed, M., et al. Moving the field forward: detection of epileptiform abnormalities on scalp electroencephalography using deep learning-clinical application perspectives. Brain Commun. 4 (5), 218(2022).
- Bagheri, E., Jin, J., Dauwels, J., Cash, S., Westover, M. B. A fast machine learning approach to facilitate the detection of interictal epileptiform discharges in the scalp electroencephalogram. J Neurosci Methods. 326, 108362(2019).
- Thomas, J., et al. Automated detection of interictal epileptiform discharges from scalp electroencephalograms by convolutional neural networks. Int J Neural Syst. 30 (11), 2050030(2020).
- Zijlmans, M., Zweiphenning, W., van Klink, N. Changing concepts in presurgical assessment for epilepsy surgery. Nat Rev Neurol. 15 (10), 594-606 (2019).
- Akiyama, T., et al. Focal resection of fast ripples on extraoperative intracranial EEG improves seizure outcome in pediatric epilepsy. Epilepsia. 52 (10), 1802-1811 (2011).
- Duncan, J. S., Winston, G. P., Koepp, M. J., Ourselin, S. Brain imaging in the assessment for epilepsy surgery. Lancet Neurol. 15 (4), 420(2016).
- Jacobs, J., et al. High-frequency electroencephalographic oscillations correlate with outcome of epilepsy surgery. Ann Neurol. 67 (2), 209-220 (2010).
- Ricci, L., et al. Virtual implantation using conventional scalp EEG delineates seizure onset and predicts surgical outcome in children with epilepsy. Clin Neurophysiol. 139, 49-57 (2022).
- Stefan, H., Rampp, S. Interictal and Ictal MEG in presurgical evaluation for epilepsy surgery. Acta Epileptologica. 2, 11(2020).
- Jahangiri, F. R., Chima, G. S., Pearson, M., Jackson, J., Siddiqui, A. A. Mapping of the language cortex. Cureus. 13 (5), e14960(2021).
- Merrifield, W. S., Simos, P. G., Papanicolaou, A. C., Philpott, L. M., Sutherling, W. W. Hemispheric language dominance in magnetoencephalography: sensitivity, specificity, and data reduction techniques. Epilepsy Behav. 10 (1), 120-128 (2007).
- Wheless, J. W., et al. Magnetoencephalography (MEG) and magnetic source imaging (MSI). Neurologist. 10 (3), 138-153 (2004).
- Breier, J. I., Simos, P. G., Zouridakis, G., Papanicolaou, A. C. Lateralization of activity associated with language function using magnetoencephalography: a reliability study. J Clin Neurophysiol. 17 (5), 503-510 (2000).
- Pataraia, E., Baumgartner, C., Lindinger, G., Deecke, L. Magnetoencephalography in presurgical epilepsy evaluation. Neurosurg Rev. 25 (3), 141-159 (2002).
- Babajani-Feremi, A., et al. Language mapping using high gamma electrocorticography, fMRI, and TMS versus electrocortical stimulation. Clin Neurophysiol. 127 (3), 1822-1836 (2016).
- Brodbeck, V., et al. Electroencephalographic source imaging: a prospective study of 152 operated epileptic patients. Brain. 134, Pt 10 2887-2897 (2011).
- Sohrabpour, A., et al. Effect of EEG electrode number on epileptic source localization in pediatric patients. Clin Neurophysiol. 126 (3), 472-480 (2015).
- Laohathai, C., et al. Practical fundamentals of clinical MEG interpretation in epilepsy. Front Neurol. 12, 722986(2021).
- Corona, L., et al. Mapping functional connectivity of epileptogenic networks through virtual implantation. Proceedings of the Annu Int Conf IEEE Eng Med Biol Soc. 2021, 408-411 (2021).
- Corona, L., et al. Non-invasive mapping of epileptogenic networks predicts surgical outcome. Brain. 146 (5), 1916-1931 (2023).
- Rijal, S., et al. Functional connectivity discriminates epileptogenic states and predicts surgical outcome in children with drug resistant epilepsy. Sci Rep. 13 (1), 9622(2023).
- Tamilia, E., et al. Noninvasive mapping of ripple onset predicts outcome in epilepsy surgery. Ann Neurol. 89 (5), 911-925 (2021).
- Matarrese, M. A. G., et al. Spike propagation mapping reveals effective connectivity and predicts surgical outcome in epilepsy. Brain. 146 (9), 3898-3912 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon