Method Article
Imagem de fonte eletromagnética na avaliação pré-cirúrgica de crianças com epilepsia resistente a medicamentos
Neste Artigo
Resumo
A magnetoencefalografia (MEG) e a eletroencefalografia de alta densidade (HD-EEG) raramente são registradas simultaneamente, embora forneçam informações confirmatórias e complementares. Aqui, ilustramos a configuração experimental para registrar MEG e HD-EEG simultâneos e a metodologia para analisar esses dados com o objetivo de localizar áreas cerebrais epileptogênicas e eloquentes em crianças com epilepsia resistente a medicamentos.
Resumo
Para crianças com epilepsia resistente a medicamentos (DRE), a ausência de convulsões depende do delineamento e ressecção (ou ablação/desconexão) da zona epileptogênica (EZ), preservando as áreas cerebrais eloquentes. O desenvolvimento de um método de localização confiável e não invasivo que forneça informações clinicamente úteis para a localização da ZE é, portanto, crucial para alcançar resultados cirúrgicos bem-sucedidos. A imagem de fonte elétrica e magnética (ESI e MSI) tem sido cada vez mais utilizada na avaliação pré-cirúrgica desses pacientes, mostrando achados promissores no delineamento de áreas cerebrais epileptogênicas e eloquentes. Além disso, a combinação de ESI e MSI em uma única solução, ou seja, imagens de fontes eletromagnéticas (EMSI), realizadas em registros simultâneos de eletroencefalografia de alta densidade (HD-EEG) e magnetoencefalografia (MEG) mostrou maior precisão de localização de fontes do que qualquer uma das modalidades sozinhas. Apesar desses achados encorajadores, essas técnicas são realizadas em apenas alguns centros terciários de epilepsia, raramente são registradas simultaneamente e são subutilizadas em coortes pediátricas. Este estudo ilustra a configuração experimental para registrar dados simultâneos de MEG e HD-EEG, bem como a estrutura metodológica para analisar esses dados com o objetivo de localizar a zona irritativa, a zona de início da convulsão e as áreas cerebrais eloquentes em crianças com DRE. Mais especificamente, as configurações experimentais são apresentadas para (i) registrar e localizar a atividade epileptiforme interictal e ictal durante o sono e (ii) registrar respostas evocadas visuais, motoras, auditivas e somatossensoriais e mapear áreas cerebrais eloquentes relevantes (ou seja, visual, motora, auditiva e somatossensorial) durante a tarefa visuomotora, bem como estímulos auditivos e somatossensoriais. As etapas detalhadas do pipeline de análise de dados são apresentadas para realizar EMSI, bem como ESI e MSI individuais usando dipolo de corrente equivalente (ECD) e mapeamento paramétrico estatístico dinâmico (dSPM).
Introdução
A epilepsia é um dos distúrbios neurológicos mais comuns e incapacitantes, caracterizado por convulsões recorrentes e não provocadas que podem ser de natureza focal ou generalizada. Apesar da disponibilidade de várias terapias farmacológicas eficazes (por exemplo, medicamentos anticonvulsivantes [ASMs]), cerca de 20-30% desses pacientes são incapazes de controlar suas convulsões e sofrem de epilepsia resistente a medicamentos (DRE)1. Para esses pacientes, a cirurgia de epilepsia é o tratamento mais eficaz para eliminar as convulsões; uma cirurgia bem-sucedida pode ser alcançada através da ressecção completa (ou ablação/desconexão) da zona epileptogênica (ZE), definida como a área mínima indispensável para a geração de crisesconvulsivas 2. O delineamento preciso e a ressecção (ou ablação/desconexão) da ZE, preservando o córtex eloquente, são fatores cruciais para garantir a ausência de convulsões. Para estabelecer a candidatura cirúrgica, várias ferramentas diagnósticas não invasivas são usadas por uma equipe multidisciplinar para definir diferentes áreas corticais (ou seja, zona irritativa, zona de início de convulsão [SOZ], zona de déficit funcional e lesão epileptogênica), que servem como aproximadores indiretos do EZ3. O monitoramento extraoperatório com EEG intracraniano (iEEG) é necessário quando nenhum desses métodos identifica inequivocamente a ZE. O papel do iEEG é definir com precisão o EZ, localizando o SOZ (ou seja, a área do cérebro onde as convulsões clínicas são geradas) e mapear áreas cerebrais eloquentes. No entanto, apresenta sérias limitações devido à sua invasividade 4,5,6, oferece cobertura espacial limitada e necessita de uma hipótese clara de localização pré-cirúrgica7. Como resultado, o foco real e a extensão da SOZ podem ser perdidos, levando a uma cirurgia malsucedida. Além disso, sua interpretação requer o registro de múltiplas crises clínicas estereotipadas durante vários dias de internação, o que aumenta as chances de complicações (por exemplo, infecção e/ou sangramento)5. Portanto, há uma necessidade não atendida de desenvolver métodos de localização confiáveis e não invasivos que possam fornecer informações clinicamente úteis e, em geral, melhorar a avaliação pré-cirúrgica de crianças com EDR.
Nas últimas décadas, a imagem de fontes elétricas e magnéticas (ESI e MSI) tem sido cada vez mais utilizada na avaliação pré-cirúrgica de pacientes com EDR para o delineamento de áreas cerebrais epileptogênicas e funcionais. Particularmente, ESI e MSI permitem a reconstrução de fontes neurais a partir de gravações não invasivas, como EEG de alta densidade (HD-EEG) e magnetoencefalografia (MEG), para ajudar a orientar o planejamento cirúrgico ou a colocação de eletrodos de iEEG. ESI e MSI podem ser aplicados para localizar descargas epileptiformes interictais (IEDs), como pontas e ondas agudas, ou atividade ictal (convulsão). Pode ainda ser usado para a localização de diferentes áreas funcionais do cérebro envolvidas nas funções sensoriais, motoras, auditivas e cognitivas. A reconstrução de eventos eletrofisiológicos, como IEDs e convulsões, permite a identificação da zona irritativa (ou seja, a área do cérebro onde os IEDs se originam) e da SOZ, respectivamente, que são considerados um substituto válido para a localização da ZE. A localização do córtex eloquente (ou seja, as áreas cerebrais indispensáveis para funções corticais definidas)3 permite, em vez disso, mapear a localização e a extensão das áreas eloquentes em relação à ressecção planejada e, portanto, reduzir antecipadamente os déficits funcionais potenciais que podem ser esperados da cirurgia de epilepsia 8,9,10,11 . Vários estudos investigaram a utilidade clínica do ESI e/ou MSI na avaliação pré-cirúrgica da epilepsia, e mostraram achados promissores no delineamento do EZ 12,13,14,15,16,17,18,19. Por exemplo, Mouthaan et al.14 realizaram uma extensa meta-análise usando dados não invasivos de 11 estudos prospectivos e retrospectivos de epilepsia e relataram que essas técnicas de localização de fontes podem identificar a ZE com alta sensibilidade (82%) e baixa especificidade (53%). Outros estudos também mostraram que MSI e ESI podem localizar corretamente o foco epiléptico dentro da área ressecada em pacientes epilépticos com ressonância magnética (RM) normal19,20,21. Esses resultados de localização são particularmente importantes para os pacientes que não são elegíveis para cirurgia de epilepsia devido a achados clínicos ou de imagem inconclusivos. Em resumo, ESI e MSI podem contribuir significativamente para o mapeamento pré-cirúrgico de áreas cerebrais epileptogênicas e funcionais em pacientes com DRE.
Apesar desses achados encorajadores, essas técnicas são atualmente realizadas em apenas alguns centros terciários de epilepsia regularmente e muitas vezes são subutilizadas em populações pediátricas. Além disso, HD-EEG e MEG raramente são registrados simultaneamente, embora forneçam informações confirmatórias e complementares. O MEG é sensível para detectar fontes superficiais com orientação tangencial, mas é cego para fontes orientadas radialmente localizadas nos giros ou em áreas mais profundas do cérebro 22,23,24,25,26. Além disso, o MEG fornece melhor resolução espacial (milímetros) em comparação com o EEG 16,22,25. Ao contrário dos sinais de EEG, os sinais de MEG são livres de referência e essencialmente não são afetados por diferentes condutividades dos tecidos cerebrais (ou seja, meninges, líquido cefalorraquidiano, crânio e couro cabeludo)25,27 fornecendo medições sem distorções dos campos magnéticos produzidos pelo cérebro. Por outro lado, o EEG pode detectar fontes de todas as orientações, mas oferece menor resolução espacial do que o MEG e é mais suscetível a artefatos 26,28. Devido a essas sensibilidades complementares à orientação e profundidade da fonte, aproximadamente 30% da atividade epileptiforme (por exemplo, IEDs) só pode ser registrada no MEG, mas não no EEG, e vice-versa 26,29,30,31,32. Ao contrário do EEG, que permite gravações prolongadas, a captura de crises clínicas com MEG é desafiadora devido ao tempo de gravação restrito que geralmente é insuficiente para registrar eventos ictais na maioria dos pacientes. Além disso, artefatos causados por movimentos da cabeça relacionados a convulsões podem interferir na qualidade dos registros de MEG 29,33,34,35. Por outro lado, os registros de MEG são mais rápidos e fáceis em comparação com o EEG, especialmente em crianças, uma vez que não há necessidade de acoplar sensores sobre a cabeça da criança35.
Os avanços no hardware tornaram possível registrar simultaneamente dados MEG e HD-EEG com um grande número de sensores (mais de 550 sensores) cobrindo todo o cabeçote. Além disso, os desenvolvimentos modernos nas tecnologias de EEG minimizaram o tempo de preparação para HD-EEG para menos de um quarto de hora36. Isso é particularmente importante para populações pediátricas com comportamentos desafiadores que não conseguem ficar paradas por períodos prolongados. Além disso, os avanços nas tecnologias de software permitiram a combinação de ESI e MSI em uma única solução, ou seja, imagens de fontes eletromagnéticas (EMSI), realizadas em gravações simultâneas de HD-EEG e MEG. Vários estudos teóricos e empíricos relataram maior precisão de localização de fonte com EMSI do que qualquer uma das modalidades isoladamente 13,30,31,37,38,39,40,41. Usando diferentes abordagens de localização de fontes para reconstruir a atividade em resposta a estímulos sensoriais, Sharon et al.37 descobriram que o EMSI teve resultados de localização consistentemente melhores do que o ESI ou o MSI sozinho em comparação com a ressonância magnética funcional (fMRI), que serve como referência não invasiva de precisão de localização precisa. Os autores sugeriram que essa localização melhorada se deve ao aumento do número de sensores para resolver a solução inversa e aos diferentes padrões de sensibilidade das duas modalidades de imagem37. Da mesma forma, Yoshinaga et al.31 realizaram análise dipolo em dados simultâneos de EEG e MEG de pacientes com epilepsia relacionada à localização intratável e mostraram que o EMSI forneceu informações que não seriam obtidas usando apenas uma modalidade isoladamente e levou a uma localização bem-sucedida para cirurgia de epilepsia em um dos pacientes analisados. Em um estudo prospectivo cego, Duez et al.13 mostraram que o EMSI alcançou uma razão de chances significativamente maior (ou seja, probabilidade de se tornar livre de convulsões) em comparação com ESI e MSI, uma precisão de localização ≥52% e uma concordância ≥53% e ≥36% com o irritativo e SOZ, respectivamente. Um estudo mais recente do nosso grupo42 mostrou que o EMSI forneceu estimativas de localização superiores e melhor desempenho de previsão de resultados do que ESI ou MSI sozinhos, com erros de localização de ressecção e SOZ de ~ 8 mm e ~ 15 mm, respectivamente. Apesar desses achados promissores, há uma carência de estudos que forneçam a estrutura metodológica sobre EMSI em crianças com DRE.
Este estudo ilustra a configuração experimental para a realização simultânea de gravações de MEG e HD-EEG, bem como a estrutura metodológica para analisar esses dados com o objetivo de localizar a zona irritativa, SOZ e áreas cerebrais eloquentes em crianças com DRE. Mais especificamente, as configurações experimentais são apresentadas para (i) registrar e localizar a atividade epileptiforme interictal e ictal durante o sono e (ii) registrar respostas evocadas visuais, motoras, auditivas e somatossensoriais e mapear áreas cerebrais eloquentes relevantes (ou seja, visual, motora, auditiva e somatossensorial) durante uma tarefa visuomotora, bem como estímulos auditivos e somatossensoriais. As etapas detalhadas do pipeline de análise de dados são apresentadas para realizar EMSI, bem como ESI e MSI individuais usando dipolo de corrente equivalente (ECD) e mapeamento paramétrico estatístico dinâmico (dSPM).
Protocolo
Os procedimentos experimentais aplicados aqui foram aprovados pelo Conselho de Revisão Institucional Regional do Norte do Texas (2019-166; Investigador principal: Christos Papadelis). A seção a seguir descreverá o protocolo experimental para a localização de fontes não invasivas de IEDs, inícios ictais e respostas evocadas por eventos (ou seja, visuais, motoras, auditivas e somatossensoriais) usando gravações simultâneas de MEG e HD-EEG acompanhadas em nosso laboratório. A Federação Internacional de Neurofisiologia Clínica43 e a American Clinical MEGSociety 44 forneceram "padrões mínimos" para o registro clínico de rotina e análise de dados espontâneos de MEG e EEG. Os procedimentos para gravações de HD-EEG descritos aqui aplicam-se apenas a sistemas de eletrodos de EEG baseados em esponja. O processo geral de preparação para cada assunto é de cerca de 2-3 h, compreendendo as gravações reais de ~ 1,5 h.
1. Preparação do sistema MEG
- Antes da chegada do sujeito, execute uma gravação MEG em sala vazia de alguns minutos para capturar os níveis de ruído de fundo e artefatos magnéticos e verifique se todos os sensores MEG estão funcionando corretamente.
- Usando o programa de ajuste de sensores MEG, certifique-se de que o valor médio de ruído branco de todos os sensores MEG esteja entre 2 e 5 fT/√Hz (fT/cm√Hz para gradiômetros).
2. Preparação do assunto
- Certifique-se de que o assunto esteja confortável com o ambiente. No caso de crianças pequenas, permita que elas explorem a sala de gravação (incluindo a sala blindada magneticamente [MSR]) e vejam o equipamento de teste que será usado para aquisição de dados.
- Analise e forneça as instruções do sujeito usando o formulário de consentimento de triagem. Se necessário, explique o procedimento para crianças pequenas usando palavras, brinquedos e jogos especiais desenvolvidos para cada faixa etária. Pergunte ao sujeito (ou aos pais do sujeito) se ele teve uma convulsão nas últimas ~ 2 horas antes da visita.
NOTA: O formulário de consentimento de triagem inclui uma descrição do teste, bem como sua segurança, por que o teste é realizado e uma descrição geral do estudo.
- Analise e forneça as instruções do sujeito usando o formulário de consentimento de triagem. Se necessário, explique o procedimento para crianças pequenas usando palavras, brinquedos e jogos especiais desenvolvidos para cada faixa etária. Pergunte ao sujeito (ou aos pais do sujeito) se ele teve uma convulsão nas últimas ~ 2 horas antes da visita.
- Remova quaisquer materiais metálicos e/ou magnéticos do sujeito e forneça ao sujeito roupas apropriadas fornecidas pelo hospital (por exemplo, aventais hospitalares, jalecos). Além disso, peça ao sujeito para remover os sapatos para evitar que poeira magnética entre no MSR. Se outros elementos ferromagnéticos, como obras odontológicas ou dispositivos médicos implantados, não puderem ser removidos, use um desmagnetizador (ou seja, desmagnetizador) para remover artefatos magnéticos residuais que podem causar interferências ou altos níveis de ruído durante as gravações de MEG. Depois de se certificar de que todas as fontes de ruído magnético foram removidas, peça ao sujeito que se sente e se acomode em uma cadeira de madeira onde os próximos procedimentos de medição serão aplicados.
NOTA: O desmagnetizador não deve ser aplicado diretamente em nenhum dispositivo eletrônico implantado (por exemplo, marca-passos, dispositivos de neuromodulação). - Meça a circunferência da cabeça do sujeito para selecionar o tamanho apropriado da rede de EEG (geralmente 32-34 cm até 58-61 cm). Usando o lado centimétrico da fita métrica, meça a circunferência da cabeça segurando a fita do násio do sujeito até ~ 1 cm acima do ínion e depois de volta ao násio.
NOTA: O násio é o ponto craniométrico entre os olhos, enquanto o íon é a ponta da protuberância occipital externa.- Selecione o tamanho de rede correto que se ajuste à circunferência da cabeça do sujeito e mergulhe-o por pelo menos 5 min (máximo de 10 min) em uma solução líquida mista composta de 1 qt de água morna da torneira, 1 colher de sopa de eletrólitos (ou seja, cloreto de potássio) e 1 colher de sopa de xampu para bebês. Durante este processo de imersão, certifique-se de que a rede esteja virada do avesso com as esponjas voltadas para fora e os fechos totalmente soltos para mergulhar totalmente os sensores dentro do balde plástico que contém a solução.
NOTA: Para garantir que o amplificador da rede não se aproxime da solução e permaneça sempre seco, enrole uma toalha ao redor do plugue da rede selecionada e, se preferir, coloque-a em uma cadeira ou suporte próximo à pia onde está o balde de plástico.
- Selecione o tamanho de rede correto que se ajuste à circunferência da cabeça do sujeito e mergulhe-o por pelo menos 5 min (máximo de 10 min) em uma solução líquida mista composta de 1 qt de água morna da torneira, 1 colher de sopa de eletrólitos (ou seja, cloreto de potássio) e 1 colher de sopa de xampu para bebês. Durante este processo de imersão, certifique-se de que a rede esteja virada do avesso com as esponjas voltadas para fora e os fechos totalmente soltos para mergulhar totalmente os sensores dentro do balde plástico que contém a solução.
- Coloque cinco bobinas magnéticas servidas como bobinas indicadoras de posição da cabeça (HPI) em locais conhecidos diretamente no couro cabeludo do sujeito usando fita de papel micropore: uma de cada lado da testa perto da linha do cabelo, uma em cada osso mastóide e uma no topo da cabeça.
NOTA: As bobinas HPI definem a posição do cabeçote em relação aos dispositivos de interferência quântica supercondutores (SQUIDs) colocados dentro do sistema MEG, emitindo campos magnéticos conhecidos que podem ser localizados durante a varredura. O número de bobinas HPI depende do sistema MEG, mas geralmente varia de 3 a 5 bobinas HPI. - Coloque eletrodos adicionais usando fita adesiva para medir a frequência cardíaca (eletrocardiografia, ECG), movimentos oculares ou piscadas (eletrooculografia, EOG) e atividade muscular (eletromiografia, EMG); A colocação desses eletrodos também permite o monitoramento do estado de saúde do sujeito.
- Coloque dois eletrodos de ECG no lado direito e esquerdo do tórax, abaixo das clavículas, respectivamente, para registrar os batimentos cardíacos do sujeito, e dois eletrodos EOG no lado superior e inferior do olho direito, respectivamente, para registrar seus movimentos oculares verticais ou piscadas.
- Para medir a atividade muscular durante a tarefa visuomotora, além disso, limpe os dedos do sujeito com compressas com álcool para melhor aderência da fita na pele e prenda um total de dois pares de eletrodos de copo não descartáveis em cada mão: um no primeiro interósseo dorsal (FDI) e outro no abdutor curto do polegar (APB).
- Antes de colar todos esses eletrodos, coloque a pasta condutora dentro do copo do eletrodo até que esteja ligeiramente cheio demais para reduzir a impedância da pele e garantir uma mistura ideal de adesividade e condutividade.
- Para estimulação tátil, prenda membranas elásticas finas diretamente nas partes distais e volares de três dedos (ou seja, polegar [D1], dedo médio [D3] e mindinho [D5]) de ambas as mãos. Encha as membranas com pulsos de ar comprimido através de tubos de plástico rígido usando um dispositivo de estimulação de sopro de ar. Libere os pulsos de ar comprimido com um intervalo entre estímulos de 1,5 ± 0,5 s seguindo uma ordem pseudoaleatória. Ajuste a pressão do estimulador tátil para 50 psi.
- Coloque dois eletrodos de ECG no lado direito e esquerdo do tórax, abaixo das clavículas, respectivamente, para registrar os batimentos cardíacos do sujeito, e dois eletrodos EOG no lado superior e inferior do olho direito, respectivamente, para registrar seus movimentos oculares verticais ou piscadas.
- Enquanto o sujeito ainda está sentado na cadeira de madeira distante de qualquer objeto metálico, determine as posições tridimensionais (3D) dos marcos anatômicos fiduciais, cinco bobinas HPI e outros pontos de formato de cabeça usando um digitalizador. Durante esse processo de digitalização da cabeça, peça ao sujeito para se sentar confortavelmente, olhar para a frente e permanecer praticamente imóvel, pois pequenos movimentos podem afetar a precisão da localização.
- Coloque o receptor de referência através dos óculos de plástico (ou seja, óculos com o cubo de referência preso de um lado) na cabeça do sujeito e ajuste os fechos para garantir uma armação de referência fixa para o assunto que deve permanecer relativamente imóvel durante toda a medição.
- Através do receptor primário da caneta, localize os pontos anatômicos fiduciais (ou seja, násio e pontos pré-auriculares esquerdo/direito) e a posição das bobinas HPI, e faça uma amostragem uniforme de pontos adicionais do couro cabeludo (pelo menos 100, de preferência perto de ~ 500) para melhorar uma reconstrução de alta qualidade da superfície da cabeça.
NOTA: Os marcos anatômicos fiduciais definem o sistema de coordenadas do sujeito. O digitalizador gera as coordenadas de um sensor no espaço 3D usando um transmissor (normalmente montado atrás do assunto no encosto da cadeira de madeira) e dois receptores (ou seja, a caneta e os receptores de referência). - Após a conclusão da digitalização, coloque o receptor da caneta a ~15 cm de distância do assunto e do transmissor e digitalize um ponto aleatório para finalizar o processo de digitalização.
NOTA: Esta etapa final do processo de digitalização pode ser diferente de outros produtos comerciais.
- Antes de aplicar a rede de EEG, peça ao sujeito para sentar em uma cadeira próxima ao amplificador de EEG e colocar toalhas no peito e nos ombros para absorver eventuais gotejamentos devido à aplicação da rede. Remova a rede de EEG do balde de plástico, vire-a com as esponjas voltadas para dentro e enrole-a suavemente em uma toalha para absorver a solução misturada em excesso.
- Com o sujeito sentado na cadeira e instruído a manter os olhos fechados durante esta etapa, coloque as duas mãos dentro da rede e espalhe-a com os dedos e, finalmente, coloque-a na cabeça do sujeito.
- Sem mover as posições das bobinas HPI, ajuste a rede esticada na cabeça do sujeito usando os dedos para garantir que os canais de referência e de násio estejam posicionados corretamente no centro do couro cabeludo e entre os olhos do sujeito, respectivamente, e finalmente prenda a tira do queixo quando a rede estiver na posição correta.
- Usando um medidor de impedância de EEG, certifique-se de que todas as impedâncias do eletrodo do couro cabeludo estejam na faixa de 0-50 kΩ (valores ˂5 kΩ são recomendados) para evitar distorções de sinal. Para reduzir as impedâncias do eletrodo do couro cabeludo, verifique se cada eletrodo tem um bom contato mecânico e elétrico com o couro cabeludo usando um cotonete de madeira para remover os pelos do sujeito entre o eletrodo e o couro cabeludo ou uma pipeta de plástico descartável para transferir uma solução misturada mais condutora para as esponjas dos eletrodos, se necessário.
- Quando todas as impedâncias estiverem idealmente de até 50 kΩ, desconecte o amplificador e prepare o assunto para a digitalização do eletrodo EEG.
NOTA: Execute a digitalização do eletrodo EEG fora do MSR e garanta espaço suficiente ao redor do assunto para gerenciar o processo de digitalização.
- Quando todas as impedâncias estiverem idealmente de até 50 kΩ, desconecte o amplificador e prepare o assunto para a digitalização do eletrodo EEG.
- Determine as posições 3D dos eletrodos de EEG usando um scanner óptico portátil. Durante esse processo, peça ao sujeito que se sente confortavelmente e olhe para a frente, a menos que seja instruído de outra forma.
- Em primeiro lugar, abra o software do scanner óptico, selecione o modelo do sensor que corresponde ao layout do sensor EEG usado durante as gravações e, em seguida, inicie o processo de digitalização.
- Durante a digitalização, segure o scanner a uma certa distância da rede de EEG (geralmente ~ 45 cm), com suas aberturas de varredura perpendiculares à superfície dos sensores, e mova-o lentamente ao redor da cabeça do sujeito seguindo faixas arqueadas de cima (centro da cabeça) para baixo (últimos sensores ao longo do pescoço) para registrar as localizações físicas de todos os sensores.
NOTA: O scanner óptico digitaliza os locais dos eletrodos de EEG na cabeça do sujeito e os transforma em um arquivo de coordenadas 3D; geralmente é caracterizado por dois sensores ópticos que emitem fontes de luz infravermelha (IR). Cada local digitalizado geralmente aparece em uma nuvem de sensor 3D. A nuvem de sensores 3D fornece feedback para a digitalização, sondagem e alinhamento das posições do sensor, enquanto o mapa do sensor 2D fornece feedback para a rotulagem dessas posições do sensor. O processo de varredura das posições dos eletrodos de EEG requer um total de 5 a 10 minutos, incluindo a sondagem dos pontos fiduciais. No entanto, o tempo de varredura às vezes pode depender do desempenho do scanner óptico na detecção das posições dos eletrodos.
- Uma vez que todos os eletrodos de EEG tenham sido escaneados (pelo menos 95%), sonde os pontos fiduciais (ou seja, násio e pontos pré-auriculares esquerdo/direito) e quatro sensores de alinhamento (ou seja, nós de alinhamento frontal, esquerdo e direito e nó REF) usando a sonda óptica sem fio para alinhar a nuvem de sensores 3D ao modelo de sensor selecionado.
NOTA: Os sensores de alinhamento são numerados com base na configuração da rede do sensor EEG.- Para sondar os pontos fiduciais, coloque a ponta da sonda óptica na pele do sujeito no centro do ponto de interesse fiducial, certificando-se de que as aberturas de varredura do scanner apontem para os discos reflexivos da sonda. Da mesma forma, coloque a ponta da sonda óptica no centro do sensor de alinhamento de interesse para sondar os sensores de alinhamento.
- Depois que todos os sensores forem escaneados e sondados, revise suas posições e rótulos na nuvem do sensor 3D e no mapa do sensor 2D em relação à rede de EEG real para verificar e, eventualmente, corrigir possíveis erros; se não ocorrerem erros durante o processo de digitalização, exporte o ficheiro de coordenadas 3D .txt e converta-o para o formato preferido.
NOTA: As coordenadas do eletrodo 3D geralmente são armazenadas em formato .txt e podem ser convertidas por meio de software de scanner óptico em vários formatos (por exemplo, .xml, .sfp, .elp ou .nsi). - Após a conclusão do processo de digitalização do eletrodo EEG (etapas 2.9-2.11), prepare o sujeito a ser transferido para dentro do MSR para realizar dados de repouso/sono (etapa 2.13), tarefa visuomotora (etapa 2.14), estimulação auditiva (etapa 2.15) e estimulação somatossensorial (etapa 2.16).
- Para os dados de repouso/sono, coloque o pórtico do sistema MEG na posição supina (Figura 1A) e organize a cama não magnética e compatível de forma que o apoio de cabeça removível fique alinhado com a abertura em forma de capacete na parte inferior do dewar. Depois de ajustar a cama para a posição correta, coloque a válvula de freio da cama na posição desligada. Coloque um lençol ou cobertor sobre a cama e um pequeno travesseiro de espuma no encosto de cabeça removível para fixação da cabeça e conforto durante a gravação.
NOTA: O dewar é um recipiente de armazenamento criogênico cheio de hélio líquido no qual as matrizes de sensores são dispostas espacialmente na parte inferior por meio de uma abertura em forma de capacete projetada para envolver a cabeça do sujeito. O capacete se encaixa em até 59-61 cm de circunferência da cabeça. O pórtico é o sistema mecânico que suporta o dewar que permite modificar sua elevação e ângulo com base na posição de medição (ou seja, sentado ou supino).- Transfira o sujeito para dentro do MSR e ajude-o a sentar na beira da cama e deitar-se nela. Coloque vários cobertores sobre o corpo do sujeito para mantê-lo aquecido durante a gravação, garantindo que os cabos dos eletrodos sejam facilmente acessíveis, e aperte levemente os cintos de segurança (ou puxe as grades, se houver), explicando ao sujeito que esta etapa é para evitar que ele role para fora da cama enquanto dorme. Se necessário, coloque uma toalha enrolada adicional sob o pescoço para fornecer suporte para o pescoço e os ombros do sujeito.
- Destrave a válvula de freio da cama para mover suavemente a cabeça do sujeito, que é colocada no encosto de cabeça removível sob a abertura em forma de capacete do dewar até tocar o interior do capacete. Para aumentar a relação sinal-ruído (SNR), aproxime a cabeça do sujeito o mais próximo possível do capacete.
- Conecte as bobinas HPI, eletrodos de ECG e EOG nos painéis correspondentes do sistema MEG, conecte a rede de EEG à unidade amplificadora dentro do MSR e verifique as medições das coordenadas da cabeça da estação de trabalho de aquisição fora do MSR para avaliar se a cabeça do sujeito está posicionada corretamente sob o dewar.
- Com o consentimento do sujeito, reduza a intensidade da luz dentro do MSR para ajudar a estimular o relaxamento e o sono. Quando o sujeito se sentir relaxado e confortável, instrua-o a descansar com os olhos fechados ou dormir durante a gravação. Tranquilize o sujeito de que ele será observado no monitor fora do MSR por meio da câmera colorida blindada por radiofrequência montada na parede do MSR durante toda a gravação.
- Para a tarefa visuomotora, coloque o pórtico do sistema MEG na posição vertical (Figura 1B) e disponha a cadeira MEG de forma que a cabeça do sujeito fique sob o pórtico, perto da abertura em forma de capacete na parte inferior do dewar. Depois de ajustar a cadeira para a posição correta, coloque a válvula de freio da cadeira na posição destravada ("0").
- Transfira o assunto para dentro do MSR. Ajude-o a sentar-se na cadeira não magnética e compatível e a encontrar uma posição confortável e relaxada. Coloque vários cobertores no corpo do sujeito para mantê-lo aquecido durante a gravação, garantindo que os cabos dos eletrodos sejam facilmente acessíveis, e coloque a mesa removível para que o sujeito possa colocar as mãos sobre ela durante a tarefa. Se necessário, coloque uma toalha sob os joelhos do sujeito para ajudar a manter a posição sentada e não deslize para baixo.
NOTA: Como o sujeito pode relaxar durante a tarefa visuomotora e, portanto, assumir uma posição mais baixa do que a inicial, levante cuidadosamente a cadeira no final de cada sessão de tarefa através do pedal de elevação (se houver) ou coloque toalhas ou cobertores na cadeira para que a cabeça do sujeito toque o interior do capacete novamente. Se necessário, coloque toalhas ou cobertores adicionais atrás da cabeça do sujeito, não apenas para melhor conforto, mas também para ajudar o sujeito a manter a cabeça o mais reta possível. A estimulação visuomotora pode ser realizada alternadamente em decúbito dorsal para evitar mover o dewar no meio de uma sessão de gravação. - Quando o sujeito estiver na posição correta, conecte as bobinas HPI, ECG, EOG, FDI e eletrodos APB no painel direito da máquina MEG, conecte a rede de EEG ao amplificador dentro do MSR e levante a cadeira através do pedal de elevação (se houver) com pequenos movimentos ou coloque toalhas ou cobertores adicionais na cadeira até que a cabeça do sujeito toque levemente o interior do capacete (verifique as medidas do coordenadas da estação de trabalho de aquisição fora do MSR).
- Coloque a tela de projeção, na qual os estímulos visuais serão projetados por meio de um sistema de espelho projetor posicionado fora do MSR, na frente do sujeito (Figura 1B), e explique a tarefa visuomotora a ser realizada durante a gravação. Particularmente, instrua o sujeito a tocar o dedo indicador na mesa somente quando o estímulo visual (por exemplo, uma imagem) aparecer na tela, respectivamente, para a mão direita e esquerda. Certifique-se de que o sujeito entenda a tarefa ou se sinta confortável em realizá-la sozinho; Se necessário, pratique a tarefa junto com o sujeito várias vezes para ajudá-lo a se familiarizar com ela.
NOTA: Se uma sessão de estimulação visuomotora for realizada em decúbito dorsal, um espelho é colocado a uma distância acima do rosto do sujeito para refletir os estímulos visuais do projetor. - Antes de fechar a porta do MSR, pergunte ao sujeito se ele se sente confortável em ficar sozinho dentro da sala; caso não o faça, uma pessoa da equipe ou seus pais permanecerão dentro do MSR durante as sessões de gravação. Além disso, tranquilize o sujeito de que ele será observado no monitor fora do MSR durante toda a gravação.
- Transfira o assunto para dentro do MSR. Ajude-o a sentar-se na cadeira não magnética e compatível e a encontrar uma posição confortável e relaxada. Coloque vários cobertores no corpo do sujeito para mantê-lo aquecido durante a gravação, garantindo que os cabos dos eletrodos sejam facilmente acessíveis, e coloque a mesa removível para que o sujeito possa colocar as mãos sobre ela durante a tarefa. Se necessário, coloque uma toalha sob os joelhos do sujeito para ajudar a manter a posição sentada e não deslize para baixo.
- Para a estimulação auditiva, use a configuração descrita na etapa 2.14 com a tela de projeção na frente do sujeito sentado. Ajude o sujeito a usar os fones de ouvido (ou fones de ouvido) através dos quais os gatilhos de som (por exemplo, sons de chirp modulados) são entregues.
- Instrua o sujeito a fixar os estímulos (por exemplo, ponto verde em um fundo preto) projetados na tela enquanto ouve os gatilhos sonoros. Se necessário, realize uma sessão de treinamento para ajudar o sujeito a entender melhor o procedimento. Antes de fechar a porta do MSR, repita os procedimentos de segurança conforme descrito anteriormente.
- Para a estimulação somatossensorial, use a configuração descrita na etapa 2.14. Pergunte ao sujeito qual vídeo (ou filme) ele deseja assistir na tela do projetor à sua frente.
- Instrua o sujeito a relaxar com os olhos abertos, assistir ao vídeo selecionado, ficar o mais imóvel possível e ignorar os estímulos táteis entregues aos dedos durante a gravação. Explique ao sujeito que ele sentirá toques suaves na pele na ponta dos dedos, respectivamente, para cada mão. Se o sujeito se sentir desconfortável, faça uma sessão de treinamento para tranquilizá-lo.
NOTA: A fixação ocular em um alvo visual é uma técnica bem estabelecida para minimizar artefatos biológicos que podem afetar a qualidade da gravação e distrair o sujeito dos estímulos táteis fornecidos durante a aquisição de dados.
- Instrua o sujeito a relaxar com os olhos abertos, assistir ao vídeo selecionado, ficar o mais imóvel possível e ignorar os estímulos táteis entregues aos dedos durante a gravação. Explique ao sujeito que ele sentirá toques suaves na pele na ponta dos dedos, respectivamente, para cada mão. Se o sujeito se sentir desconfortável, faça uma sessão de treinamento para tranquilizá-lo.
3. Aquisição de dados
NOTA: A aquisição de dados simultâneos de MEG e EEG é realizada nas instalações de MEG do Cook Children's Medical Center (CCMC). Mais detalhes sobre o uso clínico do MEG em crianças pediátricas com epilepsia podem ser encontrados em outro lugar 8,27,45.
- Registre sinais MEG usando o sistema MEG de cabeça inteira (cobertura do sensor: 1.220 cm2) caracterizado por 306 canais agrupados em 102 elementos idênticos de sensor triplo com um magnetômetro e dois gradiômetros planares ortogonais. Defina uma frequência de amostragem de pelo menos 1 kHz.
NOTA: Os magnetômetros de bobina única medem o componente do campo magnético perpendicular à superfície do capacete MEG. Os gradiômetros planares consistem em uma configuração de bobina em "forma de oito" caracterizada por pares de magnetômetros colocados a uma pequena distância entre si e medem a diferença no campo magnético entre suas localizações (ou seja, a diferença entre os dois loops de "oito"), também chamado de gradiente espacial. Em comparação com os magnetômetros, os gradiômetros planares são menos sensíveis a fontes cerebrais profundas, mas mais robustos na detecção de fontes superficiais suprimindo o ruído ambiental. Esses 306 canais são imersos e resfriados em hélio líquido a -296 ° C (4,2 K) para se tornarem supercondutores. - Grave sinais de EEG simultaneamente usando a rede de EEG não magnética de 256 canais com sensores de eletrodo Ag/AgCl uniformemente espaçados sobre o couro cabeludo, bochechas e nuca. Defina uma frequência de amostragem de pelo menos 1 kHz.
- Feche a porta do MSR para começar a gravar. Através do sistema de intercomunicação por voz, comunique-se com o sujeito, verificando se ele se sente confortável em ficar sozinho dentro do MSR. Monitore constantemente o assunto em vídeo e, em caso de emergência, entre imediatamente no MSR.
NOTA: Caso não se sinta confortável ou a enorme porta do MSR o esteja intimidando, uma pessoa da equipe ou seus pais podem permanecer dentro do MSR durante as sessões de gravação sentados em uma cadeira de madeira perto do sujeito; Certifique-se de que todos os objetos metálicos sejam removidos antes de entrar na sala. - Antes de cada gravação, instrua o sujeito através do sistema de intercomunicação de voz a manter sua posição imóvel por ~30 s antes de iniciar a tarefa. Para a tarefa visuomotora, comunique adicionalmente através do interfone qual dedo indicador (direito ou esquerdo) ele usará para a primeira sessão de gravação.
- Durante este período em que o sujeito permanece imóvel, pressione o botão de medição na caixa de diálogo de medição HPI no sistema de aquisição de dados MEG para medir o campo magnético gerado pela corrente alimentada nas bobinas HPI e determinar as posições de medição da cabeça em relação à matriz do sensor MEG; portanto, confirme se o assunto está bem posicionado (cabeça |coordenada z| ˂ 75 mm) e anote as medições 3D para cada sessão.
- Se ainda houver espaço entre a cabeça do sujeito e o capacete, entre novamente dentro do MSR e ajuste a altura da cadeira através do pedal de elevação (se houver), coloque toalhas ou cobertores na cadeira ou instrua o sujeito através do interfone sobre como mudar a cabeça em uma posição mais próxima do capacete (se o sujeito estiver sentado), e, finalmente, verifique novamente as posições de medição da cabeça. Em caso de gravações em repouso/sono, entre novamente no MSR e aproxime a cama do capacete, reduzindo a distância espacial cabeça-capacete.
- Assim que o sujeito estiver bem posicionado em relação ao capacete MEG e pronto para começar, inicie a primeira sessão de gravação (duração ~ 10 min) seguindo uma ordem precisa (consulte a etapa 3.5.1) para sincronização precisa de MEG e EEG (consulte a etapa 3.12).
NOTA: Para garantir gravações de alta qualidade, a primeira sessão de gravação é fundamental para capturar artefatos presentes nos dados devido a movimentos do sujeito ou causados pelo ambiente externo. Se necessário, entre novamente no MSR para ajustar eventuais conexões de canal ou a posição do sujeito na cadeira MEG. Recomenda-se fazer anotações de quaisquer artefatos ou eventos incomuns durante as gravações que podem ser revisados posteriormente, se necessário.- Pressione o botão de gravação no software de aquisição de dados EEG para iniciar a gravação do EEG. Pressione o botão de gravação no software de aquisição de dados MEG para iniciar a gravação MEG. Por fim, pressione o botão Iniciar do software do computador de estimulação para exibir estímulos visuais ou fornecer estímulos auditivos.
NOTA: O computador de estimulação que executa o software de estímulo visual (ou auditivo) está conectado ao sistema de espelho do projetor fora do MSR, que pode ser ligado ou desligado dependendo do tipo de gravação realizada. Durante as gravações de repouso/sono, o sistema é desligado, pois o sujeito está descansando ou dormindo, mas a execução do software de estímulo visual no computador de estimulação ajuda a cronometrar cada sessão de gravação. Durante a tarefa visuomotora, bem como durante as estimulações auditivas e somatossensoriais, o sistema é ligado permitindo que o sujeito observe os estímulos ou um vídeo projetado na tela colocada à sua frente enquanto o software está em execução. Para este estudo, foi selecionado um total de (i) 107 estímulos (ou seja, 85 imagens sobrepostas a um fundo quadriculado e 22 fundos quadriculados) com um intervalo de ~4 s entre cada estímulo para a tarefa visuomotora; (ii) 200 sons de chirp modulados com intervalo interestímulo de 3 s para a estimulação auditiva; e (iii) 200 estímulos táteis para cada dedo (ou seja, D1, D3 e D5) seguindo uma sequência semi-aleatória com um intervalo interestímulo de ~ 1,5 s para a estimulação somatossensorial.
- Pressione o botão de gravação no software de aquisição de dados EEG para iniciar a gravação do EEG. Pressione o botão de gravação no software de aquisição de dados MEG para iniciar a gravação MEG. Por fim, pressione o botão Iniciar do software do computador de estimulação para exibir estímulos visuais ou fornecer estímulos auditivos.
- Para interromper as gravações, pressione o botão de parada no software de aquisição de dados MEG e, em seguida, o botão de parada no software de aquisição de dados EEG. No final de cada sessão de gravação, comunique-se com o sujeito através do interfone para tranquilizá-lo e, se não forem necessárias conexões de canal ou ajustes de posição dentro do MSR, prossiga com a próxima sessão.
- Para a tarefa visuomotora, selecione diferentes estímulos visuais para cada sessão para manter o sujeito motivado e entretido durante a gravação.
- Para dados visuomotores ou de repouso/sono, registre um total de ~ 1 h de gravação simultânea de MEG e EEG, caracterizada por 5-6 sessões. No entanto, o número de sessões pode variar para cada disciplina. Além disso, registre um total de ~ 20 min (1-2 sessões de ~ 10 min cada) e ~ 14 min (1-2 sessões de ~ 7 min cada) de gravação simultânea de MEG e EEG para os dados de estimulação auditiva e somatossensorial, respectivamente.
NOTA: Neste estudo, os dados MEG e EEG são armazenados automaticamente no final das gravações nos formatos .fif e .mff, respectivamente, no sistema de armazenamento de TI da CCMC. - Quando a gravação terminar, digite o MSR para ajudar o sujeito a se levantar da cadeira ou da cama e peça-lhe para se sentar em uma cadeira fora do MSR para remover a rede de EEG e os eletrodos.
- Instrua o sujeito a fechar os olhos até que seja dito o contrário e ajude-o a remover a rede de EEG afrouxando totalmente as tiras do queixo e puxando suavemente a rede com as duas mãos (da testa para a parte de trás da cabeça do sujeito) até que esteja completamente removida. Durante esta etapa, certifique-se de não puxar o cabelo do sujeito ao remover a rede. Além disso, ajude o sujeito a remover suavemente os eletrodos restantes (ou seja, ECG, EOG e EMG em caso de tarefa visuomotora) previamente colados em sua pele.
- Após a remoção da rede de EEG e dos eletrodos, informe ao sujeito (e seus pais) que todos os procedimentos foram finalmente concluídos.
- Depois que o assunto sair da sala, limpe cuidadosamente o scanner óptico (conforme descrito no manual do usuário) e guarde-o dentro de seu estojo protetor.
- Limpe e desinfete as superfícies de qualquer equipamento usado durante as gravações (por exemplo, cadeiras, camas, mesas) com lenços de peróxido de hidrogênio aprovados pelo hospital ou spray desinfetante e toalhas de papel, coloque os cobertores e toalhas usados dentro do recipiente fornecido pelo hospital e jogue fora qualquer pedaço de fita adesiva usada.
- Guarde as ferramentas de medição dentro do armário de armazenamento e limpe o interior dos copos dos eletrodos cheios de pasta condutora usando cotonetes de madeira em água corrente da torneira.
- Para enxaguar a rede de EEG, encha o balde de plástico na pia com água limpa e morna da torneira e repita as etapas a seguir por um total de quatro vezes.
- Mergulhe a rede de EEG na água e agite suavemente a rede de EEG por 10-20 s (ou mergulhe-a dentro e fora do balde ~ 25 vezes).
- Escorra a água do balde e encha-o novamente com água da torneira limpa e morna.
- Para desinfetar a rede de EEG, encha o balde de plástico na pia com a solução desinfetante composta por 2 qt de água morna da torneira e 1 colher de sopa de desinfetante e mergulhe a rede de EEG dentro dela por 10 min. Enxágue o balde da solução desinfetante e siga o processo de enxágue e drenagem três vezes para remover qualquer solução residual da rede de EEG.
- Para o processo de enxágue ou desinfecção, remova a rede de EEG imersa do balde, seque-a removendo o excesso de água com a ajuda de uma toalha limpa e seca e guarde-a pendurando-a perto da pia.
- Para suprimir interferências magnéticas internas e externas e artefatos de medição/movimento dos dados MEG, aplique a extensão temporal do método de separação do espaço de sinal (tSSS) ao arquivo .fif MEG de dados brutos.
NOTA: A filtragem Maxwell espaço-temporal (tSSS) é ideal para suprimir fontes de interferência localizadas dentro ou muito próximas da matriz de sensores MEG, ou seja, interferência interna. - Ao realizar gravações simultâneas de MEG e EEG, alinhe espacialmente os sistemas de coordenadas dos dois dispositivos de aquisição em relação aos pontos de referência anatômicos na cabeça do sujeito (Figura 2A) e corrija o desvio linear do relógio entre os sinais que ocorre devido às possíveis diferentes taxas de amostragem (Figura 2B).
NOTA: Durante as gravações, os sinais MEG e EEG também podem ser afetados por mudanças lentas ao longo do tempo devido a possíveis atrasos no pressionamento dos botões Iniciar e Fim e a um desvio interno do relógio que ocorre quando os gatilhos são enviados para o software de aquisição de dados MEG e EEG. Para garantir a sincronização precisa entre esses sinais, foi desenvolvido um código interno em Python que utiliza os eventos de disparo enviados em ambos os sistemas durante a aquisição de dados como sinal de disparo comum. O código inclui três funções disponíveis na biblioteca de software MNE-Python: duas funções que leem os sinais MEG e EEG e uma função que extrai informações dos eventos de disparo dos sinais, como nomes de canais e carimbos de data/hora (ou seja, data e hora da ocorrência do evento). As diferenças de tempo entre a ocorrência de eventos de disparo em cada sinal (ou seja, delta) definem o desvio linear do relógio ao longo do tempo (Figura 2B). Uma descrição detalhada do código desenvolvido é fornecida nas próximas etapas (consulte 3.12.1-3.12.4).- Use a diferença entre o primeiro evento de disparo que ocorre em cada sinal como valor de deslocamento (ou seja, parte a ser cortada de um dos dois sinais) para alinhar as gravações.
NOTA: As funções mne.io.read_raw_fif e mne.io.read_raw_egi convertem as gravações MEG e EEG em um formato de matriz 2D, enquanto a função mne.find_events extrai informações de eventos dos sinais brutos. - Uma vez que esses primeiros gatilhos estejam alinhados, calcule o coeficiente de correlação de Pearson para avaliar o grau de correlação entre os sinais; Valores de p < 1 x 10-6 são recomendados para garantir um alinhamento perfeito.
NOTA: A função pearsonr da biblioteca scipy estima o coeficiente de correlação de Pearson entre os sinais MEG e EEG e o valor p dessa correlação. - Para validar essa precisão de correlação, estime a taxa de desvio entre os dois sinais realizando um ajuste polinomial de primeiro grau e use a extensão da disparidade resultante representada pelo coeficiente da função polinomial para reamostrar os sinais no eixo x do ajuste polinomial (Figura 2B).
NOTA: A função polyfit da biblioteca numpy se ajusta aos sinais MEG e EEG dentro de uma função polinomial; Essa função retorna um coeficiente que representa a extensão da disparidade entre os dois sinais. A função mne.resample reamostra os sinais MEG e EEG de acordo com o coeficiente da função polinomial. - Após a conclusão da reamostragem, compare os carimbos de data/hora do último evento de disparo que ocorre em cada sinal e remova as janelas de tempo que não são comuns nos sinais MEG e EEG. Por fim, mescle os sinais sincronizados de MEG e EEG para criar uma única gravação caracterizada por sensores MEG e EEG que podem ser usados para análise posterior.
NOTA: A função mne.add_channels mescla os dois sinais para criar uma única gravação.
- Use a diferença entre o primeiro evento de disparo que ocorre em cada sinal como valor de deslocamento (ou seja, parte a ser cortada de um dos dois sinais) para alinhar as gravações.
- No final de cada gravação de ~1,5 h, use um total de 5-6 (~10 min cada), 1-2 (~10 min cada) e 1-2 (~7 min cada) sessões de gravações sincronizadas de MEG e EEG, respectivamente para os dados de estimulação visuomotora (e repouso/sono), auditiva e somatossensorial, para a análise dos dados.
NOTA: Idealmente, o sujeito precisa realizar o toque com o dedo direito para três gravações visuomotoras e o toque com o dedo esquerdo para as três gravações visuomotoras restantes.
4. Análise dos dados
- Mapeamento da zona irritativa
- Gere as superfícies corticais 3D a partir da ressonância magnética do sujeito usando o processo de reconstrução cortical do FreeSurfer, que é uma ferramenta de neuroimagem de código aberto para processar, analisar e visualizar imagens de ressonância magnética do cérebro humano46.
- Importe a anatomia reconstruída no Brainstorm, que é um aplicativo de código aberto do MATLAB dedicado à visualização e processamento de dados MEG e EEG47, para visualizar os resultados da reconstrução cortical. Em Brainstorm, defina os pontos fiduciais (ou seja, násio, pré-auricular esquerdo/direito, comissura anterior/posterior e inter-hemisférico) na ressonância magnética importada que definem o sistema de coordenadas do sujeito.
- Importe o sinal simultâneo de MEG e HD-EEG no Brainstorm e registre os sensores MEG e EEG na ressonância magnética usando o processo de registro de ressonância magnética para ajustar seu alinhamento aos pontos fiduciais digitalizados. Se necessário, projete os sensores de EEG na superfície cortical.
- Abra a gravação simultânea de MEG e HD-EEG e inspecione visualmente os dados brutos para remover canais defeituosos. Além disso, aplique a técnica de correção de artefatos de projeção espaço-sinal (SSP) disponível no Brainstorm para rejeitar artefatos biológicos (por exemplo, batimentos cardíacos, piscar de olhos) das gravações.
- Aplique filtros de entalhe (50 ou 60 Hz, de acordo com a interferência da linha de energia) e passa-banda (1-70 Hz) aos dados simultâneos de MEG e HD-EEG.
- Selecione partes de dados contendo atividade interictal caracterizada por IEDs frequentes, como picos e ondas agudas, e com artefatos de movimento mínimos (se possível).
NOTA: Os IEDs são formas de onda transitórias caracterizadas por uma evolução temporal de <70 ms, amplitude de >50 μV e uma forma nítida que pode ser claramente distinguida da atividade de fundo na banda de frequência de 1-70 Hz48. A Figura 3A representa um exemplo de partes dos sinais simultâneos de MEG e HD-EEG com IEDs frequentes visíveis em ambas as gravações. - Usando a configuração de exibição padrão de 10 s por página, marque o pico negativo de cada IED que ocorre nos registros de MEG e EEG (Figura 3A), bem como em cada modalidade isoladamente. Antes de marcar cada IED, verifique o campo de topografia e os mapas potenciais para o MEG e EEG, respectivamente.
NOTA: As distribuições de tensão de pontos de tempo adicionais durante a fase ascendente de cada IED, em vez de seu pico, também devem ser verificadas para levar em conta a possível propagação da atividade epiléptica49. Mais detalhes sobre como marcar eventos de picos interictais usando o Brainstorm podem ser encontrados em outro lugar (https://neuroimage.usc.edu/brainstorm/Tutorials/Epilepsy). - Calcule um modelo realista de cabeça, definido como um modelo geométrico de três camadas (ou seja, couro cabeludo, crânio interno e crânio externo) (Figura 3B), usando o software OpenMEEG BEM (método de elemento de contorno simétrico) disponível no Brainstorm. Use o volume de ressonância magnética como espaço de origem (grade de ponto-fonte com resolução espacial de 5 mm).
NOTA: O software OpenMEEG BEM usa o método do elemento de contorno simétrico para calcular um modelo direto realista caracterizado pelo couro cabeludo (ou seja, interface ar-couro cabeludo), crânio externo (ou seja, interface couro cabeludo-crânio) e crânio interno (interface crânio-cérebro). Como solução alternativa, o método dos elementos finitos (MEF) pode ser usado para resolver o problema direto, uma vez que permite uma representação realista do condutor do volume da cabeça. Os valores de condutividade do tecido cefálico são frequentemente assumidos na literatura e podem variar dependendo da idade do sujeito50. Para resolver o modelo direto usando o FEM, calcule o modelo realista da cabeça, definido como um modelo geométrico de três a cinco camadas (ou seja, substância branca, substância cinzenta, líquido cefalorraquidiano, crânio e pele), usando o software DUNEuro FEM disponível no Brainstorm 47,50,51. Mais detalhes sobre a estimativa do modelo forward usando FEM podem ser encontrados em outro lugar (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Localize os geradores subjacentes dos picos interictais selecionados usando o método ECD irrestrito na matriz de sensores MEG, EEG e MEG e EEG combinados separadamente. Para localizar essas fontes de dipolo, calcule a covariância de ruído das gravações MEG de sala vazia ou defina-a como uma matriz de identidade.
NOTA: Considere realizar a localização da fonte em IEDs médios com distribuições de tensão semelhantes como uma abordagem alternativa caso o SNR dos IEDs seja baixo12. - Execute o método de varredura de dipolo disponível no Brainstorm no pico de cada IED previamente marcado para selecionar os dipolos de fonte mais significativos em todo o volume cerebral. Selecione apenas dipolos de fonte com uma qualidade de ajuste >60% e estime seu agrupamento definido para cada dipolo como o número de dipolos localizados a 15 mm de seu centro (Figura 3C).
NOTA: Mais detalhes sobre o agrupamento ECD podem ser encontrados em outro lugar52.
- Mapeamento da SOZ
- Gere as superfícies corticais 3D a partir da ressonância magnética do sujeito usando o processo de reconstrução cortical do FreeSurfer46.
- Importe a anatomia reconstruída no Brainstorm47 para visualizar os resultados da reconstrução cortical. Defina os pontos fiduciais na ressonância magnética importada que definem o sistema de coordenadas do sujeito.
- Importe o sinal simultâneo de MEG e HD-EEG (contendo o evento ictal) no Brainstorm e registre os sensores MEG e EEG na ressonância magnética usando o processo de registro de ressonância magnética para ajustar seu alinhamento aos pontos fiduciais digitalizados. Se necessário, projete os sensores de EEG na superfície cortical.
NOTA: Se o sujeito teve uma convulsão durante as gravações, revise as anotações feitas durante a gravação para avaliar em qual sessão o evento ictal foi gravado. - Abra a gravação simultânea de MEG e HD-EEG e inspecione visualmente os dados brutos para remover canais defeituosos. Aplique a técnica de correção de artefatos SSP disponível no Brainstorm47 para rejeitar artefatos biológicos (por exemplo, batimentos cardíacos, piscar de olhos) da gravação.
- Aplique filtros de entalhe (50 ou 60 Hz, de acordo com a interferência da linha de energia) e passa-banda (1-70 Hz) aos dados simultâneos de MEG e HD-EEG.
- De acordo com as notas de gravação, identifique o início da convulsão e seu término (se observado) e marque esses eventos no sinal para identificar a parte correta dos dados contendo descargas epileptiformes ictais. Exemplos de início de convulsão são exibidos na Figura 4 para MEG e HD-EEG, respectivamente.
NOTA: Quando um sujeito tem uma convulsão durante a aquisição do MEG, a equipe médica é obrigada a ajudá-lo imediatamente e fornecer atendimento de emergência. Assim, a duração dessas porções de dados com eventos ictais pode ser curta. - Usando a configuração de exibição padrão de 10 s por página, marque o pico negativo de cada explosão de descargas epileptiformes (por exemplo, picos repetitivos, ondas agudas ou complexos de ondas de pico) que ocorrem durante o evento ictal no MEG e EEG, bem como em cada modalidade isoladamente. Antes de cada marcação de pico, verifique o campo de topografia e os mapas de potencial para o MEG e EEG, respectivamente (Figura 4A).
NOTA: As convulsões são classificadas como generalizadas ou focais, dependendo de onde seu início começa. Embora dependente da síndrome epiléptica, uma convulsão é um fenômeno de pelo menos 10 s caracterizado por descargas elétricas repetitivas que podem variar em frequência, amplitude e morfologia. - Calcule o modelo de cabeça realista de três camadas (ou seja, couro cabeludo, crânio interno e crânio externo) para os sensores MEG e EEG usando o software OpenMEEG BEM disponível no Brainstorm. Use o volume de ressonância magnética como espaço de origem (grade de ponto-fonte com resolução espacial de 5 mm).
NOTA: Para resolver o modelo direto usando o FEM, calcule o modelo realista da cabeça, definido como um modelo geométrico de três a cinco camadas (ou seja, substância branca, substância cinzenta, líquido cefalorraquidiano, crânio e pele), usando o software DUNEuro FEM disponível no Brainstorm 47,50,51. Mais detalhes sobre a estimativa do modelo forward usando FEM podem ser encontrados em outro lugar (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Localize os geradores subjacentes das descargas ictais selecionadas usando o método ECD irrestrito na matriz de sensores MEG, EEG e MEG e EEG combinados separadamente. Para localizar essas fontes de dipolo, calcule a covariância de ruído das gravações MEG de sala vazia ou defina-a como uma matriz de identidade.
- Execute o método de varredura de dipolo disponível no Brainstorm no pico de cada forma de onda ictal previamente marcada para selecionar os dipolos de fonte mais significativos em todo o volume cerebral. Selecione apenas dipolos de origem com uma qualidade de ajuste >60% e estime seu agrupamento (distância dos dipolos do centro de cada dipolo definida como 15 mm) 52.
- Mapeamento do córtex eloquente
- Execute os passos 4.2.1-4.2.3 descritos anteriormente usando os sinais registrados durante a tarefa visuomotora, bem como durante as estimulações auditivas e somatossensoriais.
- Abra as gravações simultâneas de MEG e HD-EEG e inspecione visualmente os dados brutos para remover canais defeituosos. Separadamente, para cada sessão, aplique a técnica de correção de artefatos SSP disponível no Brainstorm47 para rejeitar artefatos biológicos (por exemplo, batimentos cardíacos, piscar de olhos) das gravações. Além disso, descarte ou marque como "Intervalo incorreto" todos os segmentos de dados contaminados por artefatos que não podem ser usados para análise posterior.
- Aplique filtros de entalhe (50 ou 60 Hz, de acordo com a interferência da linha de energia) e passa-banda (1-100 Hz) aos dados simultâneos de MEG e HD-EEG.
- Para mapear o córtex motor, abra os sinais EMG registrados nos eletrodos FDI e APB e marque manualmente o evento de toque realizado pelo sujeito, separadamente para a mão direita e esquerda, selecionando o primeiro pico de ativação muscular diferente da linha de base no eletrodo par FDI. Execute esta etapa separadamente para cada sessão usando o Brainstorm47.
NOTA: Use a guia Filtro para visualização apenas no Brainstorm e selecione faixas de frequência (por exemplo, passa-alta: 30 Hz; passa-baixa: 300 Hz; entalhe: 60 Hz) que podem ajudar a marcar corretamente os picos da atividade EMG durante a batida. O nome dos eventos precisa ser o mesmo em todas as sessões; Por exemplo, eventos em que o sujeito executou o toque com o dedo direito (ou esquerdo) podem ser nomeados como "Tap_right" (ou "Tap_left"). Esta etapa nos permite realizar uma análise única no mesmo tipo de evento que ocorreu em todas as sessões. - De cada sessão, importe os eventos que ocorrem em segmentos livres de artefatos selecionando os seguintes parâmetros: estímulos visuais: [-200; +500] ms janela de tempo, incluindo a linha de base de [-200; 0] ms antes do início do estímulo; Eventos de toque: [-1500; +1000] ms janela de tempo, incluindo a linha de base de [-1500; -1000] ms antes do início do estímulo visual; sons de chirp modulados: [-500; +1000] ms janela de tempo, incluindo a linha de base de [-500; 0] ms antes do início do estímulo; e estímulos táteis: [-100; +500] ms janela de tempo, incluindo a linha de base de [-100; 0] ms antes do início do estímulo.
- Uma vez que os eventos de uma tarefa específica tenham sido importados de todas as sessões, aplique a montagem de referência média para aumentar o SNR nos dados do EEG e estime a média entre os estímulos para obter os campos e potenciais evocados pelo evento. No caso de tarefas motoras (ou seja, batidas) e estimulação tátil, esta última etapa é realizada para a mão direita e esquerda, respectivamente.
NOTA: Os painéis A e B da Figura 5, Figura 6, Figura 7 e Figura 8 mostram exemplos de respostas evocadas visuais, motoras, auditivas e somatossensoriais, respectivamente, para MEG e EEG e seu campo de topografia relativa e mapas potenciais. O número total de estímulos para uma tarefa específica depende estritamente do número de sessões concluídas; No caso da tarefa motora, esse número também depende da tarefa de toque executada corretamente. - Para os campos e potenciais evocados visuais, motores, auditivos ou somatossensoriais, calcule o modelo de cabeça realista de três camadas (ou seja, couro cabeludo, crânio interno e crânio externo) para os sensores MEG e EEG usando o software OpenMEEG BEM disponível no Brainstorm. Use a superfície cortical 3D como espaço de origem.
NOTA: Para resolver o modelo direto usando o FEM, calcule o modelo realista da cabeça, definido como um modelo geométrico de três a cinco camadas (ou seja, substância branca, substância cinzenta, líquido cefalorraquidiano, crânio e pele), usando o software DUNEuro FEM disponível no Brainstorm 47,50,51. Mais detalhes sobre a estimativa do modelo forward usando FEM podem ser encontrados em outro lugar (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Para cada campo e potencial evocado por evento, calcule as fontes corticais nos eventos médios usando dSPM implementado na caixa de ferramentas Brainstorm para a matriz de sensores MEG, EEG e MEG e EEG combinados separadamente. Defina a matriz de covariância de ruído usando o período de linha de base pré-estímulo específico para cada tarefa (consulte a etapa 4.3.5).
- Dependendo da tarefa, extraia as fontes corticais máximas observadas na área eloquente do cérebro envolvida [córtex visual primário (V1), córtex motor primário (M1), córtex auditivo primário (A1) ou córtex somatossensorial primário (S1)] que podem ser definidas usando um atlas ou através da reconstrução de um sensor virtual (ou seja, região de interesse, ROI) naquele local (Figura 5C, Figura 6C, Figura 7C e Figura 8C).
- Execute a decomposição de tempo-frequência da wavelet de Morlet no campo evocado por eventos e fontes potenciais na área eloqüente do cérebro envolvida (V1, M1, A1 ou S1) com uma escala linear (faixa de frequência: 1:1:100 Hz).
NOTA: Para estimar as oscilações evocadas que são bloqueadas no tempo e na fase para o início do estímulo, o sinal MEG / EEG é inicialmente calculado sobre os eventos e, em seguida, torna-se sujeito à análise de tempo-frequência53,54. - Execute a padronização dos mapas de origem corticais usando o método de perturbação relacionada a eventos disponível no Brainstorm para normalizá-los em relação à linha de base (consulte a etapa 4.3.5), separadamente para cada evento (Figura 5D, Figura 6D, Figura 7D e Figura 8D).
NOTA: A padronização de mapas de origem usando perturbações relacionadas a eventos é uma medida de normalização para mapas de potência de frequência de tempo que estima o desvio da média sobre a linha de base em porcentagem. Mais detalhes sobre esse processo de padronização podem ser encontrados em outro lugar (https://neuroimage.usc.edu/brainstorm/Tutorials/TimeFrequency#Normalized_time-frequency_maps).
- Validação
- Adquira registro de iEEG extraoperatório através do implante de grades subdurais e/ou eletrodos de profundidade. O número, o tipo e a colocação dos eletrodos intracranianos são decididos pela equipe multidisciplinar de epilepsia com base na hipótese clínica gerada a partir da soma das informações obtidas dos testes diagnósticos não invasivos da avaliação pré-cirúrgica.
NOTA: Como parte da avaliação pré-cirúrgica, o iEEG extraoperatório é registrado ao longo de vários dias por meio de um sistema de EEG digital usando uma taxa de amostragem de 1.024 Hz. - Identifique a SOZ conforme definido por um epileptologista especialista com base nas informações clínicas disponíveis para cada indivíduo.
NOTA: A SOZ é definida como a área do cérebro que mostra a primeira descarga eletrográfica ictal inequívoca, que é diferente da atividade de fundo que pode ocorrer antes ou concomitantemente com o início ictal clinicamente definido. Todos os canais envolvidos nesta descarga eletrográfica ictal são considerados contatos SOZ, mesmo que capturem convulsões que se originam de diferentes áreas do cérebro. - Durante o evento ictal registrado no iEEG, marque o pico de cada explosão de descargas epileptiformes que ocorrem em cada eletrodo intracraniano e realize a localização da fonte nesses eventos ictais usando o método ECD, conforme descrito anteriormente nas etapas 4.1.7-4.1.10.
- Compare os resultados da localização do iEEG em relação à SOZ clinicamente definida como padrão-ouro para os resultados da localização da fonte.
- Adquira registro de iEEG extraoperatório através do implante de grades subdurais e/ou eletrodos de profundidade. O número, o tipo e a colocação dos eletrodos intracranianos são decididos pela equipe multidisciplinar de epilepsia com base na hipótese clínica gerada a partir da soma das informações obtidas dos testes diagnósticos não invasivos da avaliação pré-cirúrgica.
Resultados
Pacientes pediátricos com DRE foram recrutados na Clínica de Epilepsia do Jane and John Justin Institute for Mind Health, Cook Children's Health Care System (CCHCS). Aqui, são apresentados dados de três pacientes representativos: (i) uma menina de 10 anos, (ii) um menino de 13 anos e (iii) uma menina de 10 anos.
Caso 1: Uma menina de 10 anos foi internada com convulsões a partir dos três anos de idade. O paciente sofria de convulsões diárias mesmo após a administração de 8 ASMs. As convulsões iniciais foram caracterizadas por desvio ocular (lado incerto) e parada comportamental. Mais tarde, o paciente apresentou convulsões diárias de ~ 30 s, caracterizadas por beicto ictal (sinal do "chapeau de gendarme"), desvio da cabeça para a esquerda e enrijecimento tônico bilateral do braço (predominância direita). O vídeo EEG de longo prazo revelou dois grupos de convulsões tônicas assimétricas com desvio da cabeça para a esquerda, seguido por seu braço esquerdo subindo. Três convulsões tônicas também foram observadas durante o sono, com corridas frequentes de poliespinhos rápidos generalizados e ondas lentas com abertura intermitente dos olhos, olhar para cima e elevação do braço esquerdo ou direito. Esses poliespinhos e ondas de sono lento eram principalmente proeminentes no lobo temporal médio esquerdo. A ressonância magnética do cérebro revelou as seguintes displasias multifocais: (i) lobo parietal esquerdo (giro pós-central), displasia cortical focal (DFC) com sinal de transmanto (DFC tipo II), (ii) DFC da junção parieto-occipital direita e (iii) DFC do pólo temporal esquerdo. A tomografia por emissão de pósitrons (PET) demonstrou hipometabolismo no lobo parietal esquerdo, lobo temporal esquerdo e junção parieto-occipital direita correspondendo aos focos da anormalidade de sinal (ou seja, FCD) no exame de ressonância magnética. O paciente foi diagnosticado com epilepsia intratável, com semiologia estereotipada de chapeau seguida de rigidez tônica do braço, sugerindo possível início mesial frontal ou insular/temporal. A exploração extensa de estereo-EEG bilateral (sEEG) foi recomendada visando o lobo frontal, cíngulo, ínsula e as regiões de displasia. Durante o monitoramento do iEEG, o paciente apresentou convulsões típicas com "chapeau de gendarme" seguidas de elevação/flexão tônica da extremidade superior direita ou esquerda caracterizada por início difuso de EEG, máximo sobre a ínsula anterior bilateral. Os IEDs multifocais foram observados principalmente no lobo temporal anterior direito e esquerdo e no córtex frontal dorsolateral, incluindo a ínsula bilateral. A ESI realizada no registro de iEEG confirmou a localização da SOZ, que foi clinicamente definida bilateralmente no córtex frontal dorsolateral esquerdo e direito e na ínsula anterior.
Como parte da avaliação pré-cirúrgica, foi realizada a localização da fonte nos dados simultâneos de MEG e HD-EEG. Os registros de MEG e HD-EEG indicaram IEDs frequentes em ambas as regiões frontotemporais. A Figura 3A mostra um exemplo representativo de um IED em dados de MEG e HD-EEG; O campo topográfico e o mapeamento potencial de ambas as modalidades indicaram uma possível fonte subjacente na região frontotemporal direita. ESI indicou um aglomerado disperso de dipolos cobrindo áreas dos lobos frontotemporal e parietal direito e esquerdo. O MSI mostrou um aglomerado focal de dipolos no lobo frontotemporal direito, localizado próximo à ínsula direita. O EMSI indicou clusters focais de dipolos nas regiões frontotemporais bilaterais, em consonância com o ESI realizado no padrão-ouro iEEG, que confirmou as observações clínicas (Figura 3C). Esses dipolos estimados por meio do EMSI mostraram uma distância média do SOZ definido por iEEG de 9,81 mm (mediana: 11,18; std: 2,37).
Caso 2: Um menino de 13 anos com epilepsia intratável foi internado com convulsões a partir dos nove anos de idade. As convulsões começaram com uma aura seguida de desvio da cabeça / olho para a esquerda com consciência preservada às vezes e clônus focal da cabeça para a esquerda, duram ~ 30 s e ocorreram várias vezes por semana. Nenhum dos ASMs prescritos alcançou o controle das convulsões. A partir do vídeo-EEG de longo prazo, observamos picos temporais posteriores direitos e descargas frequentes de ondas de pico no hemisfério direito envolvendo o córtex temporal médio, frontotemporal, temporoparietal e centroparietal. O paciente apresentou seis crises eletroclínicas caracterizadas por alteração comportamental, desvio cabeça/olho para a esquerda com extensão do braço esquerdo e, às vezes, atividade clônica do braço esquerdo, e três convulsões com atividade convulsiva bilateral secundária. O início máximo foi no lobo temporal médio direito, com evolução no lobo frontotemporal direito. A ressonância magnética do cérebro revelou uma extensa malformação do córtex no hemisfério cerebral direito (predominantemente perisylviano) e uma leve perda de volume no hemisfério cerebral direito com dilatação ex vacuo do ventrículo lateral direito. O paciente foi diagnosticado com epilepsia intratável com início no hemisfério direito, favorecendo o início temporal e perisylviano na região de malformação cortical difusa. O EEG estereoscópico foi realizado para delinear a extensão do acometimento, com eletrodos colocados nos córtices temporal direito, perisylviano, insular e parieto-occipital. Várias crises eletroclínicas de início focal foram capturadas durante o monitoramento do iEEG com início máximo em uma ampla área do lobo frontotemporal direito. O ESI realizado em dados de iEEG localizou essas convulsões em uma área mais focal, compreendendo as áreas temporal direita (perto do giro temporal médio direito) e perisylviana.
Como parte da avaliação pré-cirúrgica, foram realizados MEG e HD-EEG simultâneos, durante os quais o paciente experimentou duas convulsões: uma enquanto estava sentado na cadeira de madeira durante o processo de digitalização e outra capturada durante a gravação real com o início visível no MEG e no HD-EEG (Figura 4A). O campo de topografia e os mapas potenciais no início ictal indicaram que o gerador subjacente do início da convulsão pode estar no lobo temporal médio direito, conforme mostrado na Figura 4A. A localização da fonte no evento ictal apresentou achados diferentes para ESI e MSI: O ESI mostrou dipolos localizados nos lobos frontotemporal e centroparietal direito, enquanto o MSI mostrou dipolos com alto agrupamento principalmente no lobo temporal direito (Figura 4B), com dipolos adicionais espalhados no córtex frontotemporal. Ao combinar essas soluções, o EMSI revelou a localização do início ictal dentro do lobo temporal concordante com o ESI no padrão-ouro iEEG (Figura 4B). Particularmente, o EMSI apresentou resultados de localização com uma distância média do SOZ definida pelo monitoramento do iEEG de 12,21 mm (mediana: 13,62; std: 2,37).
Caso 3: Uma mulher de 15 anos com epilepsia idiopática relacionada à localização foi internada com convulsões a partir dos 13 anos de idade, mas possivelmente aos 8-9 anos em retrospecto, quando foi diagnosticada com tiques devido a movimentos repetitivos e estereotipados do pescoço. O paciente apresentava breves inclinações da cabeça para a esquerda que às vezes progrediam para convulsões discognitivas focais com comportamentos hipermotores (ou seja, convulsões tônico-clônicas generalizadas), bem como convulsões noturnas. Vários ASMs foram administrados sem atingir o controle completo das convulsões. Durante o monitoramento de vídeo-EEG de longo prazo, o paciente teve convulsões eletroclínicas focais com generalização secundária com início no lobo temporal posterior esquerdo, numerosas convulsões motoras focais breves com inclinação da cabeça para a esquerda e uma convulsão eletrográfica sutil com início no córtex centroparietal esquerdo. A ressonância magnética cerebral não revelou nenhuma anormalidade intracraniana aguda e uma malformação de Chiari I. O exame de tomografia computadorizada por emissão de pósitrons (PET-CT) da cabeça foi negativo. Testes adicionais, como TC por emissão de fóton único (SPECT), MEG e HD-EEG simultâneos, radiografia da coluna cervical, angiografia por ressonância magnética (ARM) da cabeça e pescoço e, eventualmente, exploração por EEG do hemisfério esquerdo, foram recomendados.
Como parte da avaliação, o paciente participou de gravações simultâneas de MEG e HD-EEG para mapeamento de áreas cerebrais eloquentes, como os córtices primários visual, motor, auditivo e somatossensorial. Inicialmente, o paciente realizava uma tarefa visuomotora, seguida de estímulos auditivos e somatossensoriais. A primeira resposta cortical à estimulação visual ocorreu em ~70 ms após o início do estímulo para MEG e HD-EEG (Figura 5A). Figura 5B relata o campo topográfico e os mapas potenciais das localizações corticais envolvidas na estimulação visual para MEG e HD-EEG, respectivamente. Para HD-EEG, foi observada uma mudança de polaridade nos canais que cobrem as áreas occipitais do cérebro, enquanto uma distribuição de campo mais complexa foi encontrada nas mesmas áreas para MEG (Figura 5B). A localização da fonte usando dSPM revelou uma atividade cortical focal neste ponto de tempo nas seguintes regiões cerebrais do atlas Desikan-Killiany: (i) cúneo para MSI; (ii) córtex occipital lateral para ESI; e (iii) cúneo e córtex occipital lateral para EMSI (Figura 5C). A análise de tempo-frequência nas respostas corticais visuais revelou uma sincronização relacionada a eventos (ERS) na banda de frequência gama para MSI (faixa aproximada: 30-50 Hz), ESI (faixa aproximada: 40-50 Hz) e EMSI (faixa aproximada: 30-50 Hz) (Figura 5D). Para as respostas evocadas motoras, foi observada supressão da atividade do ritmo mu sobre o M1 contralateral durante o início do movimento (Figura 6A). Em Figura 6B, relatamos o campo de topografia e os mapas potenciais das áreas cerebrais ativadas durante a tarefa motora para MEG e HD-EEG, respectivamente. Os mapas de campo MEG indicaram alterações claras do influxo magnético e do fluxo de saída nas áreas centrais do cérebro contralaterais, o que pode indicar um gerador focal subjacente no M1 contralateral (Figura 6B). Os mapas de potencial HD-EEG mostraram uma mudança de polaridade focal nas mesmas áreas, com potenciais elétricos perpendiculares aos campos magnéticos (Figura 6B). Os picos de ativação máxima da fonte foram observados durante a execução da tarefa de tapping no giro pré-central contralateral do atlas Desikan-Killiany para MSI, ESI e EMSI, respectivamente, conforme exibido em Figura 6C. As respostas corticais motoras que ocorreram durante a antecipação do próximo movimento de batida mostraram ERS nas bandas beta e gama para MSI (faixa aproximada: 20-30 Hz) e EMSI (faixa aproximada: 20-40 Hz) e banda gama para ESI (faixa aproximada: 30-50 Hz), referida na literatura como mu rhythm suppression (Figura 6D).55,56 Os campos evocados auditivos e os potenciais em resposta à estimulação auditiva tiveram um pico positivo máximo em ~80 ms e ~120 ms após o início do estímulo para MEG e HD-EEG, respectivamente (Figura 7A). Em Figura 7B, relatamos o campo topográfico e os mapas potenciais das localizações corticais envolvidas na estimulação auditiva para MEG e HD-EEG, respectivamente. Tanto no MEG quanto no HD-EEG, foi observada uma mudança óbvia de polaridade com pólos negativos e positivos claramente definidos nos sensores que cobrem as áreas temporais esquerdas do cérebro; esses mapas de campo magnético perpendicular e potencial elétrico podem revelar um gerador focal subjacente em V1 (Figura 7B). Realizando-se a localização da fonte nos campos evocados auditivos médios e potenciais, observou-se ativação cortical máxima no giro temporal transverso e na porção posterior do giro temporal superior do atlas de Desikan-Killiany para MSI, ESI e EMSI, respectivamente (Figura 7C). A análise tempo-freqüencial das respostas evocadas auditivas revelou ERS na banda gama para MSI (faixa aproximada: 40-60 Hz) e EMSI (faixa aproximada: 35-50 Hz), e bandas de frequência beta e gama (faixa aproximada: 25-60 Hz) para ESI (Figura 7D). Finalmente, observamos a primeira atividade cortical em resposta à estimulação tátil em ~ 60 e ~ 50 ms após o início do estímulo para MEG e HD-EEG, respectivamente (Figura 8A). Em Figura 8B, relatamos o campo de topografia e os mapas potenciais das áreas cerebrais ativadas durante a estimulação somatossensorial para MEG e HD-EEG, respectivamente. Os mapas de campo MEG revelaram uma clara mudança de polaridade com alterações distintas do fluxo magnético nos sensores que cobrem as áreas parietais contralaterais, enquanto os mapas de potencial HD-EEG mostraram uma mudança menos óbvia de polaridade nas mesmas áreas com um pólo positivo mais forte do que o negativo. Esses mapas de campo magnético perpendicular e potencial elétrico podem indicar um gerador cortical focal em S1. Usando dSPM nas respostas evocadas somatossensoriais médias, a atividade máxima da fonte cortical neste ponto de tempo foi observada dentro do giro pós-central contralateral do atlas Desikan-Killiany para MSI, ESI e EMSI, respectivamente (Figura 8C). Em resposta aos estímulos táteis, ERS nas bandas de frequência beta e gama para MSI (faixa aproximada: 15-40 Hz) e EMSI (faixa aproximada: 20-40 Hz) e banda de frequência gama para ESI (faixa aproximada: 30-40 Hz) (Figura 8D) também foram observados.
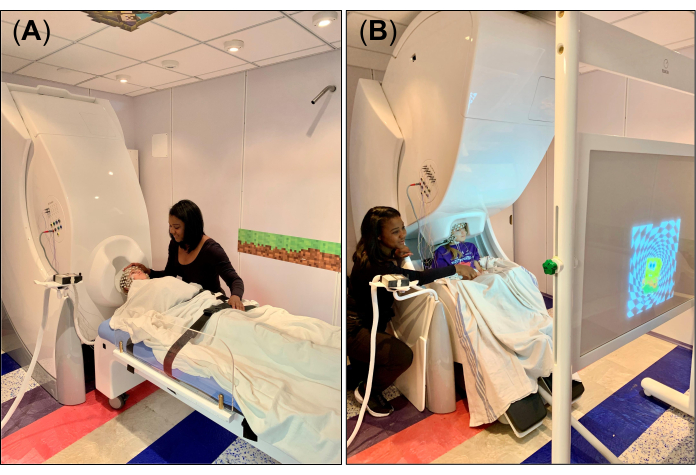
Figura 1: Configuração experimental para MEG e HD-EEG simultâneos no CCHCS. (A) Sistemas HD-EEG (256 canais) e MEG (306 sensores) com o pórtico do MEG ajustado para uma posição supina (90 °, posição horizontal) para uma gravação em estado de repouso / sono usando a cama compatível com MEG não magnética. O técnico está preparando o sujeito (uma menina de 9 anos) para a gravação, garantindo segurança e conforto. (B) Sistemas HD-EEG e MEG configurados para uma gravação na posição sentada usando a cadeira compatível com MEG não magnético. O técnico está preparando o sujeito para a gravação, garantindo a posição correta do sujeito na frente da tela onde os estímulos visuais serão projetados durante a tarefa visuomotora. Clique aqui para ver uma versão maior desta figura.
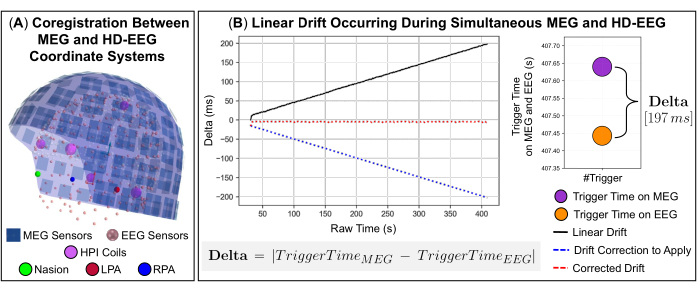
Figura 2: Aspectos técnicos da combinação de dados de gravações simultâneas de MEG e HD-EEG usando diferentes sistemas de aquisição. (A) Alinhamento espacial (co-registro) de sensores MEG e HD-EEG no mesmo sistema de coordenadas (definido pelas coordenadas da cabeça do sujeito) para um sujeito representativo (uma menina de 9 anos). As coordenadas da cabeça do sujeito são representadas pelos seguintes pontos fiduciais: násio (verde) e pontos pré-auriculares esquerdo/direito (vermelho e azul, respectivamente). Os sensores de 306 MEG (de cor azul) - 102 magnetômetros e 204 gradiômetros planares - e as bobinas do indicador de posição da cabeça (HPI) (de cor magenta) são exibidos; alinhados no mesmo sistema de coordenadas, os 256 canais HD-EEG também são exibidos (cor de rosa). (B) Painel esquerdo: Desvio linear (ou seja, delta, exibido como uma linha preta) de amostras de dados que ocorrem entre os sistemas MEG e HD-EEG para um sujeito representativo (uma menina de 9 anos). O delta é definido como o valor absoluto da diferença entre os tempos em que o mesmo gatilho é enviado para os sistemas MEG e EEG e aumenta continuamente ao longo do tempo: de valores baixos (delta = 0 ms) para altos (delta = 197 ms). A correção do desvio linear estimado usando uma função polinomial a ser aplicada aos sinais é exibida com uma linha tracejada azul. O desvio corrigido (delta ~ 0 ms ao longo do tempo) representando um tempo sincronizado entre os sistemas MEG e EEG é exibido com uma linha tracejada vermelha. Painel direito: A representação gráfica da mudança de tempo (delta = 197 ms) estimada para o último disparo enviado aos sistemas MEG e EEG é exibida. Clique aqui para ver uma versão maior desta figura.
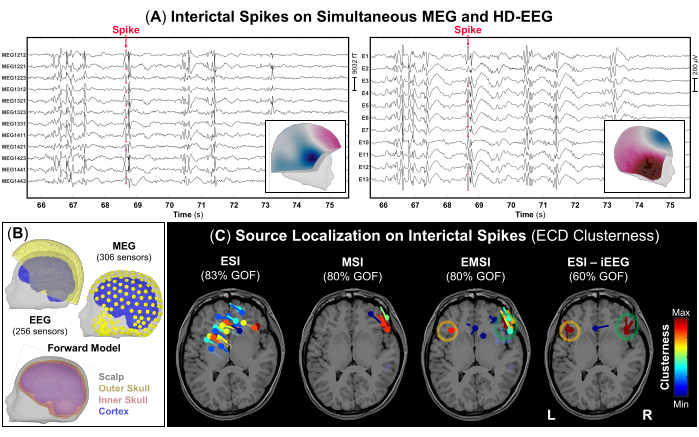
Figura 3: Descargas epileptiformes interictais (IEDs) em dados de MEG e HD-EEG. (A) Porção de tempo de registro simultâneo de MEG e HD-EEG (10 s) de uma menina de 10 anos (Caso 1) com IEDs frequentes. Um subgrupo dos sensores de 306 MEG e 256 eletrodos de EEG foi selecionado para fins de visualização. O campo de topografia e os mapas potenciais no pico de um IED são exibidos como painéis internos para MEG e HD-EEG, respectivamente. (B) Localização dos sensores MEG e HD-EEG (amarelos) co-registrados na cabeça 3D do sujeito e nas superfícies corticais (azuis). Modelo realista de cabeça do método dos elementos de contorno (BEM) consistindo em três camadas [ou seja, couro cabeludo (cor cinza), crânio externo (cor amarela) e crânio interno (cor rosa)] reconstruído a partir da ressonância magnética pré-operatória do sujeito. (C) Os resultados de agrupamento de localização de fonte realizados em IEDs usando dipolo de corrente equivalente (ECD) são mostrados na ressonância magnética pré-operatória do sujeito para ESI, MSI, EMSI e ESI em iEEG (padrão ouro) 52 . Os mapas de calor do cluster de dipolo com uma qualidade de ajuste >60% são exibidos de valores mais baixos (azul) para mais altos (vermelho). A zona de início da crise definida por meio de ESI realizada em dados de iEEG foi considerada o padrão-ouro (círculos laranja e verde). Clique aqui para ver uma versão maior desta figura.
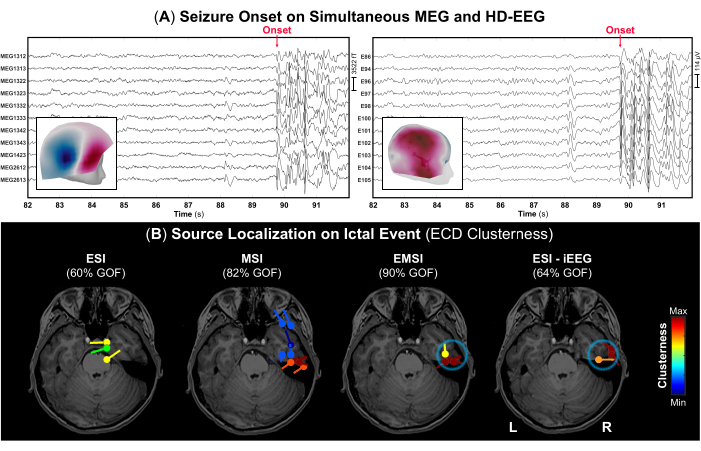
Figura 4: Início da convulsão nos dados de MEG e HD-EEG. (A) Porção de tempo de gravação simultânea de MEG e HD-EEG (10 s) de um homem de 13 anos (Caso 2) com o início da convulsão (seta vermelha). Um subgrupo dos sensores de 306 MEG e 256 eletrodos de EEG foi selecionado para fins de visualização. O campo de topografia e os mapas potenciais no início ictal são exibidos como painéis internos para MEG e HD-EEG, respectivamente. (B) Os resultados de agrupamento de localização da fonte realizados no início do evento ictal usando o método de dipolo de corrente equivalente (ECD) são mostrados na ressonância magnética pré-operatória do sujeito para ESI, MSI, EMSI e ESI no iEEG (padrão ouro) 52. Os mapas de calor do cluster de dipolo com uma qualidade de ajuste >60% são exibidos de valores mais baixos (azul) para mais altos (vermelho). A zona de início da crise definida por meio de ESI realizada em dados de iEEG foi considerada padrão-ouro (círculo azul). Clique aqui para ver uma versão maior desta figura.
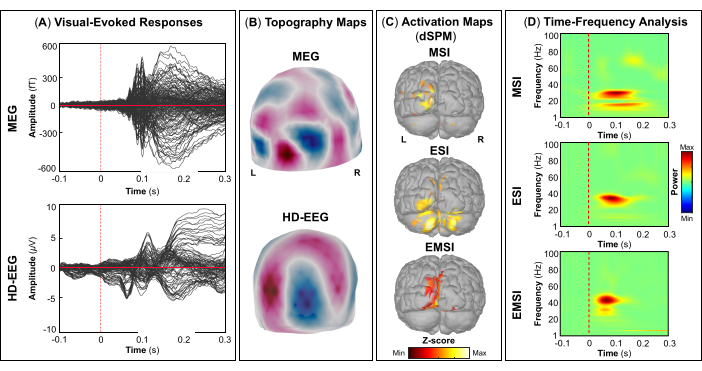
Figura 5: Campos e potenciais evocados visuais a partir de dados de MEG e HD-EEG. (A) As respostas evocadas visuais médias de uma mulher de 15 anos para MEG (painel superior) e HD-EEG (painel inferior) são exibidas para o intervalo de tempo entre -100 ms e 300 ms. (B) O campo de topografia e os mapas potenciais do córtex visual primário são exibidos para MEG e HD-EEG, respectivamente. (C) Mapas de ativação de fontes com amplitudes máximas de ativação cortical nas regiões cerebrais do atlas Desikan-Killiany (ou seja, cúneo e córtex occipital lateral) estimados usando o método de mapeamento paramétrico estatístico dinâmico (dSPM) para MSI, ESI e EMSI, respectivamente. Mapas de calor da ativação da fonte (z-score normalizado dSPM) são exibidos. (D) Mapas de tempo-frequência obtidos usando a decomposição de tempo-frequência de wavelet de Morlet nas respostas evocadas visuais no córtex visual primário são exibidos para a janela de tempo de -100 ms a 300 ms. Mapas de calor da potência de tempo-frequência, expressos em porcentagens com base no desvio dos dados normalizados da média sobre a linha de base [-200; 0] ms, são exibidos. Clique aqui para ver uma versão maior desta figura.
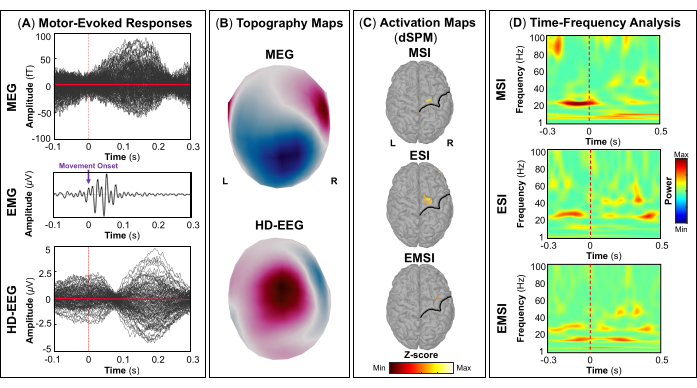
Figura 6: Campos e potenciais evocados motores a partir de dados de MEG e HD-EEG. (A) As respostas médias evocadas motoras de uma mulher de 15 anos para MEG (painel superior) e HD-EEG (painel inferior) são exibidas para a tarefa de toque de índice esquerdo no intervalo de tempo entre -100 e 300 ms. O sinal de eletromiografia (EMG) (painel central) com o início do movimento (seta roxa) é exibido para o intervalo de tempo entre -100 ms e 300 ms; o sinal é filtrado na banda de frequência 30-300 Hz (filtro Notch: 60 Hz). (B) O campo de topografia e os mapas potenciais do córtex motor primário são exibidos para MEG e HD-EEG, respectivamente. (C) Mapas de ativação da fonte com amplitudes máximas de ativação cortical no giro pré-central contralateral do atlas Desikan-Killiany estimadas usando o método de mapeamento paramétrico estatístico dinâmico (dSPM) para MSI, ESI e EMSI, respectivamente. Mapas de calor da ativação da fonte (dSPM normalizado z-score) são exibidos, juntamente com o sulco central (linha preta). (D) Mapas de tempo-frequência obtidos usando a decomposição de tempo-frequência de wavelet de Morlet nas respostas motoras evocadas no córtex motor primário para a janela de tempo de -300 ms a 500 ms. Mapas de calor da potência de tempo-frequência, expressos em porcentagens com base no desvio dos dados normalizados da média sobre a linha de base [-1500; -1000] ms, são exibidos. Clique aqui para ver uma versão maior desta figura.
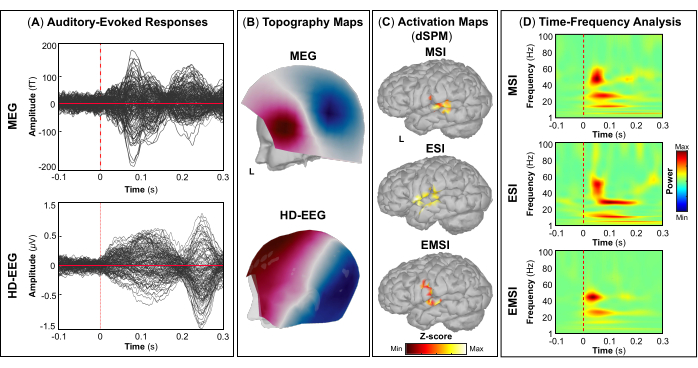
Figura 7: Campos evocados auditivos e potenciais a partir de dados de MEG e HD-EEG. (A) As respostas evocadas auditivas médias de uma mulher de 15 anos para MEG (painel superior) e HD-EEG (painel inferior) são exibidas para o intervalo de tempo entre -100 ms e 300 ms. (B) O campo topográfico e os mapas de potencial do córtex auditivo primário são exibidos para o MEG e HD-EEG, respectivamente. (C) Mapas de ativação da fonte com amplitudes máximas de ativação cortical no giro temporal transverso e na porção posterior do giro temporal superior do atlas Desikan-Killiany estimados usando o método de mapeamento paramétrico estatístico dinâmico (dSPM) para MSI, ESI e EMSI, respectivamente. Mapas de calor da ativação da fonte (z-score normalizado dSPM) são exibidos. (D) Mapas de tempo-frequência obtidos por meio da decomposição tempo-frequência das wavelets de Morlet nas respostas evocadas auditivas no córtex auditivo primário para a janela de tempo de -100 a 300 ms. Mapas de calor da potência de tempo-frequência, expressos em porcentagens com base no desvio dos dados normalizados da média sobre a linha de base [-500; 0] ms, são exibidos. Clique aqui para ver uma versão maior desta figura.
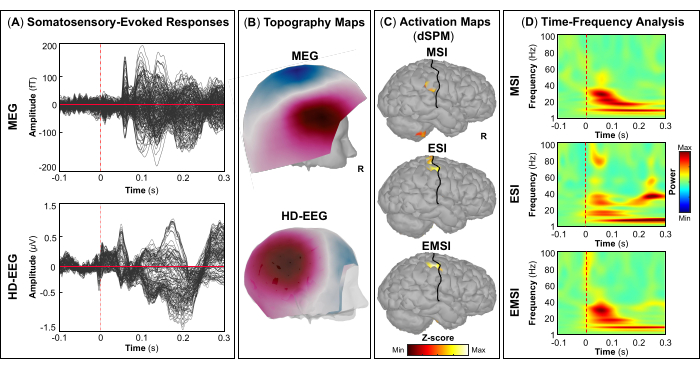
Figura 8: Campos e potenciais evocados somatossensoriais a partir de dados de MEG e HD-EEG. (A) As respostas somatossensoriais evocadas médias de uma mulher de 15 anos para MEG (painel superior) e HD-EEG (painel inferior) são exibidas para a estimulação dos dígitos esquerdos no intervalo de tempo entre -100 e 300 ms. (B) O campo de topografia e os mapas potenciais do córtex somatossensorial primário são exibidos para o MEG e HD-EEG, respectivamente. (C) Mapas de ativação da fonte com amplitudes máximas de ativação cortical no giro pós-central contralateral do atlas Desikan-Killiany estimados usando o método de mapeamento paramétrico estatístico dinâmico (dSPM) para MSI, ESI e EMSI, respectivamente. Mapas de calor da ativação da fonte (dSPM normalizado z-score) são exibidos, juntamente com o sulco central (linha preta). (D) Mapas de tempo-frequência obtidos usando a decomposição de tempo-frequência de wavelet de Morlet nas respostas evocadas somatossensoriais no córtex somatossensorial primário para a janela de tempo de -100 ms a 300 ms. Mapas de calor da potência de tempo-frequência, expressos em porcentagens com base no desvio dos dados normalizados da média sobre a linha de base [-100; 0] ms, são exibidos. Clique aqui para ver uma versão maior desta figura.
Discussão
Neste estudo, ilustramos a configuração experimental para registrar MEG e HD-EEG simultâneos em crianças com DRE enquanto descansam/dormem, realizam uma tarefa ou recebem estímulos, e propomos uma estrutura metodológica para localizar a zona irritativa, SOZ e áreas cerebrais eloquentes usando EMSI, bem como MSI e ESI individuais. Além disso, fornecemos recomendações técnicas para mesclar dados de MEG e HD-EEG de diferentes produtos disponíveis comercialmente que apresentam características exclusivas. Apresentamos dados de três casos para aumentar a utilidade clínica da EMSI na localização de áreas cerebrais epileptogênicas e eloquentes. Os resultados aqui indicam que os resultados do EMSI superam os obtidos por qualquer modalidade isoladamente, provavelmente devido ao valor aditivo das propriedades complementares dos sinais MEG e EEG na solução combinada e possivelmente devido ao aumento do número de sensores usados para registrar os dados (>550 sensores). Particularmente, o EMSI localizou de forma não invasiva os irritantes e SOZs com achados concordantes como ESI no padrão ouro do iEEG, o que confirmou as observações clínicas.
A metodologia proposta inclui as seguintes etapas críticas: (i) aquisição de alta qualidade de gravações simultâneas de MEG e HD-EEG (ou seja, alta SNR) com alta amostragem espacial de sensores (>550 sensores) cobrindo todo o cérebro de atividades interictais e ictais, bem como campos e potenciais evocados visuais, motores, auditivos e somatossensoriais, de crianças com EDR (etapas 3.1-3.2); (ii) sincronização temporal e co-registro espacial de sinais MEG e HD-EEG registrados com diferentes sistemas de aquisição (etapa 3.12); (iii) pré-processamento cuidadoso e seleção de porções de dados contendo atividade interictal (etapas 4.1.1-4.1.7), atividade de início ictal (etapas 4.2.1-4.2.7) e respostas relacionadas a eventos (etapas 4.3.1-4.3.6), respectivamente; e (iv) localização precisa da fonte da zona irritativa, SOZ e áreas cerebrais eloquentes de interesse usando métodos confiáveis de localização da fonte (por exemplo, ECDs com agrupamento e dSPM) (etapas 4.1.8-4.1.9, 4.2.8-4.2.9 e 4.3.7-4.3.9, respectivamente).
A etapa mais crítica ao realizar gravações simultâneas de MEG e HD-EEG é sincronizar espacialmente (alinhamento entre espaços de coordenadas) e temporalmente (correção do desvio linear do relógio) os dados registrados pelos dois sistemas de aquisição. Essa sincronização é crucial para garantir a correta identificação de eventos interictais, ictais e visuais/motores/auditivos/táteis que ocorrem simultaneamente nos sinais MEG e HD-EEG. Erros na seleção do ponto de tempo desses eventos podem afetar os resultados da localização da fonte e identificar áreas do cérebro que não estão necessariamente envolvidas na geração desses eventos.
Os sistemas MEG geralmente oferecem sistemas de EEG compatíveis de 32, 64 e 128 canais incorporados ao produto para realizar medições simultâneas de MEG e EEG. Nesses casos, não há necessidade de sincronizar temporariamente os dados enviando sinais de disparo comuns. Da mesma forma, a maioria dos sistemas de EEG são hoje compatíveis com todos os sistemas MEG. Apesar desses avanços no hardware, apenas alguns centros de epilepsia realizam registros simultâneos de MEG e HD-EEG como parte da avaliação pré-cirúrgica. Aqui, aproveitamos essa integrabilidade e combinamos os sistemas MEG de 306 canais e EEG de 256 canais para registrar simultaneamente a atividade cerebral com sensores >550 cobrindo a cabeça do sujeito. Até agora, poucos softwares para análise avançada de dados MEG, HD-EEG e iEEG (por exemplo, Brainstorm, CURRY, EEGLab, FieldTrip, MNE ou NUTMEG) estão disponíveis. Estudos futuros são, portanto, necessários para validar a metodologia proposta com novos softwares de análise de neuroimagem. Finalmente, a combinação de MSI e ESI em uma solução única (EMSI) aumentou a complexidade computacional da análise de dados.
O método descrito apresenta algumas limitações que devem ser abordadas em estudos futuros. Selecionamos manualmente os IEDs que ocorreram nos dados de MEG e HD-EEG de dois pacientes representativos, ignorando os picos interictais que ocorreram em apenas um dos dois sinais (MEG ou EEG). A seleção manual de picos pode ser uma abordagem demorada e subjetiva que pode ser simplificada usando abordagens automatizadas para detecção de IEDs desenvolvidas nas últimas décadas57,58,59. No entanto, a inspeção visual é sempre recomendada para uma análise cuidadosa e detecção refinada de cada IED. Além disso, usamos o SOZ como um aproximador do EZ. No entanto, a SOZ nem sempre prevê resultados cirúrgicos60,61,62,63. Estudos futuros podem, portanto, usar o resultado cirúrgico como base para um delineamento mais preciso da EZ13,14,15,16,17,19,20. Embora as convulsões possam ser capturadas com sucesso usando MEG e EEG simultâneos e localizadas usando técnicas apropriadas de localização de fonte44,64, é relativamente raro registrar tais eventos ictais na prática clínica, especialmente de pacientes ambulatoriais em ASMs. Isso se deve principalmente à duração limitada dos registros de MEG e aos movimentos corporais excessivos que ocorrem durante as convulsões (por exemplo, a cabeça do paciente escorregou para fora do dewar), o que pode causar artefatos biológicos que podem afetar gravemente os achados de localização da fonte. Em uma revisão recente, Stefan et al. relataram a ocorrência de convulsões durante os registros de MEG em 7% a 24% dos pacientes, com um tempo médio de registro de 30 minutos até 5,7 h em diferentes estudos65. No CCMC, 18 dos 89 (20,2%) pacientes tiveram eventos ictais capturados durante gravações simultâneas de MEG e HD-EEG realizadas nos últimos ~ 2 anos. No entanto, apenas 8 dos 18 (44,4%) pacientes foram analisados com sucesso. Nos casos em que os registros interictais de MEG mostram achados normais ou inconclusivos, o MEG ictal ou HD-EEG pode ser usado para localizar a EZ com alta precisão. No entanto, os requisitos técnicos e logísticos para essas gravações devem ser atendidos. Além disso, os dados representativos para a localização eloquente do córtex via EMSI não foram comparados com nenhum padrão-ouro para localização dessas áreas funcionais do cérebro, como fMRI não invasivo ou estimulação eletrocortical intraoperatória. Investigações adicionais podem, portanto, integrar EMSI e fMRI em uma ferramenta de imagem não invasiva multimodal para melhorar a precisão da localização dessas áreas cerebrais eloquentes em crianças com EDR. Este trabalho também pode ser estendido para localizar outras áreas funcionais do cérebro, como as regiões eloquentes da linguagem. A localização das funções de linguagem é de importância crítica durante a avaliação pré-cirúrgica de pacientes com EDR para determinar sua candidatura cirúrgica, planejar a extensão da ressecção cirúrgica e prevenir déficits funcionais pós-operatórios permanentes66. Vários estudos não invasivos mostraram que o mapeamento de linguagem usando MEG pode fornecer resultados concordantes, semelhantes ao teste invasivo de Wada, que é frequentemente considerado o padrão-ouro para identificar o hemisfério linguístico dominante67,68,69,70. Um estudo recente propôs uma abordagem multimodal na qual a combinação de diferentes técnicas (ou seja, mapeamento por estimulação cortical, eletrocorticografia de alta gama, fMRI e estimulação magnética transcraniana) pode fornecer informações mútuas, confirmatórias e complementares para o mapeamento de linguagem pré-cirúrgico71. Apesar dessas vantagens, o mapeamento de áreas de linguagem ainda é um desafio em pacientes pediátricos que apresentam barreiras cognitivas, intelectuais e linguísticas devido à idade. Assim, tarefas mais específicas para a idade e configurações adequadas para crianças devem ser desenvolvidas em um futuro próximo. Neste trabalho, analisamos os dados de MEG e HD-EEG usando software não certificado para fins clínicos. Embora essas ferramentas tenham se mostrado valiosas e eficazes, elas carregam questões de responsabilidade que devem ser consideradas ao relatar os achados da avaliação pré-cirúrgica para uso clínico. Aqui, descrevemos os procedimentos para gravações de HD-EEG usando apenas sistemas de eletrodos de EEG baseados em esponja. Sistemas alternativos usando eletrodos de EEG à base de gel são amplamente utilizados em ambientes clínicos e de pesquisa. Embora forneçam registros de EEG SNR mais altos, eles exigiram um tempo de preparação mais longo (~ 40-60 min) e, portanto, são menos adequados para uso pediátrico. Alternativamente, vários laboratórios usam sistemas de EEG baseados em gel de baixa densidade durante as gravações de MEG, que são vantajosos em termos de tempo de preparação (em comparação com os sistemas HD-EEG), mas oferecem resolução espacial significativamente menor devido ao número reduzido de eletrodos cobrindo todo o couro cabeludo12,16,72,73.
Atualmente, a localização das áreas cerebrais epileptogênicas em pacientes com epilepsia ainda é alcançada principalmente com o monitoramento de iEEG. Além disso, a metodologia para a localização precisa de áreas cerebrais eloquentes é mal definida, e as configurações de experimentos atualmente usadas em laboratórios de MEG são inadequadas para pacientes pediátricos, enquanto o uso de HD-EEG para esse fim é muito limitado. A localização precisa dessas áreas pode facilitar a avaliação pré-cirúrgica e aumentar o planejamento cirúrgico para ressecção ou colocação de eletrodo iEEG. Até o momento, vários estudos investigaram a contribuição do ESI ou do MSI na avaliação pré-cirúrgica de pacientes com EDR e epilepsias focais para a identificação do EZ 12,13,14,15,16,17,18,19 e áreas eloquentes do córtex somatossensorial41respectivamente. Poucos estudos mostraram melhores resultados de localização de fontes e desempenho de previsão de resultados usando EMSI em comparação com MSI ou ESI sozinho 13,31,42. Apesar desses achados, o registro de MEG e EEG raramente é realizado simultaneamente, e MSI e ESI são implementados em apenas alguns centros de epilepsia em todo o mundo. Até onde sabemos, este é o primeiro estudo que fornece sugestões para a coleta e análise simultânea de dados de MEG e HD-EEG, bem como para a realização de EMSI em epilepsia pediátrica para a identificação não invasiva da zona irritativa, SOZ e áreas cerebrais eloquentes, ou seja, córtices primários visuais, motores, auditivos e somatossensoriais.
Aqui, realizamos EMSI em picos interictais e eventos ictais detectados em dados não invasivos simultâneos de dois pacientes com EDR (Casos 1 e 2) e obtivemos um erro de localização da fonte de ~ 9 mm e ~ 12 mm do SOZ, respectivamente, em linha com estudos anteriores42. Impressionantemente, esse método alcançou uma precisão de localização comparável aos achados intracranianos (ou seja, ESI em dados de iEEG), com dipolos agrupados localizados na área do cérebro identificados como epileptogênicos pelas observações clínicas (Figura 3C e Figura 4B). Usando dados não invasivos de um terceiro paciente representativo com EDR (Caso 3), também realizamos EMSI em atividades evocadas visuais, motoras, auditivas e somatossensoriais e encontramos padrões proeminentes de ativação de fontes nas áreas cerebrais eloquentes correspondentes (ou seja, córtices visual, motor, auditivo e somatossensorial) (Figura 5C, Figura 6C, Figura 7C e Figura 8C).
Nossos resultados foram derivados da fusão de informações complementares capturadas das modalidades MEG e EEG que podem melhorar a precisão da localização. O EEG é bem conhecido por refletir todas as correntes intracranianas, enquanto o MEG é mais sensível a fontes tangenciais e cego a fontes cerebrais profundas29,74. Conforme mostrado neste estudo, a combinação de MEG e EEG pode, portanto, superar as limitações de cada modalidade, fornecer resultados de localização superiores e identificar áreas cerebrais epileptogênicas e eloquentes que ESI ou MSI podem ter perdido se usadas isoladamente. Além disso, apresentamos uma abordagem alternativa não invasiva para mapear áreas cerebrais eloquentes usando EMSI naqueles pacientes que não foram submetidos a fMRI durante a avaliação pré-cirúrgica.
A localização de áreas cerebrais epileptogênicas e eloquentes por meio de técnicas não invasivas, como MEG e EEG simultâneos, é uma etapa essencial durante a avaliação pré-cirúrgica de crianças com EDR para remoção ou desconexão completa da EZ, preservando áreas corticais eloquentes. A metodologia proposta oferece uma descrição detalhada da aquisição e análise de dados simultâneos de MEG e EEG que apóiam sua aplicação não apenas na avaliação pré-cirúrgica da epilepsia, mas também em neurociências cognitivas para explorar as funções fisiológicas do cérebro saudável em crianças com desenvolvimento típico e adultos saudáveis, bem como alterações cerebrais morfológicas e funcionais associadas à epilepsia ou outros distúrbios neurológicos. Estudos futuros que investigam redes cerebrais epileptogênicas também podem avaliar se os hubs de rede (ou seja, regiões cerebrais altamente conectadas) estimados de forma não invasiva usando EMSI em dados simultâneos de MEG e HD-EEG podem localizar com mais precisão o EZ em crianças com DRE do que aqueles estimados usando MSI e / ou ESI sozinho75 , 76 , 77. Além disso, o mapeamento não invasivo das propagações espaço-temporais de picos e ondulações (ou seja, oscilações de alta frequência, >80 Hz), estimadas por meio de EMSI, pode ajudar a entender melhor os mecanismos fisiopatológicos da propagação da atividade epileptiforme e avaliar de forma não invasiva o gerador de início dessas propagações que é um biomarcador preciso do EZ78,79. O protocolo apresentado pode ajudar a investigar ainda mais a complementaridade dos sistemas MEG e EEG, examinando a sensibilidade das matrizes de sensores MEG e EEG a fontes de diferentes orientações. Essa análise pode fornecer informações sobre as propriedades eletrofisiológicas do cérebro durante a realização simultânea de MEG e HD-EEG.
Divulgações
Os autores não relatam divulgações.
Agradecimentos
Este trabalho foi apoiado pelo Instituto Nacional de Distúrbios Neurológicos e Derrame (R01NS104116; R01NS134944; Investigador principal: Christos Papadelis).
Materiais
| Name | Company | Catalog Number | Comments |
| AIRSTIM unit | SD Instruments | N/A | The SDI AIRSTIM system is an alternative unconditioned stimulus to shock |
| Baby Shampoo | Johnson's | N/A | Baby Shampoo is as gentle to the eyes as pure water and is specially designed to gently cleanse baby’s delicate hair and scalp. |
| Control III disinfectant cleaning solution | Maril Products, Inc. | http://www.controlthree.com/ | Disinfectant and germicide solution formulated for hospitals |
| Elekta Neuromag | TRIUX | NM24132A | Comprehensive bioelectromagnetic measurement system characterized by 306-channel neuromagnetometer for functional brain studies |
| FASTRAK | Polhemus technology | NS-7806 | Using A/C electromagnetic technology, FASTRAK delivers accurate position and orientation data, with virtually no latency. With a single magnetic source, FASTRAK delivers data for up to four sensors. The source emits an electromagnetic field, sensors within the field of range are tracked in full 6DOF (6 Degrees-Of-Freedom). Setup is simple and intuitive, with no user calibration required. |
| Genuine Grass Reusable Cup EEG Electrodes | Natus Medical, Inc. | N/A | Each Genuine Grass EEG Electrode undergoes rigorous mechanical and electrical testing to assure long life for unsurpassed recording clarity and dependability. |
| Geodesic Sensor Net | Electrical Geodesics, Inc. | S-MAN-200-GSNR-001 | 32 to 256 electrodes to place on the human head to aquire dense-array electroencephalography data |
| GeoScan Sensor Digitization System | Electrical Geodesics, Inc. | 8100550-03 | Handheld Scanner and Software for 3D electrode position registration |
| Natus Xltek NeuroWorks | Natus Medical, Inc. | https://natus.com/ | The Natus NeuroWorks platform simplifies the process of collecting, monitoring and managing data for routine EEG testing, ambulatory EEG, long-term monitoring, ICU monitoring, and research studies. |
| Natus NeuroWorks EEG Software | Natus Medical, Inc. | https://natus.com/neuro/neuroworks-eeg-software/ | NeuroWorks EEG software simplifies the process of collecting, monitoring, trending and managing EEG testing data, allowing care providers to save time and focus on delivering the best care. |
| ROSA ONE Brain | Zimmer Biomet | https://www.zimmerbiomet.com/en/products-and-solutions/zb-edge/robotics/rosa-brain.html | ROSA ONE Brain is a robotic solution to assist surgeons in planning and performing complex neurosurgical procedures through a small drill hole in the skull. |
| Ten20 Conductive Paste | Weaver and company | N/A | Ten20 contains the right balance of adhesiveness and conductivity, enabling the electrodes to remain in place while allowing the transmittance of electrical signals. |
Referências
- Oldham, M. S., Horn, P. S., Tsevat, J., Standridge, S. Costs and clinical outcomes of epilepsy surgery in children with drug-resistant epilepsy. Pediatr Neurol. 53 (3), 216-220 (2015).
- Willie, J. T., et al. Real-time magnetic resonance-guided stereotactic laser amygdalohippocampotomy for mesial temporal lobe epilepsy. Neurosurgery. 74 (6), 569-584 (2014).
- Rosenow, F., Lüders, H. Presurgical evaluation of epilepsy. Brain. 124, Pt 9 1683-1700 (2001).
- Önal, Ç, et al. Complications of invasive subdural grid monitoring in children with epilepsy). J Neurosurg. 98 (5), 1017-1026 (2003).
- Hader, W. J., et al. Complications of epilepsy surgery-a systematic review of focal surgical resections and invasive EEG monitoring. Epilepsia. 54 (5), 840-847 (2013).
- Meng, Y., et al. Risk factors for surgical site infection after intracranial electroencephalography monitoring for epilepsy in the pediatric population. J Neurosurg Pediatr. 22 (1), 31-36 (2018).
- Jobst, B. C., et al. Intracranial EEG in the 21st Century. Epilepsy Curr. 20 (4), 180-188 (2020).
- Schwartz, E. S., et al. Magnetoencephalography for pediatric epilepsy: how we do it. AJNR Am J Neuroradiol. 29 (5), 832-837 (2008).
- Michel, C. M., et al. Electric source imaging of human brain functions. Brain Res Rev. 36 (2-3), 108-118 (2001).
- Michel, C. M., He, B. EEG source localization. Handb Clin Neurol. 160, 85-101 (2019).
- Michel, C. M., Brunet, D. EEG source imaging: A practical review of the analysis steps. Front Neurol. 10, 325(2019).
- Plummer, C., et al. Interictal and ictal source localization for epilepsy surgery using high-density EEG with MEG: a prospective long-term study. Brain. 142 (4), 932-951 (2019).
- Duez, L., et al. Electromagnetic source imaging in presurgical workup of patients with epilepsy: A prospective study. Neurology. 92 (6), e576-e586 (2019).
- Mouthaan, B. E., et al. Diagnostic accuracy of interictal source imaging in presurgical epilepsy evaluation: A systematic review from the E-PILEPSY consortium. Clin Neurophysiol. 130 (5), 845-855 (2019).
- Pellegrino, G., et al. Clinical yield of magnetoencephalography distributed source imaging in epilepsy: A comparison with equivalent current dipole method. Hum Brain Mapp. 39 (1), 218-231 (2018).
- Tamilia, E., et al. Assessing the localization accuracy and clinical utility of electric and magnetic source imaging in children with epilepsy. Clin Neurophysiol. 130 (4), 491-504 (2019).
- Coito, A., et al. Interictal epileptogenic zone localization in patients with focal epilepsy using electric source imaging and directed functional connectivity from low-density EEG. Epilepsia Open. 4 (2), 281-292 (2019).
- Singh, J., Ebersole, J. S., Brinkmann, B. H. From theory to practical fundamentals of electroencephalographic source imaging in localizing the epileptogenic zone. Epilepsia. 63 (10), 2476-2490 (2022).
- Brodbeck, V., et al. Electrical source imaging for presurgical focus localization in epilepsy patients with normal MRI. Epilepsia. 51 (4), 583-591 (2010).
- Santalucia, R., et al. Clinical added value of interictal automated electrical source imaging in the presurgical evaluation of MRI-negative epilepsy: A real-life experience in 29 consecutive patients. Epilepsy Behav. 143, 109229(2023).
- Schneider, F., et al. Magnetic source imaging in non-lesional neocortical epilepsy: additional value and comparison with ICEEG. Epilepsy Behav. 24 (2), 234-240 (2012).
- Hämäläinen, M., Hari, R., Ilmoniemi, R. J., Knuutila, J., Lounasmaa, O. V. Magnetoencephalography-theory, instrumentation, and applications to noninvasive studies of the working human brain. Rev Mod Phys. 65, 413-497 (1993).
- Baillet, S., Mosher, J. C., Leahy, R. M. Electromagnetic brain mapping. IEEE Signal Process Mag. 18 (6), 14-30 (2001).
- Fuchs, M., Kastner, J., Tech, R., Wagner, M., Gasca, F. MEG and EEG dipole clusters from extended cortical sources. Biomed Eng Lett. 7 (3), 185-191 (2017).
- Singh, S. P. Magnetoencephalography: Basic principles. Ann Indian Acad Neurol. 17, Suppl 1 S107-S112 (2014).
- Ahlfors, S. P., Han, J., Belliveau, J. W., Hämäläinen, M. S. Sensitivity of MEG and EEG to source orientation. Brain Topogr. 23, 227-232 (2010).
- Kim, H., Chung, C. K., Hwang, H. Magnetoencephalography in pediatric epilepsy. Korean J Pediatr. 56 (10), 431-438 (2013).
- Gorjan, D., Gramann, K., De Pauw, K., Marusic, U. Removal of movement-induced EEG artifacts: Current state of the art and guidelines. J Neural Eng. , (2022).
- Barkley, G. L., Baumgartner, C. MEG and EEG in epilepsy. J Clin Neurophysiol. 20 (3), 163-178 (2003).
- Ebersole, J. S., Ebersole, S. M. Combining MEG and EEG source modeling in epilepsy evaluations. J Clin Neurophysiol. 27 (6), 360-371 (2010).
- Yoshinaga, H., et al. Benefit of simultaneous recording of EEG and MEG in dipole localization. Epilepsia. 43 (8), 924-928 (2002).
- Baumgartner, C. Controversies in clinical neurophysiology. MEG is superior to EEG in the localization of interictal epileptiform activity: Con. Clin Neurophysiol. 115 (5), 1010-1020 (2004).
- Barkley, G. L. Controversies in neurophysiology. MEG is superior to EEG in localization of interictal epileptiform activity: Pro. Clin Neurophysiol. 115 (5), 1001-1009 (2004).
- Braeutigam, S. Magnetoencephalography: Fundamentals and established and emerging clinical applications in radiology. ISRN Radiol. 2013, 529463(2013).
- Papadelis, C., et al. Current and emerging potential for magnetoencephalography in pediatric epilepsy. J Pediatr Epilepsy. 2 (1), 73-85 (2013).
- Fiedler, P., Fonseca, C., Supriyanto, E., Zanow, F., Haueisen, J. A high-density 256-channel cap for dry electroencephalography. Hum Brain Mapp. 43 (4), 1295(2022).
- Sharon, D., Hämäläinen, M. S., Tootell, R. B. H., Halgren, E., Belliveau, J. W. The advantage of combining MEG and EEG: comparison to fMRI in focally-stimulated visual cortex. Neuroimage. 36 (4), 1225(2007).
- Pataraia, E., Lindinger, G., Deecke, L., Mayer, D., Baumgartner, C. Combined MEG/EEG analysis of the interictal spike complex in mesial temporal lobe epilepsy. Neuroimage. 24 (3), 607-614 (2005).
- Ahmed Mahmutoglu, M., Rupp, A., Baumgärtner, U. Simultaneous EEG/MEG yields complementary information of nociceptive evoked responses. Clin Neurophysiol. 143, 21-35 (2022).
- Aydin, Ü, et al. Combined EEG/MEG can outperform single modality EEG or MEG source reconstruction in presurgical epilepsy diagnosis. PLoS One. 10 (3), e0118753(2015).
- Bast, T., et al. Combined EEG and MEG analysis of early somatosensory evoked activity in children and adolescents with focal epilepsies. Clin Neurophysiol. 118 (8), 1721-1735 (2007).
- Chikara, R. K., et al. Electromagnetic source imaging predicts surgical outcome in children with focal cortical dysplasia. Clin Neurophysiol. 153, 88-101 (2023).
- Hari, R., et al. IFCN-endorsed practical guidelines for clinical magnetoencephalography (MEG). Clin Neurophysiol. 129 (8), 1720-1747 (2018).
- Bagić, A. I., Knowlton, R. C., Rose, D. F., Ebersole, J. S. American Clinical Magnetoencephalography Society Clinical Practice Guideline 1: Recording and analysis of spontaneous cerebral activity. J Clin Neurophysiol. 28 (4), 348-354 (2011).
- Papadelis, C., Chen, Y. H. Pediatric magnetoencephalography in clinical practice and research. Neuroimaging Clin N Am. 30 (2), 239-248 (2020).
- De Macedo Rodrigues, K., et al. A FreeSurfer-compliant consistent manual segmentation of infant brains spanning the 0-2 year age range. Front Hum Neurosci. 9, 21(2015).
- Tadel, F., Baillet, S., Mosher, J. C., Pantazis, D., Leahy, R. M. Brainstorm: A user-friendly application for MEG/EEG analysis. Comput Intell Neurosci. 2011, 879716(2011).
- Kane, N., et al. A revised glossary of terms most commonly used by clinical electroencephalographers and updated proposal for the report format of the EEG findings. Revision 2017. Clin Neurophysiol Pract. 2, 170-185 (2017).
- Lantz, G., et al. Propagation of interictal epileptiform activity can lead to erroneous source localizations: a 128-channel EEG mapping study. J Clin Neurophysiol. 20 (5), 311-319 (2003).
- Vorwerk, J., et al. A guideline for head volume conductor modeling in EEG and MEG. Neuroimage. 100, 590-607 (2014).
- Schrader, S., et al. DUNEuro-A software toolbox for forward modeling in bioelectromagnetism. PLoS One. 16 (6), e0252431(2021).
- Ntolkeras, G., et al. Presurgical accuracy of dipole clustering in MRI-negative pediatric patients with epilepsy: Validation against intracranial EEG and resection. Clin Neurophysiol. 141, 126-138 (2022).
- David, O., Kilner, J. M., Friston, K. J. Mechanisms of evoked and induced responses in MEG/EEG. Neuroimage. 31, 1580-1591 (2006).
- Pantev, C. Evoked and induced gamma-band activity of the human cortex. Brain Topogr. 7 (4), 321-330 (1995).
- Fox, N. A., et al. Assessing human mirror activity with EEG mu rhythm: A meta-analysis. Psychol Bull. 142 (3), 291-313 (2016).
- Genzer, S., Ong, D. C., Zaki, J., Perry, A. Mu rhythm suppression over sensorimotor regions is associated with greater empathic accuracy. Soc Cogn Affect Neurosci. 17 (9), 788-801 (2022).
- Janmohamed, M., et al. Moving the field forward: detection of epileptiform abnormalities on scalp electroencephalography using deep learning-clinical application perspectives. Brain Commun. 4 (5), 218(2022).
- Bagheri, E., Jin, J., Dauwels, J., Cash, S., Westover, M. B. A fast machine learning approach to facilitate the detection of interictal epileptiform discharges in the scalp electroencephalogram. J Neurosci Methods. 326, 108362(2019).
- Thomas, J., et al. Automated detection of interictal epileptiform discharges from scalp electroencephalograms by convolutional neural networks. Int J Neural Syst. 30 (11), 2050030(2020).
- Zijlmans, M., Zweiphenning, W., van Klink, N. Changing concepts in presurgical assessment for epilepsy surgery. Nat Rev Neurol. 15 (10), 594-606 (2019).
- Akiyama, T., et al. Focal resection of fast ripples on extraoperative intracranial EEG improves seizure outcome in pediatric epilepsy. Epilepsia. 52 (10), 1802-1811 (2011).
- Duncan, J. S., Winston, G. P., Koepp, M. J., Ourselin, S. Brain imaging in the assessment for epilepsy surgery. Lancet Neurol. 15 (4), 420(2016).
- Jacobs, J., et al. High-frequency electroencephalographic oscillations correlate with outcome of epilepsy surgery. Ann Neurol. 67 (2), 209-220 (2010).
- Ricci, L., et al. Virtual implantation using conventional scalp EEG delineates seizure onset and predicts surgical outcome in children with epilepsy. Clin Neurophysiol. 139, 49-57 (2022).
- Stefan, H., Rampp, S. Interictal and Ictal MEG in presurgical evaluation for epilepsy surgery. Acta Epileptologica. 2, 11(2020).
- Jahangiri, F. R., Chima, G. S., Pearson, M., Jackson, J., Siddiqui, A. A. Mapping of the language cortex. Cureus. 13 (5), e14960(2021).
- Merrifield, W. S., Simos, P. G., Papanicolaou, A. C., Philpott, L. M., Sutherling, W. W. Hemispheric language dominance in magnetoencephalography: sensitivity, specificity, and data reduction techniques. Epilepsy Behav. 10 (1), 120-128 (2007).
- Wheless, J. W., et al. Magnetoencephalography (MEG) and magnetic source imaging (MSI). Neurologist. 10 (3), 138-153 (2004).
- Breier, J. I., Simos, P. G., Zouridakis, G., Papanicolaou, A. C. Lateralization of activity associated with language function using magnetoencephalography: a reliability study. J Clin Neurophysiol. 17 (5), 503-510 (2000).
- Pataraia, E., Baumgartner, C., Lindinger, G., Deecke, L. Magnetoencephalography in presurgical epilepsy evaluation. Neurosurg Rev. 25 (3), 141-159 (2002).
- Babajani-Feremi, A., et al. Language mapping using high gamma electrocorticography, fMRI, and TMS versus electrocortical stimulation. Clin Neurophysiol. 127 (3), 1822-1836 (2016).
- Brodbeck, V., et al. Electroencephalographic source imaging: a prospective study of 152 operated epileptic patients. Brain. 134, Pt 10 2887-2897 (2011).
- Sohrabpour, A., et al. Effect of EEG electrode number on epileptic source localization in pediatric patients. Clin Neurophysiol. 126 (3), 472-480 (2015).
- Laohathai, C., et al. Practical fundamentals of clinical MEG interpretation in epilepsy. Front Neurol. 12, 722986(2021).
- Corona, L., et al. Mapping functional connectivity of epileptogenic networks through virtual implantation. Proceedings of the Annu Int Conf IEEE Eng Med Biol Soc. 2021, 408-411 (2021).
- Corona, L., et al. Non-invasive mapping of epileptogenic networks predicts surgical outcome. Brain. 146 (5), 1916-1931 (2023).
- Rijal, S., et al. Functional connectivity discriminates epileptogenic states and predicts surgical outcome in children with drug resistant epilepsy. Sci Rep. 13 (1), 9622(2023).
- Tamilia, E., et al. Noninvasive mapping of ripple onset predicts outcome in epilepsy surgery. Ann Neurol. 89 (5), 911-925 (2021).
- Matarrese, M. A. G., et al. Spike propagation mapping reveals effective connectivity and predicts surgical outcome in epilepsy. Brain. 146 (9), 3898-3912 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados