Method Article
Imágenes de fuente electromagnética en la evaluación prequirúrgica de niños con epilepsia resistente a los medicamentos
En este artículo
Resumen
La magnetoencefalografía (MEG) y la electroencefalografía de alta densidad (HD-EEG) rara vez se registran simultáneamente, aunque proporcionan información confirmatoria y complementaria. En este artículo, ilustramos la configuración experimental para el registro simultáneo de MEG y HD-EEG y la metodología para analizar estos datos con el objetivo de localizar áreas cerebrales epileptógenas y elocuentes en niños con epilepsia resistente a los medicamentos.
Resumen
Para los niños con epilepsia resistente a los medicamentos (DRE), la ausencia de convulsiones se basa en la delineación y resección (o ablación/desconexión) de la zona epileptógena (EZ) mientras se preservan las áreas cerebrales elocuentes. Por lo tanto, el desarrollo de un método de localización fiable y no invasivo que proporcione información clínicamente útil para la localización de la EZ es crucial para lograr resultados quirúrgicos exitosos. Las imágenes de fuente eléctrica y magnética (ESI y MSI) se han utilizado cada vez más en la evaluación prequirúrgica de estos pacientes, mostrando hallazgos prometedores en la delineación de áreas cerebrales epileptógenas y elocuentes. Además, la combinación de ESI y MSI en una sola solución, a saber, imágenes de fuente electromagnética (EMSI), realizadas en registros simultáneos de electroencefalografía de alta densidad (HD-EEG) y magnetoencefalografía (MEG), ha demostrado una mayor precisión en la localización de la fuente que cualquiera de las dos modalidades por separado. A pesar de estos hallazgos alentadores, estas técnicas se realizan solo en unos pocos centros terciarios de epilepsia, rara vez se registran simultáneamente y están infrautilizadas en las cohortes pediátricas. Este estudio ilustra la configuración experimental para el registro simultáneo de datos de MEG y HD-EEG, así como el marco metodológico para analizar estos datos con el objetivo de localizar la zona irritativa, la zona de inicio de las convulsiones y las áreas cerebrales elocuentes en niños con EDR. Más específicamente, se presentan las configuraciones experimentales para (i) registrar y localizar la actividad interictal e ictal epileptiforme durante el sueño y (ii) registrar las respuestas evocadas visuales, motoras, auditivas y somatosensoriales y mapear áreas cerebrales elocuentes relevantes (es decir, visual, motora, auditiva y somatosensorial) durante la tarea visomotora, así como las estimulaciones auditivas y somatosensoriales. A continuación, se presentan los pasos detallados de la canalización de análisis de datos para realizar EMSI, así como ESI y MSI individuales utilizando un dipolo de corriente equivalente (ECD) y un mapeo estadístico paramétrico dinámico (dSPM).
Introducción
La epilepsia es uno de los trastornos neurológicos más comunes e incapacitantes, caracterizado por convulsiones recurrentes y no provocadas que pueden ser de naturaleza focal o generalizada. A pesar de la disponibilidad de varias terapias farmacológicas efectivas (por ejemplo, medicamentos anticonvulsivos [ASM]), alrededor del 20-30% de estos pacientes no pueden controlar sus convulsiones y sufren de epilepsia resistente a los medicamentos (DRE)1. Para estos pacientes, la cirugía de la epilepsia es el tratamiento más eficaz para eliminar las convulsiones; una cirugía exitosa puede lograrse a través de la resección completa (o ablación/desconexión) de la zona epileptógena (EZ), definida como el área mínima indispensable para la generación de convulsiones2. La delineación y resección precisas (o ablación/desconexión) de la EZ, preservando la corteza elocuente, son factores cruciales para garantizar la ausencia de convulsiones. Para establecer la candidatura quirúrgica, un equipo multidisciplinario utiliza varias herramientas diagnósticas no invasivas para definir diferentes áreas corticales (es decir, zona irritativa, zona de inicio de convulsiones [SOZ], zona de déficit funcional y lesión epileptógena), que sirven como aproximadores indirectos de la EZ3. Se requiere monitorización extraoperatoria con EEG intracraneal (iEEG) cuando ninguno de estos métodos identifica inequívocamente la EZ. La función del iEEG es definir con precisión la EZ mediante la localización de la SOZ (es decir, el área del cerebro donde se generan las convulsiones clínicas) y mapear áreas cerebrales elocuentes. Sin embargo, presenta serias limitaciones debido a su invasividad 4,5,6, ofrece una cobertura espacial limitada y necesita una hipótesis clara de localización prequirúrgica7. Como resultado, es posible que se pase por alto el enfoque real y la extensión de la SOZ, lo que lleva a una cirugía infructuosa. Además, su interpretación requiere el registro de múltiples convulsiones clínicas estereotipadas durante varios días de hospitalización, lo que aumenta las posibilidades de complicaciones (por ejemplo, infección y/o sangrado)5. Por lo tanto, existe una necesidad insatisfecha de desarrollar métodos de localización confiables y no invasivos que puedan proporcionar información clínicamente útil y, en general, mejorar la evaluación prequirúrgica de los niños con EDR.
En las últimas décadas, las imágenes de fuentes eléctricas y magnéticas (ESI y MSI) se han utilizado cada vez más en la evaluación prequirúrgica de pacientes con DRE para la delineación de áreas cerebrales epileptógenas y funcionales. En particular, ESI y MSI permiten la reconstrucción de fuentes neuronales a partir de registros no invasivos, como el EEG DE ALTA DENSIDAD (HD-EEG) y la magnetoencefalografía (MEG), para ayudar a guiar la planificación quirúrgica o la colocación de electrodos iEEG. La ESI y la MSI se pueden aplicar para localizar las descargas epileptiformes interictales (IED), como picos y ondas agudas, o la actividad ictal (convulsiones). Además, se puede utilizar para la localización de diferentes áreas funcionales del cerebro involucradas en las funciones sensoriales, motoras, auditivas y cognitivas. La reconstrucción de eventos electrofisiológicos, como los IED y las convulsiones, permite la identificación de la zona irritativa (es decir, el área del cerebro donde se originan los IED) y la SOZ, respectivamente, que se consideran un sustituto válido para la localización de la EZ. La localización de la corteza elocuente (es decir, las áreas cerebrales indispensables para las funciones corticales definidas)3 permite, en cambio, mapear la ubicación y extensión de las áreas elocuentes con respecto a la resección planificada y, por lo tanto, reducir de antemano los posibles déficits funcionales que pueden esperarse de la cirugía de la epilepsia 8,9,10,11 . Varios estudios investigaron la utilidad clínica de ESI y/o MSI en la evaluación prequirúrgica de la epilepsia, y mostraron hallazgos prometedores en la delimitación de la EZ 12,13,14,15,16,17,18,19. Por ejemplo, Mouthaan et al.14 realizaron un extenso meta-análisis utilizando datos no invasivos de 11 estudios prospectivos y retrospectivos de epilepsia e informaron que estas técnicas de localización de fuentes pueden identificar en general la EZ con alta sensibilidad (82%) y baja especificidad (53%). Otros estudios también demostraron que la MSI y la ESI pueden localizar correctamente el foco epiléptico dentro del área resecada en pacientes epilépticos con una resonancia magnética (RM) normal19,20,21. Estos resultados de localización son particularmente importantes para aquellos pacientes que no son elegibles para la cirugía de epilepsia debido a hallazgos clínicos o de imagen no concluyentes. En resumen, ESI y MSI pueden contribuir significativamente al mapeo prequirúrgico de áreas cerebrales epileptógenas y funcionales en pacientes con DRE.
A pesar de estos hallazgos alentadores, estas técnicas se realizan actualmente solo en unos pocos centros terciarios de epilepsia de forma regular y, a menudo, se infrautilizan en las poblaciones pediátricas. Además, la HD-EEG y la MEG rara vez se registran simultáneamente, aunque proporcionan información confirmatoria y complementaria. La MEG es sensible para detectar fuentes superficiales con orientación tangencial, pero es ciega a las fuentes orientadas radialmente localizadas en las circunvoluciones o áreas más profundas del cerebro 22,23,24,25,26. Además, el MEG proporciona una mejor resolución espacial (milímetros) en comparación con el EEG 16,22,25. A diferencia de las señales de EEG, las señales de MEG no tienen referencias y esencialmente no se ven afectadas por las diferentes conductividades de los tejidos cerebrales (es decir, meninges, líquido cefalorraquídeo, cráneo y cuero cabelludo)25,27 proporcionando mediciones no distorsionadas de los campos magnéticos producidos por el cerebro. Por otro lado, el EEG puede detectar fuentes de todas las orientaciones, pero ofrece una resolución espacial más baja que el MEG y es más susceptible a los artefactos26,28. Debido a estas sensibilidades complementarias a la orientación y profundidad de la fuente, aproximadamente el 30% de la actividad epileptiforme (por ejemplo, IED) solo se puede registrar en MEG pero no en EEG, y viceversa 26,29,30,31,32. A diferencia del EEG, que permite registros prolongados, la captura de las convulsiones clínicas con MEG es un desafío debido al tiempo de registro restringido que generalmente es insuficiente para registrar los eventos ictales en la mayoría de los pacientes. Además, los artefactos causados por los movimientos de la cabeza relacionados con las convulsiones a menudo pueden interferir con la calidad de las grabaciones de MEG 29,33,34,35. Por otro lado, los registros de MEG son más rápidos y fáciles en comparación con el EEG, especialmente en los niños, ya que no es necesario colocar sensores sobre la cabeza de los niños35.
Los avances en hardware han hecho posible registrar simultáneamente datos MEG y HD-EEG con un gran número de sensores (más de 550 sensores) que cubren toda la cabeza. Además, los avances modernos en las tecnologías de EEG han minimizado el tiempo de preparación para el HD-EEG a menos de un cuarto de hora36. Esto es particularmente importante para las poblaciones pediátricas con comportamientos desafiantes que no pueden permanecer quietas durante períodos prolongados. Además, los avances en las tecnologías de software han permitido la combinación de ESI y MSI en una única solución, a saber, la obtención de imágenes de fuente electromagnética (EMSI), realizadas en grabaciones simultáneas de HD-EEG y MEG. Varios estudios teóricos y empíricos informaron una mayor precisión en la localización de fuentes con EMSI que con cualquiera de las modalidades solas 13,30,31,37,38,39,40,41. Utilizando diferentes enfoques de localización de fuentes para reconstruir la actividad en respuesta a estímulos sensoriales, Sharon et al.37 encontró que EMSI tuvo resultados de localización consistentemente mejores que ESI o MSI solo en comparación con la resonancia magnética funcional (fMRI), que sirve como punto de referencia no invasivo de precisión de localización precisa. Los autores sugirieron que esta localización mejorada se debe al mayor número de sensores para resolver la solución inversa y a los diferentes patrones de sensibilidad de las dos modalidades de imagen37. De manera similar, Yoshinaga et al.31 realizaron análisis dipolares en datos simultáneos de EEG y MEG de pacientes con epilepsia intratable relacionada con la localización y mostraron que EMSI proporcionó información que no se podría obtener utilizando solo una modalidad y condujo a una localización exitosa para la cirugía de epilepsia en uno de los pacientes analizados. En un estudio prospectivo ciego, Duez et al.13 mostraron que la EMSI logró un odds ratio significativamente mayor (es decir, probabilidad de dejar de sufrir convulsiones) en comparación con la ESI y la MSI, una precisión de localización ≥52% y una concordancia ≥53% y ≥36% con el irritativo y el SOZ, respectivamente. Un estudio más reciente de nuestro grupo42 ha demostrado que EMSI proporcionó estimaciones de localización superiores y un mejor rendimiento de predicción de resultados que ESI o MSI solos, con errores de localización de resección y SOZ de ~ 8 mm y ~ 15 mm, respectivamente. A pesar de estos hallazgos prometedores, faltan estudios que proporcionen el marco metodológico sobre la EMSI en niños con EDR.
Este estudio ilustra la configuración experimental para realizar registros simultáneos de MEG y HD-EEG, así como el marco metodológico para analizar estos datos con el objetivo de localizar la zona irritativa, SOZ y áreas cerebrales elocuentes en niños con DRE. Más específicamente, se presentan las configuraciones experimentales para (i) registrar y localizar la actividad interictal e ictal epileptiforme durante el sueño y (ii) registrar las respuestas evocadas visuales, motoras, auditivas y somatosensoriales y mapear áreas cerebrales elocuentes relevantes (es decir, visual, motora, auditiva y somatosensorial) durante una tarea visomotora, así como estimulaciones auditivas y somatosensoriales. A continuación, se presentan los pasos detallados de la canalización de análisis de datos para realizar EMSI, así como ESI y MSI individuales utilizando un dipolo de corriente equivalente (ECD) y un mapeo estadístico paramétrico dinámico (dSPM).
Protocolo
Los procedimientos experimentales aplicados aquí han sido aprobados por la Junta de Revisión Institucional Regional del Norte de Texas (2019-166; Investigador Principal: Christos Papadelis). En la siguiente sección se describirá el protocolo experimental para la localización no invasiva de fuentes de IED, inicios ictales y respuestas evocadas por eventos (es decir, visuales, motoras, auditivas y somatosensoriales) utilizando registros simultáneos de MEG y HD-EEG seguidos en nuestro laboratorio. La Federación Internacional de Neurofisiología Clínica43 y la Sociedad Americana de MEGClínica 44 han proporcionado "estándares mínimos" para el registro clínico de rutina y el análisis de datos espontáneos de MEG y EEG. Los procedimientos para los registros de HD-EEG descritos aquí se aplican solo a los sistemas de electrodos de EEG basados en esponja. El proceso general de preparación para cada tema es de aproximadamente 2-3 h, comprendiendo las grabaciones reales de ~ 1.5 h.
1. Preparación del sistema MEG
- Antes de la llegada del sujeto, realice una grabación MEG en una habitación vacía de unos minutos para capturar los niveles de ruido de fondo y los artefactos magnéticos y comprobar que todos los sensores MEG funcionan correctamente.
- Utilizando el programa de ajuste de sensores MEG, asegúrese de que el valor medio de ruido blanco de todos los sensores MEG esté entre 2 y 5 fT/√Hz (fT/cm√Hz para los gradiómetros).
2. Preparación de la asignatura
- Asegúrese de que el sujeto se sienta cómodo con el entorno. En el caso de los niños pequeños, permítales explorar la sala de grabación (incluida la sala con blindaje magnético [MSR]) y ver el equipo de prueba que se utilizará para la adquisición de datos.
- Evalúe y proporcione instrucciones al sujeto utilizando el formulario de consentimiento para la evaluación. Si es necesario, explique el procedimiento a los niños pequeños usando palabras, juguetes y juegos especiales desarrollados para cada grupo de edad. Pregúntele al sujeto (o a los padres del sujeto) si tuvo una convulsión dentro de las últimas ~ 2 horas antes de la visita.
NOTA: El formulario de consentimiento para la prueba de detección incluye una descripción de la prueba, así como su seguridad, por qué se realiza la prueba y una descripción general del estudio.
- Evalúe y proporcione instrucciones al sujeto utilizando el formulario de consentimiento para la evaluación. Si es necesario, explique el procedimiento a los niños pequeños usando palabras, juguetes y juegos especiales desarrollados para cada grupo de edad. Pregúntele al sujeto (o a los padres del sujeto) si tuvo una convulsión dentro de las últimas ~ 2 horas antes de la visita.
- Retire cualquier material metálico y/o magnético del sujeto y proporciónele ropa adecuada proporcionada por el hospital (p. ej., batas de hospital, uniformes médicos). Además, pida al sujeto que se quite los zapatos para evitar que el polvo magnético entre en el MSR. Si no se pueden extraer otros elementos ferromagnéticos, como obras dentales o dispositivos médicos implantados, utilice un desmagnetizador (es decir, un desmagnetizador) para eliminar los artefactos magnéticos residuales que pueden causar interferencias o altos niveles de ruido durante las grabaciones de MEG. Después de asegurarse de que se han eliminado todas las fuentes de ruido magnético, pida al sujeto que se siente y se siente cómodo en una silla de madera donde se aplicarán los siguientes procedimientos de medición.
NOTA: El desmagnetizador no debe aplicarse directamente a ningún dispositivo electrónico implantado (por ejemplo, marcapasos, dispositivos de neuromodulación). - Mida la circunferencia de la cabeza del sujeto para seleccionar el tamaño neto de EEG apropiado (generalmente de 32-34 cm hasta 58-61 cm). Usando el lado del centímetro de la cinta métrica, mida la circunferencia de la cabeza sosteniendo la cinta desde la posición del sujeto hasta ~ 1 cm por encima de la entrada y luego de regreso a la conexión.
NOTA: El nasión es el punto craneométrico entre los ojos, mientras que el pion es la punta de la protuberancia occipital externa.- Seleccione el tamaño de red correcto que se ajuste a la circunferencia de la cabeza del sujeto y sumérjalo durante al menos 5 minutos (10 minutos como máximo) en una solución líquida mixta compuesta por 1 cuarto de galón de agua tibia del grifo, 1 cucharada de electrolitos (es decir, cloruro de potasio) y 1 cucharada de champú para bebés. Durante este proceso de remojo, asegúrese de que la red esté al revés con las esponjas hacia afuera y los broches completamente aflojados para sumergir completamente los sensores dentro del cubo de plástico que contiene la solución.
NOTA: Para asegurarse de que el amplificador de la red no se acerque a la solución y permanezca siempre seco, envuelva una toalla alrededor del tapón de la red seleccionada y, si lo prefiere, colóquelo en una silla o soporte cerca del fregadero donde está el cubo de plástico.
- Seleccione el tamaño de red correcto que se ajuste a la circunferencia de la cabeza del sujeto y sumérjalo durante al menos 5 minutos (10 minutos como máximo) en una solución líquida mixta compuesta por 1 cuarto de galón de agua tibia del grifo, 1 cucharada de electrolitos (es decir, cloruro de potasio) y 1 cucharada de champú para bebés. Durante este proceso de remojo, asegúrese de que la red esté al revés con las esponjas hacia afuera y los broches completamente aflojados para sumergir completamente los sensores dentro del cubo de plástico que contiene la solución.
- Coloque cinco bobinas magnéticas que sirven como bobinas indicadoras de posición de la cabeza (HPI) en lugares conocidos directamente en el cuero cabelludo del sujeto usando cinta de papel de microporos: una a cada lado de la frente cerca de la línea del cabello, una en cada hueso mastoideo y una en la parte superior de la cabeza.
NOTA: Las bobinas HPI definen la posición de la cabeza en relación con los dispositivos de interferencia cuántica superconductores (SQUID) colocados dentro del sistema MEG mediante la emisión de campos magnéticos conocidos que se pueden localizar durante el escaneo. El número de bobinas HPI depende del sistema MEG, pero suele oscilar entre 3 y 5 bobinas HPI. - Colocar electrodos adicionales con cinta adhesiva para medir la frecuencia cardíaca (electrocardiografía, ECG), los movimientos oculares o parpadeos (electrooculografía, EOG) y la actividad muscular (electromiografía, EMG); La colocación de estos electrodos también permite monitorizar el estado de salud del sujeto.
- Coloque dos electrodos de ECG en el lado derecho e izquierdo del tórax, debajo de las clavículas, respectivamente, para registrar los latidos del corazón del sujeto, y dos electrodos de EOG en el lado superior e inferior del ojo derecho, respectivamente, para registrar sus movimientos oculares verticales o parpadeos.
- Para medir la actividad muscular durante la tarea visomotora, además, limpie los dedos del sujeto con almohadillas con alcohol para una mejor adherencia de la cinta sobre la piel y pegue un total de dos pares de electrodos de copa no desechables en cada mano: uno en el primer interóseo dorsal (FDI) y otro en el abductor corto del pulgar (APB).
- Antes de pegar todos estos electrodos, coloque la pasta conductora dentro de la copa de electrodos hasta que se llene ligeramente para reducir la impedancia de la piel y garantizar una mezcla óptima de adhesividad y conductividad.
- Para la estimulación táctil, fije membranas elásticas delgadas directamente a las partes distales y volares de tres dedos (es decir, el pulgar [D1], el dedo medio [D3] y el meñique [D5]) de ambas manos. Infle las membranas con pulsos de aire comprimido a través de tubos de plástico rígido utilizando un dispositivo de estimulación de soplo de aire. Libere los impulsos de aire comprimido con un intervalo entre estímulos de 1,5 ± 0,5 s siguiendo un orden pseudoaleatorio. Ajuste la presión del estimulador táctil a 50 psi.
- Coloque dos electrodos de ECG en el lado derecho e izquierdo del tórax, debajo de las clavículas, respectivamente, para registrar los latidos del corazón del sujeto, y dos electrodos de EOG en el lado superior e inferior del ojo derecho, respectivamente, para registrar sus movimientos oculares verticales o parpadeos.
- Mientras el sujeto sigue sentado en la silla de madera lejos de cualquier objeto metálico, determine las posiciones tridimensionales (3D) de los puntos de referencia anatómicos fiduciales, cinco bobinas HPI y otros puntos de la forma de la cabeza utilizando un digitalizador. Durante este proceso de digitalización de la cabeza, pida al sujeto que se siente cómodamente, mire al frente y permanezca prácticamente inmóvil, ya que los pequeños movimientos pueden afectar a la precisión de la localización.
- Coloque el receptor de referencia a través de las gafas de plástico (es decir, anteojos con el cubo de referencia adjunto en un lado) en la cabeza del sujeto y ajuste los cierres para asegurar un marco de referencia fijo para el sujeto que debe permanecer relativamente quieto durante toda la medición.
- A través del receptor de la aguja primaria, localice los puntos de referencia anatómicos fiduciales (es decir, los puntos de conexión y preauricular izquierdo/derecho) y la posición de las bobinas HPI, y muestree uniformemente puntos adicionales del cuero cabelludo (al menos 100, preferiblemente cerca de ~500) para mejorar una reconstrucción de alta calidad de la superficie de la cabeza.
NOTA: Los hitos anatómicos fiduciales definen el sistema de coordenadas del sujeto. El digitalizador genera las coordenadas de un sensor en el espacio 3D utilizando un transmisor (normalmente montado detrás del sujeto en el respaldo de la silla de madera) y dos receptores (es decir, el lápiz óptico y los receptores de referencia). - Una vez completada la digitalización, coloque el receptor de la aguja a ~15 cm del sujeto y del transmisor y digitalice un punto aleatorio para finalizar el proceso de digitalización.
NOTA: Este paso final del proceso de digitalización puede diferir de otros productos comerciales.
- Antes de aplicar la red de EEG, pida al sujeto que se siente en una silla cerca del amplificador de EEG y coloque toallas en su pecho y hombros para absorber eventuales goteos debido a la aplicación de la red. Retire la red de EEG del cubo de plástico, gírela con las esponjas hacia el interior y envuélvala suavemente alrededor de una toalla para absorber la solución mezclada en exceso.
- Con el sujeto sentado en la silla y con las instrucciones de mantener los ojos cerrados durante este paso, coloque ambas manos dentro de la red y extiéndala con los dedos, y finalmente colóquela en la cabeza del sujeto.
- Sin mover las posiciones de las bobinas HPI, ajuste la red estirada en la cabeza del sujeto con los dedos para asegurarse de que los canales de referencia y conexión estén correctamente colocados en el centro del cuero cabelludo y entre los ojos del sujeto, respectivamente, y finalmente abroche la correa de la barbilla una vez que la red esté en la posición correcta.
- Con un medidor de impedancia de EEG, asegúrese de que todas las impedancias de los electrodos del cuero cabelludo estén en el rango de 0 a 50 kΩ (se recomiendan valores ˂5 kΩ) para evitar distorsiones de la señal. Para reducir las impedancias del electrodo del cuero cabelludo, compruebe que cada electrodo tenga un buen contacto mecánico y eléctrico con el cuero cabelludo utilizando un bastoncillo de algodón de madera para eliminar los pelos del sujeto entre el electrodo y el cuero cabelludo o una pipeta de plástico desechable para transferir una solución mezclada más conductora a las esponjas de los electrodos si es necesario.
- Una vez que todas las impedancias sean idealmente de hasta 50 kΩ, desconecte el amplificador y prepare el sujeto para la digitalización del electrodo de EEG.
NOTA: Realice la digitalización del electrodo de EEG fuera del MSR y asegúrese de que haya suficiente espacio alrededor del sujeto para gestionar el proceso de escaneo.
- Una vez que todas las impedancias sean idealmente de hasta 50 kΩ, desconecte el amplificador y prepare el sujeto para la digitalización del electrodo de EEG.
- Determine las posiciones 3D de los electrodos de EEG utilizando un escáner óptico de mano. Durante este proceso, pídale al sujeto que se siente cómodamente y mire hacia adelante a menos que se le indique lo contrario.
- En primer lugar, abra el software del escáner óptico, seleccione la plantilla de sensor que coincida con el diseño del sensor de EEG utilizado durante las grabaciones y, a continuación, inicie el proceso de escaneo.
- Durante el escaneo, sostenga el escáner a una cierta distancia de la red de EEG (generalmente ~ 45 cm), con sus aberturas de escaneo perpendiculares a la superficie de los sensores, y muévalo lentamente alrededor de la cabeza del sujeto siguiendo franjas arqueadas desde la parte superior (centro de la cabeza) hasta la parte inferior (última fila de sensores a lo largo del cuello) para registrar las ubicaciones físicas de todos los sensores.
NOTA: El escáner óptico digitaliza las ubicaciones de los electrodos de EEG en la cabeza del sujeto y las transforma en un archivo de coordenadas 3D; suele caracterizarse por dos sensores ópticos que emiten fuentes de luz infrarroja (IR). Cada ubicación escaneada suele aparecer en una nube de sensores 3D. La nube de sensores 3D proporciona información para el escaneo, el sondeo y la alineación de las posiciones de los sensores, mientras que el mapa de sensores 2D proporciona información para el etiquetado de estas posiciones de los sensores. El proceso de escaneo de las posiciones de los electrodos de EEG requiere un total de 5-10 minutos, incluido el sondeo de los puntos de referencia. Sin embargo, el tiempo de escaneo a veces puede depender del rendimiento del escáner óptico para detectar las posiciones de los electrodos.
- Una vez que se hayan escaneado todos los electrodos de EEG (al menos el 95 %), pruebe los puntos de referencia (es decir, los puntos de conexión y los puntos preauriculares izquierdo/derecho) y los cuatro sensores de alineación (es decir, los nodos de alineación frontal, izquierdo y derecho, y el nodo REF) utilizando la sonda óptica inalámbrica para alinear la nube de sensores 3D con la plantilla de sensor seleccionada.
NOTA: Los sensores de alineación se numeran en función de la configuración neta del sensor de EEG.- Para sondear los puntos de referencia, coloque la punta de la sonda óptica en la piel del sujeto en el centro del punto de interés de la sonda asegurándose de que las aberturas de escaneo del escáner apunten a los discos reflectantes de la sonda. Del mismo modo, coloque la punta de la sonda óptica en el centro del sensor de alineación de interés para sondear los sensores de alineación.
- Una vez que todos los sensores hayan sido escaneados y sondeados, revise sus posiciones y etiquetas en la nube de sensores 3D y en el mapa de sensores 2D con respecto a la red de EEG real para verificar y, eventualmente, corregir posibles errores; si no se produjeron errores durante el proceso de escaneo, exporte el archivo de .txt de coordenadas 3D y conviértalo al formato preferido.
NOTA: Las coordenadas de los electrodos 3D generalmente se almacenan en formato .txt y se pueden convertir a través del software de escáner óptico en varios formatos (por ejemplo, .xml, .sfp, .elp o .nsi). - Una vez completado el proceso de digitalización de electrodos de EEG (pasos 2.9-2.11), prepare al sujeto que se va a transferir dentro del MSR para realizar datos de reposo/sueño (paso 2.13), tarea visomotora (paso 2.14), estimulación auditiva (paso 2.15) y estimulación somatosensorial (paso 2.16).
- Para los datos de descanso/sueño, coloque el pórtico del sistema MEG en posición supina (Figura 1A) y organice la cama no magnética y compatible de modo que el reposacabezas extraíble esté alineado con la abertura en forma de casco en la parte inferior del dewar. Después de ajustar la cama a la posición correcta, coloque la válvula de freno de la cama en la posición de desbloqueo. Coloque una sábana o manta sobre la cama y una pequeña almohada de espuma en el reposacabezas extraíble para la fijación de la cabeza y la comodidad durante la grabación.
NOTA: El dewar es un contenedor de almacenamiento criogénico lleno de helio líquido en el que los conjuntos de sensores están dispuestos espacialmente en la parte inferior a través de una abertura en forma de casco diseñada para rodear la cabeza del sujeto. El casco se adapta a una circunferencia de la cabeza de hasta 59-61 cm. El pórtico es el sistema mecánico que soporta el dewar y que permite modificar su elevación y ángulo en función de la posición de medición (es decir, sentado o en decúbito supino).- Transfiera al sujeto dentro del MSR y ayúdelo a sentarse en el borde de la cama y acostarse en él. Coloque varias mantas sobre el cuerpo del sujeto para mantenerlo caliente durante la grabación, asegurándose de que los cables de los electrodos sean fácilmente accesibles, y abrochar ligeramente los cinturones de seguridad (o levantar las barandillas si las hay), explicando al sujeto que este paso es para evitar que se salga de la cama mientras duerme. Si es necesario, coloque una toalla enrollada adicional debajo del cuello para proporcionar apoyo al cuello y los hombros del sujeto.
- Desbloquee la válvula de freno de la cama para mover suavemente la cabeza del sujeto, que se coloca en el reposacabezas extraíble debajo de la abertura en forma de casco del dewar hasta que toque el interior del casco. Para aumentar la relación señal-ruido (SNR), acerque la cabeza del sujeto al casco lo más que pueda.
- Conecte las bobinas HPI, los electrodos de ECG y EOG en los paneles correspondientes del sistema MEG, conecte la red de EEG a la unidad amplificadora dentro del MSR y verifique las mediciones de las coordenadas de la cabeza desde la estación de trabajo de adquisición fuera del MSR para evaluar si la cabeza del sujeto está colocada correctamente debajo del dewar.
- Con el consentimiento del sujeto, reduzca la intensidad de la luz dentro del MSR para ayudar a estimular la relajación y el sueño. Cuando el sujeto se sienta relajado y cómodo, indíquele que descanse con los ojos cerrados o duerma durante la grabación. Asegure al sujeto que será observado en el monitor fuera del MSR a través de la cámara en color con blindaje de radiofrecuencia montada en la pared del MSR durante toda la grabación.
- Para la tarea visomotora, coloque el pórtico del sistema MEG en posición vertical (Figura 1B) y coloque la silla MEG de modo que la cabeza del sujeto quede debajo del pórtico, cerca de la abertura en forma de casco en la parte inferior del dewar. Después de ajustar la silla a la posición correcta, coloque la válvula de freno de la silla en la posición de desbloqueo ("0").
- Transfiera el sujeto dentro del MSR. Ayúdelo a sentarse en la silla no magnética y compatible y a encontrar una posición cómoda y relajada. Coloque varias mantas en el cuerpo del sujeto para mantenerlo caliente durante la grabación asegurándose de que los cables de los electrodos sean fácilmente accesibles, y coloque la mesa extraíble de manera que el sujeto pueda poner sus manos sobre ella durante la tarea. Si es necesario, coloque una toalla debajo de las rodillas del sujeto para ayudar a mantener la posición sentada y no se deslice hacia abajo.
NOTA: Dado que el sujeto puede relajarse durante la tarea visomotora y, por lo tanto, asumir una posición más baja que la inicial, levante con cuidado la silla al final de cada sesión de tarea a través del pedal de elevación (si está presente) o coloque toallas o mantas en la silla para que la cabeza del sujeto vuelva a tocar el interior del casco. Si es necesario, coloque toallas o mantas adicionales detrás de la cabeza del sujeto, no solo para mayor comodidad, sino también para ayudar al sujeto a mantener la cabeza lo más recta posible. La estimulación visomotora se puede realizar alternativamente en posición supina para evitar mover el dewar en medio de una sesión de grabación. - Una vez que el sujeto esté en la posición correcta, conecte las bobinas HPI, los electrodos ECG, EOG, FDI y APB en el panel derecho de la máquina MEG, conecte la red de EEG a la unidad amplificadora dentro del MSR y eleve la silla a través del pedal de elevación (si está presente) con pequeños movimientos o coloque toallas o mantas adicionales en la silla hasta que la cabeza del sujeto toque ligeramente el interior del casco (verifique las medidas del coordenadas de la cabeza desde la estación de trabajo de adquisición fuera del MSR).
- Coloque la pantalla de proyección, en la que se proyectarán los estímulos visuales a través de un sistema de espejo proyector colocado fuera del MSR, frente al sujeto (Figura 1B), y explique la tarea visomotora a realizar durante la grabación. En particular, indique al sujeto que golpee la mesa con su dedo índice solo cuando el estímulo visual (por ejemplo, una imagen) aparezca en la pantalla, respectivamente, para la mano derecha e izquierda. Asegúrese de que el sujeto comprenda la tarea o se sienta cómodo realizándola solo; Si es necesario, practique la tarea junto con el sujeto varias veces para ayudarlo a familiarizarse con ella.
NOTA: Si una sesión de estimulación visomotora se realiza en posición supina, se coloca un espejo a una distancia por encima de la cara del sujeto para reflejar los estímulos visuales del proyector. - Antes de cerrar la puerta del MSR, pregúntele al sujeto si se siente cómodo estando solo dentro de la habitación; en caso de que no lo haga, una persona del equipo o sus padres permanecerán dentro del MSR durante las sesiones de grabación. Además, asegúrele al sujeto que será observado en el monitor fuera del MSR durante toda la grabación.
- Transfiera el sujeto dentro del MSR. Ayúdelo a sentarse en la silla no magnética y compatible y a encontrar una posición cómoda y relajada. Coloque varias mantas en el cuerpo del sujeto para mantenerlo caliente durante la grabación asegurándose de que los cables de los electrodos sean fácilmente accesibles, y coloque la mesa extraíble de manera que el sujeto pueda poner sus manos sobre ella durante la tarea. Si es necesario, coloque una toalla debajo de las rodillas del sujeto para ayudar a mantener la posición sentada y no se deslice hacia abajo.
- Para la estimulación auditiva, utilice la configuración descrita en el paso 2.14 con la pantalla de proyección frente al sujeto sentado. Ayude al sujeto a usar los audífonos (o auriculares) a través de los cuales se emiten los disparadores de sonido (por ejemplo, chirridos modulados).
- Indique al sujeto que fije los estímulos (por ejemplo, un punto verde sobre un fondo negro) proyectados en la pantalla mientras escucha los disparadores de sonido. Si es necesario, realice una sesión de capacitación para ayudar al sujeto a comprender mejor el procedimiento. Antes de cerrar la puerta del MSR, repita los procedimientos de seguridad descritos anteriormente.
- Para la estimulación somatosensorial, utilice la configuración descrita en el paso 2.14. Pregúntele al sujeto qué video (o película) quiere ver en la pantalla del proyector frente a él/ella.
- Indique al sujeto que se relaje con los ojos abiertos, mire el video seleccionado, permanezca lo más quieto posible e ignore los estímulos táctiles que recibe en sus dedos durante la grabación. Explique al sujeto que sentirá suaves golpecitos en la piel en la punta de los dedos, respectivamente, para cada mano. Si el sujeto se siente incómodo, realice una sesión de entrenamiento para tranquilizarlo.
NOTA: La fijación ocular en un objetivo visual es una técnica bien establecida para minimizar los artefactos biológicos que pueden afectar la calidad de la grabación y distraer al sujeto de los estímulos táctiles entregados durante la adquisición de datos.
- Indique al sujeto que se relaje con los ojos abiertos, mire el video seleccionado, permanezca lo más quieto posible e ignore los estímulos táctiles que recibe en sus dedos durante la grabación. Explique al sujeto que sentirá suaves golpecitos en la piel en la punta de los dedos, respectivamente, para cada mano. Si el sujeto se siente incómodo, realice una sesión de entrenamiento para tranquilizarlo.
3. Adquisición de datos
NOTA: La adquisición de datos simultáneos de MEG y EEG se realiza en las instalaciones de MEG en Cook Children's Medical Center (CCMC). Más detalles sobre el uso clínico de MEG en niños pediátricos con epilepsia se pueden encontrar en otros lugares 8,27,45.
- Registre señales MEG utilizando el sistema MEG de cabeza completa (cobertura del sensor: 1.220 cm2) caracterizado por 306 canales agrupados en 102 elementos idénticos de triple sensor con un magnetómetro y dos gradiómetros planos ortogonales. Establezca una frecuencia de muestreo de al menos 1 kHz.
NOTA: Los magnetómetros de bobina simple miden el componente del campo magnético perpendicular a la superficie del casco MEG. Los gradiómetros planos consisten en una configuración de bobina en "forma de ocho" caracterizada por pares de magnetómetros colocados a una pequeña distancia entre sí y miden la diferencia en el campo magnético entre sus ubicaciones (es decir, la diferencia entre los dos bucles de "ocho"), también llamada gradiente espacial. En comparación con los magnetómetros, los gradiómetros planos son menos sensibles a las fuentes cerebrales profundas, pero más robustos en la detección de fuentes superficiales mediante la supresión del ruido ambiental. Estos 306 canales se sumergen y se enfrían en helio líquido a -296 °C (4,2 K) para convertirse en superconductores. - Registre las señales de EEG simultáneamente utilizando la red de EEG no magnética de 256 canales con sensores de electrodos de Ag/AgCl espaciados uniformemente sobre el cuero cabelludo, las mejillas y la parte posterior del cuello. Establezca una frecuencia de muestreo de al menos 1 kHz.
- Cierre la puerta del MSR para comenzar a grabar. A través del sistema de intercomunicación por voz, comunícate con el sujeto, comprobando si se siente cómodo estando solo dentro del MSR. Monitoree constantemente al sujeto en video y, en caso de emergencia, ingrese inmediatamente al MSR.
NOTA: En caso de que no se sienta cómodo o la enorme puerta del MSR le intimide, una persona del equipo o sus padres pueden permanecer dentro del MSR durante las sesiones de grabación sentados en una silla de madera cerca del sujeto; Asegúrese de retirar todos los objetos metálicos antes de entrar en la habitación. - Antes de cada grabación, indique al sujeto a través del sistema de intercomunicación de voz que mantenga su posición quieta durante ~ 30 segundos antes de comenzar la tarea. Para la tarea visomotora, comunique adicionalmente a través del intercomunicador qué dedo índice (derecho o izquierdo) utilizará para la primera sesión de grabación.
- Durante este período en el que el sujeto permanece inmóvil, presione el botón de medición del cuadro de diálogo de medición HPI en el sistema de adquisición de datos MEG para medir el campo magnético generado por la corriente alimentada a las bobinas HPI y determinar las posiciones de medición de la cabeza con respecto al conjunto de sensores MEG; por lo tanto, confirme que el sujeto está bien posicionado (cabeza |coordenada z| ˂ 75 mm) y anote las mediciones 3D para cada sesión.
- Si todavía hay espacio entre la cabeza del sujeto y el casco, vuelva a entrar en el MSR y ajuste la altura de la silla a través del pedal de elevación (si está presente), coloque toallas o mantas en la silla, o instruya al sujeto a través del intercomunicador sobre cómo mover la cabeza a una posición más cercana al casco (si el sujeto está sentado), y, por último, vuelva a comprobar las posiciones de medición de la cabeza. En caso de registros de descanso/sueño, vuelva a entrar en el MSR y acerque la cama al casco, reduciendo el espacio entre la cabeza y el casco.
- Una vez que el sujeto esté bien posicionado con respecto al casco MEG y listo para comenzar, comience la primera sesión de grabación (duración ~ 10 min) siguiendo un orden preciso (consulte el paso 3.5.1) para una sincronización precisa de MEG y EEG (consulte el paso 3.12).
NOTA: Para garantizar grabaciones de alta calidad, la primera sesión de grabación es fundamental para capturar los artefactos presentes en los datos debido a los movimientos del sujeto o causados por el entorno externo. Si es necesario, vuelva a entrar en el MSR para ajustar las posibles conexiones de canales o la posición del sujeto en la silla MEG. Se recomienda tomar notas de cualquier artefacto o evento inusual durante las grabaciones que se puedan revisar posteriormente si es necesario.- Presione el botón de grabación en el software de adquisición de datos de EEG para comenzar el registro de EEG. Presione el botón de grabación en el software de adquisición de datos MEG para comenzar la grabación de MEG. Finalmente, presione el botón de inicio desde el software de la computadora de estimulación para mostrar estímulos visuales o administrar estímulos auditivos.
NOTA: La computadora de estimulación que ejecuta el software de estímulo visual (o auditivo) está conectada al sistema de espejo del proyector fuera del MSR, que se puede encender o apagar según el tipo de grabación realizada. Durante las grabaciones de descanso/sueño, el sistema se apaga ya que el sujeto está descansando o durmiendo, pero la ejecución del software de estímulo visual en la computadora de estimulación ayuda a cronometrar cada sesión de grabación. Durante la tarea visomotora, así como durante las estimulaciones auditivas y somatosensoriales, el sistema se enciende permitiendo que el sujeto observe los estímulos o un video proyectado en la pantalla colocada frente a él mientras el software está funcionando. Para este estudio, se seleccionó un total de (i) 107 estímulos (es decir, 85 imágenes superpuestas sobre un fondo de tablero de ajedrez y 22 fondos de tablero de ajedrez) con un intervalo de ~4 s entre cada estímulo para la tarea visomotora; (ii) 200 sonidos de chirrido modulados con un intervalo entre estímulos de 3 s para la estimulación auditiva; y (iii) 200 estímulos táctiles para cada dedo (es decir, D1, D3 y D5) siguiendo una secuencia semialeatoria con un intervalo entre estímulos de ~1,5 s para la estimulación somatosensorial.
- Presione el botón de grabación en el software de adquisición de datos de EEG para comenzar el registro de EEG. Presione el botón de grabación en el software de adquisición de datos MEG para comenzar la grabación de MEG. Finalmente, presione el botón de inicio desde el software de la computadora de estimulación para mostrar estímulos visuales o administrar estímulos auditivos.
- Para detener las grabaciones, presione el botón de parada en el software de adquisición de datos MEG y luego el botón de parada en el software de adquisición de datos de EEG. Al final de cada sesión de grabación, comunícate con el sujeto a través del intercomunicador para tranquilizarlo y, si no es necesario conectar canales o ajustar la posición dentro del MSR, continúa con la siguiente sesión.
- Para la tarea visomotora, seleccione diferentes estímulos visuales para cada sesión para mantener al sujeto motivado y entretenido durante la grabación.
- Para datos visomotores o de reposo/sueño, registre un total de ~1 h de registro simultáneo de MEG y EEG, caracterizado por 5-6 sesiones. Sin embargo, el número de sesiones puede variar para cada tema. Además, registre un total de ~20 minutos (1-2 sesiones de ~10 minutos cada una) y ~14 minutos (1-2 sesiones de ~7 minutos cada una) de registro simultáneo de MEG y EEG para los datos de estimulación auditiva y somatosensorial, respectivamente.
NOTA: En este estudio, los datos de MEG y EEG se almacenan automáticamente al final de las grabaciones en formatos .fif y .mff, respectivamente, en el sistema de almacenamiento informático de CCMC. - Cuando termine la grabación, ingrese el MSR para ayudar al sujeto a levantarse de la silla o la cama y pídale que se siente en una silla fuera del MSR para quitar la red de EEG y los electrodos.
- Indique al sujeto que cierre los ojos hasta que se le indique lo contrario y ayúdelo a quitarse la red de EEG aflojando completamente las correas de la barbilla y tirando suavemente de la red con las dos manos (desde la frente hacia la parte posterior de la cabeza del sujeto) hasta que se despegue por completo. Durante este paso, asegúrese de no tirar del cabello del sujeto mientras retira la red. Además, ayude al sujeto a retirar suavemente los electrodos restantes (es decir, ECG, EOG y EMG en caso de tarea visomotora) previamente pegados a su piel.
- Después de retirar la red de EEG y los electrodos, informe al sujeto (y a sus padres) que todos los procedimientos finalmente se han completado.
- Después de que el sujeto salga de la habitación, limpie cuidadosamente el escáner óptico (como se describe en el manual del usuario) y guárdelo dentro de su estuche protector.
- Limpie y desinfecte las superficies de cualquier equipo utilizado durante las grabaciones (p. ej., sillas, camas, escritorios) con toallitas de peróxido de hidrógeno aprobadas por el hospital o aerosol desinfectante y toallas de papel, coloque las mantas y toallas usadas dentro del recipiente proporcionado por el hospital y deseche cualquier trozo de cinta adhesiva usada.
- Guarde las herramientas de medición dentro del armario de almacenamiento y limpie el interior de las copas de electrodos llenas de pasta conductora con bastoncillos de algodón de madera bajo el chorro de agua del grifo.
- Para enjuagar la red de EEG, llene el balde de plástico en el fregadero con agua limpia y tibia del grifo y repita los siguientes pasos un total de cuatro veces.
- Sumerja la red de EEG en el agua y agite suavemente la red de EEG durante 10-20 s (o sumérjala dentro y fuera del cubo ~ 25 veces).
- Drene el agua del balde y vuelva a llenar el balde con agua limpia y tibia del grifo.
- Para desinfectar la red de EEG, llene el cubo de plástico del fregadero con la solución desinfectante compuesta por 2 cuartos de galón de agua tibia del grifo y 1 cucharada de desinfectante y sumerja la red de EEG en su interior durante 10 minutos. Enjuague el balde de la solución desinfectante y siga el proceso de enjuague y drenaje tres veces para eliminar cualquier solución residual de la red de EEG.
- Para el proceso de enjuague o desinfección, retire la red de EEG sumergida del balde, séquela eliminando el exceso de agua con la ayuda de una toalla limpia y seca, y guárdela colgándola cerca del fregadero.
- Para suprimir las interferencias magnéticas internas y externas y los artefactos de medición/movimiento de los datos MEG, aplique la extensión temporal del método de separación del espacio de señal (tSSS) al archivo MEG .fif de datos sin procesar.
NOTA: El filtrado Maxwell espaciotemporal (tSSS) es ideal para suprimir fuentes de interferencia ubicadas dentro o muy cerca del conjunto de sensores MEG, es decir, interferencias internas. - Al realizar registros simultáneos de MEG y EEG, alinee espacialmente los sistemas de coordenadas de los dos dispositivos de adquisición con respecto a los puntos de referencia anatómicos en la cabeza del sujeto (Figura 2A) y corrija la deriva lineal del reloj entre las señales que se produce debido a las posibles diferentes frecuencias de muestreo (Figura 2B).
NOTA: Durante las grabaciones, tanto las señales de MEG como las de EEG también pueden verse afectadas por cambios lentos a lo largo del tiempo debido a posibles retrasos en la pulsación de los botones de inicio y fin y a una deriva interna del reloj que se produce cuando los disparadores se envían al software de adquisición de datos de MEG y EEG. Para garantizar una sincronización precisa entre estas señales, se desarrolló un código interno en Python que utiliza los eventos de activación enviados en ambos sistemas durante la adquisición de datos como señal de activación común. El código incluye tres funciones disponibles en la biblioteca de software MNE-Python: dos funciones que leen las señales MEG y EEG y una función que extrae información de los eventos desencadenantes de las señales, como nombres de canales y marcas de tiempo (es decir, fecha y hora de ocurrencia del evento). Las diferencias en el tiempo entre la ocurrencia de eventos de disparo en cada señal (es decir, delta) definen la deriva lineal del reloj a lo largo del tiempo (Figura 2B). En los siguientes pasos se proporciona una descripción detallada del código desarrollado (ver 3.12.1-3.12.4).- Utilice la diferencia entre el primer evento de activación que se produce en cada señal como valor de desplazamiento (es decir, la parte que se va a recortar de una de las dos señales) para alinear las grabaciones.
NOTA: Las funciones mne.io.read_raw_fif y mne.io.read_raw_egi convierten las grabaciones de MEG y EEG en un formato de matriz 2D, mientras que la función mne.find_events extrae información de eventos de las señales sin procesar. - Una vez alineados estos primeros desencadenantes, calcule el coeficiente de correlación de Pearson para evaluar el grado de correlación entre las señales; Se recomiendan valores p < 1 x 10-6 para garantizar una alineación perfecta.
NOTA: La función de Pearson de la biblioteca scipy estima el coeficiente de correlación de Pearson entre las señales de MEG y EEG y el valor p de esta correlación. - Para validar esta precisión de correlación, estime la tasa de deriva entre las dos señales realizando un ajuste polinómico de primer grado y utilice el grado de disparidad resultante representado por el coeficiente de la función polinómica para volver a muestrear las señales en el eje x del ajuste polinómico (Figura 2B).
NOTA: La función polyfit de la biblioteca numpy ajusta las señales MEG y EEG dentro de una función polinómica; Esta función devuelve un coeficiente que representa el grado de disparidad entre las dos señales. La función mne.resample vuelve a muestrear las señales MEG y EEG de acuerdo con el coeficiente de la función polinómica. - Una vez completado el remuestreo, compare las marcas de tiempo del último evento de activación que se produjo en cada señal y elimine las ventanas de tiempo que no son comunes en las señales de MEG y EEG. Por último, combine las señales sincronizadas de MEG y EEG para crear una única grabación caracterizada por sensores de MEG y EEG que se puede utilizar para análisis posteriores.
NOTA: La función mne.add_channels fusiona las dos señales para crear una sola grabación.
- Utilice la diferencia entre el primer evento de activación que se produce en cada señal como valor de desplazamiento (es decir, la parte que se va a recortar de una de las dos señales) para alinear las grabaciones.
- Al final de cada registro de ~1,5 h, utilice un total de 5-6 (~10 min cada uno), 1-2 (~10 min cada uno) y 1-2 (~7 min cada uno) de grabaciones sincronizadas de MEG y EEG, respectivamente para los datos visomotores (y de descanso/sueño), auditivos y de estimulación somatosensorial, para el análisis de datos.
NOTA: Idealmente, el sujeto debe realizar golpecitos con el dedo derecho para tres grabaciones visomotoras y golpeteo con el dedo izquierdo para las tres grabaciones visomotoras restantes.
4. Análisis de datos
- Mapeo de la zona irritativa
- Genere las superficies corticales 3D a partir de la resonancia magnética del sujeto utilizando el proceso de reconstrucción cortical de FreeSurfer, que es una herramienta de neuroimagen de código abierto para procesar, analizar y visualizar imágenes de resonancia magnética del cerebro humano46.
- Importe la anatomía reconstruida en Brainstorm, que es una aplicación de código abierto de MATLAB dedicada a la visualización y el procesamiento de datos de MEG y EEG47, para visualizar los resultados de la reconstrucción cortical. En Lluvia de ideas, establezca los puntos de referencia (es decir, nasión, preauricular izquierdo/derecho, comisura anterior/posterior e interhemisférica) en la resonancia magnética importada que definen el sistema de coordenadas del sujeto.
- Importe la señal simultánea de MEG y HD-EEG en Brainstorm y registre los sensores de MEG y EEG en la resonancia magnética utilizando el proceso de registro de resonancia magnética para ajustar su alineación con los puntos de referencia digitalizados. Si es necesario, proyecte los sensores de EEG en la superficie cortical.
- Abra la grabación simultánea de MEG y HD-EEG e inspeccione visualmente los datos sin procesar para eliminar los canales defectuosos. Además, aplique la técnica de corrección de artefactos de proyección de espacio de señal (SSP) disponible en Brainstorm para rechazar artefactos biológicos (por ejemplo, latidos del corazón, parpadeos) de las grabaciones.
- Aplique filtros de muesca (50 o 60 Hz, según la interferencia de la línea de alimentación) y de paso de banda (1-70 Hz) a los datos simultáneos de MEG y HD-EEG.
- Seleccione partes de los datos que contengan actividad interictal caracterizada por IED frecuentes, como picos y ondas agudas, y que tengan artefactos de movimiento mínimos (si es posible).
NOTA: Los IED son formas de onda transitorias caracterizadas por una evolución temporal de <70 ms, una amplitud de >50 μV y una forma afilada que puede distinguirse claramente de la actividad de fondo en la banda de frecuencia48 de 1-70 Hz. La Figura 3A representa un ejemplo de partes de las señales simultáneas de MEG y HD-EEG con frecuentes IED visibles en ambas grabaciones. - Utilizando la configuración de visualización estándar de 10 s por página, marque el pico negativo de cada IED que se produce en los registros de MEG y EEG (Figura 3A), así como en cada modalidad sola. Antes de marcar cada IED, compruebe el campo topográfico y los mapas de potencial para el MEG y el EEG, respectivamente.
NOTA: Las distribuciones de voltaje de los puntos de tiempo adicionales durante la fase ascendente de cada DEI, en lugar de su pico, también deben verificarse para tener en cuenta la posible propagación de la actividad epiléptica49. Puede encontrar más detalles sobre cómo marcar eventos de picos interictales mediante Brainstorm en otro lugar (https://neuroimage.usc.edu/brainstorm/Tutorials/Epilepsy). - Calcule un modelo de cabeza realista, definido como un modelo geométrico de tres capas (es decir, cuero cabelludo, cráneo interno y cráneo externo) (Figura 3B), utilizando el software OpenMEEG BEM (método de elemento límite simétrico) disponible en Brainstorm. Utilice el volumen de la resonancia magnética como espacio de origen (cuadrícula de puntos de origen con una resolución espacial de 5 mm).
NOTA: El software OpenMEEG BEM utiliza el método de elementos límite simétricos para calcular un modelo directo realista caracterizado por el cuero cabelludo (es decir, la interfaz aire-cuero cabelludo), el cráneo exterior (es decir, la interfaz cuero cabelludo-cráneo) y el cráneo interior (interfaz cráneo-cerebro). Como solución alternativa, se puede utilizar el método de elementos finitos (FEM) para resolver el problema de avance, ya que permite una representación realista del conductor de volumen de la cabeza. Los valores de conductividad del tejido cefálico a menudo se asumen a partir de la literatura y pueden variar según la edad del sujeto de50 años. Para resolver el modelo hacia adelante utilizando el FEM, calcule el modelo realista de la cabeza, definido como un modelo geométrico de tres a cinco capas (es decir, materia blanca, materia gris, líquido cefalorraquídeo, cráneo y piel), utilizando el software DUNEuro FEM disponible en Brainstorm 47,50,51. Más detalles sobre la estimación del modelo a futuro utilizando FEM se pueden encontrar en otro lugar (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Localice los generadores subyacentes de los picos interictales seleccionados utilizando el método ECD sin restricciones en el conjunto de sensores MEG, EEG y MEG y EEG combinados por separado. Para localizar estas fuentes de dipolos, calcule la covarianza de ruido de las grabaciones de MEG en sala vacía o establézcala como una matriz identidad.
NOTA: Considere la posibilidad de realizar la localización de la fuente en IED promediados con distribuciones de voltaje similares como un enfoque alternativo en caso de que la SNR de los IED sea baja12. - Realice el método de escaneo de dipolos disponible en Lluvia de ideas en el pico de cada IED previamente marcado para seleccionar los dipolos de origen más significativos en todo el volumen cerebral. Seleccione solo dipolos de origen con una bondad de ajuste >60% y estime su agrupación definida para cada dipolo como el número de dipolos ubicados a 15 mm de su centro (Figura 3C).
NOTA: Se pueden encontrar más detalles sobre la agrupación de ECD en otro lugar52.
- Mapeo de la SOZ
- Genere las superficies corticales 3D a partir de la resonancia magnética del sujeto utilizando el proceso de reconstrucción cortical de FreeSurfer46.
- Importe la anatomía reconstruida en Brainstorm47 para visualizar los resultados de la reconstrucción cortical. Establezca los puntos de referencia en la resonancia magnética importada que definen el sistema de coordenadas del sujeto.
- Importe la señal simultánea de MEG y HD-EEG (que contiene el evento ictal) en Brainstorm y registre los sensores de MEG y EEG en la resonancia magnética utilizando el proceso de registro de resonancia magnética para ajustar su alineación con los puntos de referencia digitalizados. Si es necesario, proyecte los sensores de EEG en la superficie cortical.
NOTA: Si el sujeto tuvo una convulsión durante las grabaciones, revise las notas tomadas durante la grabación para evaluar en qué sesión se registró el evento ictal. - Abra la grabación simultánea de MEG y HD-EEG e inspeccione visualmente los datos sin procesar para eliminar los canales defectuosos. Aplique la técnica de corrección de artefactos SSP disponible en Brainstorm47 para rechazar artefactos biológicos (por ejemplo, latidos del corazón, parpadeos) de la grabación.
- Aplique filtros de muesca (50 o 60 Hz, según la interferencia de la línea de alimentación) y de paso de banda (1-70 Hz) a los datos simultáneos de MEG y HD-EEG.
- De acuerdo con las notas de registro, identifique el inicio de la convulsión y su terminación (si se nota) y marque estos eventos en la señal para identificar la parte correcta de los datos que contienen secreciones epileptiformes ictales. En la Figura 4 se muestran ejemplos del inicio de una convulsión para MEG y HD-EEG, respectivamente.
NOTA: Cuando un sujeto tiene una convulsión durante la adquisición de MEG, se requiere que el personal médico asista inmediatamente al sujeto y brinde atención de emergencia. Por lo tanto, la duración de esas porciones de datos con eventos ictales puede ser corta. - Usando la configuración de visualización estándar de 10 s por página, marque el pico negativo de cada ráfaga de descargas epileptiformes (por ejemplo, picos repetitivos, ondas agudas o complejos de pico-onda) que ocurren durante el evento ictal en MEG y EEG, así como en cada modalidad sola. Antes de cada marca de pico, verifique el campo de topografía y los mapas de potencial para el MEG y el EEG, respectivamente (Figura 4A).
NOTA: Las convulsiones se clasifican como generalizadas o focales dependiendo de dónde comienza su inicio. Aunque dependiente del síndrome de epilepsia, una convulsión es un fenómeno de al menos 10 s caracterizado por descargas eléctricas repetitivas que pueden variar en frecuencia, amplitud y morfología. - Calcule el modelo de cabeza realista de tres capas (es decir, cuero cabelludo, cráneo interno y cráneo externo) para los sensores MEG y EEG utilizando el software OpenMEEG BEM disponible en Brainstorm. Utilice el volumen de la resonancia magnética como espacio de origen (cuadrícula de puntos de origen con una resolución espacial de 5 mm).
NOTA: Para resolver el modelo directo utilizando el FEM, calcule el modelo realista de la cabeza, definido como un modelo geométrico de tres a cinco capas (es decir, materia blanca, materia gris, líquido cefalorraquídeo, cráneo y piel), utilizando el software DUNEuro FEM disponible en Brainstorm 47,50,51. Más detalles sobre la estimación del modelo a futuro utilizando FEM se pueden encontrar en otro lugar (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Localice los generadores subyacentes de las descargas ictales seleccionadas utilizando el método ECD sin restricciones en el conjunto de sensores MEG, EEG y MEG y EEG combinados por separado. Para localizar estas fuentes de dipolos, calcule la covarianza de ruido de las grabaciones de MEG en sala vacía o establézcala como una matriz identidad.
- Realice el método de escaneo de dipolos disponible en Lluvia de ideas en el pico de cada forma de onda ictal previamente marcada para seleccionar los dipolos de origen más significativos en todo el volumen cerebral. Seleccione solo dipolos de origen con una bondad de ajuste >60% y estime su agrupación (distancia de los dipolos desde el centro de cada dipolo establecida en 15 mm)52.
- Mapeo de la corteza elocuente
- Realizar los pasos 4.2.1-4.2.3 anteriormente descritos utilizando las señales registradas durante la tarea visomotora, así como durante las estimulaciones auditivas y somatosensoriales.
- Abra las grabaciones simultáneas de MEG y HD-EEG e inspeccione visualmente los datos sin procesar para eliminar los canales defectuosos. Por separado, para cada sesión, aplique la técnica de corrección de artefactos SSP disponible en Brainstorm47 para rechazar los artefactos biológicos (por ejemplo, latidos del corazón, parpadeos) de las grabaciones. Además, descarte o marque como "Intervalo incorrecto" todos aquellos segmentos de datos contaminados por artefactos que no se puedan utilizar para un análisis posterior.
- Aplique filtros de muesca (50 o 60 Hz, según la interferencia de la línea eléctrica) y de paso de banda (1-100 Hz) a los datos simultáneos de MEG y HD-EEG.
- Para mapear la corteza motora, abra las señales EMG registradas por los electrodos FDI y APB y marque manualmente el evento de golpeteo realizado por el sujeto, por separado para la mano derecha e izquierda, seleccionando el primer pico de activación muscular diferente de la línea de base en el par de electrodos FDI. Realice este paso por separado para cada sesión utilizando Brainstorm47.
NOTA: Utilice la pestaña Filtro para la visualización solo en Lluvia de ideas y seleccione rangos de frecuencia (por ejemplo, paso alto: 30 Hz; paso bajo: 300 Hz; muesca: 60 Hz) que pueden ayudar a marcar correctamente los picos de la actividad EMG mientras se toca. El nombre de los eventos debe ser el mismo en todas las sesiones; Por ejemplo, los eventos en los que el sujeto realizó el golpeteo con el dedo derecho (o con el dedo izquierdo) se pueden denominar "Tap_right" (o "Tap_left"). Este paso nos permite realizar un análisis único sobre el mismo tipo de evento que ocurrió en todas las sesiones. - Desde cada sesión, importe los eventos que ocurren en segmentos sin artefactos seleccionando los siguientes parámetros: estímulos visuales: ventana de tiempo [-200; +500] ms, incluida la línea de base de [-200; 0] ms antes del inicio del estímulo; Eventos de golpeteo: ventana de tiempo de [-1500; +1000] ms, incluida la línea de base de [-1500; -1000] ms antes del inicio del estímulo visual; Sonidos de chirrido modulados: ventana de tiempo de [-500; +1000] ms, incluida la línea de base de [-500; 0] ms antes del inicio del estímulo; y estímulos táctiles: ventana de tiempo de [-100; +500] ms, incluida la línea de base de [-100; 0] ms antes del inicio del estímulo.
- Una vez que se hayan importado los eventos de una tarea específica de todas las sesiones, aplique el montaje de referencia promedio para aumentar la SNR en los datos de EEG y estime el promedio a través de estímulos para obtener los campos y potenciales evocados por el evento. En el caso de las tareas motoras (es decir, el golpeteo) y la estimulación táctil, este último paso se realiza para la mano derecha y la izquierda, respectivamente.
NOTA: Los paneles A y B de la Figura 5, la Figura 6, la Figura 7 y la Figura 8 muestran ejemplos de respuestas evocadas visuales, motoras, auditivas y somatosensoriales, respectivamente, para MEG y EEG y su campo topográfico relativo y mapas de potencial. El número total de estímulos para una tarea específica depende estrictamente del número de sesiones completadas; En el caso de la tarea motora, este número también depende de la tarea de golpeteo realizada correctamente. - Para los campos y potenciales evocados visuales, motores, auditivos o somatosensoriales, calcule el modelo de cabeza realista de tres capas (es decir, cuero cabelludo, cráneo interno y cráneo externo) para los sensores MEG y EEG utilizando el software OpenMEEG BEM disponible en Brainstorm. Utilice la superficie cortical 3D como espacio de origen.
NOTA: Para resolver el modelo directo utilizando el FEM, calcule el modelo realista de la cabeza, definido como un modelo geométrico de tres a cinco capas (es decir, materia blanca, materia gris, líquido cefalorraquídeo, cráneo y piel), utilizando el software DUNEuro FEM disponible en Brainstorm 47,50,51. Más detalles sobre la estimación del modelo a futuro utilizando FEM se pueden encontrar en otro lugar (https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro). - Para cada campo y potencial evocado por eventos, calcule las fuentes corticales en los eventos promediados utilizando dSPM implementado en la caja de herramientas Brainstorm para el conjunto de sensores MEG, EEG y MEG y EEG combinados por separado. Establezca la matriz de covarianza del ruido utilizando el período de referencia previo al estímulo específico para cada tarea (véase el paso 4.3.5).
- Dependiendo de la tarea, extraiga las fuentes corticales máximas observadas en el área elocuente del cerebro involucrada [corteza visual primaria (V1), corteza motora primaria (M1), corteza auditiva primaria (A1) o corteza somatosensorial primaria (S1)] que se pueden definir utilizando un atlas o mediante la reconstrucción de un sensor virtual (es decir, región de interés, ROI) en esa ubicación (Figura 5C, Figura 6C, Figura 7C y Figura 8C).
- Realice la descomposición de la frecuencia del tiempo de la ondícula de Morlet en el campo evocado por el evento y las fuentes potenciales en el área cerebral elocuente involucrada (V1, M1, A1 o S1) con una escala lineal (rango de frecuencia: 1:1:100 Hz).
NOTA: Para estimar las oscilaciones evocadas que están bloqueadas en el tiempo y en la fase con el inicio del estímulo, la señal MEG/EEG se promedia inicialmente sobre los eventos y luego se somete a un análisis de tiempo-frecuencia53,54. - Realice la estandarización de los mapas de origen cortical utilizando el método de perturbación relacionado con eventos disponible en Brainstorm para normalizarlos con respecto a la línea de base (consulte el paso 4.3.5), por separado para cada evento (Figura 5D, Figura 6D, Figura 7D y Figura 8D).
NOTA: La estandarización de los mapas de origen utilizando perturbaciones relacionadas con eventos es una medida de normalización para los mapas de potencia de tiempo-frecuencia que estima la desviación de la media sobre la línea de base en porcentaje. Más detalles de este proceso de estandarización se pueden encontrar en otro lugar (https://neuroimage.usc.edu/brainstorm/Tutorials/TimeFrequency#Normalized_time-frequency_maps).
- Validación
- Adquisición de registro extraoperatorio de iEEG mediante la implantación de rejillas subdurales y/o electrodos de profundidad. El número, tipo y colocación de electrodos intracraneales son decididos por el equipo multidisciplinario de epilepsia a partir de la hipótesis clínica generada a partir de la suma de la información obtenida de las pruebas diagnósticas no invasivas de la evaluación prequirúrgica.
NOTA: Como parte de la evaluación prequirúrgica, el iEEG extraoperatorio se registra a lo largo de varios días a través de un sistema de EEG digital que utiliza una frecuencia de muestreo de 1.024 Hz. - Identificar la SOZ definida por un epileptólogo experto en base a la información clínica disponible para cada sujeto.
NOTA: La SOZ se define como el área del cerebro que muestra la primera descarga electrográfica ictal inequívoca, que es diferente de la actividad de fondo que puede ocurrir antes o concomitantemente con el inicio ictal clínicamente definido. Todos los canales implicados en esta descarga electrográfica ictal se consideran contactos SOZ, incluso si capturan convulsiones que se originan en diferentes áreas del cerebro. - Durante el evento ictal registrado en el iEEG, marque el pico de cada ráfaga de descargas epileptiformes que ocurren en cada electrodo intracraneal y realice la localización de la fuente en estos eventos ictales utilizando el método ECD como se describió anteriormente en los pasos 4.1.7-4.1.10.
- Compare los resultados de localización de iEEG con respecto a la SOZ clínicamente definida como el estándar de oro para los resultados de localización de origen.
- Adquisición de registro extraoperatorio de iEEG mediante la implantación de rejillas subdurales y/o electrodos de profundidad. El número, tipo y colocación de electrodos intracraneales son decididos por el equipo multidisciplinario de epilepsia a partir de la hipótesis clínica generada a partir de la suma de la información obtenida de las pruebas diagnósticas no invasivas de la evaluación prequirúrgica.
Resultados
Los pacientes pediátricos con DRE fueron reclutados de la Clínica de Epilepsia del Instituto Jane y John Justin para la Salud de la Mente, Sistema de Atención Médica Infantil de Cook (CCHCS). Se presentan datos de tres pacientes representativos: (i) una niña de 10 años, (ii) un niño de 13 años y (iii) una niña de 10 años.
Caso 1: Una niña de 10 años ingresó con convulsiones a partir de los tres años de edad. El paciente sufría convulsiones diarias incluso después de la administración de 8 ASM. Las convulsiones iniciales se caracterizaron por desviación ocular (lado poco claro) y detención conductual. Más tarde, el paciente experimentó convulsiones diarias de ~30 s caracterizadas por pucheros ictales (signo de "chapeau de gendarme"), desviación de la cabeza hacia la izquierda y rigidez bilateral del brazo tónico (predominio derecho). El electroencefalograma de video a largo plazo reveló dos grupos de convulsiones tónicas asimétricas con desviación de la cabeza hacia la izquierda, seguidas de su brazo izquierdo hacia arriba. También se observaron tres convulsiones tónicas mientras dormía, con frecuentes corridas de polipicos rápidos generalizados y ondas lentas con apertura intermitente de los ojos, mirada hacia arriba y elevación del brazo izquierdo o derecho. Estos polipicos y ondas de sueño lento fueron en su mayoría prominentes desde el lóbulo temporal medio izquierdo. La resonancia magnética cerebral reveló las siguientes displasias multifocales: (i) displasia cortical focal (FCD) del lóbulo parietal izquierdo (circunvolución postcentral) con signo transmanto (FCD tipo II), (ii) FCD de la unión parietooccipital derecha y (iii) FCD del polo temporal izquierdo. La tomografía por emisión de positrones (PET) demostró hipometabolismo en el lóbulo parietal izquierdo, el lóbulo temporal izquierdo y la unión parietooccipital derecha correspondientes a los focos de la anomalía de la señal (es decir, FCD) en el examen de resonancia magnética. El paciente fue diagnosticado de epilepsia intratable, con semiología estereotipada de la encefalia seguida de rigidez tónica del brazo, lo que sugiere un posible inicio frontal mesial o insular/temporal. Se recomendó una exploración estereo-EEG bilateral (sEEG) extensa dirigida al lóbulo frontal, el cíngulo, la ínsula y las regiones de displasia. Durante la monitorización del iEEG, el paciente presentó convulsiones típicas con "chapeau de gendarme" seguidas de elevación/flexión tónica de la extremidad superior derecha o izquierda caracterizada por un inicio difuso del EEG, máximo sobre la ínsula anterior bilateral. Los IED multifocales se observaron principalmente en el lóbulo temporal anterior derecho e izquierdo y en la corteza frontal dorsolateral, incluida la ínsula bilateral. La ESI realizada en el registro de iEEG confirmó la localización de SOZ, que se definió clínicamente bilateralmente en la corteza frontal dorsolateral izquierda y derecha y en la ínsula anterior.
Como parte de la evaluación prequirúrgica, se realizó la localización de la fuente en los datos simultáneos de MEG y HD-EEG. Los registros de MEG y HD-EEG indicaron IED frecuentes en ambas regiones frontotemporales. La Figura 3A muestra un ejemplo representativo de un IED en datos de MEG y HD-EEG; El campo topográfico y el mapeo potencial de ambas modalidades indicaron una posible fuente subyacente en la región frontotemporal derecha. La ESI indicó un grupo disperso de dipolos que cubren áreas de los lóbulos frontotemporal y parietal derecho e izquierdo. La MSI mostró un grupo focal de dipolos en el lóbulo frontotemporal derecho, ubicado cerca de la ínsula derecha. La EMSI indicó grupos focales de dipolos en las regiones frontotemporales bilaterales, en línea con la ESI realizada en el estándar de oro del iEEG, que confirmó las observaciones clínicas (Figura 3C). Estos dipolos estimados a través de EMSI mostraron una distancia media desde la SOZ definida por iEEG de 9,81 mm (mediana: 11,18; std: 2,37).
Caso 2: Un niño de 13 años con epilepsia intratable ingresó con convulsiones a partir de los nueve años. Las convulsiones comenzaron con un aura seguida de una desviación de la cabeza/ojo hacia la izquierda con conciencia preservada a veces y clonus focal de la cabeza hacia la izquierda, duraron ~ 30 s, y ocurrieron varias veces por semana. Ninguna de las ASM prescritas logró el control de las convulsiones. A partir del video-EEG a largo plazo, observamos picos temporales posteriores derechos y descargas frecuentes de ondas de pico en el hemisferio derecho que afectaban a la corteza temporal media, frontotemporal, temporoparietal y centroparietal. El paciente presentaba seis convulsiones electroclínicas caracterizadas por un cambio de comportamiento, desviación de la cabeza/ojo hacia la izquierda con extensión del brazo izquierdo y, en ocasiones, actividad clónica del brazo izquierdo, y tres convulsiones con actividad convulsiva bilateral secundaria. El inicio máximo fue en el lóbulo temporal medio derecho con una evolución en el lóbulo frontotemporal derecho. La resonancia magnética cerebral reveló una malformación extensa de la corteza en el hemisferio cerebral derecho (predominio perisilviano) y una leve pérdida de volumen en el hemisferio cerebral derecho con dilatación ex vacuo del ventrículo lateral derecho. El paciente fue diagnosticado de epilepsia intratable con inicio en el hemisferio derecho, favoreciendo el inicio temporal y perisilviano en la región de malformación cortical difusa. Se realizó un estereoEEG para delinear el grado de afectación, con electrodos colocados en las cortezas temporal, perisilviana, insular y parietooccipital derecha. Durante la monitorización del iEEG se capturaron varias convulsiones de inicio focal electroclínico con inicios máximos en una amplia área del lóbulo frontotemporal derecho. La ESI realizada en los datos de iEEG localizó estas convulsiones en un área más focal que comprende tanto el giro temporal derecho (cerca del giro temporal medio derecho) como el perisilvio.
Como parte de la evaluación prequirúrgica, se realizaron simultáneamente MEG y HD-EEG, durante las cuales el paciente experimentó dos convulsiones: una mientras estaba sentado en la silla de madera durante el proceso de digitalización y otra capturada durante el registro real con el inicio visible tanto en MEG como en HD-EEG (Figura 4A). El campo topográfico y los mapas de potencial en el inicio del ictal indicaron que el generador subyacente del inicio de la convulsión puede estar en el lóbulo temporal medio derecho, como se muestra en la Figura 4A. La localización de la fuente en el evento ictal presentó diferentes hallazgos para ESI y MSI: ESI mostró dipolos localizados hacia los lóbulos frontotemporal y centroparietal derecho, mientras que MSI mostró dipolos con alta agrupación principalmente en el lóbulo temporal derecho (Figura 4B), con dipolos dispersos adicionales en la corteza frontotemporal. Al combinar estas soluciones, el EMSI reveló la localización del inicio del ictal dentro del lóbulo temporal concordante con el ESI en el estándar de oro del iEEG (Figura 4B). En particular, EMSI presentó resultados de localización con una distancia media de la SOZ definida por la monitorización del iEEG de 12,21 mm (mediana: 13,62; std: 2,37).
Caso 3: Una mujer de 15 años con epilepsia idiopática relacionada con la localización ingresó con convulsiones a partir de los 13 años, pero posiblemente a los 8-9 años en retrospectiva, cuando se le diagnosticaron tics debido a movimientos repetitivos y estereotipados del cuello. El paciente presentaba breves inclinaciones de la cabeza hacia la izquierda que a veces progresaban a convulsiones discognitivas focales con conductas hipermotoras (es decir, convulsiones tónico-clónicas generalizadas), así como convulsiones convulsivas nocturnas. Se administraron varias MAE sin lograr un control completo de las convulsiones. Durante la monitorización video-EEG a largo plazo, el paciente presentó convulsiones electroclínicas focales con generalización secundaria con inicio en el lóbulo temporal posterior izquierdo, numerosas convulsiones motoras focales breves con inclinación de la cabeza hacia la izquierda y una convulsión electrográfica sutil con inicio en la corteza centroparietal izquierda. La resonancia magnética cerebral no reveló ninguna anomalía intracraneal aguda y una malformación de Chiari I. El examen de la cabeza con tomografía por emisión de positrones y tomografía computarizada (PET-TC) resultó negativo. Se recomendaron pruebas adicionales, como la TC (SPECT) ictal por emisión de fotón único, la MEG y la HD-EEG simultáneas, la radiografía de la columna cervical, la angiografía por resonancia magnética (ARM) de la cabeza y el cuello y, finalmente, la exploración sEEG del hemisferio izquierdo.
Como parte de la evaluación, el paciente participó en grabaciones simultáneas de MEG y HD-EEG para mapear áreas cerebrales elocuentes, como las cortezas visuales, motoras, auditivas y somatosensoriales primarias. Inicialmente, el paciente realizaba una tarea visomotora, seguida de estimulaciones auditivas y somatosensoriales. La primera respuesta cortical a la estimulación visual se produjo a ~70 ms después del inicio del estímulo tanto para MEG como para HD-EEG (Figura 5A). Figura 5B reporta el campo topográfico y los mapas potenciales de las ubicaciones corticales involucradas en la estimulación visual para MEG y HD-EEG, respectivamente. Para la HD-EEG, se observó un cambio de polaridad en los canales que cubren las áreas cerebrales occipitales, mientras que se encontró una distribución de campo más compleja en las mismas áreas para la MEG (Figura 5B). La localización de la fuente mediante dSPM reveló una actividad cortical focal en este punto de tiempo dentro de las siguientes regiones cerebrales del atlas de Desikan-Killiany: (i) cuneus para MSI; (ii) corteza occipital lateral para ESI; y (iii) cuneus y corteza occipital lateral para EMSI (Figura 5C). El análisis tiempo-frecuencia de las respuestas corticales visuales reveló una sincronización relacionada con eventos (ERS) en la banda de frecuencia gamma para MSI (rango aproximado: 30-50 Hz), ESI (rango aproximado: 40-50 Hz) y EMSI (rango aproximado: 30-50 Hz) (Figura 5D). Para las respuestas motoras evocadas, se observó una supresión de la actividad del ritmo mu sobre el M1 contralateral durante el inicio del movimiento (Figura 6A). En Figura 6B, reportamos el campo topográfico y los mapas potenciales de las áreas cerebrales activadas durante la tarea motora para MEG y HD-EEG, respectivamente. Los mapas de campo de MEG indicaron claras alteraciones de la entrada y salida magnética en las áreas cerebrales centrales contralaterales, lo que puede indicar un generador focal subyacente en el M1 contralateral (Figura 6B). Los mapas de potencial de HD-EEG mostraron un cambio de polaridad focal en las mismas áreas, con potenciales eléctricos perpendiculares a los campos magnéticos (Figura 6B). Los picos de activación de la fuente máxima se observaron mientras se realizaba la tarea de golpeteo en la circunvolución precentral contralateral del atlas de Desikan-Killiany para MSI, ESI y EMSI, respectivamente, como se muestra en Figura 6C. Las respuestas corticales relacionadas con el motor que ocurrieron durante la anticipación del próximo movimiento de golpeteo mostraron ERS en las bandas beta y gamma para MSI (rango aproximado: 20-30 Hz) y EMSI (rango aproximado: 20-40 Hz) y banda gamma para ESI (rango aproximado: 30-50 Hz), referidas en la literatura como mu rhythm suppression (Figura 6D).55,56 Los campos y potenciales evocados auditivos en respuesta a la estimulación auditiva tuvieron un pico positivo máximo a ~80 ms y ~120 ms después de la administración del inicio del estímulo para MEG y HD-EEG, respectivamente (Figura 7A). En Figura 7B, reportamos el campo topográfico y los mapas potenciales de las ubicaciones corticales involucradas en la estimulación auditiva para MEG y HD-EEG, respectivamente. Tanto en la MEG como en la HD-EEG, se observó un cambio de polaridad evidente con polos negativos y positivos claramente definidos en los sensores que cubren las áreas temporales izquierdas del cerebro; estos mapas de campo magnético perpendicular y potencial eléctrico pueden revelar un generador focal subyacente en V1 (Figura 7B). Al realizar la localización de la fuente en los campos y potenciales evocados auditivamente promedio, se observó una activación cortical máxima en la circunvolución temporal transversal y la porción posterior de la circunvolución temporal superior del atlas de Desikan-Killiany para MSI, ESI y EMSI, respectivamente (Figura 7C). El análisis tiempo-frecuencia de las respuestas evocadas auditivamente reveló ERS en la banda gamma para MSI (rango aproximado: 40-60 Hz) y EMSI (rango aproximado: 35-50 Hz), y en las bandas de frecuencia beta y gamma (rango aproximado: 25-60 Hz) para ESI (Figura 7D). Finalmente, observamos la primera actividad cortical en respuesta a la estimulación táctil a los ~60 y ~50 ms después del inicio del estímulo para MEG y HD-EEG, respectivamente (Figura 8A). En Figura 8B, reportamos el campo topográfico y los mapas potenciales de las áreas cerebrales activadas durante la estimulación somatosensorial para MEG y HD-EEG, respectivamente. Los mapas de campo de MEG revelaron un claro cambio de polaridad con distintas alteraciones del flujo magnético en los sensores que cubren las áreas parietales contralaterales, mientras que los mapas de potencial de HD-EEG mostraron un cambio de polaridad menos obvio en las mismas áreas con un polo positivo más fuerte que el negativo. Estos mapas de campo magnético perpendicular y potencial eléctrico pueden indicar un generador cortical focal en S1. Utilizando dSPM en las respuestas somatosensoriales evocadas promediadas, se observó la máxima actividad de la fuente cortical en este punto de tiempo dentro de la circunvolución postcentral contralateral del atlas de Desikan-Killiany para MSI, ESI y EMSI, respectivamente (Figura 8C). En respuesta a los estímulos táctiles, ERS en las bandas de frecuencia beta y gamma para MSI (rango aproximado: 15-40 Hz) y EMSI (rango aproximado: 20-40 Hz), y banda de frecuencia gamma para ESI (rango aproximado: 30-40 Hz) (Figura 8D) también se observaron.
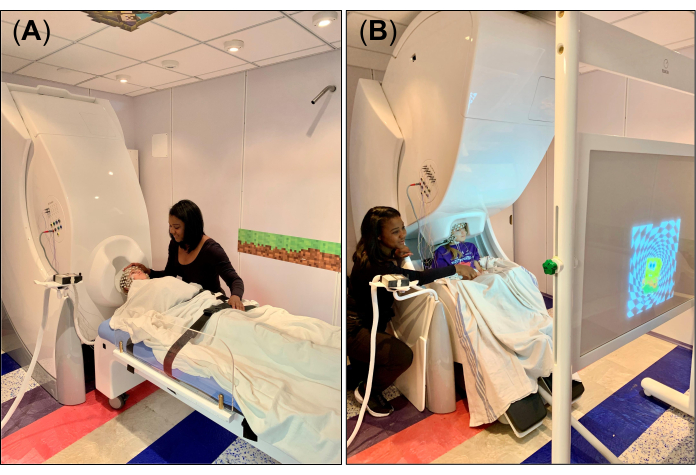
Figura 1: Configuración experimental para MEG y HD-EEG simultáneos en CCHCS. (A) Sistemas de HD-EEG (256 canales) y MEG (306 sensores) con el pórtico del MEG configurado en posición supina (90°, posición horizontal) para un registro del estado de reposo/sueño utilizando la cama no magnética compatible con MEG. El técnico está preparando al sujeto (una niña de 9 años) para la grabación mientras garantiza la seguridad y la comodidad. (B) Sistemas HD-EEG y MEG configurados para una grabación en posición sentada utilizando la silla no magnética compatible con MEG. El técnico está preparando al sujeto para la grabación mientras se asegura de la posición correcta del sujeto frente a la pantalla donde se proyectarán los estímulos visuales durante la tarea visomotora. Haga clic aquí para ver una versión más grande de esta figura.
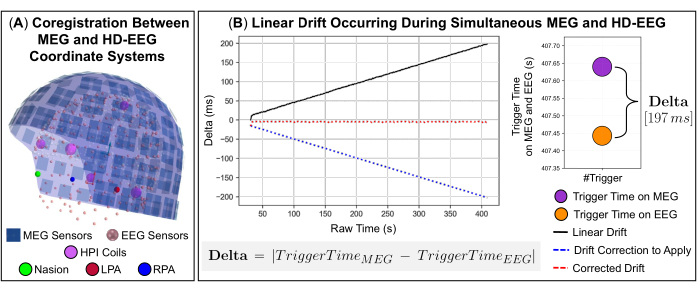
Figura 2: Aspectos técnicos de la combinación de datos de registros simultáneos de MEG y HD-EEG utilizando diferentes sistemas de adquisición. (A) Alineación espacial (corregistro) de los sensores MEG y HD-EEG en el mismo sistema de coordenadas (definido por las coordenadas de la cabeza del sujeto) para un sujeto representativo (una niña de 9 años). Las coordenadas de la cabeza del sujeto están representadas por los siguientes puntos fiduciales: nasion (de color verde) y puntos preauriculares izquierdo/derecho (de color rojo y azul, respectivamente). Se muestran los sensores de 306 MEG (de color azul) - 102 magnetómetros y 204 gradiómetros planos - y las bobinas del indicador de posición de la cabeza (HPI) (de color magenta); alineados en el mismo sistema de coordenadas, también se muestran los 256 canales HD-EEG (de color rosa). (B) Panel izquierdo: Deriva lineal (es decir, delta, mostrada como una línea negra) de muestras de datos que ocurren entre los sistemas MEG y HD-EEG para un sujeto representativo (una niña de 9 años). Delta se define como el valor absoluto de la diferencia entre los tiempos en los que se envía el mismo disparador a los sistemas MEG y EEG y aumenta continuamente con el tiempo: desde valores bajos (delta = 0 ms) hasta valores altos (delta = 197 ms). La corrección de la deriva lineal estimada utilizando una función polinómica que se aplicará a las señales se muestra con una línea discontinua azul. La deriva corregida (delta ~0 ms a lo largo del tiempo) que representa un tiempo sincronizado entre los sistemas MEG y EEG se muestra con una línea discontinua roja. Panel derecho: Se muestra la representación gráfica del desplazamiento de tiempo (delta = 197 ms) estimado para el último disparo enviado a los sistemas MEG y EEG. Haga clic aquí para ver una versión más grande de esta figura.
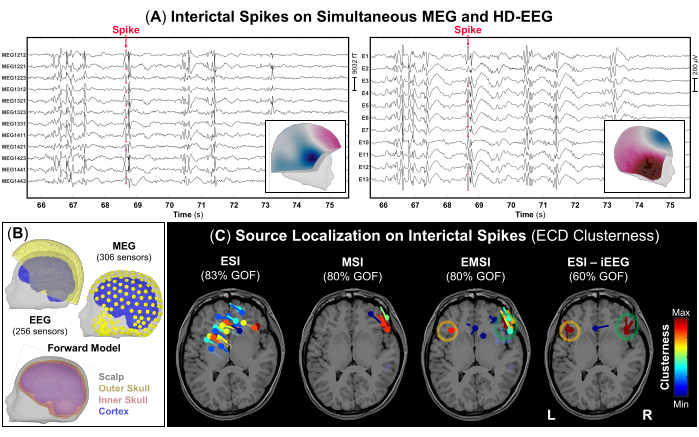
Figura 3: Descargas epileptiformes interictales (IED) en datos de MEG y HD-EEG. (A) Porción de tiempo del registro simultáneo de MEG y HD-EEG (10 s) de una niña de 10 años (Caso 1) con IED frecuentes. Se ha seleccionado un subgrupo de los sensores de 306 MEG y los 256 electrodos de EEG para fines de visualización. El campo topográfico y los mapas de potencial en el pico de un IED se muestran como paneles internos para MEG y HD-EEG, respectivamente. (B) Ubicación de los sensores MEG y HD-EEG (de color amarillo) registrados conjuntamente en la cabeza 3D del sujeto y las superficies corticales (de color azul). Modelo realista de cabeza con el método de elementos límite (BEM) que consta de tres capas [es decir, cuero cabelludo (color gris), cráneo externo (color amarillo) y cráneo interno (color rosa)] reconstruido a partir de la resonancia magnética preoperatoria del sujeto. (C) Los resultados de agrupación de localización de la fuente realizados en IED utilizando dipolo de corriente equivalente (ECD) se muestran en la resonancia magnética preoperatoria del sujeto para ESI, MSI, EMSI y ESI en iEEG (estándar de oro)52. Los mapas de calor de la agrupación de dipolos con una bondad de ajuste >60% se muestran desde valores más bajos (azules) hasta valores más altos (rojos). La zona de inicio de las convulsiones definida a través de la ESI realizada en los datos de iEEG se consideró como el estándar de oro (círculos naranjas y verdes). Haga clic aquí para ver una versión más grande de esta figura.
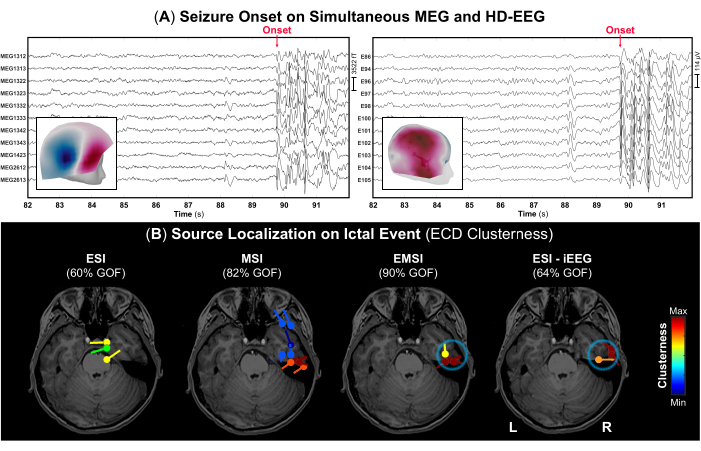
Figura 4: Inicio de las convulsiones en los datos de MEG y HD-EEG. (A) Porción de tiempo del registro simultáneo de MEG y HD-EEG (10 s) de un niño de 13 años (Caso 2) con el inicio de las convulsiones (flecha roja). Se ha seleccionado un subgrupo de los sensores de 306 MEG y los 256 electrodos de EEG para fines de visualización. El campo topográfico y los mapas de potencial al inicio del ictal se muestran como paneles internos para MEG y HD-EEG, respectivamente. (B) Los resultados de la agrupación de la localización de la fuente realizados al inicio del evento ictal utilizando el método de dipolo de corriente equivalente (ECD) se muestran en la resonancia magnética preoperatoria del sujeto para ESI, MSI, EMSI y ESI en iEEG (estándar de oro)52. Los mapas de calor de la agrupación de dipolos con una bondad de ajuste >60% se muestran desde valores más bajos (azules) hasta valores más altos (rojos). La zona de inicio de las convulsiones definida a través de la ESI realizada en los datos de iEEG se consideró como estándar de oro (círculo azul). Haga clic aquí para ver una versión más grande de esta figura.
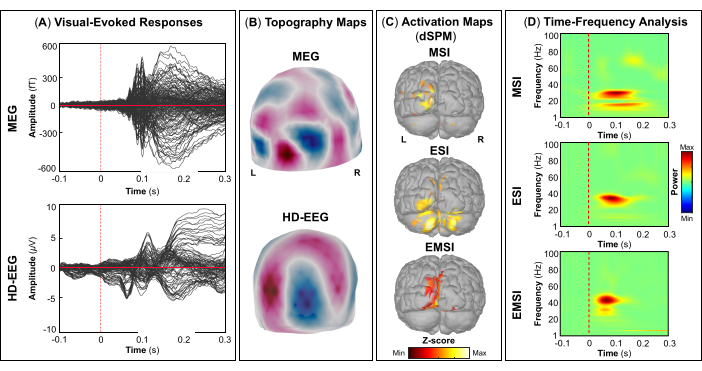
Figura 5: Campos y potenciales evocados visualmente a partir de datos de MEG y HD-EEG. (A) Se muestran las respuestas visuales evocadas promediadas de una mujer de 15 años para MEG (panel superior) y HD-EEG (panel inferior) para el intervalo de tiempo entre -100 ms y 300 ms. (B) Se muestran mapas de campo topográfico y potencial de la corteza visual primaria para MEG y HD-EEG, respectivamente. (C) Mapas de activación de fuentes con amplitudes máximas de activación cortical en regiones cerebrales del atlas de Desikan-Killiany (a saber, cúneus y corteza occipital lateral) estimados utilizando el método de mapeo estadístico paramétrico dinámico (dSPM) para MSI, ESI y EMSI, respectivamente. Se muestran los mapas de calor de la activación de la fuente (puntuación z normalizada de dSPM). (D) Los mapas de tiempo-frecuencia obtenidos utilizando la descomposición de la frecuencia del tiempo de las ondículas de Morlet en las respuestas visuales-evocadas en la corteza visual primaria se muestran para la ventana de tiempo de -100 ms a 300 ms. Se muestran mapas de calor de la potencia tiempo-frecuencia, expresados en porcentajes basados en la desviación de los datos normalizados de la media sobre la línea de base [-200; 0] ms. Haga clic aquí para ver una versión más grande de esta figura.
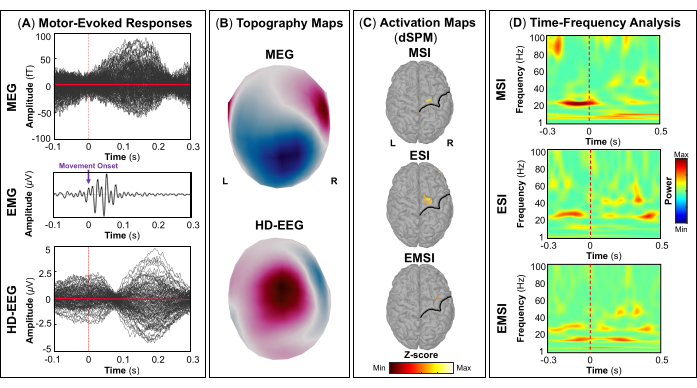
Figura 6: Campos y potenciales evocados por motor a partir de datos de MEG y HD-EEG. (A) Las respuestas motoras evocadas promediadas de una mujer de 15 años para MEG (panel superior) y HD-EEG (panel inferior) se muestran para la tarea de golpeteo del índice izquierdo en el intervalo de tiempo entre -100 y 300 ms. La señal de electromiografía (EMG) (panel central) con el inicio del movimiento (flecha morada) se muestra para el intervalo de tiempo entre -100 ms y 300 ms; la señal se filtra en la banda de frecuencia 30-300 Hz (filtro de muesca: 60 Hz). (B) El campo topográfico y los mapas de potencial de la corteza motora primaria se muestran para MEG y HD-EEG, respectivamente. (C) Mapas de activación de la fuente con amplitudes máximas de activación cortical en el giro precentral contralateral del atlas de Desikan-Killiany estimados utilizando el método de mapeo estadístico paramétrico dinámico (dSPM) para MSI, ESI y EMSI, respectivamente. Se muestran los mapas de calor de la activación de la fuente (puntuación z normalizada dSPM), junto con el surco central (línea negra). (D) Mapas de tiempo-frecuencia obtenidos utilizando la descomposición de tiempo-frecuencia de las ondículas de Morlet en las respuestas motoras evocadas en la corteza motora primaria para la ventana de tiempo de -300 ms a 500 ms. Se muestran mapas de calor de la potencia de tiempo-frecuencia, expresados en porcentajes basados en la desviación de los datos normalizados de la media sobre la línea de base [-1500; -1000] ms. Haga clic aquí para ver una versión más grande de esta figura.
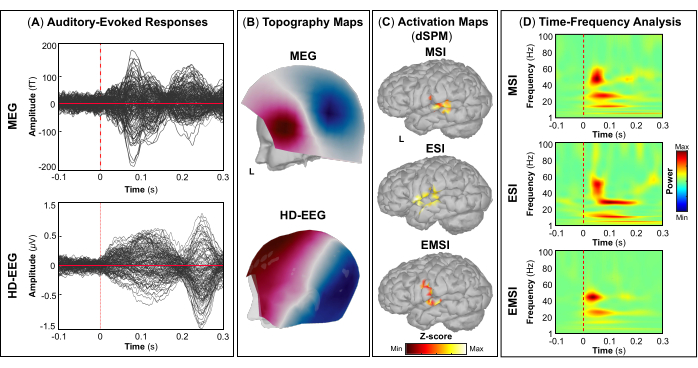
Figura 7: Campos y potenciales evocados auditivamente a partir de datos de MEG y HD-EEG. (A) Se muestran las respuestas auditivas evocadas promediadas de una mujer de 15 años para MEG (panel superior) y HD-EEG (panel inferior) para el intervalo de tiempo entre -100 ms y 300 ms. (B) El campo de topografía y los mapas de potencial de la corteza auditiva primaria se muestran para MEG y HD-EEG, respectivamente. (C) Mapas de activación de la fuente con amplitudes máximas de activación cortical en la circunvolución temporal transversal y la porción posterior de la circunvolución temporal superior del atlas de Desikan-Killiany estimados utilizando el método de mapeo estadístico paramétrico dinámico (dSPM) para MSI, ESI y EMSI, respectivamente. Se muestran los mapas de calor de la activación de la fuente (puntuación z normalizada de dSPM). (D) Mapas de tiempo-frecuencia obtenidos utilizando la descomposición de tiempo-tiempo de las ondículas de Morlet en las respuestas auditivas evocadas en la corteza auditiva primaria para la ventana de tiempo de -100 a 300 ms. Se muestran mapas de calor de la potencia tiempo-frecuencia, expresados en porcentajes basados en la desviación de los datos normalizados de la media sobre la línea de base [-500; 0] ms. Haga clic aquí para ver una versión más grande de esta figura.
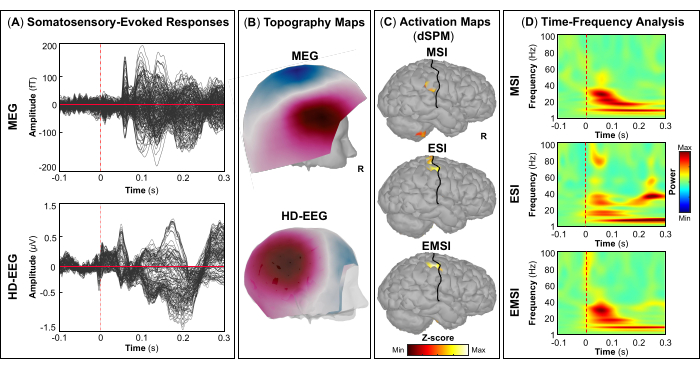
Figura 8: Campos y potenciales evocados somatosensoriales a partir de datos de MEG y HD-EEG. (A) Se muestran las respuestas somatosensoriales promediadas de una mujer de 15 años para MEG (panel superior) y HD-EEG (panel inferior) para la estimulación de los dedos izquierdos en el intervalo de tiempo entre -100 y 300 ms. (B) Se muestran mapas de campo topográfico y potencial de la corteza somatosensorial primaria para MEG y HD-EEG, respectivamente. (C) Mapas de activación de la fuente con amplitudes máximas de activación cortical en el giro postcentral contralateral del atlas de Desikan-Killiany estimados utilizando el método de mapeo estadístico paramétrico dinámico (dSPM) para MSI, ESI y EMSI, respectivamente. Se muestran los mapas de calor de la activación de la fuente (puntuación z normalizada dSPM), junto con el surco central (línea negra). (D) Mapas de tiempo-frecuencia obtenidos utilizando la descomposición de tiempo-tiempo de las ondículas de Morlet en las respuestas somatosensoriales evocadas en la corteza somatosensorial primaria para la ventana de tiempo de -100 ms a 300 ms. Se muestran mapas de calor de la potencia tiempo-frecuencia, expresada en porcentajes basados en la desviación de los datos normalizados de la media sobre la línea de base [-100; 0] ms. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este estudio, ilustramos la configuración experimental para registrar MEG y HD-EEG simultáneos en niños con DRE mientras descansan/duermen, realizan una tarea o reciben estímulos, y proponemos un marco metodológico para localizar la zona irritativa, SOZ y áreas cerebrales elocuentes utilizando EMSI, así como MSI y ESI individuales. Además, proporcionamos recomendaciones técnicas para fusionar datos de MEG y HD-EEG de diferentes productos disponibles comercialmente que presentan características únicas. Presentamos datos de tres casos para mejorar la utilidad clínica de EMSI en la localización de áreas cerebrales epileptógenas y elocuentes. Los resultados aquí indican que los resultados de EMSI superan a los obtenidos por cualquiera de las dos modalidades solas, muy probablemente debido al valor aditivo de las propiedades complementarias de las señales de MEG y EEG en la solución combinada y posiblemente debido al mayor número de sensores utilizados para registrar los datos (>550 sensores). En particular, EMSI localizó de forma no invasiva los irritantes y los SOZ con hallazgos concordantes como ESI en el estándar de oro del iEEG, lo que confirmó las observaciones clínicas.
La metodología propuesta incluye los siguientes pasos críticos: (i) adquisición de alta calidad de registros simultáneos de MEG y HD-EEG (es decir, alta SNR) con un alto muestreo espacial de sensores (>550 sensores) que cubren todo el cerebro de las actividades interictales e ictales, así como los campos y potenciales evocados visuales, motores, auditivos y somatosensoriales, de niños con DRE (pasos 3.1-3.2); ii) sincronización temporal y corregistro espacial de señales MEG y HD-EEG registradas con diferentes sistemas de adquisición (paso 3.12); (iii) preprocesamiento cuidadoso y selección de partes de datos que contienen actividad interictal (pasos 4.1.1-4.1.7), actividad de inicio ictal (pasos 4.2.1-4.2.7) y respuestas relacionadas con eventos (pasos 4.3.1-4.3.6), respectivamente; y (iv) localización precisa de la zona irritativa, SOZ y áreas cerebrales elocuentes de interés utilizando métodos confiables de localización de fuentes (p. ej., ECD con agrupamiento y dSPM) (pasos 4.1.8-4.1.9, 4.2.8-4.2.9 y 4.3.7-4.3.9, respectivamente).
El paso más crítico cuando se realizan grabaciones simultáneas de MEG y HD-EEG es sincronizar espacialmente (alineación entre espacios de coordenadas) y temporalmente (corrección de la deriva lineal del reloj) los datos registrados por los dos sistemas de adquisición. Dicha sincronización es crucial para garantizar la correcta identificación de los eventos interictales, ictales y visuales/motores/auditivos/táctiles que ocurren simultáneamente en las señales MEG y HD-EEG. Los errores en la selección del punto de tiempo de estos eventos pueden afectar los resultados de localización de origen e identificar áreas del cerebro que no están necesariamente involucradas en la generación de estos eventos.
Los sistemas MEG a menudo ofrecen sistemas EEG compatibles de 32, 64 y 128 canales incorporados en el producto para realizar mediciones simultáneas de MEG y EEG. En estos casos, no es necesario sincronizar temporalmente los datos mediante el envío de señales de activación comunes. Del mismo modo, la mayoría de los sistemas de EEG son hoy en día compatibles con todos los sistemas de MEG. A pesar de estos avances en el hardware, solo unos pocos centros de epilepsia realizan registros simultáneos de MEG y HD-EEG como parte de la evaluación prequirúrgica. Aquí, aprovechamos dicha integrabilidad y combinamos los sistemas MEG de 306 canales y EEG de 256 canales para registrar simultáneamente la actividad cerebral con >550 sensores que cubren la cabeza del sujeto. Hasta ahora, hay pocos programas informáticos disponibles para el análisis avanzado de datos MEG, HD-EEG e iEEG (por ejemplo, Brainstorm, CURRY, EEGLab, FieldTrip, MNE o NUTMEG). Por lo tanto, son necesarios estudios futuros para validar la metodología propuesta con nuevos software de análisis de neuroimagen. Finalmente, la combinación de MSI y ESI en una solución única (EMSI) aumentó la complejidad computacional del análisis de datos.
El método descrito presenta algunas limitaciones que deben ser abordadas en estudios futuros. Se seleccionaron manualmente los IED que se produjeron en los datos de MEG y HD-EEG de dos pacientes representativos, mientras que se ignoraron los picos interictales que ocurrieron en solo una de las dos señales (MEG o EEG). La selección manual de picos puede ser un enfoque subjetivo y que requiere mucho tiempo y que puede simplificarse mediante el uso de enfoques automatizados para la detección de IED desarrollados durante las últimas décadas57,58,59. Sin embargo, siempre se recomienda la inspección visual para un análisis cuidadoso y una detección refinada de cada IED. Además, utilizamos la SOZ como aproximador de la EZ. Sin embargo, la SOZ no siempre predice los resultados quirúrgicos60,61,62,63. Por lo tanto, los estudios futuros pueden utilizar el resultado quirúrgico como base para una delimitación más precisa de la EZ13,14,15,16,17,19,20. Aunque las convulsiones pueden capturarse con éxito utilizando MEG y EEG simultáneos y localizarse utilizando técnicas de localización de fuentes apropiadas44,64, es relativamente raro registrar tales eventos ictales en la práctica clínica, especialmente de pacientes ambulatorios en ASM. Esto se debe principalmente a la duración limitada de los registros de MEG y a los movimientos corporales excesivos que se producen durante las convulsiones (p. ej., la cabeza del paciente se deslizó fuera del dewar), lo que puede causar artefactos biológicos que pueden afectar gravemente los hallazgos de localización de la fuente. En una revisión reciente, Stefan et al. informaron la aparición de convulsiones durante los registros de MEG en el 7%-24% de los pacientes, con un tiempo promedio de registro de 30 minutos hasta 5,7 h en diferentes estudios65. En el CCMC, 18 de los 89 (20,2%) pacientes tuvieron eventos ictales capturados durante los registros simultáneos de MEG y HD-EEG realizados en los últimos ~ 2 años. Sin embargo, solo 8 de los 18 pacientes (44,4%) fueron analizados con éxito. En los casos en los que los registros de MEG interictal muestran hallazgos normales o no concluyentes, se puede utilizar MEG ictal o HD-EEG para localizar la EZ con alta precisión. Sin embargo, deben tenerse en cuenta los requisitos técnicos y logísticos para estas grabaciones. Además, los datos representativos de la elocuente localización de la corteza a través de EMSI no se compararon con ningún estándar de oro para la localización de estas áreas funcionales del cerebro, como la resonancia magnética funcional no invasiva o la estimulación electrocortical intraoperatoria. Por lo tanto, es posible que investigaciones posteriores integren la EMSI y la resonancia magnética funcional hacia una herramienta de imagen multimodal no invasiva para mejorar la precisión de la localización de estas áreas cerebrales elocuentes en niños con EDR. Este trabajo también puede extenderse para localizar otras áreas funcionales del cerebro, como las regiones elocuentes del lenguaje. La localización de las funciones del lenguaje es de vital importancia durante la evaluación prequirúrgica de los pacientes con DRE para determinar su aptitud quirúrgica, planificar la extensión de la resección quirúrgica y prevenir déficits funcionales postoperatorios permanentes66. Varios estudios no invasivos han demostrado que el mapeo del lenguaje mediante MEG puede proporcionar resultados concordantes, similares a la prueba invasiva de Wada, que a menudo se considera el estándar de oro para identificar el hemisferio lingüístico dominante67,68,69,70. Un estudio reciente ha propuesto un enfoque multimodal en el que la combinación de diferentes técnicas (es decir, mapeo de estimulación cortical, electrocorticografía de alta gamma, fMRI y estimulación magnética transcraneal) puede proporcionar información mutua, confirmatoria y complementaria para el mapeo prequirúrgico del lenguaje71. A pesar de estas ventajas, el mapeo de las áreas del lenguaje sigue siendo un desafío en los pacientes pediátricos que tienen barreras cognitivas, intelectuales y lingüísticas debido a su edad. Por lo tanto, en un futuro próximo se deberían desarrollar más tareas específicas para cada edad y configuraciones adaptadas a los niños. En este trabajo, analizamos los datos de MEG y HD-EEG utilizando un software que no está certificado para fines clínicos. Aunque se ha demostrado que estas herramientas son valiosas y eficaces, conllevan problemas de responsabilidad que deben tenerse en cuenta al informar los hallazgos de la evaluación prequirúrgica para uso clínico. Aquí, describimos los procedimientos para los registros de HD-EEG utilizando solo sistemas de electrodos de EEG basados en esponja. Los sistemas alternativos que utilizan electrodos de EEG a base de gel se utilizan ampliamente tanto en entornos clínicos como de investigación. Aunque proporcionan registros de EEG SNR más altos, requirieron un tiempo de preparación más largo (~ 40-60 min) y, por lo tanto, son menos adecuados para uso pediátrico. Por otra parte, varios laboratorios utilizan sistemas de EEG de baja densidad basados en gel durante los registros de MEG, que son ventajosos en términos de tiempo de preparación (en comparación con los sistemas HD-EEG), pero ofrecen una resolución espacial significativamente menor debido al reducido número de electrodos que cubren todo el cuero cabelludo12,16,72,73.
En la actualidad, la localización de las áreas cerebrales epileptógenas en pacientes con epilepsia todavía se logra principalmente con la monitorización de iEEG. Además, la metodología para la localización precisa de áreas cerebrales elocuentes está mal definida, y las configuraciones experimentales que se utilizan actualmente en los laboratorios de MEG son inapropiadas para pacientes pediátricos, mientras que el uso de HD-EEG para este propósito es muy limitado. La localización precisa de estas áreas puede facilitar la evaluación prequirúrgica y aumentar la planificación quirúrgica para la resección o la colocación de electrodos iEEG. Hasta el momento, varios estudios han investigado la contribución de la ESI o la MSI en la evaluación prequirúrgica de pacientes con DRE y epilepsias focales para la identificación de la EZ 12,13,14,15,16,17,18,19 y áreas elocuentes de la corteza somatosensorial41respectivamente. Pocos estudios han mostrado mejores resultados de localización de fuentes y rendimiento en la predicción de resultados utilizando EMSI en comparación con MSI o ESI solo 13,31,42. A pesar de estos hallazgos, el registro de MEG y EEG rara vez se realiza simultáneamente, y MSI y ESI se implementan solo en unos pocos centros de epilepsia en todo el mundo. Hasta donde sabemos, este es el primer estudio que proporciona sugerencias para recopilar y analizar datos simultáneos de MEG y HD-EEG, así como para realizar EMSI en epilepsia pediátrica para la identificación no invasiva de la zona irritativa, SOZ y áreas cerebrales elocuentes, a saber, las cortezas visuales, motoras, auditivas y somatosensoriales primarias.
Aquí, realizamos EMSI sobre picos interictales y eventos ictales detectados en datos no invasivos simultáneos de dos pacientes con DRE (Casos 1 y 2) y logramos un error de localización de la fuente de ~9 mm y ~12 mm desde el SOZ, respectivamente, en línea con estudios previos42. Sorprendentemente, este método logró una precisión de localización comparable a los hallazgos intracraneales (es decir, ESI en datos de iEEG), con dipolos agrupados localizados en el área del cerebro identificados como epileptogénicos por las observaciones clínicas (Figura 3C y Figura 4B). Utilizando datos no invasivos de un tercer paciente representativo con DRE (Caso 3), también realizamos EMSI en actividades evocadas visuales, motoras, auditivas y somatosensoriales y encontramos patrones de activación de fuentes prominentes en las áreas elocuentes correspondientes del cerebro (es decir, cortezas visuales, motoras, auditivas y somatosensoriales) (Figura 5C, Figura 6C, Figura 7C y Figura 8C).
Nuestros resultados se derivaron de la fusión de información complementaria capturada de las modalidades MEG y EEG que pueden mejorar la precisión de la localización. Es bien sabido que el EEG refleja todas las corrientes intracraneales, mientras que el MEG es principalmente sensible a las fuentes tangenciales y ciego a las fuentes cerebrales profundas29,74. Como se muestra en este estudio, la combinación de MEG y EEG puede, por lo tanto, superar las limitaciones de cada modalidad, proporcionar resultados de localización superiores e identificar áreas cerebrales epileptogénicas y elocuentes que ESI o MSI pueden haber pasado por alto si se hubieran utilizado solas. Además, presentamos un enfoque alternativo no invasivo para el mapeo de áreas cerebrales elocuentes utilizando EMSI en aquellos pacientes que no se sometieron a fMRI durante su evaluación prequirúrgica.
La localización de áreas cerebrales epileptógenas y elocuentes mediante técnicas no invasivas, como la MEG y el EEG simultáneos, es un paso esencial durante la evaluación prequirúrgica de los niños con DRE para la extirpación completa o la desconexión de la EZ mientras se preservan las áreas corticales elocuentes. La metodología propuesta ofrece una descripción detallada de la adquisición y el análisis de datos simultáneos de MEG y EEG que respaldan su aplicación no solo en la evaluación prequirúrgica de la epilepsia, sino también en las neurociencias cognitivas para explorar las funciones fisiológicas del cerebro sano tanto en niños con desarrollo típico como en adultos sanos, así como los cambios morfológicos y funcionales del cerebro asociados con la epilepsia u otros trastornos neurológicos. Los estudios futuros que investigan las redes cerebrales epileptógenas también pueden evaluar si los centros de red (es decir, regiones cerebrales altamente conectadas) estimados de manera no invasiva usando EMSI en datos simultáneos de MEG y HD-EEG pueden localizar con mayor precisión la EZ en niños con DRE que aquellos estimados usando MSI y/o ESI solo 75,76,77. Además, el mapeo no invasivo de las propagaciones espacio-temporales de picos y ondulaciones (es decir, oscilaciones de alta frecuencia, >80 Hz), estimado a través de EMSI, puede ayudar a comprender mejor los mecanismos fisiopatológicos de la propagación de la actividad epileptiforme y evaluar de manera no invasiva el generador de inicio de estas propagaciones, que es un biomarcador preciso de la EZ78,79. El protocolo presentado puede ayudar a investigar más a fondo la complementariedad de los sistemas de MEG y EEG mediante el examen de la sensibilidad de los conjuntos de sensores de MEG y EEG a fuentes de diferentes orientaciones. Dicho análisis puede proporcionar información sobre las propiedades electrofisiológicas del cerebro mientras se realizan simultáneamente MEG y HD-EEG.
Divulgaciones
Los autores no informan ninguna divulgación.
Agradecimientos
Este trabajo contó con el apoyo del Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares (R01NS104116; R01NS134944; Investigador Principal: Christos Papadelis).
Materiales
| Name | Company | Catalog Number | Comments |
| AIRSTIM unit | SD Instruments | N/A | The SDI AIRSTIM system is an alternative unconditioned stimulus to shock |
| Baby Shampoo | Johnson's | N/A | Baby Shampoo is as gentle to the eyes as pure water and is specially designed to gently cleanse baby’s delicate hair and scalp. |
| Control III disinfectant cleaning solution | Maril Products, Inc. | http://www.controlthree.com/ | Disinfectant and germicide solution formulated for hospitals |
| Elekta Neuromag | TRIUX | NM24132A | Comprehensive bioelectromagnetic measurement system characterized by 306-channel neuromagnetometer for functional brain studies |
| FASTRAK | Polhemus technology | NS-7806 | Using A/C electromagnetic technology, FASTRAK delivers accurate position and orientation data, with virtually no latency. With a single magnetic source, FASTRAK delivers data for up to four sensors. The source emits an electromagnetic field, sensors within the field of range are tracked in full 6DOF (6 Degrees-Of-Freedom). Setup is simple and intuitive, with no user calibration required. |
| Genuine Grass Reusable Cup EEG Electrodes | Natus Medical, Inc. | N/A | Each Genuine Grass EEG Electrode undergoes rigorous mechanical and electrical testing to assure long life for unsurpassed recording clarity and dependability. |
| Geodesic Sensor Net | Electrical Geodesics, Inc. | S-MAN-200-GSNR-001 | 32 to 256 electrodes to place on the human head to aquire dense-array electroencephalography data |
| GeoScan Sensor Digitization System | Electrical Geodesics, Inc. | 8100550-03 | Handheld Scanner and Software for 3D electrode position registration |
| Natus Xltek NeuroWorks | Natus Medical, Inc. | https://natus.com/ | The Natus NeuroWorks platform simplifies the process of collecting, monitoring and managing data for routine EEG testing, ambulatory EEG, long-term monitoring, ICU monitoring, and research studies. |
| Natus NeuroWorks EEG Software | Natus Medical, Inc. | https://natus.com/neuro/neuroworks-eeg-software/ | NeuroWorks EEG software simplifies the process of collecting, monitoring, trending and managing EEG testing data, allowing care providers to save time and focus on delivering the best care. |
| ROSA ONE Brain | Zimmer Biomet | https://www.zimmerbiomet.com/en/products-and-solutions/zb-edge/robotics/rosa-brain.html | ROSA ONE Brain is a robotic solution to assist surgeons in planning and performing complex neurosurgical procedures through a small drill hole in the skull. |
| Ten20 Conductive Paste | Weaver and company | N/A | Ten20 contains the right balance of adhesiveness and conductivity, enabling the electrodes to remain in place while allowing the transmittance of electrical signals. |
Referencias
- Oldham, M. S., Horn, P. S., Tsevat, J., Standridge, S. Costs and clinical outcomes of epilepsy surgery in children with drug-resistant epilepsy. Pediatr Neurol. 53 (3), 216-220 (2015).
- Willie, J. T., et al. Real-time magnetic resonance-guided stereotactic laser amygdalohippocampotomy for mesial temporal lobe epilepsy. Neurosurgery. 74 (6), 569-584 (2014).
- Rosenow, F., Lüders, H. Presurgical evaluation of epilepsy. Brain. 124, Pt 9 1683-1700 (2001).
- Önal, Ç, et al. Complications of invasive subdural grid monitoring in children with epilepsy). J Neurosurg. 98 (5), 1017-1026 (2003).
- Hader, W. J., et al. Complications of epilepsy surgery-a systematic review of focal surgical resections and invasive EEG monitoring. Epilepsia. 54 (5), 840-847 (2013).
- Meng, Y., et al. Risk factors for surgical site infection after intracranial electroencephalography monitoring for epilepsy in the pediatric population. J Neurosurg Pediatr. 22 (1), 31-36 (2018).
- Jobst, B. C., et al. Intracranial EEG in the 21st Century. Epilepsy Curr. 20 (4), 180-188 (2020).
- Schwartz, E. S., et al. Magnetoencephalography for pediatric epilepsy: how we do it. AJNR Am J Neuroradiol. 29 (5), 832-837 (2008).
- Michel, C. M., et al. Electric source imaging of human brain functions. Brain Res Rev. 36 (2-3), 108-118 (2001).
- Michel, C. M., He, B. EEG source localization. Handb Clin Neurol. 160, 85-101 (2019).
- Michel, C. M., Brunet, D. EEG source imaging: A practical review of the analysis steps. Front Neurol. 10, 325(2019).
- Plummer, C., et al. Interictal and ictal source localization for epilepsy surgery using high-density EEG with MEG: a prospective long-term study. Brain. 142 (4), 932-951 (2019).
- Duez, L., et al. Electromagnetic source imaging in presurgical workup of patients with epilepsy: A prospective study. Neurology. 92 (6), e576-e586 (2019).
- Mouthaan, B. E., et al. Diagnostic accuracy of interictal source imaging in presurgical epilepsy evaluation: A systematic review from the E-PILEPSY consortium. Clin Neurophysiol. 130 (5), 845-855 (2019).
- Pellegrino, G., et al. Clinical yield of magnetoencephalography distributed source imaging in epilepsy: A comparison with equivalent current dipole method. Hum Brain Mapp. 39 (1), 218-231 (2018).
- Tamilia, E., et al. Assessing the localization accuracy and clinical utility of electric and magnetic source imaging in children with epilepsy. Clin Neurophysiol. 130 (4), 491-504 (2019).
- Coito, A., et al. Interictal epileptogenic zone localization in patients with focal epilepsy using electric source imaging and directed functional connectivity from low-density EEG. Epilepsia Open. 4 (2), 281-292 (2019).
- Singh, J., Ebersole, J. S., Brinkmann, B. H. From theory to practical fundamentals of electroencephalographic source imaging in localizing the epileptogenic zone. Epilepsia. 63 (10), 2476-2490 (2022).
- Brodbeck, V., et al. Electrical source imaging for presurgical focus localization in epilepsy patients with normal MRI. Epilepsia. 51 (4), 583-591 (2010).
- Santalucia, R., et al. Clinical added value of interictal automated electrical source imaging in the presurgical evaluation of MRI-negative epilepsy: A real-life experience in 29 consecutive patients. Epilepsy Behav. 143, 109229(2023).
- Schneider, F., et al. Magnetic source imaging in non-lesional neocortical epilepsy: additional value and comparison with ICEEG. Epilepsy Behav. 24 (2), 234-240 (2012).
- Hämäläinen, M., Hari, R., Ilmoniemi, R. J., Knuutila, J., Lounasmaa, O. V. Magnetoencephalography-theory, instrumentation, and applications to noninvasive studies of the working human brain. Rev Mod Phys. 65, 413-497 (1993).
- Baillet, S., Mosher, J. C., Leahy, R. M. Electromagnetic brain mapping. IEEE Signal Process Mag. 18 (6), 14-30 (2001).
- Fuchs, M., Kastner, J., Tech, R., Wagner, M., Gasca, F. MEG and EEG dipole clusters from extended cortical sources. Biomed Eng Lett. 7 (3), 185-191 (2017).
- Singh, S. P. Magnetoencephalography: Basic principles. Ann Indian Acad Neurol. 17, Suppl 1 S107-S112 (2014).
- Ahlfors, S. P., Han, J., Belliveau, J. W., Hämäläinen, M. S. Sensitivity of MEG and EEG to source orientation. Brain Topogr. 23, 227-232 (2010).
- Kim, H., Chung, C. K., Hwang, H. Magnetoencephalography in pediatric epilepsy. Korean J Pediatr. 56 (10), 431-438 (2013).
- Gorjan, D., Gramann, K., De Pauw, K., Marusic, U. Removal of movement-induced EEG artifacts: Current state of the art and guidelines. J Neural Eng. , (2022).
- Barkley, G. L., Baumgartner, C. MEG and EEG in epilepsy. J Clin Neurophysiol. 20 (3), 163-178 (2003).
- Ebersole, J. S., Ebersole, S. M. Combining MEG and EEG source modeling in epilepsy evaluations. J Clin Neurophysiol. 27 (6), 360-371 (2010).
- Yoshinaga, H., et al. Benefit of simultaneous recording of EEG and MEG in dipole localization. Epilepsia. 43 (8), 924-928 (2002).
- Baumgartner, C. Controversies in clinical neurophysiology. MEG is superior to EEG in the localization of interictal epileptiform activity: Con. Clin Neurophysiol. 115 (5), 1010-1020 (2004).
- Barkley, G. L. Controversies in neurophysiology. MEG is superior to EEG in localization of interictal epileptiform activity: Pro. Clin Neurophysiol. 115 (5), 1001-1009 (2004).
- Braeutigam, S. Magnetoencephalography: Fundamentals and established and emerging clinical applications in radiology. ISRN Radiol. 2013, 529463(2013).
- Papadelis, C., et al. Current and emerging potential for magnetoencephalography in pediatric epilepsy. J Pediatr Epilepsy. 2 (1), 73-85 (2013).
- Fiedler, P., Fonseca, C., Supriyanto, E., Zanow, F., Haueisen, J. A high-density 256-channel cap for dry electroencephalography. Hum Brain Mapp. 43 (4), 1295(2022).
- Sharon, D., Hämäläinen, M. S., Tootell, R. B. H., Halgren, E., Belliveau, J. W. The advantage of combining MEG and EEG: comparison to fMRI in focally-stimulated visual cortex. Neuroimage. 36 (4), 1225(2007).
- Pataraia, E., Lindinger, G., Deecke, L., Mayer, D., Baumgartner, C. Combined MEG/EEG analysis of the interictal spike complex in mesial temporal lobe epilepsy. Neuroimage. 24 (3), 607-614 (2005).
- Ahmed Mahmutoglu, M., Rupp, A., Baumgärtner, U. Simultaneous EEG/MEG yields complementary information of nociceptive evoked responses. Clin Neurophysiol. 143, 21-35 (2022).
- Aydin, Ü, et al. Combined EEG/MEG can outperform single modality EEG or MEG source reconstruction in presurgical epilepsy diagnosis. PLoS One. 10 (3), e0118753(2015).
- Bast, T., et al. Combined EEG and MEG analysis of early somatosensory evoked activity in children and adolescents with focal epilepsies. Clin Neurophysiol. 118 (8), 1721-1735 (2007).
- Chikara, R. K., et al. Electromagnetic source imaging predicts surgical outcome in children with focal cortical dysplasia. Clin Neurophysiol. 153, 88-101 (2023).
- Hari, R., et al. IFCN-endorsed practical guidelines for clinical magnetoencephalography (MEG). Clin Neurophysiol. 129 (8), 1720-1747 (2018).
- Bagić, A. I., Knowlton, R. C., Rose, D. F., Ebersole, J. S. American Clinical Magnetoencephalography Society Clinical Practice Guideline 1: Recording and analysis of spontaneous cerebral activity. J Clin Neurophysiol. 28 (4), 348-354 (2011).
- Papadelis, C., Chen, Y. H. Pediatric magnetoencephalography in clinical practice and research. Neuroimaging Clin N Am. 30 (2), 239-248 (2020).
- De Macedo Rodrigues, K., et al. A FreeSurfer-compliant consistent manual segmentation of infant brains spanning the 0-2 year age range. Front Hum Neurosci. 9, 21(2015).
- Tadel, F., Baillet, S., Mosher, J. C., Pantazis, D., Leahy, R. M. Brainstorm: A user-friendly application for MEG/EEG analysis. Comput Intell Neurosci. 2011, 879716(2011).
- Kane, N., et al. A revised glossary of terms most commonly used by clinical electroencephalographers and updated proposal for the report format of the EEG findings. Revision 2017. Clin Neurophysiol Pract. 2, 170-185 (2017).
- Lantz, G., et al. Propagation of interictal epileptiform activity can lead to erroneous source localizations: a 128-channel EEG mapping study. J Clin Neurophysiol. 20 (5), 311-319 (2003).
- Vorwerk, J., et al. A guideline for head volume conductor modeling in EEG and MEG. Neuroimage. 100, 590-607 (2014).
- Schrader, S., et al. DUNEuro-A software toolbox for forward modeling in bioelectromagnetism. PLoS One. 16 (6), e0252431(2021).
- Ntolkeras, G., et al. Presurgical accuracy of dipole clustering in MRI-negative pediatric patients with epilepsy: Validation against intracranial EEG and resection. Clin Neurophysiol. 141, 126-138 (2022).
- David, O., Kilner, J. M., Friston, K. J. Mechanisms of evoked and induced responses in MEG/EEG. Neuroimage. 31, 1580-1591 (2006).
- Pantev, C. Evoked and induced gamma-band activity of the human cortex. Brain Topogr. 7 (4), 321-330 (1995).
- Fox, N. A., et al. Assessing human mirror activity with EEG mu rhythm: A meta-analysis. Psychol Bull. 142 (3), 291-313 (2016).
- Genzer, S., Ong, D. C., Zaki, J., Perry, A. Mu rhythm suppression over sensorimotor regions is associated with greater empathic accuracy. Soc Cogn Affect Neurosci. 17 (9), 788-801 (2022).
- Janmohamed, M., et al. Moving the field forward: detection of epileptiform abnormalities on scalp electroencephalography using deep learning-clinical application perspectives. Brain Commun. 4 (5), 218(2022).
- Bagheri, E., Jin, J., Dauwels, J., Cash, S., Westover, M. B. A fast machine learning approach to facilitate the detection of interictal epileptiform discharges in the scalp electroencephalogram. J Neurosci Methods. 326, 108362(2019).
- Thomas, J., et al. Automated detection of interictal epileptiform discharges from scalp electroencephalograms by convolutional neural networks. Int J Neural Syst. 30 (11), 2050030(2020).
- Zijlmans, M., Zweiphenning, W., van Klink, N. Changing concepts in presurgical assessment for epilepsy surgery. Nat Rev Neurol. 15 (10), 594-606 (2019).
- Akiyama, T., et al. Focal resection of fast ripples on extraoperative intracranial EEG improves seizure outcome in pediatric epilepsy. Epilepsia. 52 (10), 1802-1811 (2011).
- Duncan, J. S., Winston, G. P., Koepp, M. J., Ourselin, S. Brain imaging in the assessment for epilepsy surgery. Lancet Neurol. 15 (4), 420(2016).
- Jacobs, J., et al. High-frequency electroencephalographic oscillations correlate with outcome of epilepsy surgery. Ann Neurol. 67 (2), 209-220 (2010).
- Ricci, L., et al. Virtual implantation using conventional scalp EEG delineates seizure onset and predicts surgical outcome in children with epilepsy. Clin Neurophysiol. 139, 49-57 (2022).
- Stefan, H., Rampp, S. Interictal and Ictal MEG in presurgical evaluation for epilepsy surgery. Acta Epileptologica. 2, 11(2020).
- Jahangiri, F. R., Chima, G. S., Pearson, M., Jackson, J., Siddiqui, A. A. Mapping of the language cortex. Cureus. 13 (5), e14960(2021).
- Merrifield, W. S., Simos, P. G., Papanicolaou, A. C., Philpott, L. M., Sutherling, W. W. Hemispheric language dominance in magnetoencephalography: sensitivity, specificity, and data reduction techniques. Epilepsy Behav. 10 (1), 120-128 (2007).
- Wheless, J. W., et al. Magnetoencephalography (MEG) and magnetic source imaging (MSI). Neurologist. 10 (3), 138-153 (2004).
- Breier, J. I., Simos, P. G., Zouridakis, G., Papanicolaou, A. C. Lateralization of activity associated with language function using magnetoencephalography: a reliability study. J Clin Neurophysiol. 17 (5), 503-510 (2000).
- Pataraia, E., Baumgartner, C., Lindinger, G., Deecke, L. Magnetoencephalography in presurgical epilepsy evaluation. Neurosurg Rev. 25 (3), 141-159 (2002).
- Babajani-Feremi, A., et al. Language mapping using high gamma electrocorticography, fMRI, and TMS versus electrocortical stimulation. Clin Neurophysiol. 127 (3), 1822-1836 (2016).
- Brodbeck, V., et al. Electroencephalographic source imaging: a prospective study of 152 operated epileptic patients. Brain. 134, Pt 10 2887-2897 (2011).
- Sohrabpour, A., et al. Effect of EEG electrode number on epileptic source localization in pediatric patients. Clin Neurophysiol. 126 (3), 472-480 (2015).
- Laohathai, C., et al. Practical fundamentals of clinical MEG interpretation in epilepsy. Front Neurol. 12, 722986(2021).
- Corona, L., et al. Mapping functional connectivity of epileptogenic networks through virtual implantation. Proceedings of the Annu Int Conf IEEE Eng Med Biol Soc. 2021, 408-411 (2021).
- Corona, L., et al. Non-invasive mapping of epileptogenic networks predicts surgical outcome. Brain. 146 (5), 1916-1931 (2023).
- Rijal, S., et al. Functional connectivity discriminates epileptogenic states and predicts surgical outcome in children with drug resistant epilepsy. Sci Rep. 13 (1), 9622(2023).
- Tamilia, E., et al. Noninvasive mapping of ripple onset predicts outcome in epilepsy surgery. Ann Neurol. 89 (5), 911-925 (2021).
- Matarrese, M. A. G., et al. Spike propagation mapping reveals effective connectivity and predicts surgical outcome in epilepsy. Brain. 146 (9), 3898-3912 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados